一种油茶愈伤组织离体培养及核型分析方法
一种油茶愈伤组织离体培养及核型分析方法
1.本项目受:陕西省科技厅农业科技创新与攻关项目 (2016ny-007);陕南秦巴山区生物资源综合开发协同创新中心 (qbxt-z(p)-15-16)经费资助。
技术领域
2.本发明涉及经济作物领域,具体涉及一种油茶愈伤组织离体培养方法及使用所培养的愈伤组织进行核型分析的方法。
背景技术:
3.油茶,山茶科山茶属,别名:茶子树(湖南)、茶油树(广西)、白花茶(广东)、灌木或中乔木,常绿小乔木,蒴果球形或卵圆形,花期冬春间,果实秋季成熟[1-2]。油茶基因组复杂,种子培养实生苗易发生分化,影响良种油茶的扩大种植,且难以满足现如今的油茶研究需要,所以油茶组培快繁为解决这一问题提供了新道路。油茶组培不仅能解决良种油茶扩大难的问题,而且还可以结合现代科技,利用基因工程制造出更优质的油茶种苗[12]。因此,通过本实验选择出适合汉中油茶优良品种快繁的基本条件,为汉中及陕南选择出具有自主知识产权的适生油茶品种提供重要的遗传资源和快繁体系。
[0004]
中国是油茶的主要生产国家,其分布面积广阔,种质资源丰富,而且适应性强,而陕西汉中拥有五个超过一万亩的油茶种植县,其中南郑县油茶种植更是超过五万亩。油茶作为小型常绿小乔木,适合生长在坡地和山地,种植油茶可以节约优质的耕地资源,绿化山地,并且可以出产优质食用油,降低我国食用油进口需求,对于我国民生问题有重大意义。
[0005]
油茶多为杂合体,在有性繁殖过程中容易产生性状分离。油茶油作为一种很有营养的食用油现已被人们广泛熟知,但是现如今油茶油的产量却是供不应求,原因在于良种油茶油的种质资源和良种苗木的稀少,但是,通过油茶种子进行繁殖产生的种苗会产生严重的性状分离,使优良性状难以在子代中保持。现如今,通过嫁接、扦插等无性繁殖的方式虽然能使优良性状得到保持,但是繁育速度过慢无法达到大规模生产种植需求,所以需要建立油茶快繁体系。
[0006]
通过建立快繁体系不但可以加快育种速度,而且还能使获得的良种油茶性状在组培苗上的表达出来;快繁过程的建立,从中获得的愈伤组织还可用于油茶的转基因实验,通过转基因实验可以获得更加符合人们需求的油茶优良品种,从而达到一举多得的效果。
[0007]
优质山茶油含不饱和脂肪酸(又称美容酸)高达85%~97%,人体吸收率为97.2%,均比橄榄油高,为各种食用油之冠[3-4];同时,优质山茶油含有丰富的维生素和微量元素、植物甾醇,长期食用山茶油可有效改善心脑血管疾病[5-7];山茶油还具有凉血止血、清热化湿、杀虫解毒的功效,民间常常把山茶油作为外用药涂抹烧伤、防治皮肤破裂、滋润皮肤。山茶油经过精深加工,可制成化妆品用油、医用注射用油和按摩护肤用油。茶籽粕可提取天然活性剂茶皂素,是一种天然的洗涤剂;还可通过粉碎加工,用做生物杀虫剂和金属机加工的抛光粉。另外,脱皂茶粕的蛋白质含量也较高,营养价值高于玉米、小麦等,是很好的饲料生产原料。茶籽壳也能提取糠醛、栲胶和木糖醇等多种高附加值产品。油茶产自我
国大部分省区,其中长江流域“西南地区”华南各地有广泛栽培,茶油是一种具有保健价值的优质绿色食用油,其质量和性能都超过橄榄油,因此,油茶号称“中国的油橄榄”[8-11]。
[0008]
近几十年来,组培快繁通过它的种种成果体现出了它在快繁体系中不可替代的作用。1980年,颜慕勤通过油茶组织培养诱导出了胚状体,通过胚状体形成了再生植株[22]。1981年和1982年,隆振雄和卢天玲先后分别利用油茶未成熟子叶幼胚离体培养获得再生植株 [23,24],此后,隆振雄对油茶花药培养进行了研究,通过组织培养诱导产生了愈伤组织,并获得了绿色芽点和根,但未获得再生植株。随后油茶组织培养基本停滞。2002-2004年,毕方铖等对油茶的茎段、幼胚、子叶在离体条件下进行诱导,获得再生植株,揭示了油茶胚状体起源于单细胞原胚或者多细胞团,胚状体多从表皮细胞的胚性愈伤组织诱导产生,筛选出了再生丛芽、子叶形成胚性愈伤组织及其不定芽分化的最适培养基配方。还通过rapd鉴别分析,在dna水平上均未发现变异,说明通过组织培养建立的油茶优良无性系再生植株无变异,最终获得的组培苗木能够保持原无性系的优良特性,其遗传是稳定的,为油茶优良无性系组培扩繁和生物技术育种的再生体系建立打下了基础[16]。
[0009]
根据植物细胞具有全能性这一理论,在近几十年来发展起来的一项无性繁殖的新技术。植物的组织培养广义又叫离体培养,指从植物体分离出符合需要的组织、器官或细胞,原生质体等,通过无菌操作,在无菌条件下接种在含有各种营养物质及植物激素的培养基上进行培养以获得再生的完整植株或生产具有经济价值的其他产品的技术。狭义是指组培指用植物各部分组织,如形成层、薄壁组织、叶肉组织、胚乳等进行培养获得再生植株,也指在培养过程中从各器官上产生愈伤组织的培养,愈伤组织再经过再分化形成再生植物。但是当前对油茶无性繁殖的研究中存在无法达到消毒要求而容易污染以及愈伤组织的诱导较困难的问题。此外,鉴定染色体倍性即核型分析是植物单倍体育种的必要环节。油茶的核型分析,常用的方法是以种子实生幼苗根尖为材料,但是对于经过多年选育产生的多年生油茶品种及数百年甚至上千年的油茶古树而言,以根尖为材料进行核型分析的方法效率不高、难度很大,有时甚至无法进行。
技术实现要素:
[0010]
本发明所用离体植物材料为油茶的带芽茎段和幼嫩叶片,在两种植物激素6-ba和iaa的不同浓度配比下对油茶腋芽和叶片进行诱导培养,从而获得更多的油茶无菌愈伤组织,然后利用获得的愈伤组织进行核型分析,取得了很好的效果。
[0011]
本发明第一方面提供一种油茶愈伤组织离体培养方法,包括以下步骤:
[0012]
1)取油茶当年生幼嫩枝条或初生枝条上的带叶柄的幼嫩鲜绿色叶片,用0.1%升汞消毒;
[0013]
2)将枝条或叶片切成合适大小后接种到基本培养基上无菌培养;
[0014]
3)将枝条或叶片培养合适时间后移至包含0.5-3.5mg.l-1 6-ba和 0.01-0.3mg.l-1 iaa的ms培养基上进行诱导培养;
[0015]
在一个实施方案中,在步骤1)之前将枝条或叶片用酒精消毒并用无菌水冲洗。
[0016]
在一个实施方案中,在步骤1)之后和步骤2)之前将枝条或叶片用无菌水冲洗。
[0017]
在一个实施方案中,当使用枝条时,步骤1)中的消毒为用0.1%的升汞消毒两次,第一次10min,第二次5min。
[0018]
在一个实施方案中,当使用叶片时,步骤1)中的消毒为用0.1%的升汞消毒10min。
[0019]
在一个实施方案中,步骤3)中的合适时间为于温室中先暗培养 4天,再在光照条件下培养20天。
[0020]
在一个实施方案中,步骤3)中的诱导培养在含有2.0mg
·
l-1 6-ba+0.1mg
·
l-1iaa的ms培养基上进行。本发明第二方面提供一种使用油茶愈伤组织后进行核型分析的方法,包括以下步骤:
[0021]
1)根据如上所述的油茶愈伤组织离体培养方法获得油茶愈伤组织;
[0022]
2)将诱导的油茶愈伤组织压片并染色,进行核型分析。
[0023]
在一个实施方案中,压片所用的细胞为中期分裂相细胞。在一个实施方案中,染色前将油茶愈伤组织用饱和对二氯苯溶液预处理。
[0024]
在一个实施方案中,将油茶愈伤组织用饱和对二氯苯溶液预处理后再使用卡诺固定液(无水乙醇:冰乙酸=3:1)固定3小时。
[0025]
在一个实施方案中,将油茶愈伤组织使用卡诺固定液固定3小时后再放入1mol/l预热为60℃盐酸溶液中解离7.5分钟。
附图说明
[0026]
图1是腋芽消毒处理的流程图。
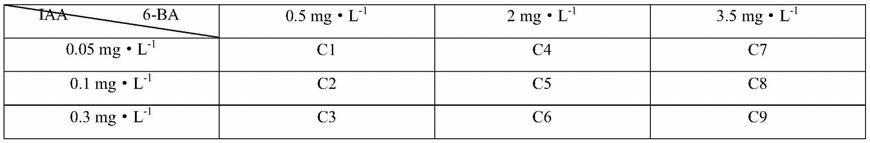
[0027]
图2是腋芽诱导处理的流程图。
[0028]
图3是叶片消毒处理的流程图。
[0029]
图4是叶片愈伤诱导的流程图。
[0030]
图5是枝条腋芽愈伤组织诱导结果。
[0031]
图6是叶片愈伤组织诱导结果。
[0032]
图7是愈伤组织分裂中期细胞较少时的核型分析结果;左图和右图代表2次独立实验。
[0033]
图8是愈伤组织有较多分裂中期细胞时的核型分析结果;左图和 右图代表2次独立实验。
具体实施方式
[0034]
下面结合具体实施例对本发明做进一步说明。
[0035]
实施例
[0036]
1.实验材料与条件
[0037]
实验材料来自于陕西省汉中市南郑县汉山的油茶种植资源圃。所用实验材料为油茶当年生幼嫩的枝条、叶片和油茶多年生枝条,于 2016年3月上旬早晨剪下,喷水带回实验室备用。ms不含蔗糖和琼脂的粉末培养基(杭州临安木木生物技术有限公司),琼脂粉(北京奥博星生物技术有限责任公司),蔗糖(天津市盛奥化学试剂有限公司),6-ba(中国科学院上海生物化学研究所),iaa(sigma),升汞 (上海化学试剂采购供应站经销),次氯酸钠(天津市北联精细化学品开发有限公司)。
[0038]
本实验所用ms培养基中全部添加30g
·
l-1的蔗糖和7g
·
l-1 的琼脂。在整个培养过程中培养基的ph为5.4,培养基在121℃下灭菌30分钟。温室的培养温度为(24
±
2)℃,光
周期:10小时光照/14 小时黑暗。
[0039]
2.枝条消毒方法的选择
[0040]
将油茶当年生幼嫩枝条和多年生的枝条的叶柄叶片一起去除,用剪刀将枝条剪成3cm长的带芽茎段放于干净的烧杯中,在自来水下冲洗20min,然后加入洗手液浸泡搅拌20min,再用自来水将洗手液冲洗干净,淋干自来水放置于干净的烧杯中备用。
[0041]
将当年生枝条在无菌操作台中分装到四个干净的烧杯中做如下处理:
[0042]
用75%的酒精消毒两次,每次30s,然后用无菌水冲洗枝条3次,再分别对四个烧杯进行消毒剂单一变量处理(5%次氯酸钠、10%次氯酸钠、0.1%升汞、0.2%升汞),每个烧杯消毒处理两次,第一次10 min,第二次5min,再用无菌水冲洗4次,淋干无菌水。在无菌的培养皿中的灭菌滤纸上用刀片切除消毒损伤部位使枝条变成长约1cm 的单芽茎段,然后接种到以ms为基本培养基的无激素培养基上,每组接种20瓶,每瓶接种2个枝条,重复3次。
[0043]
将多年生的油茶枝条也按上述四种处理方式进行处理。
[0044]
将所有接种好的放于温室中先进行4天的暗培养,然后在光照条件下进行温室培养并进行20天的观察记录。
[0045]
无菌操作注意事项:
[0046]
(1)无菌操作室要先通风5分钟,然后用紫外灯灭菌20分钟;
[0047]
(2)实验时要先用75%的酒精将实验药品、器材先擦洗消毒,镊子、刀片应在酒精灯火焰上灼烧,然后放于灭菌的培养皿中;
[0048]
(3)镊子、刀片每使用一次都必须在火焰上重新灼烧灭菌后使用,以防止出现污染;
[0049]
(4)所有的接种操作过程应尽量靠近酒精灯火焰,以确保不因为操作不当而造污染。
[0050]
3.叶片消毒方法的选择
[0051]
取初生枝条上的带叶柄的幼嫩鲜绿色叶片,放于干净的烧杯中在自来水中冲洗20min,然后用洗手液浸泡搅拌15min,再在自来水下将洗手液冲洗干净,淋干自来水备用。
[0052]
将上述叶片在无菌操作台中分装到四个干净的烧杯中做如下处理:
[0053]
用75%的酒精消毒两次,每次20s,然后用无菌水冲洗枝条3次,再分别对四个烧杯进行消毒剂单一变量处理(5%次氯酸钠、8%次氯酸钠、0.1%升汞、0.2%升汞),每个烧杯消毒处理10min,再用无菌水冲洗4次,淋干无菌水,再在加入无菌水的无菌的培养皿上用刀片切除消毒损伤部位并将叶片切成1cm2大小,然后接种到以ms为基本培养基的无激素培养基上,每组接种20瓶,每瓶接种4个1cm2的叶片,重复3次。
[0054]
将使用上述方法接种好的叶片放于温室中先暗培养4天,再在光照条件下进行温室培养并进行20天的观察记录。
[0055]
叶片消毒注意事项:
[0056]
(1)获取的叶片材料尽量保持完整。
[0057]
(2)消毒过程中应该尽量控制消毒时间,以防止消毒过度造成的叶片死亡。
[0058]
(3)剪切叶片时叶片的大小应保持适中,过大会导致叶片失水过快而影响实验效果,过小则会导致叶片营养缺乏无法在培养基上生长。
[0059]
4.枝条腋芽的诱导
[0060]
将用最适消毒方法处理的枝条在无菌操作室内移至加入激素 6-ba(0.5mg
·
l-1
、2mg
·
l-1
、3.5mg
·
l-1
)和iaa(0.05mg
·
l-1
、 0.1mg
·
l-1
、0.3mg
·
l-1
)的培养基上进行诱导观察,每组接种10 瓶,每瓶接种2个枝条,重复操作3次。40天后进行枝条腋芽诱导率(腋芽诱导率=诱导成功的腋芽/接种的腋芽
×
100%)的计算(表 1)。
[0061]
表1 枝条腋芽诱导激素组成
[0062][0063]
5.枝条消毒的结果与分析
[0064]
油茶外植体消毒即获得无菌材料是油茶组织培养成功的前提,而油茶在初代培养过程中极容易污染,因此确定油茶枝条的消毒方法是油茶组培快繁工艺技术优化的关键所在。
[0065]
通过20天的实验观察发现,当年生油茶枝条消毒剂的种类和浓度不同时消毒效果不同。当使用次氯酸钠进行消毒时无法达到消毒要求,并且枝条在接种到培养基上3~10天内就开始被真菌全部污染;使用升汞进行消毒时,有较好的消毒效果,但是当升汞浓度达到0.2%时会导致部分腋芽死亡(结果见表2和3),所以对于当年生油茶枝条消毒的最适方法为用0.1%升汞处理枝条两次,第一次10min,第二次5min。
[0066]
作为对照组,多年生油茶枝条在四种消毒条件处理下,第三天开始用5%次氯酸钠进行消毒的枝条已经开始有真菌生长,而在未来的几天中其他条件消毒的枝条也开始被真菌污染,当到达15天时,所有实验材料已经全部被污染。
[0067]
表2 不同消毒方法对油茶多年生枝条消毒的影响
[0068][0069]
注1:表中数据为实验组平均值,以下表格数据均与此相同
[0070]
表3 不同消毒方法对油茶当年生枝条消毒的影响
[0071][0072]
6.叶片消毒的结果与分析
[0073]
初生的幼嫩油茶叶片分化程度低,与环境接触时间短,所带的微生物可能较少,并且可以诱导愈伤组织,产生薄壁细胞,有利于进行转基因实验,获得更优质的油茶品种,也可进行再分化诱导,诱导出不定芽,做成人工种子或者进一步诱导成油茶幼苗。
[0074]
通过试验研究发现:叶片在8%的次氯酸钠中可以消毒,但是消毒效果很差,只有
少部分消毒成功在培养基上存活,大多数在培养到 10天之后会污染真菌,最后导致叶片死亡。叶片在0.1%的升汞中有很好的消毒效果,消毒率可以达到91%左右,而再提高升汞浓度时会出现较高的致死率(结果见表4),因此对于油茶叶片的消毒用0.1%的升汞消毒10min更为合适。
[0075]
表4 不同消毒方法对油茶叶片消毒的影响
[0076][0077]
7.枝条腋芽诱导结果与分析
[0078]
枝条直接诱导出的腋芽,可以进行腋芽的增值培养,从而获得更多的油茶无菌材料,也可将刚生长的叶片进行愈伤组织培养得到大量的愈伤组织细胞,或者直接接种到诱导生根的培养基上进行生根培养,然后炼苗培养获得油茶幼苗。
[0079]
经过对腋芽诱导实验的观察发现,不同植物激素浓度的生长调节剂配比对油茶腋芽诱导有很大影响。当生长素浓度过低时无法更好的诱导腋芽萌发,当生长素浓度过高时会抑制腋芽的萌发。随着细胞分裂素浓度的提高同一腋芽生长个数会增加,但是生长个数增长对腋芽的生长状况存在不利影响(结果见表5)。
[0080]
表5 不同激素浓度的植物生长调节剂对油茶腋芽诱导的影响
[0081][0082][0083]
8.叶片愈伤组织结果
[0084]
叶片放于愈伤组织诱导培养基上20天时,叶片切面上与培养及接触部位已经开始膨大,有愈伤组织细胞长出。
[0085]
9.压片
[0086]
9.1取材
[0087]
实验材料为油茶愈伤组织。第一次取材时间选择上午八点,采用常规压片法发现处于分裂中期的细胞数目太少,染色体形态杂乱,不便于计数(图7)。第二次取材时间选取上午十点,其他实验步骤保持一致,镜检结果较理想,染色体形态相对清晰便于计数(图8)。
[0088]
9.2预处理
[0089]
将切下的油茶愈伤组织,浸入饱和对二氯苯溶液中,有封口膜封住,处理3小时。在染色体制片技术中,预处理是整个实验的重中之重。预处理想得到两个实验基础,具体可细分为:缩短染色体,提高染色体的分散效果,跟便于观察记录;组织纺锤体出现,使较多细胞保持在分裂中期。合理的预处理能将大部分中期染色体保留下来,并维持最良好的形态特征和分裂相。预处理常用的有饱和对二氯苯和秋水仙素,作用体现在阻止纺锤体微管组装的作用。在实验中,根据材料的不同,处理时间和浓度也会有不一样的要求。所以在实验过程中通常要设置浓度梯度以研究出最适浓度,对二氯苯水溶液是饱和溶液,不需要验证最适处理浓度,而且材料价格更加经济,就是材料具有微毒性,所以在处理过程中要注意在通风橱中进行。
[0090]
9.3材料固定
[0091]
取出浸在对二氯苯水溶液中的愈伤组织用蒸馏水对预处理接受后的幼苗愈伤组织组织进行两到三次冲洗,使用卡诺固定液(无水乙醇:冰乙酸=3:1)中固定3h。
[0092]
卡诺固定液和甲醇冰乙酸溶液(甲醇:冰乙酸=3:1)[7]是常用的实验室固定液的作用是通过使用渗透力十分强的固定液使细胞快速死亡,并保持染色体原有的形态和结构,同时增大细胞膜的通透性使和染色体的嗜碱性以达到优良染色效果。固定处理后的材料应尽快进行下一步解离,如需长时间保存,可将材料保存在70%的酒精中并置于冰箱中存放[8]。固定后的实验材料只需保存几天时,将其保存于固定液中即可。
[0093]
9.4材料解离
[0094]
将固定好的细胞放入1mol/l预热为60℃盐酸溶液中解离7.5分钟,因为油茶为木本植株根系细胞壁成分相对较厚,所以处理时间相对长一些有利于后期染色体的观察。
[0095]
在染色体制片中,解离是极为重要的一步实验操作,植物组织都具有细胞壁结构,胞间层具有较多果胶组织。因此在对植物细胞进行染色体制片观察时,果胶的存在使得最终显微镜视野中染色体形态不便于计数。所以,通过解离去除细胞间的果胶层和细胞壁,温度和解离时间是解离过程中要求最严格的两个参数,过高的温度和过长的解离时间会破坏染色体的固有结构。但是温度过低会或解离时间过短,达不到破坏细胞壁和取出果胶层的目的,所以解离过程中对于最佳的解离实验对于不同的实验材料来说需要多做几次,以期得到最佳解离时间和温度。
[0096]
9.5材料染色
[0097]
将解离过后的愈伤组织材料用蒸馏水冲洗两到三次,然后至于干净的培养皿之中,加入提前配置好的卡宝品红溶液染色15-60min,本实验染色30min.
[0098]
用染色剂对要观察的细胞的染色质进行染色处理,使其置于显微镜下容易观察染色体形态和数目,染色的最佳结果是使得染色质着色,细胞质不染色或着色浅。
[0099]
9.6压片
[0100]
取处理后的愈伤组织置于蒸馏水中,冲洗表面染液,然后置于载玻片上,用刀片切下愈伤组织1mm左指按压,使细胞分散均匀,最终在装片中呈现雾状分散即可。
[0101]
9.7镜检
[0102]
用leica dm 2500显微镜观察,并对分裂相细胞进行显微拍照和保存。
[0103]
9.8染色体计数
[0104]
经计数,所用愈伤组织的染色体条数为96条,可知所述油茶为 6倍体。
[0105]
参考文献
[0106]
[1]e.jung,j.lee,j.baeketal.,“effectofcamelliajaponicaoilonhumantypeiprocollagenproductionandskinbarrierfunction,”journalofethnopharmacology,vol.112,no.1,pp.127
–
131,2007.
[0107]
[2]y.-t.cheng,s.-l.wu,c.-y.ho,s.-m.huang,c.-l.cheng,andg.-c.yen,“beneficialeffectsofcamelliaoil(camelliaoleiferaabel.)onketoprofen-inducedgastrointestinalmucosaldamagethroughupregulationofho-1andvegf,”journalofagriculturalandfoodchemistry,vol.62,no.3,pp.642
–
650,2014.
[0108]
[3]k.l.wang,f.l.cao,x.h.yaoetal.,“chemicalcompositionoffattyacidfromcamelliachekiangoleosahu,”journalofnanjingforestuniversity(naturalscienceedition),vol.35,no.2,pp.131
–
134,2011(chinese).
[0109]
[4]y.wang,d.sun,h.chen,l.qian,andp.xu,“fattyacidcompositionandantioxidantactivityoftea(camelliasinensisl.)seedoilextractedbyoptimizedsupercriticalcarbondioxide,”internationaljournalofmolecularsciences,vol.12,no.11,pp.7708
–
7719,2011.
[0110]
[5]x.fengandy.z.zhou,“influencesoffeedingteaseedoil,cornoilandfishoilonimmunestatusinmice,”actanutrimentasinica,vol.18,pp.412
–
417,1996(chinese).
[0111]
[6]c.y.linandb.cheng,“effectsoftopicalapplicationofcamelliaoilonthedevelopmentofallergiccontactdermatitis,”chinesejournalofdermatology,vol.44,no.2,pp.282
–
284,2011.
[0112]
[7]c.-p.leeandg.-c.yen,“antioxidantactivityandbioactivecompoundsofteaseed(camelliaoleiferaabel.)oil,”journalofagriculturalandfoodchemistry,vol.54,no.3,pp.779
–
784,2006.
[0113]
[8]c.-p.lee,p.-h.shih,c.-l.hsu,andg.-c.yen,“hepatoprotectionofteaseedoil(camelliaoleiferaabel.)againstccl4-inducedoxidativedamageinrats,”foodandchemicaltoxicology,vol.45,no.6,pp.888
–
895,2007.
[0114]
[9]x.y.zhu,h.m.lin,x.chen,j.xie,andp.wang“mechanochemical-assistedextractionandantioxidantactivitiesofkaempferolglycosidesfromcamelliaoleiferaabel.meal,”journalofagriculturalandfoodchemistry,vol.59,no.8,pp.3986
–
3993,2011.
[0115]
[10]s.f.li,x.r.zhu,j.h.zhang,g.y.li,d.su,andy.shan,“authenticationofpurecamelliaoilbyusingnearinfraredspectroscopyandpatternrecognitiontechniques,”journaloffoodscience,vol.77,no.4,pp.c374
–
c380,2012.
[0116]
[11]nationaloilcamelliaindustrydevelopmentplan(2009
–
2020),thestateforestryadministrationofchina,2009.
[0117]
[12]aoac,officialmethodsofanalysisoftheassociationofofficial
analyticalchemists,associationofofficialanalyticalchemists,washington,dc,usa,17thedition,2000.
[0118]
[13]j.v.o’fallon,j.r.busboom,m.l.nelson,andc.t.gaskins,“adirectmethodforfattyacidmethylestersynthesis:applicationtowetmeattissues,oils,andfeedstuffs,”journalofanimalscience,vol.85,no.6,pp.1511
–
1521,2007
[0119]
[14]y.zhu,x.y.wang,j.l.ma,h.ye,andh.y.zhong,“oilcontentinseedandfattyacidcompositioninoilofdifferentspeciesofcamelliaoleifera,”nonwoodforestresearch,vol.31,no.2,pp.134
–
137,2013(chinese).
[0120]
[15]w.gao,x.s.he,y.sun,z.y.zhan,j.j.huang,andx.l.lei,“effectsofdifferentharvestmethodsonoilcontentincamelliaoleifera,”nonwoodforestresearch,vol.31,no.4,pp.177
–
171,2013(chinese).
[0121]
[16]m.j.lerma-garc
′
a,g.ramis-ramos,j.m.herrero-mart
′
nez,ande.f.sim
′
o-alfonso,“authenticationofextravirginoliveoilsbyfourier-transforminfraredspectroscopy,”foodchemistry,vol.118,no.1,pp.78
–
83,2010.
[0122]
[17]j.yuan,c.wang,h.chen,h.zhou,andj.ye,“predictionoffattyacidcompositionincamelliaoleiferaoilbynearinfraredtransmittancespectroscopy(nits),”foodchemistry,vol.138,no.2-3,pp.1657
–
1662,2013.
[0123]
[18]j.ma,h.ye,y.rui,g.chen,andn.zhang,“fattyacidcompositionofcamelliaoleiferaoil,”journalofconsumerprotectionandfoodsafety,vol.6,no.1,pp.9
–
12,2011.
[0124]
[19]p.lin,x.h.yao,k.l.wang,t.t.zheng,andj.h.teng,“identificationandgeneticanalysisofcamelliaoleiferachanglinseriessuperiorclonesbysrapmolecularmarker,”journalofagriculturalbiotechnology,vol.18,no.2,pp.272
–
279,2010.
[0125]
[20]f.kaya-dagistanli,g.tanriverdi,a.altinok,s.ozyazgan,andm.ozturk,“theeffectsofalphalipoicacidonlivercellsdamagesandapoptosisinducedbypolyunsaturatedfattyacids,”foodandchemicaltoxicology,vol.53,pp.84
–
93,2013。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1