一种稳定生物基质中卡比多巴/左旋多巴的方法与流程
1.本发明涉及一种稳定生物基质中卡比多巴/左旋多巴的方法,尤其涉及一种满足卡比多巴/左旋多巴临床前/临床试验中样品的收集、运输、储存和检测需求的方法,属于生物技术领域。
背景技术:
2.左旋多巴(levodopa,ld)是治疗帕金森病(parkinson’s disease,pd)的最有效药物,它是多巴胺(dopamine,da)的前体药物。它可以通过血脑屏障,并在脑内被多巴脱羧酶(dopa decarboxylase,ddc)脱羧转化成da而发挥作用。由于ddc不仅存在于脑中,在其他脏器和血管壁细胞内也广泛存在,如单用ld,仅约1%药物能进入中枢,故临床上多采用ld合并外周多巴脱羧酶抑制剂(dopadecarboxylase inhibitor,ddci)如卡比多巴(carbidopa,cd)或苄丝肼(benserazide,bsz)制成复方制剂,以此提高ld进入中枢的量。
3.卡比多巴(carbidopa,cd)是外周脱羧酶抑制剂(ddci),由于其不透过血脑屏障可抑制外周组织中左旋多巴脱羧,提高进入中枢的左旋多巴含量,从而使低剂量的左旋多巴产生有效的多巴血药浓度,并降低外周的副作用。卡比多巴可单用,也可与左旋多巴联用,两者合用能使左旋多巴达到治疗作用所需的剂量减少75%,减少由进入外周组织所带来的呕吐、不自主运动等副作用。
4.在临床前和临床研究中,药代动力学研究是一种直观反映生物体内吸收、分布、代谢和排泄规律的科学。前期的资料反映,cd/ld在全血、血浆等生物基质中均存在稳定性问题,如果不能解决,实验中的检测数据就无法真实反映药物在体内的情况。关于cd/ld药代动力学研究也就无从谈起。为了推动cd/ld临床前和临床研究,需要有一种方法保证生物基质中的cd/ld在收集、运输、储存和检测处于稳定状态。
技术实现要素:
5.本发明的目的旨在提出一种稳定生物基质中卡比多巴/左旋多巴的方法,以此解决卡比多巴/左旋多巴临床前/临床试验中样品收集、运输、储存和检测时的稳定性需求,该方法操作简单快速,操作性强。
6.为实现上述目的,本发明提供一种稳定生物基质中卡比多巴/左旋多巴的方法,在生物基质中加入稳定剂,所述稳定剂中包括体积分数5%的酸化试剂和质量分数10%的抗氧化剂。
7.优选地,所述稳定剂中包括体积分数5%的三氟乙酸和质量分数10%的焦亚硫酸钠。
8.优选地,所述生物基质包括血浆、全血、排泄物、组织匀浆液中的一种。
9.优选地,所述稳定剂与全血的体积比为5:95。
10.优选地,所述稳定剂与血浆的体积比为2.5:97.5。
11.优选地,所述稳定剂的配制方法为:称取焦亚硫酸钠,加入灭菌注射用水完全溶
解,再加入三氟乙酸,混匀,获得稳定剂。
12.优选地,具体包括:在预冷的edta
·
k2抗凝管中添加50μl稳定剂,再加入0.95ml全血,混匀,置于冰上;全血样品2
‑
8℃条件下,3000g离心10min;离心后血浆于
‑
60℃以下保存。
13.优选地,具体包括:在预冷的ep管中添加25μl稳定剂,再加入0.975ml血浆,混匀后
‑
60℃以下保存。
14.本发明所达到的有益效果:
15.(1)本方法采用一种特定配比的稳定剂,基于调节ph值和添加抗氧化剂,利用调节ph值和抗氧化剂的协同作用对生物基质中的cd/ld进行保护,达到稳定cd/ld的目的,最终使含有cd/ld的生物基质样品能够在多种环境中储存。稳定剂中包括体积分数5%的三氟乙酸和质量分数10%的焦亚硫酸钠,三氟乙酸可以降低生物基质的ph值,低ph环境可以抑制基质中酶的活性,降低酶促反映,从而达到保护cd/ld的目的;焦亚硫酸钠作为一种常用抗氧化剂,常用于抑制氧化反应带来的物质变化,加入一定浓度的焦亚硫酸钠可以抑制cd/ld的氧化反应,二者协同作用,既降低了酶促反应,又抑制氧化反应,从而达到稳定cd/ld的目的。
16.(2)使用本发明,能够使含有cd/ld的全血样品在2
‑
8℃条件下保存2小时,血浆样品在2
‑
8℃条件下保存20小时,在低于
‑
60℃条件下保存30天,能够经历4次冻融循环。满足了cd/ld临床前/临床试验中样品的收集、运输、储存与检测需求,为cd/ld的药代动力学研究提供基础。
17.(3)本发明是一种全新的稳定生物基质中cd/ld方法,能够满足cd/ld临床前/临床试验中样品收集、运输、储存和检测时的稳定性需求。本发明不仅适用于血浆和全血,还适用于排泄物和组织匀浆液等多种生物基质。本方法相对于其它方法,既保证了cd/ld的稳定性,又操作简单,且使用试剂易于获得、存储,对环境污染小。
附图说明
18.图1为含20%fa+10%sp的全血;
19.图2为含5%tfa+10%sp的全血;
20.图3为不含稳定剂的全血。
具体实施方式
21.下面结合实施例对本发明作进一步描述。以下实施例仅用于更加清楚地说明本发明的技术方案,而不能以此来限制本发明的保护范围。
22.本发明中所采用的试剂和仪器均为市场上常见,均可从市场上购得。
23.实施例1
24.量取9ml灭菌注射用水完全溶解,再加入1000μl甲酸,获得稳定剂10%fa;
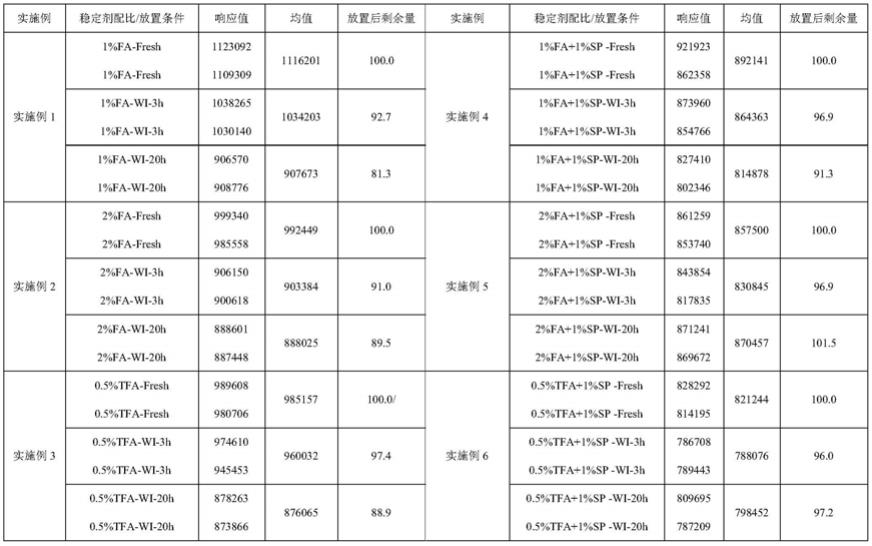
25.在预冷的ep管中添加25μl稳定剂10%fa,再加入0.975ml血浆,混匀后加入100μl0.03mg/ml cd/ld,再次混匀后平行分装3份。第1份样品立即取适量进行定量检测,第2份湿冰环境下放置3小时后进行定量检测,第3份湿冰环境下放置20小时后进行定量检测。结果见表1、表2。
26.实施例2
27.量取8ml灭菌注射用水完全溶解,再加入2000μl甲酸,获得稳定剂20%fa;
28.在预冷的ep管中添加25μl稳定剂20%fa,再加入0.975ml血浆,混匀后加入100μl0.03mg/ml cd/ld,再次混匀后平行分装3份。第1份样品立即取适量进行定量检测,第2份湿冰环境下放置3小时后进行定量检测,第3份湿冰环境下放置20小时后进行定量检测。结果见表1、表2。
29.实施例3
30.量取9.5ml灭菌注射用水,再加入500μl三氟乙酸,获得稳定剂5%tfa;
31.在预冷的ep管中添加25μl稳定剂5%tfa,再加入0.975ml血浆,混匀后加入100μl0.03mg/ml cd/ld,再次混匀后平行分装3份。第1份样品立即取适量进行定量检测,第2份湿冰环境下放置3小时后进行定量检测,第3份湿冰环境下放置20小时后进行定量检测。结果见表1、表2。
32.实施例4
33.称取1g焦亚硫酸钠,加入9ml灭菌注射用水完全溶解,再加入1000μl甲酸,获得稳定剂10%fa+10%sp;
34.在预冷的ep管中添加25μl稳定剂10%fa+10%sp,再加入0.975ml血浆,混匀后加入100μl 0.03mg/ml cd/ld,再次混匀后平行分装3份。第1份样品立即取适量进行定量检测,第2份湿冰环境下放置3小时后进行定量检测,第3份湿冰环境下放置20小时后进行定量检测。结果见表1、表2。
35.实施例5
36.称取1g焦亚硫酸钠,加入8ml灭菌注射用水完全溶解,再加入2000μl甲酸,获得稳定剂20%fa+10%sp;
37.在预冷的ep管中添加25μl稳定剂20%fa+10%sp,再加入0.975ml血浆,混匀后加入100μl 0.03mg/ml cd/ld,再次混匀后平行分装3份。第1份样品立即取适量进行定量检测,第2份湿冰环境下放置3小时后进行定量检测,第3份湿冰环境下放置20小时后进行定量检测。结果见表1、表2。
38.在预冷的edta
·
k2抗凝管中添加50μl稳定剂2%fa+1%sp,再加入0.95ml全血,混匀,置于冰上。全血样品2
‑
8℃条件下,3000g离心10min。结果见图1。
39.实施例6
40.称取1g焦亚硫酸钠,加入9.5ml灭菌注射用水完全溶解,再加入500μl三氟乙酸,获得稳定剂5%tfa+10%sp(本发明使用稳定剂);
41.在预冷的ep管中添加25μl稳定剂5%tfa+10%sp,再加入0.975ml血浆,混匀后加入100μl 0.03mg/ml cd/ld,再次混匀后平行分装3份。第1份样品立即取适量进行定量检测,第2份湿冰环境下放置3小时后进行定量检测,第3份湿冰环境下放置20小时后进行定量检测。结果见表1、表2。
42.在预冷的edta
·
k2抗凝管中添加50μl稳定剂5%tfa+10%sp,再加入0.95ml全血,混匀,置于冰上。全血样品2
‑
8℃条件下,3000g离心10min。结果见图2。
43.在预冷的edta
·
k2抗凝管中加入0.95ml全血,样品2
‑
8℃条件下,3000g离心10min。结果见图3。
44.表1不同稳定剂血浆中ld稳定性数据
[0045][0046]
表2不同稳定剂血浆中cd稳定性数据
[0047][0048]
通过对比表1与表2结果,血浆中加入实施例5与实施例6(本发明方法)中的稳定剂,在放置20小时后,cd/ld的剩余量均大于90%,能满足实验需求。实施例1、实施例2、实施例3、与实施例4放置20小时后剩余量均小于90%,不能满足实验需求。
[0049]
通过对比图1至图3结果,实施例5全血出现明显的碳化现象,离心后基本无法分离血浆,不能满足实验需求。实施例6(本发明方法)分离的血浆量基本和未加稳定剂的全血相当。
[0050]
综上所述,本发明基本能够满足cd/ld临床前/临床试验中样品的收集、运输、储存
和检测时的稳定性需求。
[0051]
为确保本发明的重现性和可靠性,又设计了实施例7与实施例8。
[0052]
实施例7
[0053]
称取1g焦亚硫酸钠,加入9.5ml灭菌注射用水完全溶解,再加入500μl三氟乙酸,获得稳定剂5%tfa+10%sp;
[0054]
在预冷的edta
·
k2抗凝管中添加100μl稳定剂5%tfa+10%sp,再加入1.9ml全血,混匀后置于冰上备用。
[0055]
取上述含稳定剂全血0.9ml至预冷的ep管中,加入0.1ml 600ng/ml cd/ld,获得全血低浓度样品(lqc)。
[0056]
平行分装2份,第1份全血样品立即在2
‑
8℃条件下,3000g离心10min,取适量血浆进行定量检测,第2份全血样品在湿冰环境下放置2小时后,在2
‑
8℃条件下,3000g离心10min,取适量血浆进行定量检测。
[0057]
重复上述步骤获得全血高浓度样品(hqc)数据。结果见表3、表4。
[0058]
表3本方法下的全血中ld稳定性数据
[0059][0060]
表4本方法下的全血中cd稳定性数据
[0061][0062]
实施例8
[0063]
称取1g焦亚硫酸钠,加入9.5ml灭菌注射用水完全溶解,再加入500μl三氟乙酸,获得稳定剂5%tfa+10%sp;
[0064]
在预冷的ep管中添加50μl稳定剂5%tfa+10%sp,再加入1.95ml血浆,混匀后置于冰上备用。
[0065]
取上述含稳定剂血浆0.9ml至预冷的ep管中,加入0.1ml 600/300ng/ml cd/ld,获得血浆低浓度样品(lqc)。
[0066]
平行分装4份,第1份样品立即取适量进行定量检测,第2份湿冰环境下放置20小时后进行定量检测,第3份湿冰
‑
60℃环境下反复冻融4次时后进行定量检测,第4份于低于
‑
60℃环境下保存30天后进行定量检测。
[0067]
重复上述步骤获得血浆高浓度样品(hqc)数据。结果见表5、表6。
[0068]
表5本方法下的血浆中ld稳定性数据
[0069][0070][0071]
表6本方法下的血浆中cd稳定性数据
[0072][0073]
结果(表3
‑
表6)表明在本发明的方法下:全血样品能够在湿冰环境下保持两小时稳定,为从动物体内抽离的全血至血浆的分离提供了支持;血浆样品在湿冰环境下保持20小时稳定,为样品的定量检测提供了支持;血浆在湿冰/
‑
60℃条件下四次冻融保持稳定,为样品的存取提供了支持;血浆在
‑
60℃条件下30天保持稳定,为样品的长期储存,长途运输提供了支持。故本方法能够满足cd/ld临床前/临床试验中样品的收集、运输和储存时的稳定性需求,且重现性、可操作性强。
[0074]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变形,这些改进和变形也应视为本发明的保护范围。
相关技术
网友询问留言
已有1条留言
-
 0184565... 来自[中国] 2023年06月02日 13:31OK
0184565... 来自[中国] 2023年06月02日 13:31OK
1