保亭花的组培快速繁殖方法
1.本发明涉及生物技术领域,具体涉及一种保亭花的组培快速繁殖方法。
背景技术:
2.组培快速繁殖技术在加快濒危物种的保护和建立体外基因库方面具有显著的优势(bowes&curtis,1991)。2012年,国家林业局和国家发改委联合印发《全国极小种群野生植物拯救保护工程规划(2011—2015年)》,将极小种群野生植物拯救保护工作推向了全国。在极小种群物种的保护方面,采用组织培养建立种质的离体保存体系非常有必要,该技术已在一些兰科植物的保护中发挥了一定的作用。然而更多的极小种群植物其离体再生体系还有待于建立,保亭花就是其中很有代表性的一个物种。
3.保亭花(wenchengia alternifolia c.y.wu&s.chow)是特产我国海南岛的保亭县、凌水县的一个单种属植物。该属最早由吴征镒和周铉于1965年发表,所依据的是20世纪30年代采自海南的两号标本,由于该属具有互生叶序、总状花序、极联合的花萼、特殊的果柄等特征,在现存唇形科植物中均非常罕见,因此吴征镒根据它建立单型亚科——保亭花亚科(wenchengioideae)(wu&chow,1965)。保亭花属独特的系统位置引起了研究唇形科植物专家的高度重视,但由于材料的缺乏,ryding(1996)根据哈佛大学标本馆存放的保亭花标本的果实,研究了其果皮的显微结构,揭示保亭花是黄芩亚科的近缘类群。近年来李波(2012)发现了该物种的一个小居群,并通过形态学、解剖学、细胞学及分子系统学等多方面的研究,表明保亭花属为黄芩亚科的基部类群,并与黄芩亚科其它成员存在一系列形态学,解剖学及细胞学的联系,因此支持将保亭花属置于黄芩亚科,而不建议建立单型的保亭花亚科(li et al,2012)。li(et al,2014)调查发现该物种的野生群体只有66个个体,其中45株为生殖植株,14株为非生殖植株和7株幼苗。保亭花的幼株比例较低与该物种在石灰岩生境,土壤缺乏,种子易受流水冲刷导致种子萌发率较低有关。因此任何对种群的干扰或栖息地的破坏都可能会引发灭绝,亟待得到保护。该物种在《中国高等植物受威胁物种名录》中被列为极度濒危cr(critically endangered)种类(覃海宁等,2017)。
4.保亭花作为极度濒危物种,尚未有人做过该物种的组培快繁实验,中科院华南植物园李波对该物种进行了迁地保护。因此对此极度濒危,种群规模极小的物种进行组培快繁研究,对于该物种的保护和种群规模的扩大具有重大意义。
5.参考文献如下:
6.bowes bg,curtis ew.conservation of the british national begonia collection by micropropagation[j].new phytologist,1991,119(1):169
‑
181.(bowes bg,curtis ew.通过微繁殖保护英国收藏的秋海棠[j].新植物学家,1991,119(1):169
‑
181);
[0007]
li b,xu wx,tu ty,et al.phylogenetic position of wenchengia(lamiaceae):ataxonomically enigmatic and critically endangered genus[j].taxon,2012,61:392
‑
401(li b,xu wx,tu ty,et al.保亭花属(唇形科)的系统发育位置:
一个分类上神秘和极度濒危的属[j].分类,2012,61:392
‑
401);
[0008]
li b,zhang zy,zhang dx.conservation status of the unique population of wenchengia alternifolia,an enigmatic plant endemic to hainan island,china[j].oryx,2014,48:354
‑
357(li b,zhang zy,zhang dx.中国海南岛特有的神秘植物——保亭花特有种群的保护状况[j].剑羚,2014,48:354
‑
357);
[0009]
ryding o.pericarp structure and phylogenetic position of the genus wenchengia(lamiaceae)[j].botanische jahrb
ü
cher,1996,118:153
‑
158(ryding o.保亭花属(唇形科)的果皮结构和系统发育位置[j].植物年鉴,1996,118:153
‑
158);
[0010]
wu cy,chow s.duo taxa nova labiatarum[j].journal of systematics and evolution,1965,10:249
‑
256.(wu cy,chow s.唇形科的两个新分类单位[j].系统与进化杂志,1965,10:249
‑
256);
[0011]
李波.唇形科保亭花属及豆腐柴属的系统发育研究[d].2012,北京:中国科学院大学研究生院.覃海宁,杨永,董仕勇等.中国高等植物受威胁物种名录[j].生物多样性,2017,25:696
‑
744。
[0012]
文中所提及的缩写字母见如下缩略词表:
[0013]
简写全称中文名ban6
‑
benzylaminopurine6
‑
苄基腺嘌呤ga3gibberellic acid赤霉素iaaindole
‑3‑
acetic acid吲哚乙酸ibaindole
‑3‑
butyric acid吲哚丁酸msmurashige and skoog mediumms培养基naaa
‑
naphthaleneacetic acida
‑
柰乙酸tdzthidiazuron噻苯隆
技术实现要素:
[0014]
本发明要解决的技术问题是提供一种保亭花的组培快速繁殖方法。
[0015]
为了解决上述技术问题,本发明提供一种保亭花的组培快速繁殖方法,包括以下步骤:
[0016]
1)、取材:
[0017]
于保亭花开花期(11月),采集保亭花的母本植株和果实;
[0018]
2)、果皮的剥离和种子的消毒:
[0019]
将步骤1)所得的果实进行果皮的剥离,所得的种子放入湿润的培养皿中(把种子放在铺有1层湿润滤纸的培养皿中),于4
±
1℃保存1~3天,然后进行清洗消毒;
[0020]
将清洗消毒后的种子播种在种子萌发培养基上,先黑暗状态下培养2~3天、然后转入光/暗交替培养直至幼苗长至2~3cm时停止培养;将所得的幼苗切除根部后,再分割成2~3段,形成每段长度为≥0.8cm(一般约为0.8~1cm)的无菌苗切段;
[0021]
所述无菌苗切段用于后续步骤5)的增殖培养;
[0022]
3)、母株腋芽的消毒:
[0023]
将步骤1)所得的母本植株于22
±
2℃进行栽种,待植株叶腋中的腋芽萌发至长度
达到1.5~2厘米时,取下整个腋芽萌发形成的茎段,将茎段进行清洗和灭菌,得消毒后茎段;
[0024]
4)、腋芽的启动培养:
[0025]
将步骤3)所得的消毒后茎段按照形态学的上端朝上、下端朝下插入到启动培养基上,进行新腋芽的诱导培养;诱导培养条件为:于22~26℃进行光/暗交替培养;
[0026]
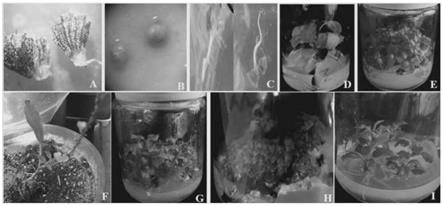
当启动培养基上的消毒后茎段长出新腋芽,且所述新腋芽萌发伸长至≥3cm且带有叶片形成幼苗时(一般为3~4cm的长度,带有3~4个节),结束启动培养;割取所述幼苗,将幼苗分割成带1~2个节的茎段;
[0027]
说明:茎段顶端的顶芽向上即为形态学的上端;茎段叶腋处的腋芽生长,叶片开展,此时的叶片可作为无菌苗的叶片,用于后续步骤6)的愈伤组织的诱导;
[0028]
5)、增殖培养/快速增殖:
[0029]
将步骤2)所得的无菌苗切段(长度约0.8~1cm)、或步骤4)所得的茎段(带1~2个节),转接于增殖培养基上进行培养;
[0030]
增殖培养条件为:于22~26℃进行光/暗交替培养;待无菌苗切段或茎段上长出丛生芽(叶腋中长出)、且丛生芽上的每个不定芽均为带有≥3个节的茎段时(即,每个不定芽为带有3~4个节的茎段,每个不定芽生长至约为3~4cm),结束培养,割取茎段(即,不定芽,单芽);
[0031]
6)、叶片愈伤组织的诱导和不定芽的分化培养:
[0032]
取步骤4)所得的叶片,在叶片主脉上间隔3~5mm切割一次(切割深度要求不切断叶脉),然后接种到愈伤组织诱导/不定芽分化培养基上进行培养;
[0033]
培养条件为:先暗培养直至在叶片叶脉切口处形成愈伤组织(为颗粒状愈伤组织),暗培养时间约为2周,然后转入光/暗交替培养;当愈伤组织上分化获得高度为2~3cm的不定芽时,结束培养;
[0034]
说明:在此培养基上不需要进行转接培养,愈伤组织上能够直接形成不定芽;
[0035]
7)、生根培养:
[0036]
将步骤5)所得的茎段或者步骤6)所得的不定芽转入生根培养基中进行生根培养;
[0037]
生根培养为先暗培养2~3天,然后转入光/暗交替培养;当茎段/不定芽的基部产生长度≥3cm的6~8条根时结束生根培养;
[0038]
8)、移栽(生根植株的移栽):
[0039]
将步骤7)所得的生根幼苗取出后,进行移栽。
[0040]
作为本发明方法的改进:
[0041]
将所述步骤5)所得的新茎段分割成带1~2个节的茎段后,重复步骤5),从而实现进一步增殖培养。
[0042]
即:所述步骤5)所得新茎段具有以下2个用途:
[0043]
用途一、分割成带1~2个节的茎段用于步骤5)的进一步增殖培养;
[0044]
用途二、用于后续的生根培养。
[0045]
作为本发明方法的进一步改进:
[0046]
所述步骤2)的种子萌发培养基为以下任一:
[0047]
种子萌发培养基ⅰ、ms+30g/l蔗糖+琼脂6.9~7.0g/l+ga
3 0.5mg/l,ph 5.8~6.0;
[0048]
种子萌发培养基ⅱ、ms+30g/l蔗糖+琼脂6.9~7.0g/l+ba 0.5mg/l,ph 5.8~6.0;
[0049]
所述步骤4)中的启动培养基为ms+ba 2mg/l+蔗糖30g/l+琼脂6.9~7.0g/l,ph 5.8~6.0;
[0050]
所述步骤5)的增殖培养基为以下任一:
[0051]
增殖培养基ⅰ:ms+ba 0.5~1mg/l+naa 0~0.5mg/l+蔗糖30g/l+琼脂6.9~7.0g/l,ph为5.8~6.0;
[0052]
增殖培养基ⅱ:ms+ba 0.5~1mg/l+iba 0~0.5mg/l+蔗糖30g/l+琼脂6.9~7.0g/l,ph为5.8~6.0;
[0053]
增殖培养基ⅲ、ms+ba 0.5~1mg/l+iaa 0~0.5mg/l+蔗糖30g/l+琼脂6.9~7.0g/l,ph为5.8~6.0;
[0054]
所述步骤6)中的愈伤组织诱导/不定芽分化培养基为以下任一:
[0055]
愈伤组织诱导/不定芽分化培养基ⅰ:ms+ba 2mg/l+naa 0~0.5mg/l+30g/l蔗糖+琼脂6.9~7.0g/l,ph 5.8~6.0;
[0056]
愈伤组织诱导/不定芽分化培养基ⅱ:ms+tdz 0.5mg/l+naa 0~0.1mg/l+30g/l蔗糖+琼脂6.9~7.0g/l,ph 5.8~6.0;
[0057]
所述步骤7)的生根培养基为以下任一:
[0058]
生根培养基ⅰ:ms+iba 0.4~1.0mg/l+蔗糖20g/l+琼脂6.9~7.0g/l,ph 5.8~6.0;
[0059]
生根培养基ⅱ、ms+naa 0.2~0.5mg/l+蔗糖20g/l+琼脂6.9~7.0g/l,ph 5.8~6.0。
[0060]
作为本发明方法的进一步改进,作为优选:
[0061]
增殖培养基ⅰ为ms+ba 0.5mg/l+naa 0.2mg/l+蔗糖30g/l+琼脂6.9~7.0g/l,ph为5.8~6.0;
[0062]
增殖培养基ⅱ为ms+ba 0.5mg/l+iba 0.2mg/l+蔗糖30g/l+琼脂6.9~7.0g/l,ph为5.8~6.0;
[0063]
愈伤组织诱导/不定芽分化培养基ⅰ:ms+ba 2mg/l+naa 0.15mg/l+30g/l蔗糖+琼脂6.9~7.0g/l,ph 5.8~6.0;
[0064]
愈伤组织诱导/不定芽分化培养基ⅱ:ms+tdz 0.5mg/l+naa 0.1mg/l+30g/l蔗糖+琼脂6.9~7.0g/l,ph 5.8~6.0。
[0065]
作为本发明方法的进一步改进:
[0066]
所述黑暗培养(24小时全部黑暗培养)的温度为22~24℃;
[0067]
光/暗交替培养(22~26℃)时:光照培养时,光照强度为35~40μmol.m
‑2.s
‑1,时间为16小时,温度为24~26℃;黑暗培养时,培养时间为8小时,温度为22~24℃;上述光照和黑暗培养交替进行。
[0068]
作为本发明方法的进一步改进:
[0069]
所述步骤2)的清洗消毒为:先将种子用无菌水冲洗,接着在超净台上用70%~75%乙醇处理25~35sec,用含0.5%有效氯的次氯酸钠溶液灭菌2~3min,再无菌水冲洗3~5次;
[0070]
所述步骤3)的清洗和灭菌为:将茎段(长度1.5~2.0cm)用加洗洁精的自来水(1l
自来水加入2~3滴洗洁精)充分洗涤后,置于流水中冲洗(约10min);然后在超净台上操作,先用70%~75%酒精浸泡处理20~30sec,无菌水冲洗后,用含0.5%有效氯的次氯酸钠溶液灭菌3~4min,无菌水冲洗3~5次。
[0071]
作为本发明方法的进一步改进:所述步骤8)的移栽(生根植株的移栽)为:将步骤7)所得的生根幼苗取出后,栽培于多肉颗粒土:泥炭=2:1质量比的混合基质上进行移栽。
[0072]
具体为:已生根植株的培养瓶转移到自然温度、阴凉干燥的环境下锻炼5~7天,然后打开瓶盖,在培养基表面浇少量水(液面高度约1~2mm),再放置1~2天后,将植株基部的琼脂洗净,将苗移栽到多肉颗粒土:泥炭=2:1的混合基质上培养3~4周,开始1~2周温度为22~24℃,相对湿度为70~80%。随后即可逐渐过渡到自然的环境条件。
[0073]
在本发明中:
[0074]
保亭花的果实为小坚果,顶部具瘤,具粗毛。为降低污染率,本发明的步骤2)在体视显微镜下将果皮剥离,且设定了相应的种子的消毒步骤。
[0075]
启动培养基的制备方法为:以ms基本培养基为基础,分别加入蔗糖、琼脂、ba,均匀混合,利用1mol/l的koh或1mol/l的hcl调节ph为5.8~6.0;每1l的ms基本培养基加入ba 2mg,蔗糖30g,琼脂6.9~7.0g。
[0076]
其余培养基按本发明告知的配方相应制备而得。
[0077]
所述步骤7)中,一般光/暗交替培养3~4周,每个幼苗能产生6~8条根,根的长度≥3cm。
[0078]
本发明选用果实和母株腋芽萌发的茎段作为外植体;
[0079]
将果实处理后进行培养再分割,形成为0.8~1cm的无菌苗切段(也可称为茎段);将母本植株腋芽萌发形成的茎段培养后进行分割,形成带1~2个节的茎段;将上述0.8~1cm的无菌苗切段和1~2个节的茎段转接于增殖培养基上进行步骤5)的增殖培养;可见茎段叶腋处形成丛生芽,将丛生芽分割成单芽,每个单芽再分割成1~2个节的茎段重复进行增殖培养。将幼苗上的叶片进行愈伤组织的诱导和不定芽的分化培养,从而获得高度为2~3cm的不定芽;将茎段叶腋处的丛生芽分割成单芽(长度约3~4cm)和叶片上形成的高度为2~3cm的不定芽进行生根培养。
[0080]
在本发明中:保亭花通过两种方式进行快速繁殖。
[0081]
一种方式是通过茎段的快速繁殖。茎段来自种子无菌萌发形成的无菌苗,或者来自消毒后母本植株叶腋处的腋芽萌发形成的茎段。通过茎段的快速扩增,此过程是芽生芽的途径,不经过愈伤组织阶段,能保持试管苗的遗传稳定性;另外一种方式是通过无菌苗的叶片诱导愈伤组织,然后诱导愈伤组织进行不定芽的分化。
[0082]
本发明中无菌苗叶片能在一种培养基上实现叶片愈伤组织诱导以及愈伤组织上不定芽的分化。此操作减少了培养步骤,省时、省力(常规的培养是叶片先形成愈伤组织,愈伤组织再转入芽分化培养基上进行分化培养)。采用本发明提供的叶片愈伤组织诱导、芽分化培养的方法,为通过基因工程改良该植物提供了基础。
[0083]
本发明具有如下的技术优势:
[0084]
(1)保亭花的生产可以在人为控制条件下进行,不受季节、气候条件与土壤等因素的制约。
[0085]
(2)增殖速度快,生产周期短,设备简单,占地面积少,能节省人力、物力等,便干工
厂化生产。
[0086]
(3)该技术方法解决了保亭花快速繁殖过程中植株容易玻璃化的问题,达到技术稳定,繁殖系数高的要求,可应用于工业化生产。
[0087]
(4)可以保存保亭花的野生资源,减少对自然资源的破坏。
[0088]
综上所述,本发明通过大量试验,摸索出一套成熟的方法,成功实现了保亭花的组培快繁,可以短时间内快速培育出大量的试管苗,为该极小种群的恢复提供一条切实可行的繁殖方式。
附图说明
[0089]
下面结合附图对本发明的具体实施方式作进一步详细说明。
[0090]
图1为保亭花的组培快繁图;
[0091]
a.11月份采自海南保亭的保亭花果实;
[0092]
b.剥去果皮的保亭花种子;
[0093]
c.种子在ms+ga
3 0.5mg/l+蔗糖30g/l+琼脂7.0g/l,ph 5.8的培养基上萌发,生长1周的幼苗;
[0094]
d.种子萌发,生长3周的幼苗,高度达到2.5cm,向上形成茎和叶,向下形成健壮的根系;
[0095]
e.无菌种子苗的顶芽在ms+ba 0.5mg/l+naa 0.2mg/l+蔗糖30g/l+琼脂7.0g/l,ph5.8的培养基上快速繁殖;
[0096]
f.采回来的野生母本植株;
[0097]
g.以母株叶腋处腋芽萌发形成的茎段作为外植体,消毒处理得到无菌茎段,无菌茎段快速繁殖;
[0098]
h.无菌苗的叶片,在ms+tdz 0.5mg/l+naa 0.1mg/l+蔗糖30g/l+琼脂7.0g/l,ph 5.8的培养基上形成的愈伤组织及其愈伤组织上分化的不定芽;
[0099]
i.高度为2~3cm的无菌苗在ms+naa 0.3mg/l+蔗糖20g/l+琼脂7.0g/l,ph 5.8的培养基上生根。
具体实施方式
[0100]
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
[0101]
以下案例中:
[0102]
黑暗培养(24小时全部黑暗培养)的温度为22~24℃;
[0103]
光/暗交替培养(22~26℃)时:光照培养时,光照强度为35~40μmol.m
‑2.s
‑1,时间为16小时,温度为24~26℃;黑暗培养时,培养时间为8小时,温度为22~24℃;上述光照和黑暗培养交替进行。
[0104]
叶腋是指茎段上叶与茎的夹角。
[0105]
实施例1、一种保亭花的组培快速繁殖方法,包括以下步骤:
[0106]
1)、取材:
[0107]
于11月保亭花的开花期,去野外调查,并采集母本植株和果实。
[0108]
说明:此时的保亭花母本,顶端具有总状花序,花序内的花具有果实,果实的成熟度达到80%以上(用手捏有一定硬度),植株还带有根系和叶片。
[0109]
2)、果皮的剥离和种子的消毒
[0110]
保亭花的果实为小坚果,顶部具瘤,具粗毛。为降低污染率,在体视显微镜下将果皮剥离,把种子放在铺有1层湿润滤纸的培养皿中,放4℃冰箱保存1~3天,然后将种子用无菌水冲洗,接着在超净台上用75%乙醇处理30sec,用含0.5%有效氯的次氯酸钠溶液灭菌2~3分钟,无菌水冲洗3~5次后,播种在种子萌发培养基上,黑暗状态下培养2~3天后转入光/暗交替培养直至幼苗长至2~3cm时停止培养。将所得的幼苗切除根部后,分成2~3段,形成每段长度约0.8~1cm的无菌苗切段,所述无菌苗切段用于增殖培养。
[0111]
所述种子萌发培养基为以下任一:
[0112]
种子萌发培养基ⅰ、ms+30g/l蔗糖+琼脂6.9~7.0g/l,ph 5.8~6.0,添加ga
3 0.5mg/l;
[0113]
种子萌发培养基ⅱ、ms+30g/l蔗糖+琼脂6.9~7.0g/l,ph 5.8~6.0,添加ba 0.5mg/l;
[0114]
种子萌发培养基ⅰ的制备方法为:在1l ms培养基中加入30g蔗糖、6.9~7.0g琼脂,0.5mg的ga3,调节ph为5.8~6.0。
[0115]
其余培养基的制备方法按照其配方以此类推进行相应的制备。
[0116]
3)、母株茎段的消毒:
[0117]
将采集回来的母本植株栽种在花盆中,置于22
±
2℃的人工气候室中进行常规栽培,待植株叶腋处长出腋芽且萌发至长度达到1.5~2cm时,取下整个腋芽萌发形成的茎段,将茎段进行清洗和灭菌,得消毒后茎段;
[0118]
所述清洗和灭菌为:将茎段(长度1.5~2.0cm)用自来水(1l自来水加入2~3滴洗洁精)充分洗涤后,置于流水中冲洗10min;然后在超净台上操作,先用75%酒精浸泡处理20~30sec,无菌水冲洗后,用含0.5%有效氯的次氯酸钠溶液灭菌3~4min,无菌水冲洗3~5次。
[0119]
4)、茎段的启动培养:
[0120]
将步骤3)所得的消毒后茎段按照形态学的上端朝上、下端朝下插入到启动培养基上,进行新腋芽的诱导培养;诱导培养条件为:于22~26℃进行光/暗交替培养;
[0121]
当启动培养基上的消毒后茎段长出新腋芽,且所述新腋芽萌发伸长至≥3cm且带有叶片形成幼苗时(一般为3~4cm的长度,带有3~4个节),结束启动培养;割取所述幼苗,将幼苗分割成带1~2个节的茎段;
[0122]
说明:茎段顶端的顶芽向上即为形态学的上端;茎段叶腋处的腋芽生长,叶片开展,此时的叶片可作为无菌苗的叶片,用于后续步骤6)的愈伤组织的诱导。
[0123]
所述启动培养基为ms+ba 2mg/l+蔗糖30g/l+琼脂6.9~7.0g/l,ph 5.8~6.0;
[0124]
诱导培养条件为:于22~26℃进行光/暗交替培养;
[0125]
所述启动培养基的制备方法为:在1l ms培养基中加入2mg ba、30g蔗糖、6.9~7.0g琼脂,调节ph为5.8~6.0。
[0126]
此步骤4)一般需要约4~5周。
[0127]
5)、种子萌发的幼苗或来自母株腋芽生成的幼苗的增殖培养/快速增殖:
[0128]
将步骤2)所得的无菌苗切段(长度约0.8~1cm)、或步骤4)所得的茎段(带1~2个节),转接于增殖培养基上进行培养;
[0129]
增殖培养基为以下任一:
[0130]
增殖培养基ⅰ:ms+ba 0.5~1mg/l+naa 0~0.5mg/l+蔗糖30g/l+琼脂6.9~7.0g/l,ph为5.8~6.0;作为优选:增殖培养基ⅰ为ms+ba 0.5mg/l+naa 0.2mg/l+蔗糖30g/l+琼脂6.9~7.0g/l,ph为5.8~6.0;
[0131]
增殖培养基ⅱ:ms+ba 0.5~1mg/l+iba 0~0.5mg/l+蔗糖30g/l+琼脂6.9~7.0g/l,ph为5.8~6.0;作为优选:增殖培养基ⅱ为ms+ba 0.5mg/l+iba 0.2mg/l+蔗糖30g/l+琼脂6.9~7.0g/l,ph为5.8~6.0。
[0132]
增殖培养基ⅲ、ms+ba 0.5~1mg/l+iaa 0~0.5mg/l+蔗糖30g/l+琼脂6.9~7.0g/l,ph为5.8~6.0。
[0133]
增殖培养条件为:于22~26℃进行光/暗交替培养;待无菌苗切段或茎段上长出丛生芽(叶腋中长出)、且丛生芽上的每个不定芽均为带有≥3个节的茎段时(即,每个不定芽为带有3~4个节的茎段,每个不定芽生长至约为3~4cm)时,结束培养,割取该新茎段(不定芽);
[0134]
步骤5)培养时间约为7周左右;
[0135]
该新茎段具有以下任一用途:
[0136]
用途一、分割成带1~2个节的茎段用于步骤5)的进一步增殖培养;
[0137]
用途二、不分割用于后续的生根培养。
[0138]
6)、叶片愈伤组织的诱导和不定芽的分化培养:
[0139]
取步骤4)所得的叶片,在叶片主脉上间隔3~5mm切割一次(切割深度要求不切断叶脉),然后接种到愈伤组织诱导/不定芽分化培养基上进行诱导;
[0140]
所述愈伤组织诱导/不定芽分化培养基为以下任一种:
[0141]
愈伤组织诱导/不定芽分化培养基ⅰ:ms+ba 2mg/l+naa 0~0.5mg/l+30g/l蔗糖+琼脂6.9~7.0g/l,ph 5.8~6.0;作为优选:ms+ba 2mg/l+naa 0.15mg/l+30g/l蔗糖+琼脂6.9~7.0g/l,ph 5.8~6.0;
[0142]
愈伤组织诱导/不定芽分化培养基ⅱ:ms+tdz 0.5mg/l+naa 0~0.1mg/l+30g/l蔗糖+琼脂6.9~7.0g/l,ph 5.8~6.0;作为优选:ms+tdz 0.5mg/l+naa 0.1mg/l+30g/l蔗糖+琼脂6.9~7.0g/l,ph 5.8~6.0;
[0143]
所述诱导条件为:先于22~24℃暗培养2周后,此时在叶片主脉的切割处会形成黄绿色颗粒状的愈伤组织;然后转入22~26℃的光/暗交替培养;此时愈伤组织上分化获得不定芽,当不定芽的高度为2~3cm,即获得高度为2~3cm的不定芽时,结束诱导培养。
[0144]
说明:在此培养基上不需要进行转接培养,愈伤组织上能够直接形成不定芽。
[0145]
7)、生根培养:
[0146]
将步骤5)所得的新茎段或者步骤6)所得的不定芽转入生根培养基中进行生根培养;
[0147]
生根培养为:先于22~24℃暗培养2~3天,然后转入22~26℃的光/暗交替培养;当新茎段/不定芽的基部产生长度≥3cm的6~8条根时结束生根培养;
[0148]
所述生根培养基为以下任意一种:
[0149]
生根培养基ⅰ:ms+iba 0.4~1.0mg/l+蔗糖20g/l+琼脂6.9~7.0g/l,ph 5.8~6.0;
[0150]
生根培养基ⅱ、ms+naa 0.2~0.5mg/l+蔗糖20g/l+琼脂6.9~7.0g/l,ph 5.8~6.0;
[0151]
8)、移栽(生根植株的移栽):
[0152]
将步骤7)所得的生根幼苗取出后,栽培于多肉颗粒土:泥炭=2:1质量比的混合基质上进行移栽。
[0153]
具体为:已生根植株的培养瓶转移到自然温度、阴凉干燥的环境下锻炼5~7天,然后打开瓶盖,在培养基表面浇少量水(液面高度约1~2mm),再放置1~2天后,将植株基部的琼脂洗净,将苗移栽到多肉颗粒土:泥炭=2:1的混合基质上培养3~4周,开始1~2周温度为22~24℃,相对湿度为70~80%。随后即可逐渐过渡到自然的环境条件。
[0154]
实验1、对实施例1进行以下的具体参数限定:
[0155]
步骤2)采用的是种子萌发培养基ⅰ,种子接种第3天(即,播种在种子萌发培养基上的第3天)开始萌发,约2~3周后,幼苗长至2~3cm,割取并切除根部后作为无菌苗;将分成2~3段,每段长度约0.8~1cm,作为无菌苗切段;
[0156]
步骤5)、
[0157]
将上述步骤2)所得的无菌苗切段和步骤4)所得的茎段(带1~2个节的茎段)接种在增殖培养基ⅰ上,增殖培养基ⅰ为ms+ba 0.5mg/l+naa 0.2mg/l+蔗糖30g/l+琼脂7.0g/l,ph 5.8;生长1周,无菌苗切段和茎段的叶腋处的腋芽开始萌发,而后继续培养,腋芽呈丛生状,当培养7周后(从接种在增殖培养基上起算)丛生芽的数目平均为6.5个,丛生芽的平均高度为3.5cm。丛生芽上的每个不定芽带有3~4个节的茎段。
[0158]
增殖倍数的计算公式为:每个茎段产生的不定芽的数目*芽伸长后节的数目。
[0159]
芽伸长后节的数目,即,每个不定芽带有茎段的节的数目,按照最低的3个节计算,此方法的增殖倍数为6.5*3=19.5倍。
[0160]
步骤7)、选用步骤5)所得的不定芽进行生根培养;
[0161]
生根培养基ⅱ为ms+naa 0.3mg/l+蔗糖20g/l+琼脂7.0g/l,ph 5.8。
[0162]
1周开始生根,4周后统计,植株的生根率达到100%,平均根数为6.3,平均根长3.2cm,植株的平均高度为5.2cm。炼苗一个月后移栽到石灰岩和泥炭土基质,成活率可达91.2%。
[0163]
成活率=移栽成活的植株数目/总的移栽植株的数目。
[0164]
实验2、
[0165]
将实验1的步骤5)的增殖培养基ⅰ改成增殖培养基ⅱ;增殖培养基ⅱ为ms+ba 0.5mg/l+iba 0.2mg/l+蔗糖30g/l+琼脂7.0g/l,ph 5.8;其余等同于实验1的步骤5)。
[0166]
生长1周,无菌苗切段和茎段的叶腋处的腋芽开始萌发,而后继续培养,腋芽呈丛生状,当培养7周后(从接种在增殖培养基上起算)丛生芽的数目平均为5.2个,丛生芽的平均高度为3.0cm。丛生芽上的每个不定芽带有3~4个节的茎段。
[0167]
此方法的增殖倍数为5.2*3=15.6倍。
[0168]
步骤7)、选用步骤5)所得的不定芽进行生根培养;
[0169]
生根培养基ⅰ为ms+iba 0.5mg/l+蔗糖20g/l+琼脂7.0g/l,ph 5.8。
0.5mg/l,其余等同于实验2,植株生长较缓慢。最终所得的结果:增殖倍数约为6.5,移栽成活率约为84.5%。
[0191]
对比例2
‑
2、将实验2生根培养基中ms培养基改为1/2ms(只有大量元素减半),其余等同于实验2,经过相同时间的培养,生根率为100%,根多,密集,较细,但植株叶片偏小,植株整体瘦弱,移栽成活率为78.5%。
[0192]
对比例3
‑
1、将实验3步骤6)中的“前2周置于暗中培养”改成“前2周也是光/暗交替培养”,其余等同于实验3。结果愈伤组织上不定芽的分化率仅为64.3%,每一块愈伤组织上的不定芽的数量平均有3.5个,不定芽的平均高度为2.5cm。
[0193]
对比例3
‑
2、将实验3的愈伤组织诱导/不定芽分化培养基ⅰ中的“naa 0.15mg/l”去除;其余等同于实验3。愈伤组织的诱导率64.3%,愈伤组织上不定芽的发生频率为61.7%。
[0194]
对比例3
‑
3、将实验3的愈伤组织诱导/不定芽分化培养基ⅰ中的“naa 0.15mg/l”去除,改成添加2.4
‑
d 0.15mg/l,愈伤组织的诱导率75%,但愈伤组织粉质,愈伤组织上不定芽的发生频率仅仅为52%。
[0195]
对比例4
‑
1、将实验4的愈伤组织诱导/不定芽分化培养基ⅱ中tdz的浓度由0.5mg/l改为0.2mg/l,其余等同于实验4。
[0196]
愈伤组织的诱导率为80%,愈伤组织上不定芽的发生频率为77.5%。
[0197]
最后还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例子,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容,直接导出或联想到的所有变形,均应认为是本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1