一种黄皮生物碱及其盐在制备抑制疫霉病菌和/或轮纹病菌活性产品中的应用
1.本发明属于天然药物技术领域,尤其涉及一种黄皮生物碱及其盐在制备抑制疫霉病菌和/或轮纹病菌活性产品中的应用。
背景技术:
2.当今世界,环境保护和食品安全已成为全社会关注的两大焦点问题。然而,以往由于化学农药的长期或不科学使用已经导致多种农作物的病原微生物和害虫产生抗药性、生态环境恶化、生物多样性水平降低等一系列问题。因此,寻找具有高效、低毒、低残留的绿色环境友好新型农药,已成为当今农药研究与创制的主要目标。植物源农药以其在自然环境中自身高选择性、易降解、无公害的优势已成为绿色农药研发的首选之一。由于从天然资源宝库中寻找农药活性化合物具有较好的结构多样性和活性特异性,因此,植物源农药便自然成为新农药创制的重要途径和研究热点。
3.黄皮为芸香科黄皮属植物。主要分布于我国南方各省,其果实有消食、顺气等功效,根、叶和果核具有行气、消滞、解表、止痛和化痰等功效,所含化学成分主要包括香豆素类、咔唑生物碱类、酰胺类和萜类等化合物,其生物活性主要包括抗菌、抗肿瘤、抗疟、保肝、抗血小板凝聚及降血脂等。由于黄皮具有重要的药用价值,现有技术也报道了一系列咔唑生物碱、酰胺、香豆素等化学成分及这些化合物的抗肿瘤、神经保护、抗菌等活性。以上所述研究主要是针对黄皮的医药活性,而黄皮的农用活性方面的研究并不多见。虽然关于黄皮抑菌活性的研究,到目前为止,取得了一定的进展,但是多数还是集中在粗提物水平上,具体到化合物水平上,目前也只有大家所熟知的(e)
‑
n
‑2‑
苯乙基肉桂酰胺。黄皮植物中生物碱的种类很多,含量也比较大,有必要对其农业抑菌活性进行系统的研究和评价,挖掘出具有更高活性的化学成分,这将对更好的开发和利用黄皮起到非常积极的作用。
4.黄皮植物中的生物碱主要包括咔唑类和酰胺类,黄皮植物的根、茎、叶、果实、种子中均有这两类生物碱的分布,极性多为中等偏小,又因其存在大的共轭体系,黄皮生物碱都具有较强的紫外吸收。此外,咔唑生物碱还具有明显的薄层色谱(tlc)显色特点,在5
‑
10%硫酸
‑
无水乙醇显色剂下加热,化合物显色为淡蓝色斑点。以上特点可在黄皮生物碱分离纯化中加以充分利用。迄今为止,对黄皮生物碱提取分离的方法概括起来主要有以下三种:(1) 采用正己烷回流提取,经tlc检测,再经硅胶反复柱层析得到黄皮生物碱,其缺点在于提取不充分,容易漏掉微量的生物碱;(2)采用石油醚和乙酸乙酯分别提取,经氯仿和乙酸乙酯分别萃取,再经反复硅胶柱层析得到生物碱,其缺点是仅用单一的正相分离材料,未使用反相等材料,容易造成样品的损失;(3)采用丙酮或甲醇回流提取,再经硅胶柱层析和tlc制备薄层板进行分离,其缺点是制备薄层板只适合微量成分的分离,不适用于大量成分。以上提取分离方法都是建立在对黄皮植物中生物碱结构新颖性和多样性的系统研究上,侧重点在于黄皮生物碱的结构,活性成分分离的针对性不强;且分离方法中主要使用硅胶材料,很少用到mci及反相材料等,容易造成样品的损失和活性成分的离散;此外,检测方法比较
单一,主要依靠tlc 检测,其灵敏度不高,微量成分容易漏检。
技术实现要素:
5.有鉴于此,本发明的目的在于提供一种黄皮生物碱及其盐在制备抑制疫霉病菌和/或轮纹病菌活性产品中的应用,本发明黄皮生物碱利用新的制备方法制备所得,对疫霉病菌和轮纹病菌的生长具有较强的抑制活性。
6.为了实现上述发明目的,本发明提供了以下技术方案:
7.本发明提供了一种黄皮生物碱及其盐在制备抑制疫霉病菌和/或轮纹病菌活性产品中的应用,所述黄皮生物碱包括白鲜碱、lansiumamide b、6
‑
甲氧基卡巴唑
‑3‑
羧酸甲酯和卡巴唑
‑3‑
羧酸甲酯中的至少一种。
8.优选的,所述盐包括所述黄皮生物碱与无机酸、有机酸、碱金属、碱土金属或碱性氨基酸反应生成的盐。
9.优选的,所述产品包括农药、生长抑制剂。
10.优选的,所述黄皮生物碱的制备方法包括如下步骤:
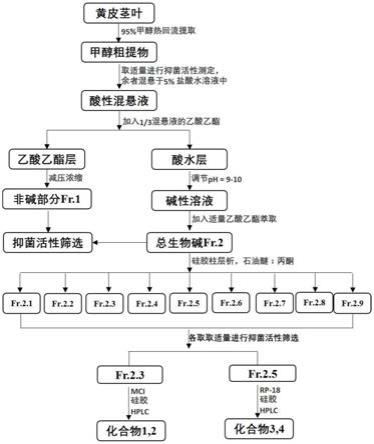
11.将黄皮茎叶与甲醇混合回流提取,减压浓缩得到甲醇浸膏;将甲醇浸膏进行酸提碱沉得到黄皮总生物碱和非生物碱部分,对黄皮总生物碱部分进行硅胶柱层析粗分离,得到各次级部分,对以上各部分分别进行抑制疫霉原菌活性测试后,对活性较强的次级部分进行tlc检测和活性追踪分离,并结合mci柱层析和rp
‑
18柱层析分离方法对活性生物碱进行分离,最后采用 hplc分离纯化得到活性黄皮生物碱成分。
12.优选的,所述甲醇为体积分数为95
‑
99%的甲醇溶液。
13.优选的,所述酸为体积分数为4
‑
6%的盐酸,所述甲醇浸膏与盐酸的质量体积比为1:8
‑
1:10。
14.优选的,所述碱沉为用氨水调节ph至9
‑
10。
15.本发明还提供了一种抑制疫霉病菌和/或轮纹病菌活性的农药,所述农药包括上述黄皮生物碱中的至少一种及其农药学上容许的盐或可接受的载体。
16.优选的,所述疫霉病菌包括辣椒、黄瓜和南瓜疫霉病菌。
17.优选的,所述轮纹病菌包括梨和苹果轮纹病菌。
18.本发明的有益效果:
19.本领域现有黄皮生物碱的提取分离方法侧重于挖掘生物碱结构的多样性和新颖性上,本发明首次是将关注点集中在抑菌活性黄皮生物碱的提取、检测、富集及活性追踪分离方面,获得了对疫霉病菌和轮纹病菌的生长具有较强抑制活性的4种黄皮生物碱类化合物,实属发明人首创。而且本发明4 种黄皮生物碱类化合物可作为抑制疫霉病菌和轮纹病菌生长的抑制剂,也可用于制备农用杀菌剂。
20.本发明利用甲醇先粗提取,再利用酸提碱沉的方法对总生物碱进行提取和富集,再将tcl特征性检测、富集和活性筛选相结合的方法进行抑菌活性生物碱的追踪分离,并成功地利用现代色谱技术对黄皮茎叶中的色素等杂质进行去除,综合运用现代色谱技术分离得到活性生物碱。本发明提取分离方法针对性强、可控性和重现性好,活性成分不容易离散和损失,成本较低,操作简便,适用于工业生产。
附图说明
21.图1为本发明黄皮植物茎叶中抑菌生物碱制备方法的流程图。
具体实施方式
22.本发明提供了一种黄皮生物碱及其盐在制备抑制疫霉病菌和/或轮纹病菌活性产品中的应用,所述黄皮生物碱包括白鲜碱、lansiumamide b、6
‑
甲氧基卡巴唑
‑3‑
羧酸甲酯和卡巴唑
‑3‑
羧酸甲酯中的至少一种。
23.在本发明中,当病菌为疫霉病菌时,所述黄皮生物碱包括白鲜碱、lansiumamide b、6
‑
甲氧基卡巴唑
‑3‑
羧酸甲酯和卡巴唑
‑3‑
羧酸甲酯中的至少一种,当病菌为轮纹病菌时,所述黄皮生物碱至少包括白鲜碱。
24.在本发明中,所述白鲜碱、lansiumamide b、6
‑
甲氧基卡巴唑
‑3‑
羧酸甲酯和卡巴唑
‑3‑
羧酸甲酯化合物的结构式分别为:
[0025][0026]
在本发明中,所述盐优选的包括所述黄皮生物碱与无机酸、有机酸、碱金属、碱土金属或碱性氨基酸反应生成的盐,本发明对于无机酸、有机酸、碱金属、碱土金属或碱性氨基酸的具体种类没有特殊限定,比如无机酸包括硫酸、盐酸、磷酸、硝酸,有机酸包括乙酸、甲磺酸、柠檬酸、酒石酸、乳酸、棕榈酸,碱金属包括钾、钠,碱土金属包括钙、镁,碱性氨基酸包括赖氨酸。本发明对于所述产品的种类没有特殊限定,优选的包括农药、生长抑制剂。本发明对于疫霉病菌和轮纹病菌的具体种类没有特殊限定,所述疫霉病菌优选的包括辣椒、黄瓜和南瓜疫霉病菌,所述轮纹病菌优选的包括梨和苹果轮纹病菌。
[0027]
在本发明中,所述黄皮生物碱的制备方法优选的包括如下步骤:将黄皮茎叶与甲醇混合回流提取,减压浓缩得到甲醇浸膏;将甲醇浸膏进行酸提碱沉得到黄皮总生物碱和非生物碱部分,对黄皮总生物碱部分进行硅胶柱层析粗分离,得到各次级部分,对以上各部分分别进行抑制疫霉原菌活性测试后,对活性较强的次级部分进行tlc检测和活性追踪分离,并结合mci柱层析和rp
‑
18柱层析分离方法对活性生物碱进行分离,最后采用hplc分离纯化得到活性黄皮生物碱成分。
[0028]
本发明对于黄皮茎叶的来源没有特殊限定,可通过市售途径购买所得,也可通过自行采集获得。在本发明中,所述黄皮茎叶优选的需经风干粉碎处理,所述甲醇优选为体积分数为95
‑
99%的甲醇溶液,所述回流提取的温度优选为55
‑
65℃,所述回流提取的次数优选为2
‑
3次,每次回流提取的时间优选为2
‑
3h。
[0029]
在本发明中,对甲醇浸膏进行酸提碱沉时,所用的酸优选为盐酸,所述盐酸的体积分数优选为4
‑
6%,所述甲醇浸膏与盐酸的质量体积比优选为 1:8
‑
1:10。将甲醇浸膏与盐酸充分混悬后,优选的还需加入乙酸乙酯,混匀后静置分层,所述乙酸乙酯的加入量优选的为混悬液量的1/3。分出乙酸乙酯层后,优选的,余液用乙酸乙酯再萃取1
‑
2次,合并乙酸乙酯层,减压浓缩后得到非生物碱部分。剩余水相进行碱沉处理,所述碱优选为氨水,所述碱
沉的ph值优选为9
‑
10,然后用乙酸乙酯进行萃取,萃取的次数优选为3
‑
5 次,合并乙酸乙酯层,减压浓缩得到黄皮总生物碱部分。本发明采用酸提碱沉可富集黄皮总生物碱部分,使目标产物不易离散和损失。
[0030]
在本发明中,对黄皮总生物碱部分进行硅胶柱层析粗分离时所用的硅胶柱目数优选为200
‑
300目,洗脱剂优选为石油醚:丙酮体积比为10:0
‑
0:10,得到33个流分。将这些流分用tlc进行检测,显色剂为5
‑
8%硫酸
‑
无水乙醇,在加热下显色为淡蓝色斑点的各流分按照极性大小不同,合并为9个次级部分fr.1.1
‑
fr.2.9。分别取9个次级部分配制供试药液,进一步进行抑制疫霉原菌活性筛选。根据筛选结果选择抑菌活性最强的fr.2.3和fr.2.5做进一步活性追踪分离。
[0031]
在本发明中,所述获得白鲜碱和lansiumamide b的步骤优选为将fr.2.3 用60目聚酰胺拌样,经中压mci柱层析,所述mci柱层析的洗脱剂优选为甲醇:水=20:80,40:60,60:40,80:20,90:10,100:0梯度洗脱,根据tlc 检测,将具有相同蓝色斑点的流分合并为4个亚组分fr.2.3.1
‑
fr.2.3.4。再进一步将含有主斑点的部分fr.2.3.2进行反复硅胶柱层析,洗脱剂优选为石油醚:丙酮=5:1
‑
3:1,经tlc检测,合并主斑点部分得到混合物fr.2.3.2.3。进一步采用hplc对fr.2.3.2.3进行多次分离和纯化得到化合物白鲜碱和 lansiumamide b,所述hplc的流动相优选为甲醇:水=70:30
‑
80:20。
[0032]
在本发明中,所述获得6
‑
甲氧基卡巴唑
‑3‑
羧酸甲酯和卡巴唑
‑3‑
羧酸甲酯的步骤优选为将fr.2.5经中压rp
‑
18柱层析,所述rp
‑
18柱层析洗脱剂优选为甲醇:水=20:80,40:60,60:40,80:20,100:0,经tlc检测,合并得到 5个亚组分fr.2.5.1
‑
fr.2.5.5。进一步对含有主斑点的fr.2.5.3进行反复硅胶柱层析,洗脱剂优选为石油醚:丙酮=5:1
‑
3:1,得到含有两个主斑点的混合物。经hplc多次分离纯化得到化合物6
‑
甲氧基卡巴唑
‑3‑
羧酸甲酯和卡巴唑
‑3‑ꢀ
羧酸甲酯,所述hplc的流动相优选为甲醇:水=60:40
‑
70:30。
[0033]
通过1h
‑
nmr、
13
c
‑
nmr和ms,并对比文献中的波谱数据将以上化合物鉴定为:白鲜碱(1)(参见:tangjitjaroenkun j,et al.chemical constituentsofthe stems ofzanthoxylum limonellaalston[j].phytochemistry letters,2012, 5(3):443
‑
445),lansiumamide b(2)(参见:jer
‑
huei lin.cinnamamidederivatives from clausena lansium[j].phytochemistry,1989,28(2):621
‑
622), 6
‑
甲氧基卡巴唑
‑3‑
羧酸甲酯(3)(参见:tian
‑
shung wu,et al.carbazolealkaloids from clausena excavata and their biological activity.phytochemistry, 1996,43(1):133
‑
140)和卡巴唑
‑3‑
羧酸甲酯(4)(参见:li w s,et al.carbazolealkaloids from clausena lansium[j].phytochemistry,1991,30(1):343
‑
346)。
[0034]
本发明还提供了一种抑制疫霉病菌和/或轮纹病菌活性的农药,所述农药包括上述黄皮生物碱中的至少一种及其农药学上容许的盐或可接受的载体。
[0035]
本发明对于农药的剂型没有特殊要求,制备成本领域常规的农药剂型均可,比如可为乳油、可湿性粉剂、粉剂、颗粒剂、水乳剂、微乳剂、油剂或缓释剂。本发明对于农药学上可接受的载体类型没有特殊限定,采用本领域常规制备农药的药物载体均可,比如填料(如硅藻土、高岭土、陶土等)、助溶剂(如二甲苯等)、乳化剂(如十二烷基苯磺酸钙等)、润湿剂(如皂角、十二烷基苯磺酸钠等)、分散剂(如木质素磺酸盐等)、渗透剂(如渗透剂等)、粘着剂(如淀粉、明胶等)、稳定剂(如抗氧化剂等)等。在本发明中,所述疫霉病菌优选的包括辣
椒、黄瓜和南瓜疫霉病菌,所述轮纹病菌优选的包括梨和苹果轮纹病菌。
[0036]
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0037]
实施例1
[0038]
取风干的黄皮植物茎叶3.0kg,粉碎后,用95%甲醇回流提取3次(每次用甲醇10l),时间为3h,合并三次甲醇提取液,减压浓缩得到甲醇浸膏(97g);将甲醇浸膏与5%盐酸按照1:10(m:v)充分混悬后,加入1/3混悬液量的乙酸乙酯,充分混匀后,静置分层后,分出乙酸乙酯层,余液用乙酸乙酯再提取2次,合并乙酸乙酯层,减压浓缩后得到非生物碱部分fr.1(54 g)。
[0039]
剩余水相用氨水调至ph 9,然后用乙酸乙酯进行反复萃取5次,合并乙酸乙酯层,减压浓缩得到黄皮总生物碱fr.2(11g)。取适量甲醇提取物、 fr.1和fr.2配制成质量浓度为10mg/ml的粗提物供试药液母液,测试甲醇提取物、fr.1和fr.2对辣椒疫霉病菌的抑菌活性。结果显示,黄皮总生物碱 fr.2对辣椒疫霉病菌的抑菌活性最明显。
[0040]
选择活性明显的fr.2做进一步活性追踪分离。将fr.2经200目硅胶柱层析,洗脱剂为石油醚:丙酮=10:0,10:1,5:1,4:1,3:1,2:1,1;1,0:10,共得到33个流分,将这些流分用tlc进行检测,显色剂为6%硫酸
‑
无水乙醇,在加热下显色为淡蓝色斑点的各流分按照极性大小不同,合并为9个次级部分fr.1.1
‑
fr.2.9。分别取9个次级部分适量,配置成浓度为3mg/ml的供试药液母液,稀释到所需测试浓度,并进一步进行抑制辣椒疫霉病菌活性测试。根据测试结果选择对辣椒疫霉病菌生长抑制活性较强的fr.2.3和fr.2.5做进一步活性追踪分离。
[0041]
将fr.2.3用60目聚酰胺拌样,经中压mci柱层析,洗脱剂为甲醇:水= 20:80,40:60,60:40,80:20,90:10,100:0梯度洗脱,根据tlc检测,将具有相同蓝色斑点的流分合并为4个亚组分fr.2.3.1
‑
fr.2.3.4。再将含有主斑点的部分fr.2.3.2进行反复硅胶柱层析,洗脱剂为石油醚:丙酮=5:1
‑
3:1,经 tlc检测,合并主斑点部分得到混合物fr.2.3.2.3。进一步采用hplc(hplc:安捷伦1260;色谱柱:xdb
‑
c18;粒径:5μm;柱子规格9.4
×
250mm;流速:2ml/min;进样方式:手动进样;流动相:甲醇:水=70:30
‑
80:20)对fr.2.3.2.3 进行多次分离和纯化得到化合物白鲜碱(1)(19mg,6.33ppm)和 lansiumamide b(2)(31mg,10.33ppm)。
[0042]
fr.2.5经中压rp
‑
18柱层析,洗脱剂为甲醇:水=20:80,40:60,60:40, 80:20,100:0,经tlc检测,合并得到5个亚组分fr.2.5.1
‑
fr.2.5.5。然后对含有主斑点的fr.2.5.3进行反复硅胶柱层析,洗脱剂为石油醚:丙酮=5:1
‑
3:1,得到含有主斑点的混合物。经hplc(hplc:安捷伦1260;色谱柱:xdb
‑
c18;粒径:5μm;柱子规格9.4
×
250mm;流速:2ml/min;进样方式:手动进样;流动相:甲醇:水=60:40
‑
70:30)多次分离纯化得到化合物6
‑
甲氧基卡巴唑
‑3‑
羧酸甲酯(3)(21mg,7.00ppm)和卡巴唑
‑3‑
羧酸甲酯(4)(24mg, 8.00ppm)。上述分离方法的具体流程图如图1所示。
[0043]
通过1h
‑
nmr、
13
c
‑
nmr和ms对上述化合物的结构进行鉴定,化合物白鲜碱(1)、lansiumamide b(2)、6
‑
甲氧基卡巴唑
‑3‑
羧酸甲酯(3)和卡巴唑
‑3‑
羧酸甲酯(4)结构鉴定的波谱数据如下:
[0044]
白鲜碱(1):白色固体,c
12
h9no2.esi
‑
ms(pos.)m/z:222[m+na]
+
.1h nmr (400mhz,acetone
‑
d6)δ
h
:8.24(d,j=8.0hz,1h,h
‑
5),7.91(d,j=8.0hz,1h,h
‑
8), 7.87(br.s,1h,h
‑
2
′
),7.70(t,j=8.0hz,1h,h
‑
7),7.46(t,j=8.0hz,1h,h
‑
6),7.38 (br.s,1h,h
‑3′
),4.50(s,3h,h
‑
och3).
13
c nmr(100mhz,acetone
‑
d6)δ
c
:164.7(s, c
‑
2),157.5(s,c
‑
4),146.6(s,c
‑
9),144.9(d,c
‑2′
),130.2(d,c
‑
7),128.6(d,c
‑
8), 124.5(d,c
‑
6),123.2(d,c
‑
5),119.4(s,c
‑
10),106.1(d,c
‑3′
),104.4(s,c
‑
3),59.9(q, c
‑
och3).
[0045]
lansiumamide b(2)淡黄色粉末,esi
‑
ms(pos.)m/z:286[m+na]
+
.1h nmr (400mhz,cdcl3)δ
h
:7.59(1h,d,j=15.8hz,h
‑8′
),7.05
‑
7.42(10h,m),6.87(1h,d, j=15.8hz,h
‑7′
),6.44(1h,d,j=8.0hz,h
‑
8),6.18(1h,d,j=8.0hz,h
‑
7),3.08 (3h,s,n
‑
ch3).
13
c nmr(100mhz,acetone
‑
d6)δ
c
:167.9(s,c
‑9′
),140.4(d,c
‑7′
), 129.9(s,c
‑
1),129.4(d,c
‑
2,6),129.2(d,c
‑2′
,6
′
),128.5(s,c
‑
4),128.3(t,c
‑
8),128.1 (s,c
‑4′
),125.3(s,c
‑1′
),117.0(d,c
‑8′
),115.3(d,c
‑3′
,5
′
),114.9(d,c
‑
3,5),112.6(t, c
‑
7).
[0046]6‑
甲氧基卡巴唑
‑3‑
羧酸甲酯(3):淡黄色粉末,esi
‑
ms(pos.)m/z:278 [m+na]
+
.h nmr(acetone
‑
d6)δ
h
:10.33(s,1h,nh),8.93(1h,brs,h
‑
4),8.27(1h,dd, j=7.8,1.8hz,h
‑
2),7.70(1h,d,j=1.8hz,h
‑
5),7.48(1h,d,j=7.8hz,h
‑
1),7.42 (1h,d,j=7.8hz,h
‑
8),7.18(1h,dd,j=7.8,1.8hz,h
‑
7),4.03(3h,s,3
‑
cooch3), 3.96(3h,s,6
‑
och3).
13
c nmr(100mhz,acetone
‑
d6)δ
c
:167.7(s,3
‑
cooch3), 155.4(s,c
‑
6),142.3(s,c
‑
1a),137.0(s,c
‑
8a),127.5(d,c
‑
2),124.4(s,c
‑
5a),123.6(s, c
‑
4a),123.4(d,c
‑
4),121.2(s,c
‑
3),116.7(d,c
‑
7),112.8(d,c
‑
8),111.4(d,c
‑
1), 103.8(d,c
‑
5),56.1(q,6
‑
och3),51.8(q,3
‑
cooch3).
[0047]
卡巴唑
‑3‑
羧酸甲酯(4):淡黄色粉末,c
15
h
13
no3.esi
‑
ms(pos.)m/z:248 [m+na]
+
.1h nmr(500mhz,acetone
‑
d6)δ
h
:10.74(s,1h,nh),8.83(br.s,1h,h
‑
4), 8.25(d,j=7.6hz,1h,h
‑
5),8.09(dd,j=8.5,1.1hz,1h,h
‑
2),7.59(overlapped,1h, h
‑
8),7.57(m,1h,h
‑
1),7.46(t,j=7.6hz,1h,h
‑
7),7.27(t,j=7.6hz,1h,h
‑
6), 3.92(s,3h,och3).
13
c nmr(125mhz,acetone
‑
d6)δ
c
:168.1(s,cooch3),143.8(s, c
‑
1a),141.6(s,c
‑
8a),127.9(d,c
‑
2),127.4(d,c
‑
7),124.1(s,c
‑
4a),123.8(s,c
‑
5a), 123.3(d,c
‑
4),121.9(s,c
‑
3),121.4(d,c
‑
5),120.8(d,c
‑
6),112.3(d,c
‑
1),111.1(d, c
‑
8),52.1(q,och3).
[0048]
实施例2
[0049]
取风干的黄皮植物茎叶5.0kg,粉碎后,用99%甲醇回流提取2次(每次用甲醇16l),时间为2h,合并三次甲醇提取液,减压浓缩得到甲醇浸膏;将甲醇浸膏与4%盐酸按照1∶8(m∶v)充分混悬后,加入1/3混悬液量的乙酸乙酯,充分混匀后,静置分层后,分出乙酸乙酯层,余液用乙酸乙酯再提取2次,合并乙酸乙酯层,减压浓缩后得到非生物碱部分fr.1。
[0050]
剩余水相用氨水调至ph 10,然后用乙酸乙酯进行反复萃取4次,合并乙酸乙酯层,减压浓缩得到黄皮总生物碱fr.2。取适量甲醇提取物、fr.1和 fr.2配制成质量浓度为10mg/ml的粗提物供试药液母液,测试甲醇提取物、 fr.1和fr.2对辣椒疫霉病菌和梨轮纹病菌的抑菌活性。结果显示,黄皮总生物碱fr.2对梨轮纹病菌和辣椒疫霉病菌的抑菌活性最明显。
[0051]
选择活性明显的fr.2做进一步活性追踪分离。将fr.2经300目硅胶柱层析,洗脱剂为石油醚:丙酮=10:0,10:1,5:1,4:1,3:1,2:1,1;1,0:10,共得到33个流分,将这些流分用tlc进行检测,显色剂为8%硫酸
‑
无水乙醇,在加热下显色为淡蓝色斑点的各流分按照极性大小不同,合并为9个次级部分fr.1.1
‑
fr.2.9。分别取9个次级部分适量,配置成浓度为
3mg/ml的供试药液母液,稀释到所需测试浓度,并进一步进行抑制辣椒疫霉病菌活性测试。根据测试结果选择对辣椒疫霉病菌生长抑制活性较强的fr.2.3和fr.2.5做进一步活性追踪分离。
[0052]
将fr.2.3用60目聚酰胺拌样,经中压mci柱层析,洗脱剂为甲醇:水= 20:80,40:60,60:40,80:20,90:10,100:0梯度洗脱,根据tlc检测,将具有相同蓝色斑点的流分合并为4个亚组分fr.2.3.1
‑
fr.2.3.4。再将含有主斑点的部分fr.2.3.2进行反复硅胶柱层析,洗脱剂为石油醚:丙酮=5:1
‑
3:1,经 tlc检测,合并主斑点部分得到混合物fr.2.3.2.3。进一步采用hplc(hplc:安捷伦1260;色谱柱:xdb
‑
c18;粒径:5μm;柱子规格9.4
×
250mm;流速:2ml/min;进样方式:手动进样;流动相:甲醇:水=70:30
‑
80:20)对fr.2.3.2.3 进行多次分离和纯化得到化合物白鲜碱(1)和lansiumamide b(2)。
[0053]
fr.2.5经中压rp
‑
18柱层析,洗脱剂为甲醇:水=20:80,40:60,60:40, 80:20,100:0,经tlc检测,合并得到5个亚组分fr.2.5.1
‑
fr.2.5.5。然后对含有主斑点的fr.2.5.3进行反复硅胶柱层析,洗脱剂为石油醚:丙酮=5:1
‑
3:1,得到含有主斑点的混合物。经hplc(hplc:安捷伦1260;色谱柱:xdb
‑
c18;粒径:5μm;柱子规格9.4
×
250mm;流速:2ml/min;进样方式:手动进样;流动相:甲醇:水=60:40
‑
70:30)多次分离纯化得到化合物6
‑
甲氧基卡巴唑
‑3‑
羧酸甲酯(3)和卡巴唑
‑3‑
羧酸甲酯(4)。
[0054]
实施例3
[0055]
用丙酮做溶剂将实施例1中获得的黄皮植物甲醇粗提物(甲醇浸膏)配置成浓度为10g/l的母液,将实施例1中获得的总生物碱部分fr.2、非生物碱部分fr.1、粗分离的各部分fr.2.3和fr.2.5分别配置成浓度为3mg/ml的母液。分别吸取上述各母液加入到融化了的pda培养基(约50℃)中,混合均匀后倒入培养皿中,配置成1000、500、250、125和62.5μg/ml浓度梯度的含毒培养基。以混入相同体积的丙酮培养基做对照。用打孔器打取直径为0.6cm的供试辣椒疫霉病菌菌饼,分别接种于含毒培养基和对照培养基中央,有菌丝的一面向下,每个培养皿放置一个菌饼,每处理重复三次,放置于25℃恒温培养箱中培养4d,采用十字交叉法测定菌落直径(cm)。按照以下公式计算抑菌率。
[0056][0057]
根据生物统计几率值换算表,将抑制百分率换算成抑制几率值。以试验中设定的浓度对数为横坐标,抑制几率值为纵坐标,计算甲醇粗提物、总生物碱部分、非生物碱部分和粗分离各部分(fr.2.3,fr.2.5)的毒力回归直线方程和有效中浓度ec
50
。结果如表1所示。
[0058]
表1不同组别对辣椒疫霉病菌生长抑制作用结果
[0059]
[0060]
由表1可以看出,本发明黄皮茎叶甲醇粗提物、总生物碱、粗分离各部分浓度与对辣椒疫霉病菌生长的抑制活性具有较高的线性相关性,总生物碱对于辣椒疫霉病菌具有较高的抑制活性,非生物碱没有抑菌活性。
[0061]
实施例4
[0062]
用丙酮做溶剂将实施例1分离得到的生物碱白鲜碱(1)、lansiumamideb(2)、6
‑
甲氧基卡巴唑
‑3‑
羧酸甲酯(3)和卡巴唑
‑3‑
羧酸甲酯(4)分别配置成浓度为1mg/ml的母液,分别吸取上述各母液加入到融化了的pda 培养基(约50℃)中,混合均匀后倒入培养皿中,配置成浓度为200μg/ml 的含毒培养基。以混入相同体积的百菌清培养基做对照。分别用打孔器打取直径为0.6cm的供试梨轮纹病菌(b.dothidea)和辣椒疫霉病菌(p.capsici) 菌饼,分别接种于含毒培养基和对照培养基中央,有菌丝的一面向下,每个培养皿放置一个菌饼,每处理重复三次,放置于25℃恒温培养箱中培养4d,采用十字交叉法测定菌落直径(cm)。按照实施例3的公式计算抑菌率。结果如表2所示。
[0063]
表2本发明4种黄皮生物碱对梨轮纹和辣椒疫霉病菌的抑制活性结果 (浓度:200μg/ml)
[0064][0065]
由表2可以看出,本发明4种化合物对辣椒疫霉病原菌活性均具有较好抑制作用,化合物1白鲜碱对梨轮纹病原菌活性也具有较好抑制作用。
[0066]
实施例5
[0067]
将实施例1分离获得的化合物1
‑
4,分别加入到4%的硫酸乙醇溶液中, ph=4,过滤,干燥,制成硫酸盐化合物1
‑
4。
[0068]
实施例6
[0069]
将实施例2分离所得化合物1
‑
4,分别加入到4%的盐酸溶液中,ph=4,过滤,干燥,制成盐酸盐化合物1
‑
4。
[0070]
实施例7
[0071]
将实施例1分离所得化合物1
‑
4,分别加入到4%的酒石酸溶液,ph=4,过滤,干燥,制成酒石酸盐化合物1
‑
4。
[0072]
实施例8
[0073]
将实施例1所得化合物1
‑
4按10%溶解在二甲苯有机溶剂中,再加入5%的十二烷基苯磺酸钙乳化剂和2%其他助剂,再用二甲苯补足100%,经搅拌混合配制成一种均相透明的油状液体。
[0074]
实施例9
[0075]
将实施例4所得的盐按10%溶解在二甲苯有机溶剂中,再加入5%的十二烷基苯磺酸钙乳化剂和2%其他助剂,再用二甲苯补足100%,经搅拌混合配制成一种均相透明的油状液体。
[0076]
实施例10
[0077]
将实施例2所得化合物1
‑
4与甲苯有机溶剂、农药乳化剂300号按质量比10:85:5混合成均匀透明的油相,在搅拌下,慢慢加入蒸馏水,开始形成油包水型乳状液,再经搅拌加热,使之迅速转相成水包油型乳状液,冷却至室温,静置过滤得微乳剂。
[0078]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1