细胞冻存试剂盒及其使用方法与流程
1.本发明涉及细胞及生物工程领域,特别是涉及一种细胞冻存试剂盒及其使用方法。
背景技术:
2.干细胞是具有自我更新和多向分化的潜能的特殊细胞群体,包括如胚胎干细胞(embryonic stem cell,es)、诱导多能性干细胞(induced pluripotent stem cells,ipscs)、间充质干细胞(mesenchymal stem cells,mscs)等,干细胞药物开发是当今最具潜力的生物医药产业方向。理论上,干细胞体外培养可保持数量持续增加,同时保留分化为其他类型细胞与器官的生物学潜能,这一特性使得干细胞药物的无限产出成为可能。但传统的干细胞持续性培养通常会导致其衰老和功能丧失,另一方面还将造成生产成本大幅升高,这些都成为限制干细胞产业开发的瓶颈。因此,避免体外持续性传代,将细胞种子长期保存并按需启动备份使用,成为更为合理的模式。
3.细胞冻存是使用最为广泛的长期保存技术,利用超低温环境降低代谢,达到长期储存的目的;冻存细胞可复苏并可活化为功能性细胞。干细胞具有来源珍贵、数量稀少、增殖代数有限等特征,冻存并按需求复苏使用,是其开发标准程序。但是低温冻存及复苏过程中会对细胞产生一定的损伤,主要有以下两类:(1)物理性损伤:细胞胞质的高水合性环境在冷冻与复苏过程中内产生大量冰晶,对内容物造成损害,进而导致细胞死亡。通常添加二甲基亚砜(dimethyl sulfoxide,dmso)等冷冻保护剂以抑制冰晶的形成。dmso能渗透细胞膜进入胞内,增大渗透压,降低冰点,减少胞内冰晶形成;在特定浓度下(小于1%,体积分数)其毒性极小,且在胞内可快速代谢分解,是最为常用的保护剂。(2)化学损伤:氧化应激(oxidation stress,os)是细胞在冻存复苏过程中所受到的最常见的化学损伤有害刺激条件下,产生活性氧自由基(reactive oxygen species,ros),引起dna损伤、基因突变、蛋白质变性并导致细胞死亡或生理学功能发生改变的现象。细胞反复冻融过程中会产生大量的ros,在长期冻存的细胞中(12个月以上),冻融复苏过程中产生的ros是常规培养的5-6倍。通常认为低浓度的dmso是一种有效的ros清除剂(ros scavenger)。但是在高浓度下,dmso(5-10%细胞冻存时使用浓度)则呈相反的生物学效应;冻存复苏后星形胶质细胞ros水平显著增加,凋亡率增高、生长异常,细胞数量和活力明显降低。干细胞冻存实验同样显示,冻存处理会显著提升胞内ros水平(约5倍),导致细胞活率下降;冻融产生的高浓度ros会对细胞的克隆形成率,细胞分化潜能等干细胞的特有生物学功能降。
4.目前在世界范围内已经超过50种的干细胞类药物进入ii期临床阶段。干细胞药物相对于传统药物的治疗周期明显加长,并且干细胞药物制备过程中会多次启动冷冻保存的种子备份,多次冻存复苏程序将产生累积性的冰晶、ros损伤,对干细胞造成不可预见性的物理损伤和化学损伤。另一方面,作为细胞成药过程中的重要辅料成分,冻存体系的生物安全性及生物相容性已经成为了产品质控的重要环节。虽然现阶段dmso仍被认为是最为有效的冻存保护剂;但是由于dmso功能的两面性,对干细胞而言其不算是一种高生物亲和性物
质。因此,本领域亟需开发新的细胞冻存方案,以满足细胞成药技术对冻存细胞的细胞活性以及生物相容性的需求。
技术实现要素:
5.基于此,有必要针对传统的细胞冻存方法容易造成细胞损伤,并且生物安全性和相容性低的问题,提供一种细胞冻存试剂盒及其使用方法。
6.本技术提出了一种细胞冻存试剂盒,所述细胞冻存试剂盒包括第一冻存母液和第二冻存母液,所述第一冻存母液含有90g/l~110g/l的越橘提取物、90g/l~110g/l的羟乙基淀粉、180g/l~220g/l的右旋糖苷40;
7.所述第二冻存母液含有90g/l~110g/l的脯氨酸、180g/l~220g/l的人血清白蛋白、270g/l~330g/l的右旋糖苷40。
8.在其中的一个实施例中,所述第一冻存母液含有100g/l的越橘提取物、100g/l的羟乙基淀粉、200g/l的右旋糖苷40;
9.所述第二冻存母液含有100g/l的脯氨酸、200g/l的人血清白蛋白、300g/l的右旋糖苷40。
10.在其中的一个实施例中,所述细胞冻存试剂盒用于间充质干细胞的冻存前的冻存预处理和/或冻存后的复苏预处理。
11.本技术还提出了一种上述的细胞冻存试剂盒的使用方法,所述使用方法包括以下步骤:
12.细胞冻存缓冲保护体系制备步骤,将所述细胞冻存试剂盒中的所述第一冻存母液和所述第二冻存母液按体积比(0.8~1.2):10混合,制得细胞冻存缓冲保护体系;
13.冻存预处理步骤,将待冻存细胞于含有所述细胞冻存缓冲保护体系的细胞培养基中培养20h~28h。
14.在其中的一个实施例中,在所述细胞冻存缓冲保护体系制备步骤中,所述第一冻存母液和所述第二冻存母液按体积比为1:10混合。
15.在其中的一个实施例中,在所述冻存预处理步骤中,所述细胞冻存缓冲保护体系与所述细胞培养基的体积比为(0.8~1.2):10。
16.在其中的一个实施例中,在所述冻存预处理步骤之后,还包括以下步骤:
17.细胞冻存悬液制备步骤,将所述待冻存细胞重悬于所述细胞冻存缓冲保护中,调整细胞浓度为1
×
106~5
×
106个细胞/ml,制得细胞冻存悬液;
18.冻存步骤,将所述细胞冻存悬液按照冻存程序进行冻存。
19.在其中的一个实施例中,在所述细胞冻存缓冲保护体系制备步骤之前,还包括以下步骤:
20.细胞冻存缓冲保护体系工作浓度确认步骤,将所述待冻存细胞重悬于添加不同体积比所述第一冻存母液的细胞培养基中培养100h~140h,根据培养后的所述待冻存细胞的活率确认所述第一冻存母液的工作浓度。
21.在其中的一个实施例中,所述使用方法还包括以下步骤:
22.复苏预处理步骤,将冻存后的冻存细胞于含有所述细胞冻存缓冲保护体系的复苏培养基中培养40h~56h。
23.在其中的一个实施例中,在所述复苏预处理步骤中,所述细胞冻存缓冲保护体系与所述复苏培养基的体积比为(0.8~1.2):10。
24.上述细胞冻存试剂盒中,采用越橘提取物和脯氨酸作为主要原料,能有效降低细胞冻存过程中因冰晶形成对细胞造成的氧化应激损伤,能够使冻存后的细胞维持细胞活率、形态、增殖能力以及分化潜能,冻存后细胞生物学活性得到保持,冻存代数得到延长,并且以越橘提取物和脯氨酸替代传统的二甲基亚砜作为冷冻保护剂和抗氧剂,进一步提高了生物安全性和相容性。
附图说明
25.图1为本技术实施例1培养的p1~p2代种子细胞的细胞形态图;
26.图2为本技术实施例1培养的p3~p5代工作细胞的细胞形态图;
27.图3为本技术实施例1培养的p0~p15代msc细胞活率曲线图;
28.图4为本技术实施例1的msc细胞活率柱状图;
29.图5为本技术实施例1的msc细胞的生长曲线图;
30.图6为本技术实施例1的msc细胞形态对比图;
31.图7为本技术对比例1的msc细胞形态对比图;
32.图8为本技术实施例1和对比例1的msc细胞活率对比图;
33.图9为本技术实施例1和对比例1的msc细胞生长曲线图;
34.图10为复苏细胞的凋亡功能测定的标准pi-annexin v测定细胞凋亡示意图;
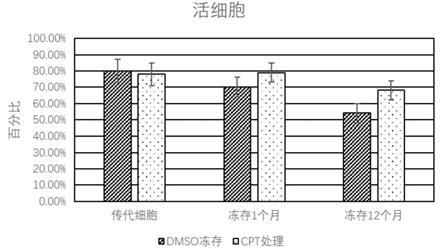
35.图11为实施例1和对比例1的冻存复苏方法对活细胞的细胞凋亡影响图;
36.图12为实施例1和对比例1的冻存复苏方法对死细胞的细胞凋亡影响图;
37.图13为实施例1和对比例1的冻存复苏方法对早期凋亡细胞的细胞凋亡影响图;
38.图14为实施例1和对比例1的冻存复苏方法对凋亡细胞的细胞凋亡影响图;
39.图15为细胞克隆形成功能鉴定的克隆形态图;
40.图16为细胞克隆形成功能鉴定的克隆形成率对比图;
41.图17为分化功能鉴定的成脂肪细胞诱导分化能力鉴定图;
42.图18为分化功能鉴定的成骨细胞诱导分化能力鉴定图;
43.图19为遗传稳定性实验的facs检测msc细胞表面标志物图;
44.图20为遗传稳定性实验的细胞周期示意图;
45.图21为遗传稳定性实验的冻存复苏后培养至p5的细胞周期统计图;
46.图22为遗传稳定性实验的冻存复苏后培养至p20的细胞周期统计图;
47.图23为遗传稳定性实验的冻存复苏后oncogene mrna水平变化图。
具体实施方式
48.为了使本发明的实验目的、技术方案及优点更加清晰明了,以下结合具体实施方式对本发明进一步详细阐述。应当理解的是,此处所描述的具体实施方式仅仅用以解释本发明,但并不用于限定本发明。
49.本技术的第一大方面提出了一种细胞冻存试剂盒,该细胞冻存试剂盒包括第一冻存母液(cpt-a)和第二冻存母液(cpt-b),所述第一冻存母液含有90g/l~110g/l的越橘提
取物、90g/ml~110g/ml的羟乙基淀粉、180g/l~220g/l的右旋糖苷40;所述第二冻存母液含有90g/ml~110g/ml的脯氨酸、180g/ml~220g/ml的人血清白蛋白、270g/ml~330g/ml的右旋糖苷40。
50.上述细胞冻存试剂盒中,采用越橘提取物和脯氨酸作为主要原料,能有效降低细胞冻存过程中因冰晶形成对细胞造成的氧化应激损伤,能够使冻存后的细胞维持细胞活率、形态、增殖能力以及分化潜能,冻存后细胞生物学活性得到保持,冻存代数得到延长,并且以越橘提取物和脯氨酸替代传统的二甲基亚砜作为冷冻保护剂和抗氧剂,进一步提高了生物安全性和相容性。
51.其中,脯氨酸是天然生物小分子,合成人体蛋白质的重要氨基酸之一。在本技术中,脯氨酸作为冰晶抑制剂使用,在冻存过程中,脯氨酸可以渗透入细胞内与水氢键结合,抑制低温条件下冰晶的形成,同时与细胞内水结合减少胞浆水分流失,保护细胞内蛋白质的结构和功能,进而减少氧化应激作用。脯氨酸不仅能够抑制冰晶形成减少氧化应激,而且由于其为合成人体蛋白质的氨基酸之一,故其生物安全性较高,不会对细胞的冻存和复苏造成不良影响。
52.其中,越橘属于杜鹃花科(ericaceae)越橘属(vaccinium spp.)浆果类植物。越橘果实作为重要的视力保护性成分,在欧洲广泛用作功能性食品添加剂,并被联合国粮农组织(fao)确定为人类五大健康食品之一。高纯度欧洲越橘的提取物(myrtocyan)已被收录入欧洲的药典收载,并作用视力缓解制剂使用。在本技术中,采用越橘提取物作为抗氧化剂和ros清除剂,以减轻细胞冻存过程中的ros损伤、提高细胞活率、降低细胞凋亡、保持细胞体外分化潜能。
53.其中,越橘果实的功能性成分有原花青素(oligomeric proantho cyanidins cryoprotective a,opc)、花青素(vma)与花色苷,其中opc是最为强大的抗氧化和ros清除成分。本技术中利用高纯度的越橘提取物,其成分纯度高且种类明确,并且通过验证发现其与脯氨酸配合在细胞冻存过程中能够有效降低氧化应激、清除ros,提高冻存后细胞复苏的存活率。虽然在医药工业中已经开发出利用植物活性成分用于皮肤损伤修复等,但在细胞培养和冻存领域,植物活性成分的应用研究还不成熟,或植物提取物成分复杂,或抗氧化效果并不理想。
54.进一步地,本技术的细胞冻存试剂盒中各组分为生物源性小分子物质,都已被证明具有高度的生物相容性,且已被收入进入药典名录,成分明确,满足干细胞药物生产制备环节中所宣称的化学成分明晰这一特征;并且质量可控,批次间稳定性高,安全性高。此外,该细胞冻存试剂盒还可作为核心辅助性原料进入干细胞类药物产业环节。
55.作为一种优选实施方式,在上述细胞冻存液细胞冻存试剂盒中,第一冻存母液含有95g/l~105g/l的越橘提取物、95g/ml~105g/ml的羟乙基淀粉、190g/l~210g/l的右旋糖苷40;第二冻存母液含有95g/ml~105g/ml的脯氨酸、190g/ml~210g/ml的人血清白蛋白、285g/ml~315g/ml的右旋糖苷40。
56.进一步优选地,在上述细胞冻存试剂盒中,第一冻存母液含有100g/l的越橘提取物、100g/ml的羟乙基淀粉、200g/l的右旋糖苷40;第二冻存母液含有100g/ml的脯氨酸、200g/ml的人血清白蛋白、300g/ml的右旋糖苷40。
57.作为一种可选实施方式,细胞冻存试剂盒中第一冻存母液与第二冻存母液的体积
比为(0.9~1.1):10。进一步优选的,所述细胞冻存试剂盒中所述第一冻存母液与所述第二冻存母液的体积比为1:10。在该实施例中,以脯氨酸为冰晶抑制剂,以原花青素为ros清除剂,并以人血清白蛋白、羟乙基淀粉、右旋糖苷40为缓冲系统模拟适宜细胞生存的人造代血浆。
58.在上述实施例中,优选的,细胞冻存试剂盒的溶剂为生理盐水,即第一冻存母液和第二冻存母液的溶剂为生理盐水。在细胞冻存试剂盒的制备过程中,通过将越橘提取物、羟乙基淀粉、右旋糖苷40溶解于生理盐水中制备第一冻存母液,通过将脯氨酸、人血清白蛋白、右旋糖苷40溶解于生理盐水中制备第二冻存母液。在使用前再将第一冻存母液和第二冻存母液按比例混合制得细胞冻存缓冲保护体系(cpt)。
59.在上述实施例中,可选地,细胞冻存试剂盒的制备方法如下:
60.在避光条件下称取适量的越橘提取物,并溶于生理盐水中;称取适量羟乙基淀粉、右旋糖苷40溶于生理盐水中,作为系统稳定剂;将越橘提取物溶液与羟乙基淀粉、右旋糖苷40溶液混合,并用生理盐水调整终浓度至90g/l~110g/l的越橘提取物、90g/ml~110g/ml的羟乙基淀粉、180g/l~220g/l的右旋糖苷40,制得第一冻存母液避光保存。
61.称取适量脯氨酸溶于生理盐水中;称取适量人血清白蛋白、右旋糖苷40溶于生理盐水中;将脯氨酸溶液和人血清白蛋白、右旋糖苷40溶液混合,并用生理盐水调整终浓度至90g/ml~110g/ml的脯氨酸、180g/ml~220g/ml的人血清白蛋白、270g/ml~330g/ml的右旋糖苷40,制得第二冻存母液保存。
62.作为一种可选实施方式,可通过少量dmso对越橘提取物提供助溶。即第一冻存母液制备方法可以是如下步骤:
63.在避光条件下称取适量的越橘提取物,并溶于少量dmso中;称取适量羟乙基淀粉、右旋糖苷40溶于生理盐水中,作为系统稳定剂;将越橘提取物溶液与羟乙基淀粉、右旋糖苷40溶液混合,并用生理盐水调整终浓度至90g/l~110g/l的越橘提取物、90g/ml~110g/ml的羟乙基淀粉、180g/l~220g/l的右旋糖苷40,制得第一冻存母液避光保存。
64.在使用前将第一冻存母液与第二冻存母液按需要配比混合,制得细胞冻存缓冲保护体系。
65.作为一种可选实施方式,所述细胞冻存试剂盒用于间充质干细胞的冻存前的冻存预处理和/或冻存后的复苏预处理。
66.在该实施例中,通过冻存前的预处理,能够利用越橘提取物和脯氨酸对待冻存的细胞进行保护,以避免其进一步冻存时对待冻存细胞的冰晶或氧化应激损伤,通过冻存后的预处理,能够利用越橘提取物和脯氨酸消除冻存过程中产生的ros,避免其复苏培养过程中ros影响复苏培养的细胞活性,以确保复苏后细胞的保持细胞活率、形态、增殖能力以及分化潜能。
67.其中,间充质干细胞为人间充质干细胞,来源于离体组织;可以为单一来源,也可以是混合来源;可以是种子细胞,也可以是工作细胞。该类人间充质干细胞可以来源于不同的组织,包括但不限于血液、新生儿伴随组织、牙髓、成体脂肪、成体皮肤等可立体的组织,也可包括但不限于经体外诱导扩增的间充质干细胞。其中,新生儿伴随组织包括脐血、脐带、羊膜、胎盘、羊水中的任意一种或几种。在该实施方式中,间充质干细胞的种子细胞优选处于第1-2代,工作细胞优选处于第3-5代。
68.本技术的第二大方面提出了上述细胞冻存试剂盒的使用方法,该使用方法包括以下步骤:
69.细胞冻存缓冲保护体系制备步骤,将细胞冻存试剂盒中的第一冻存母液和所述第二冻存母液按体积比(0.9~1.1):10混合,制得细胞冻存缓冲保护体系;
70.冻存预处理步骤,将待冻存细胞于含有所述细胞冻存缓冲保护体系的细胞培养基中培养20h~28h。
71.作为一种可选实施方式,在所述细胞冻存缓冲保护体系制备步骤中,所述第一冻存母液和所述第二冻存母液按体积比为1:10混合。
72.作为一种可选实施方式,在所述冻存预处理步骤中,所述细胞冻存缓冲保护体系与所述细胞培养基的体积比为(0.8~1.2):10。进一步优选地,所述细胞冻存缓冲保护体系与所述细胞培养基的体积比为1:10。
73.可选地,在冻存预处理步骤中,将待冻存细胞于含有细胞冻存缓冲保护体系的细胞培养基中培养24h,细胞培养基与所述细胞冻存缓冲保护体系的体积比为1:10。
74.例如,待冻存细胞预处理步骤如下:
75.取待冻存细胞株于含有40g/l~60g/l、优选为50g/l血小板裂解液的细胞培养基中,该细胞培养基中不添加血清,于37℃、5%co2环境下培养72h,至融合度为70%~75%;按1:10的体积比将第一冻存母液与第二冻存母液混合,形成完整的细胞冻存缓冲保护体系;按1:10的体积比将细胞冻存缓冲保护体系与细胞培养基混合,将上述待冻存细胞株转至混合后的细胞培养基中,37℃、5%co2环境下继续培养24h,至融合度80%~85%。
76.作为一种可选实施方式,在所述冻存预处理步骤之后,还包括以下步骤:
77.细胞冻存悬液制备步骤,将待冻存细胞重悬于所述细胞冻存缓冲保护体系中,调整细胞浓度为1
×
106~5
×
106个细胞/ml,制得细胞冻存悬液;
78.冻存步骤,将所述细胞冻存悬液按照冻存程序进行冻存。
79.在上述使用方法中,使用的细胞冻存缓冲保护体系中采用越橘提取物和脯氨酸作为主要原料,能有效降低细胞冻存过程中因冰晶形成对细胞造成的氧化应激损伤,冻存后细胞生物学活性得到保持,冻存代数得到延长,并且以越橘提取物和脯氨酸替代传统的二甲基亚砜作为冷冻保护剂和抗氧剂,生物安全性和相容性好。
80.进一步优选地,在细胞冻存悬液制备步骤中,调整细胞浓度为1
×
106个细胞/ml,制得细胞冻存悬液,并将细胞冻存悬液分至冻存管中,每管4.0ml~4.5ml。
81.进一步优选地,细胞冻存缓冲保护体系在使用前于4℃预冷。
82.进一步优选地,在冻存步骤中,冻存程序为将分装有细胞冻存悬液的冻存管于室温下转至4℃放置30min,然后放到程序降温盒中转至-80℃冰箱中储存10h~14h,最后将程序降温盒转至液氮中冻存。
83.可选地,细胞冻存悬液在液氮中冻存期限优选为1~12个月。
84.作为一种可选实施方式,在上述使用方法中,待冻存的细胞为处于第1-2代的种子细胞、处于第3-5代的工作细胞。
85.作为一种可选实施方式,在所述细胞冻存缓冲保护体系制备步骤之前,还包括以下步骤:还包括以下步骤:
86.细胞冻存缓冲保护体系工作浓度确认步骤,将待冻存细胞重悬于添加不同体积比
所述第一冻存母液的细胞培养基中培养100h~140h,根据培养后的待冻存细胞的活率确认第一冻存母液的工作浓度。
87.通过细胞冻存缓冲保护体系工作浓度确认步骤,能够得到细胞冻存缓冲保护体系的最佳工作浓度,以使在进行冻存预处理、冻存以及复苏预处理中,采用更佳的工作浓度,从而获得更好的细胞冻存复苏效果。
88.进一步优选地,在细胞冻存缓冲保护体系工作浓度确认步骤中,将待冻存细胞重悬于添加不同体积比所述第一冻存母液的细胞培养基中培养120h,根据培养后的待冻存细胞的活率确认第一冻存母液的工作浓度;
89.其中,混合后的细胞培养基中越橘提取物的终浓度可以分别为0g/l、0.5g/l、1.0g/l、2.0g/l、5.0g/l、10.0g/l、20.0g/l等,此外,还可以根据实际的需要调整为其他终浓度范围。
90.在上述实施例中,细胞培养基为含有40g/l~60g/l的人血小板裂解液的生理盐水溶液。其中,人血小板裂解液中无血清添加物。
91.作为一种可选实施方式,在上述使用方法中,还包括以下步骤:
92.复苏预处理步骤,将冻存后的冻存细胞于含有所述细胞冻存缓冲保护体系的复苏培养基中培养40h~56h。
93.进一步可选地,在复苏预处理步骤之前,还包括以下步骤:
94.解冻步骤,将冻存后的细胞冻存悬液于37℃水浴1min后,离心后获得冻存细胞。
95.作为一种可选实施方式,在所述复苏预处理步骤中,所述细胞冻存缓冲保护体系与所述复苏培养基的体积比为(0.8~1.2):10。
96.例如,在复苏预处理步骤中,将所述冻存细胞于含有细胞冻存缓冲保护体系的复苏体系中,于37℃、5%co2环境下培养48h。其中,所述细胞冻存缓冲保护体系与所述复苏培养基的体积比为1.0:10。
97.实施例1
98.高生物安全性人源间充质干细胞的培养:
99.按间充质干细胞的临床试验产品标准,在gmp车间之中进行间充质干细胞的大规模扩增。
100.采集健康人的脐带、羊膜、胎盘、脂肪等组织,磷酸缓冲液(pbs)洗掉血管中的残留血液,分离并去除血管组织及血细胞,将剩余组织剪碎至约1~2mm2组织块;移至1g/l胶原酶ii中,37℃消化2h,2000r/min离心10min;取下层沉淀用2.5g/l胰蛋白酶消化20min,2000r/min离心10min;弃上清,保留沉淀,用pbs吹打成悬液,100μm滤网过滤,2000r/min离心10min,获得单细胞;pbs洗涤2次,以20000/cm2的密度接种于添加50g/l浓度人血小板裂解物的间充质干细胞无血清的细胞培养基中,于37℃、50g/lco2饱和湿度环境下培养;2天后除去未贴壁细胞,更换新鲜细胞培养基,每3~4天换新鲜细胞培养基,当细胞生长至约80%融合时,按3000/cm2的密度进行传代。其中,定义p1-p2代为种子细胞,p3-p5代为工作细胞。
101.对各代细胞取样,通过显微镜镜检观察细胞形态,由图1所示的p1~p2代种子细胞可以看出,间充质干细的胞原代细胞呈现出典型的梭状形态,贴壁较为松散;由图2所示的p3~p5代工作细胞可以看出,间充质干细胞的传代细胞呈现典型的梭状形态,贴别紧密,内
容物充盈至整个胞浆。
102.对各代细胞取样,使用台盼蓝染色,进行细胞计数进而计算细胞活率,细胞活率如表1所示,活率曲线图如图3所示。由图3所示的活率曲线图可以看出,间充质干细胞的种子细胞的活率较低,当传代条件逐渐稳定后,工作细胞活率维持在》85%。
103.表1冻存细胞各代细胞活率
[0104][0105][0106]
细胞冻存试剂盒的制备和最佳工作浓度确认:
[0107]
称取越橘提取物0.1g并将其溶于100ul的dmso中;准确称取聚合度为100的羟乙基淀粉(hes100)0.1g、聚合度40的葡聚糖(dextran 40)0.2g溶于500ul 9.0g/l nacl溶液中,0.22μm滤膜除菌过滤;在无菌状态下混合越橘提取物溶液与hes100、dextran40溶液,用9.0g/l nacl溶液定容至1ml,获得第一冻存母液,其中含有越橘提取物100g/l,hes100 100g/l,dextran40200g/l。
[0108]
称取脯氨酸(proline)10g、人血清白蛋白(hsa)20g、右旋糖苷40(dextran 40)30g,用适量pbs溶解并最终定容至100ml,0.22μm滤膜除菌过滤,获得第二冻存母液,其中含有proline 100g/l、hsa200 g/l、dextran40300g/l。
[0109]
将第一冻存母液按不同体积比添加至细胞培养基中,至越橘提取物终浓度分别为0g/l、0.5g/l、1.0g/l、2.0g/l、5.0g/l、10.0g/l、20.0g/l;正常对数生长期msc细胞,至细胞融合度为70%~75%时分别接种于上述细胞培养基中,并于37℃、50g/l co2饱和湿度环境下继续培养120h。
[0110]
在间充质干细胞培养24h时以及培养48h时取样,使用台盼蓝染色,进行细胞计数进而计算细胞活率,不同越橘提取物终浓度、不同作用时间的细胞活率如表2所示,柱状图
如图4所示,并进一步根据该细胞活力结果确定第一冻存母液的最佳工作浓度。
[0111]
表2不同越橘提取物终浓度、不同作用时间的细胞活率
[0112]
时间(hr)24hr细胞活率48hr细胞活率085%85%0.5g/l82%82%1.0g/l82%84%2.0g/l74%71%5.0g/l52%37%10g/l31%14%20g/l19%10%
[0113]
由图4可知,msc细胞对不同浓度的第一冻存母液反应不同,当越橘提取物终浓度在0.5g/l~1.0g/l区间时,培养48h对于细胞活率基本不造成影响,细胞活率在85%以上;而当越橘提取物终浓度高于2.0g/l时候细胞活率大幅度降低,故在本技术中,细胞冻存缓冲保护体系工作浓度优选为越橘提取物在培养基中的终浓度为0.5g/l~2.0g/l,可以为0.5g/l、0.6g/l、0.7g/l、0.8g/l、0.9g/l、1.0g/l、1.1g/l、1.2g/l、1.3g/l、1.4g/l、1.5g/l、1.6g/l、1.7g/l、1.8g/l、1.9g/l、2.0g/l,越橘提取物在培养基中的终浓度可以是上述终浓度中的任意一种或介于任意相邻的两种终浓度之间。而在本技术的以下实施例中,选取间充质干细胞细胞耐受的最大越橘提取物终浓度2.0g/l为最佳工作浓度,尽可能大地发挥越橘提取物的作用。
[0114]
按越橘提取物终浓度为0.01%将第一冻存母液添加至细胞培养基中进行,,并间隔12h时间取样,使用台盼蓝染色,进行细胞计数结果如表3所示,获得msc细胞的生长曲线图如图5所示。
[0115]
表3细胞生长对比数据
[0116]
时间/h未处理培养基含越橘提取物终浓度为1.0g/l的细胞培养基01.00e+051.00e+05121.20e+051.30e+05241.90e+052.10e+05484.30e+054.50e+05729.10e+058.90e+05961.77e+061.63e+061201.89e+061.75e+06
[0117]
如图5所示,在细胞培养基中越橘提取物终浓度为0.01%时,msc细胞生长曲线未见异常。
[0118]
在本技术的上述实施例中,以间充质干细胞为例选取以越橘提取物终浓度2.0g/l为最佳工作浓度,但是对其他细胞进行冻存时,宜根据上述方法重新确认相应的最佳工作浓度。
[0119]
间充质干细胞的冻存预处理:
[0120]
本实施例中以工作细胞作为待冻存细胞,正常对数生长期msc细胞,至细胞融合度为80%时2.5g/l胰蛋白酶消化,用新鲜细胞培养基吹打后制成细胞悬液,2000r/min离心
10min去除上清,将细胞沉淀置于冰上;将上述间充质干细胞在冻存前24h进行冻存预处理,即按体积比1:10在间充质干细胞的细胞培养基中添加细胞冻存缓冲保护体系,并于37℃,50g/l co2饱和湿度环境下继续培养24h再如前步骤收获细胞。
[0121]
对冻存预处理后冻存前的细胞取样,在显微镜镜检观察细胞形态;并使用台盼蓝染色,进行细胞计数并进行细胞活率计算。
[0122]
间充质干细胞的冻存:
[0123]
将冻存预处理后的间充质干细胞以细胞冻存缓冲保护体系重悬细胞,调整细胞浓度为1
×
106个细胞/ml,将细胞悬液分至冻存管内,每管4ml~4.5ml,拧紧盖子如前重悬细胞,并在管壁上做好标记,标明细胞名称、冻存日期等;按下列顺序依次降温:室温
→
4℃30min
→
程序将温盒-80℃过夜
→
液氮。
[0124]
间充质干细胞的复苏预处理及复苏培养:
[0125]
当需要复苏细胞时从液氮中取出冻存管,直接浸入37℃温水中1min,并不时摇动令其尽快融化;37℃水浴中取出冻存管,于超净台中打开盖子,用枪头吸出细胞悬液,加到15ml离心管中,离心管中已预先加入了3ml复苏培养基,轻弹混匀;1000rpm,5min离心去除上清液,轻轻敲打重悬细胞,加入含有细胞冻存缓冲保护体系的复苏培养基(所述细胞冻存缓冲保护体系与所述复苏培养基的体积比为1:10),轻弹重悬细胞,调整细胞密度,接种培养皿,37℃,50g/lco2饱和湿度环境下继续培养24h,更换一次复苏培养基,继续进行复苏培养。
[0126]
对冻存1个月的间充质干细胞和冻存12个月的间充质干细胞分别按照上述复苏预处理和复苏培养步骤进行复苏,通过显微镜镜检观察复苏后细胞形态,并使用台盼蓝染色,进行细胞计数并进一步计算细胞活率。同时,对复苏后的间充质干细胞于标准条件下继续msc的传代培养,每天取样测定绘制复苏细胞的生长曲线。
[0127]
本实施例中冻存预处理24h的细胞形态均未显示出细胞形态学异常,且呈现出典型的梭状细胞形态,内容如充盈至整个胞浆;冻存1个月后复苏的细胞形态和冻存12个月后复苏的细胞形态也未出现细胞形态学异常,并呈现出典型的梭状细胞形态。
[0128]
实施例2
[0129]
实施例2与实施例1各步骤相同,不同之处在于间充质干细胞的冻存步骤中,以dmso冻存液进行冻存。
[0130]
于无菌状态下,按照人血清白蛋白:dextran40:dmso的体积比为2:7:1配置dmso冻存液,在无菌条件下将dmso冻存液逐滴加入冻存预处理后的细胞中重悬该细胞,制得dmso冻存细胞悬液,调整细胞浓度为1
×
106个细胞/ml,将细胞悬液分至冻存管内,每管4ml~4.5ml,拧紧盖子如前重悬细胞,并在管壁上做好标记,标明细胞名称、冻存日期等;按下列顺序依次降温:室温
→
4℃30min
→
程序将温盒-80℃过夜
→
液氮。
[0131]
如图6所示,从左至右分别为本实施例中冻存前利用细胞冻存缓冲保护体系进行冻存预处理24h的细胞形态、利用dmso冻存液冻存1个月后复苏的细胞形态、利用dmso冻存液冻存12个月后复苏的细胞形态,从图中可知细胞冻存缓冲保护体系进行冻存预处理后的细胞未显示出细胞形态学异常,呈现出典型的梭状细胞形态,内容如充盈至整个胞浆;经细胞冻存缓冲保护体系进行冻存预处理再进行dmso冻存液冻存复苏的细胞未见形态学异常,可见,经过细胞冻存缓冲保护体系进行冻存预处理和复苏预处理,能够与传统的dmso冻存
液冻存过程兼容,并且能够有效避免dmso冻存液带来的化学损伤,提高确保dmso冻存液冻存后细胞的活率、形态、增殖能力以及分化潜能,冻存后细胞生物学活性得到保持,冻存代数得
[0132]
对比例1
[0133]
对比例1的待冻存的间充质干细胞未经本技术的细胞冻存缓冲保护体系或dmso冻存液预处理,直接以间充质干细胞以dmso冻存液进行冻存。
[0134]
间充质干细胞的冻存:
[0135]
于无菌状态下配制标准dmso冻存液,按照人血清白蛋白:dextran40:dmso的体积比为2:7:1配置dmso冻存液,在无菌条件下将dmso冻存液逐滴加入待冻存的间充质干细胞重悬该待冻存细胞,制得dmso冻存细胞悬液,调整细胞浓度为1
×
106个细胞/ml,将细胞悬液分至冻存管内,每管4ml~4.5ml,拧紧盖子如前重悬细胞,并在管壁上做好标记,标明细胞名称、冻存日期等;按下列顺序依次降温:室温
→
4℃30min
→
程序将温盒-80℃过夜
→
液氮。
[0136]
对未经细胞冻存液进行冻存预处理的待冻存细胞取样,在显微镜镜检观察细胞形态;并使用台盼蓝染色,进行细胞计数并进行细胞活率计算。
[0137]
间充质干细胞的复苏培养:
[0138]
当需要复苏细胞时从液氮中取出冻存管,直接浸入37℃温水中1min,并不时摇动令其尽快融化;37℃水浴中取出冻存管,于超净台中打开盖子,用枪头吸出细胞悬液,加到15ml离心管中,离心管中已预先加入了3ml复苏培养基,轻弹混匀;1000rpm,5min离心去除上清液,轻轻敲打重悬细胞,加入复苏培养基,轻弹重悬细胞,调整细胞密度,接种培养皿,37℃,50g/lco2饱和湿度环境下继续培养24h,更换一次复苏培养基,继续进行复苏培养。
[0139]
对冻存1个月的间充质干细胞和冻存12个月的间充质干细胞分别按照上述复苏步骤进行复苏,通过显微镜镜检观察复苏后细胞形态,并使用台盼蓝染色,进行细胞计数并进一步计算细胞活率。同时,对复苏后的间充质干细胞于标准条件下继续msc的传代培养,每天取样测定绘制复苏细胞的生长曲线。
[0140]
如图7所示,从左至右分别为本实施例中冻存前的细胞形态、利用dmso冻存液冻存1个月后复苏的细胞形态、利用dmso冻存液冻存12个月后复苏的细胞形态,从图中可知冻存前的细胞未显示出细胞形态学异常,呈现出典型的梭状细胞形态,内容如充盈至整个胞浆;经dmso冻存液冻存1个月和12个月后复苏的细胞未见形态学异常。
[0141]
进一步地,如图8所示,示出了本技术实施例1和对比例1的冻存前、冻存1个月后复苏以及冻存12个月后复苏的间充质干细胞的细胞活率,其中,实施例1的冻存前细胞活率为经过冻存预处理后、冻存前的细胞活率。
[0142]
相比于原代细胞直接进行培养的传代细胞,冻存复苏后的细胞活率均有所降低;随着冻存深度的增加,细胞活率进一步降低;而相对于对比例1的dmso标准冻存处理,本技术实施例1使用本技术的冻存细胞缓冲保护体系进行冻存1月后以及冻存12月后,均可有效提升细胞活率,并且本技术的细胞冻存缓冲保护体系对长时间冻存细胞的保护更加明显。
[0143]
如图9所示,示出了传代细胞、本技术实施例1以及对比例1的不同冻存时间后复苏细胞生长曲线。从图中可以看出,与传代细胞相比,dmso冻存后的细胞进入对数生长期的时间明显滞后,其滞后期与冻存时间正相关;本技术的细胞冻存缓冲保护体系可明显消减冻
存所造成的生长滞后效应。
[0144]
复苏细胞的凋亡功能测定:
[0145]
复苏细胞的凋亡功能测定方法为以1.25g/l胰蛋白酶(不含edta)消化细胞形成单细胞悬液,4℃预冷生理盐水洗涤细胞两次;1500rpm 5min,离心收集细胞弃上清;使用400μl annexin v结合液悬浮细胞,调整细胞浓度约为106cells/ml;在细胞悬液中加入5μl annexin v-fitc染色液,2-8℃避光反应15min;5-10μl pi-rnase溶液于2-8℃下,避光反应5min;流式细胞仪检测,测定细胞凋亡水平。
[0146]
采用上述方法分别对实施例1的冻存前利用细胞冻存缓冲保护体系预处理24h的细胞、冻存1个月后的复苏细胞、冻存12个月后复苏细胞测定细胞凋亡水平。
[0147]
采用上述方法分别对对比例1的冻存前细胞、冻存1个月后的复苏细胞、冻存12个月后复苏细胞测定细胞凋亡水平。
[0148]
如图10所示,pi-annexin v方法是测定细胞凋亡的经典方法,通过测定细胞在凋亡过程中膜通透性与凋亡特异性蛋白表达双参数,可以区分活细胞、死细胞、早期凋亡与晚期凋亡细胞。
[0149]
图11至图14分别示出了实施例1和对比例1的活细胞、死细胞、早期凋亡细胞以及凋亡细胞的百分比柱状图,从这些图中可以看出,冻存复苏会造成死亡细胞与凋亡细胞群体的增加,随着冻存时间的增加,细胞死亡与凋亡情况加剧;在冻存过程中使用本技术的细胞冻存缓冲保护体系进行相应的处理,可有效降低早期凋亡细胞群体,阻止细胞进入凋亡过程。
[0150]
复苏细胞的细胞克隆形成功能鉴定:
[0151]
复苏细胞的细胞克隆形成功能鉴定方法为取复苏后对数生长期的间充质干细胞悬液,反复吹打使细胞充分分散,将细胞以250个/孔接种至六孔板中,十字方向轻轻晃动六孔板,使细胞分散均匀,加3ml培养液,培养14d后,将细胞用4%多聚甲醛固定20min,弃固定液,晾干;加入结晶紫染液,染色10~20min,弃染色液;pbs冲洗干净。计数大于50个细胞的克隆数,进而计算克隆形成率。克隆形成率=克隆数/接种细胞数
×
100%。
[0152]
采用上述方法分别对实施例1的传代细胞、冻存12个月后的复苏细胞以及对比例1的冻存12个月后复苏细胞测定克隆形成功能鉴定。
[0153]
如图15所示,从左至右分别为实施例1的传代细胞,对比例1dmso冻存12月后复苏细胞,实施例1cpt冻存12月后复苏细胞的克隆形体,无论是dmso冻存,还是本技术的cpt冻存,细胞都显示出克隆形成能力。
[0154]
如图16所示,为不同冻存液冻存后克隆形成率(cfu)对比图,从中可以看出,细胞经过冻存都会对其后期的克隆形成产生一定的影响,随着冻存深度(冻存时长的增加)克隆形成能力进一步受损;在短期实验中(冻存时间1个月)标准dmso冻存与cpt处理后其克隆形成能力没有显著性差异;cpt对于深度冻存细胞的保护性能力要明显强于使用标准dmso冻存。
[0155]
复苏细胞的分化功能鉴定
[0156]
取复苏后对数生长期间充质干细胞进行成脂肪细胞和成软骨细胞诱导分化实验。将间充质干细胞制成单细胞悬液,以2
×
104/cm2的密度接种于12孔板中,每孔加入间充质干细胞无血清完全培养基2ml;37℃,5%co2培养,待细胞达80%融合,倾去旧的培养液,每
孔加入2ml分化成软骨诱导分化培养基或者成脂诱导分化培养基;每3~4天换液,诱导2~3周;2~3周后,成骨分化进行茜素红染色,成脂分化用油红o染色。
[0157]
采用上述方法分别对实施例1的传代细胞、冻存12个月后的复苏细胞以及对比例1的冻存12个月后复苏细胞诱导分化。
[0158]
如图17所示,从左至右分别为传代细胞、dmso冻存后,cpt冻存处理后的成脂肪细胞诱导分化能力鉴定图,从图中可以看出dmso冻存,cpt预处理冻存后复苏的细胞都显示出与传代细胞相似的成脂分化功能。
[0159]
如图18所示,从左至右分别为传代细胞、dmso冻存后,cpt冻存处理后的成骨细胞诱导分化能力鉴定图,从图中可以看出dmso冻存,cpt预处理冻存后复苏的细胞都显示出与传代细胞相似的成骨分化功能。显示出cpt处理后的细胞均能良好的保持间充质干细胞的生物学功能。
[0160]
复苏细胞的遗传稳定性实验
[0161]
取传代细胞连续培养至第20代(p20),取dmso冻存后的细胞连续培养至p20,去cpt冻存处理后的细胞连续培养至p20;消化收集单细胞,离心去除培养上清;一部分细胞加入-20℃冷乙醇固定细胞,并于37℃条件下使用0.5mg/ml的碘化丙啶-rnase,进行细胞染色,在流式细胞仪上测定细胞周期,并使用fcs express测定细胞周期,每个样本测量细胞数量不小于1万个;另取约500万个细胞,使用pbs洗涤2次,加入1ml rna提取液trizol于冰上静置5min,吹打混匀,加入200ul三氯甲烷,室温静置5min;4℃,12000rpm,20min,收集上层透明rna溶液,加入等体积的异丙醇,室温静置10min;4℃,12000rpm,20min,离心收集沉淀,75%乙醇洗涤一次,4℃,12000rpm,20min;干燥后总rna溶于30ul depc水中;使用rna反转录试剂盒,反转录为cdna;使用p53,c-myc基因rt-pcr试剂盒检测oncogene的转录水平,使用gapdh转录水平作为内参;比较经不同冻存方法复苏培养细胞的p53,c-myc基因的转录水平改变改变倍数(即p20代表达量/p3代表达量).
[0162]
其中,图19显示了facs检测msc细胞表面标志物图。进一步地,实施例1的间充质干细胞表型检测结果如表4所示。
[0163]
表4间充质干细胞表型检测结果(流式细胞术)
[0164][0165]
如图21和图22所示,细胞周期变化,在低培养代数时标准dmso冻存及cpt处理冻存后复苏的细胞,均显示与传代细胞类似的细胞周期分布图,细胞群体中处于s期的细胞均超过20%;而随着培养代数的增加,细胞周期发生变化,s期细胞群体减少,预示细胞增殖能力减弱及潜在的基因组不稳定性升高,其中dmso处理后s期细胞较其他两组更为减少。
[0166]
图23显示出与干细胞潜在致癌性相关的oncogene在不同条件下的改变。随着培养代数的升高(即细胞衰老程度的增加),p53,p21与c-myc基因的mrna水平均有所升高;经dmso冻存复苏后,表达量差异更加明显,经cpt无法阻止传代oncogene基因转录水平的升高,但可以延缓此升高的趋势。
[0167]
通过以上实施例可以验证,本技术的细胞冻存试剂盒与标准dmso冻存程序相比,经细胞冻存试剂盒保护性预处理可明显提高细胞复苏活率;使用cpt的冻存msc,相关干细胞生物学活性的到保持,相比传统冻存体系,细胞冻存代数延长(普通冻存12-15代,cpt15-18代);本技术中植物性保护剂配方与用传统的dmso冻存体系完全兼容,在保证dmso抑制冻存冰晶形成的前提下,同时降低冰晶解冻所产生氧化应激损伤。
[0168]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1