一种香草兰脱毒种苗的高通量繁育方法
的ms改良培养基。
12.优选的,所述增殖生根培养基为含有0.1mg/l naa、0.05mg/l ga3的vm培养基。
13.本发明提供了一种香草兰脱毒种苗的高通量繁育方法,其特征在于,包括以下步骤:
14.a)将香草兰豆荚消毒,得到灭菌后的豆荚;
15.b)将灭菌后的豆荚取出种子,接种到权利要求1~4任意一项所述的无菌种子萌发培养基上进行种子无菌萌发,得到脱毒芽段;
16.c)将脱毒芽段接种到权利要求1~4任意一项所述的丛生芽诱导培养基上进行丛生芽诱导,得到丛生芽;
17.d)将将丛生芽进行分株后,接种到权利要求1~4任意一项所述的增殖生根培养基上进行增殖生根,得到完整植株。
18.优选的,步骤a)所述消毒方法具体为:将香草兰豆荚表面依次经多菌灵溶液浸泡、百菌清溶液浸泡、无菌水清洗;而后转入无菌工作台上,用75%酒精将豆荚表面消毒,无菌水冲洗,再用升汞浸泡,无菌水冲洗,得到灭菌后的豆荚。
19.优选的,步骤a)所述多菌灵溶液的质量浓度为0.05wt%;多菌灵溶液浸泡时间为1~2h;所述百菌清溶液的质量浓度为0.1wt%;百菌清溶液浸泡时间为0.5~1h;无菌水清洗的次数为4~5次;所述升汞的浓度为0.1wt%。
20.优选的,所述无菌萌发的时间为20d~30d;所述丛生芽诱导的时间为35d~45d所述增殖生根的时间为20d~35d。
21.优选的,所述丛生芽诱导的温度为26~30℃;所述丛生芽诱导需要在光照的条件下进行,所述光照强度1000~1200lux、光照周期8h/d。
22.优选的,所述增殖生根的温度为26~30℃;所述增殖生根需要在光照的条件下进行,所述光照强度800~1000lux、光照周期12h/d。
23.与现有技术相比,本发明提供了一种香草兰脱毒种苗的高通量繁育方法,包括以下步骤:a)将香草兰豆荚消毒,得到灭菌后的豆荚;b)将灭菌后的豆荚取出种子,接种到权利要求1~4任意一项所述的无菌种子萌发培养基上进行种子无菌萌发,得到脱毒芽段;c)得将脱毒芽段接种到权利要求1~4任意一项所述的丛生芽诱导培养基上进行丛生芽诱导,得到丛生芽;d)将将丛生芽进行分株后,接种到权利要求1~4任意一项所述的增殖生根培养基上进行增殖生根,得到完整植株。
24.本发明以不同外植体脱毒方法和培养基作为对照方法,与本发明方法在相同环境条件下进行培养,结果显示,只有以0.05%多菌灵溶液、0.1%百菌清、75%酒精、0.1%升汞组合为消毒脱毒方法,才能得到脱毒茎段,最终获得脱毒丛生芽,只用75%酒精为消毒脱毒方法,在培养中种子染菌无法萌发,没有获得脱毒茎段或脱毒丛生芽,因此在香草兰种子脱毒萌发与脱毒丛生芽再生方面,本发明方法显著优于各对照方法。
25.本发明方法选择脱毒的香草兰种子作为外植体,无菌种子萌发培养基配方:不加有机元素的ms改良培养基,添加6
‑
苄氨基腺嘌呤(6
‑
ba)、萘乙酸(naa)和赤霉素(ga3);丛生芽诱导培养基配方:以ms为基础培养基,添加6
‑
苄氨基腺嘌呤(6
‑
ba)和萘乙酸(naa),实现了无菌种子通过培养,能够拥有10根以上脱毒丛生芽的分化率,对日后的香草兰脱毒种苗的高通量繁育与基因工程学研究具有重要意义。
附图说明
26.图1为本发明香草兰脱毒种苗高通量繁育技术。
具体实施方式
27.本发明提供了一种香草兰脱毒种苗的高通量繁育方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都属于本发明保护的范围。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
技术实现要素:
、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
28.本发明提供了一种香草兰脱毒种苗的培养基组合,包括无菌种子萌发培养基、丛生芽诱导培养基和增殖生根培养基;
29.所述无菌种子萌发培养基包括:0.3~1.0mg/l 6
‑
ba、0.1~1.0mg/l naa和0.1~0.5mg/l ga3;
30.所述丛生芽诱导培养基包括:1.0~2.5mg/l 6
‑
ba和0.1~0.5mg/l naa。
31.所述增殖生根培养基包括:0.1~0.5mg/l naa和0.05~0.1mg/l ga3。
32.本发明提供的一种香草兰脱毒种苗的培养基组合,包括无菌种子萌发培养基;所述无菌种子萌发培养基包括:0.3~1.0mg/l 6
‑
ba、0.1~1.0mg/l naa和0.1~0.5mg/l ga3;优选的,所述无菌种子萌发培养基为含有0.5mg/l 6
‑
ba、0.1mg/l naa、0.1mg/l ga3的ms改良培养基。
33.本发明提供的一种香草兰脱毒种苗的培养基组合,包括丛生芽诱导培养基;所述丛生芽诱导培养基包括:1.0~2.5mg/l 6
‑
ba和0.1~0.5mg/l naa;优选的,所述丛生芽诱导培养基为含有1.0mg/l 6
‑
ba、0.1mg/l naa、0.1mg/l ga3的ms改良培养基。
34.本发明提供的一种香草兰脱毒种苗的培养基组合,包括增殖生根培养基;所述增殖生根培养基包括:0.1~0.5mg/l naa和0.05~0.1mg/l ga3;优选的,所述增殖生根培养基为含有0.1mg/l naa、0.05mg/l ga3的vm培养基。
35.本发明提供了一种香草兰脱毒种苗的高通量繁育方法,其特征在于,包括以下步骤:
36.a)将香草兰豆荚消毒,得到灭菌后的豆荚;
37.b)将灭菌后的豆荚取出种子,接种到权利要求1~4任意一项所述的无菌种子萌发培养基上进行种子无菌萌发,得到脱毒芽段;
38.c)将得到的脱毒芽段接种到权利要求1~4任意一项所述的丛生芽诱导培养基上进行丛生芽诱导,得到丛生芽;
39.d)将丛生芽进行分株后,接种到权利要求1~4任意一项所述的增殖生根培养基上进行增殖生根,得到完整植株。
40.本发明提供了一种香草兰脱毒种苗的高通量繁育方法,首先将香草兰豆荚消毒,得到灭菌后的豆荚。
41.本发明所述消毒方法具体为:将香草兰豆荚表面依次经多菌灵溶液浸泡、百菌清溶液浸泡、无菌水清洗;而后转入无菌工作台上,用75%酒精将豆荚表面消毒,无菌水冲洗,再用升汞浸泡,无菌水冲洗,得到灭菌后的豆荚。
42.将香草兰豆荚表面依次经多菌灵溶液浸泡;所述多菌灵溶液的质量浓度为0.05wt%;多菌灵溶液浸泡时间优选为1~2h;更优选为2h;无菌水清洗的次数为4~5次;
43.百菌清溶液浸泡、无菌水清洗;所述百菌清溶液的质量浓度为0.1wt%;无菌水清洗的次数为4~5次;百菌清溶液浸泡时间优选为0.5~1h;更优选为0.5h。
44.而后转入无菌工作台上,用75%酒精将豆荚表面消毒,无菌水冲洗;所述无菌水冲洗次数为3次;再用升汞浸泡,无菌水冲洗,得到灭菌后的豆荚。
45.所述升汞的浓度为0.1wt%;浸泡时间为0.5h。浸泡后无菌水冲洗4
‑
5次;
46.将灭菌后的豆荚取出种子,接种到上述技术方案任意一项所述的无菌种子萌发培养基上进行种子无菌萌发,得到脱毒芽段。本发明对于所述无菌种子萌发培养基上述已经有了清楚的限定,在此不再赘述。
47.本发明所述无菌种子萌发的条件为26~30℃;暗培养。所述无菌萌发的时间为20d~30d;
48.得将脱毒芽段接种到上述技术方案任意一项所述的丛生芽诱导培养基上进行丛生芽诱导,得到丛生芽。本发明对于所述丛生芽诱导培养基上述已经有了清楚的限定,在此不再赘述。
49.本发明所述丛生芽诱导的温度为26~30℃;暗光照;所述丛生芽诱导的时间为35d~45d。
50.优选的,所述丛生芽诱导需要在光照的条件下进行,所述光照强度1000~1200lux、光照周期8h/d。
51.将丛生芽进行分株后,接种到上述技术方案任意一项所述的增殖生根培养基上进行增殖生根,得到完整植株。
52.本发明所述增殖生根的温度为26~30℃;所述增殖生根需要在光照的条件下进行,所述光照强度800~1000lux、光照周期12h/d。所述增殖生根的时间为20d~35d。
53.本发明提供了一种香草兰脱毒种苗的高通量繁育方法,包括以下步骤:a)将香草兰豆荚消毒,得到灭菌后的豆荚;b)将灭菌后的豆荚取出种子,接种到权利要求1~4任意一项所述的无菌种子萌发培养基上进行种子无菌萌发,得到脱毒芽段;c)得将脱毒芽段接种到权利要求1~4任意一项所述的丛生芽诱导培养基上进行丛生芽诱导,得到丛生芽;d)将将丛生芽进行分株后,接种到权利要求1~4任意一项所述的增殖生根培养基上进行增殖生根,得到完整植株。
54.本发明以不同外植体脱毒方法和培养基作为对照方法,与本发明方法在相同环境条件下进行培养,结果显示,只有以0.05%多菌灵溶液、0.1%百菌清、75%酒精、0.1%升汞组合为消毒脱毒方法,才能得到脱毒茎段,最终获得脱毒丛生芽,只用75%酒精为消毒脱毒方法,在培养中种子染菌无法萌发,没有获得脱毒茎段或脱毒丛生芽,因此在香草兰种子脱毒萌发与脱毒丛生芽再生方面,本发明方法显著优于各对照方法。
55.本发明方法选择脱毒的香草兰种子作为外植体,无菌种子萌发培养基配方:不加有机元素的ms改良培养基,添加6
‑
苄氨基腺嘌呤(6
‑
ba)、萘乙酸(naa)和赤霉素(ga3);丛生芽诱导培养基配方:以ms为基础培养基,添加6
‑
苄氨基腺嘌呤(6
‑
ba)和萘乙酸(naa),实现了无菌种子通过培养,能够拥有10根以上脱毒丛生芽的分化率,对日后的香草兰脱毒种苗的高通量繁育与基因工程学研究具有重要意义。
56.本发明以特定的消毒手段保证香草兰组织无病毒感染,为香草兰脱毒苗再生提供无菌种子为外植体材料及特定的诱导培养基,并获得丛生芽,提高了种苗繁育效率及获得大量状态一致的脱毒组培苗,对日后的香草兰脱毒种苗的高通量繁育具有重要意义。
57.为了进一步说明本发明,以下结合实施例对本发明提供的一种香草兰脱毒种苗的高通量繁育方法进行详细描述。
58.本发明涉及香草兰组织培养及种苗高通量繁育技术领域,公开了一种以香草兰无菌种子为外植体的脱毒种苗快繁技术方法。本发明技术所述方法将将成熟健康香草兰豆荚表面用0.05%多菌灵溶液、0.1%百菌清、75%酒精、0.1%升汞消毒干净,取出豆荚内成熟后发黑的香草兰脱毒种子作为外植体;将脱毒后的外植体接种到种子萌发培养基上进行萌发60d左右,再接到丛生芽增殖诱导培养基上进行丛生芽诱导增殖30d左右,得到丛生芽,以达到脱毒种苗高通量繁育的目的。本方法最终实现了以无菌种子萌发出脱毒茎段为外植体,进行丛生芽增殖分化,能够拥有10根以上的脱毒丛生芽,极大地提高了种苗繁育效率。这一香草兰的脱毒种苗离体再生方法,为日后香草兰脱毒种苗的工厂化高通量繁育与基因工程育种研究提供了技术支撑。
59.实施例1:本发明所述方法
60.将成熟健康香草兰豆荚表面经0.05%多菌灵溶液浸泡2h后,再用0.1%百菌清浸泡0.5h,用无菌水清洗4
‑
5次;转入无菌工作台上,先用75%酒店充分擦拭豆荚表面消毒,无菌水冲洗3次,再用0.1%升汞浸泡0.5h,无菌水冲洗4
‑
5次,沥干水分,沥干水分后待接种。
61.将灭菌消毒后的豆荚取出种子,接种到无菌种子萌发培养基上进行种子无菌萌发,得到脱毒茎段;所述无菌种子萌发培养基为含有0.5mg/l 6
‑
ba、0.1mg/l naa、0.1mg/l ga3的不加有机元素的ms改良培养基。
62.将诱导出的脱毒茎段,进行丛生芽增殖诱导后,接种到丛生芽诱导增殖培养基上,28
±
2℃下2000lux光照培养进行丛生芽增殖,培养基配方为ms+1.5mg/l 6
‑
苄氨基腺嘌呤(6
‑
ba)、0.3mg/l萘乙酸(naa)、0.1mg/l赤霉素(ga3)。
63.将诱导出的丛生芽,进行丛生芽分成单芽后,接种到增殖生根培养基上,28
±
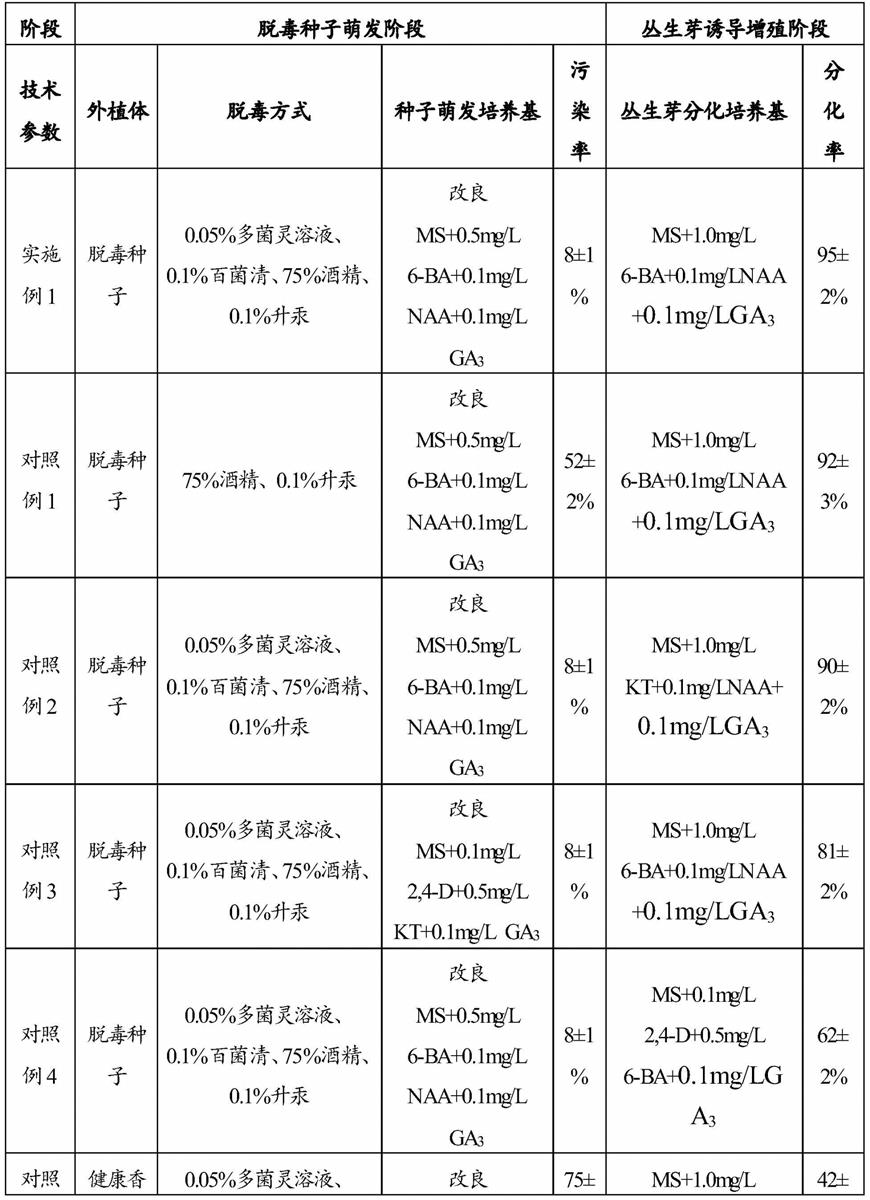
2℃下1000lux光照培养进行增殖生根,培养基配方为vm+0.1mg/l naa、0.05mg/l ga3。
64.本实施例组培快繁技术中各个时期的培养效果见图1。
65.实现了无菌种子的脱毒培养,能够拥有10根以上脱毒丛生芽的分化率。
66.对照例1:
67.以75%酒精与0.1%升汞组合为灭菌脱毒方法,采用实施例1中培养方法,具体如下:
68.将成熟健康香草兰豆荚在无菌工作台上,先用75%酒店充分擦拭豆荚表面消毒,无菌水冲洗3次,再用0.1%升汞浸泡0.5h,无菌水冲洗4
‑
5次,沥干水分,沥干水分后待接种。
69.将灭菌消毒后的豆荚取出种子,接种到无菌种子萌发培养基上进行种子无菌萌发,得到脱毒茎段;所述无菌种子萌发培养基为含有0.5mg/l 6
‑
ba、0.1mg/l naa、0.1mg/l ga3的不加有机元素的ms改良培养基。种子有一部分污染无法萌发。
70.将诱导出的脱毒茎段,进行丛生芽增殖诱导后,接种到丛生芽诱导增殖培养基上,28
±
2℃下2000lux光照培养进行丛生芽增殖,培养基配方为ms+1.5mg/l 6
‑
苄氨基腺嘌呤
(6
‑
ba)、0.3mg/l萘乙酸(naa)、0.1mg/l赤霉素(ga3)。
71.将诱导出的丛生芽,进行丛生芽分成单芽后,接种到增殖生根培养基上,28
±
2℃下1000lux光照培养进行增殖生根,培养基配方为vm+0.1mg/l naa、0.05mg/l ga3。
72.无菌种子的脱毒效果不佳,经培养能够拥有10根以上脱毒丛生芽的分化率。
73.对照例2:
74.将实施例1中的丛生芽诱导增殖培养基改为ms+1.0mg/l激动素(kt)+0.1mg/l萘乙酸(naa)+0.1mg/lga3。具体如下:
75.将成熟健康香草兰豆荚表面经0.05%多菌灵溶液浸泡2h后,再用0.1%百菌清浸泡0.5h,用无菌水清洗4
‑
5次;转入无菌工作台上,先用75%酒店充分擦拭豆荚表面消毒,无菌水冲洗3次,再用0.1%升汞浸泡0.5h,无菌水冲洗4
‑
5次,沥干水分,沥干水分后待接种。
76.将灭菌消毒后的豆荚取出种子,接种到无菌种子萌发培养基上进行种子无菌萌发,得到脱毒茎段;所述无菌种子萌发培养基为含有0.5mg/l 6
‑
ba、0.1mg/l naa、0.1mg/l ga3的不加有机元素的ms改良培养基。
77.将诱导出的脱毒茎段,进行丛生芽诱导,接种到丛生芽诱导增殖培养基上,28
±
2℃下2000lux光照培养进行增殖生根,培养基配方为ms+1.0mg/l激动素(kt)+0.1mg/l萘乙酸(naa)。
78.将诱导出的丛生芽,进行丛生芽分成单芽后,接种到增殖生根培养基上,28
±
2℃下1000lux光照培养进行增殖生根,培养基配方为vm+0.1mg/l naa、0.05mg/l ga3。
79.实现了无菌种子的脱毒培养,能够诱导拥有5根左右脱毒丛生芽的分化率。
80.对照例3:
81.将实施例1中的无菌种子萌发培养基改为0.1mg/l 2,4
‑
二氯苯氧乙酸(2,4
‑
d)、0.5mg/l激动素(kt)、0.1mg/l ga3的不加有机元素的ms改良培养基。具体如下:
82.将成熟健康香草兰豆荚表面经0.05%多菌灵溶液浸泡2h后,再用0.1%百菌清浸泡0.5h,用无菌水清洗4
‑
5次;转入无菌工作台上,先用75%酒店充分擦拭豆荚表面消毒,无菌水冲洗3次,再用0.1%升汞浸泡0.5h,无菌水冲洗4
‑
5次,沥干水分,沥干水分后待接种。
83.将灭菌消毒后的豆荚取出种子,接种到无菌种子萌发培养基上进行种子无菌萌发,得到脱毒茎段;所述无菌种子萌发培养基为含有0.1mg/l 2,4
‑
二氯苯氧乙酸(2,4
‑
d)、0.5mg/l激动素(kt)、0.1mg/l ga3的不加有机元素的ms改良培养基。
84.将诱导出的脱毒茎段,进行丛生芽诱导,接种到丛生芽诱导增殖培养基上,28
±
2℃下2000lux光照培养进行增殖生根,培养基配方为ms+1.5mg/l 6
‑
苄氨基腺嘌呤(6
‑
ba)、0.3mg/l萘乙酸(naa)。
85.将诱导出的丛生芽,进行丛生芽分成单芽后,接种到增殖生根培养基上,28
±
2℃下1000lux光照培养进行增殖生根,培养基配方为vm+0.1mg/l naa、0.05mg/l ga3。
86.无菌种子有一部分无法萌发,而愈伤组织化,经诱导能够拥有3根右左的丛生芽。
87.对照例4:
88.将实施例1中的丛生芽诱导增殖培养基改为ms+0.1mg/l 2,4
‑
二氯苯氧乙酸(2,4
‑
d)+0.5mg/l 6
‑
ba+0.1mg/l ga3。具体如下:
89.将成熟健康香草兰豆荚表面经0.05%多菌灵溶液浸泡2h后,再用0.1%百菌清浸泡0.5h,用无菌水清洗4
‑
5次;转入无菌工作台上,先用75%酒店充分擦拭豆荚表面消毒,无
菌水冲洗3次,再用0.1%升汞浸泡0.5h,无菌水冲洗4
‑
5次,沥干水分,沥干水分后待接种。
90.将灭菌消毒后的豆荚取出种子,接种到无菌种子萌发培养基上进行种子无菌萌发,得到脱毒茎段;所述无菌种子萌发培养基为含有0.5mg/l 6
‑
ba、0.1mg/l naa、0.1mg/l ga3的不加有机元素的ms改良培养基。
91.将诱导出的脱毒茎段,进行丛生芽诱导,接种到丛生芽诱导增殖培养基上,28
±
2℃下2000lux光照培养进行增殖生根,培养基配方为ms+0.1mg/l 2,4
‑
二氯苯氧乙酸(2,4
‑
d)+0.5mg/l 6
‑
ba。
92.将诱导出的丛生芽,进行丛生芽分成单芽后,接种到增殖生根培养基上,28
±
2℃下1000lux光照培养进行增殖生根,培养基配方为vm+0.1mg/l naa、0.05mg/l ga3。
93.实现了无菌种子的脱毒培养,能够诱导拥有3根左右脱毒丛生芽的分化率。
94.对照例5:
95.将健康香草兰母株茎段表面经0.05%多菌灵溶液浸泡2h后,再用0.1%百菌清浸泡0.5h,用无菌水清洗4
‑
5次;转入无菌工作台上,先用75%酒店充分擦拭豆荚表面消毒,无菌水冲洗3次,再用0.1%升汞浸泡0.5h,无菌水冲洗4
‑
5次,沥干水分,沥干水分后待接种。
96.将灭菌消毒后的豆荚取出种子,接种到无菌种子萌发培养基上进行种子无菌萌发,得到脱毒茎段;所述无菌种子萌发培养基为含有0.5mg/l 6
‑
ba、0.1mg/l naa、0.1mg/l ga3的不加有机元素的ms改良培养基。
97.将诱导出的脱毒茎段,进行丛生芽增殖诱导后,接种到丛生芽诱导增殖培养基上,28
±
2℃下2000lux光照培养进行丛生芽增殖,培养基配方为ms+1.5mg/l 6
‑
苄氨基腺嘌呤(6
‑
ba)、0.3mg/l萘乙酸(naa)。母株茎段接入培养后,多半开始褐化死亡。
98.将诱导出的丛生芽,进行丛生芽分成单芽后,接种到增殖生根培养基上,28
±
2℃下1000lux光照培养进行增殖生根,培养基配方为vm+0.1mg/l naa、0.05mg/l ga3。
99.无法实现茎段的脱毒,经培养多半开始褐化死亡,能够诱导拥有5根左右的丛生芽。
100.试验例1:对比试验
101.按照实施例1和对照例1
‑
5的方法进行试验,统计无菌种子萌发率与丛生芽增殖诱导率,结果见表1。
102.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
103.表1不同培养方法外植体污染率、丛生芽诱导率对比
[0104][0105][0106]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人
员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1