一种基于NLRP3基因敲除的非酒精性脂肪肝动物模型的构建方法及应用与流程
一种基于nlrp3基因敲除的非酒精性脂肪肝动物模型的构建方法及应用
技术领域
1.本发明属于医药技术领域,具体涉及一种基于nlrp3基因敲除的非酒精性脂肪肝动物模型的构建方法及应用。
背景技术:
2.非酒精性脂肪肝(non-alcoholic fatty liver disease,nafld)是以无过量饮酒史和其他明确损肝因素导致的慢性肝脏脂质代谢综合征,是胰岛素抵抗、脂质代谢紊乱等多种因素导致的肝脏损伤。nafld早期的病理形式为单纯的肝脂肪变性,随着病程的发展以及非酒精性脂肪肝炎(non-alcoholic steatohepatitis,nash)参与,逐步发展为肝纤维化和肝硬化,最终导致肝衰竭。根据流行病学调查发现,西方国家正常人群nafld的患病率约为20%-40%。随着我国经济的迅速发展,人们生活的习惯和饮食结构发生改变,nafld在我国的发病情况也不容小觑。目前,我国nafld的患病率从20世纪90年代的12.9%升高至21.2%,其中10%-20%的nafld患者进展为nash,资料显示,nafld已成为我国继病毒性肝炎之后第二大慢性疾病,成为威胁人类健康的严重问题。
3.选择有效合适的动物模型是研究nafld的实验基础。目前,用于构建非酒精性脂肪肝模型的动物基本采用大鼠、小鼠、兔、斑马鱼和小型猪等,不同的模型动物在构建非酒精性脂肪肝各有其优缺点。兔与人类的胆固醇代谢不完全一致,病变部位与人类也不尽相同,且容易继发感染而死亡;斑马鱼虽然易于活体观察病变,但其在进化上与人类甚远,而且发育早期细胞的家系很难确定;小型猪与人在解剖学和疾病发生机理方面有很大相似性,但其体型较大,饲养管理与实验操作困难,难以获得足够的样本量;大鼠和小鼠模型体积较小,繁殖力强,易于大规模饲养,而且可以获得大量的样本量,是nafld模型常用的实验动物,具有多方面优势。
4.目前,常用的方法有营养性脂肪肝模型、药物中毒性脂肪肝模型和基因敲除或突变诱发模型,不同的造模方法所构建的nafld动物模型的形成机制以及病理改变也不同,各有其优点和缺陷。营养性脂肪肝模型与人类nafld的致病机制相似,而且具有渐进性发展的特点,该方法的缺点是建模时间长,造模周期一般在2-3个月;药物中毒性脂肪肝模型虽然建模时间短、病变明显,但其发病机制、肝脏的病理改变与人类nafld差异较大,且药物毒性强,导致造模动物死亡率高;基因敲除或基因突变性模型能自发形成脂肪肝,且伴有脂肪代谢紊乱等代谢综合征,能够从整体水平、组织器官水平以及细胞和分子水平揭示非酒精性脂肪肝的发生发展机制。
技术实现要素:
5.为解决现有技术中存在的问题,本发明提供一种基于nlrp3基因敲除的非酒精性脂肪肝动物模型的构建方法及应用,本发明的构建方法以nlrp3基因敲除动物(nlrp3-/-)为模型动物,通过高脂高果糖饮食构建非酒精性脂肪肝模型,通过连续监测不同时期nafld模
型实验动物的多项指标,模拟出nafld的病程,为nafld的发病机制、治疗药物的筛选和评价等方面提供理论依据。
6.一种基于nlrp3基因敲除的非酒精性脂肪肝动物模型的构建方法,包括以下步骤:
7.(1)将野生实验动物和nlrp3基因敲除实验动物适应性饲养后分别分为对照组ⅰ和实验组ⅰ,以及对照组ⅱ和实验组ⅱ;
8.(2)给予实验组ⅰ和实验组ⅱ实验动物高脂饲料和果糖饮水,对照组ⅰ和对照组ⅱ实验动物基础饲料和饮用水,分别进行饲养造模;
9.在造模过程中,对实验动物每周称重,并进行油红o染色检测和tunnel检测,判断造模是否成功。
10.作为优选,实验动物的适应性饲养时间为4~7天。进一步优选为5天。
11.作为优选,实验动物的饲养条件为:饲养在动物屏障中心,室内温度18℃-26℃,相对湿度50%-70%,明暗循环12h/d,自由饮食和饮水,动物笼盒、玉米芯垫料及饲料、饮用水均经过高温高压消毒灭菌处理,每周更换3次动物垫料,每天补充饲料和饮用水。其中饮食可根据需要提供,如适应性饲养和对比组实验动物饲养为基础饲料,造模实验组实验动物为高脂饲料。
12.作为优选,将野生实验动物和nlrp3基因敲除实验动物分别进行实验组和对照组分组时,采用随机的方式进行。
13.作为优选,所述高脂饲料的配方以总量为100%计,包括:0.3~0.7%丙基硫氧嘧啶、1~3%胆固醇、0.5~1.5%胆盐,3~8%果糖、8~13%猪油、2~7%蛋黄粉和70~80%基础饲料;
14.所述果糖饮水的浓度为20~30%。
15.作为进一步优选,所述高脂饲料的配方以总量为100%计,包括:0.5%丙基硫氧嘧啶、2%胆固醇、1%胆盐,5%果糖、10%猪油、5%蛋黄粉和76.5%基础饲料;
16.所述果糖饮水的浓度为25%。
17.作为优选,所述实验动物为大鼠或小鼠。
18.作为优选,所述nlrp3基因敲除实验动物为纯合子(nlrp3-/-)雄性小鼠,体重为19~21g,品系为c57/bl6,spf级;
19.所述野生实验动物为雄性小鼠,品系为c57/bl6。
20.作为优选,步骤(2)中,进行油红o染色检测和tunnel检测的同时,检测造模后的实验动物的血清生化指标和mda含量。
21.作为进一步优选,所述血清生化指标包括alt(谷丙转氨酶)、ast(谷草转氨酶)、tg(甘油三酯)和tc(总胆固醇)含量。
22.作为进一步优选,通过检测实验动物血清生化指标和mda(丙二醛)含量,判定造模成功与否的标准为:
23.血清中alt、ast、tg、tc含量以及肝组织mda指标高于正常水平2倍判定为轻度nafld,高于正常水平3倍为中度nafld。
24.作为优选,对实验动物进行油红o染色检测和tunnel检测包括两个阶段:
25.第一阶段为在6~10周时,对部分实验组ⅰ和实验组ⅱ的实验动物进行油红o染色检测和tunnel检测;进行第一阶段检测后,根据油红o染色检测和tunnel检测的检测结果,
对是否造模成功进行判断,并对造模成功的情况,进行如下第二阶段的检测;
26.第二阶段为在18~23周时,对剩余实验组ⅰ和实验组ⅱ的实验动物、对照组ⅰ和实验组ⅰ的实验动物分别进行油红o染色检测和tunnel检测。
27.作为进一步优选,在造模第8周末处理部分实验组ⅰ和实验组ⅱ的实验动物,第20周末处理对剩余实验组ⅰ和实验组ⅱ的实验动物、对照组ⅰ和实验组ⅰ的实验动物;
28.所述处理为:将实验动物禁食12h,麻醉后腹主动脉采血,室温静置后离心分离血清,检测生化指标和mda;取最大叶肝脏用10%中性甲醛固定,分别进行油红o染色和tunnel检测;其余肝组织-80℃冻存备用。
29.采用冰冻切片进行油红o染色,观察肝细胞脂肪变化;使用tunnel检测试剂盒制作切片,测定肝细胞凋亡数量,根据脂肪堆积和细胞凋亡数量判断nafld严重程度及nlrp3对nafld的影响。
30.同时检测血清生化指标和mda,根据检测指标对nafld严重程度及nlrp3在nafld中的作用进行评价。
31.取-80℃冻存的肝组织置于10倍体积的磷酸盐缓冲液(pbs)中匀浆,制成10%的肝组织匀浆液,elisa试剂盒检测肝匀浆炎症因子il-1β、nf-κb含量。
32.作为优选,使用tunnel检测试剂盒制作切片时,利用多聚赖氨酸为切片粘合剂,进行常规石蜡包埋、切片、脱蜡和水化。tunnel检测试剂盒制作切片后,在光镜下分析结果,根据凋亡细胞的形态特征判断凋亡细胞:单个细胞,周围无炎症反应及坏死,包浆收缩,细胞核中有棕黄色颗粒或核碎片者为阳性细胞。
33.作为优选,采用油红o染色检测结合tunnel检测,判断造模是否成功的标准为:
34.通过对油红o染色的红染和tunnel检测试剂盒制作切片,确定脂滴数量及细胞凋亡情况,对nafld严重程度进行判断,30%~50%的肝细胞脂肪变性,无炎症、坏死,判断为轻度;50%~75%的肝细胞脂肪变性,判断为中度;75%的肝细胞脂肪变性并伴有肝细胞坏死、炎症细胞浸润,判断为重度。
35.作为优选,采用trizol总rna提取试剂进行肝组织rna提取,采用紫外分光光度计测量rna纯度及浓度,采用prime script
tm
rt reagent kit with gdna eraser进行cdna反转录,采用基因特异性引物对nlrp3、caspase-1、asc、il-1β的cdna模板进行rt-pcr扩增,用荧光定量pcr仪,以内参gapdh作为参照,采用2
‑△△
ct
法进行数据的相对定量分析。
36.以实验动物选用小鼠为例,作为具体优选,一种基于nlrp3基因敲除的非酒精性脂肪肝动物模型的构建方法,包括以下步骤:
37.(1)实验小鼠饲养在动物屏障中心,室内温度18℃-26℃,相对湿度50%-70%,明暗循环12h/d,自由饮食和饮水,小鼠笼盒、玉米芯垫料及饲料、饮用水均经过高温高压消毒灭菌处理,每周更换3次小鼠垫料,每天补充饲料和饮用水;
38.(2)将野生型(wt)和nlrp3基因敲除(nlrp3-/-)小鼠,随机分为
①
wt正常对照组(wt)(对照组ⅰ)、
②
nlrp3-/-对照组(ko)(对照组ⅱ)、
③
wt高脂高果糖饮食组(wt-hfd)(实验组ⅰ)和
④
nlrp3-/-高脂高果糖饮食组(ko-hfd)(实验组ⅱ);
①
组和
②
组给予基础饲料和普通饮用水,
③
组和
④
组给予高脂饲料(配方为0.5%丙基硫氧嘧啶、2%胆固醇、1%胆盐,5%果糖、10%猪油、5%蛋黄粉和76.5%基础饲料)和25%的果糖饮用水;
39.(3)每周称重并观察各组小鼠的一般情况,在造模后第8周末处理部分
③
组和
④
组
小鼠,20周末后一并处理剩余
③
组和
④
组小鼠、
①
组和
②
组小鼠;小鼠处理前禁食12h,麻醉小鼠后称重,腹主动脉采血,分离血清;取最大叶肝脏用10%中性甲醛固定,做肝组织病理学观察,其余肝组织-80℃冻存备用;
40.(4)取小鼠肝组织置10倍体积的磷酸盐缓冲液(pbs)中匀浆,制备成10%的肝组织匀浆液,4℃下12000rpm离心15min,取上清液备用;
41.(5)使用生化分析仪检测血清alt、ast、tg、tc含量,紫外分光光度计检测肝匀浆mda含量,elisa试剂盒检测肝组织匀浆上清液中炎症因子il-1β、nf-κb含量,通过这些指标的检测判断nafld严重程度以及nlrp3在nafld中的作用;
42.(6)肝脏用10%中性甲醛固定后,采用冰冻切片进行油红o染色,观察肝细胞脂肪堆积;利用多聚赖氨酸为切片粘合剂,进行常规石蜡包埋、切片、脱蜡和水化,使用tunnel检测试剂盒制作切片,在光镜下分析结果,根据凋亡细胞的形态特征判断凋亡细胞:单个细胞,周围无炎症反应及坏死,包浆收缩,细胞核中有棕黄色颗粒或核碎片者为阳性细胞;
43.(7)采用trizol总rna提取试剂进行肝组织rna提取,采用紫外分光光度计测量rna纯度及浓度,采用prime script
tm
rt reagent kit with gdna eraser进行cdna反转录,采用基因特异性引物对nlrp3、caspase-1、asc、il-1βcdna模板进行rt-pcr扩增,用荧光定量pcr仪,以内参gapdh作为参照,采用2
‑△△
ct
法进行数据的相对定量分析。
44.本发明公开了一种非酒精性脂肪肝动物模型的构建及其应用,以nlrp3基因敲除动物(nlrp3-/-)为模型动物,通过高脂高果糖饮食构建非酒精性脂肪肝模型,检测nlrp3及相关因子的表达水平,对各指标与非酒精性脂肪肝的相关性进行分析,阐述nlrp3在非酒精性脂肪肝的发病机制中的作用。此模型为进一步开展脂肪肝的药效观察和相关分子机制研究奠定了研究基础。
45.一种上述任一项所述的构建方法在药物筛选中的应用。
46.一种上述任一项所述的构建方法在nafld发病机制研究中的应用。
47.一种上述任一项所述的构建方法在肝病研究中的应用。
48.与现有技术相比,本发明的有益效果为:
49.(1)本发明利用nlrp3基因敲除(nlrp3-/-)动物自发形成脂肪肝,且伴有肥胖、胰岛素抵抗等代谢综合征的有点,能够从整体水平、组织器官水平以及细胞和分子水平揭示非酒精性脂肪肝的发生发展机制。
50.(2)本发明以nlrp3基因敲除动物(nlrp3-/-)为模型动物,通过高脂高果糖饮食构建非酒精性脂肪肝模型,此模型为进一步开展脂肪肝的药效观察和相关分子机制研究奠定了实验基础。
51.(3)本发明通过监测不同时期nafld模型动物的多项指标,并模拟出从单纯性脂肪肝到脂肪性肝炎甚至到肝纤维化的连续过程,为该模型在nafld的发病机制、治疗药物的筛选和评价等方面提供理论依据。
附图说明
52.图1为本发明实施例中小鼠尾部组织琼脂糖凝胶电泳基因型片段检测结果;
53.图2为本发明实施例中ko、ko-hfd、wt、wt-hfd组小鼠体重变化趋势图;
54.图3中(a)和(b)分别为elisa试剂盒检测ko、ko-hfd 8week、ko-hfd 20week、wt、
wt-hfd 8week、wt-hfd 20week组小鼠肝匀浆炎症因子nf-κb和il-1β含量实验结果;其中,***表示p<0.01;
55.图4为ko、ko-hfd 8week、ko-hfd 20week、wt、wt-hfd 8week、wt-hfd 20week组小鼠油红o染色切片实验结果;
56.图5为ko、ko-hfd 8week、ko-hfd 20week、wt、wt-hfd 8week、wt-hfd 20week组小鼠tunnel法检测凋亡细胞实验结果;
57.图6中(a)、(b)、(c)和(d)为ko、ko-hfd 8week、ko-hfd20week、wt、wt-hfd 8week、wt-hfd 20week组小鼠rt-pcr法检测小鼠nlrp3、caspase-1、asc和il-1βmrna表达量实验结果;其中,***表示p<0.01。
具体实施方式
58.以下实例仅是代表性的,用于阐明和理解本发明的精神实质,但不以此限制本发明的范围,任何在本发明的精神和范围内对本发明的技术方案进行的修改和替换,都在本发明的保护范围之内。
59.实验材料:
60.清洁级c57/bl6雄性野生型(wt)小鼠购买于上睿太莫斯生物科技有限公司,合格证编号为:scxk(沪)2016-0001;nlrp3基因敲除纯合子(nlrp3-/-)小鼠购于上海南方模式股份有限公司,合格证编号:20170010008820;高脂饲料购买于南通特洛菲饲料科技有限公司,产品批号:20201212。
61.一种基于nlrp3基因敲除的非酒精性脂肪肝小鼠模型的构建方法,包括步骤如下:
62.步骤1:nlrp3基因敲除杂合子(nlrp3
+/-)小鼠,品系为c57/bl6,周龄6~10周,spf级,共9只(3雄6雌)。实验小鼠均饲养在动物中心的屏障环境中,室内温度18℃-26℃,相对湿度50%~70%,明暗循环12h/d,自由饮食和饮水。小鼠笼盒、玉米芯垫料及饲料、饮用水均经过高温高压消毒灭菌处理。每周更换3次小鼠垫料,每天补充饲料和饮用水。小鼠的性成熟期为60天左右,母鼠妊娠期为21天左右,繁殖采用1只雄鼠与2只雌鼠同居的方式进行。
63.步骤2:对nlrp3基因敲除小鼠子代出现野生型(nlrp3
+/+
)、杂合子(nlrp3
+/-)和纯合子(nlrp3-/-)3种表型进行基因型鉴定,剪取小鼠尾尖1.0cm,放入1.5ml离心管中,按照dna提取试剂盒操作说明提取dna。利用premier 5.0设计引物:上游野生型(nlrp3
+/+
)引物5
’‑
gcg cgt tcc tgt cct tga tag a-3’;上游纯合子(nlrp3-/-)引物5
’‑
cct cca caa ctg taa taa cta act-3’;下游通用引物:5
’‑
ttt ttc taa gcc aat cct-3’,对小鼠尾部基因片段进行扩增。小鼠尾部组织琼脂糖凝胶电泳基因型片段为:野生型431bp、纯合子317bp、杂合子431bp和317bp,按此基因条带可以鉴别出各个基因型小鼠。
64.步骤3:步骤2中琼脂糖凝胶电泳结果如图1所示,根据基因片段大小,筛选出6只纯合子小鼠3只雄性3只雌性。将配种所得纯合子(nlrp3-/-)小鼠雌雄各3只,采用1只雄鼠与1只雌鼠同居的方式配种,得到30只纯合子(nlrp3-/-)雄性小鼠备用。
65.步骤4:清洁级c57/bl6雄性野生型(wt)和nlrp3基因敲除(nlrp3-/-)小鼠各30只,适应性饲养5d后,随机分为
①
wt正常对照组(wt)6只、
②
(nlrp3-/-)对照组(ko)6只、
③
wt高脂高果糖饮食组(wt-hfd)24只和
④
nlrp3-/-高脂高果糖饮食组(ko-hfd)24只;
①
组和
②
组给予基础饲料和普通饮用水,
③
组和
④
组给予高脂饲料(配方为0.5%丙基硫氧嘧啶、2%胆
固醇、1%胆盐,5%果糖、10%猪油、5%蛋黄粉和76.5%基础饲料)和25%的果糖饮用水;每周称重并观察各组小鼠的一般情况,分别在造模后第8周末分别处理
③
组和
④
组中小鼠各6只,20周末后一并处理
①
组和
②
组小鼠、
③
组和
④
组中剩余小鼠;小鼠处理前禁食12h,以3%的戊巴比妥钠(0.2ml/100g)腹腔注射麻醉,称重,腹主动脉采血,分离血清;取最大叶肝脏用10%中性甲醛固定,做肝组织病理学观察,其余肝组织-80℃冻存备用。
66.小鼠各项指标检测:nlrp3及相关炎症因子在模型中的表达情况检测
67.实验材料:
68.谷丙转氨酶(alt/gpt)测试盒(货号:c009-1)、谷草转氨酶(ast/got)测试盒(货号:c010-1)、甘油三酯(tg)测试盒(货号:a110-2)、总胆固醇(t-cho)测试盒(货号:a111-1)、丙二醛(mda)测定试剂盒购买于南京建成科技有限公司。小鼠nf-κb抑制因子α(nfkbia)elisa试剂盒、小鼠白细胞介素1β(il-1β)酶联免疫分析(elisa)试剂盒购买于华美生物科技有限公司。
69.统计分析:用spss20.0对实验数据进行统计学处理,两样本均数之间的差异显著性用独立样本均值比较的t检验,应用方差分析对变量之间的相互关系进行检验,p《0.05为差异有统计学意义。
70.1.小鼠体重变化:体重增长与脂肪组织功能障碍高度相关,因此可根据体重变化推测nafld模型是否建立成功。造模过程中每周对小鼠进行称重,结果如图2所示。由图2可知,经过8周喂养高脂饲料以及果糖饮水后的wt-hfd组和ko-hfd组小鼠,体重明显比喂养普通饲料及普通饮用水的wt组和ko组小鼠的体重高,初步判断小鼠在经过8周高脂饲料及果糖饮水喂养后,nafld模型建立成功。
71.而wt-hfd组和ko-hfd组小鼠在经过20周喂养高脂饲料以及果糖饮水后,体重持续上涨,且都明显高于喂养普通饲料及普通饮用水的wt组和ko组小鼠,表明nafld随着时间的增加逐渐加重。伴有nash的小鼠肝细胞被免疫细胞吞噬,肝脏代谢能力减弱导致了高脂饲料喂养的小鼠体重不断增加,通过对比ko-hfd组小鼠体重与wt-hfd组小鼠体重,发现小鼠在nlrp3基因敲除后,体重增加变慢,nafld模型建立时间增加,表明nlrp3在nafld中扮演重要角色,小鼠在敲除nlrp3基因后,nash得以改善,存活的肝细胞增加脂肪代谢使体重减轻。
72.2.小鼠血清生化指标及mda含量检测:将小鼠腹主动脉采集的血液,室温放置2h后3000rpm离心10min,取上清液,使用全自动生化分析仪检测血清alt、ast、tg、tc含量,nanodrop 2000紫外分光光度计检测mda活性,结果如表1所示。
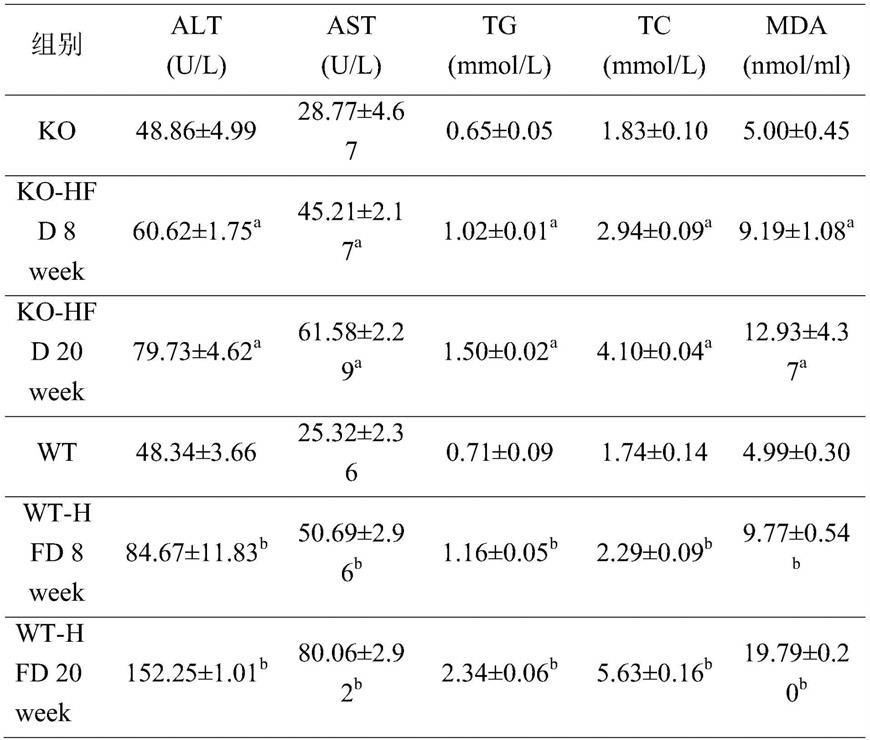
73.表1小鼠血清生化指标及mda含量检测结果
[0074][0075]
注:a指与ko组对比p<0.001,b指与wt组对比p<0.001。
[0076]
由表1可知,小鼠经过8周喂养高脂饲料以及果糖饮水后alt、ast、tg、tc和mda水平上升为原来的2倍,提示小鼠肝脏轻度脂肪堆积,成功建立轻度nafld模型,ko-hfd 8week组比wt-hfd 8week组水平低,提示小鼠在敲除nlrp3基因后,减缓了nafld模型的建立时间,减轻了nafld严重程度。小鼠经过20周喂养高脂饲料以及果糖饮水后血清tg、tc和mda水平明显上升,提示小鼠肝细胞脂肪堆积并且存在明显的脂质过氧化,alt和ast水平明显上升,提示肝细胞存在死亡,wt-hfd组alt和ast上升3倍而ko-hfd组上升2倍,提示小鼠在敲除nlrp3基因后,肝脏炎症水平下降,肝细胞死亡情况减少,证明nlrp3在nafld中上调炎症水平,使得nafld加重。
[0077]
3.小鼠肝脏油红o染色和tunnel检测:
[0078]
肝脏组织用10%中性甲醛固定后,采用冰冻切片进行油红o染色,观察肝细胞脂肪变,结果如图4所示。参照“美国国立卫生研究院nash临床研究网络病理工作组指南”进行非酒精性脂肪肝活动度评分。
[0079]
肝脏组织以10%中性甲醛固定后,利用多聚赖氨酸为切片粘合剂,进行常规石蜡包埋、切片、脱蜡和水化,使用tunnel检测试剂盒制作切片,在光镜下分析结果,根据凋亡细胞的形态特征判断凋亡细胞:单个细胞,周围无炎症反应及坏死,包浆收缩,细胞核中有棕黄色颗粒或核碎片者为阳性细胞。每张切片观察10个高倍镜(10
×
40)视野,对阳性细胞进行计数,取平均值。检测结果如图5所示。
[0080]
由图4和5可知,wt-hfd组和ko-hfd组小鼠经过8周喂养高脂饲料以及果糖饮水后,
肝脏存在轻度的脂肪堆积,提示nafld模型建立成功;ko-hfd 8week组比wt-hfd 8week组脂肪堆积数量少,提示小鼠在敲除nlrp3基因后延长了nafld模型建立时间,缓解了nash的发展。wt-hfd组和ko-hfd组小鼠经过20周喂养高脂饲料以及果糖饮水后,wt-hfd 20week组和ko-hfd 20week组肝组织油红染色切片有明显红染并且有明显细胞凋亡,提示肝脏有明显的脂肪堆积情况,脂毒性、炎症导致细胞产生凋亡;另一方面,wt-hfd组红染范围大于ko-hfd组且wt-hfd组凋亡细胞数量是ko-hfd组2倍,提示小鼠在敲除nlrp3基因后,脂肪堆积情况有所缓解,细胞凋亡数量降低,疾病有所好转,表明nlrp3导致的炎症在nafld中促进脂肪代谢紊乱和肝细胞凋亡,加重了病情促进了nafld发展。
[0081]
4.采用trizol总rna提取试剂进行肝组织rna提取,nanodrop 2000采用紫外分光光度计测量rna纯度及浓度,采用prime script
tm
rt reagent kit with gdna eraser进行cdna反转录,采用基因特异性引物对nlrp3、caspase-1、asc、il-1β的cdna模板进行rt-pcr扩增,用荧光定量pcr仪,以内参gapdh作为参照,采用2
‑△△
ct
法进行数据的相对定量分析,引物序列如表2所示。
[0082]
表2各基因引物序列及扩增产物大小
[0083][0084]
5.肝组织炎症因子的检测
[0085]
取-80℃冻存的小鼠肝组织置10倍体积的磷酸盐缓冲液(pbs)中匀浆,制备成10%的肝组织匀浆液,elisa试剂盒检测肝匀浆炎症因子il-1β、nf-κb含量,结果如图3所示。
[0086]
由图3可知,小鼠经过8周喂养高脂饲料以及果糖饮水后nf-κb和il-1β含量有所上升,而经过20周喂养高脂饲料以及果糖饮水后nf-κb和il-1β表达情况明显上调且wt-hfd组水平高于ko-hfd组,提示nlrp3虽然介导nash,但只是其中一部分,小鼠在失去nlrp3基因后,炎症因子的表达降低,但依旧有少量的表达,这说明在nafld中nash不仅由nlrp3介导,还有其他机制也产于其中。
[0087]
由rt-pcr法检测的各组小鼠在造模各时期的nlrp3、caspase-1、asc、il-1β的mrna表达量结果如图6所示。由图6可知,rt-pcr的实验结果也证明了上述观点,即小鼠在敲除nlrp3基因后nlrp3及asc的mrna不表达而caspase1和il-1β的mrna表达上调,提示除了
nlrp3外依旧有其他途径产于nash但nlrp3介导的肝炎在nash中扮演重要角色。
[0088]
由上述结果可知,本发明实施例以nlrp3基因敲除小鼠(nlrp3-/-)为模型动物,通过高脂高果糖饮食成功构建非酒精性脂肪肝模型,并且成功模拟出nafld的病程,为nafld的发病机制提供依据。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1