一种卵母细胞和胚胎玻璃化冷冻载体及方法与流程
1.本发明属于动物胚胎工程技术领域,具体涉及一种卵母细胞和胚胎玻璃化冷冻载体及方法。
背景技术:
2.卵母细胞和胚胎的玻璃化冷冻是将卵母细胞和胚胎通过系列脱水后,放置在一个载体上直接投入零下196℃的液氮环境中快速降温,使细胞内外液体均达到玻璃化状态。卵母细胞和胚胎冷冻是保存妇女生育功能和动物遗传资源的重要方法之一。玻璃化冷冻是采用较高浓度及极其黏稠的冷冻保护剂处理卵母细胞和胚胎,使胚胎在冷冻的过程中,从生理温度急速降温到-196℃,胚胎细胞内外液体瞬间冻结成玻璃化固体状态。与程序冷冻法相比,玻璃化方法冷冻过程中,胚胎细胞内的液体不会形成冰晶,从而避免了冰晶对卵母细胞和胚胎细胞的物理化学损伤,获得了较好的冷冻效果。玻璃化冷冻胚胎复苏率通常达到95%以上,若冷冻囊胚,效果则更好,复苏率可达到99%以上,显著的高于程序冷冻方法,优势也较明显,所以越来越多的中心逐步开始使用玻璃化冷冻方法,也成为现阶段胚胎冷冻的主要方法。同样,玻璃化冷冻技术已成为冷冻保存卵母细胞的金标准。
3.现有技术中心公开了多种胚胎玻璃化冷冻载体,如开放式拉长细管(ops)和cryotop。但是利用ops和cryotop进行玻璃化冷冻的胚胎解冻后的存活率和受胎率不理想。这是由于,最终冷冻液体积的大小会影响胚胎冷冻/解冻过程的降温和升温的速度,从而决定最终的冷冻效果。例如,ops的最终冷冻液体积是2~5μl,冷冻体积较大。cryotop的最终冷冻液体积可控制在1μl左右,但是需要人工吸取多余的液体,这需要操作人员多年的培训和工作经验才能完成这一复杂的步骤,因而操作效果因人而异,不稳定。
技术实现要素:
4.有鉴于此,本发明的目的在于提供一种卵母细胞和胚胎玻璃化冷冻载体及方法,能够控制最终冷冻液体积在0.3~0.8μl,大大提高了冷冻效率。
5.本发明提供了一种卵母细胞和胚胎玻璃化冷冻载体,包括冷冻管本体,所述冷冻管本体的一端为u型斜口,其特征在于,在所述冷冻管本体的u型斜口端的内壁上贴附有吸水材料。
6.优选的,所述吸水材料包括滤纸。
7.优选的,所述吸水材料的形状包括长方形;所述吸水材料的长度为18~20mm,所述吸水材料的宽度为5~6mm。
8.优选的,所述吸水材料的外沿和u型斜口的外沿平齐。
9.优选的,所述u型斜口的斜角的角度为60
°
。
10.优选的,所述u型斜口的长度为0.5~1cm
11.优选的,所述冷冻管本体由精液冷冻管一端斜切制备得到;所述精液冷冻管的规格为0.25ml。
12.本发明还提供了一种基于上述方案所述卵母细胞和胚胎玻璃化冷冻载体的卵母细胞和/或胚胎玻璃化冷冻方法,包括以下步骤:
13.将含有卵母细胞和/或胚胎的冷冻液转移至上述方案所述卵母细胞和胚胎玻璃化冷冻载体的吸水材料上,进行液氮冷冻。
14.优选的,所述转移开始的时间为胚胎经冷冻液冷冻处理结束前5~10s。
15.本发明提供了一种卵母细胞和胚胎玻璃化冷冻载体,包括冷冻管本体,所述冷冻管本体的一端为u型斜口,在所述冷冻管本体的u型斜口端的内壁上贴附有吸水材料。在将含有卵母细胞和/或胚胎的冷冻液转移至吸水材料上后,可自动吸取多余的冷冻液,从而能够控制最终冷冻液体积在0.5μl左右,大大提高了冷冻效率和冷冻胚胎复苏率,命名这种载体为“paper straw”或叫“纸管”。采用本发明的冷冻载体对动物卵母细胞和/或胚胎进行玻璃化冷冻,胚胎的复苏率在99%以上。此外,采用本发明的载体对动物卵母细胞和/或胚胎进行玻璃化冷冻,操作简单,技术人员不需要培训便可应用,为玻璃化冷冻技术商业化提供了技术保障,大大扩大了此项技术在女性生育力保存和家畜育种中的广泛应用。
附图说明
16.图1为精液冷冻管的结构示意图,其中1-精液冷冻管本体、11-棉塞;
17.图2为对精液冷冻管进行斜切的示意图,其中1-精液冷冻管本体、11-棉塞、3-手术刀、4-u型斜口长度、5
‑‑
u型斜口;
18.图3为吸水材料自u型斜口插入冷冻管本体内的示意图,其中,1-精液冷冻管本体、11-棉塞、2-吸水材料、5
‑‑
u型斜口;
19.图4为卵母细胞和动物胚胎玻璃化冷冻载体的吸水材料上加入含有卵母细胞和/或胚胎的冷冻液的示意图,其中,1-精液冷冻管本体、11-棉塞、2-吸水材料、5
‑‑
u型斜口、6-含有卵母细胞和/或胚胎的冷冻液。
具体实施方式
20.本发明提供了一种卵母细胞和胚胎玻璃化冷冻载体,包括冷冻管本体,所述冷冻管本体的一端为u型斜口,其特征在于,在所述冷冻管本体的u型斜口端的内壁上贴附有吸水材料。
21.本发明的卵母细胞和胚胎玻璃化冷冻载体适用于人和动物。
22.在本发明中,所述吸水材料优选的包括滤纸,滤纸经济便宜,本发明的卵母细胞和胚胎玻璃化冷冻载体能够达到和cryotop相当的冷冻效果,但是更经济实惠、成本更低,cryotop的售价是20美元,而本发明的胚胎玻璃化冷冻载体成本约合0.5美元。在本发明中,所述吸水材料的形状优选的包括长方形;所述吸水材料的长度优选为18~20mm,所述吸水材料的宽度优选为5~6mm。在本发明中,所述吸水材料的外沿和u型斜口的外沿平齐。
23.在本发明中,所述u型斜口的斜角的角度优选为60
°
;所述u型斜口的长度为0.5~1cm。
24.在本发明中,所述卵母细胞和胚胎玻璃化冷冻载体的制备方法优选的包括以下步骤:对精液冷冻管一端斜切,形成含有u型斜口的冷冻管本体;在所述冷冻管本体的u型斜口端的内壁上贴附吸水材料。
25.在本发明中,所述斜切优选的采用手术刀进行;所述斜切所述精液冷冻管的规格优选为0.25ml或0.5ml,所述精液冷冻管的结构示意图参见图1,斜切的示意图参见图2。
26.在本发明中,所述吸水材料自u型斜口插入冷冻管本体内,自然贴附于冷冻管本体的内壁上,不通过粘附剂粘附。在本发明中,所述吸水材料自u型斜口插入冷冻管本体内的示意图参见图3。
27.本发明还提供了一种基于上述方案所述卵母细胞和胚胎玻璃化冷冻载体的卵母细胞和/或胚胎玻璃化冷冻方法,包括以下步骤:
28.将含有卵母细胞和/或胚胎的冷冻液转移至上述方案所述玻璃化冷冻载体的吸水材料上,并将其前端直接投入液氮里进行冷冻。然后把冷冻载体放入普通液氮罐里保存。示意图参见图4。
29.本发明的卵母细胞和胚胎玻璃化冷冻载体在使用前优选的经过灭菌处理;所述灭菌的方式优选为气体灭菌,更优选为臭氧灭菌。
30.在本发明中,所述转移的时间优选为在卵母细胞和胚胎经冷冻液冷冻处理结束前5~10s。
31.本发明对所述冷冻液的配方没有特殊限制,采用本领域常规的玻璃化冷冻液及冷冻方法即可。
32.本发明对卵母细胞和胚胎进行玻璃化冷冻后,优选的还包括解冻;所述解冻的方法包括:将玻璃化冷冻载体加入到解冻液中,进行解冻。本发明对解冻液的配方和解冻的参数没有特殊限制,采用本领域常用的玻璃化解冻液即可。
33.下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。
34.实施例1
35.1)用手术刀在一根规格为0.25ml的精液冷冻管前端1.0cm处,以60度的角度切去细管的上部,从而细管的底部形成一个u槽斜口;
36.2)将长20mm、宽5mm的化学滤纸插入u槽斜口的细管内,并使滤纸的前端与细管的前端齐平;把10~15只纸管装入气体灭菌袋,进行气体灭菌,得到灭菌的玻璃化冷冻载体(纸管);
37.3)在卵母细胞和胚胎经冷冻液冷冻处理结束前5~10s,将含有卵母细胞和/或胚胎的冷冻液转移至步骤2)得到的纸管的吸水材料上,移入液氮进行冷冻。
38.把纸管直接放入解冻液,进行解冻。
39.实施例2
40.1、卵母细胞的获取
41.将8~10周龄母鼠(瑞士小鼠和b6d2杂交得到f1母鼠),腹腔注射10iu/只pmsg(sigma),48~50h后,注射100iu/只hcg。于注射hcg(sigma)后的18~20h颈椎脱臼处死,取出输卵管,置于培养液m2(sigma)中,解剖显微镜下,用注射器针头划开输卵管膨大部位,可见卵冠丘复合物,移入含80iu/ml的透明质酸酶溶液(sigma)中进行消化,反复吹吸,脱颗粒,收集形态正常、具有第一极体的卵母细胞放入m16(sigma)液中,加盖后置于37℃5%培养箱中待用。
42.2、胚胎的获取
43.用上述小鼠超排方案,对8~10周龄母鼠(瑞士小鼠和b6d2杂交得到f1母鼠),腹腔
注射pmsg和hcg进行超排处理后,与公鼠1∶1合笼。合笼见栓后第3~3.5d,将供体小鼠颈椎脱臼致死,酒精浸泡消毒,在解剖盘内剪开腹部皮肤并向上扩创,显露腹壁肌肉,再于耻骨前缘剪开肌肉,拨开内脏,暴露子宫角。用眼科剪先将子宫角上的脂肪剥离干净。于子宫颈处剪断后,子宫角连同输卵管和卵巢一起取出,置与50mm表面皿中。先用5号细针头在子宫角和输卵管结合部挑开,再用注射器抽取1~2ml dpbs(sigma)+5%bsa液(37℃),接上特制的平头注射针头,从子宫体处分别进入两侧子宫角进行冲胚。冲出液体静置片刻后,在体视显微镜下,用捡卵针将发育良好的囊胚期的胚胎捡出,放入m16液,置于37℃5%培养箱中待用。
44.3、玻璃化冷冻程序
45.冷冻基础液(holding solution,hs)为含犊牛血(fetal calf serum,fcs)10%(v/v)+dpbs(sigma)。首先,在室温下将卵母细胞或胚胎在基础液预平衡2min后,然后移入平衡液(equilibrium solution,es),含二甲基亚砜(dimethy sulfoxid,dmso)7.5%(v/v)+乙二醇(ethylene glycol,eg)7.5%(v/v)的基础液平衡3min;最后在玻璃化冷冻液(vitrification solution,vs):dmso 15%(v/v)+eg 15%(v/v)+1.0m蔗糖的基础液内平衡90s(卵母细胞),或45(胚胎)。根据实验要求,将卵母细胞获胚胎装载于不同的玻璃化冷冻载体(ops,cryotop和纸管)直接投入液氮冷冻。
46.4、解冻程序
47.卵母细胞或胚胎复苏前,将解冻液升温至室温,将冷冻载体从液氮中取出,在空气中暴露3s后将前端置于解冻液1(基础液+1.0m蔗糖)中使卵母细胞或胚胎脱落至液体中,平衡1min后,再依次转移至解冻液2(基础液+0.5m蔗糖),解冻液3液(基础液+0.25m蔗糖),基础液中各3min。解冻的卵母细胞进行体外受精,观察受精率和囊胚发育率;解冻的胚胎将继续培养观察其存活率、发育率和孵化率。
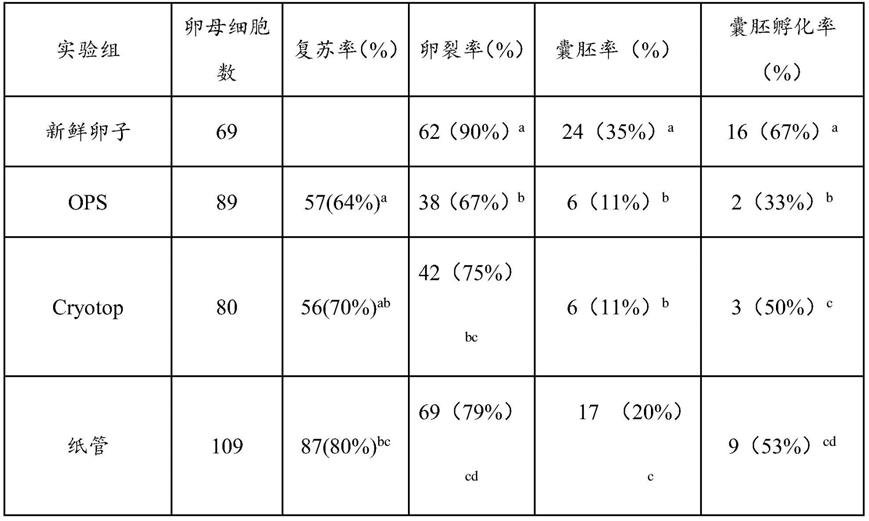
48.5、卵母细胞体外受精(ivf)及发育
49.将解冻卵母细胞转移至受精液(htf,sigma)中,在37℃、5%co2下培养2h后行受精。在此期间,将10~14周的雄鼠以颈椎脱臼法处死,切开腹部,暴露出雄鼠睾丸和附睾等组织,分离出附睾,刺破/剪破后取出精液,置于tyh(sigma)培养滴中,置于于37℃,5%co2培养箱中孵育使精子获能1~2h。光学显微镜下观察精子的活力和状态,根据精子状态,取适量的精子滴于孵育好的卵母细胞培养滴中,进行体外受精(受精密度为2
×
105精子/ml)。受精后4h左右,更换培养液,同m2清洗胚胎3次后,移入m6培养液继续放在co2培养箱中培养。于授精后的16~24h统计复苏率和卵裂率率,在受精后第5天统计囊胚率。在受精后第6天统计孵化率。
50.复苏率=存活卵母细胞存活数/解冻卵母细胞数
×
100%;
51.卵裂率率=受精卵子数/卵子总数
×
100%。
52.囊胚率=囊胚数/总卵母细胞
×
100%。
53.孵化率=孵化囊胚数/总囊胚数
×
100%。
54.6、胚胎发育
55.解冻后的囊胚放入m16液,置于37℃5%培养箱中继续培养48h观察。在24h记录统计复苏率和囊胚率。在48h记录统计囊胚孵化率。
56.复苏率=囊胚存活数/解冻囊胚数
×
100%;
57.囊胚率=囊胚数/解冻胚胎总数
×
100%;
58.囊胚孵化率=孵化囊胚数/总囊胚数
×
100%。
59.实验设计和结果
60.1、生物统计学方法
61.统计学方法采用spss11.5软件进行数据统计处理,计数资料采用χ2检验,显著性差异的阈值被设定为p《0.05。不同字母代表显著性差异。
62.2、卵母细胞玻璃化冷冻
63.表1不同玻璃化载体对卵母细胞冷冻、体外受精和胚胎发育的影响
[0064][0065]
3.胚胎玻璃化冷冻
[0066]
表2不同玻璃化载体对冷冻及其胚胎发育的影响
[0067]
实验组囊胚数复苏率(%)囊胚率(%)囊胚孵化率(%)新鲜囊胚65 58(89%)a39(67%)aops7664(84%)a57(75%)b24(42%)bcryotop8068(85%)a63(79%)b32(51%)c纸管8979(89%)a72(81%)
ab
40(56%)c[0068]
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1