嗜球果伞素类型化合物防除在线粒体细胞色素b蛋白中含有赋予对Qo抑制剂VIII的耐受性的氨基酸替代F129L的植物病原性真菌的用途的制作方法
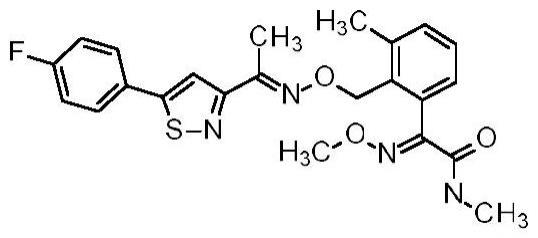
嗜球果伞素类型化合物防除在线粒体细胞色素b蛋白中含有赋予对qo抑制剂viii的耐受性的氨基酸替代f129l的植物病原性真菌的用途
1.本发明涉及式i的嗜球果伞素类型化合物及其n-氧化物和盐防除在线粒体细胞色素b蛋白中含有赋予对qo抑制剂(qoi)的耐受性的氨基酸替代f129l(也称为线粒体细胞色素b基因中的f129l突变)的植物病原性真菌的用途以及防除该类真菌的方法。本发明还涉及新的化合物,制备这些化合物的方法,包含至少一种该化合物的组合物,植物健康应用以及涂有至少一种该化合物的种子。本发明还涉及一种防治在线粒体细胞色素b蛋白中具有氨基酸替代f129l的大豆锈病真菌(豆薯层锈菌(phakopsora pachyrhizi))的方法。
2.本文所用“qo抑制剂”包括能够通过与线粒体中细胞色素bc1复合物的泛氢醌氧化中心(ubihydroquinone oxidation center)结合而减弱和/或抑制呼吸的任何物质。该氧化中心通常位于线粒体内膜的外侧上。这些化合物中的许多也已知为嗜球果伞素类型或嗜球果伞素类似化合物。
3.在线粒体细胞色素b(cytb)基因中的突变f129l应指编码“f”的密码子129(苯丙氨酸;例如ttt或ttc)的任何如下核苷酸替代,所述核苷酸替代导致产生编码“l”的密码子(亮氨酸;例如tta,ttg,ttg,ctt,ctc,cta或ctg),例如在cytb(细胞色素b)基因中密码子129的第一个核苷酸由
‘
t’替代为
‘
c’(ttt替代为ctt),这在细胞色素b蛋白中在位置129产生由f到l的单氨基酸替代。已知该f129l突变赋予对qo抑制剂的耐受性。
4.通常称为嗜球果伞素类型杀真菌剂的qoi杀真菌剂常用于在作物中防治许多真菌病原体。qo抑制剂通常通过在线粒体中与细胞色素bc1复合物(电子传递复合物iii)的泛氢醌氧化中心结合以抑制呼吸而起作用。所述氧化中心位于线粒体内膜的外侧上。使用qoi的主要实例包括例如嗜球果伞素类在小麦上用于防治小麦壳针孢(septoria tritici)(也已知为禾生球腔菌(mycosphaerella graminicola)),后者为小麦叶枯病的起因。遗憾的是,该类qoi的广泛使用已经导致耐受该类qoi的突变病原体的选择。已经在几种植物病原性真菌如小麦白粉菌(blumeria graminis)、斐济球腔菌(mycosphaerella fijiensis)、古巴假霜霉(pseudoperonspora cubensis)或苹果黑星病(venturia inaequalis)中检测到对qoi的耐受性。在农业应用中对qoi的耐受性主要归因于在其细胞色素bc1复合物—已经发现被特定qoi控制的qoi目标蛋白—的细胞色素b基因中含有单氨基酸残基替代g143a的病原体(wo 2013/092224)。尽管几种商业qoi杀真菌剂也已经广泛用于大豆锈病防治,但未观察到在细胞色素b蛋白中赋予对qoi杀真菌剂的耐受性的单氨基酸残基替代g143a。
5.相反,大豆锈病在细胞色素b基因中获得不同基因突变,从而引起也赋予对qoi杀真菌剂的耐受性的单氨基酸替代f129l。常用qoi杀真菌剂,即唑菌胺酯(pyraclostrobin)、腈嘧菌酯(azoxystrobin)、啶氧菌酯(picoxystrobin)、肟醚菌胺(orysastrobin)、醚菌胺(dimoxystrobin)和叉氨苯酰胺(metominostrobin)对大豆锈病的效力已经降至对于农业实践具有实际问题的程度。
6.尽管看起来肟菌酯(trifloxystrobin)不太受f129l突变影响以达到与其他qoi杀真菌剂如腈嘧菌酯和唑菌胺酯相同的程度,但肟菌酯对于带有f129l qoi耐受性突变的真
o-c
1-c4烷基)-c
1-c4烷基、-c(=o)-c
1-c4烷基、-o-ch
2-c(=n-o-c
1-c4烷基)-c
1-c4烷基、c
3-c6环烷基、c
3-c6环烯基、-c
1-c2烷基-c
3-c6环烷基、-o-c
3-c6环烷基、苯基、3-6员杂环烷基、3-6员杂环烯基和5或6员杂芳基,
21.其中所述杂环烷基、杂环烯基和杂芳基除碳原子外还含有1、2或3个选自n、o和s的杂原子,条件是该杂环烷基、杂环烯基和杂芳基不能含有2个连续的选自o和s的原子;
22.和/或
23.与相邻碳环原子键合的2个ra取代基与两个中间的碳环原子一起形成部分不饱和或芳族5-6员稠合碳环或杂环,
24.其中杂环除了碳原子外还包括1或2个独立地选自n、o和s的杂原子作为环成员原子,条件是该杂环不能含有2个连续的选自o和s的原子;
25.并且其中ra的脂族和环状结构部分和上述稠合碳环或杂环未被取代或带有1、2、3、4个或至多最大数目的相同或不同的基团rb:
26.rb选自卤素、cn、nh2、no2、c
1-c4烷基、c
1-c4卤代烷基、-o-c
1-c4烷基、-o-c
1-c4卤代烷基和c
3-c6环烷基;
27.r5、r6相互独立地选自h、c
1-c6烷基、c
1-c6卤代烷基和c
2-c4炔基。
28.细胞色素b(cytb,也称为cob)基因中的突变f129l应指编码“f”的密码子129(苯丙氨酸;例如ttt或ttc)的任何如下核苷酸替代,所述核苷酸替代导致产生编码“l”的密码子(亮氨酸;例如tta,ttg,ttg,ctt,ctc,cta或ctg),例如在细胞色素b基因中密码子129的第一个核苷酸由
‘
t’替代为
‘
c’(ttt替代为ctt),这在细胞色素b蛋白(cytb)中在位置129产生由f(苯丙氨酸)到l(亮氨酸)的单氨基酸替代(f129l)。在本发明中,在细胞色素b基因中的突变f129l应理解为是在细胞色素b蛋白中在位置129由f(苯丙氨酸)到l(亮氨酸)的单氨基酸替代(f129l)。
29.许多其他植物病原性真菌,如锈病,尤其是大豆锈病(豆薯层锈菌和山马蟥层锈菌(phakopsora meibromiae))以及来自链格孢属(alternaria)、核腔菌属(pyrenophora)和丝核菌属(rhizoctonia)的真菌在细胞色素b基因中获得对qo抑制剂赋予耐受性的f129l突变。
30.优选的真菌品种是早疫链格孢(alternaria solani)、豆薯层锈菌、山马蟥层锈菌、大麦网斑内脐蠕孢(pyrenophora teres)、小麦黄斑叶枯病菌(pyrenophora tritici-repentis)和立枯丝核菌(rhizoctonia solani);尤其是豆薯层锈菌。
31.本发明一方面涉及保护易受和/或受到在线粒体细胞色素b蛋白中含有赋予对qo抑制剂的耐受性的氨基酸替代f129l的植物病原性真菌侵袭的植物的方法,该方法包括对所述植物施用至少一种式i化合物或者包含至少一种式i化合物的组合物,用至少一种式i化合物或者包含至少一种式i化合物的组合物处理所述植物的植物繁殖材料和/或对所述植物病原性真菌施用至少一种式i化合物或者包含至少一种式i化合物的组合物。
32.根据另一实施方案,该防除植物病原性真菌的方法包括:a)确定在线粒体细胞色素b蛋白中含有对qo抑制剂赋予耐受性的氨基酸替代f129l的植物病原性真菌,或者处于因本文所定义的植物病原性真菌发生病害危险中的材料、植物、土壤或种子,以及b)用有效量的至少一种式i化合物或包含它的组合物处理所述真菌或材料、植物、土壤或植物繁殖材料。
33.术语“在线粒体细胞色素b蛋白中含有赋予对qo抑制剂的耐受性的氨基酸替代f129l的植物病原性真菌”应理解为至少10%,优选至少30%,更优选至少50%,甚至更优选至少75%,最优选90-100%,尤其是95-100%的待防治真菌分离物在线粒体细胞色素b蛋白中含有赋予对qo抑制剂的耐受性的该f129l替代。
34.尽管就特定实施方案描述本发明,但该描述不应以限制性意义解释。
35.在详细描述本发明的示例性实施方案之前,给出对于理解本发明而言重要的定义。如本说明书和所附权利要求书中使用的那样,单数形式“一个”和“一种”也包括相应的复数,除非上下文另有明确规定。在本发明上下文中,术语“约”和“大约”表示本领域熟练技术人员理解为仍确保所述特征的技术效果的准确度区间。该术语通常表示与所示数值的偏差为
±
20%,优选
±
15%,更优选
±
10%,甚至更优选
±
5%。应理解的是术语“包含”并非限制性的。对本发明而言,术语“由
……
构成”被认为是术语“包括”的优选实施方案。
36.除非另有说明,阐述下列定义来说明和定义用来在本文描述本发明和所附权利要求书的各种术语的含义和范围。这些定义不应从字面意义上解释,因为它们并不意欲为一般定义并且仅与本技术相关。
37.术语“化合物i”涉及式i化合物。同样,该专门用语用于所有子式,例如“化合物i.2”涉及式i.2化合物或者“化合物v”涉及式v化合物等等。
38.术语“独立地”当在对变量的取代基选择上下文中使用时是指在不止一个取代基选自许多可能的取代基时,那些取代基可以相同或不同。
39.在各变量的上面定义中提到的有机结构部分或基团是各基团成员的单独列举的集合性术语。术语“c
v-c
w”显示在每种情况下可能的碳原子数。
40.术语“卤素”涉及氟、氯、溴和碘。
41.术语“c
1-c4烷基”涉及具有1-4个碳原子的直链或支化饱和烃基,例如甲基(ch3)、乙基(c2h5)、丙基、1-甲基乙基(异丙基)、丁基、1-甲基丙基、2-甲基丙基、1,1-二甲基乙基。
42.术语“c
2-c4链烯基”涉及具有2-4个碳原子和在任意位置的双键的直链或支化不饱和烃基,如乙烯基、1-丙烯基、2-丙烯基、1-甲基乙烯基、1-丁烯基、2-丁烯基、3-丁烯基、1-甲基-1-丙烯基、2-甲基-1-丙烯基、1-甲基-2-丙烯基、2-甲基-2-丙烯基。
43.术语“c
2-c4炔基”涉及具有2-4个碳原子并且含有至少一个叁键的直链或支化不饱和烃基,如乙炔基、丙-1-炔基、丙-2-炔基、丁-1-炔基、丁-2-炔基、丁-3-炔基、1-甲基丙-2-炔基。
44.术语“c
1-c4卤代烷基”涉及具有1-4个碳原子的直链或支化烷基,其中这些基团中的一些或所有氢原子可以被如上所述的卤原子替代,例如氯甲基、溴甲基、二氯甲基、三氯甲基、氟甲基、二氟甲基、三氟甲基、氯氟甲基、二氯一氟甲基、一氯二氟甲基、1-氯乙基、1-溴乙基、1-氟乙基、2-氟乙基、2,2-二氟乙基、2,2,2-三氟乙基、2-氯-2-氟乙基、2-氯-2,2-二氟乙基、2,2-二氯-2-氟乙基、2,2,2-三氯乙基和五氟乙基、2-氟丙基、3-氟丙基、2,2-二氟丙基、2,3-二氟丙基、2-氯丙基、3-氯丙基、2,3-二氯丙基、2-溴丙基、3-溴丙基、3,3,3-三氟丙基、3,3,3-三氯丙基、ch
2-c2f5、cf
2-c2f5、cf(cf3)2、1-氟甲基-2-氟乙基、1-氯甲基-2-氯乙基、1-溴甲基-2-溴乙基、4-氟丁基、4-氯丁基、4-溴丁基或九氟丁基。
45.术语
“‑
o-c
1-c4烷基”涉及经由氧在该烷基中的任意位置键合的具有1-4个碳原子的直链或支化烷基,例如och3、och2ch3、o(ch2)2ch3、1-甲基乙氧基、o(ch2)3ch3、1-甲基丙氧
基、2-甲基丙氧基或1,1-二甲基乙氧基。
46.术语“c
3-c6环烷基”涉及具有3-6个碳环成员的单环饱和烃基,如环丙基(c3h5)、环丁基、环戊基或环己基。术语“c
3-c6环烯基”涉及具有3-6个碳环成员和一个或多个双键的单环饱和烃基。
47.术语“3-6员杂环烷基”涉及除了碳原子外具有一个或多个杂原子如o、n、s作为环成员的3-6员单环饱和环体系。术语“c
3-c6杂环烯基”涉及除了碳原子外具有一个或多个杂原子如o、n和s作为环成员并且具有一个或多个双键的3-6员单环体系。
48.术语
“‑c1-c4烷基-c
3-c6环烷基”涉及具有1-4个碳原子的烷基(如上所定义),其中该烷基的一个氢原子被具有3-6个碳原子的环烷基替代。
49.术语“苯基”涉及c6h5。
50.术语含有1、2、3或4个选自o、n和s的杂原子的“5或6员杂芳基”应理解为是指具有5或6个环原子的芳族杂环。实例包括:
[0051]-除了碳原子外例如含有1、2或3个n原子和/或一个硫和/或一个氧原子的5员杂芳基:例如2-噻吩基、3-噻吩基、3-吡唑基、4-吡唑基、5-吡唑基、2-唑基、4-唑基、5-唑基、2-噻唑基、4-噻唑基、5-噻唑基、
[0052]
2-咪唑基、4-咪唑基和1,3,4-三唑-2-基;
[0053]-除了碳原子外例如含有1、2、3或4个n原子作为环成员的6员杂芳基,例如2-吡啶基、3-吡啶基、4-吡啶基、3-哒嗪基、4-哒嗪基、2-嘧啶基、
[0054]
4-嘧啶基、5-嘧啶基和2-吡嗪基。
[0055]
术语“c
1-c2亚烷基连接基”是指一端键合于式i的核结构且另一端键合于该特定取代基的二价烷基如-ch
2-或-ch
2-ch
2-。
[0056]
本文所用“化合物”,尤其是“化合物i”包括所有立体异构和互变异构形式以及所有比例的其混合物,前药,同位素形式,其可农用盐、n-氧化物和s-氧化物。
[0057]
术语“立体异构体”是用于单独化合物的所有异构体的通用术语,这些异构体的不同仅在于其原子在空间中的取向。术语立体异构体包括镜像异构体(对映体),镜像异构体混合物(外消旋体,外消旋混合物),几何(顺/反或e/z)异构体以及具有不止一个手性中心的化合物的异构体—相互不为镜像(非对映体)。术语“互变异构体”涉及两种(或更多种)仅在一个(或多个)可移动原子的位置和电子分布上相互不同的化合物的共存,例如酮-烯醇互变异构体。本文所用术语“可农用盐”包括取决于在本文所述化合物上发现的特定取代基而用酸或碱制备的活性化合物的盐。“n-氧化物”涉及含氮杂芳基或杂环的氮原子的氧化物。n-氧化物可以在氧化剂,例如过氧化物如间氯过苯甲酸或过氧化氢存在下形成。n-氧化物涉及也已知为胺-n-氧化物的氧化胺并且为含有n
→
o键的化合物。
[0058]
就各变量而言,中间体的实施方案对应于化合物i的实施方案。
[0059]
优选那些化合物i和适用的话还有本文所提供的所有子式化合物,例如式i.1和i.2化合物,以及中间体如化合物ii、iii、iv和v,其中各取代基和变量(如n、r1、r2、r3、r4、r5、r6、ra和rb)相互独立地或者更优选组合(2个或更多个本文所定义的取代基的任何可能组合)具有下列含义:
[0060]
还优选这样的用途、方法、混合物和组合物,其中各定义(如植物病原性真菌、处理、作物、化合物ii、其他活性成分、溶剂、固体载体)相互独立地或者更优选组合具有下列
c(=o)-c
1-c4烷基、-c(=n-o-c
1-c4烷基)-c
1-c4烷基、-o-ch
2-(=n-o-c
1-c4烷基)-c
1-c4烷基、-c(=n-o-c
1-c4烷基)-c(=o-nh-c
1-c4烷基)、c
3-c6环烷基、c
3-c6环烯基、-c
1-c2烷基-c
3-c6环烷基、-o-c
3-c6环烷基、苯基、3-5员杂环烷基、3-5员杂环烯基和5或6员杂芳基,其中所述杂环烷基、杂环烯基和杂芳基除了碳原子外含有1、2或3个选自n、o和s的杂原子,并且其中ra的脂族和环状结构部分未被取代或者带有1、2或3个相互独立地选自卤素、cn、nh2、no2、c
1-c2烷基和c
1-c2卤代烷基的相同或不同基团rb。
[0070]
更优选ra选自cn、c
1-c4烷基、c
2-c4链烯基、c
2-c4炔基、-o-c
1-c4烷基、-c(=o)-c
1-c2烷基、-c(=n-o-c
1-c2烷基)-c
1-c2烷基、-o-ch
2-c(=n-o-c
1-c2烷基)-c
1-c2烷基、-c(=n-o-c
1-c2烷基)-c(=o-nh-c
1-c2烷基)、c
3-c4环烷基、c
3-c4环烯基、-c
1-c2烷基-c
3-c4环烷基、-o-c
3-c4环烷基、苯基、3-5员杂环烷基和5或6员杂芳基,其中所述杂环烷基和杂芳基除了碳原子外含有1或2个选自n、o和s的杂原子,并且其中ra的脂族或环状结构部分未被取代或者带有1、2或3个相互独立地选自卤素、cn、c
1-c2烷基和c
1-c2卤代烷基的相同或不同基团rb。
[0071]
甚至更优选ra选自c
1-c3烷基、c
2-c3链烯基、c
2-c3炔基、-o-c
1-c3烷基、-c(=o)-c
1-c2烷基、-c(=n-o-c
1-c2烷基)-c
1-c2烷基、c
3-c4环烷基、-c
1-c2烷基-c
3-c4环烷基、-o-c
3-c4环烷基、苯基、3-5员杂环烷基和5或6员杂芳基,其中所述杂环烷基和杂芳基除了碳原子外含有1或2个选自n、o和s的杂原子,并且其中ra的脂族和环状结构部分未被取代或者带有1、2或3个相互独立地选自卤素、cn、甲基和c1卤代烷基的相同或不同基团rb。
[0072]
特别优选ra选自卤素、c
1-c4烷基、c
2-c3链烯基、c
2-c3炔基、-o-c
1-c4烷基、-c(=n-o-c
1-c2烷基)-c
1-c2烷基和苯基,其中ra的脂族或环状结构部分未被取代或者带有1、2或3个相互独立地选自卤素、cn、甲基和c1卤代烷基的相同或不同基团rb。
[0073]
根据另一实施方案,r5、r6相互独立地优选选自h、c
1-c4烷基、c
1-c4卤代烷基和c
2-c4炔基,更优选选自h和c
1-c4烷基。
[0074]
根据另一优选实施方案,本发明涉及式i化合物及其立体异构体和互变异构体形式以及其n-氧化物和可农用盐防除在线粒体细胞色素b蛋白中含有赋予对qo抑制剂的耐受性的氨基酸替代f129l的植物病原性真菌的用途:
[0075]
其中
[0076]
r1选自o和nh;以及
[0077]
r2选自ch和n,条件是在r1是nh的情况下r2是n;
[0078]
r3选自卤素、cn、c
1-c4烷基、c
2-c4链烯基、c
1-c4卤代烷基和c
3-c4环烷基;
[0079]
r4选自c
1-c6烷基、c
2-c4链烯基、c
2-c4炔基、c
1-c6卤代烷基、c
2-c4卤代链烯基、-c(=o)-c
1-c4烷基、-(c
1-c2烷基)-o-(c
1-c2烷基)、-(c
1-c2烷基)-o-(c
1-c2卤代烷基)、c
3-c6环烷基、c
3-c6卤代环烷基和-c
1-c4烷基-c
3-c6环烷基;
[0080]
het为5或6员杂芳基,其中所述杂芳基除碳原子外还含有1或2个选自n、o和s的杂原子,条件是该杂芳基不能含有2个连续的选自o和s的原子;
[0081]
其中所述杂芳基未被取代或带有1、2或3个相同或不同的基团ra:ra选自卤素、cn、-nr5r6、c
1-c4烷基、c
2-c4链烯基、c
2-c4炔基、-o-c
1-c4烷基、-c(=n-o-c
1-c4烷基)-c
1-c4烷基、-c(=o)-c
1-c4烷基、-o-ch
2-c(=n-o-c
1-c4烷基)-c
1-c4烷基、c
3-c6环烷基、c
3-c6环烯基、-c
1-c2烷基-c
3-c6环烷基、-o-c
3-c6环烷基、苯基、3-6员杂环烷基、3-6员杂环烯基和5或6员杂芳基,
[0082]
其中所述杂环烷基、杂环烯基和杂芳基除碳原子外还含有1或2个选自n、o和s的杂原子,
[0083]
和/或
[0084]
与相邻碳环原子键合的2个ra取代基与两个中间的碳环原子一起形成稠合苯基环,
[0085]
并且其中ra的脂族和环状结构部分和上述稠合苯基环未被取代或带有1、2、3、4个或至多最大数目的相同或不同的基团rb:
[0086]
rb选自卤素、cn、nh2、no2、c
1-c4烷基、c
1-c4卤代烷基、-o-c
1-c4烷基、-o-c
1-c4卤代烷基和c
3-c6环烷基;
[0087]
r5、r6相互独立地选自h、c
1-c6烷基和c
2-c4炔基。
[0088]
某些带有末端吡啶基环的嗜球果伞素类型化合物已经描述于wo 1998/23156中。其他嗜球果伞素类型化合物已经描述于ep 370269和ep 463488中。然而,没有提到这些化合物抑制在线粒体细胞色素b蛋白中含有赋予对qo抑制剂的耐受性的f129l替代的真菌病原体。本发明化合物与上述公布中所述那些的不同在于连接于肟连接基的特定取代基r4和/或含有在如本文所定义的甲基肟侧链的邻位连接于中心苯基环的作为r3的特定基团。
[0089]
因此,根据第二方面,本发明提供式i的新化合物及其立体异构体和互变异构体形式以及其n-氧化物和可农用盐:
[0090][0091]
其中
[0092]
r1选自o和nh;
[0093]
r2选自ch和n;
[0094]
r3选自卤素、cn、c
1-c4烷基、c
2-c4链烯基、c
2-c4炔基、c
1-c4卤代烷基、c
2-c4卤代链烯基、c
2-c4卤代炔基、c
3-c6环烷基、-o-c
1-c4烷基、-o-c
1-c4卤代烷基、-o-c
3-c6环烷基、-c
1-c2烷基-c
3-c6环烷基、苯基、3-6员杂环烷基和5或6员杂芳基,
[0095]
其中所述杂环烷基和杂芳基除碳原子外还含有1、2或3个选自n、o和s的杂原子,条件是该杂环烷基和杂芳基不能含有2个连续的选自o和s的原子,
[0096]
其中所述苯基、杂环烷基和杂芳基直接或经由氧原子或经由c
1-c2亚烷基连接基键合,并且其中所述苯基和杂芳基未被取代或被1、2或3个相同或不同的选自卤素、cn、nh2、no2、c
1-c4烷基、c
1-c4卤代烷基、-o-c
1-c4烷基和-oc
1-c4卤代烷基的取代基取代;
[0097]
r4选自c
1-c6烷基、c
2-c4链烯基、c
2-c4炔基、c
1-c6卤代烷基、c
2-c4卤代链烯基、c
2-c4卤代炔基、o-c
1-c4烷基、-c(=o)-c
1-c4烷基、-(c
1-c2烷基)-o-(c
1-c2烷基)、-(c
1-c2烷基)-o-(c
1-c2卤代烷基)、c
3-c6环烷基、c
3-c6卤代环烷基和-c
1-c4烷基-c
3-c6环烷基;
[0098]
het为5或6员杂芳基,其中所述杂芳基除碳原子外还含有1、2或3个选自n、o和s的杂原子,条件是该杂芳基不能含有2个连续的选自o和s的原子;
[0099]
其中所述杂芳基未被取代或带有1、2、3个或至多最大数目的相同或不同的基团ra:
噻唑基、4-噻唑基、3-异噻唑基和5-咪唑基,特别是3-异噻唑基、2-噻唑基或4-噻唑基。
[0112]
根据另一实施方案,het为6员杂芳基,其中所述杂芳基除碳原子外还含有1、2或3个选自n、o和s的杂原子,条件是该杂芳基不能含有2个连续的选自o和s的原子;优选地,所述6员杂芳基除碳原子外还含有1或2个氮原子;更优选地,所述杂芳基选自2-吡啶基、3-吡啶基、4-吡啶基、3-吡嗪基、4-吡嗪基、2-嘧啶基、4-嘧啶基、5-嘧啶基和2-吡嗪基;甚至更优选选自2-吡啶基、3-吡啶基、4-吡啶基、2-嘧啶基、4-嘧啶基、3-哒嗪基、2-吡嗪基;特别是2-吡啶基。
[0113]
根据另一实施方案,het为吡啶基或噻唑基。
[0114]
根据另一实施方案,het带有1、2、3、4或5个ra取代基;更优选1、2或3个ra取代基,甚至更优选1或2个ra取代基;特别是1个ra取代基。
[0115]
根据另一实施方案,het未被取代或带有1、2或3个ra取代基,更优选het未被取代或带有1或2个ra取代基,特别是het未被取代。
[0116]
根据另一实施方案,ra选自卤素、cn、nh-c
1-c4烷基、n(c
1-c4烷基)2、c
1-c4烷基、c
2-c4链烯基、c
2-c4炔基、-o-c
1-c4烷基、-c(=n-o-c
1-c4烷基)-c
1-c4烷基、-c(=o)-c
1-c4烷基、-o-ch
2-c(=n-o-c
1-c4烷基)-c
1-c4烷基、c
3-c4环烷基、-c
1-c2烷基-c
3-c4环烷基、-o-c
3-c4环烷基、苯基、3-5员杂环烷基、3-5员杂环烯基和5或6员杂芳基,其中所述杂环烷基、杂环烯基和杂芳基除了碳原子外含有1或2个选自n、o和s的杂原子优选ra选自卤素、cn、nh-c
1-c2烷基、n(c
1-c2烷基)2、c
1-c4烷基、c
2-c4链烯基、c
2-c4炔基、-c(=n-o-c
1-c4烷基)-c
1-c4烷基、-c(=o)-c
1-c2烷基、c
3-c4环烷基、-o-c
3-c4环烷基、苯基、3-5员杂环烷基和5或6员杂芳基,其中所述杂环烷基和杂芳基除了碳原子外含有1或2个选自n、o和s的杂原子。更优选ra选自卤素、cn、c
1-c3烷基、-o-c
1-c3烷基、-c(=n-o-ch3)-ch3、c
3-c4环烷基、-o-c
3-c4环烷基、苯基、3-5员杂环烷基和5或6员杂芳基,其中所述杂环烷基和杂芳基除了碳原子外含有1或2个选自n、o和s的杂原子。ra尤其选自卤素、cn、c
1-c2烷基、-o-c
1-c2烷基、乙烯基、乙炔基和-c=(n-o-ch3)-ch3。
[0117]
根据ra的上述实施方案,上述杂环烷基更优选是4员杂环烷基,其中所述杂环烷基除了碳原子外含有1个选自n、o和s的杂原子,优选n。
[0118]
根据ra的上述实施方案,上述杂芳基更优选是5员杂芳基,其中所述杂芳基除了碳原子外含有1或2个选自n、o和s,优选n和o的杂原子。
[0119]
根据ra的上述实施方案,脂族和环状结构部分未被取代或带有1、2、3、4个或至多最大数目的选自卤素、cn、nh2、no2、c
1-c4烷基、c
1-c4卤代烷基、-o-c
1-c4烷基和-o-c
1-c4卤代烷基的相同或不同基团rb;更优选仅ra的环状结构部分未被取代或带有1、2、3、4个或至多最大数目的选自卤素、cn、nh2、no2、c
1-c4烷基、c
1-c4卤代烷基、-o-c
1-c4烷基和-o-c
1-c4卤代烷基的相同或不同基团rb;甚至更优选仅ra的苯基结构部分未被取代或带有1、2、3、4或5个选自卤素、cn、c
1-c4烷基、c
1-c4卤代烷基、-o-c
1-c4烷基和-o-c
1-c4卤代烷基的相同或不同基团rb;ra的所述苯基结构部分尤其未被取代或带有1、2或3个选自卤素、cn、c
1-c2烷基、c
1-c2卤代烷基、-o-c
1-c2烷基和-o-c
1-c2卤代烷基的相同或不同基团rb。
[0120]
根据另一优选实施方案,本发明涉及式i化合物及其立体异构体和互变异构体形式以及其n-氧化物和可农用盐:
[0121]
其中
[0122]
r1选自o和nh;以及
[0123]
r2选自ch和n,条件是在r1是nh的情况下r2是n;
[0124]
r3选自卤素、cn、c
1-c4烷基、c
2-c4链烯基、c
1-c4卤代烷基和c
3-c4环烷基;
[0125]
r4选自c
1-c6烷基、c
2-c4链烯基、c
2-c4炔基、c
1-c6卤代烷基、c
2-c4卤代链烯基、-c(=o)-c
1-c4烷基、-(c
1-c2烷基)-o-(c
1-c2烷基)、-(c
1-c2烷基)-o-(c
1-c2卤代烷基)、c
3-c6环烷基、c
3-c6卤代环烷基和-c
1-c4烷基-c
3-c6环烷基;
[0126]
het为5或6员杂芳基,其中所述杂芳基除碳原子外还含有1或2个选自n、o和s的杂原子,条件是该杂芳基不能含有2个连续的选自o和s的原子;
[0127]
其中所述杂芳基未被取代或带有1、2或3个相同或不同的基团ra:ra选自卤素、cn、-nr5r6、c
1-c4烷基、c
2-c4链烯基、c
2-c4炔基、-o-c
1-c4烷基、-c(=n-o-c
1-c4烷基)-c
1-c4烷基、-c(=o)-c
1-c4烷基、-o-ch
2-c(=n-o-c
1-c4烷基)-c
1-c4烷基、c
3-c6环烷基、c
3-c6环烯基、-c
1-c2烷基-c
3-c6环烷基、-o-c
3-c6环烷基、苯基、3-6员杂环烷基、3-6员杂环烯基和5或6员杂芳基,
[0128]
其中所述杂环烷基、杂环烯基和杂芳基除碳原子外还含有1或2个选自n、o和s的杂原子,
[0129]
和/或
[0130]
与相邻碳环原子键合的2个ra取代基与两个中间的碳环原子一起形成稠合苯基环,
[0131]
并且其中ra的脂族和环状结构部分和上述稠合苯基环未被取代或带有1、2、3、4个或至多最大数目的相同或不同的基团rb:
[0132]
rb选自卤素、cn、nh2、no2、c
1-c4烷基、c
1-c4卤代烷基、-o-c
1-c4烷基、-o-c
1-c4卤代烷基和c
3-c6环烷基;
[0133]
r5、r6相互独立地选自h、c
1-c6烷基和c
2-c4炔基。
[0134]
根据另一实施方案,r1是o且r2是n,这些化合物具有式i.1:
[0135][0136]
根据另一实施方案,r1是o且r2是ch,这些化合物具有式i.2:
[0137][0138]
根据另一实施方案,r1是nh且r2是n,这些化合物具有式i.3:
[0139][0140]
优选化合物i的r3是下列基团3-1至3-8中的一个:
[0141][0142]
甚至更优选r3是ch3、och3、cf3、chf2或c3h5,尤其是ch3。
[0143]
本发明的特别优选实施方案涉及其中r4是下列基团4-1至4-10之一的化合物i:
[0144][0145]
本发明的特别优选实施方案涉及其中ra选自下列基团a-1至a-18之一的化合物i:
[0146][0147]
根据另一实施方案,r1为o,r2为n且r3为ch3,这些化合物具有式i.1.1:
[0148][0149]
根据另一实施方案,r1为o,r2为ch且r3为ch3,这些化合物具有式i.2.1:
[0150][0151]
根据另一实施方案,r1为nh,r2为n且r3为ch3,这些化合物具有式i.3.1:
[0152][0153]
在一个实施方案中,化合物i具有式i.3.1,并且het、ra和r4根据下表a的任一行,这些化合物被命名为i.3.1-a-1至i.3.1-a-441。
[0154]
在另一实施方案中,化合物i具有式i.2,并且het、ra和r4根据下表a的任一行,这些化合物被命名为i.2.1-a-1至i.2.1-a-441。
[0155]
在一个实施方案中,化合物i具有式i.1.1,并且n、ra和r4根据下表a的任一行,这些化合物被命名为i.1.1-a-1至i.1.1-a-441。
[0156]
表a:
[0157]
[0158]
[0159]
[0160]
[0161]
[0162][0163]
所述化合物可以通过类似于已知的现有技术方法(例如ep 414153、wo 98/23156)的各种途径得到,有利的是通过在下列方案1-4以及本技术的试验部分所示的合成得到。
[0164]
一种制备化合物i的合适方法示于方案1中。
[0165]
方案1:
[0166][0167]
这开始于使用羟胺盐酸盐和碱如吡啶、氢氧化钠或乙酸钠在极性溶剂如甲醇、甲醇-水混合物或乙醇中在60-100℃,优选约65℃的反应温度下将酮转化为相应肟。在其中得到e/z混合物的情况下,异构体可以通过本领域已知的提纯技术(例如柱层析、结晶、蒸馏等)分离。然后在碱性条件下使用例如氢化钠、碳酸铯或碳酸钾作为碱并且使用有机溶剂如二甲基甲酰胺(dmf)或乙腈(acn),优选使用碳酸铯作为碱和acn作为溶剂在约24℃的室温(rt)下进行与中间体iv的偶联,其中x是离去基团如卤素、甲苯磺酸酯和甲磺酸酯,优选x是cl或br。其中r1是o的酯化合物i可以通过在rt下使用四氢呋喃(thf)作为溶剂与甲胺(优选40%水溶液)反应而转化为其中r1是nh的式i的酰胺。
[0168]
制备化合物i的另一通用方法示于方案2中。
[0169]
方案2:
[0170][0171]
使用碱如三乙胺在dmf中使中间体iv与n-羟基琥珀酰亚胺vi反应。反应温度通常为50-70℃,优选约70℃。向相应o-苄基羟胺—中间体viii的转化通过除去邻苯二甲酰亚胺基团实现,这优选使用水合肼在甲醇作为溶剂中在25℃下进行。替换地,使用甲胺在甲醇作为溶剂中在25℃下除去邻苯二甲酰亚胺基团可以提供中间体ix。中间体viii和中间体ix分别可以使用乙酸或吡啶在甲醇作为溶剂中在50-65℃的温度下与酮缩合。替换地,该缩合还可以用乙醇钛(iv)(ti(oet)4)使用thf作为溶剂在约70℃下进行。所需产物通常伴随有不希望的异构体,后者例如可以通过柱层析、结晶除去。
[0172]
制备中间体iv的通用方法示于方案3中。
[0173]
方案3:
[0174][0175]
化合物xi可以通过锂-卤素交换或者通过产生格利雅试剂并进一步与草酸二甲酯或草酸氯甲酯在溶剂存在下反应而由x得到。优选的溶剂是thf、2-甲基-thf并且温度可以为-70℃至-78℃。将中间体xi转化为中间体xii可以使用n-甲基羟胺盐酸盐和碱如吡啶或乙酸钠在极性溶剂如甲醇中实现。反应温度优选为约65℃。通常得到e/z混合物,异构体可以通过本领域已知的提纯技术(例如柱层析、结晶)分离。中间体xii的溴化提供所需中间体化合物iv,其中r1是o并且r2=n。中间体xii与n-溴代琥珀酰亚胺在溶剂如四氯化碳、氯苯、acn中使用自由基引发剂如1,1
′‑
偶氮二(环己烷甲腈)或偶氮二异丁腈的该反应在70-100℃的温度下进行。优选的自由基引发剂是1,1
′‑
偶氮二(环己烷甲腈),优选的溶剂是氯苯且优选的温度为80℃。
[0176]
含有不同取代基r3的化合物的合成按照与其中r3是溴的方案3类似的顺序进行。中间体iii与其中r3是溴的中间体iv的偶联提供如上所述的化合物i。使用标准化学反应,如suzuki或stille反应,可以将溴基团转化为例如其他r3取代基如环烷基、烷氧基和链烯基。例如乙烯基的额外转化提供具有其他r3取代基如乙基、cn和卤代烷基的化合物i。
[0177]
大多数通式ii的酮可市购,然而对于不能市购的而言,这些的制备使用现有技术中已知的方法内部进行。方案4描述了合成这些酮的各种文献已知方法。
[0178]
方案4:
[0179][0180]
酮ii可以由相应的带卤素前体xiv得到,其中x优选是溴或碘。在化合物xiii中使用正丁基锂的锂-卤素交换(j org chem,1998,63(21),7399-7407)或者使用thf作为溶剂合成相应格利雅试剂(nature comm,2017,8(1),1-7)以及随后与n-甲氧基-n-甲基乙酰胺在约-70℃至-78℃下反应可以提供酮ii。替换地,化合物xiv和三丁基(1-乙氧基乙烯基)锡烷在具有合适配体的过渡金属催化剂,优选钯存在下在溶剂如二烷中在约100℃的反应温度下的偶联反应,然后用1n hcl处理可以提供酮ii(org lett,2016,18(7),1630-1633,wo 2018/115380)。xiv与1,4-丁二醇乙烯基醚在具有合适配体的过渡金属催化剂,优选钯以及溶剂如1,2-丙二醇和碱如碳酸钠存在下在约120℃的反应温度下反应,然后用1n hcl处理可以提供酮ii(chem a eur j,2008,14(18),5555-5566)。另一方法使用酸化合物xv,可以将其转化为相应的weinreb酰胺或羧酸酯xvii并随后与甲基溴化镁(memgbr)在溶剂如thf中于-78℃至0℃,优选0℃的温度下反应而提供酮ii。另一方法使用腈xvi与memgbr的反
应,这在溶剂如thf或甲苯,优选thf中进行并且反应温度为25-60℃,优选60℃,然后用1n hcl处理(eur j med chem,2015,102,582-593)。
[0181]
化合物i及其组合物分别适合作为对宽范围的植物病原性真菌有效的杀真菌剂,所述植物病原性真菌包括土传真菌,尤其来自根肿菌纲(plasmodiophoromycetes)、peronosporomycetes(同义词卵菌纲(oomycetes))、壶菌纲(chytridiomycetes)、接合菌纲(zygomycetes)、子囊菌纲(ascomycetes)、担子菌纲(basidiomycetes)和半知菌纲(deuteromycetes)(同义词不完全菌纲(fungi imperfecti))的土传真菌。它们可以作为叶面杀真菌剂、拌种用杀真菌剂和土壤杀真菌剂用于作物保护中。
[0182]
化合物i及其组合物优选用于防治各种栽培植物上、植物繁殖材料(例如种子)上以及这些植物的作物材料上的植物病原性真菌,所述栽培植物例如为禾谷类,例如小麦、黑麦、大麦、小黑麦、燕麦或稻;甜菜,例如糖用甜菜或饲料甜菜;水果,例如仁果(苹果、梨等)、核果(例如李、桃、杏仁、樱桃)或小果,也称为浆果(草莓、悬钩子、黑莓、鹅莓等);豆科植物,例如兵豆、豌豆、苜蓿或大豆;油料植物,例如油籽油菜、芥菜、橄榄、向日葵、椰子、可可豆、蓖麻油植物、油棕、花生或大豆;葫芦科植物,例如南瓜、黄瓜或甜瓜;纤维植物,例如棉花、亚麻、大麻或黄麻;柑桔类水果,例如橙子、柠檬、葡萄柚或橘;蔬菜,例如菠菜、莴苣、芦笋、卷心菜、胡萝卜、洋葱、西红柿、马铃薯、葫芦或柿子椒;月桂类植物,例如鳄梨、肉桂或樟脑;能源和原料植物,例如玉米、大豆、油籽油菜、甘蔗或油棕;玉米;烟草;坚果;咖啡;茶;香蕉;葡萄藤(食用葡萄和葡萄汁葡萄藤);啤酒花;草坪;甜叶菊(也称为stevia);天然橡胶植物;或观赏和森林植物,例如花卉、灌木、落叶树和常绿树(针叶树、桉树等)。
[0183]
化合物i及其组合物更优选分别用于防治大田作物上的真菌,所述大田作物例如为马铃薯、甜菜、烟草、小麦、黑麦、大麦、燕麦、稻、玉米、棉花、大豆、油籽油菜、豆科植物、向日葵、咖啡或甘蔗;水果;葡萄藤;观赏植物;或蔬菜,例如黄瓜、西红柿、菜豆或南瓜。
[0184]
术语“植物繁殖材料”应理解为表示植物的所有生殖部分,例如种子;以及可用于繁殖植物的无性植物材料,例如插条和块茎(例如马铃薯)。这包括种子、根、果实、块茎、球茎、根茎、枝条、芽和其他植物部分;包括要在萌芽后或从土壤中出苗后进行移植的幼苗和幼小植物。
[0185]
根据本发明,所有上面的栽培植物应理解为包括所有属于相应栽培植物的属种、亚种、变种、品种和/或杂种,包括但不限于冬季和春季品种,尤其是禾谷类如小麦和大麦,以及油籽油菜,例如冬小麦、春小麦、冬大麦等等。
[0186]
玉米也已知为印第安玉米或玉蜀黍(甜玉米(zea mays)),其包括所有种类的玉米如饲料玉米和甜玉米。根据本发明包括所有玉米亚种和/或品种,尤其是粉质玉米(zea mays var.amylacea)、爆裂玉米(zea mays var.everta)、马齿玉米(zea mays var.indentata)、硬质玉米(zea mays var.indurata)、甜玉米(zea mays var.saccharata和var.rugosa)、糯玉米(zea mays var.ceratina)、链淀粉玉米(高直链淀粉甜玉米品种)、荚玉米或野生玉米(zea mays var.tunicata)和条纹玉米(zea mays var.japonica)。
[0187]
大多数大豆品种可分为不确定和确定生长习性,而大豆的野生祖先—野大豆(glycine soja)是不确定的(pnas 2010,107(19)8563-8568)。不确定生长习性(成熟组,mg 00至mg 4.9)的特征是开花开始后营养生长的持续,而确定大豆品种(mg 5至mg 8)的特征是在开花开始时已经完成了大部分营养生长。根据本发明包括所有大豆栽培品类或品种,
尤其是不确定和确定的栽培品类或品种。
[0188]
优选地,分别用化合物i及其组合物对植物繁殖材料进行的处理用于防治禾谷类如小麦、黑麦、大麦和燕麦;稻、玉米、棉花和大豆上的真菌。
[0189]
术语“栽培植物”应理解为包括已经通过诱变或基因工程修饰以对植物提供新性状或者修饰已经存在的性状的植物。诱变包括使用x射线或诱变化学试剂进行随机诱变,以及靶向诱变,以便在植物基因组的特定基因座处产生突变。靶向诱变通常使用寡核苷酸或蛋白质如crispr/cas、锌指核酸酶、talen或兆核酸酶。基因工程通常使用重组dna技术在植物基因组中产生在天然情况下不能容易地通过杂交育种、诱变或天然重组获得的修饰。通常,将一个或多个基因整合到植物基因组中以增加性状或改善或修饰性状。这些整合的基因也称为转基因,而包含该转基因的植物称为转基因植物。植物转型过程通常产生若干转型事件,该转型事件的不同之处在于已整合转基因的基因座。在特定基因座上包含特定转基因的植物通常描述为包含特定“事件”,其通过特定事件名称提及。已引入植物中或已修饰的性状包括除草剂耐受性、昆虫抗性、增加的产量和对非生物条件如干旱的耐受性。
[0190]
已通过使用诱变和基因工程产生除草剂耐受性。通过诱变和育种已变得对乙酰乳酸合成酶(als)抑制剂除草剂具有耐受性的植物例如以的名义提供。对草甘膦(glyphosate)、草铵膦(glufosinate)、2,4-滴(2,4-d)、麦草畏(dicamba)、oxynil除草剂(如溴苯腈(bromoxynil)和碘苯腈(ioxynil))、磺酰脲除草剂、als抑制剂和4-羟基苯基丙酮酸双加氧酶(hppd)抑制剂(如异氟草(isoxaflutole)和硝磺酮(mesotrione))的除草剂耐受性已经通过使用转基因产生。
[0191]
化合物i及其组合物分别特别适合防治植物病害的下列致病因子:大豆和禾谷类上的锈病(例如大豆上的豆薯层锈菌和山马蟥层锈菌(p.meibomiae);小麦上的小麦叶锈菌(puccinia tritici)、小麦杆锈病菌(p.graminis)、小麦叶锈菌(p.recondita)和小麦条锈菌(p.striiformis));特种作物、大豆、油籽油菜和向日葵上的霉病(例如草莓和葡萄藤上的灰葡萄孢(botrytis cinerea),油籽油菜、向日葵和大豆上的核盘菌(sclerotinia sclerotiorum)、小核盘菌(s.minor)和白绢病(s.rolfsii));禾谷类上的镰孢霉属(fusarium)病害(例如小麦上的大刀镰孢(fusarium culmorum)和禾本科镰孢(f.graminearum));特种作物上的霜霉病(例如葡萄藤上的葡萄生单轴霉(plasmopara viticola),马铃薯上的致病疫霉(phytophthora infestans));特种作物和禾谷类上的白粉病(例如葡萄藤上的葡萄钩丝壳(uncinula necator),各种特种作物上的白粉菌属(erysiphe),禾谷类上的小麦白粉菌);以及禾谷类、大豆和玉米上的叶斑病(例如禾谷类上的叶枯病菌(zymoseptoria tritici)和颖枯壳多孢(septoria nodorum),大豆上的大豆壳针孢(s.glycines),玉米和大豆上的尾孢属(cercospora))。
[0192]
另一个实施方案涉及式(i)化合物在防除大豆植物和植物繁殖材料(例如种子)和这些植物的作物材料上的大豆锈病中的用途。大豆锈病由称为豆薯层锈菌和山马蟥层锈菌的两种真菌病原体引起。
[0193]
因此,另一实施方案涉及化合物i在防除大豆植物和植物繁殖材料(例如种子)和这些植物的作物材料上的豆薯层锈菌和/或山马蟥层锈菌中的用途。更优选的实施方案是化合物i在防除大豆植物和植物繁殖材料(例如种子)和这些植物的作物材料上的豆薯层锈菌中的用途。
[0194]
因此,本发明涉及防除大豆锈病(豆薯层锈菌和/或山马蟥层锈菌)的方法,包括:用有效量的至少一种化合物i或包含该化合物i的组合物处理大豆植物或大豆植物繁殖材料以免受豆薯层锈菌和/或山马蟥层锈菌的侵袭。
[0195]
针对大豆锈病的处理可以是预防性的或治疗性的。
[0196]
大豆植物针对大豆锈病的处理优选是预防性的。当大豆植物在出现第一个症状后不久就处于感染风险时,应进行预防性治疗。根据一个实施方案,大豆植物的第一次处理应发生在营养生长阶段v3至v4(意味着4至4个完全展开的三叶)开始到生殖生长阶段r2(盛开),更优选发生在营养生长阶段v6至v8(意味着6至8个完全展开的三叶)开始到生殖生长阶段r3(开始开花)。取决于疾病压力,可能需要施用2-4次,在极端条件下最多施用5次,施用间隔为14-28天。
[0197]
当用作针对大豆锈病的叶面喷雾剂时,化合物i的施用量取决于所用的具体化合物和病害压力为5-500g/ha,优选10-200g/ha,更优选15-150g/ha,特别是30-125g/ha。
[0198]
此外,本发明涉及如本文所定义的式i化合物防除在线粒体细胞色素b蛋白中含有赋予对qo抑制剂的耐受性的氨基酸替代f129l的植物病原性真菌的用途。
[0199]
细胞色素b(cytb,也称为cob)基因中的突变f129l应指编码“f”的密码子129(苯丙氨酸;例如ttt或ttc)的任何如下核苷酸替代,所述核苷酸替代导致产生编码“l”的密码子(亮氨酸;例如tta,ttg,ttg,ctt,ctc,cta或ctg),例如在细胞色素b基因中密码子129的第一个核苷酸由
‘
t’替代为
‘
c’(ttt替代为ctt),这在细胞色素b蛋白(cytb)中在位置129产生由f(苯丙氨酸)到l(亮氨酸)的单氨基酸替代(f129l)。在本发明中,在细胞色素b基因中的突变f129l应理解为是在细胞色素b蛋白中在位置129由f(苯丙氨酸)到l(亮氨酸)的单氨基酸替代(f129l)。
[0200]
许多其他植物病原性真菌,如锈病,尤其是大豆锈病(豆薯层锈菌和山马蟥层锈菌(phakopsora meibromiae))以及来自链格孢属(alternaria)、核腔菌属(pyrenophora)和丝核菌属(rhizoctonia)的真菌在细胞色素b基因中获得对qo抑制剂赋予耐受性的f129l突变。
[0201]
优选的真菌品种是早疫链格孢(alternaria solani)、豆薯层锈菌、山马蟥层锈菌、大麦网斑内脐蠕孢(pyrenophora teres)、小麦黄斑叶枯病菌(pyrenophora tritici-repentis)和立枯丝核菌(rhizoctonia solani);尤其是豆薯层锈菌。
[0202]
本发明一方面涉及保护易受和/或受到在线粒体细胞色素b蛋白中含有赋予对qo抑制剂的耐受性的氨基酸替代f129l的植物病原性真菌侵袭的植物的方法,该方法包括对所述植物施用至少一种式i化合物或者包含至少一种式i化合物的组合物,用至少一种式i化合物或者包含至少一种式i化合物的组合物处理所述植物的植物繁殖材料和/或对所述植物病原性真菌施用至少一种式i化合物或者包含至少一种式i化合物的组合物。
[0203]
根据另一实施方案,该防除植物病原性真菌的方法包括:a)确定在线粒体细胞色素b蛋白中含有对qo抑制剂赋予耐受性的氨基酸替代f129l的植物病原性真菌,或者处于因本文所定义的植物病原性真菌发生病害危险中的材料、植物、土壤或种子,以及b)用有效量的至少一种式i化合物或包含它的组合物处理所述真菌或材料、植物、土壤或植物繁殖材料。
[0204]
术语“在线粒体细胞色素b蛋白中含有赋予对qo抑制剂的耐受性的氨基酸替代
f129l的植物病原性真菌”应理解为至少10%,优选至少30%,更优选至少50%,甚至更优选至少75%,最优选90-100%,尤其是95-100%的待防治真菌分离物在线粒体细胞色素b蛋白中含有赋予对qo抑制剂的耐受性的该f129l替代。
[0205]
化合物i及其组合物分别还适合在储存产品或收获产品的保护中以及在材料保护中防治有害微生物。
[0206]
当用于保护材料或储存产品时,活性物质的施用量取决于施用区域的种类和所需的效果。材料保护中常用的施用量例如为0.001g至2kg,优选为0.005g至1kg活性物质/立方米被处理材料。
[0207]
化合物i及其组合物分别可以用于改善植物健康。本发明还涉及一种通过分别用有效量的化合物i及其组合物处理植物、其繁殖材料和/或其中植物生长或要生长的场所而改善植物健康的方法。
[0208]
化合物i直接或以组合物形式通过用杀真菌有效量的活性物质处理真菌,需要防止真菌侵袭的植物、植物繁殖材料如种子、土壤、表面、材料或空间而使用。施用可以在植物、植物繁殖材料如种子、土壤、表面、材料或空间被真菌侵染之前和之后进行。
[0209]
植物繁殖材料可以在种植或移栽时或在种植或移栽之前用化合物i直接或包含至少一种化合物i的组合物预防性地处理。
[0210]
本发明还涉及包含助剂和至少一种化合物i的农业化学组合物。
[0211]
当用于植物保护时,活性物质的施用量取决于所需效果的种类为0.001-2kg/ha,优选0.005-2kg/ha,更优选0.05-0.9kg/ha,甚至更优选0.075-0.75kg/ha,特别是0.1-0.3kg/ha。
[0212]
在植物繁殖材料如种子例如通过撒粉、包衣或浸泡的处理中,通常要求活性物质的量为0.1-1000g/100kg,优选1-1000g/100kg,更优选1-100g/100kg,最优选5-100g/100kg植物繁殖材料(优选种子)。
[0213]
农业化学组合物包含杀真菌有效量的化合物i。术语“杀真菌有效量”表示足以在栽培植物上或在储存产品或收获产品或者材料保护中防治植物病原性真菌且不对被处理植物、被处理储存产品或收获产品或者被处理材料引起显著损害的量的组合物或化合物i。该量可以在宽范围内变化且取决于各种因素如待防治的真菌品种、被处理的栽培植物、储存产品、收获产品或材料、气候条件以及所用具体化合物i。
[0214]
用户通常将该农业化学组合物用于前剂量装置、小背包喷雾器、喷雾罐、喷雾飞机或灌溉系统。通常将该农业化学组合物用水、缓冲剂和/或其他助剂配制至所需施用浓度,从而得到即用喷雾液或本发明农业化学组合物。每公顷农业利用区通常施用20-2000升,优选50-400升即用喷雾液。
[0215]
化合物i、其n-氧化物和盐可以转化成农业化学组合物常用的类型,例如溶液、乳液、悬浮液、粉剂、粉末、糊、颗粒、模压品、胶囊及其混合物。组合物类型(也参见“catalogue of pesticide formulation types and international coding system”,technical monograph,第2期,2008年5月第6版,croplife international)的实例是悬浮液(sc、od、fs),可乳化浓缩物(ec),乳液(ew、eo、es、me),胶囊(例如cs、zc),糊,锭剂,可湿性粉末或粉剂(wp、sp、ws、dp、ds),模压品(例如br、tb、dt),颗粒(例如wg、sg、gr、fg、gg、mg),杀虫制品(例如ln)以及处理植物繁殖材料如种子的凝胶配制剂(例如gf)。组合物如mollet和
grubemann,formulation technology,wiley vch,weinheim,2001;或knowles,new developments in crop protection product formulation,agrow reports ds243,t&f informa,london,2005所述以已知方式制备。
[0216]
合适的助剂是溶剂,液体载体,固体载体或填料,表面活性剂,分散剂,乳化剂,润湿剂,辅助剂,加溶剂,渗透促进剂,保护性胶体,粘附剂,增稠剂,保湿剂,驱除剂,引诱剂,进食刺激剂,相容剂,杀菌剂,防冻剂,消泡剂,着色剂,增粘剂和粘合剂。
[0217]
农业化学组合物通常包含0.01-95重量%,优选0.1-90重量%,更优选1-70重量%,尤其是10-60重量%的活性物质(例如至少一种化合物i)。农业化学组合物通常包含5-99.9重量%,优选10-99.9重量%,更优选30-99重量%,特别是40-90重量%的至少一种助剂。所用活性物质(例如化合物i)以90-100%,优选95-100%(根据nmr谱)的纯度使用。
[0218]
为了处理植物繁殖材料,尤其是种子,通常使用种子处理用溶液(ls),悬浮乳液(se),可流动浓缩物(fs),干处理用粉末(ds),淤浆处理用水分散性粉末(ws),水溶性粉末(ss),乳液(es),可乳化浓缩物(ec)和凝胶(gf)。所述组合物在稀释2-10倍后在即用制剂中给出0.01-60重量%,优选0.1-40重量%的活性物质浓度。施用可以在播种之前或期间进行。化合物i及其组合物分别在植物繁殖材料,尤其是种子上的施用方法包括拌种、包衣、造粒、撒粉、浸泡以及犁沟内施用方法。优选通过不诱发萌发的方法,例如通过拌种、造粒、包衣和撒粉将化合物i或其组合物分别施用于植物繁殖材料上。
[0219]
可以向化合物i或其组合物中作为预混物加入或者在紧临使用前加入(桶混合)各种类型的油、润湿剂、辅助剂、肥料或微营养素和其他农药(例如杀真菌剂、生长调节剂、除草剂、杀虫剂、安全剂)。这些试剂可以以1:100-100:1,优选1:10-10:1的重量比与本发明组合物混合。
[0220]
将化合物i或包含它们的组合物以杀真菌剂的使用形式与其他杀真菌剂混合在许多情况下拓宽杀真菌活性谱或防止杀真菌剂抗药性的产生。此外,在许多情况下得到协同增效作用(协同增效混合物)。
[0221]
化合物i可以与其一起使用的下列农药ii用来说明可能的组合,但不限制它们:
[0222]
a)呼吸抑制剂
[0223]-qo位点的配合物iii抑制剂:腈嘧菌酯(a.1.1)、甲香菌酯(coumethoxystrobin)(a.1.2)、丁香菌酯(coumoxystrobin)(a.1.3)、醚菌胺(a.1.4)、烯肟菌酯(enestroburin)(a.1.5)、烯肟菌胺(fenaminstrobin)(a.1.6)、fenoxystrobin/氟菌螨酯(flufenoxystrobin)(a.1.7)、氟嘧菌酯(fluoxastrobin)(a.1.8)、亚胺菌(kresoxim-methyl)(a.1.9)、mandestrobin(a.1.10)、叉氨苯酰胺(a.1.11)、肟醚菌胺(a.1.12)、啶氧菌酯(a.1.13)、唑菌胺酯(a.1.14)、唑胺菌酯(pyrametostrobin)(a.1.15)、唑菌酯(pyraoxystrobin)(a.1.16)、肟菌酯(a.1.17)、2-(2-(3-(2,6-二氯苯基)-1-甲基亚烯丙基氨基氧甲基)苯基)-2-甲氧亚氨基-n-甲基乙酰胺(a.1.18)、pyribencarb(a.1.19)、氯啶菌酯(triclopyricarb)/chlorodincarb(a.1.20)、唑酮菌(famoxadone)(a.1.21)、咪唑菌酮(fenamidone)(a.1.21)、n-[2-[(1,4-二甲基-5-苯基吡唑-3-基)氧基甲基]苯基]-n-甲氧基氨基甲酸甲酯(a.1.22)、metyltetraprole(a.1.25)、(z,2e)-5-[1-(2,4-二氯苯基)吡唑-3-基]氧基-2-甲氧亚氨基-n,3-二甲基戊-3-烯酰胺(a.1.34)、(z,2e)-5-[1-(4-氯苯基)吡唑-3-基]氧基-2-甲氧亚氨基-n,3-二甲基戊-3-烯酰胺(a.1.35)、嘧螨胺
(pyriminostrobin)(a.1.36)、吡氟菌酯(bifujunzhi)(a.1.37)、2-(邻-((2,5-二甲基苯基氧亚甲基)苯基)-3-甲氧基丙烯酸甲酯(a.1.38);
[0224]-qi位点的配合物iii抑制剂:氰霜唑(cyazofamid)(a.2.1)、吲唑磺菌胺(amisulbrom)(a.2.2)、2-甲基丙酸[(6s,7r,8r)-8-苄基-3-[(3-羟基-4-甲氧基吡啶-2-羰基)氨基]-6-甲基-4,9-二氧代-1,5-二氧壬环-7-基]酯(a.2.3)、fenpicoxamid(a.2.4)、吡啶菌酰胺(florylpicoxamid)(a.2.5)、metarylpicoxamid(a.2.6);
[0225]-配合物ii抑制剂:麦锈灵(benodanil)(a.3.1)、苯并烯氟菌唑(benzovindiflupyr)(a.3.2)、联苯吡菌胺(bixafen)(a.3.3)、啶酰菌胺(boscalid)(a.3.4)、萎锈灵(carboxin)(a.3.5)、呋菌胺(fenfuram)(a.3.6)、氟吡菌酰胺(fluopyram)(a.3.7)、氟酰胺(flutolanil)(a.3.8)、氟唑菌酰胺(fluxapyroxad)(a.3.9)、呋吡唑灵(furametpyr)(a.3.10)、isofetamid(a.3.11)、吡唑萘菌胺(isopyrazam)(a.3.12)、丙氧灭绣胺(mepronil)(a.3.13)、氧化萎锈灵(oxycarboxin)(a.3.14)、氟唑菌苯胺(penflufen)(a.3.15)、吡噻菌胺(penthiopyrad)(a.3.16)、氟唑菌酰羟胺(pydiflumetofen)(a.3.17)、联苯吡嗪菌胺(pyraziflumid)(a.3.18)、氟唑环菌胺(sedaxane)(a.3.19)、叶枯酞(tecloftalam)(a.3.20)、溴氟唑菌(thifluzamide)(a.3.21)、inpyrfluxam(a.3.22)、pyrapropoyne(a.3.23)、氟茚唑菌胺(fluindapyr)(a.3.28)、n-[2-[2-氯-4-三氟甲基苯氧基]苯基]-3-二氟甲基-5-氟-1-甲基吡唑-4-甲酰胺(a.3.29)、(e)-2-[2-[(5-氰基-2-甲基苯氧基)甲基]苯基]-3-甲氧基丙-2-烯酸甲酯(a.3.30)、isoflucypram(a.3.31)、2-二氟甲基-n-(1,1,3-三甲基-茚满-4-基)吡啶-3-甲酰胺(a.3.32)、2-二氟甲基-n-[(3r)-1,1,3-三甲基-茚满-4-基]吡啶-3-甲酰胺(a.3.33)、2-二氟甲基-n-(3-乙基-1,1-二甲基-茚满-4-基)吡啶-3-甲酰胺(a.3.34)、2-二氟甲基-n-[(3r)-3-乙基-1,1-二甲基-茚满-4-基]吡啶-3-甲酰胺(a.3.35)、2-二氟甲基-n-(1,1-二甲基-3-丙基-茚满-4-基)吡啶-3-甲酰胺(a.3.36)、2-二氟甲基-n-[(3r)-1,1-二甲基-3-丙基-茚满-4-基]吡啶-3-甲酰胺(a.3.37)、2-二氟甲基-n-(3-异丁基-1,1-二甲基-茚满-4-基)吡啶-3-甲酰胺(a.3.38)、2-二氟甲基-n-[(3r)-3-异丁基-1,1-二甲基-茚满-4-基]吡啶-3-甲酰胺(a.3.39)、cyclobutrifluram(a.3.24);
[0226]-其他呼吸抑制剂:二氟林(diflumetorim)(a.4.1);硝基苯基衍生物:乐杀螨(binapacryl)(a.4.2)、敌螨通(dinobuton)(a.4.3)、敌螨普(dinocap)(a.4.4)、氟啶胺(fluazinam)(a.4.5)、消螨多(meptyldinocap)(a.4.6)、嘧菌腙(ferimzone)(a.4.7);有机金属化合物:三苯锡基盐,如薯瘟锡(fentin-acetate)(a.4.8)、三苯锡氯(fentin chloride)(a.4.9)或毒菌锡(fentin hydroxide)(a.4.10);唑嘧菌胺(ametoctradin)(a.4.11);硅噻菌胺(silthiofam)(a.4.12);
[0227]
b)甾醇生物合成抑制剂(sbi杀真菌剂)
[0228]-c14脱甲基酶抑制剂:三唑类:戊环唑(azaconazole)(b.1.1)、双苯三唑醇(bitertanol)(b.1.2)、糠菌唑(bromuconazole)(b.1.3)、环唑醇(cyproconazole)(b.1.4)、醚唑(difenoconazole)(b.1.5)、烯唑醇(diniconazole)(b.1.6)、烯唑醇m(diniconazole-m)(b.1.7)、氧唑菌(epoxiconazole)(b.1.8)、腈苯唑(fenbuconazole)(b.1.9)、喹唑菌酮(fluquinconazole)(b.1.10)、氟硅唑(flusilazole)(b.1.11)、粉唑醇(flutriafol)(b.1.12)、己唑醇(hexaconazole)(b.1.13)、酰胺唑(imibenconazole)
(b.1.14)、环戊唑醇(ipconazole)(b.1.15)、环戊唑菌(metconazole)(b.1.17)、腈菌唑(myclobutanil)(b.1.18)、oxpoconazole(b.1.19)、多效唑(paclobutrazole)(b.1.20)、戊菌唑(penconazole)(b.1.21)、丙环唑(propiconazole)(b.1.22)、丙硫菌唑(prothioconazole)(b.1.23)、硅氟唑(simeconazole)(b.1.24)、戊唑醇(tebuconazole)(b.1.25)、氟醚唑(tetraconazole)(b.1.26)、三唑酮(triadimefon)(b.1.27)、唑菌醇(triadimenol)(b.1.28)、戊叉唑菌(triticonazole)(b.1.29)、烯效唑(uniconazole)(b.1.30)、2-(2,4-二氟苯基)-1,1-二氟-3-(四唑-1-基)-1-[5-[4-(2,2,2-三氟乙氧基)苯基]-2-吡啶基]丙-2-醇(b.1.31)、2-(2,4-二氟苯基)-1,1-二氟-3-(四唑-1-基)-1-[5-[4-(三氟甲氧基)苯基]-2-吡啶基]丙-2-醇(b.1.32)、fluooxytioconazole(b.1.33)、ipfentrifluconazole(b.1.37)、氯氟醚菌唑(mefentrifluconazole)(b.1.38)、(2r)-2-[4-(4-氯苯氧基)-2-三氟甲基苯基]-1-(1,2,4-三唑-1-基)丙-2-醇、(2s)-2-[4-(4-氯苯氧基)-2-三氟甲基苯基]-1-(1,2,4-三唑-1-基)丙-2-醇、2-氯甲基-2-甲基-5-(对甲苯基甲基)-1-(1,2,4-三唑-1-基甲基)环戊醇(b.1.43);咪唑类:抑霉唑(imazalil)(b.1.44)、稻瘟酯(pefurazoate)(b.1.45)、丙氯灵(prochloraz)(b.1.46)、氟菌唑(triflumizol)(b.1.47);嘧啶类、吡啶类、哌嗪类:异嘧菌醇(fenarimol)(b.1.49)、啶斑肟(pyrifenox)(b.1.50)、嗪氨灵(triforine)(b.1.51)、[3-(4-氯-2-氟苯基)-5-(2,4-二氟苯基)异唑-4-基]-(3-吡啶基)甲醇(b.1.52)、4-[[6-[2-(2,4-二氟苯基)-1,1-二氟-2-羟基-3-(1,2,4-三唑-1-基)丙基]-3-吡啶基]氧基]苄腈(b.1.53)、2-[6-(4-溴苯氧基)-2-三氟甲基-3-吡啶基]-1-(1,2,4-三唑-1-基)丙-2-醇(b.1.54)、2-[6-(4-氯苯氧基)-2-三氟甲基-3-吡啶基]-1-(1,2,4-三唑-1-基)丙-2-醇(b.1.55);
[0229]-δ14-还原酶抑制剂:4-十二烷基-2,6-二甲基吗啉(aldimorph)(b.2.1)、吗菌灵(dodemorph)(b.2.2)、吗菌灵乙酸酯(dodemorph-acetate)(b.2.3)、丁苯吗啉(fenpropimorph)(b.2.4)、克啉菌(tridemorph)(b.2.5)、苯锈啶(fenpropidin)(b.2.6)、粉病灵(piperalin)(b.2.7)、螺茂胺(spiroxamine)(b.2.8);
[0230]-3-酮基还原酶抑制剂:环酰菌胺(fenhexamid)(b.3.1);
[0231]-其他甾醇生物合成抑制剂:氯苯肟唑(chlorphenomizole)(b.4.1);
[0232]
c)核酸合成抑制剂
[0233]-苯基酰胺类或酰基氨基酸类杀真菌剂:苯霜灵(benalaxyl)(c.1.1)、精苯霜灵(benalaxyl-m)(c.1.2)、kiralaxyl(c.1.3)、甲霜灵(metalaxyl)(c.1.4)、精甲霜灵(metalaxyl-m)(c.1.5)、甲呋酰胺(ofurace)(c.1.6)、霜灵(oxadixyl)(c.1.7);
[0234]-其他核酸合成抑制剂:土菌消(hymexazole)(c.2.1)、异噻菌酮(octhilinone)(c.2.2)、恶喹酸(oxolinic acid)(c.2.3)、磺嘧菌灵(bupirimate)(c.2.4)、5-氟胞嘧啶(c.2.5)、5-氟-2-(对甲苯基甲氧基)嘧啶-4-胺(c.2.6)、5-氟-2-(4-氟苯基甲氧基)嘧啶-4-胺(c.2.7)、5-氟-2-(4-氯苯基甲氧基)嘧啶-4-胺(c.2.8);
[0235]
d)细胞分裂和细胞骨架抑制剂
[0236]-微管蛋白抑制剂:苯菌灵(benomyl)(d1.1)、多菌灵(carbendazim)(d1.2)、麦穗宁(fuberidazole)(d1.3)、涕必灵(thiabendazole)(d1.4)、甲基托布津(thiophanate-methyl)(d1.5)、pyridachlometyl(d.1.6)、n-乙基-2-[(3-乙炔基-8-甲基-6-喹啉基)氧
4-哌啶基]-n-四氢萘-1-基吡啶-2-甲酰胺(g.5.5)、4-[1-[2-[3-二氟甲基-5-三氟甲基吡唑-1-基]乙酰基]-4-哌啶基]-n-四氢萘-1-基吡啶-2-甲酰胺(g.5.6)、4-[1-[2-[5-环丙基-3-二氟甲基吡唑-1-基]乙酰基]-4-哌啶基]-n-四氢萘-1-基吡啶-2-甲酰胺(g.5.7)、4-[1-[2-[5-甲基-3-三氟甲基吡唑-1-基]乙酰基]-4-哌啶基]-n-四氢萘-1-基吡啶-2-甲酰胺(g.5.8)、4-[1-[2-[5-二氟甲基-3-三氟甲基吡唑-1-基]乙酰基]-4-哌啶基]-n-四氢萘-1-基吡啶-2-甲酰胺(g.5.9)、4-[1-[2-[3,5-二(三氟甲基)吡唑-1-基]乙酰基]-4-哌啶基]-n-四氢萘-1-基吡啶-2-甲酰胺(g.5.10)、(4-[1-[2-[5-环丙基-3-三氟甲基吡唑-1-基]乙酰基]-4-哌啶基]-n-四氢萘-1-基吡啶-2-甲酰胺(g.5.11);
[0250]
h)具有多位点作用的抑制剂
[0251]-无机活性物质:波尔多液(bordeaux混合物)(h.1.1)、铜(h.1.2)、醋酸铜(h.1.3)、氢氧化铜(h.1.4)、王铜(copper oxychloride)(h.1.5)、碱式硫酸铜(h.1.6)、硫(h.1.7);
[0252]-硫代-和二硫代氨基甲酸酯类:福美铁(ferbam)(h.2.1)、代森锰锌(mancozeb)(h.2.2)、代森锰(maneb)(h.2.3)、威百亩(metam)(h.2.4)、代森联(metiram)(h.2.5)、甲基代森锌(propineb)(h.2.6)、福美双(thiram)(h.2.7)、代森锌(zineb)(h.2.8)、福美锌(ziram)(h.2.9);
[0253]-有机氯化合物:敌菌灵(anilazine)(h.3.1)、百菌清(chlorothalonil)(h.3.2)、敌菌丹(captafol)(h.3.3)、克菌丹(captan)(h.3.4)、灭菌丹(folpet)(h.3.5)、抑菌灵(dichlofluanid)(h.3.6)、双氯酚(dichlorophen)(h.3.7)、六氯苯(h.3.8)、五氯酚(pentachlorphenole)(h.3.9)及其盐、四氯苯酞(phthalide)(h.3.10)、对甲抑菌灵(tolylfluanid)(h.3.11);
[0254]-胍类及其他:胍(h.4.1)、多果定(h.4.2)、多果定游离碱(h.4.3)、双胍盐(guazatine)(h.4.4)、双胍辛胺(guazatine-acetate)(h.4.5)、双胍辛醋酸盐(iminoctadine)(h.4.6)、双胍辛胺三乙酸盐(iminoctadine-triacetate)(h.4.7)、双八胍盐(iminoctadine-tris(albesilate))(h.4.8)、二噻农(dithianon)(h.4.9)、2,6-二甲基-1h,5h-[1,4]二噻二烯并[2,3-c:5,6-c
′
]联吡咯-1,3,5,7(2h,6h)-四酮(h.4.10);
[0255]
i)细胞壁合成抑制剂
[0256]-葡聚糖合成抑制剂:井冈霉素(validamycin)(i.1.1)、多氧霉素(polyoxinb)(i.1.2);
[0257]-黑素合成抑制剂:咯喹酮(pyroquilon)(i.2.1)、三环唑(tricyclazole)(i.2.2)、氯环丙酰胺(carpropamid)(i.2.3)、双氯氰菌胺(dicyclomet)(i.2.4)、氰菌胺(fenoxanil)(i.2.5);
[0258]
j)植物防御诱发剂
[0259]-噻二唑素(acibenzolar-s-methyl)(j.1.1)、噻菌灵(probenazole)(j.1.2)、异噻菌胺(isotianil)(j.1.3)、噻酰菌胺(tiadinil)(j.1.4)、调环酸钙(prohexadione-calcium)(j.1.5);膦酸酯类:藻菌磷(fosetyl)(j.1.6)、乙磷铝(fosetyl-aluminum)(j.1.7)、亚磷酸及其盐(j.1.8)、膦酸钙(j.1.11)、膦酸钾(j.1.12)、碳酸氢钾或钠(j.1.9)、4-环丙基-n-(2,4-二甲氧基苯基)噻二唑-5-甲酰胺(j.1.10);
[0260]
k)未知作用模式
[0261]-拌棉醇(bronopol)(k.1.1)、灭螨蜢(chinomethionat)(k.1.2)、环氟菌胺(cyflufenamid)(k.1.3)、清菌脲(cymoxanil)(k.1.4)、棉隆(dazomet)(k.1.5)、咪菌威(debacarb)(k.1.6)、双氯氰菌胺(diclocymet)(k.1.7)、哒菌清(diclomezine)(k.1.8)、野燕枯(difenzoquat)(k.1.9)、野燕枯甲基硫酸酯(difenzoquat-methylsulfate)(k.1.10)、二苯胺(k.1.11)、杀螟松(fenitropan)(k.1.12)、胺苯吡菌酮(fenpyrazamine)(k.1.13)、氟联苯菌(flumetover)(k.1.14)、flumetylsulforim(k.1.60)、磺菌胺(flusulfamide)(k.1.15)、flutianil(k.1.16)、超敏蛋白(harpin)(k.1.17)、磺菌威(methasulfocarb)(k.1.18)、氯定(nitrapyrin)(k.1.19)、异丙消(nitrothal-isopropyl)(k.1.20)、tolprocarb(k.1.21)、喹啉铜(oxin-copper)(k.1.22)、丙氧喹啉(proquinazid)(k.1.23)、辛菌胺(seboctylamine)(k.1.61)、tebufloquin(k.1.24)、叶枯酞(k.1.25)、唑菌嗪(triazoxide)(k.1.26)、n
′‑
(4-(4-氯-3-三氟甲基苯氧基)-2,5-二甲基苯基)-n-乙基-n-甲基甲脒(k.1.27)、n
′‑
(4-(4-氟-3-三氟甲基苯氧基)-2,5-二甲基苯基)-n-乙基-n-甲基甲脒(k.1.28)、n
′‑
[4-[[3-[(4-氯苯基)甲基]-1,2,4-噻二唑-5-基]氧基]-2,5-二甲基苯基]-n-乙基-n-甲基甲脒(k.1.29)、n
′‑
(5-溴-6-(茚满-2-基)氧基-2-甲基-3-吡啶基)-n-乙基-n-甲基甲脒(k.1.30)、n
′‑
[5-溴-6-[1-(3,5-二氟苯基)乙氧基]-2-甲基-3-吡啶基]-n-乙基-n-甲基甲脒(k.1.31)、n
′‑
[5-溴-6-(4-异丙基环己氧基)-2-甲基-3-吡啶基]-n-乙基-n-甲基甲脒(k.1.32)、n
′‑
[5-溴-2-甲基-6-(1-苯基乙氧基)-3-吡啶基]-n-乙基-n-甲基甲脒(k.1.33)、n
′‑
(2-甲基-5-三氟甲基-4-(3-三甲基硅烷基丙氧基)苯基)-n-乙基-n-甲基甲脒(k.1.34)、n
′‑
(5-二氟甲基-2-甲基-4-(3-三甲基硅烷基丙氧基)苯基)-n-乙基-n-甲基甲脒(k.1.35)、2-(4-氯苯基)-n-[4-(3,4-二甲氧基苯基)异唑-5-基]-2-丙-2-炔氧基乙酰胺(k.1.36)、3-[5-(4-氯苯基)-2,3-二甲基异唑烷-3-基]吡啶(pyrisoxazole)(k.1.37)、3-[5-(4-甲基苯基)-2,3-二甲基异唑烷-3-基]吡啶(k.1.38)、5-氯-1-(4,6-二甲氧基嘧啶-2-基)-2-甲基-1h-苯并咪唑(k.1.39)、(z)-3-氨基-2-氰基-3-苯基丙-2-烯酸乙酯(k.1.40)、四唑吡氨酯(picarbutrazox)(k.1.41)、n-[6-[[(z)-[(1-甲基四唑-5-基)苯基亚甲基]氨基]氧基甲基]-2-吡啶基]氨基甲酸戊酯(k.1.42)、n-[6-[[(z)-[(1-甲基四唑-5-基)苯基亚甲基]氨基]氧基甲基]-2-吡啶基]氨基甲酸丁-3-炔基酯(k.1.43)、ipflufenoquin(k.1.44)、quinofumelin(k.1.47)、噻霉酮(benzothiazolinone)(k.1.48)、溴菌腈(bromothalonil)(k.1.49)、2-(6-苄基-2-吡啶基)喹唑啉(k.1.50)、2-[6-(3-氟-4-甲氧基苯基)-5-甲基-2-吡啶基]喹唑啉(k.1.51)、dichlobentiazox(k.1.52)、n
′‑
(2,5-二甲基-4-苯氧基苯基)-n-乙基-n-甲基甲脒(k.1.53)、aminopyrifen(k.1.54)、氟醚菌酰胺(fluopimomide)(k.1.55)、n
′‑
[5-溴-2-甲基-6-(1-甲基-2-丙氧基乙氧基)-3-吡啶基]-n-乙基-n-甲基甲脒(k.1.56)、n
′‑
[4-(4,5-二氯噻唑-2-基)氧基-2,5-二甲基苯基]-n-乙基-n-甲基甲脒(k.1.57)、flufenoxadiazam(k.1.58)、n-甲基-4-[5-三氟甲基-1,2,4-二唑-3-基]苯硫代甲酰胺(k.1.59)、n-甲氧基-n-[[4-[5-三氟甲基-1,2,4-二唑-3-基]苯基]甲基]环丙烷甲酰胺(k.1.60;wo2018/177894,wo2020/212513)、n-((4-[5-(三氟甲基)-1,2,4-二唑-3-基]苯基)甲基)丙酰胺(k.1.62)、3,3,3-三氟-n-[[3-氟-4-[5-(三氟甲基)-1,2,4-二唑-3-基]苯基]甲基]丙酰胺(k.1.63)、3,3,3-三氟-n-[[2-氟-4-[5-(三氟甲基)-1,2,4-二唑-3-基]苯基]甲
(邻甲苯基甲基)苯基]-n-乙基-n-甲基甲脒(k.1.98)。
[0264]
称为组分2的活性物质、其制备及其例如对有害真菌的活性是已知的(参见:http://www.alanwood.net/pesticides);这些物质可市购。由iupac命名法描述的化合物、其制备及其农药活性也是已知的。
[0265]
在二元混合物中,组分1)和组分2)的重量比通常取决于所用组分的性能,它通常在1:10,000-10,000:1范围内,常常是1:100-100:1,经常是1:50-50:1,优选1:20-20:1,更优选1:10-10:1,甚至更优选1:4-4:1,尤其是1:2-2:1。根据其他实施方案,组分1)和组分2)的重量比通常在1000:1-1:1范围内,常常是100:1-1:1,经常是50:1-1:1,优选20:1-1:1,更优选10:1-1:1,甚至更优选4:1-1:1,尤其是2:1-1:1。根据其他实施方案,组分1)和组分2)的重量比通常在20,000:1-1:10范围内,常常是10,000:1-1:1,经常是5,000:1-5:1,优选5,000:1-10:1,更优选2,000:1-30:1,甚至更优选2,000:1-100:1,尤其是1,000:1-100:1。根据其他实施方案,组分1)和组分2)的重量比通常在1:1-1:1000范围内,常常是1:1-1:100,经常是1:1-1:50,优选1:1-1:20,更优选1:1-1:10,甚至更优选1:1-1:4,尤其是1:1-1:2。根据其他实施方案,组分1)和组分2)的重量比通常在10:1-1:20,000范围内,常常是1:1-1:10,000,经常是1:5-1:5,000,优选1:10-1:5,000,更优选1:30-1:2,000,甚至更优选1:100-1:2,000,尤其是1:100-1:1,000。
[0266]
在三元混合物,即包含组分1)和组分2)以及化合物iii(组分3)的组合物中,组分1)和组分2)的重量比取决于所用活性物质的性能,它通常在1:100-100:1范围内,经常是1:50-50:1,优选1:20-20:1,更优选1:10-10:1,尤其是1:4-4:1,并且组分1)和组分3)的重量比通常在1:100-100:1范围内,经常是1:50-50:1,优选1:20-20:1,更优选1:10-10:1,尤其是1:4-4:1。需要的话,将任何其他活性组分以20:1-1:20的比例加入组分1)中。这些比例还适合通过种子处理施用的混合物。
[0267]
优选包含至少一种选自a)组中qo位点的配合物iii抑制剂,更优选选自化合物(a.1.1)、(a.1.4)、(a.1.8)、(a.1.9)、(a.1.10)、(a.1.12)、(a.1.13)、(a.1.14)、(a.1.17)、(a.1.21)、(a.1.25)、(a.1.34)和(a.1.35);特别是选自(a.1.1)、(a.1.4)、(a.1.8)、(a.1.9)、(a.1.13)、(a.1.14)、(a.1.17)、(a.1.25)、(a.1.34)和(a.1.35)的活性物质作为组分2)的混合物。
[0268]
还优选包含至少一种选自a)组中qi位点的配合物iii抑制剂,更优选选自化合物(a.2.1)、(a.2.3)、(a.2.4)和(a.2.6);特别是选自(a.2.3)、(a.2.4)和(a.2.6)的活性物质作为组分2)的混合物。
[0269]
还优选包含至少一种选自a)组中配合物ii抑制剂,更优选选自化合物(a.3.2)、(a.3.3)、(a.3.4)、(a.3.7)、(a.3.9)、(a.3.11)、(a.3.12)、(a.3.15)、(a.3.16)、(a.3.17)、(a.3.18)、(a.3.19)、(a.3.20)、(a.3.21)、(a.3.22)、(a.3.23)、(a.3.24)、(a.3.28)、(a.3.31)、(a.3.32)、(a.3.33)、(a.3.34)、(a.3.35)、(a.3.36)、(a.3.37)、(a.3.38)和(a.3.39);特别是选自(a.3.2)、(a.3.3)、(a.3.4)、(a.3.7)、(a.3.9)、(a.3.12)、(a.3.15)、(a.3.17)、(a.3.19)、(a.3.22)、(a.3.23)、(a.3.24)、(a.3.31)、(a.3.32)、(a.3.33)、(a.3.34)、(a.3.35)、(a.3.36)、(a.3.37)、(a.3.38)和(a.3.39)的活性物质作为组分2)的混合物。
[0270]
还优选包含至少一种选自a)组中其他呼吸抑制剂,更优选选自化合物(a.4.5)和
(a.4.11);尤其是(a.4.11)的活性物质作为组分2)的混合物。
[0271]
还优选包含至少一种选自b)组中c14脱甲基酶抑制剂,更优选选自化合物(b.1.4)、(b.1.5)、(b.1.8)、(b.1.10)、(b.1.11)、(b.1.12)、(b.1.13)、(b.1.17)、(b.1.18)、(b.1.21)、(b.1.22)、(b.1.23)、(b.1.25)、(b.1.26)、(b.1.29)、(b.1.33)、(b.1.34)、(b.1.37)、(b.1.38)、(b.1.43)、(b.1.46)、(b.1.53)、(b.1.54)和(b.1.55);特别是选自(b.1.5)、(b.1.8)、(b.1.10)、(b.1.17)、(b.1.22)、(b.1.23)、(b.1.25)、(b.1.33)、(b.1.34)、(b.1.37)、(b.1.38)、(b.1.43)和(b.1.46)的活性物质作为组分2)的混合物。
[0272]
还优选包含至少一种选自b)组中δ14-还原酶抑制剂,更优选选自化合物(b.2.4)、(b.2.5)、(b.2.6)和(b.2.8);尤其是(b.2.4)的活性物质作为组分2)的混合物。
[0273]
还优选包含至少一种选自c)组中苯基酰胺类和酰基氨基酸类杀真菌剂,更优选选自化合物(c.1.1)、(c.1.2)、(c.1.4)和(c.1.5);特别是选自(c.1.1)和(c.1.4)的活性物质作为组分2)的混合物。
[0274]
还优选包含至少一种选自c)组中其他核酸合成抑制剂,更优选选自化合物(c.2.6)、(c.2.7)和(c.2.8)的活性物质作为组分2)的混合物。
[0275]
还优选包含至少一种选自d)组,更优选选自化合物(d.1.1)、(d.1.2)、(d.1.5)、(d.2.4)和(d.2.6);特别是选自(d.1.2)、(d.1.5)和(d.2.6)的活性物质作为组分2)的混合物。
[0276]
还优选包含至少一种选自e)组,更优选选自化合物(e.1.1)、(e.1.3)、(e.2.2)和(e.2.3);尤其是(e.1.3)的活性物质作为组分2)的混合物。
[0277]
还优选包含至少一种选自f)组,更优选选自化合物(f.1.2)、(f.1.4)和(f.1.5)的活性物质作为组分2)的混合物。
[0278]
还优选包含至少一种选自g)组,更优选选自化合物(g.3.1)、(g.3.3)、(g.3.6)、(g.5.1)、(g.5.3)、(g.5.4)、(g.5.5),g.5.6),g.5.7)、(g.5.8)、(g.5.9)、(g.5.10)和(g.5.11);特别是选自(g.3.1)、(g.5.1)和(g.5.3)的活性物质作为组分2)的混合物。
[0279]
还优选包含至少一种选自h)组,更优选选自化合物(h.2.2)、(h.2.3)、(h.2.5)、(h.2.7)、(h.2.8)、(h.3.2)、(h.3.4)、(h.3.5)、(h.4.9)和(h.4.10);特别是选自(h.2.2)、(h.2.5)、(h.3.2)、(h.4.9)和(h.4.10)的活性物质作为组分2)的混合物。
[0280]
还优选包含至少一种选自i)组,更优选选自化合物(i.2.2)和(i.2.5)的活性物质作为组分2)的混合物。
[0281]
还优选包含至少一种选自j)组,更优选选自化合物(j.1.2)、(j.1.5)、(j.1.8)、(j.1.11)和(j.1.12);尤其是(j.1.5)的活性物质作为组分2)的混合物。
[0282]
还优选包含至少一种选自k)组,更优选选自化合物(k.1.41)、(k.1.42)、(k.1.44)、(k.1.47)、(k.1.57)、(k.1.58)和(k.1.59);特别是选自(k.1.41)、(k.1.44)、(k.1.47)、(k.1.57)、(k.1.58)和(k.1.59)的活性物质作为组分2)的混合物。
[0283]
包含活性成分的混合物的组合物可以通过常规手段制备,例如通过对化合物i的组合物所给手段制备。
实施例:
[0284]
合成方法
[0285]
实施例4(根据下表s编号):(2e)-2-甲氧亚氨基-2-[3-甲基-2[[(e)-1-[4-(三氟甲基)-2-吡啶基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0286][0287]
步骤1:1-[4-(三氟甲基)-2-吡啶基]乙酮
[0288]
在25℃下向2-氯-4-(三氟甲基)吡啶(3.0g,16.52mmol)在丁烷-2,3-二醇(10ml)中的溶液中一次性加入4-乙烯氧基丁-1-醇(3.06ml,25mmol)。加入碳酸钠(3.5g,33mmol)并在25℃下使用n2气将反应混合物脱气20分钟。加入乙酸钯(0.186g,0.82mmol)和3-二苯基磷烷基丙基(二苯基)膦(0.68g,2mmol),并将反应混合物在120℃和氮气下搅拌3小时。tlc显示起始材料被完全消耗。将反应混合物冷却至25℃并向其中加入1n hcl(10ml)。将反应混合物在110℃下再次加热1小时。反应混合物用饱和nahco3溶液(50ml)淬灭并通过硅藻土床过滤。水相滤液用乙酸乙酯(etoac,2x20ml)萃取。合并的有机层经na2so4干燥,浓缩并通过硅胶柱纯化(etoac:庚烷=20:80),得到1-[4-(三氟甲基)-2吡啶基]乙酮(2.5g,80%),为棕色液体。1h nmr (500mhz,dmso-d6):δ9.03(s,1h),8.15-8.10(m,1h),8.09-8.08(m,1h),2.69(s,3h)。
[0289]
步骤2:1-[4-(三氟甲基)-2-吡啶基]乙酮肟
[0290]
在n2下向1-[4-(三氟甲基)-2-吡啶基]乙酮(10g,52.87mmol)在meoh(100ml)中的溶液中加入盐酸羟胺(9.25g,132mmol)和naoac(10.83g,132mmol)。将混合物在n2和70℃下搅拌2小时。tlc显示反应完成。将反应混合物浓缩,然后溶解在etoac(100ml)和h2o(100ml)中。水相用etoac(2x50ml)萃取。合并的有机层用盐水(100ml)洗涤,经na2so4干燥,浓缩并通过硅胶柱纯化(etoac:庚烷=20:80),得到1-[4-(三氟甲基)-2-吡啶基]-乙酮肟(4.3g,39.8%),为白色固体。1h nmr(500mhz,dmso-d6)δ=11.8(s,1h),8.88(d,j=5.0hz,1h),8.06(s,1h),7.76(d,j=5.0hz,1h),2.25(s,3h)。
[0291]
步骤3:(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[4-(三氟甲基)-2-吡啶基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0292]
向1-[4-(三氟甲基)-2-吡啶基]乙酮肟(4.3g,21.06mmol)在acn(50ml)中的溶液中加入cs2co3(17.11g,52.65mmol)。将混合物在25℃下搅拌10分钟。加入(2e)-2-[2-(溴甲基)-3-甲基-苯基]-2-甲氧亚氨基-乙酸甲酯(6.95g,23.16mmol)并将反应混合物在25℃下搅拌12小时。tlc显示反应完成。反应混合物用h2o(100ml)淬灭,用etoac(2x100ml)萃取。将有机相用盐水(100ml)洗涤,经na2so4干燥,浓缩并通过硅胶柱(庚烷:etoac=~90:10)纯化,得到标题化合物(5.67g,63.6%),为灰白色固体。1h nmr(500mhz,dmso-d6)δ=8.89(d,j=5.0hz,1h),8.00(s,1h),7.81-7.79(m,1h),7.34-7.30(m,2h),7.03-7.02(m,1h),5.12(br s,2h),3.91(s,3h),3.68(s,3h),2.45(s,3h),2.20(s,3h)。
[0293]
实施例5:(2e)-2-甲氧亚氨基-n-甲基-2-[3-甲基-2-[[(e)-1-[4-(三氟甲基)-2-吡啶基]-亚乙基氨基]氧基甲基]苯基]乙酰胺
[0294][0295]
向(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[4-(三氟甲基)-2-吡啶基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯(12g,28.34mmol)在thf(120ml)中的溶液中加入menh2(15ml,40%水溶液)。将混合物在25℃下搅拌2小时。tlc(etoac:庚烷=20:80)显示反应完成。蒸发溶剂。粗产物用h2o(150ml)稀释,用etoac(3x100ml)萃取。有机相用盐水(100ml)洗涤,经na2so4干燥并浓缩。用正戊烷(2x50ml)洗涤粗物质,得到标题化合物(11.0g,91.4%),为灰白色固体。1h nmr(500mhz,dmso-d6):δ8.88(d,j=5.0hz,1h),8.28-8.23(m,1h),8.05(s,1h),7.79-7.78(m,1h),7.31-7.28(m,2h),6.97-6.95(m,1h),5.12(br s,2h),3.86(s,3h),2.67(s,3h),2.45(s,3h),2.20(s,3h)。
[0296]
实施例11:(2e)-2-[2-[[(e)-1-[5-(4-氟苯基)异噻唑-3-基]亚乙基氨基]-氧基-甲基]-3-甲基-苯基]-2-甲氧亚氨基乙酸甲酯
[0297][0298]
步骤1:3-(4-氟苯基)-3-氧代丙酸甲酯
[0299]
在25℃下向1-(4-氟苯基)乙烯酮(22g,159.26mmol)和草酸二甲酯(20.68g,175mmol)在甲苯(250ml)中的溶液中加入叔丁醇钾(26.75g,238.89mmol)。将混合物在n2和25℃下搅拌2小时。tlc(庚烷:etoac=10:1)显示反应完成。将反应混合物用1n hcl(70ml)淬灭并用etoac(2x100ml)萃取。有机相用盐水(50ml)洗涤,经na2so4干燥并浓缩。粗化合物用庚烷(200ml)洗涤,得到纯的3-(4-氟苯基)-3-氧代-丙酸甲酯(31g,86.82%)。1hnmr:(300mhz,dmso-d6):δ8.18
–
8.15(m,2h),8.14(bs,1h),7.43
–
7.35(m,2h),7.11(s,1h),3.85(3h,s)。
[0300]
步骤2:3-(4-氟苯基)-3-氧代-丙脒酸甲酯
[0301]
在25℃下向3-(4-氟苯基)-3-氧代-丙酸甲酯(31g,138.27mmol)在甲苯(300ml)中的溶液中加入乙酸铵(31.94g,414.83mmol)和乙酸(1.65g,0.2mmol))。将混合物在n2和110℃下搅拌2小时。tlc(庚烷:etoac=5:1)显示反应完成。反应混合物用饱和碳酸氢钠水溶液(30ml)淬灭并用etoac(2x100ml)萃取,有机相用盐水(50ml)洗涤,经na2so4干燥并浓缩,得到纯3-(4-氟苯基)-3-氧代-丙脒酸甲酯(30g,97.2%)。1h nmr:(300mhz,dmso-d6):δ9.45(br s,1h),8.01
–
7.94(m,2h),7.89(br s,1h),7.33
–
7.27(m,2h),6.43(s,1h),3.89(3h,s)。
[0302]
步骤3:5-(4-氟苯基)异噻唑-3-甲酸甲酯
[0303]
在25℃下向3-(4-氟苯基)-3-氧代-丙脒酸甲酯(30g,134.4mmol)在thf(300ml)中的溶液中加入p2s5(20.887g,94mmol)。将混合物在n2和25℃下搅拌2小时,然后减压浓缩。将粗化合物溶解在etoac(200ml)中,然后在n2和0℃下滴加30% h2o2(7.6ml,67.02mmol)并搅拌2小时。tlc(石油醚(pe):etoac=5:1)显示反应完成。用水(50ml)淬灭反应并通过硅藻土过滤。残余物用etoac洗涤。浓缩滤液。粗化合物5-(4-氟苯基)异噻唑-3-甲酸甲酯(20g)无
[2-(溴甲基)-3-甲基-苯基]-2-甲氧基-亚氨基-乙酸甲酯(769mg,2.56mmol)并在65℃下搅拌2小时。tlc(庚烷:etoac=5:1)显示反应完成。混合物用h2o(30ml)淬灭并用etoac(2x50ml)萃取。有机相用盐水(30ml)洗涤,经na2so4干燥,浓缩并通过快速柱层析纯化以得到标题化合物(450mg,43%)。1h nmr(500mhz,dmso-d6):δ7.86-7.84(m,3h),7.38
–
7.29(m,4h),7.04
–
7.03(m,1h),5.07(br s,2h),3.92(s,3h),3.69(s,3h),2.50(s,3h),2.18(3h,s)。
[0316]
实施例12:(2e)-2-[2-[[(e)-1-[5-(4-氟苯基)异噻唑-3-基]亚乙基氨基]氧基甲基]-3-甲基-苯基]-2-甲氧亚氨基-n-甲基乙酰胺
[0317][0318]
向(2e)-2-[2-[[(e)-1-[5-(4-氟苯基)异噻唑-3-基]亚乙基氨基]氧基甲基]-3-甲基-苯基]-2-甲氧亚氨基-乙酸甲酯(250mg,0.549mmol)在thf(4ml)中的搅拌溶液中加入甲胺(85mg,3mmol),并将混合物在15℃下搅拌16小时。tlc(庚烷:etoac=5:1)显示反应完成。混合物用h2o(10ml)淬灭并用etoac(3x15ml)萃取。有机相用盐水(50ml)洗涤,经na2so4干燥并浓缩,得到呈固体的标题化合物(220mg,85.42%)。1h nmr(500mhz,dmso-d6):δ8.30(d,j=5hz,1h),7.94
–
7.89(m,3h),7.37
–
7.26(m,4h),6.96(d,j=6.5hz,1h),5.01(br s,2h),3.87(s,3h),2.66(d,j=4.5hz,3h),2.44(s,3h),2.19(s,3h)。
[0319]
实施例19:(2e)-2-甲氧亚氨基-2-[2-[[(e)-1-[5-[3-(三氟甲基)苯基]异唑-3基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0320][0321]
步骤1.2,4-二氧代-4-[3-(三氟甲基)苯基]丁酸甲酯
[0322]
向1-[3-(三氟甲基)苯基]乙酮(10g,0.05mol)在甲苯(100ml)中的溶液中加入草酸二甲酯(7.532gm,0.064mol)。将反应混合物在室温和n2下搅拌10分钟,然后分批加入叔丁醇钾(11.9g,0.106mol)。然后,将反应混合物在室温下再搅拌2小时。tlc(庚烷:etoac=5:1)显示反应完成。混合物用1n hcl(30ml)和h2o(70ml)稀释。水相用etoac(2x100ml)萃取。合并的etoac层用盐水(100ml)洗涤,经na2so4干燥并浓缩。将粗产物在30ml庚烷中搅拌得到固体,将其过滤并用20ml庚烷洗涤,真空干燥,得到2,4-二氧代-4-[3-(三氟甲基)苯基]丁酸甲酯(6.0g,96.1%),为白色固体。1h nmr(500mhz,dmso):δ8.264-8.392(m,2h),8.194(t 1h),7.802-7.841(t,1h),7.186(d,1h),3.910(s,3h)。
[0323]
步骤2:5-[3-(三氟甲基)苯基]异唑-3-甲酸甲酯
[0324]
在室温和n2下向2,4-二氧代-4-[3-(三氟甲基)苯基]丁酸甲酯(5.0g,0.018mol)在meoh(60ml)中的溶液中加入盐酸羟胺(1.9g,0.027mol)。将反应混合物在50℃下搅拌2小时。tlc(庚烷:etoac=9:1)显示反应完成。真空蒸发meoh以获得物质,将其用h2o(30ml)稀释,用etoac(30mlx2次)萃取。将有机相用盐水(30ml)洗涤,经na2so4干燥,浓缩并将粗化合
物在二乙醚(10ml)中搅拌并将获得的固体在真空下过滤并在真空下干燥以提供粗5-[3-(三氟甲基)苯基]异唑-3-甲酸甲酯(4.2g,85%),为白色固体。
[0325]
步骤3:5-[3-(三氟甲基)苯基]异唑-3-甲酸
[0326]
在0℃下向5-[3-(三氟甲基)苯基]异唑-3-甲酸甲酯(4.2g,0.015mol)在thf:meoh(40ml:40ml)中的搅拌溶液中加入溶解在h2o(40ml)中lioh.h2o(3.252g,0.077mol)。将反应混合物在rt下搅拌16小时。tlc(庚烷中的40%etoac)显示反应完成。用1n hcl(ph 2-3)酸化物质并用etoac(3x40ml)萃取。有机相用盐水(50ml)洗涤,经na2so4干燥并浓缩,得到粗残余物,将其在庚烷(20ml)中搅拌。滤出固体并干燥,得到5-[3-(三氟甲基)苯基]-异唑-3-羧酸(3.8g,95.4%,为白色固体)。1h nmr(500mhz,dmso):δ14.2(br s,1h),8.31(s,1h),8.261
–
8.276(dd,1h),7.912
–
7.928(dd,1h),7.818-7.834(dd,1h),7.679(s,1h)。
[0327]
步骤4:n-甲氧基-n-甲基-5-[3-(三氟甲基)苯基]异唑-3-甲酰胺
[0328]
在n2和0℃下向5-[3-(三氟甲基)苯基]异唑-3-甲酸(4.0g,0.016mol)在dcm(50ml)中的溶液中加入草酰氯(2.0ml,0.023mol)和催化量的dmf。使反应混合物达到室温并搅拌1小时。通过tlc(庚烷中的40%etoac)监测酰氯形成的进程,并且在酸完全转化后,将反应物质真空浓缩。将残余物溶解于dcm(50ml)并在0℃加入三乙胺(10.910ml,0.078mol),然后加入n-甲氧基甲胺盐酸盐(1.8g,0.019mol)。将所得混合物在rt和n2下搅拌4小时。tlc(庚烷:etoac=7:3)显示反应完成。将混合物用h2o(50ml)淬灭,分离有机层并将用dcm(2x50ml)萃取水相。合并的有机相经na2so4干燥并浓缩,得到粗产物,其通过快速柱层析(庚烷中的30% etoac)纯化得到n-甲氧基-n-甲基-5-[3-(三氟甲基)苯基]异唑-3-甲酰胺(3.1g,66.4%),为白色固体。1h nmr:(500mhz,dmso):δ8.301(s,1h),8.224
–
8.283(dd,1h),8.073
–
8.093(dd,1h),7.58-7.864(t,1h),7.527(s,1h),3.749(s,3h),2.5(s,3h)。
[0329]
步骤5:1-[5-[3-(三氟甲基)苯基]异唑-3-基]乙酮
[0330]
在-78℃下向n-甲氧基-n-甲基-5-[3-(三氟甲基)苯基]异唑-3-甲酰胺(2.3g,0.0076mol)在thf(40ml)中的溶液中滴加甲基溴化镁(7.6ml,0.023mol)并在相同温度下在n2下搅拌30分钟。tlc(庚烷:etoac=5:1)指示反应完成。将反应物质用氯化铵水溶液(10ml)淬灭并用h2o(30ml)稀释并用etoac(3x40ml)萃取。有机相用盐水(50ml)洗涤,经na2so4干燥并浓缩得到粗产物,其通过快速层析(庚烷中的20% etoac)纯化,得到1-[5-[3-(三氟甲基)苯基]异唑-3-基]乙烯酮(1.2g,61.4%)。
[0331]
步骤6:1-[5-[3-(三氟甲基)苯基]异唑-3-基]乙酮肟
[0332]
在rt下向1-[5-[3-(三氟甲基)苯基]异唑-3-基]乙烯酮(1.2g,0.005mol)在meoh(30ml)中的溶液中加入吡啶(0.758ml,0.009mol),然后在n2下加入盐酸羟胺(0.654g,0.009mol)。将所得混合物在65℃下搅拌4小时。tlc(庚烷:etoac=5:1)指示反应完成。真空蒸发反应物质。将获得的粗产物用h2o(30ml)稀释并用etoac(3x30ml)萃取。有机相用1n hcl(50ml)和盐水(50ml)洗涤,经na2so4干燥并浓缩,得到粗产物,将其通过快速柱层析纯化(庚烷中的20% etoac),得到1-[5-[3-(三氟甲基)-苯基]-异唑-3-基]乙酮肟(1.0g,78.7%)。1h nmr:(500mhz,dmso):δ11.9(s,1h),8.342
–
8.309(m,3h),7.884-7.899(dd,
1h),7.462(s,1h),3.749(s,3h),2.2(s,3h)。
[0333]
步骤7:(2e)-2-甲氧亚氨基-2-[2-[[(e)-1-[5-[3-(三氟甲基)苯基]异唑-3-基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0334]
在n2下向氢化钠(60%-0.089g,2.221mmol)在dmf(10ml)中的搅拌溶液中滴加溶解在dmf(5.0ml)中的1-[5-[3-(三氟甲基)苯基]异唑-3-基]乙酮肟(0.5g,1.850mmol)。将混合物在rt下搅拌1小时。然后,加入溶解在dmf(5.0ml)中的(2e)-2-[2-(溴甲基)-3-甲基-苯基]-2-甲氧亚氨基-乙酸甲酯(0.611g,2.035mmol)并搅拌1小时。tlc(庚烷:etoac=5:1)指示反应完成。将反应物质用1n hcl(5ml)淬灭,用h2o(15ml)稀释并用etoac(3x20ml)萃取。有机相用盐水(30ml)洗涤,经na2so4干燥,浓缩并通过快速层析(庚烷中的20% etoac)纯化,得到标题化合物(0.6g,65.7%),为白色固体。1h nmr:(500mhz,dmso):δ8.223-8.286(m,2h),7.905(d,1h),7.816(t,1h),7.392(m,3h),7.042(d,1h),5.107(br s,2h),3.927(s,3h),3.723(s,3h),2.508(s,3h),2.164(s,3h)。
[0335]
实施例22:(2e)-2-甲氧亚氨基-n-甲基-2-[3-甲基-2-[[(e)-1-[5-[3-(三氟甲基)苯基]-异唑-3-基]亚乙基氨基]氧基甲基]苯基]乙酰胺
[0336][0337]
向(2e)-2-甲氧亚氨基-2-[2-[[(e)-1-[5-[3-三氟甲基)苯基]-异唑-3-基]亚乙基氨基]氧基甲基]苯基乙酸甲酯(0.3g,0.613mmol)在thf(5ml)中的溶液中加入甲胺(~33%,在水中,2.0ml)并将所得混合物在rt下搅拌2小时。tlc(pe:etoac=5:1)显示反应完成。将反应混合物用饱和nhcl4水溶液(10ml)淬灭并用etoac(3x10ml)萃取。有机相用盐水(10ml)洗涤,经na2so4干燥并浓缩得到(2e)-2-甲氧亚氨基-n-甲基-2-[3-甲基-2-[[(e)-1-[5-[3-(三氟甲基)苯基]异唑-3-基]亚乙基氨基]氧基甲基]苯基]乙酰胺(0.2g,产率:66.3%),为白色固体。1h nmr:(500mhz,dmso):δ8.206-8.307(m,3h),7.769-7.903(m,2h),7.427(t,1h),7.331(m,2h),6.958(d,1h),5.088(br s,2h),3.877(s,3h),2.696(s,3h),2.440(s,3h),2.160(s,3h)。
[0338]
实施例27:(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[3-(三氟甲基)-2-吡啶基]-亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0339][0340]
步骤1:3-(三氟甲基)吡啶-2-甲腈
[0341]
向2-氯-3-(三氟甲基)吡啶(5g,27.54mmol)在dmf/水(50ml/0.5ml)中的溶液中加入pd2(dba)3(0.58g,0.633mmol)催化剂、dppf(0.702g,1.267mmol)并脱气15分钟。然后,加入氰化锌(1.487g,12.666mmol)并在n2和120℃下搅拌1小时。tlc(庚烷:etoac=10:1)显示反应完成。将反应混合物冷却至rt。然后,加入水(500ml)并用etoac(2x50ml)萃取。有机相用盐水(50ml)洗涤,经na2so4干燥,浓缩并通过硅胶柱纯化(庚烷:etoac:100:0~85:15),得
到3-(三氟甲基)吡啶-2-甲腈(3.7g,100%),为灰白色固体。1h nmr(500mhz,dmso-d6):δ9.06(d,j=4.0hz,1h),8.53-8.51(m,1h),8.03-8.01(m,1h)。
[0342]
步骤2:1-[3-(三氟甲基)-2-吡啶基]乙酮
[0343]
在0℃下向3-(三氟甲基)吡啶-2-甲腈(3.7g,21.50mmol)在thf(40ml)中的溶液中滴加甲基溴化镁(3m,在乙醚中,14.33ml,42.99mmol)并在0℃下搅拌1小时。tlc(pe:etoac=10:2)显示反应完成。向反应混合物中加入氯化铵水溶液(50ml)并用etoac(2x50ml)萃取。有机相用盐水(50ml)洗涤,经na2so4干燥,浓缩并通过硅胶柱纯化(庚烷:etoac:100:0~80:20),得到1-[3-(三氟甲基)-2-吡啶基]乙烯酮(3.4g,84.6%),为无色油。1h nmr(500mhz,dmso-d6):δ8.81(d,j=5.0hz,1h),8.11(d,j=8.0hz,1h),7.57(dd,j=5.0,8.0hz,1h),2.71(s,3h)。
[0344]
步骤3:(1e)-1-[3-(三氟甲基)-2-吡啶基]乙酮肟
[0345]
向1-[3-(三氟甲基)-2-吡啶基]乙酮(2.5g,13.218mmol)在甲醇(25ml)中的溶液中加入honh2.hcl(1.01g,14.54mmol)和2,6-二甲基吡啶(1.847ml,15.8mmol)。将混合物在n2和60℃下搅拌3小时。tlc(庚烷:etoac=10:2)显示反应完成。将混合物冷却至rt,蒸发至干,用h2o(25ml)淬灭并用etoac(3x25ml)萃取。将有机相用盐水(25ml)洗涤,经na2so4干燥并通过硅胶柱(庚烷:etoac=100:0~75:25)纯化,得到(1e)-1-[3-(三氟甲基)-2-吡啶基]乙酮肟(2.1g,85%),为灰白色固体。1h nmr(300mhz,dmso-d6):δ11.53(s,1h),8.87(d,j=4.5hz,1h),8.26(d,j=8.1hz,1h),7.665-7.649(m,1h),2.15(s,3h)。
[0346]
步骤4:(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[3-(三氟甲基)-2-吡啶基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0347]
向(1e)-1-[3-(三氟甲基)-2-吡啶基]乙酮肟(0.7g,3.429mmol)在dmf(7ml)中的溶液中加入(2e)-2-[2-(溴甲基)-3-甲基-苯基]-2-甲氧亚氨基-乙酸甲酯(1.13g,3.772mmol)和cs2co3(2.229g,6.858mmol)。将混合物在25℃下搅拌2小时。tlc(庚烷:etoac=4:1)显示反应完成。将反应混合物用h2o(70ml)淬灭并用etoac(3x20ml)萃取。有机相用盐水(25ml)洗涤,经na2so4干燥,浓缩并通过硅胶柱纯化(庚烷:etoac=100:0~80:20)得到标题化合物(1g,产率:68.1%),为白色固体。1h nmr(300mhz,dmso-d6):δ8.86(d,j=4.2hz,1h),8.27(d,j=7.5hz,1h),7.68-7.64(m,1h),7.33-7.26(m,2h),7.02
–
6.99(m,1h),4.96(s,2h),3.90(s,3h),3.65(s,3h),2.38(s,3h),2.10(s,3h)。
[0348]
实施例28:(2e)-2-甲氧亚氨基-n-甲基-2-[3-甲基-2-[[(e)-1-[3-(三氟甲基)-2-吡啶基]-亚乙基氨基]氧基甲基]苯基]乙酰胺
[0349][0350]
向(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[3-(三氟甲基)-2吡啶基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯(500mg,1.181mmol)在thf(5ml)中的溶液中加入menh2(40%水溶液,2ml)并将混合物在25℃下搅拌2小时。tlc(pe:etoac=5:1)显示反应完成。混合物用h2o(15ml)淬灭并用etoac(3x15ml)萃取。有机相用盐水(25ml)洗涤,经na2so4干燥并浓缩,得到标题化合物(400mg,79.2%),为白色固体。1h nmr(300mhz,dmso-d6):δ8.86(d,j=4.5hz,1h),8.27(d,j=7.2hz,1h),8.13(d,j=4.5hz,1h),7.68-7.64(m,1h),7.31-7.24
(m,2h),6.95-6.92(m,1h),4.97(s,2h),3.83(s,3h),2.65(d,j=4.5hz,3h),2.38(s,3h),1.99(s,3h)。
[0351]
实施例29:(2e)-2-甲氧亚氨基-2-[2-[[(e)-1-[4-[(e)-n-甲氧基-c-甲基-碳酰亚胺基]-2-吡啶基]亚乙基氨基]氧基甲基]-3-甲基-苯基]乙酸甲酯
[0352][0353]
步骤1:(e)-n-甲氧基-1-(4-吡啶基)乙亚胺
[0354]
在n2下向1-(4-吡啶基)乙酮(25g,206mmol)在meoh(250ml)中的溶液中加入甲氧胺盐酸盐(25.86g,309mmol)和吡啶(32.64g,413mmol)。将混合物在n2和70℃下搅拌3小时。tlc(庚烷:etoac=5:1)显示反应完成。将混合物浓缩并溶解于etoac(250ml)和h2o(250ml)中。水相用etoac(2x250ml)萃取,用盐水(250ml)洗涤,经na2so4干燥并浓缩,得到(e)-n-甲氧基-1-(4-吡啶基)乙亚胺(21g,67.8%),为浅棕色油。1h nmr(500mhz,dmso-d6):δ8.62-8.61(m,2h),7.63-7.61(m,2h),3.97(s,1h),2.19(s,3h)。
[0355]
步骤2:1-[4-[(e)-n-甲氧基-c-甲基-碳亚氨基]-2-吡啶基]乙酮
[0356]
向(e)-n-甲氧基-1-(4-吡啶基)乙亚胺(10g,67mmol)在dcm(200ml)中的溶液中加入2-氧丙酸(丙酮酸)(17.59g,200mmol)、硝酸银(0.906g,5.32mmol)、过硫酸铵(22.77g,100mmol)和水(200ml),然后滴加三氟乙酸(22.8g,200mmol)。将混合物在40℃下搅拌3小时。tlc(庚烷:etoac=4:1)显示反应完成。将混合物用dcm(200ml)和h2o(200ml)稀释,通过硅藻土过滤并用dcm(200ml)洗涤。水相用dcm(2x200ml)萃取,用盐水(200ml)洗涤,经na2so4干燥并浓缩并通过硅胶柱纯化(庚烷:etoac=100:0~70:30),得到1-[4-[(e)-n-甲氧基-c-甲基-碳亚氨基]-2-吡啶基]乙酮肟(2.6g,20.3%),为灰白色固体。1h nmr(500mhz,dmso-d6):δ8.71-8.76(m,1h),8.16(s,1h),7.89-7.87(m,1h),4.00(s,1h),2.66(s,3h),2.35(s,3h)。
[0357]
步骤3:1-[4-[(e)-n-甲氧基-c-甲基-碳亚氨基]-2-吡啶基]乙酮肟
[0358]
在n2下向1-[4-[(e)-n-甲氧基-c-甲基-碳亚氨基]-2-吡啶基]乙酮(9g,47mmol)在meoh(90ml)中的溶液中加入盐酸羟胺(4.881g,70mmol)和吡啶(7.407g,94mmol)。将混合物在n2和70℃下搅拌3小时。tlc(庚烷:etoac=4:1)显示反应完成。将混合物浓缩,然后溶解在etoac(100ml)和h2o(100ml)中。水相用etoac(2x100ml)萃取,用盐水(100ml)洗涤,经na2so4干燥,浓缩并通过硅胶柱纯化(庚烷:etoac=100:0~60:40),得到1-[4-[(e)-n-甲氧基-c-甲基-碳亚氨基]-2-吡啶基]乙酮肟(5.2g,53.6%),为浅棕色固体。1h nmr(500mhz,dmso-d6):δ11.6(s,1h),8.62-8.61(m,1h),8.11(s,1h),7.60-7.59(m,1h),3.99(s,3h),2.18(s,3h),2.11(s,3h)。
[0359]
步骤4:(2e)-2-甲氧亚氨基-2-[2-[[(e)-1-[4-[(e)-n-甲氧基-c-甲基-碳亚氨基]-2-吡啶基]亚乙基氨基]氧基甲基]-3-甲基-苯基]乙酸甲酯。
[0360]
向1-[4-[(e)-n-甲氧基-c-甲基-碳亚氨基]-2-吡啶基]乙酮肟(11g,53mmol)在acn(260ml)中的溶液中加入(2e)-2-[2-(溴甲基)-3-甲基-苯基]-2甲氧亚氨基-乙酸甲酯(15.93g,53mmol)和碳酸铯(34.6g,106.1mmol)。将混合物在20℃下搅拌4小时。tlc(庚烷:
etoac=5:1)显示反应完成。混合物用h2o(250ml)淬灭并用etoac(2x200ml)萃取。有机相用盐水(200ml)洗涤,经na2so4干燥,浓缩并通过硅胶柱纯化(庚烷:etoac=100:0~70:30)得到标题化合物(20g,产率:85.7%),为白色固体。1h nmr(500mhz,dmso-d6):δ8.61(d,j=5hz,1h),7.98(s,1h),7.63-7.62(m,1h)7.33-7.29(m,2h)7.03-7.02(m,1h)5.08(bs,2h)4.00(s,3h)3.98(s,3h),3.91(s,3h),2.51(s,3h),2.20(s,3h),2.16(s,3h)。
[0361]
实施例30:(2e)-2-甲氧亚氨基-2-[2-[[(e)-1-[4-[(e)-n-甲氧基-c-甲基-碳亚氨基]-2吡啶基]亚乙基氨基]氧基甲基]-3-甲基-苯基]-n-甲基-乙酰胺
[0362][0363]
向(2e)-2-甲氧亚氨基-2-[2-[[(e)-1-[4-[(e)-n-甲氧基-c-甲基-碳亚氨基]-2-吡啶基]亚乙基氨基]氧基甲基]-3-甲基-苯基]乙酸甲酯(6g,14mmol)在thf(60ml)中的溶液中加入甲胺(~40%,在水中,6.54g,211mmol)。将混合物在20℃下搅拌2小时。tlc(庚烷:etoac=4:1)显示反应完成。将反应混合物用h2o(150ml)淬灭并用etoac(3x150ml)萃取。有机相用盐水(150ml)洗涤,经na2so4干燥,浓缩并通过硅胶柱(庚烷:etoac=100:0~60:40)纯化得到标题化合物(5.2g,产率:86%),为白色固体。1h nmr(500mhz,dmso-d6):δ8.61(d,j=5hz,1h),8.22(d,j=5.00hz,1h),8.01(s,1h),7.63-7.61(m,1h),7.31-7.27(m,2h),6.96
–
6.94(m,1h),5.08(bs,2h),3.99(s,3h)3.86(s,3h),2.65(d,j=5.00hz,3h),2.47(s,3h)2.21(s,3h),2.16(s,3h)。
[0364]
实施例123:(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[5-(三氟甲基)噻唑-2-基]-亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0365][0366]
步骤1:2-(1,1-二甲氧基乙基)噻唑
[0367]
在n2下向1-噻唑-2-基乙酮(50g,0.393mol)在meoh(300ml)中的溶液中加入三甲氧基甲烷(258ml,2.34mol)和对甲苯磺酸(74g,0.393mol)。将反应混合物在n2和65℃下搅拌16小时。tlc(庚烷:etoac=10:1)显示反应完成。将反应混合物冷却至rt,用dcm(600ml)稀释。加入饱和nahco3溶液(250ml)以中和酸。水相再次用dcm(2x300ml)萃取。合并的有机相用水(2x300ml)和盐水(300ml)洗涤,经na2so4干燥并浓缩,得到(2-(1,1-二甲氧基乙基)噻唑(53g,65.05%),为无色液体。1h nmr(500mhz,chcl
3-d):δ7.86(d,1h),7.73(d,1h),3.1(s,6h),1.6(s,3h)。
[0368]
步骤2:2-(1,1-二甲氧基乙基)-5-碘噻唑
[0369]
在搅拌下向在n2和-78℃下的2-(1,1-二甲氧基乙基)噻唑(42g,0.242mol)在thf(420ml)中的溶液中滴加己烷中的2.5m正丁基锂(121ml,0.303mol)。在相同温度下搅拌45分钟后,在搅拌下滴加在100mlthf中的碘(64g,0254mol)。将混合物在-78℃和n2下搅拌2小时。tlc(庚烷:etoac=10:1)显示反应完成。混合物用100ml饱和氯化铵溶液淬灭。水相用
etoac(2x500ml)萃取。合并的有机相用水(300ml)和盐水(300ml)洗涤,经na2so4干燥,浓缩并通过快速柱层析(庚烷中的10-15% etoac)纯化。蒸发溶剂,得到2-(1,1-二甲氧基乙基)-5-碘-噻唑(48g,66.2%),为浅棕色液体。1h nmr(500mhz,chcl
3-d):δ7.85(s,1h),3.2(s,6h),1.72(s,3h)。步骤3:2-(1,1-二甲氧基乙基)-5-(三氟甲基)噻唑
[0370]
在n2下向2-(1,1-二甲氧基乙基)-5-碘-噻唑(40g,133mmol)中加入2,2-二氟-2-氟磺基-乙酸甲酯(28g,415mmol)、碘化铜(28g,147mmol)和dmf(320ml)。将反应混合物在100℃下加热并搅拌12小时。tlc(庚烷:etoac=10:1)显示反应完成。将反应物质冷却至rt。加入冰水(100ml),随后加入etoac(500ml)。沉淀出固体,通过硅藻土过滤并用etoac(50ml)彻底洗涤。分离有机层。水层用etoac(2x400ml)萃取。用水(2x300ml)和盐水(300ml)洗涤合并的有机层。有机层经na2so4干燥并浓缩。粗产物通过快速柱层析纯化(庚烷中的10-15% etoac)。蒸发溶剂,得到2-(1,1-二甲氧基乙基)-5-(三氟甲基)-噻唑(10.8g,33%),为浅棕色液体。1h nmr(500mhz,chcl
3-d):δ8.11(s,1h),3.27(s,6h),1.74(s,3h)。
[0371]
步骤4:1-[5-(三氟甲基)噻唑-2-基]乙烯酮
[0372]
在0℃下向2-(1,1-二甲氧基乙基)-5-(三氟甲基)噻唑(10g,41mmol)在dcm(15ml)中的溶液中加入三氟乙酸(27ml,410mmol)和水(ml)。将反应混合物在rt下搅拌2小时。tlc(庚烷:etoac=10:1)显示反应完成。反应物质用dcm(200ml)稀释并用饱和nahco3溶液(150ml)中和。水相用dcm(2x200ml)萃取。合并的有机相用水(100ml)和盐水(100ml)洗涤,经na2so4干燥并浓缩,得到1-[5-(三氟甲基)噻唑-2-基]乙烯酮(6.7g,82%),为浅棕色油。1h nmr(500mhz,chcl
3-d):δ8.2(s,1h),2.76(s,3h)。
[0373]
步骤5:1-[5-(三氟甲基)噻唑-2-基]乙烯酮肟
[0374]
在n2下向1-[5-(三氟甲基)噻唑-2-基]乙烯酮(6.7g,34mmol)在meoh(60ml)中的溶液中加入盐酸羟胺(3.5g,51mmol)和吡啶(5.4g,69mmol)。将反应混合物在n2和80℃下搅拌4小时。tlc(pe:etoac=10:1.5)显示反应完成。将反应混合物浓缩,然后溶解在etoac(100ml)和h2o(100ml)中。水相用etoac(2x50ml)萃取。合并的有机层用盐水(100ml)洗涤,经na2so4干燥并真空浓缩。将粗产物在meoh(12ml)中搅拌15分钟,通过布氏漏斗过滤并真空干燥,得到1-[5-(三氟甲基)噻唑-2-基]-乙烯酮肟(3.7g,51%),为白色固体。1h nmr(500mhz,chcl
3-d):δ13.2(s,1h),8.6(s,1h),2.2(s,3h)。
[0375]
步骤6:(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[e-1-[5-(三氟甲基)噻唑-2-基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0376]
向1-[5-(三氟甲基)噻唑-2-基]乙烯酮肟(3.7g,17.60mmol)在acn(40ml)中的溶液中加入cs2co3(11.44g,35.20mmol)。将混合物在25℃下搅拌10分钟。然后,加入(2e)-2-[2-(溴甲基)-3-甲基-苯基]-2-甲氧亚氨基-乙酸甲酯(5.8g,19.36mmol)。将混合物在25℃下搅拌12小时。tlc(pe:etoac=80:20)显示反应完成。将混合物用h2o(100ml)淬灭并用etoac(2x100ml)萃取。将合并的有机相用盐水(100ml)洗涤,经na2so4干燥,浓缩并通过快速柱层析(正庚烷:etoac=~80:20)纯化,得到标题化合物(5.1g,66.8%),为白色固体。1h nmr(500mhz,dmso-d):δ8.68(s,1h),7.32-7.37(m,2h),7.05(d,1h),5.23(br s,2h),3.92(s,3h),3.64(s,3h),2.45(s,3h),2.35(s,3h)。
[0377]
实施例53:(2e)-2-甲氧亚氨基-n-甲基-2-[3-甲基-2-[[(e)-1-[5-(三氟甲基)噻唑-2基]亚乙基氨基]氧基甲基]苯基]乙酰胺
[0378][0379]
向(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[5-(三氟甲基)噻唑-2-基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯(5.7g,13.27mmol)在thf(25ml)中的溶液中加入甲胺(20ml,40%水溶液)并将混合物在25℃下搅拌2小时。tlc(50%pe:etoac)显示反应完成。蒸发溶剂并将获得的粗物质用h2o(150ml)稀释,用etoac(3x100ml)萃取。合并的有机相用盐水(100ml)洗涤,经na2so4干燥并浓缩。粗产物通过快速柱层析纯化(正庚烷:etoac=~80:35作为洗脱剂),得到标题化合物(5.1g,89.7%),为白色固体。1h nmr(500mhz,dmso-d):δ8.65(s,1h),8.2(d,1h),7.29-7.35(m,2h),6.97(d,1h),5.2(br s,2h),3.81(s,3h),2.62(s,3h),2.48(s,3h),2.35(s,3h)。
[0380]
实施例72:(2e)-2-[2-[[(e)-[环丙基-[4-(三氟甲基)-2-吡啶基]亚甲基]氨基]-氧基甲基]-3-甲基-苯基]-2-甲氧亚氨基乙酸甲酯
[0381][0382]
步骤1:环丙基-[4-(三氟甲基)-2-吡啶基]甲酮
[0383]
向在n2下冷却至0℃的2-溴-4-(三氟甲基)吡啶(10g,44mmol)在甲苯(80ml)中的溶液中滴加异丙基氯化镁(2m,在thf中)(24.3ml,48mmol)10分钟。使反应达到rt并搅拌1.5小时。将所得深棕色混合物冷却至0℃并加入n-甲氧基-n-甲基嘧啶-5-甲酰胺(6.28g,49mmol)在甲苯(10ml)中的溶液。将反应在0℃下搅拌1小时并用饱和氯化铵水溶液(100ml)淬灭。分离各相并用etoac(50ml)萃取水相。合并的有机层经硫酸镁干燥并真空浓缩。使用柱层析(庚烷中的5-10% etoac)纯化粗物质,得到环丙基-[4-(三氟甲基)-2-吡啶基]甲酮。产率6.28g(63%)。1h nmr(dmso-d6,500mhz):δ9.07(s,1h),8.14-8.10(m,2h),3.46-3.42(m,1h),1.10-1.15(m,4h)。
[0384]
步骤2:环丙基-[4-(三氟甲基)-2-吡啶基]甲酮肟
[0385]
向环丙基-[4-(三氟甲基)-2-吡啶基]甲酮(12.0g,56mmol)在甲醇(120ml)中的溶液中加入盐酸羟胺(7.7g,111mmol)和乙酸钠(9.1g,111mmol)并在回流下搅拌4小时。将混合物浓缩并在etoac(10ml)和水(10ml)之间分配。分离有机层,经na2so4干燥并真空浓缩。通过柱层析(庚烷中的20% etoac)纯化粗物质以获得环丙基-[4-(三氟-甲基)-2-吡啶基]甲基-酮肟。产率6.7g(52.2%)。1h nmr(dmso-d6,500mhz):δ11.6(s,1h),8.81-8.80(d,1h),7.88(s,1h),7.76-7.75(m,1h),2.44-2.42(m,1h),1.27-1.25(m,2h),0.90-0.89(m,2h)。
[0386]
步骤3:(2e)-2-[2-[[(e)-[环丙基-[4-(三氟甲基)-2-吡啶基]亚甲基]氨基]氧基甲基]-3-甲基-苯基]-2-甲氧亚氨基-乙酸甲酯
[0387]
向环丙基-[4-(三氟甲基)-2-吡啶基]甲酮肟(5.5g,24mmol)在dmf(70ml)中的溶液中加入(2e)-2-[2-(溴甲基)-3-甲基-苯基]-2-甲氧亚氨基-乙酸甲酯(7.89g,26mmol)和cs2co3(15.5g,47.7mmol)并在25℃下搅拌2小时。混合物用h2o(40ml)淬灭,用etoac(40ml)萃取。分离有机层,用盐水(30ml)洗涤,经na2so4干燥并真空浓缩。将粗物质与庚烷(30ml)一
起研磨,然后在0℃下在meoh(10ml)中结晶。将固体过滤并干燥,得到标题化合物(产率7.0g,65.2%)。1h nmr(dmso-d6,500mhz):δ8.82-8.81(d,1h),7.80-7.79(m,2h)7.34-7.30(m,2h),7.04-7.02(m,1h),5.03(br s,2h),3.91(s,3h),3.63(s,3h),2.33-2.29(m,1h),1.17-1.15(m,2h),0.90-0.88(m,2h)。实施例70:(2e)-2-[2-[[(e)-[环丙基-[4-(三氟甲基)-2-吡啶基]亚甲基]氨基]氧基甲基]-3-甲基-苯基]-2-甲氧亚氨基-n-甲基-乙酰胺
[0388][0389]
向(2e)-2-[2-[[(e)-[环丙基-[4-(三氟甲基)-2-吡啶基]亚甲基]氨基]-氧基甲基]-3-甲基-苯基]-2-甲氧亚氨基乙酸甲酯(7.0g,16mmol)在thf(50ml)中的溶液中加入甲胺(~33%,在水中,20ml),并将混合物在25℃下搅拌12小时。反应用etoac(20ml)和水(20ml)稀释。分离有机层并用水和盐水洗涤,经na2so4干燥并真空浓缩。通过柱层析(庚烷中的40% etoac)纯化粗物质,得到标题化合物。产率6.0g(85.3%)。1h nmr(dmso-d6,500mhz):δ8.82-8.81(d,1h),8.23-8.22(m,1h),7.86-7.78(m,2h),7.31-7.29(m,2h),6.97-6.95(m,1h),5.03(br s,2h)3.85(s,3h),2.65(s,3h),2.51(s,3h),2.34(m,1h),1.19-1.17(m,2h),0.97-0.85(m,2h)。
[0390]
实施例79:(2e)-2-[2-[[(e)-1-[5-(4-氟苯基)噻唑-2-基]亚乙基氨基]氧基甲基]-3甲基-苯基]-2-甲氧亚氨基-n-甲基乙酰胺
[0391][0392]
步骤1:1-(5-溴噻唑-2-基)乙烯酮
[0393]
在-78℃和n2下在15分钟内向2-(1,1-二甲氧基乙基)噻唑(2.7g,16mmol,1.eq.)在thf(60ml)中的溶液中缓慢加入正丁基锂(15.5ml,2.5m,2.5eq.),并在-78℃和n2下继续反应1小时。在-78℃和n2下向该反应混合物中加入cbr4并在相同温度下持续2小时。在25℃下用1n hcl(25ml)溶液缓慢淬灭反应并用h2o(100ml)稀释并用etoac(3x100ml)萃取,然后用盐水洗涤(2x100ml)。有机层经na2so4干燥并浓缩,得到粗化合物(1.8g)。使用组合快速柱层析(庚烷中的0-10% etoac)纯化粗化合物,得到1-(5-溴噻唑-2基)乙烯酮(1.7g,53%产率)。1h nmr(500mhz,dmso-d6)δ=8.24(s,1h),2.60(s,3h)。
[0394]
步骤2:1-[5-(4-氟苯基)噻唑-2-基]乙烯酮
[0395]
在25℃下向1-(5-溴噻唑-2-基)乙烯酮(2g,9.70mmol,1eq.)在二烷(35ml)中的溶液中加入k2co3(4g,29mmol,3eq.),然后加入h2o(5ml)和4-氟苯硼酸(1.6g,11.64mmol,1.2eq.)。通过吹扫n
2 15分钟使反应混合物脱气,然后在n2下加入pdcl2(dppf)2(0.35g,0.485mmol,0.05eq.)并在110℃下回流6小时。反应混合物用h2o(50ml)稀释并用etoac(3x50ml)萃取,随后用盐水(2x100ml)。有机层经na2so4干燥,浓缩并通过快速层析(己烷中的0-10% etoac)纯化,得到1-[5-(4-氟苯基)-噻唑-2-基]乙烯酮,为白色固体(1.1g,50%产率)。1h nmr(500mhz,dmso-d6)δ=8.6(s,1h),8.1-7.9(m,2h),7.4-7.3(m,2h),2.7(s,3h)。
[0396]
步骤3:1-[5-(4-氟苯基)噻唑-2-基]乙酮肟
[0397]
向1-[5-(4-氟苯基)噻唑-2-基]乙烯酮(1.5g,6.78mmol,1.0eq)在meoh(30ml)中的溶液中加入盐酸羟胺(0.7g,10mmol,1.5eq)和吡啶(0.8ml,14mmol,2eq)。将反应混合物回流6小时。将混合物冷却至25℃并在减压下除去溶剂。残余物用水(50ml)稀释并用etoac(3x50ml)萃取。有机层用无水na2so4干燥并减压浓缩,得到粗产物,将其通过柱层析纯化(庚烷中的0-30% etoac),得到1-[5-(4-氟苯基)-噻唑-2基]-乙酮肟,为白色固体(0.32g,产率:对于e-异构体为20%)。1h nmr(500mhz,dmso-d6)δ=11.90(s,1h),8.24(s,1h),7.77-7.74(m,2h),7.33-7.29(m,2h),2.4(s,3h)。步骤4:(2e)-2-[2-[[(e)-1-[5-(4-氟苯基)噻唑-2-基]亚乙基氨基]氧基甲基]-3甲基-苯基]-2-甲氧亚氨基-乙酸甲酯
[0398]
在25℃和n2下在10分钟内向nah(0.076g,2.5eq,60%,3.174mmol)在dmf(20ml)中的搅拌悬浮液中加入在dmf(5ml)中的1-[5-(4-氟苯基)噻唑-2-基]乙酮肟(0.419g,1.397mmol,1.eq.)。将混合物在rt下搅拌2小时。在rt下向该混合物中加入(2e)-2-[2-(溴甲基)-3-甲基-苯基]-2-甲氧亚氨基-乙酸甲酯(0.225g,0.931mmol,1.1eq.)并在50℃下搅拌2小时。将混合物冷却至室温,用h2o(30ml)淬灭并用etoac(3x30ml)、冷h2o(3x100ml)萃取,然后用盐水洗涤(3x50ml)。有机层经na2so4干燥并浓缩。粗化合物经联合快速柱层析(庚烷中的0-15% etoac)纯化,得到标题化合物,为白色固体(0.2g,41%产率)。1h nmr(500mhz,dmso-d6)δ=8.4(s,1h),7.7-7.8(m,2h),7.3-7.4(m,4h),7.03-7.02(m,1h),5.12(br s,2h),3.91(s,3h),3.68(s,3h),2.5(s,3h),2.3(s,3h)。ms:[m+h]+456。
[0399]
实施例78:(2e)-2-[2-[[(e)-1-[5-(4-氟苯基)噻唑-2-基]亚乙基氨基]氧基甲基]-3-甲基-苯基]-2-甲氧亚氨基-n-甲基乙酰胺
[0400][0401]
向(2e)-2-[2-[[(e)-1-[5-(4-氟苯基)噻唑-2-基]亚乙基氨基]氧基甲基]-3-甲基-苯基]-2-甲氧亚氨基-乙酸甲酯(0.120g,0.272mmol,1eq.)在thf(10ml)中的搅拌溶液中加入甲胺盐酸盐(40%,在h2o中,0.7ml)并在25℃下搅拌1小时。然后,将混合物用h2o(20ml)稀释并用etoac(3x20ml)萃取,随后用盐水(2x20ml)。有机层经na2so4干燥并浓缩。粗化合物经组合快速柱层析纯化(庚烷中的0-30% etoac),得到标题化合物,为白色固体(0.1g,80%产率)。1h nmr(500mhz,dmso-d6)δ=8.37(s,1h),8.20-8.19(s,1h),7.78-7.74(m,2h),7.34-7.28(m,4h),6.97-6.96(br s,1h),5.12(br s,2h),3.83(s,3h),2.60(s,3h),2.52(br s,3h),2.30(s,3h)。
[0402]
实施例84:(2e)-2-甲氧亚氨基-n-甲基-2-[3-甲基-2-[[(e)-1-[5-(三氟甲基)-3-吡啶基]-亚乙基氨基]氧基甲基]苯基]乙酰胺
[0403][0404]
步骤1:1-[5-(三氟甲基)-3-吡啶基]乙烯酮
[0405]
向3-溴-5-(三氟甲基)吡啶(0.5g,2.212mmol,1eq.)在1,4-二烷(20ml)中的溶
液中加入1-甲氧基乙烯基(三丙基)锡烷(1.012g,0.003mol,1.5eq),然后在25℃和n2下一次性加入pdcl2(pph3)2(0.070g,0.11mmol,0.05eq)。将反应混合物在n2和100℃下搅拌6小时。tlc(庚烷中的10%etoac)显示sm已完全消耗。将反应混合物冷却至25℃并加入1n hcl(10ml)。将混合物在100℃下再次加热1小时。反应经nahco3饱和溶液(20ml)淬灭,通过硅藻土床过滤并用etoac(30ml)洗涤。滤液水相用etoac(2x20ml)萃取。合并的有机层经na2so4干燥并浓缩以获得1-[5-(三氟甲基)-3-吡啶基]乙酮(0.2g,47%),为棕色液体。产物不经纯化用于下一步。
[0406]
步骤2:1-[5-(三氟甲基)-3-吡啶基]乙酮肟
[0407]
在n2下向1-[5-(三氟甲基)-3-吡啶基]乙酮(3g,15.86mmol,1eq.)在meoh(50ml)中的溶液中加入盐酸羟胺(2.736g,39.654mmol,2.5eq)和吡啶(3.13g,0.040mol,2.5eq)。将混合物在n2和65℃下搅拌2小时。tlc(庚烷中的20% etoac)显示反应完成。将混合物浓缩,然后溶解在etoac(100ml)和h2o(100ml)中。水相用etoac(3x50ml)萃取。合并的有机层用盐水(100ml)洗涤,经na2so4干燥,浓缩并通过硅胶柱纯化(庚烷中的0-20% etoac),得到e异构体1-[5-(三氟甲基)-3-吡啶基]乙酮肟(1.8g,54%),为白色固体。1h nmr(500mhz,dmso-d6)δ=11.8(s,1h),9.12(s,1h),8.96(s,1h),8.31(s,1h),2.23(s,3h)。ms:[m+h]
+
205。
[0408]
步骤3:(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[5-(三氟甲基)-3-吡啶基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0409]
向1-[5-(三氟甲基)-3-吡啶基]乙酮肟(0.500g,2.44mmol,1eq)在dmf(10ml)中的溶液中加入cs2co3(1.59g,4.89mmol,2eq)。将混合物在25℃下搅拌10分钟。加入dmf(5ml)中的(2e)-2-[2-(溴甲基)-3-甲基-苯基]-2-甲氧亚氨基-乙酸甲酯(0.978g,2.69mmol,1.1eq)并将反应混合物在25℃和n2下搅拌12小时。tlc(庚烷中的10%etoac)显示反应完成。将混合物用冷h2o(100ml)淬灭,用etoac(3x50ml)萃取。有机相用盐水(100ml)洗涤,经na2so4干燥,浓缩并通过硅胶柱纯化(庚烷中的0-10% etoac),得到标题化合物(0.800g,76.5%),为灰白色固体。1h nmr(500mhz,dmso-d6)δ=9.01(d,2h),8.28(s,1h),7.22(d,2h),7.01(s,1h),4.98(br s,2h),4.13(s,3h),3.90(s,3h),2.49-2.43(d,3h),2.18(s,3h)。ms:[m+h]
+
424。
[0410]
实施例85:(2e)-2-甲氧亚氨基-n-甲基-2-[3-甲基-2-[[(e)-1-[5-(三氟甲基)-3-吡啶基]-亚乙基氨基]氧基甲基]苯基]乙酰胺:
[0411][0412]
向(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[5-(三氟甲基)-3-吡啶基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯(0.500g,1eq)在thf(10ml)中的溶液中加入甲胺盐酸盐(4ml,40%,在h2o中)并在25℃下搅拌2小时。tlc(庚烷中的30%etoac)显示反应完成。蒸发溶剂。将获得的粗物质用h2o(30ml)稀释,用etoac(3x20ml)萃取。有机相用盐水(20ml)洗涤,经na2so4干燥并浓缩。用正戊烷(4x20ml)洗涤粗化合物,得到标题化合物(0.300g,60%),为灰白色固体。1h nmr(500mhz,dmso-d6)δ=9.10(s,h),9.0(s,1h),8.3(d,1h),8.2(br s,1h),7.31(d,2h),6.9(s,1h),5.12(br s,2h),3.9(s,3h),2.70(m,3h),2.55(m,3h),
2.20(s,3h)。
[0413]
实施例89:(2e)-2-甲氧亚氨基-n-甲基-2-[3-甲基-2-[[(e)-1-[6-(三氟甲基)吡嗪-2基]亚乙基氨基]氧基甲基]苯基]乙酰胺
[0414][0415]
步骤1:1-[6-(三氟甲基)吡嗪-2-基]乙酮
[0416]
在n2下向1-(6-溴吡嗪-2-基)乙酮(1.2g,5.97mmol)和2,2-二氟-2-氟磺酰基-乙酸甲酯(3.4g,18mmol)在dmf(12ml)中的溶液中加入cui(1.36g,7.16mmol)。将混合物在90℃下搅拌2小时。混合物的颜色随时间从浅棕色变为深棕色。反应用水淬灭并用etoac萃取。形成的乳液通过硅藻土过滤并用etoac洗涤。分离各层,水层用etoac(10ml)萃取。合并有机层,用冷水、盐水洗涤,经na2so4干燥并浓缩至干。粗产物通过柱层析(庚烷中的20-25% etoac)纯化,得到1-[6-(三氟甲基)吡嗪-2-基]乙烯酮。产率0.25g,(22%)。1h nmr(dmso-d6,500mhz):δ9.45-9.40(d,1h),9.13-9.07(m,1h),2.58(s,3h)。
[0417]
步骤2:1-[6-(三氟甲基)吡嗪-2-基]乙酮肟
[0418]
在n2下向1-[6-(三氟甲基)吡嗪-2-基]乙烯酮(0.25g,1mmol)在甲醇(4ml)中的溶液中加入盐酸羟胺(0.1g,1.64mmol)、吡啶(0.2g,3mmol)。将混合物在66℃下搅拌4小时。将反应混合物浓缩,溶解于乙酸乙酯(10ml)中并用水(10ml)洗涤。水相用乙酸乙酯萃取,合并有机层。将有机层浓缩并通过柱层析纯化,使用庚烷中的20%乙酸乙酯作为洗脱剂,得到[6-(三氟甲基)吡嗪-2-基]乙酮肟。产率0.2g(74.1%)。1h nmr(dmso-d6,500mhz):δ12.2(s,1h),12.1(s,1h)9.4(s,1h),9.1(s,1h),9.0(s,1h),8.8(s,1h)2.2(s,6h)。
[0419]
步骤3:(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[6-(三氟甲基)吡嗪-2-基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0420]
向1-[6-(三氟甲基)吡嗪-2-基]乙酮肟(0.24g,1.17mmol)在dmf(10ml)中的溶液中加入(2e)-2-[2-(溴甲基)-3-甲基-苯基]-2-甲氧亚氨基-乙酸甲酯(0.57g,1.93mmol)和cs2co3(1.14g,3.5mmol)。将混合物在25℃下搅拌1小时,然后加热至80℃并保持2小时。混合物用水(40ml)淬灭并用etoac(40ml)萃取。有机相用盐水(30ml)洗涤,经na2so4干燥并浓缩。粗产物通过柱层析(庚烷中的20% etoac)纯化,得到(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[6-(三氟甲基))吡嗪-2-基]-亚乙基氨基]氧基甲基]苯基]乙酸甲酯。产率0.07g(15%)。1h nmr(dmso-d6,500mhz):δ9.2(s,1h),9.2(s,1h)7.3(m,2h),7.1-7.0(m,1h),5.23(br s,2h),3.9(s,3h),3.7(s,3h),2.51(s,3h),2.1(s,3h)。
[0421]
步骤4:(2e)-2-甲氧亚氨基-n-甲基-2-[3-甲基-2-[[(e)-1-[6-(三氟甲基)吡嗪-2-基]-亚乙基氨基]氧基甲基]苯基]乙酰胺
[0422]
向(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[6-(三氟甲基)吡嗪-2-基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯(0.06g,0.14mmol)在thf(1ml)中的溶液中加入甲胺(~33%,在水中,1ml)。将反应混合物在25℃下搅拌3小时。混合物用水淬灭并用etoac(5ml)稀释。分离有机层,用水、盐水洗涤,经硫酸钠干燥并浓缩。通过柱层析(庚烷中的50% etoac)纯化粗物质,得到标题化合物。产率0.06g,(97.5%)。1h nmr(dmso-d6,500mhz):δ9.3(s,1h),9.2(s,1h),8.3(m,1h),7.3(m,2h),7.0(m,1h),5.23(br s,2h),3.9(s,3h),2.7(s,
3h),2.5(s,3h),2.0(s,3h)。
[0423]
实施例96:(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[5-(三氟甲基)吡嗪-2基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0424][0425]
步骤1:1-[5-(三氟甲基)吡嗪-2-基]乙烯酮
[0426]
向2-氯-5-(三氟甲基)吡嗪(0.5g,27mmol)在二烷(5ml)中的溶液中加入pdcl2(pph3)2(0.2g,0.27mmol)和三丁基(1-乙氧基乙烯基)锡烷(1.08g,3mmol)。将反应加热至回流并搅拌1小时。加入1n hcl水溶液(2.5ml)。将反应在回流下搅拌1小时。通过tlc(庚烷中的10% etoac)监测反应。将混合物冷却至rt并用etoac分配。分离etoac层,用盐水洗涤,经na2so4干燥并浓缩。通过柱层析(庚烷中的5-10% etoac)纯化粗物质,得到1-[5-(三氟甲基)吡嗪-2-基]-乙烯酮。产率0.3g(57.6%)。1h nmr(cdcl3,500mhz):δ9.3(s,1h),9.0(s,1h),2.8(s,3h)。
[0427]
步骤2:1-[5-(三氟甲基)吡嗪-2-基]乙酮肟
[0428]
在n2下向1-[5-(三氟甲基)吡嗪-2-基]乙酮(0.3g,2mmol)在甲醇(4ml)中的溶液中加入盐酸羟胺(0.13g,2mmol)和吡啶(0.25g,2.36mmol)。将混合物在回流下搅拌2小时,浓缩,溶解于etoac(10ml)中并用水(10ml)洗涤。水相用etoac(10ml)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥并浓缩。使用柱层析(庚烷中的20% etoac)纯化粗物质,得到1[5-(三氟甲基)吡嗪-2-基]乙酮肟。产率0.2g(61.8%)。1h nmr(dmso-d6,500mhz):δ12.3(s,1h),9.2(s,2h),2.2(s,3h)。
[0429]
步骤3:(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[5-(三氟甲基)吡嗪-2-基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0430]
向1-[5-(三氟甲基)吡嗪-2-基]乙酮肟(0.2g,0.97mmol)在acn(3ml)中的溶液中加入(2e)-2-[2-(溴甲基)-3-加入甲基-苯基]-2-甲氧亚氨基-乙酸甲酯(0.29g,0.97mmol)和cs2co3(0.63g,1.95mmol)。将混合物在25℃下搅拌2小时,用水(40ml)淬灭并用etoac(40ml)萃取。分离有机层,用盐水(30ml)洗涤,经na2so4干燥并浓缩。粗混合物通过柱层析(庚烷中的15% etoac)纯化,得到标题化合物。产率0.4g(97.4%)。1h nmr(dmso-d6,500mhz):δ9.2(s,1h),9.1(s,1h)7.3(m,2h),7.1-7.0(m,1h),5.23(br s,2h),3.9(s,3h),3.7(s,3h),2.51(s,3h),2.2(s,3h)。
[0431]
实施例97:(2e)-2-甲氧亚氨基-n-甲基-2-[3-甲基-2-[[(e)-1-[5-(三氟甲基)吡嗪-2基]亚乙基氨基]氧基甲基]苯基]乙酰胺
[0432][0433]
向(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[5-(三氟甲基)吡嗪-2-基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯(0.2g,0.58mmol)在thf(2.5ml)中的溶液中加入甲胺(~33%,在水中,1.2ml)。将反应在25℃下搅拌3小时并用水淬灭。加入etoac(5ml)。分离有机层,用盐水洗涤,经na2so4干燥并浓缩。粗产物通过柱层析(庚烷中的20% etoac)纯化,得到
标题化合物。产率0.19g(71.6%)。1h nmr(dmso-d6,500mhz):δ9.17(s,1h),9.12(s,1h);8.3(m,1h),7.3(m,2h),7.0(m,1h),5.23(br s,2h),3.86(s,3h),2.69(s,3h),2.5(s,3h),2.18(s,3h)。
[0434]
实施例113:(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[6-(三氟甲基)嘧啶-4基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0435][0436]
步骤1:1-[6-(三氟甲基)嘧啶-4-基]乙酮
[0437]
向4-氯-6-(三氟甲基)嘧啶(1.0g,5.48mmol)在二烷(10ml)中的溶液中加入pdcl2(pph3)2(0.4g,0.54mmol)和三丁基(1-乙氧基乙烯基)锡烷(2.96g,8mmol)。将反应混合物回流3小时,冷却至rt,然后加入1n hcl水溶液(2.5ml)并再搅拌1小时。反应用etoac(30ml)稀释。分离有机层,用盐水(40ml)洗涤,经na2so4干燥并真空浓缩。通过柱层析(庚烷中的0-30%etoac)纯化粗物质,得到1-[6-(三氟甲基)嘧啶-4-基]乙烯酮。产率0.52g(49.9%)。1h nmr(dmso-d6,500mhz):δ9.7(s,1h),8.3(s,1h),2.7(s,3h)。
[0438]
步骤2:1-[6-(三氟甲基)嘧啶-4-基]乙酮肟
[0439]
向1-[6-(三氟甲基)嘧啶-4-基]乙酮(0.19g,0.99mmol)在meoh(10ml)中的溶液中加入盐酸羟胺(0.066g,2mmol)和吡啶(0.15g,2mmol)。将混合物回流1小时,浓缩并溶解在etoac(10ml)中并用h2o(10ml)洗涤。水相用etoac(10ml)萃取。合并的有机层用盐水(10ml)洗涤,经na2so4干燥并浓缩。通过柱层析(庚烷中的40% etoac)纯化粗物质,得到1-[6-(三氟甲基)嘧啶-4-基]乙酮肟。产率0.15g(73%)。1h nmr(dmso-d6,500mhz):δ12.8(s,1h),9.46(s,1h),8.17-8.16(d,1h),2.15(s,3h)。
[0440]
步骤3:(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[6-(三氟甲基)嘧啶-4-基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0441]
向环丙基[4-(三氟甲基)-2-吡啶基]甲酮肟(0.5g,2.4mmol)在dmf(10ml)中的溶液中加入(2e)-2-[2-(溴甲基)-3-甲基-苯基]-2-甲氧亚氨基-乙酸甲酯(0.73g,2.4mmol)和cs2co3(1.58g,4.88mmol)。将反应混合物在25℃下搅拌12小时。用水(30ml)淬灭反应,用etoac(20ml)萃取。分离有机层,用盐水(30ml)洗涤,经na2so4干燥并真空浓缩。通过柱层析(庚烷中的0-30% etoac)纯化粗物质,得到标题化合物,为白色固体。产率0.38g(36.4%)。1h nmr(dmso-d6,500mhz):δ9.47(s,1h),8.10(s,1h),7.33-7.31(m,2h),7.05-7.02(m,1h),5.17(br s,2h),3.90(s,3h),3.69(s,3h)2.50(s,3h),2.09(s,3h)。
[0442]
实施例114:(2e)-2-甲氧亚氨基-n-甲基-2-[3-甲基-2-[[(e)-1-[4-(三氟甲基)-6-乙烯基-2-吡啶基]亚乙基氨基]氧基甲基]苯基]乙酰胺
[0443][0444]
向(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[6-(三氟甲基)-嘧啶-4-基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯(0.2g,0.47mmol)在thf(10ml)中的溶液中加入甲胺(~
33%,在水中,2ml)。将混合物在25℃下搅拌5小时。反应用etoac(10ml)和水(10ml)稀释。分离有机层并用盐水洗涤,经na2so4干燥并真空浓缩。粗产物通过柱层析(庚烷中的40% etoac)纯化,得到标题化合物。产率0.18g(90%)。1h nmr(dmso-d6,500mhz):δ9.5(s,1h),8.2(m,1h),8.2(s,1h),7.32-7.30(m,2h),7.0-6.9(m,1h),5.2(br s,2h),3.9(s,3h),2.7(s,3h),2.50(s,3h),2.09(s,3h)。
[0445]
实施例116:(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[4-(三氟甲基)-6-乙烯基-2-吡啶基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0446][0447]
步骤1:1-[6-氯-4-(三氟甲基)-2-吡啶基]乙酮
[0448]
向2,6-二氯-4-(三氟甲基)吡啶(1.0g,5mmol)在二烷(5ml)中的溶液中加入pdcl2(dppf)(0.17g,0.5mmol)和三丁基(1-乙氧基乙烯基)锡烷(1.17g,3mmol)。在n2下将反应回流搅拌1小时。加入1n hcl水溶液(2.5ml)并在回流下继续反应另外1小时。通过tlc(庚烷中的10%etoac)监测反应。使混合物达到室温并用水稀释并用etoac(30ml)萃取。分离有机层,用盐水洗涤,经na2so4干燥并蒸发至干。使用柱层析(庚烷中的5-10% etoac)纯化粗物质,得到1-[6-氯-4-(三氟甲基)-2-吡啶基]乙酮。产率0.43g(60%)。1h nmr(dmso-d6,500mhz):δ8.4(s,1h),8.1(s,1h),2.7(s,3h)。
[0449]
步骤2:1-[6-氯-4-(三氟甲基)-2-吡啶基]乙酮肟
[0450]
向1-[6-氯-4-(三氟甲基)-2-吡啶基]乙酮(0.6g,2.68mmol)在meoh(6ml)中的溶液中加入盐酸羟胺(0.2g,4mmol)和吡啶(0.42g,5mmol)。将反应在回流下搅拌2小时。将混合物浓缩并在etoac(10ml)和水(10ml)之间分配。分离有机相,用盐水(20ml)洗涤,经na2so4干燥并浓缩。通过柱层析(庚烷中的30% etoac)纯化粗物质,得到1-[6-氯-4-(三氟甲基)-2-吡啶基]乙酮肟。产率0.32g(50.4%)。1h nmr(dmso-d6,500mhz):δ12.1(s,1h),8.0(s,2h),2.2(s,3h)。
[0451]
步骤3:(2e)-2-[2-[[(e)-1-[6-氯-4-(三氟甲基)-2-吡啶基]亚乙基氨基]氧基甲基]-3-甲基-苯基]-2-甲氧亚氨基乙酸甲酯
[0452]
向1-[6-氯-4-(三氟甲基)-2-吡啶基]乙酮肟(0.32g,1.34mmol)在dmf(4ml)中的溶液中加入(2e)-2-[2-(溴甲基)-3-甲基-苯基]-2-甲氧亚氨基-乙酸甲酯(0.4g,1mmol)和碳酸铯(0.87g,3mmol)。将混合物在25℃下搅拌16小时,用水(40ml)淬灭并用etoac(40ml)萃取。分离有机层,用盐水(30ml)洗涤,经na2so4干燥,浓缩并通过柱层析纯化(庚烷中的0
–
20%etoac),得到(2e)-2-[2-[[(e)-1-[6-氯-4-(三氟甲基)-2-吡啶基]亚乙基氨基]氧基甲基]-3-甲基-苯基]-2-甲氧亚氨基-乙酸甲酯,为白色固体。产率0.33g(54.7%)。1h nmr(dmso-d6,500mhz):δ8.01(s,1h),7.4(m,1h),7.35-7.26(m,2h),7.03-7.0(m,1h),5.23(br s,2h),4.02(s,3h),3.83(s,3h),2.49(s,3h),2.23(s,3h)。
[0453]
步骤4:(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[4-(三氟甲基)-6-乙烯基-2-吡啶基]-亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0454]
向(2e)-2-[2-[[(e)-1-[6-氯-4-(三氟甲基)-2-吡啶基]亚乙基氨基]氧甲基]-3-甲基-苯基]-2-甲氧亚氨基-乙酸甲酯(0.11g,0.24mmol)在二烷(1.4ml)和水(0.6ml)中
的溶液中加入(dppf)pdcl2(0.009g,0.012mmol)、碳酸钾(0.066g,0.48mmol)和三氟(乙烯基)硼烷钾(0.064g,0.48mmol)。将反应混合物回流1.5小时并通过tlc(庚烷中的30%etoac)监测。使反应达到室温并用水(50ml)淬灭。混合物用etoac(50ml)萃取。有机层用盐水洗涤,经na2so4干燥并真空浓缩。通过柱层析(庚烷中的0-30% etoac)纯化粗物质,得到标题化合物。产率0.085g(76.2%)。1h nmr(dmso-d6,500mhz):δ8.01(s,1h),7.47(m,1h),7.35-7.26(m,2h),7.03-7.0(m,1h),6.86-6.80(m,1h),6.38-6.35(d,1h),5.58-5.56(d,1h),5.18(br s,2h),4.02(s,3h),3.82(s,3h),2.50(s,3h),2.30(s,3h)。
[0455]
实施例138:(2e)-2-甲氧亚氨基-n-甲基-2-[3-甲基-2-[[(e)-1-[4-(三氟甲基)-6-乙烯基-2吡啶基]亚乙基氨基]氧基甲基]苯基]乙酰胺
[0456][0457]
向(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[4-(三氟甲基)-6-乙烯基-2-吡啶基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯(0.28g,0.62mmol)在thf(8ml)中的溶液中加入甲胺(~33%,在水中,1.2ml)。将混合物在25℃下搅拌3小时。反应用etoac稀释并用水洗涤。分离有机层并用盐水洗涤,经na2so4干燥并真空浓缩。通过柱层析(庚烷中的30% etoac)纯化粗物质,得到标题化合物。产率0.25g(99.3%)。1h nmr(dmso-d6,500mhz):δ8.23-8.22(s,1h),7.92-7.88(m,2h),7.31-7.27(m,2h),6.98-6.92(m,2h),6.48-6.45(d,1h),5.66-5.63(d,1h),5.12(br s,2h),3.86(s,3h),2.67(s,3h),2.50(s,3h),2.22(s,3h)。
[0458]
实施例117:(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[2-甲基-5-(三氟甲基)吡唑-3-基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0459][0460]
步骤1:2-甲基-5-(三氟甲基)-1h-吡唑-3-酮
[0461]
向4,4,4-三氟-3-氧代-丁酸乙酯(1.5g,8.1mmol)在乙醇(20ml)中的溶液中加入甲基肼(0.45g,10mmol)、吡啶(1.41g,18mmol)和h2so4(1ml)。将反应混合物在rt下搅拌2小时。反应用etoac(10ml)稀释,用水洗涤,然后用盐水洗涤,经na2so4干燥并真空浓缩。通过柱层析(庚烷中的15-20% etoac)纯化粗物质,得到2-甲基-5-(三氟甲基)-1h-吡唑-3-酮。产率0.4g(29.4%)。1h nmr(dmso-d6,500mhz):δ11.69(s,1h),5.72(s,1h),3.59(s,3h)。
[0462]
步骤2:[2-甲基-5-(三氟甲基)-1,3-二氢吡唑-3-基]三氟甲磺酸酯
[0463]
在0℃下向2-甲基-5-(三氟甲基)-1h-吡唑-3-酮(0.8g,5mmol)在dcm(10ml)中的溶液中加入三乙胺(0.13g,5.7mmol),然后将混合物搅拌10分钟。使反应达到室温,加入双(三氟甲基)磺酸酐(1.63g,5.7mmol)并搅拌30分钟。将反应用etoac(10ml)稀释并用水、盐水洗涤并分离有机层。有机层经na2so4干燥并真空浓缩。通过柱层析(庚烷中的15-20% etoac)作为洗脱剂纯化粗物质,得到[2-甲基-5-(三氟甲基)-1,3-二氢吡唑-3-基]三氟甲磺酸酯。产率53.0g(83%)。1h nmr(dmso-d6,500mhz):δ7.11(s,1h),3.91(s,3h)。
[0464]
步骤3:1-[2-甲基-5-(三氟甲基)吡唑-3-基]乙酮
[0465]
向[2-甲基-5-(三氟甲基)-1,3-二氢吡唑-3-基三氟甲磺酸酯(0.3g,1mmol)在二烷(10ml)中的溶液中加入pdcl2(dppf)(0.002g,0.1mmol)和三丁基(1-乙氧基乙烯基)锡烷(0.54g,2mmol)并将反应回流。1小时后,使反应达到室温并加入1n hcl水溶液(2.5ml)并继续反应1小时。反应混合物用etoac(30ml)稀释。分离有机层,用盐水(20ml)洗涤,经na2so4干燥并真空浓缩。通过柱层析(庚烷中的5-30% etoac)纯化粗物质,得到1-[2-甲基-5-(三氟甲基)-吡唑-3-基]乙烯酮。产率0.43g,(60%)。
[0466]
步骤4:1-[2-甲基-5-(三氟甲基)吡唑-3-基]乙酮肟
[0467]
向1-[6-(三氟甲基)嘧啶-4-基]乙酮(1.2g,6mmol)在meoh(20ml)中的溶液中加入盐酸羟胺(0.19g,1.2mmol)和吡啶(0.98g,1.2mmol)并在回流下搅拌3小时。将混合物浓缩并溶解在etoac(10ml)中。用水、盐水洗涤etoac萃取物,经硫酸钠干燥并真空浓缩。通过柱层析(庚烷中的30%etoac)纯化粗物质,得到1-[2-甲基-5-(三氟甲基)吡唑-3-基]乙酮肟。产率0.45g(34.8%)。1h nmr(dmso-d6,500mhz):δ11.68(s,1h),7.01(s,1h),3.96(s,3h),2.09(s,3h)。
[0468]
步骤5:(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[2-甲基-5-(三氟甲基)吡唑-3-基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯
[0469]
向1-[2-甲基-5-(三氟甲基)吡唑-3-基]乙酮肟(0.52g,2.5mmol)在dmf(10ml)中的溶液中加入(2e)-2-[2-(溴甲基)-3-甲基-苯基]-2-甲氧亚氨基-乙酸甲酯(0.8g,2.7mmol)和cs2co3(1.63g,5.02mmol)。将反应混合物在25℃下搅拌6小时。反应用水(30ml)稀释并用etoac(40ml)萃取。分离有机层并用盐水(30ml)洗涤,经na2so4干燥并真空浓缩。通过柱层析(庚烷中的30% etoac)纯化粗物质,得到标题化合物,为白色固体。产率0.52g(48.1%)。1h nmr(dmso-d6,500mhz):δ7.32-7.28(m,2h),7.04-7.02(m,1h),5.07(br s,2h),3.90(s,3h),3.86(s,3h),3.67(s,3h),2.42(s,3h),2.1(s,3h)。
[0470]
实施例118:(2e)-2-甲氧亚氨基-n-甲基-2-[3-甲基-2-[[(e)-1-[2-甲基-5-(三氟-甲基)吡唑-3-基]亚乙基氨基]氧剂甲基]苯基]乙酰胺
[0471][0472]
向(2e)-2-甲氧亚氨基-2-[3-甲基-2-[[(e)-1-[2-甲基-5-(三氟甲基)吡唑-3-基]亚乙基氨基]氧基甲基]苯基]乙酸甲酯(0.41g,0.96mmol)在thf(10ml)中的溶液中加入甲胺(~33%,在水中,2ml)。将混合物在25℃下搅拌5小时。反应用h2o(10ml)和etoac(25ml)稀释。分离有机层并用盐水洗涤,经na2so4干燥并真空浓缩。通过柱层析(庚烷中的30% etoac)纯化粗物质,得到标题化合物。产率0.4g(99.8%)。1h nmr(dmso-d6,500mhz):δ8.23-8.22(d,1h),7.28-7.27(m,2h),7.12(s,1h),6.96
ꢀ‑
6.95(m,1h),5.07(br s,2h),3.86(s,3h),2.66(s,3h),2.51(s,3h),2.41(s,3h),2.10(s,3h)。
[0473]
表s中的以下实施例如上所述合成并如表l中所述通过lcms表征,对于化合物实施例1-159使用方法a,而对于化合物实施例160-164使用方法b。
[0474]
表l:lcms方法
[0475][0476]
表s:
[0477]
[0478]
[0479]
[0480]
[0481]
[0482]
[0483]
[0484][0485]
生物学研究
[0486]
a.温室
[0487]
将该化合物溶于溶剂/乳化剂比例(体积)为99/1的丙酮和/或二甲亚砜和基于乙氧基化烷基酚的润湿剂/乳化剂wettol的混合物中,得到5ml的总体积。然后加入水至总体积为100ml。然后用所述溶剂-乳化剂-水混合物稀释该储备溶液至下表中给出的最终浓度。
[0488]
应用实施例1.在大豆上对由豆薯层锈菌引起的大豆锈病(phakpa p2)的保护性防治
[0489]
用含有浓度如下所述的活性成分或混合物的前述喷雾溶液将盆栽大豆秧苗的叶片喷雾至滴流。使植株风干。将试验植株在温室中于23-27℃和60-80%的相对湿度下栽培2天。然后对植株接种豆薯层锈菌的孢子。所用菌株在线粒体细胞色素b蛋白中含有赋予对qo抑制剂的耐受性的氨基酸替代f129l。为了确保人工接种成功,将植株转移至相对湿度约
95%和20-24℃的潮湿室中达24小时。然后将试验植株在温室中于23-27℃和60-80%的相对湿度下栽培高达14天。以患病叶面积%肉眼评价叶片上的真菌侵袭程度,未处理对照的病害水平通常高于85%。
[0490]
应用实施例2.在大豆上对由豆薯层锈菌引起的大豆锈病(phakpa p6)的保护性防治
[0491]
用含有浓度如下所述的活性成分的前述喷雾溶液将盆栽大豆秧苗的叶片喷雾至滴流。使植株风干。将试验植株在温室中于23-27℃和60-80%的相对湿度下栽培6天。然后对植株接种豆薯层锈菌的孢子。所用菌株在线粒体细胞色素b蛋白中含有赋予对qo抑制剂的耐受性的氨基酸替代f129l。为了确保人工接种成功,将植株转移至相对湿度约95%和23-27℃的潮湿室中达24小时。然后将试验植株在温室中于23-27℃和60-80%的相对湿度下栽培高达14天。以患病叶面积%肉眼评价叶片上的真菌侵袭程度,未处理对照的病害水平通常高于85%。
[0492]
上述应用实施例的结果在表1中给出。对于防治在线粒体细胞色素b蛋白中含有赋予对qo抑制剂的耐受性的氨基酸替代f129l的植物病原性真菌给出下列所有测试结果。
[0493]
表1:
[0494]
[0495]
[0496]
[0497]
[0498]
[0499]
[0500]
[0501]
[0502]
[0503]
[0504]
[0505][0506]
b.微试验
[0507]
将活性化合物分开在二甲亚砜中配制成浓度为10000ppm的储备溶液。将储备溶液根据比例混合,用移液管移到微滴定板(mtp)中并用水稀释至所述浓度。
[0508]
在加入如下面所述的相应真菌孢子悬浮液之后,将各板置于温度为18℃的水蒸气饱和室中。接种7天后使用吸收光度计在405nm下测量mtp。
[0509]
应用实施例3.对灰霉病灰葡萄孢(botrci)的活性
[0510]
使用灰葡萄孢在生物麦芽或酵母-细菌蛋白胨-乙酸钠水溶液中的孢子悬浮液。
[0511]
应用实施例4.对小麦叶枯病病原体小麦壳针孢(septtr)的活性
[0512]
使用小麦壳针孢在生物麦芽或酵母-细菌蛋白胨-甘油或dob水溶液中的孢子悬浮液。
[0513]
应用实施例5.对晚疫病病原体致病疫霉(phytin)的活性
[0514]
使用含有基于豌豆汁的水性营养培养基或ddc培养基的致病疫霉孢子悬浮液。
[0515]
应用实施例6.对大刀镰孢(fusacu)的活性
[0516]
使用大刀镰孢在生物麦芽或酵母-细菌蛋白胨-甘油或dob水溶液中的孢子悬浮液。
[0517]
将测量参数与不含活性化合物的对照方案的生长(100%)和不含真菌的空白值相比较,以确定相应活性化合物中病原体的相对生长%。
[0518]
表2:
[0519]
[0520]
[0521]
[0522]
[0523]
[0524]
[0525]
[0526]
[0527]
[0528][0529]
对比试验
[0530]
表c1:
[0531][0532]
表c1中的结果表明与其中位置r3未被取代且末端环为苯基的肟菌酯相比,在r3位置的特定取代基与末端杂芳基环一起改善了对在线粒体细胞色素b蛋白中含有赋予对qo抑制剂的耐受性的氨基酸替代f129l的植物病原性真菌的杀真菌活性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1