一种斑兰叶组织培养基及组织培养快速繁殖方法
1.本发明涉及植物组织培养技术领域,尤其涉及一种斑兰叶组织培养基及组织培养快速繁殖方法。
背景技术:
2.斑兰叶(pandanus amaryllifolius)是露兜树科露兜树属多年生草本植物,又名斑斓叶、香兰叶、板兰叶,原产于印度尼西亚马鲁古群岛,我国上世纪50年代引种并在海南试种成功,目前主栽于海南、云南,且广东、台湾等省也有少量种植。斑兰叶叶片富含角鲨烯、亚油酸、草蒿脑和甾醇等活性成分,主要香气成分为2-乙酰-1-吡咯啉,散发出一种特殊香气——粽香,被誉为“东方人的香草”。由于斑兰叶具有增强细胞活力、加快新陈代谢、提高人体免疫力的作用,且是制作糕点、冰淇淋、糖果等的纯天然食品原料,同时在美化环境、芳香居室等方面有诸多应用,具有重要的经济价值和开发前景。
3.由于市场对斑兰叶的需求在急速增长,导致种苗供不应求。目前,斑兰叶种苗繁殖主要有茎蔓扦插繁殖和根蘖苗繁殖两种方式,但它们都存在周期长,繁殖效率低下等问题,加之目前斑兰叶叶片价格高,导致种植户多不愿意分蘖繁苗。组织培养快速繁殖系统是在果树、花卉、药材等农业领域应用广泛的方法,具有性状稳定、可批量操作、繁殖速度快等优点。斑兰叶的组织培养快速繁殖相关的报道到目前为止报道不多,王景飞等以香露兜地面茎为外植体,构建快速繁殖体系,获得再生植株;吉训志等以地上茎、叶片、侧芽为外植体,通过不同培养条件,只有侧芽获得愈伤,并对愈伤抗氧化酶活力进行了检测。本发明以斑兰叶侧芽为外植体,探讨外植体大小、表面灭菌时间和方法、增殖培养基的组成、生根培养基的组成等对斑兰叶快速繁殖的影响,建立相关组织培养快速繁殖体系,以期为突破和缓解生产大量且亟需高品质斑兰叶苗的现状,促进产业健康迅速发展,同时也为斑兰叶新品种选育和繁殖提供理论依据。
技术实现要素:
4.本发明的目的在于克服现有技术中的不足,提供一种斑兰叶组织培养基及组织培养快速繁殖方法,能够快速、低成本地繁殖斑兰叶组培优质苗。
5.本发明的第一个方面是提供一种斑兰叶继代培养基,以ms为基本培养基,每升培养基中添加naa 0.05-1mg、6-ba 2-4mg。
6.优选地,所述每升斑兰叶继代培养基中添加naa 0.05mg、6-ba 2-4mg。
7.进一步优选地,每升斑兰叶继代培养基中添加naa 0.05mg、6-ba 3-4mg。
8.更进一步优选地,每升斑兰叶继代培养基中添加naa 0.05mg、6-ba 3mg。
9.优选地,所述斑兰叶继代培养基中添加有新鲜斑兰叶的叶汁或叶汁的冻干粉。
10.新鲜斑兰叶的叶汁是通过新鲜斑兰叶片添加少量水榨汁后过滤得到。将叶汁冻干即可得到新鲜斑兰叶的叶汁的冻干粉。
11.进一步优选地,每升斑兰叶继代培养基中添加有1-2g新鲜斑兰叶的叶汁或叶汁的
冻干粉。
12.本发明的第二个方面是提供一种斑兰叶丛芽诱导培养基,以ms为基本培养基,每升培养基中添加tdz 0-0.1mg、6-ba 1-3mg。
13.优选地,每升斑兰叶丛芽诱导培养基中添加tdz 0.1mg、6-ba 1-3mg。
14.进一步优选地,每升斑兰叶丛芽诱导培养基中添加tdz 0.1mg、6-ba 2-3mg。
15.更进一步优选地,每升斑兰叶丛芽诱导培养基中添加tdz 0.1mg、6-ba 2mg。
16.本发明的第三个方面是提供一种斑兰叶生根培养基,以1/2ms为基本培养基,每升培养基中添加naa 0.1-0.2mg或者添加iba 0.1-0.2mg。
17.优选地,每升斑兰叶生根培养基中添加naa 0.2mg。
18.本发明的第四个方面是提供一种斑兰叶组培培养基组合,其特征在于,其包括本发明第一个方面所述的斑兰叶继代培养基、本发明第二个方面所述的斑兰叶丛芽诱导培养基和本发明第三个方面所述的斑兰叶生根培养基。
19.本发明的第五个方面是提供一种斑兰叶组培快速繁殖方法,采用本发明第一个方面所述的斑兰叶继代培养基进行继代培养。
20.优选地,所述斑兰叶组培快速繁殖方法包括以下步骤:(1)外植体选取:选取无明显病害、长势健壮、分蘖旺盛的种斑兰叶母株,取下完整侧芽为外植体;(2)外植体表面灭菌处理;
21.(3)丛芽诱导增殖培养:将外植体切段或切片接种到权利要求4所述的斑兰叶丛芽诱导培养基中,培养4周左右;(4)继代培养:将丛芽诱导增殖培养后的从芽接种到权利要求1-3 中任意一项所述的斑兰叶继代培养基中,培养4周左右;(5)生根培养:将继代培养后的幼芽或从芽接种到权利要求5所述的斑兰叶生根培养基种,培养培养4周左右;(6)幼苗移栽。
22.其中,选取的外植体大小为0.5-4cm左右,优选为2-4cm左右,进一步优选为2cm左右。
23.其中,外植体表面灭菌处理时,采用70%乙醇灭菌30s-3min,0.1%升汞灭菌3-10min,优选采用70%乙醇灭菌1-3min,0.1%升汞灭菌5-10min,进一步优选采用70%乙醇灭菌3min, 0.1%升汞灭菌10min。
24.进一步优选地,选取的外植体为2cm左右,且外植体表面灭菌处理时采用70%乙醇灭菌 3min,0.1%升汞灭菌10min。
25.优选地,移栽基质选用重量比1:1的黄泥和黑土,或者重量比1:1:1的黄泥、椰糠和黑土。
26.本发明的有益效果:
27.(1)本发明的斑兰叶丛芽诱导培养基启动增殖快,能够使外植体容易形成多芽体,生长发育迅速;
28.(2)本发明的斑兰叶继代培养基针对性强,实用性好,能够有效提高增殖率,分化苗健壮,生长迅速,能较好兼顾愈伤扩增和幼芽扩繁,四周增殖率可高达5.56,添加斑兰叶粉能进一步提高增殖效率,能将增殖效率提高至6.42;
29.(3)本发明的斑兰叶生根培养基,生根效率高,可高达99%,根生长发育状态好,能满足生产上的需要;
30.(4)本发明以斑兰叶幼嫩侧芽作为外植体较好,污染少,启动增殖快,表面灭菌方法较好,污染率小、褐化程度低,斑兰叶丛芽诱导培养启动增殖快,斑兰叶继代培养增殖效率高,斑兰叶生根培养生根效率高,根生长发育状态好,可使斑兰叶组培苗快速大量繁殖,可实现规模化生产,推动斑兰叶种植业大力发展,促使以斑兰叶原料为依托的药品、保健食品、观赏花卉等相关产业发展。
附图说明
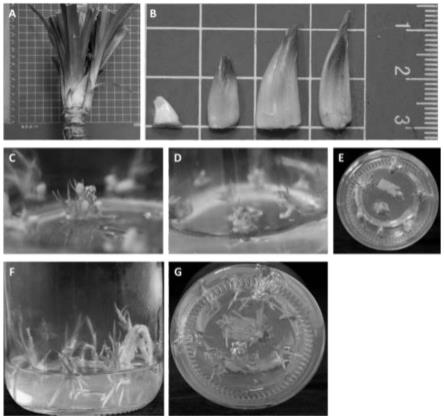
31.图1为本发明斑兰叶组织培养快速繁殖过程。其中,图a:斑兰叶侧芽;图b:斑兰叶侧芽大小;图c:斑兰叶丛芽诱导增殖培养;图d:斑兰叶多芽体继代培养;图e:斑兰叶多芽体继代培养侧视图;图f:斑兰叶幼芽生根培养;图g:斑兰叶幼芽生根培养侧视图。
具体实施方式
32.下面参照附图,结合具体的实施例对本发明作进一步的说明,以更好地理解本发明。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
33.1材料
34.选取海南儋州那大镇宝岛新村附近多年生斑兰叶作为母株,移栽到海南热作两院种业科技有限责任公司苗圃,经过连续一年观察,选取长势旺盛,粽香浓郁的母株作为组织培养起始材料。植株植物学特征经过吴琼研究员鉴定。
35.2数据及图像处理和分析方法
36.采用sas软件程序进行差异显著性检验,用microsoft excel进行作图。图像采集使用佳能eos 750d相机。
37.3方法与实验结果
38.3.1外植体选取
39.选取斑兰叶侧芽为外植体,外植体根据大小分为三种,及0.5-1.0cm左右、2.0cm左右、 3-4cm左右。取材前注意遮荫和覆盖防雨网,于连续天晴数天后,在苗圃中选取无明显病害、长势健壮、分蘖旺盛的母株,取下完整侧芽为外植体,带回实验室备用。
40.3.2外植体表面灭菌
41.外植体经过自来水连续冲洗30min洗去表面泥土和杂质后,吸干表面多余水分,置于超净工作台备用。表面灭菌方法:(1)70%乙醇30s,0.1%升汞3min;(2)70%乙醇1min,0.1%升汞5min;(3)70%乙醇3min,0.1%升汞10min。外植体表面灭菌后,无菌水冲洗3-5次,每次1-2min,超净台中用吸水纸吸干多余水分后,接种于ms培养基上,每个处理接种外植体数量不少于30个,一周后统计污染率以及褐化情况。
42.污染率(%)=污染外植体数量/接种外植体数量
×
100%。
43.对斑兰叶不同大小外植体通过不同表面灭菌处理,接种于ms培养基上7天之后,统计污染率和褐化程度发现,外植体大小在2cm左右,灭菌方法(3):70%乙醇3min,0.1%升汞10min 的效果较好,污染率低,为2.5%,褐化程度中等;不同大小外植体褐化程度与灭菌时间正相关,外植体越小,灭菌时间越长,褐化程度越严重。
44.表1不同大小外植体经过不同表面灭菌方法后污染率及褐化程度统计
[0045][0046]
3.3丛芽诱导增殖培养
[0047]
斑兰叶吸芽经过表面灭菌和切割后,接种到不同的丛芽诱导培养基a-f中进行丛芽诱导培养。丛芽诱导培养基a-f分别以ms为基础培养基,添加适量激素(如表2所示)。以2cm 大小的侧芽为外植体,每个组合不少于25个外植体,接种4周后统计启动诱导率、褐化程度,四周后统计增殖系数及增殖芽分化生长情况,筛选并优化丛芽诱导启动增殖培养基。
[0048]
结果如表3所示。通过统计分析发现:组合e启动诱导率高达96.3%,优于其它五种组合,同时增殖系数最高,高达4.76,褐化程度最轻,愈伤翠绿色、丛芽饱满、叶脉清晰、叶片翠绿色、茎节清晰;随着6-ba浓度的提高,诱导率和增殖系数都有提高,褐化程度减轻,但容易导致丛芽分化的幼芽纤细、叶脉不清、茎节瘦长;tdz能有效提高诱导率和增殖系数,减轻褐化程度。
[0049]
增殖系数=接种四周后愈伤块上丛芽数目/接种愈伤块上的丛芽数目(每个组合统计不少于 15个带丛芽的愈伤块)。
[0050]
诱导率=启动增殖外植体数量/接种外植体数量
×
100%。
[0051]
表2不同丛芽诱导培养基的激素浓度组成
[0052] abcdeftdz(mg/l)0000.10.10.16-ba(mg/l)123123
[0053]
表3不同丛芽诱导培养基对斑兰叶诱导率的影响
[0054][0055]
3.4继代培养
[0056]
以丛芽诱导增殖培养后的丛芽为材料,将其接种到不同的继代培养基a-f中进行继代培养。继代养基a-f分别以ms为基础培养基,添加适量激素(如表4所示)。四周后统计启动增殖比率和增殖系数,观察丛芽生长状态,每个组合统计丛芽块不少于50个。结果如表5所示,继代培养基b增殖系数最高,达5.56,且愈伤较少、呈翠绿色、较紧实,愈伤上附着丛芽饱满、叶脉清晰、叶片翠绿色、茎节清晰,暗示苗发育良好,上述结果表明该培养基的激素浓度比较适宜作为继代培养基使用。
[0057]
我们的研究还发现,通过在培养基中添加一定比例的斑兰叶汁,能进一步提高增殖效率。取新鲜斑兰叶片10克添加少量水榨汁后过滤,定容至100ml制成斑兰叶汁,备用。应当理解的是,在实践中,根据应用情形,也可以将新鲜斑兰叶片添加少量水榨汁后过滤,冻干制成斑兰叶冻干粉进行应用。
[0058]
配置继代培养基g-l:
[0059]
继代培养基g:ms培养基;
[0060]
继代培养基h:以ms为基础培养基,每升培养基添加过滤斑兰叶汁10ml(即每升培养基中添加1g新鲜斑兰叶片的叶汁);
[0061]
继代培养基i:以ms为基础培养基,每升培养基添加过滤斑兰叶汁20ml(即每升培养基中添加2g新鲜斑兰叶片的叶汁);
[0062]
继代培养基j:以ms为基础培养基,每升培养基添加6-ba 3mg和naa 0.05mg;
[0063]
继代培养基k:以ms为基础培养基,每升培养基添加6-ba 3mg、naa 0.05mg和过滤斑兰叶汁10ml(即每升培养基中添加1g新鲜斑兰叶片的叶汁);
[0064]
继代培养基l:以ms为基础培养基,每升培养基添加6-ba 3mg、naa 0.05mg和过滤斑兰叶汁20ml(即每升培养基中添加2g新鲜斑兰叶片的叶汁)。
[0065]
以丛芽诱导增殖培养后的丛芽为材料,将其接种到继代培养基g-l中进行继代培养,四周后统计率和增殖系数,观察丛芽生长状态,每个组合统计丛芽块不少于50个。结果如表6所示,培养基中单独添加新鲜斑兰叶片的叶汁可以提高丛芽的增殖系数,但对比单独激素提高增殖系数的效率低,激素提高的效率要明显高于斑兰叶粉;培养基中添加斑兰叶汁能明显的改善斑兰叶幼苗的营养生长,促进叶片发育和茎节发育,有利于后期幼苗生根和移栽;每升培养基中添加2g新鲜斑兰叶片的叶汁提高丛芽增殖效率高于每升培养基中添加1g新鲜斑兰叶片的叶汁,添加新鲜斑兰叶片的叶汁可以由单独添加激素的5.56提高到
6.42,显著加快斑兰叶的增殖进程。
[0066]
增殖系数=接种四周后愈伤块上丛芽数目/接种愈伤块上的丛芽数目(每个组合统计不少于 15个带丛芽的愈伤块)。
[0067]
表4不同继代培养基的激素浓度组成
[0068] abcdefnaa(mg/l)0.050.050.050.10.10.16-ba(mg/l)234234
[0069]
表5继代培养基a-f对斑兰叶丛芽增殖的影响
[0070][0071][0072]
表6添加斑兰叶粉对不同继代培养基丛芽增殖的影响
[0073][0074]
注:本表中的培养基j与表5中的继代培养基b为同一培养基,对应的增殖系数是两次实验的结果,略微存在差异,属于正常现象。
[0075]
3.5生根培养
[0076]
以继代培养后1-1.5cm左右的再生丛芽为材料,接种于不同生根培养基上(r1:1/2ms;r2:1/2ms+naa 0.1mg/l;r3:1/2ms+naa 0.2mg/l;r4:1/2ms+iba 0.1mg/l;r5:1/2 ms+iba 0.2mg/l),生根4周后,统计生根效率,平均生根条数,平均生根长度等指标,每种生根培养基接种数量不少于50株,筛选并优化斑兰叶组培苗的生根培养条件。
[0077]
以斑兰叶生长发育良好的幼芽为材料,选用1-1.5cm长,带有1-2个茎节,叶片展开,叶脉清晰的幼苗接种在r1-r3三种生根培养基,每个组合不少于50株,筛选比较适宜于
斑兰叶快繁苗生根的培养基。斑兰叶幼芽接入生根培养基4周后,统计生根率,平均生根条数,平均生根长度,根生长发育等情况。
[0078]
生根率(%)=生根丛芽数/接种丛芽数
×
100%。
[0079]
表7不同培养基对斑兰叶幼芽生根的影响
[0080][0081]
通过实验发现:r1、r2、r3三种培养基均能有效促进幼芽生根,生根率分别高达83%、 98%、99%,r2、r3能明显促进生根,且显著高于r1;从平均生根条数和平均生根长度看, r2、r3明显超过r1,r2和r3相比,平均生根条数和平奖生根长度没有差异,但r3中根粗壮且坚硬,容易将芽顶起与培养基分离,不利于再生幼苗进一步生长;r4、r5生根率、平均生根条数和平均生根长度与略高于r2、r3,但没有明显的区别,生产上iaa价格高于naa,为节约生产成本考虑,选用r2作为生根培养基较好。三种生根培养基4周后均未发现根褐化现象。综合考虑生产成本等问题,选用r2为斑兰叶的生根培养基比较适宜。
[0082]
3.6幼苗移栽
[0083]
将生根培养后的组培苗在户外炼苗一周(避免日光直接暴晒,最好在树荫下或者在 70%-80%遮荫度的阴棚下),进行移栽。移栽前洗去附着在根部的培养基,并用1000倍稀释的 30%多菌灵粉剂浸泡5-10分钟后移栽。移栽基质选用比较常见的几种组合,及河沙、椰糠和黑土等比混合、黄土和黑土等比混合、黄土和椰糠以及黑土等比混合,移栽一个月后统计存活率、观察根部发育情况、茎及叶片发育情况,筛选移栽基质适宜的配方。统计发现,移栽基质选用等比黄泥、椰糠和黑土混合较佳,一个月存活率最高,为98.5%,综合根部发育情况和茎及叶片生长情况,发现该组合苗生长较为健壮,根系恢复快且发达。每周补施一次千分之一的复合肥,促进幼苗生长,3个月后株高能达到10-12cm,可以作为成苗出圃。
[0084]
存活率(%)=存活幼苗数/移栽幼苗数
×
100%。
[0085]
表8:不同基质对移栽斑兰叶幼苗存活率及生长发育情况的影响
[0086]
[0087][0088]
以上对本发明的具体实施例进行了详细描述,但其只作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对该实用进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1