二亚苯基碘鎓氯化物用于类风湿关节炎模型造模的用途、类风湿关节炎模型造模方法
1.本发明属于生物技术领域,具体涉及二亚苯基碘鎓氯化物用于类风湿关节炎模型造模的用途、类风湿关节炎模型造模方法。
背景技术:
2.类风湿关节炎(rheumatoid arthritis,ra)是一种自身免疫性疾病,表现为对称小关节的慢性关节滑膜炎症,而且以炎症的持续反复发作为主要特征。ra完整的发病机制并不明确,其病程表现为关节滑膜增生和血管翳形成,继而造成关节软骨的破坏,最终导致骨、关节坏死从而致残。目前国内外展开了很多相关药物治疗的研究,实验动物模型的合理选择成为ra研究的基本保证。常用模型多为啮齿类动物,这类模型具有以下优点:体型较小、适合群养,价格优惠可以减少研究投入;大/小鼠和人的关节炎易感基因型高度一致,通过现代基因修饰技术对模型动物的改良可以阐明免疫介导的关节炎分子作用机制;造模操作规程简单成熟,方便实验重复。诱导式关节炎模型可根据造模物质的不同进行分类,常见的有佐剂诱导型(adjuvant-induced arthritis,aa)、胶原诱导型(collagen-induced arthritis,cia)和胶原抗体诱导型关节炎(collagen antibody induced arthritis,caia)。其中大鼠cia模型的组织和免疫学改变与人ra最接近,ra模型的病情表现最为显著和持久。
3.cia模型是由trentham等于1977年首次建立的实验性关节炎动物模型。通过皮下注射ⅱ型胶原和等量cfa的混合液来建造,来源于鸡、小牛和大鼠的ⅱ型胶原均能引起关节炎症。cia是mhc相关型,以t/b淋巴细胞介导的关节炎症侵蚀为主要特征。
4.二亚苯基碘鎓氯化物(diphenyleneiodonium chloride,dpi),又称氯化二亚苯基碘鎓,属于联苯碘类化合物,最早发现其具有抑制糖异生的效应,可导致血糖降低。后续研究发现,该化合物的药理作用主要与其抑制nadph氧化酶的活性,进而抑制呼吸链有关。研究表明,氯化二亚苯基碘鎓可能通过与nadph氧化酶的黄素基团发生相互作用而抑制相应电子转运体,从而抑制电子传递和活性氧(ros)产生。
5.目前未见dpi用于类风湿关节炎模型造模的应用报道。
技术实现要素:
6.本发明的目的是为了提供二亚苯基碘鎓氯化物用于类风湿关节炎模型造模的用途、类风湿关节炎模型造模方法。
7.本发明上述目的通过如下技术方案实现:
8.二亚苯基碘鎓氯化物用于类风湿关节炎动物模型造模的用途。
9.二亚苯基碘鎓氯化物用于制备类风湿关节炎动物模型造模剂的用途。
10.一种类风湿关节炎模型造模方法,在造模初始时按胶原诱导型类风湿关节炎模型造模方法对模型动物诱导1次,在后续造模时间内使用二亚苯基碘鎓氯化物对模型动物诱
导强化。
11.优选地,按胶原诱导型类风湿关节炎模型造模方法对模型动物诱导的物质中含ⅱ型胶原。
12.更优选地,按胶原诱导型类风湿关节炎模型造模方法对模型动物诱导的物质中还含有灭活结合分枝杆菌的完全弗氏佐剂。
13.更优选地,所述模型动物为小鼠。
14.更优选地,在造模初始时按胶原诱导型类风湿关节炎模型造模方法对模型动物诱导1次后,每日腹腔注射100ng/kg二亚苯基碘鎓氯化物,连续注射42天。
15.有益效果:
16.本发明发现,二亚苯基碘鎓氯化物可以有效提高类风湿关节炎模型的诱导效率,ⅱ型胶原诱导1次结合二亚苯基碘鎓氯化物增强对模型鼠的类风湿关节炎的诱导效率显著优于传统ⅱ型胶原诱导多次。本领域技术人员知道,二亚苯基碘鎓氯化物nadph氧化酶的抑制剂,可以通过抑制电子传递和活性氧产生发挥抗炎作用。而在本发明中,二亚苯基碘鎓氯化物发挥的作用是强化类风湿关节炎,这种技术效果是让本领域技术人员意料不到的。
附图说明
17.图1为cⅱ/-、cⅱ/cⅱ诱导方案;
18.图2为各组关节炎症状比较;
19.图3为各组关节炎指数评分比较;
20.图4为各组组织炎症性浸润程度比较;
21.图5为各组周围组织中性粒细胞聚集程度比较;
22.图6为各组软骨破坏程度比较;
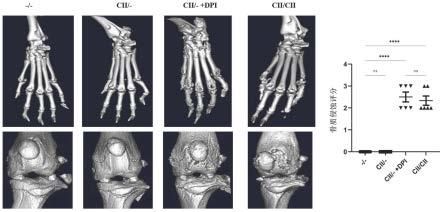
23.图7为各组骨质破坏程度比较。
具体实施方式
24.下面结合附图和实施例具体介绍本发明实质性内容,但并不以此限定本发明的保护范围。
25.一、实验材料
26.耗材:手套,帽子,口罩,小鼠固定器,小鼠耳标及耳标钳,移液枪及枪头,50ml烧杯,200ml烧杯,5ml离心管,2mlep管,冰盒,标记笔,试管架,1ml注射针,棉球,纸巾等。
27.试剂:鸡ⅱ型胶原(cⅱ),灭活结核杆菌,不完全弗氏佐剂(ifa),完全弗氏佐剂(cfa),75%无水乙醇,生理盐水,二亚苯基碘鎓氯化物(diphenyleneiodonium chloride,dpi)等。
28.动物:dba/1小鼠,
♂
性,10-11周,体重(25
±
2)g,spf级,分为4组:
29.分组饲养条件模型诱导数量a(normal)常规饲料喂养不诱导cia模型6只b(cⅱ/-)常规饲料喂养诱导cia模型6只c(cⅱ/-+dpi)常规饲料喂养诱导cia模型6只d(cⅱ/cⅱ)常规饲料喂养诱导cia模型6只
30.其中,cⅱ/-、cⅱ/cⅱ诱导方案如图1所示。
31.设备:超声乳化器、病理切片机、多光谱全自动组织定量分析仪、micro-ct、小动物活体成像系统,冰箱等。
32.二、实验方法
33.1、乳液制备
34.(1)配制4mg/ml的鸡ⅱ型胶原:1.25ml的10mm冰醋酸加入5mg鸡ⅱ型胶原中,置于4℃冰箱摇床中过夜,温和混匀,使其充分溶解,呈透透明状,-20℃保存。
35.(2)配制含1mg/ml灭活结合分枝杆菌的完全弗氏佐剂:50mg灭火结核杆菌加入1.25ml不完全弗氏佐剂中,充分混匀,存于-20℃冰箱备用。
36.(3)cia免疫乳化剂配制:取配制好的4mg/ml的鸡ⅱ型胶原和含1mg/ml灭活结合分枝杆菌的完全弗氏佐剂1:1于5ml离心管中,使用超声乳化器(参数:power30%,working3seconds,pause 3seconds for 10-15min)充分混匀。乳化过程需匀速上下移动5ml离心管,确保各部位均匀充分混匀。乳化后,吸取10μl乳化剂于乘有清水的烧杯中加入一滴乳液,测试乳液的稳定性,直至观察到乳化剂保持圆形,不扩散,为合格。(该过程全程冰上操作)
37.2、cia造模过程
38.(1)注射部位:小鼠固定器固定好小鼠,酒精棉球擦拭尾根部皮肤。
39.(2)注射过程:1ml注射器吸取cia免疫乳化剂,并排出空气。在尾部避开血管的皮下组织进行注射。针尖斜面朝上,以15
°‑
30
°
角度距尾根部1.5-2cm处进针,进针后在平行进针至距尾根部0.5cm-1cm处,注射乳化剂(100μl/只)。注射完成后,拔出针尖,酒精棉球按压2-3秒。
40.(3)加强免疫:在第21天,同样方法加强免疫。
41.(4)免疫计划:
42.a组(normal):正常组,不需进行免疫处理;
43.b组(cⅱ/-):cⅱ免疫1次对照组,仅d0进行免疫;
44.c组(cⅱ/-+dpi):cⅱ免疫1次实验组,仅d0进行免疫;
45.d组(cⅱ/cⅱ):cⅱ免疫2次对照组,d0和d21进行免疫。
46.3、实验处理
47.二亚苯基碘鎓氯化物(diphenyleneiodonium chloride,dpi):一种nadph氧化酶(nox)抑制剂。动物给药方式:腹腔注射(ip)。
48.a组(normal):不处理;
49.b组(cⅱ/-):生理盐水ip 100μl,每日一次,连续42天;
50.c组(cⅱ/-+dpi):dpi ip 100μl(100ng/kg),每日一次,连续42天;
51.d组(cⅱ/cⅱ):生理盐水ip 100μl,每日一次,连续42天。
52.4、关节炎评分标准
53.观察小鼠一般情况,根据小鼠足爪关节肿胀及活动情况进行足爪关节评分,记录小鼠关节病变的严重程度。四足按0-4五级评分,评分相加为小鼠的足爪关节评分,最高16分,评分标准如下。
54.cia足爪关节评分标准
55.分值症状表现0关节无红肿1小趾关节红肿2趾关节和足跖关节红肿3踝关节以下足爪红肿4包括踝关节在内的全部足爪红肿,出现强直
56.注:day 21开始隔天进行足爪关节评分
57.5、滑膜组织炎症性浸润程度测定
58.第42天,腹腔注射10%水合氯醛麻醉小鼠,100μl/只。待小鼠麻醉后,行脱颈处死,取左侧膝关节于4%中性甲醛溶液固定,石蜡包埋,5μm连续切片,常规he染色。用leica光学显微镜拍片观察滑膜组织形态,每个滑膜切片选取5个视野(
×
200),参照以下2个标准进行滑膜组织形态学评分,取其均值。组织评分由本研究组中人员分别独立进行,参与评分人员并不知晓切片对应样本的相关信息。
59.滑膜病理学评分标准
60.分值炎性细胞浸润滑膜细胞增生0无浸润无增生(1-2层)1稀疏散在少量增生(3-4层)2较密集中等增生(5-7层)3大量弥漫大量增生(≥8层)
61.6、滑膜中性粒细胞浸润程度测定
62.5μm石蜡切片常规处理,100ml/l山羊血清封闭,兔抗mpo抗体(1∶100)4℃孵育过夜。hrp标记的山羊抗兔二抗(1∶1000)室温孵育1h,dab试剂盒显色后苏木素复染,中性树脂封片保存。分别对滑膜衬里层和衬里下层mpo的表达进行半定量评分,随机选取5个高倍镜视野(
×
200),根据阳性细胞百分比评分,取其均值。组织评分由本研究组中人员分别独立进行,参与评分人员并不知晓切片对应患者的相关信息。
63.免疫组化评分标准
64.分值阳性细胞百分比0《5%15%-25%226%-50%350%-75%4》75%
65.7、软骨破坏程度测定
66.5μm石蜡切片脱蜡至水后入番红染色液染色1-2h。自来水稍洗,洗去多余染料。切片放入50%、70%、80%梯度酒精脱色各1-2min。接着切片放入固绿染色液中染色1min。无水乙醇脱水两次。二甲苯透明、中性树胶封片。显微镜镜检,图像采集分析。染色判读:软骨呈红色或橙红色,背景绿色。根据以下标准评分,取其均值。组织评分由本研究组中人员分别独立进行,参与评分人员并不知晓切片对应患者的相关信息
67.番红o-固绿染色mankin评分标准
68.分值侵蚀程度0正常1轻微减少2中度减少3重度减少4未着色
69.8、骨质破坏程度测定
70.第42天,腹腔注射10%水合氯醛麻醉小鼠,100μl/只。待小鼠麻醉后,行脱颈处死,取右侧膝关节及足爪于4%中性甲醛溶液固定,micro-ct完成扫描,用analyze 12.0micro-ct分析软件进行足爪及膝关节三维重建,观察关节表面情况,按以下标准进行膝和足关节评分,取其均值。
71.骨质侵蚀评分标准
72.分值侵蚀程度0正常1少量侵蚀,1-2个小浅部位2中等侵蚀,1-4个中等大小和深度部位3重度侵蚀,5个以上部位,局部或完全侵蚀到骨皮质
73.9、数据处理
74.数据采用均值(mean)土标准差(sd)的形式表示,使用graphad prism作图,采用独立样本t检验或单因素方差分析进行统计评价处理组和对照组之间的差异显著性。*p《0.05,**p《0.01,***p《0.001,****p《0.0001表示显著性差异程度。p《0.05认为有统计学意义。
75.三、实验结果
76.1、关节炎症状和关节炎评分
77.关节炎症状如图2所示,关节炎指数评分如表1和图3所示,从结果可以看出与cii/-相比,dpi处理的cii/-组小鼠关节出现明显肿胀。与cii/cii组相比,cii/-+dpi组更早发生关节炎,且关节炎评分更高。
78.表1各组小鼠关节炎指数评分
[0079][0080]
2、组织炎症性浸润程度
[0081]
各组小鼠滑膜组织炎性评分和滑膜增生评分如表2~3和图4所示,从滑膜he染色结果可以看出与cii/-组相比,cii/-+dpi组出现了与cii/cii一样的病理表现,滑膜炎性细胞浸润增强、滑膜细胞增生明显。
[0082]
表2各组小鼠滑膜组织炎性评分
[0083][0084]
表3各组小鼠滑膜增生评分
[0085][0086]
3、周围组织中性粒细胞聚集程度
[0087]
周围组织中性粒细胞聚集程度如表4和图5所示,从滑膜mpo(中性粒细胞标记蛋白)免疫组化结果可以看出cii/-组中有轻微的中性粒细胞浸润,而cii/-+dpi组和cii/cii组伴有明显的中性粒细胞浸润。
[0088]
表4各组小鼠mpo免疫组化评分
[0089][0090]
4、软骨破坏程度
[0091]
软骨破坏程度如表5和图6所示,从番红o-固绿染色结果可以看出正常组和cii/-组未出现软骨异常,而cii/-+dpi组和cii/cii组软骨明显减少。
[0092]
表5各组小鼠番红o-固绿染色评分
[0093][0094]
5、骨质破坏程度
[0095]
骨质破坏程度如表6和图7所示,从micro-ct结果可以看出cii/-+dpi组和cii/cii组伴有明显的骨质破坏。
[0096]
表6各组小鼠骨质侵蚀评分
[0097][0098]
上述实验结果说明,二亚苯基碘鎓氯化物可以有效提高类风湿关节炎模型的诱导
效率,ⅱ型胶原诱导1次结合二亚苯基碘鎓氯化物增强对模型鼠的类风湿关节炎的诱导效率显著优于传统ⅱ型胶原诱导多次。
[0099]
上述实施例的作用在于具体介绍本发明的实质性内容,但本领域技术人员应当知道,不应将本发明的保护范围局限于该具体实施例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1