一种沙子空心李的离体培养方法
1.本发明属于植物离体培养技术领域,具体涉及一种沙子空心李的离体培养方法。
背景技术:
2.沙子空心李长期种植,受病毒、类菌原体的侵染导致树势衰弱,产量下降,对不良条件的抵抗力减弱,品种退化。同时种苗繁殖不规范,将健壮带病毒枝和徒长枝作为接穗繁殖,导致沙子空心李同品种各个单株间产量发生变异,品质好坏不一,形态特征出现畸变,成熟期不同,优良种性减弱。为了沙子空心李资源的提纯复壮及优质苗木的规模化繁育,探索一种沿河空心李离体快繁的方法非常必要。
技术实现要素:
3.本发明要解决的技术问题是:提供了一种沙子空心李的离体培养方法,为沙子空心李提纯复壮奠定基础,也为其工厂化育苗提供技术支撑。
4.本发明的技术方案是:一种沙子空心李的离体培养方法,包含以下步骤:(1)材料采集及消毒灭菌:选取生长状态良好的沙子空心李带腋芽枝条,将其剪成1.5-2.0cm大小的茎段,每个茎段带有1-2 个腋芽,清洁后进行消毒处理;(2)腋芽萌发:将经过消毒灭菌的茎段两端各剪去2-4mm,接种到初代培养基上,放置于培养室内进行腋芽的萌发;(3)增殖壮苗培养:待腋芽萌发至1-2cm时将腋芽沿着底部斜切下来,接种到增殖壮苗培养基上,放置于培养室内进行增殖壮苗培养;(4)生根培养:待壮苗培养45-55d,将空心李无根组培苗转移至生根培养基上,放置于培养室内进行生根培养55-65d;(5) 移栽:待步骤(4)诱导的根长为2-3cm时,打开瓶盖置于培养室中驯化3-5d后,冲洗干净根部培养基,移栽至灭菌的营养土中,置于 25
±
2℃室内环境中自然生长。
5.所述的步骤(1)中,选取的材料为12-1月的沙子空心李冬季带休眠芽的枝条,将表面灰尘冲洗干净,将枝条剪成茎段后,用洗涤剂洗涤3遍后于流动的自来水下冲洗,再用无菌水漂洗3遍以上,用无菌的纱布擦尽多余水分,放入超净工作台;用75%酒精浸泡消毒,无菌水清洗3次以上;再用0.1%的升汞消毒,无菌水清洗5次,最后用无菌滤纸吸去表面水分。
6.所述的步骤(2)中,初代培养基配方如下:ms+6-ba 0.5mg/l+naa 0.2mg/l+蔗糖30g/l+琼脂7.5g/l。
7.所述的步骤(3)中,增殖壮苗培养基配方如下:ms+6-ba 0.5 mg/l+naa 0.1mg/l+ga
3 0.5mg/l+kt 1.5mg/l+蔗糖30g/l+琼脂7.5 g/l。
8.所述的步骤(4)中,生根培养基配方如下:1/2ms+iba 0.5 mg/l+naa 0.2mg/l+蔗糖30g/l+琼脂7.5g/l。
9.所述培养条件为:温度保持25
±
2℃,光照时间12h/d,光照强度3000-50001ux,培养基ph均为5.8。
10.本发明的有益效果:本发明以沙子空心李冬季带腋芽茎段作为材料,在腋芽萌发前消毒,解决了外植体经消毒后易褐化的问题,同时,在腋芽萌发后,立即切下新芽接种于
新的培养基上,解决了因茎段带真菌而后续污染新芽的问题。本发明克服了沙子空心李原有离体培养体系中消毒后真菌污染严重、增殖速度慢以及生根难的问题,成功建立了沙子空心李高效的离体培养体系,可为沙子空心李提纯复壮奠定基础,也可为其工厂化育苗提供技术支撑。
附图说明
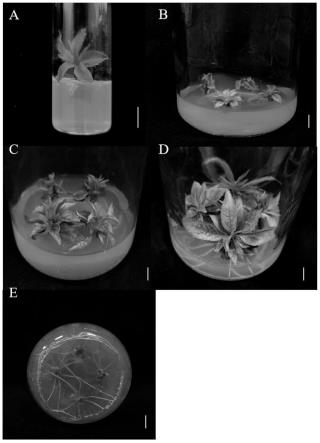
11.图1为本发明实施例外植体各阶段的状态图(图中所标比例尺均为1cm);图中:a:培养5d时带腋芽茎段的萌发情况;b:将萌发腋芽切下至增殖培养基中培养0d的情况;c:腋芽增殖壮苗培养30d 的情况;d:生根培养50d的腋芽生长情况;e:生根培养50d的根生长情况。
具体实施方式
12.下文将结合具体实施方式对本发明作进一步详尽解释,给出的实施例仅仅为了阐明本发明,而不限制本发明的范围。
13.下述实施例中的实施方法,如无特殊说明,均为常规方法。
14.下述实施例中所用的材料、试剂等,为一般商业途径获得。
15.本发明实施例中所用的ms培养基购自杭州百思生物技术有限公司,1/2ms为ms的正常用量减半。
16.6-ba:6-苄氨基嘌呤,是一种细胞分裂素;
17.naa:萘乙酸,是一种生长素;
18.kt:激动素,是一种内源细胞分裂素;
19.ga3:赤霉素,是一种植物生长调节剂;
20.iba:吲哚乙酸,是一种内源生长素。
21.培养温度保持25
±
2℃,光照时间12h/d,光照强度3000-50001ux。各个阶段的培养基ph均为5.8。
22.实施例1
23.一种沙子空心李的离体培养方法,是以沙子空心李冬季休眠芽为外植体,建立离体培养体系,包括以下步骤:
24.(1)材料采集及消毒灭菌:选取生长状态良好的沙子空心李带腋芽枝条,将其剪成1.5-2.0cm大小的茎段,每个茎段带有1-2个腋芽,清洁后进行消毒处理,用75%酒精浸泡消毒30s后,无菌水清洗 3次,每次1min;再用0.1%的升汞消毒10min,无菌水清洗5次,最后用无菌滤纸吸去表面水分;
25.(2)腋芽萌发:将经过消毒灭菌的茎段两端各剪去2-4mm,接种到初代培养基上,放置于培养室内进行腋芽的萌发;
26.初代培养基组分:ms+6-ba 0.5mg/l+naa 0.2mg/l+蔗糖30g/l+ 琼脂7.5g/l。
27.(3)增殖壮苗培养:待腋芽萌发至1-2cm时将腋芽沿着底部斜切下来,接种到增殖壮苗培养基上,放置于培养室内进行增殖壮苗培养;
28.增殖壮苗培养基组分:ms+6-ba 0.5mg/l+naa 0.1mg/l+ga
3 0.5 mg/l+kt 1.5mg/l+蔗糖30g/l+琼脂7.5g/l。
29.(4)生根培养:待壮苗培养50d后,将空心李无根组培苗转移至生根培养基上,放置于培养室内进行生根培养60d;
30.生根培养基组分:1/2ms+iba 0.5mg/l+naa 0.2mg/l+蔗糖30g/l+ 琼脂7.5g/l。
31.(5)移栽:待步骤(4)诱导的根长为2-3cm时,打开瓶盖置于培养室中驯化4d后,冲洗干净根部培养基,移栽至灭菌的营养土中,置于25
±
2℃室内环境中自然生长。
32.实施例2
33.一种沙子空心李的离体培养方法,是以沙子空心李冬季休眠芽为外植体,建立离体培养体系,包括以下步骤:
34.(1)材料采集及消毒灭菌:选取生长状态良好的沙子空心李带腋芽枝条,将其剪成1.5-2.0cm大小的茎段,每个茎段带有1-2个腋芽,清洁后进行消毒处理,用75%酒精浸泡消毒30s后,无菌水清洗 3次,每次1min;再用0.1%的升汞消毒8min,无菌水清洗5次,最后用无菌滤纸吸去表面水分;
35.(2)腋芽萌发:将经过消毒灭菌的茎段两端各剪去2-4mm,接种到初代培养基上,放置于培养室内进行腋芽的萌发;
36.初代培养基组分:ms+6-ba 0.5mg/l+naa 0.2mg/l+蔗糖30g/l+ 琼脂7.5g/l。
37.(3)增殖壮苗培养:待腋芽萌发至1-2cm时将腋芽沿着底部斜切下来,接种到增殖壮苗培养基上,放置于培养室内进行增殖壮苗培养;
38.增殖壮苗培养基组分:ms+6-ba 1.0mg/l+naa 0.5mg/l+ga
3 0.1 mg/l+kt 1.5mg/l+蔗糖30g/l+琼脂7.5g/l。
39.(4)生根培养:待壮苗培养50d后,将空心李无根组培苗转移至生根培养基上,放置于培养室内进行生根培养60d;
40.生根培养基组分:1/2ms+iba 1.0mg/l+naa 0.2mg/l+蔗糖30g/l+ 琼脂7.5g/l。
41.(5)移栽:待步骤(4)诱导的根长为2-3cm时,打开瓶盖置于培养室中驯化4d后,冲洗干净根部培养基,移栽至灭菌的营养土中,置于25
±
2℃室内环境中自然生长。
42.实施例3
43.一种沙子空心李的离体培养方法,是以沙子空心李冬季休眠芽为外植体,建立离体培养体系,包括以下步骤:
44.(1)材料采集及消毒灭菌:选取生长状态良好的沙子空心李带腋芽枝条,将其剪成1.5-2.0cm大小的茎段,每个茎段带有1-2个腋芽,清洁后进行消毒处理,用75%酒精浸泡消毒30s后,无菌水清洗 3次,每次1min;再用0.1%的升汞消毒14min,无菌水清洗5次,最后用无菌滤纸吸去表面水分;
45.(2)腋芽萌发:将经过消毒灭菌的茎段两端各剪去2-4mm,接种到初代培养基上,放置于培养室内进行腋芽的萌发;
46.初代培养基组分:ms+6-ba 0.5mg/l+naa 0.2mg/l+蔗糖30g/l+ 琼脂7.5g/l。
47.(3)增殖壮苗培养:待腋芽萌发至1-2cm时将腋芽沿着底部斜切下来,接种到增殖壮苗培养基上,放置于培养室内进行增殖壮苗培养;
48.增殖壮苗培养基组分:ms+6-ba 0.1mg/l+naa 0.1mg/l+ga
3 0.1 mg/l+kt 0.5mg/l+蔗糖30g/l+琼脂7.5g/l。
49.(4)生根培养:待壮苗培养50d后,将空心李无根组培苗转移至生根培养基上,放置
于培养室内进行生根培养60d;
50.生根培养基组分:1/2ms+iba 0.1mg/l+naa 0.5mg/l+蔗糖30g/l+ 琼脂7.5g/l。
51.(5)移栽:待步骤(4)诱导的根长为2-3cm时,打开瓶盖置于培养室中驯化4d后,冲洗干净根部培养基,移栽至灭菌的营养土中,置于25
±
2℃室内环境中自然生长。
52.针对实施例1-3,设置不同消毒时间试验组,对实施例1-3的外植体消毒情况及腋芽萌发效果观察并记录:
53.表1不同消毒时间处理对腋芽萌发及外植体灭菌的影响
[0054][0055]
由表1可知,选择0.1%的升汞消毒10min时,萌发率最高可达 42.22%,优于其他消毒处理,芽的生长质量最好,有利于后续阶段继续培养。
[0056]
腋芽萌发后,针对实施例1-3,采用不同浓度的6-ba、naa、ga3和kt组合的培养基设计正交实验表格,在培养温度保持25
±
2℃,光照时间12h/d,光照强度3000-50001ux的条件下培养50d,结果见表2。
[0057]
表2不同质量浓度的6-ba、naa、ga3和kt组合的培养基对沙子空心李增殖的影响
[0058][0059]
由表2可知,当6-ba浓度为0.5mg/l,naa浓度为0.1mg/l, ga3浓度为0.5mg/l,kt浓度为1.5mg/l时,增殖芽生长情况健壮,且增殖芽多,增殖系数达到5.15
±
0.75。
[0060]
将壮苗增殖的苗转接至生根培养基上诱导生根,采用不同浓度的 iba和naa组合培养基,在培养温度保持25
±
2℃,光照时间12h/d,光照强度3000-50001ux的条件下培养60d,结果见表3。
[0061]
表3不同浓度的iba和naa组合培养基中沙子空心李苗生根情况
[0062][0063]
由表3可知,当iba浓度为0.5mg/l,naa浓度为0.2mg/l时,组培苗生根率最高,为65%,平均生根数为9.35
±
2.86。
[0064]
本发明选用贵州沿河本地空心李冬季休眠带腋芽茎段作为外植体得到空心李萌发腋芽,筛选出增殖芽培养基配方,构建了沿河沙子空心李离体培养体系。由图1所示本发明实施例外植体各阶段的状态图(图中所标比例尺均为1cm),图中:a:培养5d时带腋芽茎段的萌发情况;b:将萌发腋芽切下至增殖培养基中培养0d的情况; c:腋芽增殖壮苗培养30d的情况;d:生根培养50d的腋芽生长情况; e:生根培养50d的根生长情况。
[0065]
以上所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例,基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1