一种干细胞冻存液及其冻存方法和复苏方法与流程
1.本发明属于细胞冻存技术领域,具体涉及一种干细胞冻存液及其冻存方法和复苏方法。
背景技术:
2.目前市场上的干细胞冻存液质量参差不齐,其关键在于干细胞的活性控制难度大,现有的干细胞冻存液使用过程中干细胞易出现黏附、聚集成团,稳定性差的问题,从而影响了现有干细胞复苏后的效果与活率,除此之外,商品化冻存液的价格较高,不便于大规模冻存。
3.因此,需要提供一种针对上述现有技术不足的改进技术方案。
技术实现要素:
4.本发明的目的在于提供一种干细胞冻存液及其冻存方法和复苏方法,以便于解决或改善下述中的至少一项问题:商品化冻存液价格高、冻存效果差。
5.为了实现上述目的,本发明提供如下技术方案:一种干细胞冻存液,
6.所述干细胞冻存液包括下述体积百分比的组分:二甲基亚砜5-20%、谷胱甘肽注射液0.1-3%、羟乙基淀粉氯化钠注射液5-20%、氨甲环酸注射液0.5-2%、人血白蛋白注射液8-25%、维生素c注射液0.5-3%和右旋糖酐注射液20-35%,余量为10%葡萄糖注射液;其中,所述谷胱甘肽注射液中,谷胱甘肽的浓度为0.6%;所述羟乙基淀粉氯化钠注射液中,羟乙基淀粉的浓度为0.06g/ml,氯化钠的浓度为0.009g/ml;所述氨甲环酸注射液中,氨甲环酸的浓度为0.1g/ml;所述人血白蛋白注射液中,人血白蛋白的浓度为20%;所述维生素c注射液中,维生素c的浓度为0.1g/ml;所述右旋糖酐注射液中,右旋糖酐的浓度为6%。
7.优选地,所述干细胞冻存液包括下述体积百分比的组分:二甲基亚砜5-8%、谷胱甘肽注射液0.5-1%、羟乙基淀粉氯化钠注射液10-20%、氨甲环酸注射液0.5-1%、人血白蛋白注射液15%、维生素c注射液1.5%和右旋糖酐注射液25-30%,余量为10%葡萄糖注射液。
8.优选地,所述干细胞冻存液用于间充质干细胞和毛囊dp细胞的冻存。
9.本发明还提供了一种干细胞冻存方法,其采用下述技术方案:一种干细胞冻存方法,采用如上所述的干细胞冻存液对干细胞进行直接冻存;所述直接冻存包括下述步骤:将所述干细胞与所述干细胞冻存液混匀,并放在程序降温盒后,置于-80℃环境中保存,以1℃/min的降温速率进行降温。
10.优选地,采用如上所述的干细胞冻存液对干细胞进行程序降温冻存;所述程序降温冻存包括下述步骤:a.4℃平衡;b.以1℃/min的降温速率降温至-4℃;c.以25℃/min的降温速率降温至-40℃;d.以10℃/min的升温速率升温至-12℃;e.以1℃/min的降温速率降温至-40℃;f.以10℃/min的降温速率降温至-90℃;g.置于-80℃环境中保存。
11.优选地,步骤a中,所述干细胞与所述干细胞冻存液混匀后,所述干细胞的浓度为
(1.5-10)
×
106cells/ml。
12.本发明还提供了一种干细胞复苏方法,其采用下述技术方案:一种干细胞复苏方法,将采用如上所述的干细胞冻存液冻存后的干细胞从-80℃环境中取出后,置于37℃水浴中复苏;或,置于常温条件下融化复苏。
13.优选地,所述常温为20-30℃,所述常温条件下融化复苏的时间为5-20min。
14.有益效果:
15.本发明的干细胞冻存液具有成本低廉、冻存效果好、效率高和粘度低、易于实现冻存液和干细胞的分离等优点。
16.采用本发明的干细胞冻存液对干细胞进行冻存时,无需经过程序降温,也可保持较高的活率(复苏后细胞活率可达80%以上),冻存步骤快捷方便。
17.本发明的干细胞冻存液不含动物血清(无动物源),无内毒素且成本低廉,有效期长。
18.采用本发明的干细胞冻存液对干细胞进行冻存,复苏后细胞的存活率较高,且后续培养时干细胞具有较高的分泌能力,复苏步骤简单快捷。
19.采用本发明的干细胞冻存液对干细胞进行冻存,冻存后的干细胞可在常温下化融复苏,无需水浴加热,且复苏后细胞的存活率高。
20.采用常温复苏的方式对冻存的干细胞进行复苏,使得可以在b级洁净区(干细胞制剂的使用或生产过程中,需要在b级洁净区对复苏后的干细胞进行操作)实现干细胞的复苏;相对于现有技术中常用的水浴复苏,可有效减少操作的繁琐程度(b级洁净区无法放水浴锅,采用现有技术中常用的水浴复苏方法对干细胞进行复苏时,需要在c级洁净区进行,之后再传递到b级洁净区,操作繁琐),同时常温复苏减少了水浴复苏可能产生的污染情况。
附图说明
21.构成本技术的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。其中:
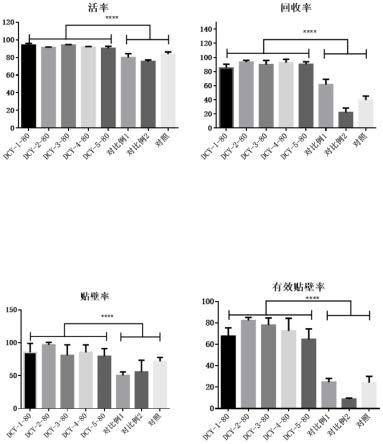
22.图1为分别采用实施例1-5、对比例1-2和对照组的冻存液对脐带间充质干细胞进行冻存并对复苏后的细胞活率、回收率、贴壁率和有效贴壁率的测定结果图;
23.图2为采用本发明实施例2的干细胞冻存液对脐带间充质干细胞进行冻存并复苏后,细胞的流式检测结果图。
具体实施方式
24.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员所获得的所有其他实施例,都属于本发明保护的范围。
25.下面将结合实施例来详细说明本发明。需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
26.本发明针对目前干细胞冻存液存在的问题,提供一种干细胞冻存液,本发明实施例的干细胞冻存液包括下述体积百分比的组分:二甲基亚砜5-20%(例如,5%、10%、15%或20%)、谷胱甘肽注射液0.1-3%(例如,0.1%、0.5%、1%、2%或3%)、羟乙基淀粉氯化钠
注射液5-20%(例如,5%、10%、15%或20%)、氨甲环酸注射液0.5-2%(例如,0.5%、1%、1.5%或2%)、人血白蛋白注射液8-25%(例如,8%、12%、16%、20%或25%)、维生素c注射液0.5-3%(例如,0.5%、1%、2%或3%)和右旋糖酐注射液20-35%(例如,20%、25%、30%或35%),余量为葡萄糖注射液;谷胱甘肽注射液中,谷胱甘肽的浓度为0.6%(无菌谷胱甘肽冻干粉针以100ml 10%葡萄糖注射液溶解稀释后得到);羟乙基淀粉氯化钠注射液中,羟乙基淀粉的浓度为0.06g/ml,氯化钠的浓度为0.009g/ml;氨甲环酸注射液中,氨甲环酸的浓度为0.1g/ml;人血白蛋白注射液中,人血白蛋白的浓度为20%;维生素c注射液中,维生素c的浓度为0.1g/ml;右旋糖酐注射液中,右旋糖酐的浓度为6%;葡萄糖注射液中葡萄糖的浓度为0.1g/ml(10%)。本发明的干细胞冻存液采用了10%葡萄糖注射液作为补足溶剂,相较于传统的生理盐水,其既可以作为细胞保护剂,也可以作为细胞额外的代谢能源;本发明的干细胞冻存液中的右旋糖酐也可作为细胞保护剂,减少细胞粘连;羟乙基淀粉的加入可起到防止细胞的沉积、减少离心时的损伤的作用;维生素c的加入可起到提高本发明的干细胞冻存液的抗氧化能力的作用。
27.本发明优选实施例中,干细胞冻存液包括下述体积百分比的组分:二甲基亚砜5-8%(例如,5%、6%、7%或8%)、谷胱甘肽注射液0.5-1%(例如,0.5%、0.8%或1%)、羟乙基淀粉氯化钠注射液10-20%(例如,10%、15%或20%)、氨甲环酸注射液0.5-1%(例如,0.5%、0.8%或1%)、人血白蛋白注射液15%、维生素c注射液1.5%和右旋糖酐注射液25-30%(例如,25%、28%或30%),余量为葡萄糖注射液。本发明实施例中的二甲基亚砜的用量为5-8%(例如,5%、6%、7%或8%),相对于市售冻存液(二甲基亚砜的用量通常为10%),降低了二甲基亚砜的用量,有助于加强干细胞的活性,减少细胞损伤。
28.本发明优选实施例中,干细胞冻存液用于间充质干细胞和毛囊dp细胞的冻存。
29.本发明还提出了一种干细胞冻存方法,本发明实施例的干细胞冻存方法为:采用如上所述的干细胞冻存液对干细胞进行直接冻存;直接冻存包括下述步骤:将干细胞与干细胞冻存液混匀并放在程序降温盒后,置于-80℃环境中保存,以1℃/min的降温速率进行降温。
30.本发明优选实施例中,采用如上所述的干细胞冻存液对干细胞进行程序降温冻存;程序降温冻存包括下述步骤:a.4℃平衡(调整好冻存液中干细胞的浓度后,分装,置于4℃平衡);b.以1℃/min的降温速率降温至-4℃;c.以25℃/min的降温速率降温至-40℃;d.以10℃/min的升温速率升温至-12℃;e.以1℃/min的降温速率降温至-40℃;f.以10℃/min的降温速率降温至-90℃;g.置于-80℃环境中(例如,-80℃冰箱)保存。
31.本发明优选实施例中,步骤a中,干细胞与干细胞冻存液混匀后,干细胞的浓度为(1.5-10)
×
106cells/ml(例如,1.5
×
106cells/ml、2
×
106cells/ml、3
×
106cells/ml、4
×
106cells/ml、5
×
106cells/ml、6
×
106cells/ml或10
×
106cells/ml)。
32.优选地,步骤a中,干细胞与干细胞冻存液混匀后,干细胞的浓度为(2-5)
×
106cells/ml。
33.本发明还提出了一种干细胞复苏方法,本发明实施例的干细胞复苏方法为:将采用上述干细胞冻存液冻存后的干细胞从-80℃环境中取出后,置于37℃水浴中复苏;或,置于常温条件下融化复苏。
34.其中,采用本发明的干细胞冻存液冻存的干细胞可以在常温进行复苏的原理目前
还不明确,我们推测是:采用冻存袋进行冻存时,由于冻存袋的表面积比较大,其内的冻存细胞悬液可以大面积的和外界室温进行接触,另外袋子的温度传导性也较好,这样可以使其内的细胞很快越过-20℃冰晶状态(该状态对细胞伤害较大);冻存管冻存时,冻存管与外界室温的面积较小,所以复苏情况相较于袋子会稍差一些(但冻存管内的冻存液体积较小,可在更短时间内实现冻存管内冻存液的融化)。
35.本发明优选实施例中,常温条件为20-30℃(例如,20℃、25℃或30℃),常温条件下融化复苏的时间为5-20min(例如,5min、10min、15min或20min)。
36.本发明优选实施例中,冻存袋(冻存液体积为10ml)在常温条件下融化复苏的时间为10-20min(例如,10min、15min或20min);冻存管(冻存液体积为1ml)在常温条件下融化复苏的时间为5-8min(例如,5min、6min、7min或8min)。
37.本发明优选实施例中,从人源脐带间充质干细胞主细胞库中取所需支数的细胞,置于超低温运输箱,通过物流通道转运至c级洁净区。迅速将细胞置于自封袋,然后将自封袋置于c级洁净区的电热恒温水浴锅中,37.0℃条件下不断摇晃使冻存的细胞迅速融化,融化时间约1-2min,或采用常温融化。
38.下面通过具体实施例对本发明的干细胞冻存液及其冻存方法和复苏方法进行详细说明。
39.下面实施例中,采用下表1中的原料制备本发明的干细胞冻存液
40.表1原料来源
[0041][0042]
实施例1
[0043]
本实施例的冻存液(dcy-1)包括下述体积百分比的组分:
[0044]
dcy-1组分如下:二甲基亚砜10%、谷胱甘肽注射液1%(无菌冻干粉针以100ml 10%葡萄糖注射液溶解稀释后使用)、羟乙基淀粉氯化钠注射液(即表1中的羟乙基淀粉200/0.5氯化钠注射液)15%、氨甲环酸注射液1%、人血白蛋白注射液15%、维生素c注射液1.5%和右旋糖酐注射液(即表1中的右旋糖酐40氨基酸注射液)25%,余量为10%葡萄糖注射液。
[0045]
本实施例的冻存液(dcy-1)的制备方法:将谷胱甘肽注射液、羟乙基淀粉氯化钠注射液、氨甲环酸注射液、人血白蛋白注射液、维生素c注射液和右旋糖酐注射液按照体积比混合,之后加入二甲基亚砜,过滤除菌即得本实施例的冻存液(dcy-1)。
[0046]
实施例2
[0047]
本实施例的冻存液(dcy-2)包括下述体积百分比的组分:
[0048]
dcy-2组分如下:二甲基亚砜5%、谷胱甘肽注射液1%(无菌冻干粉针以100ml 10%葡萄糖注射液溶解稀释后使用)、羟乙基淀粉氯化钠注射液(即表1中的羟乙基淀粉200/0.5氯化钠注射液)15%、氨甲环酸注射液1%、人血白蛋白注射液15%、维生素c注射液1.5%和右旋糖酐注射液(即表1中的右旋糖酐40氨基酸注射液)25%,余量为10%葡萄糖注射液。
[0049]
本实施例的冻存液(dcy-2)的具体制备步骤同实施例1。
[0050]
实施例3
[0051]
本实施例的冻存液(dcy-3)包括下述体积百分比的组分:
[0052]
dcy-3组分如下:二甲基亚砜8%、谷胱甘肽注射液1%(无菌冻干粉针以100ml 10%葡萄糖注射液溶解稀释后使用)、羟乙基淀粉氯化钠注射液(即表1中的羟乙基淀粉200/0.5氯化钠注射液)15%、氨甲环酸注射液1%、人血白蛋白注射液15%、维生素c注射液1.5%和右旋糖酐注射液(即表1中的右旋糖酐40氨基酸注射液)25%,余量为10%葡萄糖注射液。
[0053]
本实施例的冻存液(dcy-2)的具体制备步骤同实施例1。
[0054]
实施例4
[0055]
本实施例的冻存液(dcy-4)包括下述体积百分比的组分:
[0056]
dcy-4组分如下:二甲基亚砜8%、谷胱甘肽注射液0.5%(无菌冻干粉针以100ml 10%葡萄糖注射液溶解稀释后使用)、羟乙基淀粉氯化钠注射液(即表1中的羟乙基淀粉200/0.5氯化钠注射液)20%、氨甲环酸注射液0.5%、人血白蛋白注射液25%、维生素c注射液2%和右旋糖酐注射液(即表1中的右旋糖酐40氨基酸注射液)20%,余量为10%葡萄糖注射液。
[0057]
本实施例的冻存液(dcy-2)的具体制备步骤同实施例1。
[0058]
实施例5
[0059]
本实施例的冻存液(dcy-5)包括下述体积百分比的组分:
[0060]
dcy-5组分如下:二甲基亚砜8%、谷胱甘肽注射液3%(无菌冻干粉针以500ml 10%葡萄糖注射液溶解稀释后使用)、羟乙基淀粉氯化钠注射液(即表1中的羟乙基淀粉200/0.5氯化钠注射液)5%、氨甲环酸注射液2%、人血白蛋白注射液8%、维生素c注射液0.5%和右旋糖酐注射液(即表1中的右旋糖酐40氨基酸注射液)35%,余量为10%葡萄糖注射液。
[0061]
本实施例的冻存液(dcy-2)的具体制备步骤同实施例1。
[0062]
对比例1
[0063]
本对比例的冻存液包括下述体积百分比的组分:二甲基亚砜10%、谷胱甘肽注射液1%(无菌冻干粉针以100ml 10%葡萄糖注射液溶解稀释后使用)、羟乙基淀粉氯化钠注射液(即表1中的羟乙基淀粉200/0.5氯化钠注射液)15%、氨甲环酸注射液1%、人血白蛋白
注射液15%、维生素c注射液1.5%和右旋糖酐注射液0%,余量为10%葡萄糖注射液。
[0064]
本对比例的冻存液的具体制备步骤同实施例1。
[0065]
对比例2
[0066]
本对比例的冻存液包括下述体积百分比的组分:二甲基亚砜10%、谷胱甘肽注射液1%(无菌冻干粉针以100ml 10%葡萄糖注射液溶解稀释后使用)、羟乙基淀粉氯化钠注射液0%、氨甲环酸注射液1%、人血白蛋白注射液15%、维生素c注射液1.5%和右旋糖酐注射液(即表1中的右旋糖酐40氨基酸注射液)25%,余量为10%葡萄糖注射液。
[0067]
本对比例的冻存液的具体制备步骤同实施例1。
[0068]
实验例
[0069]
1、分别采用dcy-1、dcy-2、dcy-3、dcy-4、dcy-5、对比例1、对比例2和市售冻存液(对照组,美国fda批准的一种商品化冻存液)对20210902407ucf干细胞(由脐带组织贴壁而来,待融合度达到80-90%(约3-4天)进行传代,传代至第五代可进行冻存)进行冻存、复苏和再培养,并对复苏后的细胞存活率、回收率、再培养后的细胞浓度以及细胞贴壁率进行测定。
[0070]
按照下述步骤进行人源脐带间充质干细胞的冻存:
[0071]
冻存方法为:冻存细胞采用preset-1.prg程序(此为程控降温仪自带的程序系统):4℃平衡;每分钟降温1℃,时间8分钟,降至-4℃;每分钟降温25℃,降至-40℃;每分钟升温10℃,升至-12℃;每分钟降温1℃,时间28分钟,降至-40℃;每分钟降温10℃,时间5分钟,降至-90℃箱体开机,冻存完毕后放在-80℃冰箱中保存。
[0072]
复苏方法为:从人源脐带间充质干细胞主细胞库中取所需支数的细胞,置于超低温运输箱,通过物流通道转运至c级洁净区。迅速将细胞置于自封袋,然后将自封袋置于c级洁净区的电热恒温水浴锅中,37.0℃条件下不断摇晃使冻存的细胞迅速融化,融化时间约1min。
[0073]
再培养的方法为:将融化后的细胞悬液加至9ml的市售脐带间充质干细胞培养基中,400g,离心5min,去上清后重悬计数,根据计数结果按照要求进行细胞的接种培养,培养采用培养瓶或细胞工厂。
[0074]
实验结果如下表2及说明书附图图1所示:
[0075]
表2不同冻存液对20210902407ucf批次细胞活率、回收率、贴壁率和有效贴壁率的影响
[0076]
[0077][0078]
其中,“活细胞浓度(106cells/ml)接种前”是指复苏后测得的活细胞浓度;
[0079]
细胞活率的测定方法为:采用ao/pi染色,使用细胞计数仪计数;
[0080]
活细胞浓度的测定方法为:与细胞活率一样,采用细胞计数仪测定(细胞计数仪器会直接给出测定结果数据);
[0081]
回收率的测定方法为:细胞复苏后的活细胞数/冻存前的活细胞数;
[0082]
贴壁率的测定方法为:从复苏的活细胞中取50万细胞接种至六孔板,培养17h后去掉六孔板中的上清,用生理盐水清洗后,消化六孔板中的细胞,记录每孔的总细胞数,计算
细胞的贴壁率,贴壁率=消化后细胞总数/接种的细胞数(通常为50万/孔);
[0083]
有效贴壁率的测定方法为:有效贴壁率=贴壁率
×
回收率
×
活率。
[0084]
上表2中,dcy-1-1-80代表采用dcy-1冻存液按照上述程序降温冻存方法在-80℃冰箱冻存的第1支细胞,每支细胞包含1ml液体以及200万细胞。以此类推,dcy-1-2-80代表采用dcy-1冻存液按照上述程序降温冻存方法在-80℃冰箱冻存的第2支细胞;即,dcy-1-1-80至dcy-1-6-80为采用dcy-1冻存液按照上述程序降温冻存方法做的6个重复实验;
[0085]
dcy-2-1-80代表采用dcy-2冻存液按照上述程序降温冻存方法在-80℃冰箱直接冻存的第1支细胞,每支细胞包含1ml液体以及200万细胞。以此类推,dcy-2-2-80代表采用dcy-2冻存液按照上述程序降温冻存方法在-80℃冰箱直接冻存的第2支细胞;dcy-2-1-80至dcy-2-6-80为采用dcy-2冻存液按照上述程序降温冻存方法做的6个重复实验;
[0086]
dcy-3-1-80代表采用dcy-3冻存液按照上述程序降温冻存方法在-80℃冰箱冻存的第1支细胞,每支细胞包含1ml液体以及200万细胞。以此类推,dcy-3-2-80代表采用dcy-3冻存液按照上述程序降温冻存方法在-80℃冰箱冻存的第2支细胞;dcy-3-1-80至dcy-3-6-80为采用dcy-3冻存液按照上述程序降温冻存方法做的6个重复实验;
[0087]
dcy-4和dcy-5同上(每支细胞包含1ml液体以及200万细胞),dcy-4和dcy-5的冻存液也分别做了6个重复实验;
[0088]
对照1、对照2和对照3为采用上述市售冻存液做的3个重复实验(每支细胞包含1ml液体以及200万细胞);
[0089]
对比例1-1至对比例1-3为采用上述对比例1的冻存液做的3个重复试验(每支细胞包含1ml液体以及200万细胞);
[0090]
对比例2-1至对比例2-3为采用上述对比例2的冻存液做的3个重复实验(每支细胞包含1ml液体以及200万细胞)。
[0091]
由上表2和图1(采用prism对表2中的数据进行分析后得到,图1中的“****”代表显著差异)可知:对照组为美国fda批准的一种商品化冻存液,脐带间充质干细胞在冻存24h后的冻存效果对比。dcy-1为dmso含量为10%的冻存液;dcy-2为dmso含量为5%的冻存液其余成分与dcy-1相同;dcy-3为dmso含量为8%的冻存液其余成分与dcy-1相同;dcy-4组分为二甲基亚砜8%、谷胱甘肽注射液0.5%(无菌冻干粉针以100ml 10%葡萄糖注射液溶解稀释后使用)、羟乙基淀粉氯化钠注射液20%、氨甲环酸注射液0.5%、人血白蛋白注射液25%、维生素c注射液2%和右旋糖酐注射液20%,余量为10%葡萄糖注射液;dcy-5组分为二甲基亚砜8%、谷胱甘肽注射液3%(无菌冻干粉针以500ml 10%葡萄糖注射液溶解稀释后使用)、羟乙基淀粉氯化钠注射液5%、氨甲环酸注射液2%、人血白蛋白注射液8%、维生素c注射液0.5%和右旋糖酐注射液35%,余量为10%葡萄糖注射液。相较于对照组,本发明实施例1-5的五种冻存液(dcy-1、dcy-2、dcy-3、dcy-4和dcy-5)冻存的脐带间充质干细胞复苏后均有较高的存活率,达到了85%以上;且回收率较高,相对于市售冻存液有显著提高;相对于市售冻存液的粘性较大,复苏后细胞不易分离,本发明实施例1-5的冻存液可在400g,5min条件下与脐带间充质干细胞稳定分离。贴壁率方面,本发明实施例1-5的冻存液基本稳定在70%以上(对照组及对比例1-2的冻存液的贴壁率则明显更差)。
[0092]
采用对比例1和对比例2的冻存液对脐带间充质干细胞(20210902407ucf)进行冻存的实验结果表明:采用对比例1和对比例2的冻存液进行冻存时,复苏后细胞存活率整体
低于80%,细胞存活率过低。
[0093]
2、对上述采用本发明实施例2的冻存液(dcy-2)、冻存方法和复苏方法复苏后得到的细胞进行流式检测,实验结果如说明书附图图2所示。
[0094]
流式检测方法为:流式检测仪检测干细胞表面标志物,间充质干细胞标准是三个阳性指标,五个阴性指标。
[0095]
由图2可知:该实施例细胞的阳性表面标志物均在99%以上,阴性指标均在2%以下,表明其具有较好的干细胞分泌能力和活性。
[0096]
3、将采用实施例2的冻存液和上述程序降温冻存方法,-80℃冻存24h后的细胞取出后,分别进行常温(25℃)复苏和水浴复苏(37.0℃,复苏时间1min左右),并对复苏后细胞活率、活细胞浓度和结团率进行检测:
[0097]
其中,常温复苏方法如下:
[0098]
常温25℃左右复苏两个冻存袋(每个冻存袋约有5000万细胞,采用实施例2的冻存液dcy-2进行冻存),将冻存袋(冻存液体积为10ml)自-80℃冰箱中取出后,置于25℃无菌环境中,复苏时间为15min(细胞融化);
[0099]
将上述复苏的细胞按照复苏方法分成两组(常温组和水浴组,每组做2个重复),分别按1:4的比例重悬,重悬后进行各时间点的计数。
[0100]
实验结果如下表3所示:
[0101]
表3
[0102][0103][0104]
其中,活率、活细胞浓度、结团率采用细胞计数仪测定得到。
[0105]
由上表3可知:
[0106]
采用实施例2的冻存液(dcy-2)冻存的细胞在常温复苏的情况下依旧能保持较高的活率(》80%),常温放置48h后活率依旧在80%左右。
[0107]
4、按照与上述同样的方法分别对采用对比例1和对比例2的冻存液冻存后的细胞进行常温(25℃左右,复苏时间5min)复苏,实验结果如下表4所示:
[0108]
表4常温复苏对对比例1-2的冻存液冻存细胞的影响
[0109][0110]
其中:(1)上表4中的“对比例1-1”、“对比例1-2”和“对比例1-3”为采用对比例1的冻存液做的3个重复;“对比例2-1”、“对比例2-2”和“对比例2-3”为采用对比例2的冻存液做的3个重复;
[0111]
(2)表4中的细胞活率、活细胞浓度、回收率、总细胞数和贴壁率的测定方法与表2相同;
[0112]
(3)冻存管中冻存液的体积为1ml。
[0113]
5、分别将脐带间充质干细胞与对照组(市售)、实施例1、实施例2和实施例3的冻存液混匀,并采用直接冻存的方法进行冻存(将细胞与冻存液混匀并放在程序降温盒后直接置于-80℃冰箱中进行冻存;程序降温盒可将降温速率控制在1℃/min左右;本发明所采用的降温盒为cellhome程序降温盒);24h后从-80℃冰箱中取出冻存细胞,并在37.0℃水浴中复苏1min左右,之后接种于脐带间充质干细胞培养基中进行培养,对复苏后细胞活率、活细胞浓度(接种前)、回收率、接种17h后总细胞浓度和贴壁率进行检测,检测结果如下表5所示:
[0114]
表5直接冻存对不同冻存液冻存细胞的细胞活率、回收率、贴壁率的影响
1-无”至“dcy-1-6-无”为采用实施例1的冻存液分别做的6个重复;“dcy-2-1-无”至“dcy-2-6-无”为采用实施例2的冻存液分别做的6个重复;“dcy-3-1-无”至“dcy-3-6-无”为采用实施例3的冻存液分别做的6个重复;
[0118]
(2)表5中的细胞活率、活细胞浓度、回收率、总细胞数和贴壁率的测定方法与表2相同。
[0119]
由上表5可知,采用本发明的冻存液对脐带间充质干细胞进行冻存时,可直接置于-80℃环境中进行冻存;且可对脐带间充质干细胞产生较好的保护作用,复苏后细胞活率可维持在85%左右,优于对照组(市售冻存液)。
[0120]
6、除脐带间充质干细胞外,我们也用该冻存液对羊膜间充质干细胞(酶消化法从羊膜组织中获得,经两次传代后冻存)和毛囊dp细胞(由人头皮组织而来,经酶解法原代培养7天后每四天传代一次,两次传代后冻存)进行了冻存,并进行了水浴复苏,结果见表6和表7。
[0121]
表6不同冻存液对20210801509amf羊膜间充质干细胞活率、回收率、贴壁率和有效贴壁率的影响
[0122]
[0123][0124]
表7不同冻存液对20220300503hpc毛囊dp细胞活率、回收率、贴壁率和有效贴壁率的影响
[0125]
[0126]
[0127][0128]
由上表6和表7可知,本发明的干细胞冻存液也适用于羊膜间充质干细胞和毛囊dp细胞的冻存;相较于对照组冻存液(市售冻存液)和对比例1-2的冻存液,有助于保持细胞复苏后的贴壁能力以及维持较高的活率。
[0129]
7、考察冻存时,冻存液中细胞浓度对细胞存活率的影响:
[0130]
使冻存液(dcy-3)中悬浮的脐带间充质干细胞的细胞浓度分别为1.5
×
106cells/ml、5.0
×
106cells/ml和10.0
×
106cells/ml,之后分别取1ml细胞悬浮液分装于2ml冻存管中(每个浓度做3个重复),按照上述程序降温方法降温并冻存于-80℃冰箱;
[0131]
冻存24h后,水浴复苏,并对复苏后的细胞活率进行检测(采用ao/pi染色,使用细胞计数仪计数),检测结果如下表8所示:
[0132]
表8不同细胞浓度对脐带间充质干细胞活率的影响(dcy-3冻存)
[0133]
[0134][0135]
由表8可知,当本发明的干细胞冻存液中的细胞浓度为(1.5-10)
×
106cells/ml范围内时,均可为干细胞提高较好的冻存保护作用,复苏后细胞的存活率可达90%以上。
[0136]
以上所述仅为本发明的优选实施例,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1