一种槭叶铁线莲的组织培养方法与流程
1.本发明涉及组织培养技术领域,具体涉及一种槭叶铁线莲的组织培养方法。
背景技术:
2.槭叶铁线莲(clematis acerifolia maxim.)是毛茛科,铁线莲属植物,主要分布在北京地区,在河北偶有分布报道。不同于铁线莲属的其它植物,槭叶铁线莲典型生境是太行山脉的悬崖(图1)。在北京地区,每年4月起,就能看到房山、门头沟等地的悬崖上,一株株美丽的槭叶铁线莲迎风绽放,彰显着北京地域特色。
3.作为一种珍稀、生境特殊、分布狭窄的植物,对槭叶铁线莲进行保护是保护自然环境、保护生物多样性的必然要求。同时,槭叶铁线莲作为一种乡土植物,在园林绿化中的垂直绿化中有较好的应用前景,又是非常难得的早春植物材料。人工繁殖是增加植株数量、保护植物的重要途径,然而目前还未见有关于槭叶铁线莲组织培养的相关报道。
技术实现要素:
4.本发明要解决的技术问题是提供一种槭叶铁线莲的组织培养方法。
5.为了解决上述技术问题,本发明提供了一种槭叶铁线莲的组织培养方法。
6.本发明提供的槭叶铁线莲的组织培养方法包括如下步骤:
7.1)将槭叶铁线莲种子依次经过乙醇溶液和次氯酸钠溶液处理,得到消毒处理后的槭叶铁线莲种子;
8.2)将所述消毒处理后的槭叶铁线莲种子在发芽培养基中进行发芽培养,待培养至槭叶铁线莲种苗根部与茎部的连接处出现黑褐色时,在黑褐色连接处的最下端进行切割,并以切除根部的种苗作为外植体;
9.3)将所述外植体依次在初代培养基和继代培养基中进行增殖培养,得到槭叶铁线莲不定芽;
10.所述初代培养基和所述继代培养基均为含有6ba、naa和zt的wpm培养基。
11.上述组织培养方法中,所述乙醇溶液可为体积分数为70%的乙醇溶液。
12.所述乙醇溶液处理的时间可为20-40s,优选为30s。
13.所述次氯酸钠溶液可为浓度为0.1%的次氯酸钠溶液。
14.所述次氯酸钠溶液处理的时间可为12-18min,优选为15min。
15.上述组织培养方法中,所述步骤2)中,所述发芽培养基优选为white培养基。
16.上述组织培养方法中,所述步骤3)中,所述6ba在所述初代培养基中的终浓度可为3.8-4.2mg/ml,优选为4mg/ml。
17.所述naa在所述初代培养基中的终浓度为0.1mg/ml。
18.所述zt在所述初代培养基中的终浓度为0.5mg/ml。
19.所述6ba在所述继代培养基中的终浓度可为4.3-4.7mg/ml,优选为4.5mg/ml。
20.所述naa在所述继代培养基中的终浓度为0.1mg/ml。
21.所述zt在所述继代培养基中的终浓度为0.8mg/ml。
22.上述组织培养方法中,所述步骤3)包括如下步骤:
23.3-1)将所述外植体在初代培养基中进行培养,得到带有初步分化的芽的愈伤组织;
24.3-2)将所述带有初步分化的芽的愈伤组织在继代培养基中进行培养,得到槭叶铁线莲不定芽。
25.进一步的,所述步骤3-1)中,所述外植体在初代培养基中培养也可获得不带芽的愈伤组织,该不带芽的愈伤组织在继代培养基中也可以进一步分化,得到槭叶铁线莲不定芽。
26.更进一步的,所述步骤3-1)和所述步骤3-2)中,所述培养的时间均可为1-3个月,优选为3个月。
27.上述组织培养方法中,所述步骤3)后还包括将所述槭叶铁线莲不定芽在生根培养基中进行生根培养的步骤;所述生根培养基为含有6ba和iaa的1/2wpm培养基。
28.进一步的,所述6ba在所述生根培养基中的终浓度为0.2mg/ml。
29.所述iaa在所述生根培养基中的终浓度为0.1mg/ml。
30.更进一步的,所述生根培养的时间可为25-30天,优选为30天。
31.上述组织培养方法中,所述初代培养基和所述继代培养基均由6ba、naa、zt和wpm培养基组成。
32.所述生根培养基由6ba、iaa和1/2wpm培养基组成。
33.上述组织培养方法中,所述培养的条件均为温度为25℃,光照黑暗时间为12h/12h。
34.为了解决上述技术问题,本发明还提供了用于槭叶铁线莲组织培养的试剂盒。
35.本发明提供的用于槭叶铁线莲组织培养的试剂盒包括上述发芽培养基、上述初代培养基和上述继代培养基。
36.进一步的,所述试剂盒还包括上述生根培养基。
37.更进一步的,所述试剂盒还包括上述乙醇溶液和上述次氯酸钠溶液。
38.上述试剂盒在如下x1)-x4)任一种中的应用也属于本发明的保护范围:
39.x1)槭叶铁线莲组织培养;
40.x2)制备槭叶铁线莲组织培养的产品;
41.x3)保护槭叶铁线莲;
42.x4)制备保护槭叶铁线莲的产品。
43.本发明提供的槭叶铁线莲组织培养方法具有以下优点:
44.第一,本发明以槭叶铁线莲种子为材料,并以其发芽培养后获得的种苗为研究对象,比较了在根茎连接处不同部位切割获得的切除根部的种苗作为外植体的增殖效果。与茎段、根尖等相比,本发明使用种子作为材料获取外植体可以最大程度的避免植株受到伤害,最大程度的保护植物,同时种子繁殖能够较好的保持植物的遗传多样性,尤其对分布狭窄的珍稀植物种群的繁殖有重要意义。
45.第二,本发明的初代培养基起到的作用有两个:一个是诱导产生愈伤组织,另一个是初步诱导出芽。与仅诱导出愈伤组织的培养基配方相比,可提高分化速率,快速成苗。这
对于生长速度极慢的槭叶铁线莲繁殖有非常重要的意义,是解决槭叶铁线莲繁育的一个突破点。同时本发明中的继代培养基又可以进一步促进芽的增殖,并起到壮苗的作用,加速成苗过程。
46.第三,本发明通过大量实验研究发现:与“ms培养基是铁线莲属植物的最基本培养基”,“6ba、naa、kt是最常用激素”和“在两种大花组铁线莲组织培养中加入玉米素zt没有反应”等铁线莲属植物组织培养相关研究和报道不同,在槭叶铁线莲组织培养中,white培养基在发芽培养阶段有较好的效果,而在愈伤组织诱导和不定芽的增殖过程中,玉米素zt的效果优于只使用6ba、naa,也优于kt。
47.第四,本发明组织培养方法以槭叶铁线莲种子为材料经过发芽培养、初代培养、继代培养和生根培养,仅需半年左右即可获得5cm左右的槭叶铁线莲幼苗,芽增殖系数较高(大于7),对于短时间内增加槭叶铁线莲植株数量,保护槭叶铁线莲,具有重要意义。
附图说明
48.图1为槭叶铁线莲生境。
49.图2为槭叶铁线莲种子在体式显微镜下的观察结果及在生境中的图片。图2a为槭叶铁线莲种子在体式显微镜下的观察结果。图2b和图2c为槭叶铁线莲种子在生境中的图片,其中红色圈内为飘落的槭叶铁线莲种子。
50.图3为槭叶铁线莲种子在不同发芽培养基中的长势情况。从左到右依次为white培养基、ms培养基、wpm培养基。
51.图4为槭叶铁线莲外植体在最佳初代培养基中的生长情况。
52.图5为槭叶铁线莲愈伤组织在最佳继代培养基中的生长和繁殖情况。图5a为槭叶槭叶铁线莲愈伤组织在最佳继代培养基中的生长情况。图5b和图5c为批量繁殖槭叶铁线莲的外植体增殖情况。
53.图6为槭叶铁线莲种苗及根茎部连接处的不同切割位置的示意图。图6a为槭叶铁线莲种苗在肉眼下的观察结果。图6b和图6c为槭叶铁线莲种苗在体视显微镜下的观察结果,其中1-5所示的箭头分别表示不同的切割位置,对应表6的5个处理。
54.图7为槭叶铁线莲不定芽在最佳生根培养基中的生长情况。
具体实施方式
55.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
56.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
57.下述实施例中涉及的试剂及来源如下:
58.次氯酸钠naclo溶液是福晨(天津)化学试剂有限公司的产品。
59.无水乙醇是天津市汇杭化工科技有限公司的产品。
60.蔗糖是天津市光复科技发展有限公司的产品。
61.琼脂、white盐、ms盐和wpm盐均是phytotechnology品牌(西美杰公司代理)的产品。
62.植物激素6ba、naa、iaa、iba、kt、zt、ga、2,4-d均是北京科舟生物技术有限公司的产品。
63.下述实施例中涉及的培养基及配方如下:
64.ms培养基溶剂为水,溶质及其浓度为ms盐4.43g/l,琼脂7g/l,蔗糖30g/l;ph值调整至5.8。
65.white培养基溶剂为水,溶质及其浓度为white盐0.93g/l,琼脂7g/l,蔗糖30g/l;ph值调整至5.8。
66.wpm培养基溶剂为水,溶质及其浓度为wpm盐2.41g/l,琼脂7g/l,蔗糖30g/l;ph值调整至5.8。
67.1/2ms培养基与ms培养基的区别仅在于:大量元素用量为ms培养基中大量元素用量的1/2。
68.1/4ms培养基与ms培养基的区别仅在于:大量元素用量为ms培养基中大量元素用量的1/4。
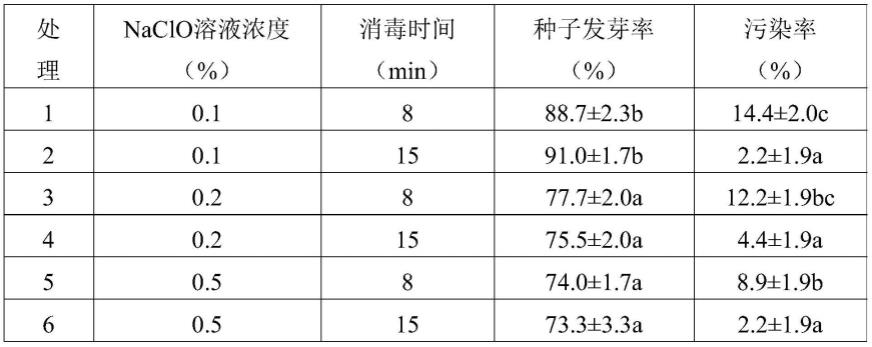
69.1/2wpm培养基与wpm培养基的区别仅在于:所有元素用量为wpm培养基中元素用量的1/2。
70.下述实施例中的槭叶铁线莲种子于2018年至2020年搜集自北京房山和门头沟的槭叶铁线莲分布地。搜集方式如下:槭叶铁线莲种子具有尾毛(图2a),在成熟期被风吹散,可飘落至生境的悬崖石缝或蜘蛛网等处(图2b和c),通过搜集即可获得。
71.下述实施例中的槭叶铁线莲的培养条件如下:温度为25℃,光照黑暗时间为12h/12h。
72.实施例1、槭叶铁线莲组织培养方法的优化
73.一、消毒条件的优化
74.使用体积分数为70%的乙醇溶液对槭叶铁线莲种子进行消毒处理30s,再分别使用浓度为0.5%、0.2%或0.1%的naclo溶液消毒15min或8min,得到消毒处理后的种子。将消毒处理后的种子放入含有发芽培养基(white培养基)的三角瓶中培养,每粒种子放置在1个三角瓶中,每个处理设置3个重复,每个重复30粒种子。15天后统计污染率,连续5天不发芽时认定种子发芽结束,统计种子发芽率。
75.污染率=污染的种子数目/参与试验的种子数目。
76.种子发芽率=发芽结束时发芽的种子数目/参与试验的种子数目。
77.结果如表1所示。通过表1可知,naclo浓度和消毒时间对槭叶铁线莲种子的发芽率和污染率均有显著影响。当naclo浓度为0.1%时,槭叶铁线莲种子发芽率显著高于浓度为0.2%和0.5%条件下的种子发芽率。当naclo浓度较高时,污染率显著下降,但种子发芽率也发生下降。综合考虑种子发芽率和污染率,优选处理2,即使用浓度为0.1%的naclo溶液消毒15min作为槭叶铁线莲种子的最佳消毒条件。
78.表1、不同消毒条件对槭叶铁线莲种子发芽率和污染率的影响
[0079][0080]
注:表中的不同小写字母代表0.05水平差异显著。
[0081]
二、发芽培养基的优化
[0082]
将使用步骤一中确定的最佳消毒条件进行消毒处理后的槭叶铁线莲种子分别在5种含有不同发芽培养基的三角瓶中进行培养。从培养第8天开始统计发芽情况,连续5天没有新的种子发芽时,认定发芽结束,统计种子发芽率和简化活力指数svi。每个三角瓶中播种1粒种子,每个处理设置3个重复,每个重复25粒种子。
[0083]
种子发芽率=发芽结束时发芽的种子数目/参与试验的种子数目。
[0084]
简化活力指数svi=种子发芽率
×
根长,其中根长为在发芽结束时测量的根长。
[0085]
结果如表2和图3所示。通过表2可知,在不同发芽培养基中槭叶铁线莲种子的发芽率没有显著差异,但种苗后续长势存在显著差异(图3)。槭叶铁线莲种子在ms培养基中可以正常发芽,但是种苗生长过程中表现出根部变黑,根长较短,甚至幼苗死亡的不良性状;在1/2ms、1/4ms和wpm培养基中,槭叶铁线莲种子可以正常萌发,但长势较弱;在white培养基中,槭叶铁线莲种子可以正常萌发,且根长较长、种苗长势较壮。综合考虑种子发芽率和种苗长势,优选处理5,即使用white培养基作为槭叶铁线莲种子的最佳发芽培养基。
[0086]
表2、不同发芽培养基对槭叶铁线莲种子萌发的影响
[0087]
处理培养基种子发芽率(%)简化活力指数svi1ms89.3
±
2.3a1.05
±
0.11a21/2ms90.7
±
2.3a1.53
±
0.27b31/4ms90.7
±
2.3a1.88
±
0.18bc4wpm90.7
±
2.3a1.95
±
0.08c5white92.0
±
0a3.39
±
0.08d
[0088]
注:表中的不同小写字母表示0.05水平差异显著。
[0089]
三、初代培养基的优化
[0090]
将使用步骤一中确定的最佳消毒条件进行消毒处理后的槭叶铁线莲种子在步骤二中确定的最佳发芽培养基中培养得到种苗。以切除根部的种苗作为外植体分别在含有不同激素(6ba、naa、ga、kt、zt,2,4-d)的不同基础培养基(wpm培养基、white培养基、ms培养基、1/2ms培养基)中进行初代培养,每个处理设置3个重复,1个重复10个外植体。培养3个月后计算愈伤组织诱导率及芽增殖系数。
[0091]
愈伤组织诱导率=出现愈伤组织的数目/参与试验的外植体数目。
[0092]
芽增殖系数=芽数目/参与试验的外植体数目。
[0093]
结果表明:当选用ms培养基、1/2ms培养基作为基础培养基时,无论激素如何变化,外植体均会出现叶枯黄或茎秆变红等情况,显示ms培养基和1/2ms培养基并不适合作为槭叶铁线莲初代培养的基础培养基。当选用white培养基作为基础培养基时,调整激素比例及用量,均未出现芽直接增殖或者产生愈伤组织的情况,说明white培养基也不适合作为槭叶铁线莲初代培养的基础培养基。
[0094]
当选用wpm培养基作为基本培养基时,对于6ba+naa+ga三种激素组合处理后的外植体,无论激素浓度如何调整,后代产生愈伤组织的比例均较低(均小于10%);而对于6ba+naa+2,4-d三种激素组合处理后的外植体,产生的愈伤组织绿色、致密,但在后续芽增殖的过程中,芽的增殖率极低,约为6.7%左右。基于此,本发明使用6ba、naa为必选激素,kt、zt作为备选激素,对后代愈伤组织诱导率及不定芽的初步增殖情况进行统计。
[0095]
试验中发现,根据愈伤组织颜色的不同,愈伤组织共有白色疏松、绿色致密、淡绿色疏松3种状态。淡绿色疏松的愈伤组织在后续芽增殖中有较好的增殖效果。
[0096]
6ba+naa+kt三种激素组合对槭叶铁线莲初代培养的效果如表3所示,通过表3可知,使用kt后,有4个组合的愈伤组织的诱导率大于70%。整体看来有植株细弱、产生白色愈伤组织、愈伤组织褐色等问题。
[0097]
6ba+naa+zt三种激素组合对槭叶铁线莲初代培养的效果如表4所示,通过表4可知,仅使用6ba和naa,有愈伤组织生长状况,但是没有芽增殖情况;与之相比,使用zt后,有4个组合愈伤组织诱导率较高,大于80%,且有芽增殖情况,可获得带有初步分化的芽的愈伤组织。按照外植体较健壮,愈伤组织淡绿色、质地疏松,后代愈伤组织诱导率高,有芽增殖的标准,优选处理2,即使用含有4mg/ml 6ba+0.1mg/ml naa+0.5mg/ml zt三种激素的wpm培养基作为最佳初代培养基,外植体在初代培养基中培养3个月,愈伤组织诱导率可达96.7%,且芽增殖系数为2.7
±
0.5。槭叶铁线莲的外植体在最佳初代培养基中的生长情况如图4所示。
[0098]
表3、6ba+naa+kt对槭叶铁线莲初代培养的效果
[0099][0100]
注:表中的不同小写字母表示0.05水平差异显著。
[0101]
表4、6ba+naa+zt对槭叶铁线莲初代培养的效果
[0102][0103][0104]
注:表中的不同小写字母表示0.05水平差异显著。
[0105]
四、继代培养基的优化及不同外植体对继代培养效果的影响
[0106]
1、继代培养基的优化
[0107]
槭叶铁线莲的外植体在步骤三中确定的最佳初代培养基中培养3个月后,愈伤组织直径可达1.5cm左右,苗长可达3cm左右,将1块愈伤组织切成2个外植体(该外植体为带有初步分化的芽的愈伤组织),再分别转入含有不同激素(6ba、naa、zt)的wpm培养基中进行继代培养,培养3个月后计算芽增殖系数。每个处理设置3个重复,每个重复有10瓶,每瓶中接种1块愈伤组织切成的2个外植体。
[0108]
芽增殖系数=继代培养3个月后芽数目/参与试验的愈伤组织数目。
[0109]
结果如表5所示。通过表5可知,在4.5mg/ml 6ba+0.1mg/ml naa+0.8mg/ml zt组合情况下,后代芽增殖情况最好,因此优选处理5,即使用含有4.5mg/ml 6ba+0.1mg/ml naa+0.8mg/ml zt的wpm培养基作为最佳继代培养基,在最佳继代培养基中培养3个月后,可增殖7.6
±
0.6个外植体,苗长可达到5cm左右。槭叶铁线莲愈伤组织在最佳继代培养基中的生长情况如图5所示。
[0110]
表5、不同继代培养基的芽增殖情况
[0111]
处理6ba(mg/ml)naa(mg/ml)zt(mg/ml)芽增殖系数140.10.52.7
±
0.5a24.50.10.53.7
±
0.6b350.10.54.6
±
0.5c440.10.84.8
±
0.6c54.50.10.87.6
±
0.6e650.10.85.6
±
0.5d
[0112]
注:表中的不同小写字母表示0.05水平差异显著。
[0113]
2、不同外植体对继代培养效果的影响
[0114]
分别将带有初步分化的芽的愈伤组织、不带芽的愈伤组织和初步分化的芽(不带愈伤组织)在步骤1中确定的最佳继代培养基中进行培养,培养3个月后观察芽增殖情况。
[0115]
结果表明:带有初步分化的芽的愈伤组织和不带芽的愈伤组织在继代培养基中均可进一步促进芽分化,而初步分化的芽(不带愈伤组织)在继代培养基中有壮苗效果,但无
法继续进行芽分化。
[0116]
五、是否初代培养对组培效果的影响
[0117]
将使用步骤一中确定的最佳消毒条件进行消毒处理后的槭叶铁线莲种子在步骤二中确定的最佳发芽培养基中培养得到种苗。以切除根部的种苗作为外植体在步骤四中确定的最佳继代培养基中进行培养,每个处理设置3个重复,1个重复10个外植体。培养3个月后计算愈伤组织诱导率及芽增殖系数。
[0118]
结果表明:外植体在继代培养基中未出现愈伤组织和芽增殖的情况,甚至出现外植体萎蔫、生长停滞情况,说明不经过初代培养,外植体无法直接在继代培养基中成功诱导获得愈伤组织和芽。
[0119]
六、不同外植体对组培效果的影响
[0120]
将使用步骤一中确定的最佳消毒条件进行消毒处理后的槭叶铁线莲种子在步骤二中确定的最佳发芽培养基中进行培养,培养一个月,获得种苗。经过在培养期间的观察发现,随着培养时间的延长,培养获得的种苗根部和茎部的连接处会出现黑褐色(图6),在黑褐色连接处或其附近进行切割获取外植体,根据在黑褐色连接处进行切割的位置不同,分为如下5个处理组:
[0121]
处理组1:在种苗根部和茎部的连接处未出现黑褐色前,在根部和茎部连接处进行切割,以切除根部的种苗作为外植体。
[0122]
处理组2:在种苗根部和茎部的连接处出现黑褐色后,在黑褐色连接处的最上端进行切割,以切除根部的种苗作为外植体(该外植体不含有黑褐色连接处)。
[0123]
处理组3:在种苗根部和茎部的连接处出现黑褐色后,在黑褐色连接处的中间进行切割,以切除根部的种苗作为外植体(该外植体含有部分黑褐色连接处)。
[0124]
处理组4:在种苗根部和茎部的连接处出现黑褐色后,在黑褐色连接处的最下端进行切割,以切除根部的种苗作为外植体(该外植体含有全部黑褐色连接处)。
[0125]
处理组5:在种苗根部和茎部的连接处出现黑褐色后,在黑褐色连接处的下方进行切割,以切除根部的种苗作为外植体(该外植体含有全部黑褐色连接处且保留了一部分根部)。
[0126]
将上述处理组1-5获得的各外植体分别先在步骤三中确定的最佳初代培养基中培养3个月,再在步骤四中确定的最佳继代培养基中培养3个月,经过初代培养、继代培养后统计芽增殖系数。每个处理设置3个重复,每个重复10个外植体。
[0127]
芽增殖系数=芽数目/参与试验的外植体数目。
[0128]
结果如表6所示。经过比较可知,与其它各处理组相比,处理组4的芽增殖系数最高,增殖效果最好,说明处理组4更适合槭叶铁线莲繁殖。处理组1中芽增值系数较好,但标准差较大,实际试验过程中,处理组1中芽增殖情况重复性较差。因此优选处理组4,即以在黑褐色连接处最下端进行切割后获得的切除根部的种苗作为最佳外植体,该外植体在经过初代和继代培养后的芽增殖系数可达7.6
±
0.6。
[0129]
表6、外植体的不同切割方法对芽增殖系数的影响
[0130]
名称芽增殖系数处理组15.2
±
1.5b处理组24.5
±
0.5a
处理组34.6
±
0.5a处理组47.6
±
0.6c处理组54.2
±
0.7a
[0131]
注:表中的不同小写字母分别代表0.05水平差异显著。
[0132]
七、生根培养基的优化
[0133]
将步骤六中确定的最佳外植体先在步骤三中确定的最佳初代培养基中培养3个月,然后在步骤四中确定的最佳继代培养基中培养3个月后,再分别在不同的生根培养基中进行生根培养,培养30天后观察后代植株生长情况。根据生根培养基中的激素或浓度的不同,分为如下3个实验组:
[0134]
实验组1:含有1.0mg/ml naa和0.2mg/ml iba的1/2wpm培养基。
[0135]
实验组2:含有0.1mg/ml naa和0.1mg/ml iba的1/2wpm培养基。
[0136]
实验组3:含有0.2mg/ml 6ba和0.1mg/ml iaa的1/2wpm培养基。
[0137]
结果如表7所示。通过表7可知,与其它各实验组相比,经实验组3中的生根培养基培养获得的植株苗绿、健壮、有根,因此优选实验组3,即含有0.2mg/ml 6ba和0.1mg/ml iaa的1/2wpm培养基作为最佳生根培养基。槭叶铁线莲愈伤组织在最佳生根培养基中的生长情况如图7所示。
[0138]
表7、不同生根培养基对植株生长情况的影响
[0139]
名称植株生长情况实验组1苗发黄实验组2苗细弱,须根实验组3苗绿,健壮,有根
[0140]
实施例2、槭叶铁线莲组织培养方法的应用
[0141]
一、以2020年采自北京房山的槭叶铁线莲种子为试验材料进行槭叶铁线莲的组织培养
[0142]
1、消毒
[0143]
将槭叶铁线莲种子经过体积分数为70%的乙醇溶液处理30s,然后经过浓度为0.1%的naclo溶液消毒15min,得到消毒处理后的槭叶铁线莲种子。
[0144]
2、外植体的获得
[0145]
将步骤1获得的消毒处理后的槭叶铁线莲种子在实施例1步骤二中确定的最佳发芽培养基中进行发芽培养,发芽率为86.7
±
5.8%,并按照实施例1步骤六中确定的最佳外植体获取方法获取外植体。
[0146]
3、初代培养
[0147]
将步骤2获得的外植体接种至实施例1步骤三中确定的最佳初代培养基中进行初代培养,培养1个月后,开始出现槭叶铁线莲愈伤组织和初步分化的芽。
[0148]
4、继代培养
[0149]
将步骤3获得的带有初步分化的芽的愈伤组织接种至实施例1步骤四中确定的最佳继代培养基中进行继代培养,培养3个月后,得到槭叶铁线莲不定芽,芽增殖系数为7.6
±
0.5。
[0150]
5、生根培养
[0151]
将步骤4获得的槭叶铁线莲不定芽接种至实施例1步骤七中确定的最佳生根培养基中进行生根培养,培养25天后可长根。
[0152]
二、以2019年采自北京门头沟的槭叶铁线莲种子为试验材料进行槭叶铁线莲的组织培养
[0153]
1、消毒
[0154]
将槭叶铁线莲种子经过体积分数为70%的乙醇溶液处理30s,然后经过浓度为0.1%的naclo溶液消毒15min,得到消毒处理后的槭叶铁线莲种子。
[0155]
2、外植体的获得
[0156]
将步骤1获得的消毒处理后的槭叶铁线莲种子在实施例1步骤二中确定的最佳发芽培养基中进行发芽培养,发芽率为93.3
±
5.8%,并按照实施例1步骤六中确定的最佳外植体获取方法获取外植体。
[0157]
3、初代培养
[0158]
将步骤2获得的外植体接种至实施例1步骤三中确定的最佳初代培养基中进行初代培养,培养1个月后,开始出现槭叶铁线莲愈伤组织和初步分化的芽。
[0159]
4、继代培养
[0160]
将步骤3获得的带有初步分化的芽的愈伤组织接种至实施例1步骤四中确定的最佳继代培养基中进行继代培养,培养3个月后,得到槭叶铁线莲不定芽,芽增殖系数为7.7
±
0.5。
[0161]
5、生根培养
[0162]
将步骤4获得的槭叶铁线莲不定芽接种至实施例1步骤七中确定的最佳生根培养基中进行生根培养,培养25天后可长根。
[0163]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1