一种促进兰科植物种子快速成苗的方法
lindl.)。
12.其中,步骤s1中灭菌处理的方法为:在超净工作台上,用75%酒精灭菌60s,无菌水洗3次,0.1%升汞灭菌15min,无菌水洗4次。
13.其中,在步骤s2中,培养瓶中装有110ml基础培养基。
14.其中,在步骤s2中,切掉果荚两端,纵切剖开果荚,再将果荚放入装有20ml无菌水的瓶子中,轻轻摇晃,使果荚上的种子落入无菌水中,然后用吸管吸取0.5-1ml含有种子的无菌水均匀撒在均匀洒在培养瓶中的基础培养基上。
15.其中,在步骤s3和步骤s4中,培养瓶表面灭菌的方法为:用75%的酒精擦拭培养瓶表面灭菌。
16.其中,在步骤s3中,用无菌针管吸取10ml壮苗培养基均匀撒在小芽上。
17.其中,在步骤s4中,用无菌针管吸取10ml生根培养基均匀撒在小苗基部。
18.其中,步骤s2-步骤s4的培养条件为:温度为25
±
2℃,光照强度为1500~2000lx,光照时间12h/d。
19.与现有技术相比,本发明具有如下有益效果:
20.(1)本发明的提供的方法在整个过程只需进行1次接种,不需要转瓶,节省时间,降低污染,提高工作效率,且组培苗生长时间短,从播种到成苗只需270d,相比传统1年的繁育时间,大大缩短,能加快新品种繁育进程;
21.(2)与《一种白及组培苗一次性成苗的方法》(cn 108739380 a)相比,本发明采用的是固体状培养基喷洒,而该专利采用的是液体培养基,本发明使用针管吸取和喷洒固体培养基,能在小苗基部形成一定的空隙,保证小苗的呼吸,而液态培养基容易导致小苗因水份过多而死亡;
22.(3)传统组培苗生长过程只通过基部吸收营养,本发明在组培苗的生根阶段,通过喷雾机喷洒营养液,有效的促进了小苗叶片吸收,使小苗叶色更加浓绿,小苗健壮,移栽成活率更高。三十烷醇是一种适用范围相当广泛的植物生长促进剂,可经由植物的茎、叶吸收,然后促进植物的生长,增加干物质的积累、改善细胞膜的透性、增加叶绿素的含量、提高光合强度、增强淀粉酶、多氧化酶、过氧化物酶活性。海藻糖在提高组培苗的抗性方面有一定的作用,在移栽前通过叶面喷施可以提高移栽成活率。在植物体内的海藻糖可以保护植物在恶劣的环境条件下,免受外界的伤害,从而延长植物的生命。
具体实施方式
23.下面结合具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。实施例中采用的原料、实际若无特殊说明,皆为市售所得。
24.实施例1促进树兰种子快速成苗
25.步骤s1,果荚灭菌处理:选取尚未开裂、绿色、饱满、无病虫害的树兰果荚,用酒精棉球擦干净果荚表面的杂质,在超净工作台上,用75%酒精灭菌60s,无菌水洗3次,0.1%升汞灭菌15min,无菌水洗4次;
26.步骤s2,无菌播种:切掉果荚两端,纵切剖开果荚,再将果荚放入装有20ml无菌水的瓶子中,轻轻摇晃,使果荚上的种子落入无菌水中,然后用吸管吸取1ml无菌水和种子的混合液均匀撒在均匀洒在培养瓶中的基础培养基上,每个果荚可接种20瓶;所述基础培养
基的配方为:ms+6-ba 3.0mg/l+naa0.1mg/l+香蕉50g/l+蔗糖30g/l+琼脂4g/l;
27.步骤s3,壮苗培养:播种90d之后,种子萌发,用75%的酒精擦拭培养瓶表面灭菌,打开瓶盖,用无菌针管吸取10ml壮苗培养基均匀撒在小芽上;所述壮苗培养基的配方为:ms+6-ba 1.0mg/l+naa0.5mg/l+香蕉100g/l+蔗糖30g/l+琼脂4g/l;
28.步骤s4,生根培养:壮苗培养90d后,待小芽长出3-5片叶,株高达到3-4cm时,用75%的酒精擦拭培养瓶表面灭菌,打开瓶盖,用无菌针管吸取10ml生根培养基均匀撒在小苗基部,再用雾化机吸取营养液,向小苗的叶片上喷洒;所述生根培养基的配方为:ms+naa 1.0mg/l+香蕉100g/l+蔗糖30g/l+琼脂4g/l;所述营养液的配方为:ms+三十烷醇0.05g/l+海藻糖0.1g/l;
29.步骤s5,移栽:生根培养90d后,根系长出,即可移栽种植,总培养时间为270d。
30.实施例2促进石斛种子快速成苗
31.步骤s1,果荚灭菌处理:选取尚未开裂、绿色、饱满、无病虫害的石斛果荚,用酒精棉球擦干净果荚表面的杂质,在超净工作台上,用75%酒精灭菌60s,无菌水洗3次,0.1%升汞灭菌15min,无菌水洗4次;
32.步骤s2,无菌播种:切掉果荚两端,纵切剖开果荚,再将果荚放入装有10ml无菌水的瓶子中,轻轻摇晃,使果荚上的种子落入无菌水中,然后用吸管吸取1ml无菌水和种子的混合液均匀撒在均匀洒在培养瓶中的基础培养基上,每个果荚可接种10瓶;所述基础培养基的配方为:ms+6-ba 3.0mg/l+naa0.1mg/l+香蕉50g/l+蔗糖30g/l+琼脂4g/l;
33.步骤s3,壮苗培养:播种90d之后,种子萌发,用75%的酒精擦拭培养瓶表面灭菌,打开瓶盖,用无菌针管吸取10ml壮苗培养基均匀撒在小芽上;所述壮苗培养基的配方为:ms+6-ba 1.0mg/l+naa0.5mg/l+香蕉100g/l+蔗糖30g/l+琼脂4g/l;
34.步骤s4,生根培养:壮苗培养90d后,待小芽长出3-5片叶,株高达到3-4cm时,用75%的酒精擦拭培养瓶表面灭菌,打开瓶盖,用无菌针管吸取10ml生根培养基均匀撒在小苗基部,再用雾化机吸取营养液,向小苗的叶片上喷洒;所述生根培养基的配方为:ms+naa 1.0mg/l+香蕉100g/l+蔗糖30g/l+琼脂4g/l;所述营养液的配方为:ms+三十烷醇0.05g/l+海藻糖0.1g/l;
35.步骤s5,移栽:生根培养90d后,根系长出,即可移栽种植,总培养时间为270d。
36.对照实施例3树兰种子传统培养方法
37.步骤s1,果荚灭菌处理:选取尚未开裂、绿色、饱满、无病虫害的树兰果荚,用酒精棉球擦干净果荚表面的杂质,在超净工作台上,用75%酒精灭菌60s,无菌水洗3次,0.1%升汞灭菌15min,无菌水洗4次;
38.步骤s2,无菌播种:切掉果荚两端,纵切剖开果荚,用镊子取出种子,将其均匀地撒播在萌发诱导培养基(1/2ms+naa0.1 mg/l+椰汁50ml/l+蔗糖30g/l+琼脂4.2g/l)。培养室温度23℃~27℃,光照强度2400lx~3200lx,光周期10h~12h(以下同);
39.步骤s3,一次壮苗培养:播种90d后,种子萌发,选取萌发的健壮树兰幼苗,插入壮苗培养基中(ms+6-ba 1.0mg/l+naa0.5mg/l+香蕉100g/l+蔗糖30g/l+琼脂4g/l);
40.步骤s4,二次壮苗培养:一次壮苗80d后,树兰幼苗长高,取出小苗插入新的壮苗培养基中(ms+6-ba 1.0mg/l+naa0.5mg/l+香蕉100g/l+蔗糖30g/l+琼脂4g/l);
41.步骤s5,生根培养:二次壮苗80d后,将树兰无菌小苗切成单株,接入生根培养基中
(1/2ms+naa0.5 mg/l+香蕉50g/l+白砂糖25g/l+琼脂4.2g/l,ph 5.5~5.8);
42.步骤s6,移栽:生根培养80d后,根系长出,即可移栽种植,总培养时间为330d。
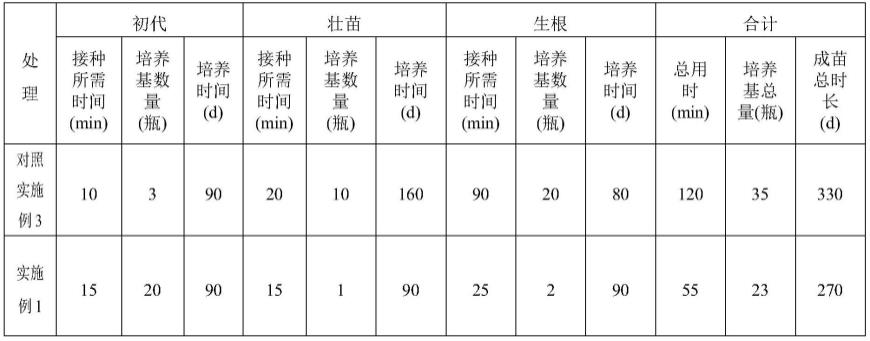
43.调查实施例1和对照实施例3所耗费的人工时间和培养瓶数,结果如表1所示:
44.表1实施例1和对照实施例3所耗费的人工时间和培养瓶数
[0045][0046]
从表1可以看出,采用本发明的方法,处理每个培养瓶所耗费的人工时间更短,工作效率更高,生产成本较低。
[0047]
分别统计50株实施例1和对照实施例3的树兰生根苗移栽90d后的平均株高、叶片数、移栽成活率,结果如表2所示:
[0048]
表2实施例1和对照实施例3的树兰生根苗移栽效果对比
[0049][0050]
从表2可以看出,实施例1得到的生根苗在移栽90d后,不管是株高,还是叶片数、移栽成活率,均优于对照实施例3的生根苗。
[0051]
前述对本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1