一种辐花苣苔组织培养快繁方法与流程
1.本发明涉及辐花苣苔繁殖相关领域,具体为一种辐花苣苔组织培养快繁方法。
背景技术:
2.苦苣苔科植物多为多年生草本,中国苦苣苔科植物在喀斯特地貌地区分布较多,是特化适应石灰岩地貌的一个重要类群,具有重要的观赏价值。该科植物多分布于热带及亚热带荫蔽潮湿区域,多数植株或生长在岩石壁上,或见于林下斜坡,具有极强的耐荫性。
3.辐花苣苔是多年生草本,花冠紫色或蓝色,花期8月,因其花辐射对称被收录在单型属辐花苣苔属中,2011年被并入广义马铃苣苔属,为国家一级重点保护野生植物,极狭域分布在海拔1500~1600m之间的林下岩石上,它的存在对于研究贵州喀斯特环境演变与生物多样性起源及进化具有重要作用。
4.在相同的生态条件下濒危植物通常表现出生存力及适应力较差的共同特征,因其结实率、种子萌发率低等因素,致使珍稀濒危植物繁殖能力极弱,种群数量日趋减少。近年来,辐花苣苔居群及栖息地面积有明显的下降趋势,这说明了其对环境要求的严格程度及自身对环境适应的脆弱性,目前对原产苦苣苔科植物的研究相对缺乏,没有一个具体的对于珍稀濒危植物辐花苣苔的组织培养技术。
5.为解决辐花苣苔野外居群数量极少的问题,急需开展其组织培养技术研究。利用快速繁殖的方法(即在短期内获得遗传性一致的大量再生植株的方法)建立快繁体系,对该物种进行有效的人工繁殖保育。
技术实现要素:
6.本发明的目的在于提供一种辐花苣苔组织培养快繁方法,以解决上述背景技术中提出的目前对原产苦苣苔科植物的研究相对缺乏,没有一个具体的对于珍稀濒危植物辐花苣苔的组织培养技术,辐花苣苔野外居群数量极少的问题。
7.为实现上述目的,本发明提供如下技术方案:一种辐花苣苔组织培养快繁方法,包括如下步骤:
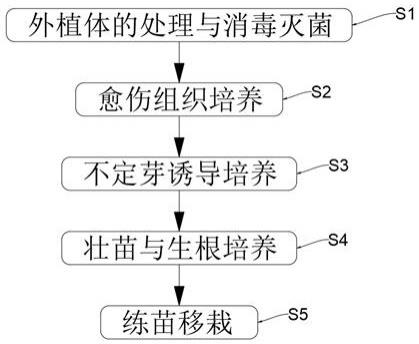
8.s1:外植体的处理与消毒灭菌;
9.将剪下的嫩叶用加有适量洗涤剂的自来水洗净,再用流水冲洗30min,去除外植体表面的杂质,在超净台进行灭菌处理,用75%无水乙醇消毒20s,消毒后用无菌水清洗3次,再用0.1%升汞浸泡消毒5min,消毒后用无菌水清洗5次,用无菌滤纸吸干外植体表面水分,后将嫩叶剪为1cm
×
1cm的方块,放入培养基;
10.s2:愈伤组织培养;
11.将灭菌后的叶片接种至愈伤组织培养基中,进行愈伤组织培养;
12.所述愈伤组织培养基为包括以下浓度组分的1/2ms培养基:4.0mg/l 6-ba、20g/l蔗糖和5.0g/l琼脂;
13.所述愈伤组织培养基的ph值为5.7;
14.s3:不定芽诱导培养;
15.将获得的愈伤组织接种至诱导不定芽培养基中,进行不定芽诱导培养;
16.所述诱导不定芽培养基为包括以下浓度组分的1/2ms培养基:4.0mg/l 6-ba、0.1mg/l naa、20g/l蔗糖和5.0g/l琼脂;
17.所述诱导不定芽培养基的ph值为5.7;
18.s4:壮苗与生根培养;
19.将获得的不定芽接入壮苗与生根培养培养基中,进行壮苗与生根培养;
20.s5:练苗移栽;
21.选取长势、根系良好的组培瓶苗,打开瓶盖放置在自然环境下,7d后在温室中进行炼苗移栽,将组培瓶苗从培养中取出,用流水洗净根部残留培养基,移栽到装有基质的育苗盘中,在室内自然条件下驯化培养;
22.所述育苗盘中基质采用草炭:蛭石:珍珠岩=1:1:1。
23.优选的,所述s2、s3和s4中,培养温度为23℃;在培养期间进行光照,光暗周期比为10:14,光照的强度为1300~1800lux。
24.优选的,所述s4中,所述壮苗培养基为包括以下浓度组分的1/2ms培养基:4.0mg/l 6-ba、0.2mg/l naa、0.1mg/l iba、20g/l蔗糖、5.0g/l琼脂和1.0g/l活性炭;
25.所述壮苗培养基的ph值为5.7。
26.优选的,所述s4中,所述生根培养基为包括以下浓度组分的1/2white培养基:4.0mg/l 6-ba、0.2mg/l naa、0.1mg/l iba、20g/l蔗糖、5.0g/l琼脂和1.0g/l活性炭;
27.所述生根培养基的ph值为5.7。
28.优选的,所述s4中,所述生根培养基为包括以下浓度组分的1/2white培养基:4.0mg/l 6-ba、0.2mg/l naa、0.5mg/l iba、20g/l蔗糖、5.0g/l琼脂和1.0g/l活性炭;
29.所述生根培养基的ph值为5.7。
30.优选的,所述s1中,0.1%升汞浸泡消毒过程中轻微震荡瓶身,使外植体得到充分消毒。
31.优选的,所述s1中,1cm
×
1cm的嫩叶方块放入培养基时叶面朝上。
32.与现有技术相比,本发明的有益效果是:
33.1、该发明中,从不同外植体和消毒剂对比、不同消毒时间、愈伤诱导、不定芽诱导、壮苗与生根培养、移栽基质筛选等系统完整的研究了辐花苣苔的组培快繁技术体系,为辐花苣苔种质资源的保护和离体保存提供了技术保障。能够利用组培快繁技术体系,对该物种进行有效的人工繁殖保育,解决了目前对原产苦苣苔科植物的研究相对缺乏,没有一个具体的对于珍稀濒危植物辐花苣苔的组织培养技术,辐花苣苔野外居群数量极少的问题。
34.2、该发明中,采用75%无水乙醇消毒20s,用无菌水清洗3次,0.1%升汞浸泡5min,用无菌水清洗5次的消毒灭菌方案,可有效降低外植体污染率,且减少外植体死亡率。
35.3、该发明中,(1/2ms+4.0mg/l 6-ba)组合中愈伤组织诱导速度较快、诱导率较高;(1/2ms+4.0mg/l 6-ba+0.1mg/l naa)组合对不定芽的诱导效果最优,不定芽诱导率高;(1/2ms+4.0mg/l 6-ba+0.2mg/l naa+0.1mg/l iba)组合对壮苗培养效果最优,小苗叶片较绿较大,生长状况较好,(1/2white+4.0mg/l 6-ba+0.2mg/l naa+0.1mg/l iba)和(1/2white+4.0mg/l 6-ba+0.2mg/l naa+0.5mg/l iba)组合生根率最高,根较粗壮且长;等比例的草
炭:蛭石:珍珠岩组合基质的移栽成活率最高。通过愈伤诱导、不定芽诱导、壮苗与生根培养、移栽基质筛选等步骤各项数据的定量化完成对辐花苣苔的组织培养快繁,有利于标准化优质培养繁殖。
附图说明
36.图1为本发明的一种辐花苣苔组织培养快繁方法的方法步骤图。
具体实施方式
37.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
38.1.材料与方法
39.1.1试验材料
40.供试材料为保育于中国苦苣苔科植物保育中心(贵州)的辐花苣苔,保育地位于贵州省贵阳市,贵州省植物园内(106
°
42
′
e,26
°
34
′
n),海拔约1300m,年均气温15.3℃,相对湿度约为74%,年平均总降水量为1174.7mm,试验时选择长势良好、无病虫害的嫩叶作为外植体。
41.1.2试验方法
42.1.2.1外植体的处理与消毒灭菌
43.将剪下的嫩叶用加有适量洗涤剂的自来水洗净,再用流水冲洗30min,去除外植体表面的杂质,在超净台进行灭菌处理。
44.用75%无水乙醇消毒20s,消毒后用无菌水清洗3次,再用0.1%升汞进行浸泡消毒,消毒时间分别为3、5、7、9min,消毒后用无菌水清洗5次,在灭菌过程中轻微震荡瓶身,使外植体得到充分消毒。
45.用无菌滤纸吸干外植体表面水分,后将嫩叶剪为1cm
×
1cm的方块,放入培养基时叶面朝上。
46.1.2.2愈伤组织与不定芽诱导培养
47.培养条件:温度为23℃;在培养期间进行光照;光暗周期比为10:14;光照的强度为1300~1800lux。
48.固定培养条件:c1~c10、f1~f10中加入20g/l蔗糖,5.0g/l琼脂,调节ph值为5.7。
49.表1愈伤组织与不定芽诱导培养的生长激素组合
50.[0051][0052]
将灭菌后的叶片接种至c1c10、f1f10培养基中。每瓶接种1片,每种培养基接种叶片30片,3次重复。
[0053]
愈伤组织培养20d后,统计叶片诱导出的愈伤组织数,计算出愈率。
[0054]
选取诱导出的愈伤组织叶片进行不定芽诱导培养60d后,统计愈伤分化出的不定芽数,计算出芽率。
[0055]
1.2.3壮苗与生根培养
[0056]
培养条件:温度为23℃;在培养期间进行光照;光暗周期比为10:14;光照的强度为1300~1800lux。
[0057]
固定培养条件:t1~t10中加入20g/l蔗糖,5.0g/l琼脂,1.0g/l活性炭,调节ph值
为5.7。
[0058]
表2壮苗与生根培养的生长激素组合
[0059]
编号生长激素组合t11/2ms+6-ba 4.0mg/l+naa 0.2mg/l+iba 0.1mg/lt21/2ms+6-ba 4.0mg/l+naa 0.2mg/l+iba 0.3mg/lt31/2ms+6-ba 4.0mg/l+naa 0.2mg/l+iba 0.5mg/lt41/2ms+6-ba 4.0mg/l+naa 0.2mg/l+iba 0.7mg/lt51/2ms+6-ba 4.0mg/l+naa 0.2mg/l+iba 1.0mg/lt61/2white+6-ba 4.0mg/l+naa 0.2mg/l+iba 0.1mg/lt71/2white+6-ba 4.0mg/l+naa 0.2mg/l+iba 0.3mg/lt81/2white+6-ba 4.0mg/l+naa 0.2mg/l+iba 0.5mg/lt91/2white+6-ba 4.0mg/l+naa 0.2mg/l+iba 0.7mg/lt101/2white+6-ba 4.0mg/l+naa 0.2mg/l+iba 1.0mg/l
[0060]
将获得的不定芽接入t1~t10培养基中。每瓶接种1株叶片量与长势一致的不定芽小苗,每种培养基接种30株,3次重复。
[0061]
培养60d后,统计植株的平均株高并记录其生长状况,并观察统计根长及生根株数,计算生根率。
[0062]
1.2.4练苗移栽
[0063]
选取长势、根系良好的组培瓶苗,打开瓶盖放置在自然环境下,7d后在温室中进行炼苗移栽,将组培瓶苗从培养中取出,用流水洗净根部残留培养基,移栽到装有基质的育苗盘中,基质采用草炭:蛭石:珍珠岩=1:1:1,草炭:珍珠岩=1:1,鹿沼土:树皮=1:1,每盆育苗盘移栽长势大小一致的5株组培苗,3次重复,在室内自然条件下驯化培养,移栽30d后统计移栽成活率。
[0064]
2数据统计与处理
[0065]
愈伤组织诱导率=产生愈伤组织个数/外植体数
×
100%;
[0066]
不定芽诱导率=产生不定芽数/愈伤组织数
×
100%;
[0067]
污染率=污染外植体数/外植体数
×
100%;
[0068]
死亡率=死亡外植体数/外植体数
×
100%(外植体没有萌动现象且黑化即判定为死亡);
[0069]
存活率=未污染且萌动个数/外植体数
×
100%;
[0070]
生根率=生根株数/接种株数
×
100%;
[0071]
移栽成活率=移栽成活数/移栽总数
×
100%。
[0072]
试验数据均采用excel 2007(2007,美国)和spss(13.0,美国)分析处理,lsd法进行差异显著性检验(p≤0.05)。
[0073]
3分析与结果
[0074]
3.1不同消毒灭菌时间对外植体的影响
[0075]
采用4组不同消毒灭菌时间的方法,结果由表3可知,外植体的污染率随时间的增加而减少,其中消毒时间5min和7min外植体污染率相同;外植体的存活率先升高而后降低,其中消毒时间为5min时外植体存活率高达90%,说明用0.1%升汞消毒灭菌可有效降低外
植体污染率,但消毒灭菌时间超过5min会使外植体死亡率升高。
[0076]
表3不同消毒灭菌时间
[0077][0078][0079]
因此选出最佳消毒灭菌方法:75%无水乙醇消毒20s,用无菌水清洗3次,0.1%升汞浸泡5min,用无菌水清洗5次。
[0080]
3.2不同植物激素与培养基浓度组合对愈伤组织诱导培养的影响
[0081]
将消毒灭菌后的外植体接种至c1~c10愈伤组织诱导的培养基上,其中c1~c5采用ms为基础培养基,c5~c10采用1/2ms为基础培养基,分别观察到c1~c5和c5~c10在培养30d和22d后外植体均出现叶片边缘隆起的现象,由此可知1/2ms培养基诱导率更快。从表4得知,采用细胞分裂素6-ba不同浓度配比下的ms和1/2ms培养基对辐花苣苔植体愈伤组织诱导的影响不同,其中以ms为基础培养基中,1.0mg/l与4.0mg/l6-ba组合中愈伤组织诱导率分别为12.2%和65.6%,以1/2ms为基础培养基中,1.0mg/l与4.0mg/l 6-ba组合中愈伤组织诱导率分别为22.2%和77.8%,c9显著大于其他组合,c1~c4和c5~c9组合中随着6-ba浓度升高,诱导率逐渐增加,当6-ba浓度超过4.0mg/l时出现抑制生长现象。
[0082]
表4不同植物激素与培养基浓度组合对愈伤组织诱导培养的影响
[0083]
[0084][0085]
由此得出,c9(1/2ms+4.0mg/l 6-ba)组合中诱导速度较快、诱导率较高,为最优条件。
[0086]
3.3不同植物激素浓度组合对不定芽诱导培养的影响
[0087]
在获得愈伤组织诱导培养最优组合的基础上,将获得的愈伤组织接种至f1~f10的不定芽诱导培养基中,都采用1/2ms为基础培养基,60d后观察出芽数,愈伤组织开始形成黄绿色圆点,再逐渐分化为不定芽,由表5得知,f1~f5和f6~f10组合中随着naa浓度升高,诱导率逐渐增加,f10组合的不定芽诱导率小于70%,其余组合均大于70%,f1不定芽诱导率显著大于其他组合,原因在于6-ba与naa浓度已达到不定芽诱导的抑制点,两者浓度继续增大会抑制不定芽诱导。
[0088]
表5不同植物激素浓度组合对不定芽诱导培养的影响
[0089][0090][0091]
由此可知,f1(1/2ms+4.0mg/l 6-ba+0.1mg/l naa)组合对不定芽的诱导效果最优,生长速度快、不定芽诱导率高。
[0092]
3.4不同植物激素与培养基浓度组合对壮苗与生根培养的影响
[0093]
在获得不定芽诱导培养最优组合的基础上,将得到的不定芽接种至t1~t10的壮
苗与生根培养基中,采用1/2ms和1/2white为基础培养基,60d后观察小苗生长状态及生根情况。
[0094]
由表6分析,根据小苗的平均株高可知,t1~t5组合中随着iba浓度升高,苗平均株高逐渐降低,iba浓度超过0.1mg/l时,出现抑制苗生长现象,t6~t10组合中无论iba浓度大小,小苗平均株高均无显著差异,t1~t5组合的苗平均株高为1.42cm,显著大于t6~t10组合的苗平均株高0.55cm,总体来说,t1~t5组合小苗的叶片较大,叶绿素含量多,生长状态较好,其中t1组合小苗状态最佳,t6~t10组合的小苗叶片较小且出现发黄现象。
[0095]
根据生根率可知,t1~t4组合中随着iba浓度升高,生根率逐渐增加,t4与t5的生根率相同,在iba浓度达到0.7mg/l时,生根率维持平衡不再升高,同时t1~t5组合产生大量的气生根,t6~t10组合中随着iba浓度升高,出现了生根率先降低后升高再降低的趋势,在iba浓度达到0.7mg/l时,生根率降低,出现抑制根生长现象,t1~t5组合的平均生根率为25.3%,显著小于t6~t10组合的平均生根率90.7%,总体来说,t6~t10组合小苗的根较粗壮,生长状况较好,有分支且有明显的根毛结构,其中t6与t8组合根状态最佳。从整体上说明了1/2ms作为基础培养基更适合壮苗,1/2white作为基础培养基更适合生根。
[0096]
表6不同植物激素浓度组合对壮苗与生根培养的影响
[0097]
植物激素组合接种株数平均株高(cm)生根株数生根率(%)t1152.42
±
1.33a213.3
±
1.44bt2151.55
±
1.22b320.0
±
0.00bt3151.29
±
1.50bc426.7
±
1.89bt4151.17
±
0.26c533.3
±
1.29bt5150.67
±
1.03d533.3
±
1.43bt6150.55
±
0.78d15100.0
±
0.00at7150.48
±
1.63d1386.7
±
0.25at8150.58
±
1.12d15100.0
±
0.00at9150.54
±
0.75d1386.7
±
1.63at10150.62
±
1.09d1280.0
±
0.33a
[0098]
由此可知,t1(1/2ms+4.0mg/l 6-ba+0.2mg/l naa+0.1mg/l iba)组合对壮苗培养效果最优,小苗叶片较绿较大,生长状况较好;t6(1/2white+4.0mg/l 6-ba+0.2mg/l naa+0.1mg/l iba)和t8(1/2white+4.0mg/l 6-ba+0.2mg/l naa+0.5mg/l iba)组合生根率最高,根较粗壮且长。
[0099]
3.5不同基质组合对组培苗移栽的影响
[0100]
由表7可知,30d后统计移栽成活率,等比例的三种基质组合相比,草炭:蛭石:珍珠岩组合的移栽成活率最高为93.3%,显著高于其他两种基质,组培苗生长状况较优良,较健壮,草炭土:珍珠岩组合次之为73.3%,鹿沼土:树皮组合最低为46.7%。
[0101]
表7不同基质组合对组培苗移栽的影响
[0102]
基质组合比例移栽总数移栽成活数移栽成活率(%)生长状况草炭:蛭石:珍珠岩1:1:1151493.3
±
0.44a长势优良,苗较健壮草炭:珍珠岩1:1151173.3
±
0.51b长势一般,苗细弱鹿沼土:树皮1:115746.7
±
0.22c长势差,苗细弱
[0103]
由此可知,等比例的草炭:蛭石:珍珠岩组合基质的移栽成活率最高。
[0104]
4讨论与结论
[0105]
在植物组培技术研究中,对外植体的选择要遵循再生能力强和遗传稳定性好的原则,而获得无菌外植体是组培成功的必要前提。目前外植体灭菌的常用消毒剂主要有升汞与次氯酸钠,在组培过程中,为获得无菌外植体而选择合适的消毒剂和消毒时间尤为重要。本发明在外植体和消毒剂选择环节,分别采用叶片和茎段、次氯酸钠和升汞,在相同的试验条件下,培养5天后茎段全部死亡,叶片状态正常,用次氯酸钠作消毒剂的外植体在两天内全部污染,可能是辐花苣苔的叶片两面密被贴伏较多的白色短柔毛,次氯酸钠灭菌不完全导致污染率高,在外植体和消毒剂选择完成的基础上对消毒时间进行筛选,最终采用75%无水乙醇消毒20s,无菌水清洗3次,0.1%升汞浸泡5min,无菌水清洗5次,存活率高达90.0%。
[0106]
植物生长调节剂是影响植物离体形态发生的最重要影响因子,由于植物外植体中原本就含有不同种类与浓度的内源激素,所以需添加的外源激素种类及浓度也就不同,在离体形态发生过程中,生长素促进外植体生长与生根,且能与细胞分裂素共同作用诱导不定芽分化及侧芽形成,细胞分裂素促进分化和芽形成,抑制根的发育与衰老,因此,筛选适宜的植物生长调节剂种类和浓度配比对细胞脱分化、再分化并形成再生植物有关键性作用。本发明在叶片的愈伤组织诱导中单独采用了细胞分裂素6-ba诱导已有较好的效果,当6-ba浓度超过一定浓度时出现抑制生长现象,不定芽诱导采用6-ba和naa结合效果最佳。
[0107]
而对愈伤组织诱导的方法相比较为简单,表明辐花苣苔在愈伤组织诱导培养阶段只需添加单一的细胞分裂素就有较好的效果,可能本身的内源激素已经足够促进愈伤组织形成,在今后的研究中可采取降低甚至不添加激素的方法,减少激素积累造成植株遗传性状不稳定的影响,获得优良植株。
[0108]
本发明在壮苗与生根培养阶段采用较高浓度的6-ba和naa、iba组合,ms培养基含无机盐浓度高,元素平衡较好,缓冲性能好,white培养基是一种无机盐类浓度较低的培养基,非常适合于生根和幼胚的培养,因此,以1/2ms和1/2white为基本培养基,以1/2ms为培养基容易让植株产生气生根,影响植株生长,但与一定浓度范围的细胞分裂素和生长素结合又能促进壮苗,以1/2white培养基结合一定浓度范围的细胞分裂素和生长素促进生根。
[0109]
对辐花苣苔组培苗移栽,使用等比例基质草炭:蛭石:珍珠岩组合最优,草炭土和蛭石能保肥和保水,珍珠岩使基质疏松透气,利于根部生长,移栽成活率最高且生长状态最好。
[0110]
综上所述,最佳消毒灭菌方法为75%无水乙醇消毒20s,用无菌水清洗3次,0.1%升汞浸泡5min,用无菌水清洗5次;c9(1/2ms+4.0mg/l 6-ba)组合中愈伤组织诱导速度较快、诱导率较高;f1(1/2ms+4.0mg/l 6-ba+0.1mg/l naa)组合对不定芽的诱导效果最优,不定芽诱导率高;t1(1/2ms+4.0mg/l 6-ba+0.2mg/l naa+0.1mg/l iba)组合对壮苗培养效果最优,小苗叶片较绿较大,生长状况较好,t6(1/2white+4.0mg/l 6-ba+0.2mg/l naa+0.1mg/l iba)和t8(1/2white+4.0mg/l 6-ba+0.2mg/l naa+0.5mg/l iba)组合生根率最高,根较粗壮且长;等比例的草炭:蛭石:珍珠岩组合基质的移栽成活率最高。从不同外植体和消毒剂对比、不同消毒时间、愈伤诱导、不定芽诱导、壮苗与生根培养、移栽基质筛选等系统完整的研究了辐花苣苔的组培快繁技术体系,为辐花苣苔种质资源的保护和离体保存提
供了技术保障。
[0111]
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1