一种含牡丹提取物的植物复合抗菌剂及其制备方法和应用与流程
1.本发明涉及植物抗菌剂技术领域,具体涉及一种含牡丹提取物的植物复合抗菌剂及其制备方法和应用。
背景技术:
2.植物病原真菌会影响农作物的生长。而化学农药的使用会在作物、水和土壤中有残留,导致农药残留超标和环境污染等为题。同时化学农药也会抑制甚至杀死土壤中的其它有益微生物,使土壤有机质含量下降,降低土壤肥力,带来诸多社会、经济和生态问题。
3.抗菌剂,是指一类用来防治各类病源微生物引起植物病害的药剂。对病原微生物有杀死作用或抑制生长作用,但又不妨碍植物正常生长的药剂。抗菌剂一般分为无机抗菌剂,有机抗菌剂和天然抗菌剂。无机抗菌剂是利用银、铜、锌等金属的抗菌能力,通过物理吸附离子交换等方法,将银、铜、锌等金属(或其离子)固定在氟石、硅胶等多孔材料的表面制成抗菌剂,然后将其加入到相应的制品中即获得具有抗菌能力的材料。水银、镉、铅等金属也具有抗菌能力,但对人体有害;铜、镍、铅等离子带有颜色,将影响产品的美观,锌有一定的抗菌性,但其抗菌强度仅为银离子的1/1000。有机抗菌剂的主要品种有香草醛或乙基香草醛类化合物,还有酰基苯胺类、咪唑类、噻唑类、异噻唑酮衍生物、季铵盐类、双呱类、酚类等。一般来说有机抗菌剂耐热性差些,容易水解,有效期短。天然抗菌剂主要提取于天然物质,是最早为人们所使用的抗菌剂。天然抗菌剂按其来源分为三类:一是植物源抗菌剂,此类抗菌剂中的有效成分主要是萜类化合物及其衍生物等;二是动物源抗菌剂,此类抗菌剂中最常用的是壳聚糖,这类抗菌剂的抗菌活性会随着金属离子活泼性的增加而增强;三是微生物源抗菌剂,包括微生物自身以及微生物的拮抗性代谢产物,微生物源抗菌剂是通过分泌抗菌素以及诱导寄主产生抗病原等来起到抗菌作用。目前的天然抗菌剂抗菌作用有限,杀菌率低,不能广谱长效使用且数量很少。
4.作为一种理想的抗菌剂应该具有即效、广谱、长效、稳定及安全的抗菌效果。然而现有的抗菌剂,无论是无机的、有机的、还是天然生物的,都没有达到理想的要求。
5.牡丹是毛茛科、芍药属植物。为多年生落叶灌木,茎高达2米;分枝短而粗。叶通常为二回三出复叶,表面绿色,无毛,背面淡绿色,有时具白粉,叶柄长5-11厘米,和叶轴均无毛。花单生枝顶,苞片5,长椭圆形;萼片5,绿色,宽卵形,花瓣5或为重瓣,玫瑰色、红紫色、粉红色至白色,通常变异很大,倒卵形,顶端呈不规则的波状;花药长圆形,长4毫米;花盘革质,杯状,紫红色;心皮,密生柔毛。蓇葖长圆形,密生黄褐色硬毛。花期5月;果期6月。牡丹的主要成分是:丹皮酚、没食子酸、没食子甲酸、茶叶素、单宁酸、槲皮素等。牡丹的花朵可以制成花茶,是女性的佳品。牡丹根皮提取物在抗菌方面也是有很大作用。牡丹皮在各种药理实验报告中被证实含有镇静镇痛、清热降压、抗菌消炎、抗氧化、抗过敏及止血的活性成分。目前牡丹提取物大部分应用于化妆品防腐,还未有应用于植物病害的抗菌剂的报道。
技术实现要素:
6.针对上述现有技术,本发明的目的是提供一种含牡丹提取物的植物复合抗菌剂及其制备方法。
7.为实现上述目的,本发明采用如下技术方案:本发明提供第一方面一种含牡丹提取物的植物复合抗菌剂,包括以下质量份的组分:牡丹提取物20-30份,菊芋提取物10-20份,黄连提取物10-15份,灰色链霉菌1-3份,死亡谷芽胞杆菌1-3份,酿酒酵母1-3份。
8.作为优选,所述牡丹提取物的制备方法为:将牡丹全株烘干、粉碎至100目得到牡丹物料,向牡丹物料加入混合酶溶液进行酶解,混合酶溶液的加入量为牡丹物料重量的4-6倍,混合酶溶液中纤维素酶的质量浓度为0.3mg/ml,果胶酶的质量浓度为0.3mg/ml,酶解时间2-4h,于85-90℃下灭酶,将灭酶后的溶液进行超声波提取,超声频率为80-100khz,超声时间为0.5-1h,重复三次,分离并合并提取液作为牡丹提取物。
9.作为优选,所述菊芋提取物的制备方法为:将菊芋叶和菊芋根茎烘干后粉碎得菊芋混合物,加入乙醇,乙醇浓度为85%,乙醇的加入量为菊芋混合物质量的3倍,在95℃下加热浸提1h,分离提取液作为菊芋提取物。
10.作为优选,所述黄连提取物的制备方法为:将黄连粉碎后加入乙醇,乙醇浓度为85%,乙醇的加入量为黄连质量的3倍,在90℃下加热浸提1h,分离提取液作为黄连提取物。
11.作为优选,所述灰色链霉菌在抗菌剂中的有效活菌数≥1
×
107cfu/g,死亡谷芽胞杆菌在抗菌剂中的有效活菌数≥1
×
107cfu/g,酿酒酵母在抗菌剂中的有效活菌数≥1
×
107cfu/g。
12.作为更优选,所述灰色链霉菌的保藏编号为cicc11002,死亡谷芽胞杆菌的保藏编号为cicc21334,酿酒酵母的保藏编号为cicc1288。
13.本发明第二方面提供上述含牡丹提取物的植物复合抗菌剂的制备方法,包括以下步骤:将牡丹提取物、菊芋提取物、黄连提取物混合均匀,加入灰色链霉菌、死亡谷芽胞杆菌、酿酒酵母搅拌均匀,得到抗菌剂。
14.本发明第三方面提供上述含牡丹提取物的植物复合抗菌剂在防治植物病害中的应用。
15.作为优选,所述植物病害是由尖孢镰刀菌、黑曲霉、野油菜黄单胞杆菌中的一种或多种引起的。
16.作为优选,所述抗菌剂在使用时稀释200-500倍,采用喷雾或灌溉的方法施用于植物。
17.牡丹提取物、菊芋提取物、黄连提取物作为植物抗菌源,植物抗菌源的作用主要有破坏或降解细胞壁、破坏细胞质膜、破坏细胞膜蛋白质结构,使细胞内容物泄露,使细胞质凝聚、减弱质子运动力。但这几种作用机制并非都是独立的,会相互影响。灰色链霉菌、死亡谷芽胞杆菌、酿酒酵母作为微生物抗菌源,微生物抗菌源的抗菌机制主要是:(1)通过分泌抗菌素,抑制细菌细胞壁的合成,改变胞浆膜的通透性,抑制蛋白质的合成,影响核酸和叶酸代谢;(2)通过占有生存空间、消耗氧气等方式削弱以致消除同一生存环境中的某些病原
物;(3)诱导寄主产生防御反应或对病原菌直接寄生而抑制病原菌;(4)寄生在病原菌上,分泌能破坏真菌细胞壁的酶。
18.本发明的有益效果:本发明将多种抗菌物质复配,植物抗菌源、微生物抗菌源二者协同作用,具有良好的抗菌、杀菌作用,克服单一抗菌源的局限性,具有广谱、高效的特点。
19.本发明中的植物抗菌源破坏细胞壁和细胞膜,使细胞内容物泄漏;微生物抗菌源能够分泌抗菌素,抑制病原菌,分泌破坏真菌细胞壁的酶;各物质协同作用,提高抗菌剂的杀菌抑菌能力。
具体实施方式
20.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
21.正如背景技术所述,基于此,本发明提供一种含牡丹提取物的植物复合抗菌剂,包括以下质量份的组分:牡丹提取物20-30份,菊芋提取物10-20份,黄连提取物10-15份,灰色链霉菌1-3份,死亡谷芽胞杆菌1-3份,酿酒酵母1-3份。
22.牡丹提取物的制备方法为:将牡丹全株烘干、粉碎至100目得到牡丹物料,向牡丹物料加入混合酶溶液进行酶解,混合酶溶液的加入量为牡丹物料重量的4-6倍,混合酶溶液中纤维素酶的质量浓度为0.3mg/ml,果胶酶的质量浓度为0.3mg/ml,酶解时间2-4h,于85-90℃下灭酶,将灭酶后的溶液进行超声波提取,超声频率为80-100khz,超声时间为0.5-1h,重复三次,分离并合并提取液作为牡丹提取物。
23.菊芋提取物的制备方法为:将菊芋叶和菊芋根茎烘干后粉碎得菊芋混合物,加入乙醇,乙醇浓度为85%,乙醇的加入量为菊芋混合物质量的3倍,在95℃下加热浸提1h,分离提取液作为菊芋提取物。
24.黄连提取物的制备方法为:将黄连粉碎后加入乙醇,乙醇浓度为85%,乙醇的加入量为黄连质量的3倍,在90℃下加热浸提1h,分离提取液作为黄连提取物。
25.灰色链霉菌在抗菌剂中的有效活菌数≥1
×
107cfu/g,死亡谷芽胞杆菌在抗菌剂中的有效活菌数≥1
×
107cfu/g,酿酒酵母在抗菌剂中的有效活菌数≥1
×
107cfu/g。灰色链霉菌的保藏编号为cicc11002,死亡谷芽胞杆菌的保藏编号为cicc21334,酿酒酵母的保藏编号为cicc1288。
26.上述含牡丹提取物的植物复合抗菌剂的制备方法,包括以下步骤:将牡丹提取物、菊芋提取物、黄连提取物混合均匀,加入灰色链霉菌、死亡谷芽胞杆菌、酿酒酵母搅拌均匀,得到抗菌剂。
27.上述含牡丹提取物的植物复合抗菌剂应用于防治植物病害,所述的植物病害是由尖孢镰刀菌、黑曲霉、野油菜黄单胞杆菌中的一种或多种引起的;抗菌剂在使用时稀释200-500倍,采用喷雾或灌溉的方法施用于植物。
28.为了使得本领域技术人员能够更加清楚地了解本技术的技术方案,以下将结合具体的实施例详细说明本技术的技术方案。
29.本发明实施例中所用的试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。
30.本发明以下实施例和对比例中所用灰色链霉菌(streptomyces griseus)购自于中国工业微生物菌种保藏管理中心,菌株保藏编号为cicc11002;死亡谷芽胞杆菌(bacillus vallismortis)购自于中国工业微生物菌种保藏管理中心,菌株保藏编号为cicc21334;酿酒酵母(saccharomyces cerevisiae)购自于中国工业微生物菌种保藏管理中心,菌株保藏编号为cicc1288;尖孢镰刀菌(fusarium oxysporum schltdl)、黑曲霉(aspergillus niger)均购自于上海通蔚实业有限公司,野油菜黄单胞杆菌(xanthomonas campestris)购自于宁波泰斯拓生物技术有限责任公司。
31.实施例1牡丹提取物25份,菊芋提取物15份,黄连提取物12份,灰色链霉菌2份,死亡谷芽胞杆菌2份,酿酒酵母2份。
32.(1)将牡丹全株烘干、粉碎至100目得到牡丹物料,向牡丹物料加入混合酶溶液进行酶解,混合酶溶液的加入量为牡丹物料重量的6倍,混合酶溶液中纤维素酶的质量浓度为0.3mg/ml,果胶酶的质量浓度为0.3mg/ml,酶解时间4h,于90℃下灭酶,将灭酶后的溶液进行超声波提取,超声频率为100khz,超声时间为1h,重复三次,分离并合并提取液作为牡丹提取物。
33.(2)将菊芋叶和菊芋根茎烘干后粉碎得菊芋混合物,加入乙醇,乙醇浓度为85%,乙醇的加入量为菊芋混合物质量的3倍,在95℃下加热浸提1h,分离提取液作为菊芋提取物。
34.(3)将黄连粉碎后加入乙醇,乙醇浓度为85%,乙醇的加入量为黄连质量的3倍,在90℃下加热浸提1h,分离提取液作为黄连提取物。
35.(4)将牡丹提取物、菊芋提取物、黄连提取物混合均匀,加入灰色链霉菌、死亡谷芽胞杆菌、酿酒酵母搅拌均匀,得到抗菌剂。
36.实施例2牡丹提取物20份,菊芋提取物10份,黄连提取物10份,灰色链霉菌1份,死亡谷芽胞杆菌1份,酿酒酵母1份。
37.(1)将牡丹全株烘干、粉碎至100目得到牡丹物料,向牡丹物料加入混合酶溶液进行酶解,混合酶溶液的加入量为牡丹物料重量的6倍,混合酶溶液中纤维素酶的质量浓度为0.3mg/ml,果胶酶的质量浓度为0.3mg/ml,酶解时间4h,于90℃下灭酶,将灭酶后的溶液进行超声波提取,超声频率为100khz,超声时间为1h,重复三次,分离并合并提取液作为牡丹提取物。
38.(2)将菊芋叶和菊芋根茎烘干后粉碎得菊芋混合物,加入乙醇,乙醇浓度为85%,乙醇的加入量为菊芋混合物质量的3倍,在95℃下加热浸提1h,分离提取液作为菊芋提取物。
39.(3)将黄连粉碎后加入乙醇,乙醇浓度为85%,乙醇的加入量为黄连质量的3倍,在90℃下加热浸提1h,分离提取液作为黄连提取物。
40.(4)将牡丹提取物、菊芋提取物、黄连提取物混合均匀,加入灰色链霉菌、死亡谷芽胞杆菌、酿酒酵母搅拌均匀,得到抗菌剂。
41.实施例3牡丹提取物30份,菊芋提取物20份,黄连提取物15份,灰色链霉菌3份,死亡谷芽胞
杆菌3份,酿酒酵母3份。
42.(1)将牡丹全株烘干、粉碎至100目得到牡丹物料,向牡丹物料加入混合酶溶液进行酶解,混合酶溶液的加入量为牡丹物料重量的6倍,混合酶溶液中纤维素酶的质量浓度为0.3mg/ml,果胶酶的质量浓度为0.3mg/ml,酶解时间4h,于90℃下灭酶,将灭酶后的溶液进行超声波提取,超声频率为100khz,超声时间为1h,重复三次,分离并合并提取液作为牡丹提取物。
43.(2)将菊芋叶和菊芋根茎烘干后粉碎得菊芋混合物,加入乙醇,乙醇浓度为85%,乙醇的加入量为菊芋混合物质量的3倍,在95℃下加热浸提1h,分离提取液作为菊芋提取物。
44.(3)将黄连粉碎后加入乙醇,乙醇浓度为85%,乙醇的加入量为黄连质量的3倍,在90℃下加热浸提1h,分离提取液作为黄连提取物。
45.(4)将牡丹提取物、菊芋提取物、黄连提取物混合均匀,加入灰色链霉菌、死亡谷芽胞杆菌、酿酒酵母搅拌均匀,得到抗菌剂。
46.对比例1本对比例中的抗菌剂的原料为牡丹提取物30份,菊芋提取物20份,黄连提取物15份,其余与实施例3相同。
47.对比例2本对比例中的抗菌剂的原料为灰色链霉菌3份,死亡谷芽胞杆菌3份,酿酒酵母3份,其余与实施例3相同。
48.实验例采用文献《植物提取物抑菌活性及抑菌机理》(周云冬.江南大学,2019.)中的步骤进行抗菌剂抑菌活性测定、最低抑制浓度和最低致死浓度测定。
49.1.抗菌剂抑菌活性测定细菌在lb液体培养基37℃下培养12 h,使用生理盐水洗涤两次并制备成菌体浓度为1.0
×
10
8 cfu
·
ml-1
的细胞悬液。霉菌pda斜面,28℃下培养48 h,加入5 ml无菌生理盐水,轻轻将琼脂表面的孢子刮下,无菌玻璃珠打散,用灭菌的脱脂棉过滤除去菌丝,生理盐水冲洗滤渣3次,最终稀释成浓度为1.0
×
10
8 cfu
·
ml-1
的孢子悬浮液。
50.采用琼脂滤纸片扩散法,每个无菌培养皿(90 mm)用20 ml lb、yepd、pda培养基制备,凝固后,将100 μl菌体浓度为1
×
10
8 cfu
·
ml-1
悬浮液均匀涂布于培养基表面,待表面稍微干后,6 mm无菌滤纸圆盘浸渍了10 μl抗菌剂的贴于最上层,无菌生理盐水被用作阴性对照。细菌在37℃培养24 h,霉菌在30℃培养48 h后,通过测量抑菌圈直径评价实施例1-3和对比例1-3的抗菌剂抑菌活性,实验结果如表1所示。抑菌率(%)=(对照组直径-处理组直径)/(对照组直径-6)
×
100%。
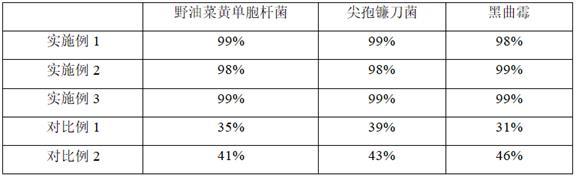
51.表1
在野油菜黄单胞杆菌的抑制实验中,实施例1-3使用植物抗菌源和微生物抗菌源,抑菌率均在98%以上;对比例1单独使用了植物抗菌源,抑菌率为35%;对比例2单独了微生物抗菌源,抑菌率为41%;单独使用植物抗菌源、单独使用微生物抗菌源二者抑菌效果之和为76%,低于同时使用植物抗菌源、微生物抗菌源的实施例3,因此,本发明同时使用植物抗菌源、微生物抗菌源在抑制杀灭细菌方面具有协同促进作用。
52.在黑曲霉的抑制实验中,实施例1-3使用植物抗菌源和微生物抗菌源,抑菌率均在98%以上;对比例1单独使用了植物抗菌源,抑菌率为31%;对比例2单独了微生物抗菌源,抑菌率为46%;单独使用植物抗菌源、单独使用微生物抗菌源二者抑菌效果之和为77%,低于同时使用植物抗菌源、微生物抗菌源的实施例3,因此,本发明同时使用植物抗菌源、微生物抗菌源在抑制杀灭真菌方面具有协同促进作用。
53.综上所述,本发明的抗菌剂在抑制杀灭细菌和真菌方面具有协同促进作用。
54.2.最低抑制浓度和最低致死浓度测定参照美国临床实验室标准化委员会(clsi)微量稀释法,在无菌96孔平底微量培养板中,100 μl稀释的抗菌剂(终浓度100、50、25、12.5、6.25、3.12、1.56、0.78和0 mg
·
ml-1
)与菌体浓度为1
×
10
8 cfu
·
ml-1
细菌悬浮液混合,37℃培养24 h后,使用多功能酶标仪600 nm处检测光密度。光密度变化值小于0.05认为是抑制菌体生长的最低浓度,并被定义为最低抑制浓度(mic)。从大于最低抑制浓度的孔中吸取100 μl细菌悬浮液均匀涂布于新鲜lb琼脂平板上,37℃传代培养24 h后,以每个平板菌落数少于5个定义为最低致死浓度(mbc)。参照美国临床实验室标准化委员会(clsi)微量稀释法,在无菌96孔平底微量培养,实验结果如表2所示。
55.表2本发明实施例1-3的抗菌剂的最低抑制浓度和最低致死浓度,远小于对比例1-2,表明实施例1-3的抗菌效力远高于对比例1-3。
56.以上所述仅为本技术的优选实施例而已,并不用于限制本技术,对于本领域的技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1