一种心肌纤维化和肾纤维化动物模型的构建方法与流程
1.本发明涉及实验动物模型领域,具体涉及一种心肌纤维化和肾纤维化动物模型的构建方法。
背景技术:
2.阿霉素是临床上常用的一种蒽环类抗肿瘤药,通常用于治疗许多类型的癌症,但它有副作用,包括呕吐、皮疹、脱发和骨髓抑制,最危险的副作用是心肌病、心肌纤维化和心力衰竭。同时它能对肾小球和肾小管上皮产生直接毒性作用,使肾近曲小管上皮细胞胞膜屏障和吸收功能受损,细胞核崩解。脱落的小管上皮细胞与管腔内的蛋白质及其他细胞成分构成管型,堵塞管腔,导致肾小管内压升高,加重肾脏损伤,最终形成慢性肾衰竭。目前根据阿霉素构建的模型只单一关注心功能的损伤或者肾功能的损伤,这使得在研究阿霉素诱导的药效、药理、病因学模型中浪费了很多试验信息,对于阿霉素所构建的模型潜力开发不足。
技术实现要素:
3.为解决现有技术存在的不足,本发明提供了一种心肌纤维化和肾纤维化动物模型的构建方法。本发明着重于构建阿霉素诱导动物模型,通过阿霉素诱导实验动物心肌纤维化和肾纤维化,该模型能同时应用于心肌纤维化和肾纤维化的研究。
4.一种心肌纤维化和肾纤维化动物模型的构建方法,实验动物在经过实验前期适应后,注射特制的阿霉素溶液,给药12周后,得到心肌纤维化和肾纤维化动物模型。
5.优选的,所述实验前期至少为3天。
6.优选的,所述阿霉素溶液为阿霉素粉末和生理盐水的混合液,通过超声波至无肉眼可见颗粒。
7.优选的,所述阿霉素溶液的浓度为0.5mg/ml3mg/ml。
8.优选的,在实验前期内,动物房的环境条件为室温20℃-26℃,湿度40%-70%。
9.优选的,所述动物房内每小时空气更换10-20次。
10.优选的,所述动物房内照明每12小时进行一次明暗循环交替。
11.优选的,实验动物经过实验前期后进行右肾切除手术,给予3次美洛昔康镇痛,分别为手术当日、手术后第一天和手术后第两天,每天一次。
12.优选的,所述阿霉素溶液的给予途径为尾静脉单次推注。
13.优选的,所述实验动物为大鼠、小鼠、兔、犬或猫,也可以实用灵长类、禽类或畜类等。
14.由于上述技术方案的运用,本发明与现有技术相比具有下列有益效果:
15.提供了一种心肌纤维化和肾纤维化动物模型的构建方法,能同时研究阿霉素诱导心肌纤维化和肾纤维化的解决方案,在使用尽量少的实验动物的前提下,获得更多的实验数据,这更符合实验动物福利的要求和实验动物伦理的宗旨。
附图说明
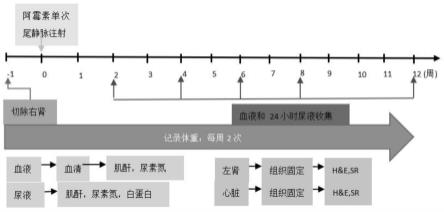
16.图1是本发明模型建立的流程图。
17.图2是假模型组中和模型组中实验动物体重变化的对比图。
18.图3是假模型组中和模型组中实验动物血清肌酐变化的对比图。
19.图4是假模型组中和模型组中实验动物血清尿素氮变化的对比图。
20.图5是假模型组中和模型组中实验动物尿液体积变化的对比图。
21.图6是假模型组中和模型组中实验动物尿液肌酐变化的对比图。
22.图7是假模型组中和模型组中实验动物尿液尿素氮变化的对比图。
23.图8是假模型组中和模型组中实验动物尿液白蛋白变化的对比图。
24.图9是假模型组中和模型组中实验动物肌酐清除率变化的对比图。
25.图10是假模型组中和模型组在12周后实验动物心脏重量/体重之比的对比图。
26.图11是假模型组中和模型组在12周后实验动物肾脏重量/体重之比的对比图。
27.图12是假模型组中和模型组在12周后实验动物心脏冠状切面乳头肌水平h&e染色图。
28.图13是假模型组中和模型组在12周后实验动物左心室室壁厚度的对比图。
29.图14是假模型组中和模型组在12周后实验动物室间隔厚度的对比图。
30.图15是假模型组中和模型组在12周后实验动物心脏sr染色(200x)图。
31.图16是假模型组中和模型组在12周后实验动物全心胶原沉积面积占比的对比图。
32.图17是假模型组中和模型组在12周后实验动物肾脏h&e染色(200x)图。
33.图18是假模型组中和模型组在12周后实验动物肾小管评分的对比图。
34.图19是假模型组中和模型组在12周后实验动物肾脏sr染色(200x)图。
35.图20是假模型组中和模型组在12周后实验动物肾脏胶原沉淀面积占比的对比图。
36.其中:
37.a:假模型组;b:模型组;
38.t-test:*p《0.05vs.假模型组;
39.t-test:**p《0.01vs.假模型组;
40.t-test:***p《0.001vs.假模型组。
具体实施方式
41.下面结合附图对本发明的较佳实施例进行详细阐述,以使本发明的优点和特征能更易于被本领域技术人员理解,从而对本发明的保护范围做出更为清楚明确的界定。
42.本发明公开了心肌纤维化和肾纤维化动物模型的构建方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
43.本发明中所用试剂或仪器均可由市场购得。
44.下面结合实施例,进一步阐述本发明:
45.实施例1
46.1材料和方法
47.1.1试剂
48.试剂名称品牌盐酸阿霉素medchemexpress无水乙醇国药集团化学试剂有限公司95%乙醇国药集团化学试剂有限公司二甲苯国药集团化学试剂有限公司苏木素染色液珠海贝索生物技术有限公司伊红染色液珠海贝索生物技术有限公司肌酐检测试剂盒(酶法)潍坊泽成生物技术有限公司尿素氮检测试剂盒(酶学速率法)潍坊泽成生物技术有限公司氯化钠注射液山东齐都药业有限公司白蛋白检测试剂盒(溴甲酚绿法)潍坊泽成生物技术有限公司
49.1.2仪器器材
50.[0051][0052]
1.3实验动物
[0053][0054]
在动物接收后,兽医将对所有动物进行体检。然后对动物进行实验前期的检疫/适应。实验前期是指从动物到达日至首次给药日,实验前期至少为3天。
[0055]
动物饲养于屏障系统中,动物房环境条件控制为室温20℃-26℃,湿度40%-70%,饲养人员每天上下午各记录一次。房间内每小时空气更换10-20次。动物房内照明12/12小
时明暗循环交替(实验活动进行中必须的中断除外),任何中断都将记录下来;动物将进行合笼饲养,入组试验后,动物保持合笼饲养,每笼4只,动物笼具为聚砜材质的塑料笼具,带有玉米芯垫料,笼具中有供啃咬或遮蔽的玩具给每笼动物作为环境丰富措施。每个笼具将放置一个识别组别的笼卡,笼卡将具有试验号,组别,性别,动物名称和数量,动物将按照组别依次排列。
[0056]
动物饲料来源于北京科澳协力饲料有限公司的饲料。动物自由采食。任何额外的食物添加必须经过专题负责人的许可并记录。由自动饮水装置提供的二级反渗透水。
[0057]
1.4实验方法
[0058]
1.4.1造模剂配制
[0059]
称取适量阿霉素粉末,加入适量生理盐水,涡旋并超声至无肉眼可见颗粒,得到1mg/ml浓度的阿霉素溶液,避光保存,现配现用。
[0060]
1.4.2试验分组和模型建立
[0061]
动物经过检疫期后,经异氟烷麻醉大鼠,通过手术方法切除右肾,在此期间动物体温并将其保持在37
±
0.5℃。待动物苏醒后转移至笼中,手术当日、手术后第一天和手术后第两天,每天一次共3次给予美洛昔康镇痛。手术后一周,根据动物体重,以组间动物体重差异最小为原则进行分组,共分为2组,分别为假模型组(n=8),模型组(n=8),对模型组8只动物尾静脉单次推注阿霉素诱导建模,注射剂量5mg/kg阿霉素,对假模型组8只动物尾静脉单次推注等量生理盐水作为对照,继续观察12周。
[0062]
1.4.3模型指标监测
[0063]
1.4.3.1动物体重监测
[0064]
试验期间监测动物体重变化,手术造模后一周两次。
[0065]
1.4.3.2动物血清肌酐、尿素氮监测
[0066]
检测时间:阿霉素注射后2周、4周、6周、8周和12周。
[0067]
检测动物:所有动物。
[0068]
检测方法:血生化仪结合相应试剂盒检测。
[0069]
样品处理方法:经舌下静脉取全血200μl室温静置30min以上,4℃,5000rpm,5min分离血清,-80℃保存待测。
[0070]
1.4.3.3动物尿液肌酐、尿素氮、白蛋白监测
[0071]
检测时间:阿霉素注射后2周、4周、6周、8周和12周。
[0072]
检测动物:所有动物。
[0073]
检测方法:血生化仪结合相应试剂盒检测。
[0074]
样品处理方法:利用代谢笼收集动物24h尿液,记录24h尿液体积,取1ml上清待测。
[0075]
根据尿液体积、血清肌酐和尿液肌酐计算肌酐清查率。
[0076]
1.4.3.4动物心脏和肾脏重量
[0077]
阿霉素注射后12周,动物经异氟烷麻醉,沿腹中线打开腹腔,沿膈肌和胸肋软骨打开胸腔,离断下腔静脉,经腹主动脉灌注生理盐水,待心脏和肾脏血迹褪去,经腹中动脉灌注10%福尔马林,待动物肌肉不再抖动,取心脏和肾脏,称量重量,计算脏器/体重指数。称量重量后将心脏和肾脏浸入10%福尔马林固定。
[0078]
1.4.3.5动物心脏和肾脏病理检测
[0079]
固定好心脏和肾脏,分别对心脏和肾脏进行石蜡组织切片制作,然后进行h&e(hematoxylin-eosin,苏木精-伊红)染色,sr(sirius red,天狼星红)染色,使用hamamatsu nano zoomer digital pathology(s210)切片扫描仪进行切片全景扫描,在h&e染色下测量心脏室壁厚度,在sr染色下扫描心脏胶原沉积面积占比,在h&e染色下分析肾脏损伤变化,在sr染色下扫描肾脏胶原沉积面积占比。
[0080]
表1肾小管损伤评分标准
[0081][0082]
注释:肾小管损伤分数=肾小管上皮扁平化和肾小管扩张分数+肾小管坏死百分比分数+炎症浸润程度评分。
[0083]
1.5实验结果
[0084]
由图2-图20,可以看出:
[0085]
体重变化:阿霉素注射后,模型动物体重增长趋势变缓,显著低于假模型组。
[0086]
血清肌酐变化:阿霉素注射后,与假模型组相比,模型组血清肌酐有升高的趋势。
[0087]
血清尿素氮变化:阿霉素注射后,与假模型组相比,模型组血清尿素氮有升高的趋势。
[0088]
尿液体积变化:阿霉素注射后,与假模型组相比,模型组24h尿液体积显著降低。
[0089]
尿液肌酐变化:阿霉素注射后,与假模型组相比,模型组24h尿液肌酐显著降低。
[0090]
尿液尿素氮变化:阿霉素注射后,与假模型组相比,模型组24h尿液尿素氮有下降的趋势。
[0091]
尿液白蛋白变化:阿霉素注射后,与假模型组相比,模型组24h尿液白蛋白显著升高。
[0092]
肌酐清除率变化:阿霉素注射后,与假模型组相比,模型组肌酐清除率显著降低。
[0093]
心脏重量/体重变化:阿霉素注射后,与假模型组相比,模型组心脏重量/体重显著升高。
[0094]
肾脏重量/体重变化:阿霉素注射后,与假模型组相比,模型组肾脏重量/体重显著升高。
[0095]
心室壁厚度变化:阿霉素注射后,与假模型组相比,模型组左心室壁和室间隔显著变薄。
[0096]
心肌纤维化变化:阿霉素注射后,与假模型组相比,模型组心脏胶原沉积面积显著增加。
[0097]
肾小管损伤评分:阿霉素注射后,与假模型组相比,模型组肾脏肾小管损伤评分显著升高。
[0098]
肾纤维化变化:阿霉素注射后,与假模型组相比,模型组肾脏胶原沉积面积显著增加。
[0099]
由上可知,在给实验动物注射阿霉素后,实验动物发生了心肌纤维化和肾纤维化的变化,且心脏胶原沉积面积和肾脏胶原沉积面积都比假模型组的显著增加,表明该动物模型的构建方法能同时诱导心肌纤维化和肾纤维化。
[0100]
以上仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1