一种模拟临床化疗耐药过程的肝癌耐药动物模型构建方法
1.本公开涉及生物技术领域,具体地,涉及一种构建肝癌耐药动物模型的方法、该方法构建得到的肝癌耐药动物模型。
背景技术:
2.相对于其它肿瘤类型,肝癌耐药领域的基础和临床研究十分匮乏,特别是缺少合适的动物模型。在以往的研究中,为了定量监测肝癌耐药动物肿瘤动态变化过程,肝癌耐药动物模型均采用裸鼠皮下接种耐药肿瘤细胞或肿瘤组织。临床肝癌是肝癌细胞侵袭肝脏组织,而皮下接种的肿瘤细胞脱离了肝脏的营养及代谢环境;更为重要的是,耐药肿瘤细胞或组织是通过体外细胞培养技术诱导后产生耐药的,而非肝脏肿瘤经化疗药物治疗后产生的耐药,因此无论是肿瘤的生长还是对化疗药物的耐药过程,均与临床肝癌耐药相距甚远。
3.现有模型包括人源肿瘤组织异种移植模型,人源肿瘤细胞异种皮下移植模型。但现有三种模型都存在一定的缺陷,比如人源肿瘤组织来源异种移植,存在标本需经过严格的伦理审查,程序复杂且获得性差;现有人源肿瘤细胞异种移植存在荷瘤小鼠必须是免疫严重缺陷型裸小鼠,饲养条件苛刻且价格昂贵,同时移植位置不是肝癌原发部位,不能很好的模拟肝癌的发生发展。可见,以往报道的病人来源肿瘤异种移植模型、细胞来源异种移植在肝癌研究中起到了重要作用,但是它们具有标本获取困难且程序复杂等缺陷。
4.因此亟需一种构建方法简单便捷、能够真实模拟肝癌耐药发生、发展的原位肿瘤发生模型。
技术实现要素:
5.本公开的目的是提供一种构建方法简单便捷、能够真实模拟肝癌耐药发生、发展的原位肿瘤发生模型。
6.为了实现上述目的,本公开提供了一种构建肝癌耐药动物模型的方法,该方法包括以下步骤:
7.s1、培养荧光标记的肝癌细胞;
8.s2、将所述荧光标记的肝癌细胞移植至小鼠肝脏中,得到移植后的小鼠;
9.s3、将所述移植后的小鼠培养1-3周后,尾静脉注射荧光显像剂,利用动物活体成像法监测药物干预前小鼠体内肝癌细胞的初始荧光强度;
10.s4、给予小鼠抗肝癌化疗药物治疗,给药3-8周后,利用动物活体成像法监测药物干预后小鼠体内肝癌细胞的荧光强度;若药物干预后小鼠体内肝癌细胞的荧光强度不小于药物干预前小鼠体内肝癌细胞的初始荧光强度,则得到所述肝癌耐药动物模型。
11.根据本公开,所述小鼠为4-6周龄balb/c裸鼠。
12.根据本公开,所述抗肝癌药为索拉非尼,给药量为每2天15-60mg/kg,优选为每2天30mg/kg。
13.根据本公开,步骤s2中,所述肝癌细胞的移植量为(2-5)
×
106个hepg2/luc细胞
(根据细胞量将细胞用pbs定容至20-50μl)。
14.根据本公开,所述荧光显像剂包括d-荧光素钾盐和/或
18
f-fdg。
15.根据本公开,所述肝癌细胞通过以下方法制备得到:通过脂质体包裹带有neo抗性基因和荧光素酶报告基因的表达质粒pgl4.17,体外转染人肝癌细胞hepg2。
16.根据本公开,所述neo抗性基因的核苷酸序列如seq id no.1所示,所述荧光素酶报告基因的核苷酸序列如seq id no.2所示。
17.另一方面,本公开提供了上述方法构建得到的肝癌耐药模型。
18.通过上述技术方案,本公开提供了一种构建肝癌耐药动物模型的方法及动物模型,利用该方法构建得到的动物模型能够用于定量监测肝癌耐药动物肿瘤动态变化过程,准确模拟肝癌耐药发生、发展,对于肝癌临床研究具有重要意义。
19.本公开的其他特征和优点将在随后的具体实施方式部分予以详细说明。
附图说明
20.附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制。在附图中:
21.图1为本公开提供的索拉非尼耐药动物模型时间线示意图。
22.图2为各组动物kaplan-meier生存曲线图。
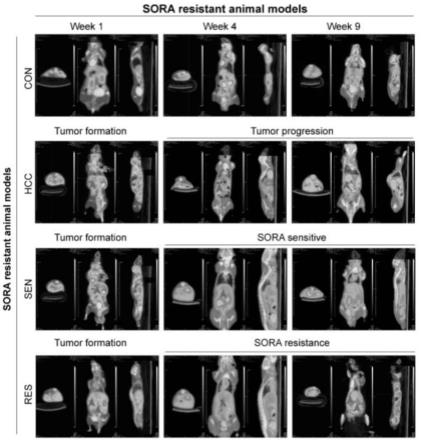
23.图3为小鼠活体成像图。
24.图4为
18
f-fdg micropet/ct肿瘤代谢测定图。
25.图5为活体成像生物荧光定量图。
26.图6为
18
f-fdg micropet/ct肿瘤代谢生物荧光定量图。
27.图7为小鼠肝与脑的重量比测定图。
28.图8为肝脏肿瘤的代表图。
29.图9为各组动物肝组织h&e染色图像。
30.图10为pgl4.17[luc2/neo]荧光素酶表达载体的示意图。
具体实施方式
[0031]
以下对本公开的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本公开,并不用于限制本公开。
[0032]
一方面,本公开提供了一种构建肝癌耐药动物模型的方法,该方法包括以下步骤:
[0033]
s1、培养荧光标记的肝癌细胞;
[0034]
s2、将所述荧光标记的肝癌细胞移植至小鼠肝脏中,得到移植后的小鼠;
[0035]
s3、将所述移植后的小鼠培养1-3周后,尾静脉注射荧光显像剂,利用动物活体成像法监测药物干预前小鼠体内肝癌细胞的初始荧光强度;
[0036]
s4、给予小鼠抗肝癌化疗药物治疗,给药3-8周后,利用动物活体成像法持续多次监测药物干预后小鼠体内肝癌细胞的荧光强度;若药物干预后小鼠体内肝癌细胞的荧光强度不小于药物干预前小鼠体内肝癌细胞的初始荧光强度,则得到所述肝癌耐药动物模型。
[0037]
可选地,所述小鼠为4-6周龄balb/c裸鼠。
[0038]
可选地,所述抗肝癌药物为索拉非尼,给药量为每2天15-60mg/kg,优选为每2天
30mg/kg。
[0039]
可选地,步骤s2中,所述肝癌细胞的移植量为(2-5)
×
106个hepg2/luc细胞(根据细胞量将细胞用pbs定容至20-50μl)。
[0040]
可选地,所述荧光显像剂包括d-荧光素钾盐和/或
18
f-fdg。
[0041]
可选地,所述肝癌细胞通过以下方法制备得到:通过脂质体包裹带有neo抗性基因和荧光素酶报告基因的表达质粒pgl4.17,体外转染人肝癌细胞hepg2。
[0042]
可选地,所述neo抗性基因的核苷酸序列如seq id no.1所示,所述荧光素酶报告基因的核苷酸序列如seq id no.2所示。
[0043]
另一方面,本公开提供了上述方法构建得到的肝癌耐药动物模型。
[0044]
以下通过实施例进一步详细说明本发明。
[0045]
实施例1
[0046]
本实施例用于构建肝癌原位癌索拉非尼耐药动物模型。
[0047]
如图1所示,采用100只4-6周龄balb/c裸鼠,每笼5只,置于特定的无病原体房间中,在25℃
±
1℃以及12小时昼夜交替环境下饲养,自由饲喂饲料和水。其中10只作为正常对照组,剩余动物接种肝癌细胞。首先建立基于hepg2细胞的肝脏原位异种移植肝癌模型,具体操作为:通过脂质体包裹带有neo抗性基因(如seq id no.1所示)和荧光素酶报告基因(如seq id no.2所示)的表达质粒pgl4.17(如图10所示),体外转染人肝癌细胞hepg2,得到hepg2/luc细胞;用三溴乙醇麻醉裸鼠,采用腹部正中切口,暴露肝脏后,将2
×
106个hepg2/luc细胞植入肝脏最大叶,用医用ob胶黏合伤口,用5-0丝线缝合腹部切口,得到移植后的小鼠。为监测肿瘤生长情况,采用小动物活体成像仪以及micropet/ct两种新技术进行检测,结果互相验证以提高准确性。手术1周后,对移植后的小鼠进行尾静脉注射d-luciferin(15mg/ml,200ml,静脉注射),而后采用lumina iii小动物活体成像仪(perkinelmer,waltham,ma,usa)监测小鼠肝脏肿瘤生物发光情况(肝脏位置有荧光表示有肿瘤,且荧光强度越强表示肿瘤越大)。间隔3-5天后(两种检测方法均需要对小鼠麻醉处理,故需要一定的间隔时间),对移植后的小鼠进行尾静脉注射11.1mbq(300mci)
18
f-fdg,采用inveon micropet/ct(siemens medical solution,ger)检测小鼠肝脏肿瘤生物发光情况(若肝脏有肿瘤,则肿瘤位置荧光强度明显强于肝脏正常位置的本底荧光强度,且荧光强度与肿瘤大小成正比)。将携带肿瘤的裸鼠作为肝癌组(hcc),第2周开始给予不同剂量的索拉非尼(15/30/60mg/kg/2天)治疗。给药3周后(即术后4周),同样先后采用上述两种肿瘤成像技术监测索拉非尼对肿瘤的抑制效果。与手术后的第一次成像相比,将肿瘤持续萎缩(即ivis小动物活体成像仪中荧光强度减弱或inveon micropet/ct糖代谢减弱)的动物归为索拉非尼敏感组(sen),将肿瘤持续生长(即ivis小动物活体成像仪中荧光强度增强或inveon micropet/ct糖代谢增强)的动物归为索拉非尼耐药组(res)。手术7周及9周后(即给药6周和8周后),同样采用上述两种技术进行第3、4次肿瘤成像试验,继续监测动物肿瘤生长情况是否符合对应组别。若药敏组中某些小鼠的肿瘤先减小后增加,则将其重新划归到耐药组;或者耐药组中某些小鼠的肿瘤先增加后减小,则将其划归到药敏组。最后麻醉处死动物并取材。
[0048]
手术1周后肿瘤成像检测结果显示,90只裸鼠全部成瘤,其中15只作为肝癌对照组,其余75只均分为3组(25只/组),从术后第2周开始分别给予不同剂量的索拉非尼(15/
30/60mg/kg/2天)治疗。给药3周后(即手术后4周)肿瘤成像结果显示,相比第1次肿瘤成像的荧光强度,上述3组索拉非尼治疗组中均有部分小鼠肝脏肿瘤的荧光强度减弱,上述小鼠视为药敏组(sen);剩余小鼠肝脏肿瘤的荧光强度则有所增强,上述小鼠视为耐药组(res)。第3次(给药6周)以及第4次(给药8周)肿瘤成像试验结果表明,绝大部分小鼠肿瘤生长趋势符合相应组别,仅有少部分小鼠肿瘤生长情况不符。对于药敏组中个别小鼠的肿瘤荧光强度呈现先减小后增加的趋势,则将该小鼠划归到耐药组;对于耐药组中个别小鼠的肿瘤荧光强度呈现先增加后减小的趋势,则将该小鼠划归到药敏组。简而言之,从手术后第2周开始肝癌组(hcc)小鼠的肝脏肿瘤荧光强度及糖代谢持续增强(即肿瘤持续生长);而后给予不同剂量的索拉非尼治疗,从术后4周(给药3周)开始,索拉非尼敏感组(sen)小鼠的肝脏肿瘤荧光强度及糖代谢开始陆续下降,索拉非尼耐药组(res)即便经过了索拉非尼治疗,其肝脏肿瘤荧光强度及糖代谢也在持续增强,上述结果说明成功建立了索拉非尼耐药动物模型(图3-6)。此外,肝癌小鼠经过30mg/kg/2天剂量的索拉非尼治疗后,最终划归到耐药组的比例(约70%)相比于15mg/kg/2天剂量(约60%)和60mg/kg/2天(约55%)剂量的比例高,即诱导耐药动物的成功率最高。
[0049]
肝癌组(hcc)和耐药组(res)裸鼠的总体生存时间明显短于药敏组,且肿瘤大小和重量明显强于药敏组(图2,7-8)。组织h&e染色结果表明,hcc组和res组也有相似的病理变化,包括肿瘤病灶出现较多的坏死区域,少数正常细胞出现空泡样变化,炎症细胞高度浸润,而sen组的肿瘤病灶和炎性细胞浸润程度明显优于hcc组和res组(图9,黑色无尾箭头、黑色短尾箭头和黑色长尾箭头分别表示坏死区域、空泡样改变和炎性浸润。比例尺,50或100μm。数据用平均值
±
标准差表示;*p《0.05,**p《0.01,***p《0.001)。
[0050]
综上所述,本公开提供的方法构建得到了肝癌耐药动物模型,并且该模型耐药诱导的整体成功率约为70%,成功率较高。利用该动物模型能够真实地模拟肝癌对化疗药耐药的发生发展微环境,对于肝癌临床研究具有重要意义。
[0051]
以上详细描述了本公开的优选实施方式,但是,本公开并不限于上述实施方式中的具体细节,在本公开的技术构思范围内,可以对本公开的技术方案进行多种简单变型,这些简单变型均属于本公开的保护范围。
[0052]
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本公开对各种可能的组合方式不再另行说明。
[0053]
此外,本公开的各种不同的实施方式之间也可以进行任意组合,只要其不违背本公开的思想,其同样应当视为本公开所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1