一种CD69人源化小鼠模型的构建方法及其应用与流程
本发明涉及动物基因工程领域,具体涉及一种cd69人源化小鼠模型的构建方法及其应用。
背景技术:
1、生物医学研究的最终目标是解决人类疾病,然而人体免疫反应和体内疾病研究的伦理限制可能会使人们对疾病的病因理解不足,从而导致治疗出现误差。因此人们尝试通过多种实验模型进行研究,如细胞、组织、动物模型。动物模型作为人类生物学的替代品无疑是最合适的选择。在动物模型中,小鼠因其体积小、易于维护和处理、生殖周期短、与人类共享基因组和生理特性以及易于进行基因操作的能力而被广泛使用。
2、但在研究人类生物学时,小鼠模型仍存在局限性。虽然二者基因组有着极高的相似性,但是某些蛋白的功能结构域,例如受体与供体结合位点,在小鼠和人之间仍然可能存在差异。另外研究发现,某些人源基因在小鼠中也缺少同源基因。因此,为了更好的重现人类生物系统,更准确地反映癌症或自身免疫疾病的发病机制,人们进一步开发了人源化小鼠模型。目前,人源化小鼠在人类传染病、癌症、再生医学、移植物抗宿主病、过敏和免疫方面的研究已取得了重大进展,未来随着人源化小鼠的不断发展,该模型会应用于更多疾病的临床前期实验。
3、癌症免疫治疗也被称为免疫肿瘤学,是一种利用身体自身免疫系统的力量来预防、控制和消除癌症的癌症治疗形式。近几十年来,免疫检查点阻断疗法已经成为癌症免疫治疗的主力军,如最具代表性的抗pd-1/pd-l1疗法,通过破坏共抑制性t细胞信号介导抗肿瘤活性;此外,其介导的负调控免疫反应还可以有效防止肿瘤微环境中的效应t细胞耗竭。然而目前诱导和预防t细胞衰竭的机制仍有很大未知。而cd69可以通过t细胞在组织中的迁移和滞留来调节炎症,它在诱导肿瘤浸润性t细胞耗竭中起重要作用。
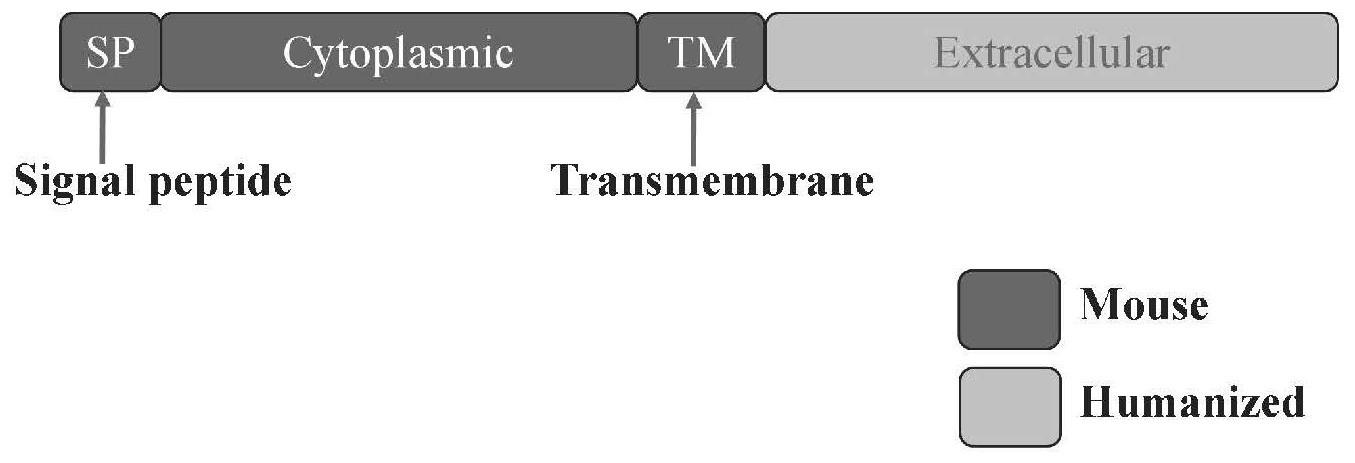
4、cd69是一种具有c型凝集素样结构域的2型糖蛋白。作为一种白细胞的早期激活标志物,cd69仅表达在激活后的免疫细胞上,包括t细胞、b细胞、nk细胞、粒细胞、巨噬细胞和树突状细胞。cd69根据其结构功能可以划分为三个结构域:胞外结构域能够与配体蛋白互作、跨膜结构域介导1-磷酸鞘氨醇受体1(s1p1)的结合及内化、胞内结构域富含丝氨酸残基可以介导信号传导。已知cd69在免疫稳态和免疫激活期间通过内化s1p1来调节淋巴器官中淋巴细胞的滞留。在肿瘤免疫中,cd69在tme和tdln的t细胞上高表达。cd69缺陷小鼠表现出抗肿瘤免疫力增强和免疫耗竭缓解的表型。文献显示,anti-cd69单克隆抗体治疗减轻了荷瘤小鼠的t细胞耗竭和肿瘤进展。这些发现突出了cd69在控制由t细胞耗竭介导的肿瘤免疫逃逸中的新作用,提示cd69可能是癌症免疫治疗的新靶点。同时cd69也在多种炎症性疾病和自身免疫性疾病中发挥负调节机制。研究显示,cd69-/-小鼠增加了多种t细胞依赖性自身免疫和炎性疾病的发病率和严重程度,如ii型胶原诱导的关节炎、过敏性哮喘、皮肤接触性超敏反应和自身免疫性心肌炎等。因此,cd69也被认为是用于治疗免疫介导的炎症性疾病的关键靶点。
5、cd69人源化小鼠是指利用基因修饰的方法,在免疫系统健全的小鼠上,将鼠源cd69替换为人源的基因,构建能与抗人源cd69单抗相互作用的小鼠模型。该模型与普通小鼠相比,实现了针对关键靶分子的人源化改造,同时保留了完整的免疫系统,可用于筛选和评价人类cd69中和抗体或抑制人类cd69活性的小分子药物,是理想的临床前药物测试动物模型。因此,构建cd69人源化的小鼠模型在筛选评价cd69靶点药物方面具有较高的应用价值。现有关于人cd69在体内的功能研究大多只能通过动物同源基因(如鼠cd69)功能的推断,或者通过体外实验模拟。目前暂未见表达人cd69动物模型的构建方法及其在靶点药物应用方面的相关文献报道。
技术实现思路
1、针对目前存在的问题,本发明的第一方面提供一种cd69人源化小鼠模型的构建方法,所述构建方法得到的小鼠模型表达人鼠嵌合cd69蛋白,并且小鼠模型的鼠源cd69蛋白被部分敲除。
2、优选的,所述构建方法得到的小鼠模型鼠源cd69基因编码的胞外区序列被人源cd69基因编码的胞外区序列替换,同时保留鼠源cd69基因编码的胞内区序列。
3、优选的,所述构建方法得到的小鼠模型中选取的人源cd69基因氨基酸序列如seqid no.1所示,被替换的鼠源cd69基因氨基酸序列如seq id no.2所示。
4、优选的,使用crispr-cas9基因编辑技术敲除小鼠模型的鼠源cd69蛋白。
5、优选的,所述crispr-cas9基因编辑技术中使用的sgrna基因序列为(a)seq idno.5和seq id no.6,或者(b)seq id no.7和seq id no.8。
6、更优选的,所述crispr-cas9基因编辑技术中使用的sgrna基因序列为seq idno.7和seq id no.8。
7、优选的,所述小鼠模型构建方法包括如下步骤:
8、(1)构建表达人源化cd69基因的打靶载体,用于人源化cd69基因的插入;
9、(2)设计针对小鼠cd69基因胞外和跨膜区两端的sgrna,利用体外转录技术获得上述sgrna;
10、(3)将步骤(1)构建的打靶载体、步骤(2)获得的sgrna以及cas9蛋白共注射或共电转至小鼠受精卵细胞质或细胞核中,并将该受精卵移植至假孕小鼠,对假孕生仔鼠进行基因型鉴定,筛选成功插入正确人源片段的阳性f0小鼠;
11、(4)f0小鼠与背景鼠进行繁殖获得f1小鼠,对f1代鼠尾进行基因鉴定,筛选出cd69人源化小鼠模型。
12、优选的,所述步骤(1)中包括下述步骤:根据人源cd69的结构及功能,将鼠源cd69基因编码的胞外区用人源cd69基因编码的胞外区替换,保留小鼠的胞内区序列,选取的人源cd69基因氨基酸序列如seq id no.1所示,被替换的鼠源cd69基因氨基酸序列如seq idno.2所示。
13、优选的,所述步骤(1)中包括下述步骤:选取人源cd69基因的62-199aa,利用同源重组的技术替换小鼠cd69基因的62-199aa,选取的人源cd69基因序列如seq idno.3所示。
14、优选的,所述步骤(1)中构建成功的打靶载体序列如seq id no.4所示。
15、优选的,所述步骤(2)中sgrna的基因序列为(a)seq id no.5和seq id no.6,或者(b)seq id no.7和seq id no.8。
16、更优选的,所述步骤(2)中sgrna的基因序列为seq id no.7和seq id no.8。
17、优选的,所述步骤(3)中提供受精卵的小鼠和假孕小鼠的品系为balb/c。
18、优选的,所述步骤(3)中f0小鼠基因型鉴定使用的5’端鉴定引物如seq id no.9和seq id no.10所示,3’端鉴定引物如seq id no.11和seq id no.12所示。
19、优选的,所述步骤(3)中f0小鼠基因型鉴定使用的pcr反应体系如下:
20、
21、
22、优选的,所述步骤(3)中f0小鼠基因型鉴定使用的pcr反应条件如下:
23、
24、本发明的第二方面提供上述构建方法得到的小鼠在研究cd69基因相关功能和作用机制中的应用。
25、优选的,所述应用是非诊断和非治疗目的的。
26、本发明的第三方面提供上述构建方法得到的小鼠在筛选用于治疗与cd69基因相关疾病的药物中的应用。
27、优选的,所述应用是非诊断和非治疗目的的。
28、优选的,所述与cd69基因相关疾病为哮喘。
29、本发明的有益效果:
30、本发明的动物模型设计了切割鼠源cd69基因的sgrna,同时设计包含人源cd69基因的donor,将sgrna、donor和cas9混样,注射到balb/cjgpt背景小鼠的受精卵中,进行同源重组,获得阳性f0,f0小鼠与balb/c小鼠配种获得稳定的遗传阳性f1小鼠模型。本发明的动物模型解决了在动物体内研究人类基因编码蛋白的功能以及研究人类疾病发病机制等问题,为候选抗人cd69抗体药物的临床安全性及药效研究提供有力的科学基础和技术。
- 还没有人留言评论。精彩留言会获得点赞!