采用大腔膛的核及磁共振成像或者大腔膛的CT及磁共振成像的辐射治疗规划和跟踪系统的制作方法与工艺
本申请涉及图像引导辐射治疗规划。其尤其适合与多模态辐射治疗规划结合应用。
背景技术:
辐射治疗是一种常用的肿瘤学治疗技术,其中,将一定剂量或者一系列剂量的高能伽玛(γ)辐射、粒子束或其他辐射输送至患者身体或者患者身体的目标区域,以实现诸如根除癌变组织的治疗效果。在辐射处置之前基于一个或多个规划体积图像规划辐射治疗会话(session),所述一个或多个规划体积图像的目的在于限定肿瘤和周围组织的解剖学边界,以确定辐射束参数和剂量分布。在辐射治疗规划(RTP)中通常采用计算机断层摄影(CT)扫描器,因为成像腔膛具有充分的尺寸,以容纳较大的/平的辐射治疗床和平均体格或大于平均体格的患者连同固定装置的相当体积。而且,如此采集的CT数据直接提供了用于RTP的组织的衰减性质。RTP床是经过仔细设计的平的支撑,其确保按照与成像时一样的位置对患者进行处置。用于RTP的CT成像的一个问题是患者将受到额外的电离辐射,其将导致对额外的长期不良副作用,例如癌症的担忧(而在很多情况下癌症正是其所要处置的)。此外,CT无法为身体的所有软组织区域提供必要的图像质量。最近人们引入了正电子发射断层摄影(PET)作为可行的癌症检测成像模态,其包括转移扩散。在与诸如CT的其他数据融合之后,PET能够提供额外的用于辐射治疗规划和监测的肿瘤机能信息。在PET扫描中,向患者施用放射性药剂,其中,所述放射性药剂的放射性衰变事件将产生正电子。每一正电子在短射程内与电子相互作用从而产生发射两个反向的γ射线的正电子-电子湮灭事件。在采用符合探测电路的情况下,围绕患者的辐射探测器环形阵列探测对应于湮灭事件的符合反向γ射线事件。连接两个符合探测的响应线(LOR)含有湮灭事件的位置。所述响应线与投影数据类似,对其重建,以生成二维或三维图像。PET聚焦在诸如肿瘤性癌变组织的具有高代谢活动的区域上,因此有助于将恶性肿瘤与良性肿瘤、表征肿瘤复发和辐射坏死的低含氧量区域区分开。PET已经表现出了改善分级、预后、规划和跟踪监测的潜力。然而,PET的一些限制包括空间分辨率有限,并且在出现高示踪剂累积的情况下缺少组织以外的额外解剖学细节。PET在描绘解剖学细节方面一般较差,因此在相对于其他患者解剖学结构定位肿瘤方面存在困难。存在多模态PET-CT系统用于进行辐射治疗规划,但是如上所述,这一布置仍将使患者遭受额外的来自所采用的CT扫描的有害电离辐射。磁共振成像(MRI)和光谱检查(MRS)提供了作为RTP中的解剖学成像的替代的可能性。在MR扫描中,通过静态主磁场B0对所要检查的身体组织的核自旋对准,并通过在射频(RF)段内振荡的横向磁场B1对其进行激励。使所产生的驰豫信号暴露于梯度磁场下,从而对所产生的共振定位。按照已知的方式接收所述弛豫信号,并将其重建成单维或多维图像。MRI具有优良的软组织成像,而MRS能够表征组织代谢,其能够提供有关感兴趣区域内的血管生成、细胞增殖和细胞程序死亡的信息。然而,磁共振系统受到其腔膛尺寸的限制,其无法舒适地容纳大于平均体格的患者以及较大的RTP床/平台面。此外,在某些定位/固定情况下,额外的腔膛空间(>70cm)是有益的,但是对于当前的MR系统而言,并不存在这样的额外空间。成像模态之间的图像配准的准确性是RTP的重要特征,因此优选在同一会话内执行这两种扫描,从而避免患者移动和误配准误差。组合图像表示之间的偏差可能对处置评估工具,例如剂量体积直方图、肿瘤控制概率、正常组织并发症概率和适形性(conformality)指标产生重要影响。因此,需要一种PET-MRI多模态辐射治疗规划系统,其具有足够大的腔膛,从而舒适地容纳所述RTP床/平台面、大于平均体格的患者以及固定装置,从而以改进的工作流程在单个成像会话内执行扫描。
技术实现要素:
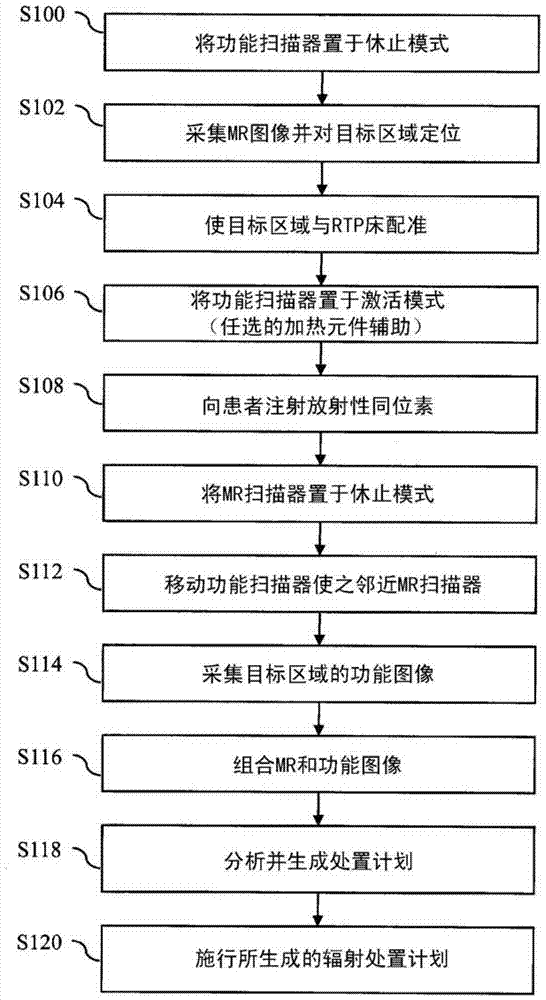
本申请提供了克服上述问题和其他问题的新的改进的方法和系统。根据一个方面,提出一种辐射治疗规划(RTP)系统。所述RTP系统包括具有第一腔膛的磁共振(MR)系统,所述第一腔膛沿MR纵轴限定容纳受检者的MR成像区域。所述第一腔膛具有至少70cm的直径,在优选实施例中为85cm。所述RTP系统包括具有第二腔膛的核成像扫描器,所述第二腔膛沿与所述MR纵轴对准的核纵轴限定容纳受检者的核成像区域。所述第二腔膛具有至少70cm的直径,在优选实施例其为85cm。所述系统包括具有平的台面的、线性移动通过所述MR和核成像区域的辐射治疗床,辐射治疗床顺次将受检者定位到所述MR和核成像区域内。所述平的台面的材料与MR和PET成像过程都兼容。在另一实施例中,所述第二扫描器也可是CT扫描器。根据另一方面,提出一种用于生成或更新辐射治疗计划的方法。所述方法包括将受到辐射治疗床支撑的受检者定位到MR扫描器的MR成像区域和核扫描器的核成像区域之一内。采集目标体积的MR或核图像表示并相对于对应的成像区域对目标体积定位。使所定位的目标体积与辐射治疗床配准,并相对于所述辐射治疗床确定患者的预期坐标位置。将受检者从所述MR成像区域和所述核成像区域之一线性地重新定位到所述核扫描器和与之共享共同的纵轴的MR扫描器之一的另一成像区域内。采用所述核及MR扫描器中的另一个采集所述目标体积的图像表示。将所采集到的MR及核图像表示组合成组合图像表示。根据所述组合、MR及核图像表示之一生成或更新辐射治疗计划。限定MR成像区域的第一腔膛和限定核成像区域的第二腔膛中的每者均具有至少70cm的直径。一个优点存在于改进的工作流程内。另一个优点是降低了辐射治疗规划过程中的电离辐射暴露。另一个优点是,将通过增加来自MR图像的软组织对比度改进辐射治疗计划。在阅读并理解了下述详细说明的情况下,本领域技术人员将认识到本发明的进一步的优点。附图说明本发明可以采取各种部件和部件布置的形式,以及各种步骤和步骤布置的形式。附图的作用仅在于对优选实施例进行举例说明,不应将其推断为对本发明构成限制。图1是一种多模态辐射治疗规划系统的示意图;图2是采用图1的系统规划辐射治疗的方法的流程图;图3是采用图1的系统规划辐射治疗的另一方法的流程图;以及图4是采用图1的系统监测和更新辐射治疗的方法的流程图。具体实施方式参考图1,辐射治疗规划(RTP)系统10能够实施磁共振成像和/或光谱检查以及第二成像模态,例如,PET、SPECT等核成像或者计算机断层摄影(CT)成像。RTP系统10包括解剖学成像系统,在所示的实施例中,是容纳在第一扫描架14内的诸如磁共振扫描器的大腔膛解剖学扫描器12。第一患者容纳腔膛16限定MR扫描器12的第一或MR检查区域18。患者容纳腔膛16具有至少70cm的直径。然而,也可以设想更大的,例如,85cm的腔膛直径。可以通过增大超导磁体的净腔膛以及提高腔膛内的RF身体线圈和梯度线圈部件的直径而实现更大腔膛的MR扫描器。利用增大的RF放大器功率和梯度放大器功率能够稍微补偿RF身体线圈(用于发射功能)和梯度线圈部件的降低的效率。所述MR扫描器包括主磁体20,其生成通过所述第一检查区域18的时间稳定、空间均匀的B0场。与所述主磁体邻近设置的梯度磁场线圈22的作用在于相对于所述B0磁场沿选定轴生成磁场梯度,从而对所述磁共振信号进行空间编码,以及生成磁化破坏场梯度等。所述磁场梯度线圈22可以包括被配置成沿三个正交方向产生磁场梯度的线圈段,所述三个方向通常为纵向或z向、横向或者x向以及垂直方向或y向。可以使梯度线圈凹陷到主磁体内,以顺应增大的腔膛直径。使诸如全身射频线圈的射频(RF)线圈组件24邻近检查区域设置。所述RF线圈组件生成用于激励受检者的经对准偶极子中的磁共振的射频B1脉冲。所述射频线圈组件24还用于探测从具有至少55cm的截面直径的视场(FOV)内的成像区域发出的磁共振信号。也可以将仅接收的RF线圈用于所述磁共振信号的探测。可以采用大于85cm的腔膛实现大约60-65cm的较大FOV。将任选的局部化铁增压器(booster)并入到RF线圈组件24内,从而在不截断轴向FOV的情况下实现更大的横截面的FOV。在这种布置中,通过磁体设计,使轴向FOV随着横截面FOV的增大而按比例增大,或者任选使轴向FOV保持与较小腔膛(例如,60cm腔膛)MR系统相似,以创建扁圆球形或者椭圆球形成像体积。在大腔膛MR系统中,通常没有规定使轴向FOV延伸到常规60cm腔膛系统之外。将第二成像系统容纳到限定第二患者容纳腔膛30的第二扫描架28内,在所示的实施例中,所述第二成像系统是诸如PET扫描器的功能扫描器26。所述患者容纳腔膛30具有至少70cm的直径。然而,也可以设想更大的,例如,85cm的腔膛直径。应当认识到,也可以设想CT扫描器、SPECT扫描器等。围绕腔膛30布置辐射探测器固定环,例如,光学耦合至闪烁体层34的光学探测器层32,以限定第二或PET检查区域36。任选将RF屏蔽38设置到光学探测器32和闪烁体34组件的面上,并且在一些实施例中,所述屏蔽顺着所述探测器组件的前后端延伸。所述RF屏蔽38对可能干扰MR扫描的由PET扫描器发出的RF噪声进行屏蔽。在PET(或SPECT)扫描器利用常规光电倍增管(PMT)作为光学探测器的情况下,它们将并入磁屏蔽材料,以降低所述PMT上的MR系统的边缘磁场的影响。在采用固态探测器的情况下,能够消除磁屏蔽(但是仍将利用RF屏蔽)。在来自MR扫描器12的RF脉冲的泄漏RF场可能激励或干扰闪烁体相关电子部件的情况下,所述RF屏蔽也是有利的。因此,所述RF屏蔽38还起着降低源自于光学探测器32及相关电路的RF干扰的作用。闪烁体层34不断地发射光学辐射,其将触发来自光学探测器的电响应。这一电响应将生成可能对MR信噪比造成不利影响的RF干扰。在SPECT扫描器中,将探测器32并入到各个机头内,所述机头被安装用于围绕第二腔膛30旋转,以及相对于受检者进行径向运动。为了采集受检者的磁共振数据,将受检者定位在MR检查区域18内,优选处于主磁场的等中心上或附近。扫描控制器40控制梯度控制器42,梯度控制器使得梯度线圈22跨越成像区域施加选定的磁场梯度脉冲,其可以是适合于选定磁共振成像或光谱检查序列的。所述扫描控制器40控制RF发射器44,RF发射器令所述RF线圈组件24生成磁共振激励和操纵B1脉冲。所述扫描控制器还控制一个或多个RF接收器46,该一个或多个RF接收器连接至RF线圈组件24,从而由其接收所生成的磁共振信号。将从接收器46接收的数据暂时存储到数据缓冲器48内,并由MR数据处理器50对其进行处理。MR数据处理器50能够执行本领域已知的各种功能,包括图像重建(MRI)、磁共振光谱检查(MRS)等。将所重建的磁共振图像、光谱检查读出结果以及其他经处理的MR数据存储到MR图像存储器52内。为了采集核成像数据,将患者置于PET检查区域36内。PET扫描控制器60对PET扫描器26进行操作,以执行选定目标区域的选定成像序列。典型地,向所要成像的对象或患者注入一种或多种放射性药剂或放射性同位素示踪剂,之后将其置于PET检查区域36内。用于PET的此类示踪剂的例子为18F-FDG、C-11,用于SPECT的此类示踪剂的例子为Tc-99m、Ga67核In-111。对于SPECT示踪剂而言,由所述示踪剂直接产生γ辐射。对于PET而言,示踪剂在所述对象内的存在产生了来自所述对象的发射辐射。通过围绕检查区域36的闪烁体探测器34探测辐射事件。通过时间戳单元62使时间戳与每一探测到的辐射事件相关联。符合探测器64确定γ射线的符合对,并基于所述符合对的探测时间的差异和视场的已知直径确定由γ射线的每一符合对定义的响应线(LOR)。重建处理器66将所有的LOR重建成存储到功能图像存储器68内的图像表示。任选地,飞行时间处理器70通过由每一LOR的时间戳导出飞行时间信息而对每一辐射事件定位。在一个实施例中,首先将患者置于核扫描器26内,并对其成像。在采集核图像数据之后,对核扫描器26的选定部件断电,并且就PMT而言,暂时降低所施加的偏压,从而减少/停止可能在图像采集过程中对MR扫描器12造成干扰的RF信号的发射。将患者支撑平移到MR检查区域18内,MR扫描器12采集用于进行重建的MR成像数据,其包括用于PET数据的衰减校正的数据。一旦完成了MR数据采集,就对核扫描器26的所述选定部件加电。到当前患者离开检查室,下一患者抵达并准备好成像时,核扫描器26处于可全面运转状态,并且准备好对患者进行核图像数据采集。如果所述核探测器没有达到其标称工作温度,那么加热元件72能够调节所述过程。在另一实施例中,在MR过程中对核扫描器26的光学探测器32和相关电路有选择地断电。为了重新开始PET扫描器26的正常操作,加热元件72在延长的休止周期之后使光学探测器32的温度迅速升高至标称工作温度,或者在休止周期内保持最低工作温度。可以将所述核扫描器26置于休止模式内,其包括对光学探测器32断电或者降低提供给其的功率,以降低RF干扰。在所述休止周期之后,任选借助加热元件72激活所述扫描器或者将其置于激活模式下,以采集核成像数据。所述加热元件72可以是电阻加热元件、暖空气管道、流体散热器等。在另一实施例中,将PET电路60、62、64、66、68、70设置到检查室外,以降低RF干扰。或者或此外,可以在核成像过程中将MR扫描器12置于休止(降低的RF噪声)模式内。诊断成像系统10包括工作站或图形用户接口(GUI)80,其包括显示装置82和用户输入装置84,临床医生能够采用其选择扫描序列和协议,显示图像数据等。所述两个扫描架14、28在线性布置内彼此相邻,并且彼此紧密靠近。扫描架14、28共享公共的辐射治疗规划(RTP)床90,其沿患者支撑轨道或路径92在两个检查区域18、36之间沿纵轴平移。所述床任选具有顺应患者在PET和MR扫描器之间的旋转的旋转设计,连同通过每一扫描器的线性行进。电动机或其他驱动机构(未示出)提供所述支撑在检查区域18、34内的纵向移动和垂直调整。所述RTP床90任选包括可伸缩护栏93,从而在运送过程中使患者保持在所述床上,图中所示的护栏处于伸缩位置。在所示的实施例中,第二扫描架28沿扫描架轨道94平移,从而缩短两个成像系统12、26之间的患者运送时间。两个扫描架之间的闭合布置降低了患者移动和误配准误差的可能性。可以将所述扫描架隔开,以降低成像模态之间的干扰。例如,PET扫描器26的光学探测器32发射RF信号,其可能对MR扫描器12的共振检测造成干扰。而且,所述MR扫描器的磁边缘场随着与扫描器的距离的增大而降低。在一个实施例中,可以将扫描架14、28放到一起,以降低患者错位的可能性,或者可以通过沿轨道94移动扫描器12、26中的一者或两者而将它们分开,以降低所述核扫描器和MR扫描器12、26之间的干扰。在辐射治疗规划中,患者在处置之前、处置之间以及处置之后的图像采集过程中必须处于与辐射处置过程中相同的固定位置上。在很多情况下,辐射处置过程包括一系列经规划的(分成几部分的)剂量输送。在一个实施例中,RTP床或患者支撑90具有与为受检者提供辐射处置的辐射治疗系统(未示出)的台面基本等同的几何结构。其通常为平的台面表面。RTP床90和辐射治疗系统台面几何结构之间的不精确可能导致患者位置复现性差、图像空间失真、患者标记不准确等,其有可能导致不准确的辐射处置,从而对患者造成显著的伤害。在另一实施例中,RTP床90能从患者支撑轨道92上拆卸下来,以供在辐射治疗系统中使用。通过采用同一床进行治疗规划和治疗输送,减少或者避免了由两个床之间的几何结构不准确性造成的图像配准误差和定位误差。辐射处置系统台面任选大于常规MR或核成像系统患者支撑,以顺应各种为了取得通往目标区域的最佳处置路径的患者位置。在任一种成像系统中,患者支撑以及某些情况下的肢体末端升高的患者定位/固定受到腔膛尺寸的限制,其又制约着可用的患者位置,其中,对于常规MR系统而言,腔膛的尺寸一般为60cm,对于常规PET系统而言,腔膛的尺寸一般为70cm。这也是通常采用具有更大的能够容纳更大的辐射治疗床的腔膛(~80-85cm)的计算机断层摄影(CT)系统执行辐射治疗规划的一个原因。然而,采用CT系统执行规划是以使原本已经很脆弱的患者遭受更多的电离辐射为代价的,其可能造成额外的长期不良副作用。而且,在存在来自CT的额外电离辐射剂量的情况下,就会不愿执行处置中成像以评估处置响应或器官移动/变化,从而达到重新规划目的。而采用MR则减少了这种顾虑。然而,将CT用于RTP已经得到了公认,因为能够直接获得组织的衰减特性,能够很好地对硬组织成像,并且能够获得良好的几何精确度。着眼于这一点,替代实施例包括将大腔膛CT-MR组合用于RTP。当前CT是RTP的黄金标准,然而将MR数据与CT数据融合,使其作为处置计划的部分,以改善RT规划,将(例如)肿瘤附近的软组织结构或血管考虑在内,能够带来医疗利益。而且,如文中提到的,由于不存在额外的电离辐射,因而将MR用于肿瘤响应监测/跟踪也是有好处的。与所描述的具有RTP床/平台面的大腔膛核医学(NM)扫描器,例如,PET扫描器和MR扫描器类似,也可以将所述NM扫描器改为大腔膛CT扫描器。在这一实施例中,以CT造影剂代替PET造影剂。通过这种方式,可以针对RTP有效率地实现既定患者的单个工作流程会话,其中,借助改进的互配准使CT和MR图像采集之间的患者移动降至了最低。所述CT和MR扫描器优选处于同一室内。在额外的替代实施例中,它们在空间上接近,并且所述共享的RTP床还包括手推车(trolley),以允许将固定到平的台面上的患者从一个系统到另一系统容易地转运。在所描述的CT+MR例子中,可以将CT用于RTP,并且采集并融合MR数据,以改善规划,可以将MR用于RTP,并且可以将CT和MR中的任一者或两者用于处置响应/效率监测(优选MR)。在另一实施例中,提供了一种核医学扫描器和一种组合的MR/CT扫描器。可以将所述NM和CT扫描器用于规划,并且可以将所述NM和MR扫描器周期性地用于跟踪检查,以监测进展。所述RTP系统10包括较大的腔膛16、36,其直径为70cm或更大,优选为80-85cm,其大到足以容纳具有复制对应的辐射处置系统的床的尺寸的RTP床90。在这种布置中,在RTP系统10和辐射处置系统之间再现了准确的患者定位,从而在不对患者引入有害的额外电离辐射的情况下在部分(fraction)之间或者在几个部分之后监测处置进展。所述RTP床90和相似的处置系统床是平的,而不是像常规成像系统当中那样是凹面的或者曲面的。常规成像系统通常具有凹面形状,以顺应腔膛的圆形开口,并限制患者的移动。床90的垂直和纵向运动是准确的并且可再现的。RTP床90包括多个安装结构96,例如,安装孔、夹具等,以顺应各种专门的附着和约束装置,从而在治疗周期的多个部分期间将患者重复地准确固定到共同的固定位置上。所述床90和约束装置对于MR成像以及核及CT成像都是兼容的,其不应当包含任何产生显著的伪影的物体或材料。例如,所述床90是非铁磁的,具有低RF损耗并且不生成质子信号,以满足MR兼容性标准。为了实现核及CT成像兼容性,所述床90在用于成像的能量范围内具有低γ射线和x射线衰减和散射。这些针对MR的标准一般能够采用具有一定程度的γ射线和X射线衰减的机械设计、玻璃和/或凯夫拉尔增强塑料实现,为了实现核及CT成像兼容性,能够针对RTP床90以及MR线圈或患者固定附件对所述衰减进行建模和定量表示,并通过相应的重建处理器50、66对其加以考虑。将图1中的配准标记、基准标记物98或者两者的组合结合到床90的表面中或者表面上,其使所述床相对于图像扫描器12、26和受检者配准。在一个实施例中,患者配准系统100检测诸如栅格、线、点等的配准标记或者基准标记物98。患者配准系统100包括扫描架激光器102、壁式安装激光器(未示出)、顶板(未示出)或其任何组合,它们与两个检查区域18、36的等中心具有准确的空间关系。所述激光器根据相对于检查区域18、36的激光角度和测得的距离生成表示配准标记的三维(3D)空间位置的信号。配准处理器104根据这些信号确定所述配准标记的三维空间坐标,并使所述配准标记的实际坐标位置与预期的坐标位置进行比较。可以在患者身上标绘出所述配准标记,因而所述标记可通过患者配准系统100检测到,以进行定位。配准处理器104确定接收自配准系统100的实际坐标位置和配准标记的预期坐标位置之间的比较结果,并生成反馈信号,将该信号显示在GUI80上,从而对临床医生提供指导意见。配准处理器104生成类似的反馈信号,从而使RTP床90与对应的检查区域18、36配准。所生成的信号指示每一相应的成像扫描器12、26的控制器40、60对RTP床90的垂直和/或水平位置做相应的调整。在另一实施例中,将扫描器12和26两者都可对其成像的基准标记物粘附到RTP床90的安装结构96和/或患者上,或者粘附到附着至患者的固定装置上。执行定位扫描,从而确定所述基准标记物相对于成像区域18、36的3D坐标位置。配准处理器104由所述定位扫描确定所述基准的实际坐标位置,并使其与预期坐标位置进行比较。配准处理器104通过GUI80指示临床医生对患者重新定位,或者指示相应的扫描器控制器对RTP床90重新定位。应当认识到,所述基准标记物是能通过患者配准系统100检测的,因而能够采用成像扫描器12、26或者采用患者配准系统100通过所述基准标记物使患者和床90配准。所述基准标记物可在各个模态图像数据集内看到,从而简化了多模态图像数据集的配准,由此得到用于RTP和处置监测的融合图像显示。在监测的优选工作流程中,患者返回接受扫描,应用其固定和基准标记物布置,并任选(以及自动)使新采集的图像数据与处置前图像数据融合。参考图2,在处置前辐射治疗规划中,在将核扫描器26置于休止模式S100之后,采用MR扫描器12对将要接受治疗辐射剂量的目标体积成像,之后相对于MR成像区域18对其定位S102。休止模式是指扫描器不发射任何可能对其他扫描器的功能造成潜在干扰的噪声,例如,电噪声或RF噪声的工作模式。目标区域的MR成像生成有关目标区域的形状、尺寸和位置的解剖学数据。对于对比健康组织以及周围软组织或血管结构描绘肿瘤软组织而言,MR成像优于CT成像。对于对包括骨骼在内的较硬组织成像而言,CT优于MR成像,而且在某些由呼吸导致的运动伪像将影响图像质量的人体应用中,为了进行非常快速的扫描,在这样的一些条件下也优选采用CT。一旦完成了对目标区域的定位,就采用患者配准系统100使患者位置和目标体积与RTP床配准S104。所述配准过程确定患者和RTP床90上的配准标记的预期坐标位置。任选借助加热元件72将核扫描器26置于激活模式S106。为了准备好进行核图像数据采集,向患者注射或者在开始MR研究之前预先向患者注射放射性同位素S108。将MR扫描器12置于休止模式S110,任选移动核扫描器26使之与MR扫描器邻近S112,以降低患者在MR和核成像区域18、36之间行进的纵向距离。在采集目标区域的处置前核图像表示的过程中将MR扫描器置于休止模式S114。诸如PET的核成像提供了目标区域的功能数据而不是解剖学数据,例如,其表征细胞增殖来说明目标区域出现肿瘤、血流、细胞坏死、缺氧等。所述功能数据可以用于在处置周期内更新所生成的处置计划,以考虑肿瘤恶性生长、细胞死亡或者其他临床重要发现的增加或减少。融合处理器110将来自MR和PET扫描器12、26的经配准的处置前图像表示组合S116成合成图像。通过规划处理器112对融合图像进行分析,其根据目标区域的解剖学和功能特征生成或更新处置计划S118。根据所生成的或更新的处置计划由单独的辐射处置系统执行S118生成的或更新的辐射处置计划S120,从而根据所确定的预期坐标位置将患者定位到所述辐射处置系统的处置床上。在另一实施例中,在手推车上将固定的患者从RTP系统10转运到辐射处置系统,从而在同一RTP床90上对患者进行成像和处置。当然,所述治疗计划是受到诸如辐射肿瘤学家的处置专业人员的监督、调整和批准的。可以在与规划处理器112接口的图形用户界面(GUI)80上或者单独的处置规划GUI(未示出)上使所述处置计划可视化。参考图3,为了准备好进行核图像数据采集,向患者注射或者在开始MR研究之前预先向患者注射放射性同位素S200,并将MR扫描器12置于休止模式S202。之后采用核扫描器26对要接收处置辐射剂量的目标体积成像,并相对于核成像区域36对其进行定位S204。目标区域的核成像生成有关细胞增殖的表征的功能数据,从而示出所述目标区域的肿瘤、血流、细胞坏死、缺氧等的存在。所述功能数据可以用于在处置周期内更新所生成的处置计划,以考虑肿瘤恶性生长或细胞死亡的增加或减少。一旦完成了对目标区域的定位,就采用患者配准系统100使患者位置和目标体积与RTP床配准S206。所述配准过程确定患者和RTP床90上的配准标记的预期坐标位置。将MR扫描器12置于激活模式S208,同时将核扫描器26置于休止模式210,并任选将其移动到与MR扫描器12邻近的位置S212,以降低患者在MR和核成像区域18、36之间行进的纵向距离。目标区域的MR成像生成有关目标区域的形状、尺寸和位置的解剖学数据而不是功能数据。对于对比健康组织以及周围软组织或血管结构描绘肿瘤软组织而言,MR成像优于CT成像。对于对包括骨骼在内的较硬组织成像而言,CT优于MR成像,而且在由呼吸导致的运动伪影将影响图像质量的某些人体应用中,为了进行非常快速的扫描,在这样的一些条件下也优选采用CT。在MR图像数据采集S214之后,融合处理器110将来自MR和核扫描器12、26的经配准的处置前图像表示组合S216成合成图像。通过规划处理器112对融合图像进行分析,从而根据目标区域的解剖学和功能特征生成或更新处置计划S218。根据所生成的或更新的处置计划通过辐射处置系统执行辐射处置S120,从而根据所确定的预期坐标位置将患者定位到所述辐射处置系统的处置床上。当然,所述处置计划是受到诸如辐射肿瘤学家的处置专业人员的监督、调整和批准的。可以在与规划处理器112接口的图形用户界面(GUI)80上或者单独的处置规划GUI(未示出)上使所述处置规划可视化。尽管在上文的描述中是在功能图像之前取得解剖学图像,但是应当认识到也可以使所述顺序相反。参考图4,由于患者不用经受CT成像的有害的额外电离辐射,因而能够更加频繁地执行处置中MR或MR及NM成像和监测,例如,在每一处置会话之前和之后。当在规划过程中根据患者的预期坐标位置使患者和RTP床90配准S200之后,采集目标区域的MR及核图像S202,并采用融合处理器112对其组合S204。规划处理器112分析经融合的图像表示S206,并确定是更新当前的处置计划S208并施行更新后的处置计划S210,继续当前的处置计划并再次施行所述处置部分S212,还是由于已经根除了目标体积或者目标体积已经不再呈恶性而终止处置周期S214。在一些情况下,对于处置监测阶段可以只采集MR数据。已经参考优选实施例描述了本发明。在阅读并理解了前述详细说明的同时,本领域技术人员可能想到修改和变化。这意味着,应当将本发明推断为包括所有此类落在所附权利要求或者其等同要件的范围内的修改和变化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1