多种抗人CSF-1R抗体的联合疗法及其用途的制作方法
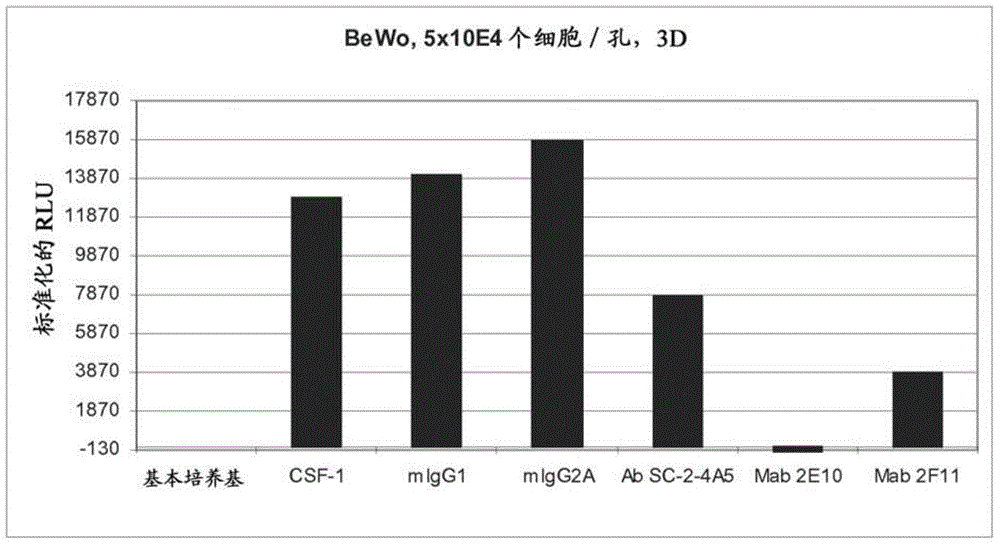
发明背景人CSF-1受体(CSF-1R;集落刺激因子1受体;同义词:M-CSF受体;巨噬细胞集落刺激因子1受体,Fms原癌基因,c-fms,SEQIDNO:62)从1986年起是已知的(Coussens,L.等,Nature320(1986)277-280)。CSF-1R是一种生长因子,并且由c-fms原癌基因编码(综述见例如Roth,P.和Stanley,E.R.,Curr.Top.Microbiol.Immunol.181(1992)141-167)。CSF-1R是CSF-1(集落刺激因子1,又称作M-CSF,巨噬细胞集落刺激因子)的受体,并且介导此细胞因子的生物学效果(Sherr,C.J.等,Cell41(1985)665-676)。集落刺激因子-1受体(CSF-1R)(又称作c-fms)的克隆第一次记载于Roussel,M.F.等,Nature325(1987)549-552。在该出版物中,显示了CSF-1R具有依赖于蛋白质C端尾部变化的转化潜力,包括抑制性酪氨酸969磷酸化的丧失,其结合Cbl,且由此调节受体下调(Lee,P.S.等,EmboJ.18(1999)3616-3628)。最近,鉴定出CSF-1R的第二种配体,称作白介素-34(IL-34)(Lin,H.等,Science320(2008)807-811)。目前,结合CSF-1R胞外域的两种CSF-1R配体是已知的。第一种是CSF-1(集落刺激因子1,又称作M-CSF,巨噬细胞;SEQIDNO:86),并且在细胞外以二硫键连接的同二聚体发现(Stanley,E.R.等,JournalofCellularBiochemistry21(1983)151-159;Stanley,E.R.等,StemCells12Suppl.1(1995)15–24)。第二种是IL-34(HumanIL-34;SEQIDNO:87)(Hume,D.A.等,Blood119(2012)1810-1820)。CSF-1R信号传导的主要生物学效果是造血前体细胞向巨噬细胞谱系(包括破骨细胞)的分化、其增殖、迁移、和存活。CSF-1R的活化由其CSF-1R配体CSF-1(M-CSF)和IL-34介导。CSF-1(MCSF)与CSF-1R的结合诱导同二聚体的形成和通过酪氨酸磷酸化对激酶的活化(Li,W.等,EMBOJournal.10(1991)277-288;Stanley,E.R.等,Mol.Reprod.Dev.46(1997)4-10)。生物学活性同二聚体CSF-1在CSF-1受体胞外域(CSF-1R-ECD)的亚域D1至D3内结合CSF-1R。CSF-1R-ECD包含5个免疫球蛋白样亚域(称作Dl至D5)。胞外域(CSF1R-ECD)的亚域D4至D5不参与CSF-1结合(Wang,Z.等MolecularandCellularBiology13(1993)5348-5359)。亚域D4参与二聚化(Yeung,Y-G.等Molecular&CellularProteomics2(2003)1143–1155;Pixley,F.J.等,TrendsCellBiol14(2004)628-638)。进一步的信号传导由分别与PI3K/AKT和Ras/MAPK途径连接的PI3K的p85亚基和Grb2介导。这两种重要的信号传导途径可以调节增殖、存活和凋亡。结合CSF-1R的磷酸化胞内域的其它信号传导分子包括STAT1,STAT3,PLCy,和Cbl(Bourette,R.P.andRohrschneider,L.R.,GrowthFactors17(2000)155-166)。CSF-1R信号传导在免疫应答中,在骨重塑中及在生殖系统中具有生理学作用。已经显示了CSF1(Pollard,J.W.,Mol.Reprod.Dev.46(1997)54-61)或CSF-1R(Dai,X.M.等,Blood99(2002)111-120)的敲除动物具有与CSF-1R在相应的细胞类型中的作用一致的造骨、造血、组织巨噬细胞、和生殖表型。Sherr,C.J.等,Blood73(1989)1786-1793涉及抑制CSF-1活性的一些针对CSF-1R的抗体。Ashmun,R.A.等,Blood73(1989)827-837涉及CSF-1R抗体。Lenda,D.等,JournalofImmunology170(2003)3254-3262涉及CSF-1缺陷小鼠中降低的巨噬细胞募集,增殖,和活化在肾炎症期间导致降低的肾小管凋亡。Kitaura,H.等,JournalofDentalResearch87(2008)396-400涉及抑制正牙学牙活性的抗CSF-1抗体。WO2001/030381提及CSF-1活性抑制剂,包括反义核苷酸和抗体,而仅公开了CSF-1反义核苷酸。WO2004/045532涉及通过CSF1拮抗剂预防转移和骨损失以及治疗转移性癌症,其仅公开抗CSF-1抗体为拮抗剂。WO2005/046657涉及通过抗CSF-1抗体治疗炎性肠病。US2002/0141994涉及集落刺激因子的抑制剂。WO2006/096489涉及通过抗CSF-1抗体治疗类风湿性关节炎。WO2009/026303和WO2009/112245涉及在胞外域(CSF-1R-ECD)的前三个亚域(D1至D3)内结合CSF-1R的某些抗CSF-1R抗体。WO2011/123381(A1)涉及针对CSF-1R的抗体。发明概述本发明包括结合人CSF-1R的抗体,其特征在于结合人CSF-1R的胞外域的(二聚化)域D4至D5(SEQIDNo:85),该抗体用于:a)抑制CSF-1R配体依赖性和/或CSF-1R配体不依赖性CSF-1R表达型肿瘤细胞的细胞增殖;b)抑制具有CSF-1R配体依赖性和/或CSF-1R配体不依赖性CSF-1R表达型巨噬细胞浸润物的肿瘤的细胞增殖;c)抑制(CSF-1R配体依赖性和/或CSF1R配体不依赖性)CSF-1R表达型单核细胞和巨噬细胞的细胞存活;和/或d)抑制(CSF-1R配体依赖性和/或CSF-1R配体不依赖性)CSF-1R表达型单核细胞向巨噬细胞的细胞分化;其中所述抗CSF-1R抗体与化疗剂、放射、和/或癌症免疫疗法组合施用。这种与结合人CSF-1R的抗体联合的疗法具有有价值的特性,如相对于CSF-1R活化的更小活化潜力及因此降低的毒性和无CSF-1R受体刺激(例如,相比于以与域D1至D3结合为特征的结合人CSF-1R的抗体的联合疗法),所述抗体的特征在于结合(二聚化)域D4至D5。如本文中使用的,术语“配体依赖性”指经由胞外ECD的不依赖于配体的信号传导(并且不包括由胞内激酶域中的活化点突变介导的依赖性信号传导)。在一个实施方案中,在此背景中的CSF-1R配体指CSF-1R配体,其选自人CSF-1(SEQIDNo:86)和人IL-34(SEQIDNo:87);在一个实施方案中,CSF-1R配体是人CSF-1(SEQIDNo:86);在一个实施方案中,CSF-1R配体是人IL-34(SEQIDNo:87))。本发明包括结合人CSF-1R的抗体,即如下的结合人CSF-1R的抗体,其特征在于:结合人CSF-1R胞外域的(二聚化)域D4至D5(SEQIDNo:85),该抗体用于治疗具有CSF-1R表达型肿瘤或具有含CSF-1R表达型巨噬细胞浸润物的肿瘤的患者,其中肿瘤特征在于CSF-1R配体增加(在一个实施方案中,CSF-1R配体选自人CSF-1(SEQIDNo:86)和人IL-34(SEQIDNo:87);在一个实施方案中,CSF-1R配体是人CSF-1(SEQIDNo:86);在一个实施方案中,CSF-1R配体是人IL-34(SEQIDNo:87))(在血清,尿液或肿瘤活组织检查中可检出),其中所述抗CSF-1R抗体与化疗剂、放射和/或癌症免疫疗法组合施用。术语“CSF-1R配体增加”指治疗前人CSF-1R配体(在一个实施方案中,CSF-1R配体选自人CSF-1(SEQIDNo:86)和人IL-34(SEQIDNo:87);在一个实施方案中,CSF-1R配体是人CSF-1(SEQIDNo:86);在一个实施方案中,CSF-1R配体是人IL-34(SEQIDNo:87))的过表达(与正常组织相比)或通过用抗CSF-1R抗体治疗诱导的人CSF-1R配体过表达(且与治疗前的表达水平相比)。在某些实施方案中,术语“增加”或“高于”指与来自参照样品的CSF-1R配体水平相比,通过本文中描述的方法检测的CSF-1R配体水平比参照水平高或者总体增加5%,10%,20%,25%,30%,40%,50%,60%,70%,80%,85%,90%,95%,100%或更多。在某些实施方案中,术语增加指CSF-1R配体水平的升高,其中升高是与例如从参照样品预先测定的CSF-1R配体水平相比高至少约1.5-,1.75-,2-,3-,4-,5-,6-,7-,8-,9-,10-,15-,20-,25-,30-,40-,50-,60-,70-,75-,80-,90-,或100倍。在一个优选的实施方案中,术语升高的水平指处于或高于参照水平的数值。在本发明的一个实施方案中,抗CSF-1R抗体的特征在于:抗体结合人CSF-1R胞外域(SEQIDNO:64)(包含域D1至D5),并且不结合人CSF-1R的胞外域的域D1至D3(SEQIDNO:66)。在一个实施方案中,可以与抗CSF-1R抗体一起施用的化疗剂包括但不限于抗瘤形成剂,包括烷化剂,包括:氮芥类(nitrogenmustards),诸如双氯乙基甲胺(mechlorethamine),环磷酰胺(cyclophosphamide),异环磷酰胺(ifosfamide),美法仑(melphalan)和苯丁酸氮芥(chlorambucil);亚硝脲类(nitrosoureas),诸如卡莫司汀(carmustine,BCNU),洛莫司汀(lomustine,CCNU),和司莫司汀(semustine)(甲基-CCNU);Temodal(TM)(替莫唑胺(temozolamide)),乙撑亚胺类(ethylenimines)/甲基蜜胺(methylamelamine)诸如三乙撑蜜胺(thriethylenemelamine)(TEM),三乙烯(triethylene),硫代磷酰胺(thiophosphoramide)(塞替派(thiotepa)),六甲蜜胺(hexamethylmelamine)(HMM,六甲蜜胺(altretamine));磺酸烷基酯类(alkylsulfonates)诸如白消安(busulfan);三嗪(triazines)诸如达卡巴嗪(dacarbazine)(DTIC);抗代谢物,包括叶酸类似物诸如甲氨蝶呤(methotrexate)和三甲曲沙(trimetrexate),嘧啶类似物诸如5-氟尿嘧啶(5FU)、氟脱氧尿嘧啶(fluorodeoxyuridine),吉西他滨,阿糖胞苷(cytosinearabinoside)(AraC,阿糖胞苷),5-氮胞苷(azacytidine),2,2'-二氟脱氧胞苷(2,2’-difluorodeoxycytidine),嘌呤类似物诸如6-巯嘌呤(6-merca.rho.topurine),6-硫鸟嘌呤,硫唑嘌呤(azathioprine),T-脱氧助间型霉素(deoxycoformycin)(喷司他丁(pentostatin)),红羟基壬基腺嘌呤(erythrohydroxynonyladenine,EHNA),磷酸氟达拉滨(fludarabinephosphate),和2-氯脱氧腺苷(克拉屈滨(cladribine),2-CdA);天然产物,包括抗有丝分裂药物诸如帕利他赛(paclitaxel),长春花生物碱类(vincaalkaloids),包括长春碱(VLB),长春新碱(vincristine),和长春瑞滨(vinorelbine),泰索帝(taxotere),雌莫司汀(estramustine),和磷酸雌莫司汀(estramustinephosphate);表鬼臼毒素类(epipodophylotoxins)诸如依托泊苷和替尼泊苷(teniposide);抗生素诸如放射菌素(actimomycin)D,道诺霉素(daunomycin)(柔红霉素(rubidomycin)),多柔比星,米托蒽醌(mitoxantrone),伊达比星(idarubicin),博来霉素(bleomycin),普卡霉素(plicamycin)(光神霉素(mithramycin)),丝裂霉素(mitomycin)C,和放线菌素(actinomycin);酶(诸如L-门冬酰胺酶);生物反应修饰剂(biologicalresponsemodifier)诸如干扰素-alpha,IL-2,G-CSF和GM-CSF;混杂的药剂,包括铂配位复合物诸如奥沙利铂,顺铂和卡铂,蒽二酮类(anthracenediones)诸如米托蒽醌(mitoxantrone),取代的脲诸如羟基脲(hydroxyurea),甲基肼(methylhydrazine)衍生物,包括N-甲基肼(MIH)和丙卡巴肼(procarbazine),肾上腺皮质抑制剂诸如米托坦(mitotane)(o,p-DDD)和氨鲁米特(aminoglutethimide);激素和拮抗剂,包括肾上腺皮质类固醇拮抗剂诸如泼尼松(prednisone)和等同物,地塞米松(dexamethasone)和氨鲁米特(aminoglutethimide));Gemzar(TM)(吉西他滨),黄体酮(progestin)诸如己酸羟孕酮(hydroxyprogesteronecaproate),醋酸甲羟孕酮(medroxyprogesteroneacetate)和乙酸甲地孕酮(megestrolacetate);雌激素诸如己烯雌酚(diethylstilbestrol)和乙炔基雌二醇(ethinylestradiol)等同物;抗雌激素诸如他莫昔芬(tamoxifen);雄激素,包括丙酸睾酮(testosteronepropionate)和氟甲睾酮(fluoxymesterone)/等同物;抗雄激素诸如氟他胺(flutamide),促性腺素释放素类似物和亮丙瑞林(leuprolide);及非类固醇抗雄激素诸如氟他胺(flutamide)。靶向表遗传机制(epigeneticmechanism)的疗法(包括但不限于组氨酸脱乙酰基酶抑制剂,去甲基化剂(例如Vidaza)和转录抑制(ATRA)疗法的释放)也可以与抗原结合蛋白组合。在一个实施方案中,化疗剂选自下组:紫杉烷类(taxanes)(如例如帕利他赛(泰素(Taxol)),多西他赛(docetaxel)(Taxotere),经修饰的帕利他赛(例如Abraxane和Opaxio),多柔比星(doxorubicin),舒尼替尼(sunitinib)(Sutent),索拉非尼(sorafenib)(Nexavar),和其它多激酶(multikinase)抑制剂,奥沙利铂(oxaliplatin),顺铂(cisplatin)和卡铂,依托泊苷(etoposide),吉西他滨(gemcitabine),和长春碱(vinblastine)。在一个实施方案中,化疗剂选自下组:紫杉烷类(如例如泰素(帕利他赛),多西他赛(Taxotere),经修饰的帕利他赛(例如Abraxane和Opaxio)。在一个实施方案中,化疗剂选自5-氟尿嘧啶(5-FU),亚叶酸(leucovorin),依立替康(irinotecan),或奥沙利铂。在一个实施方案中,化疗剂是5-氟尿嘧啶,亚叶酸和依立替康(FOLFIRI)。在一个实施方案中,化疗剂是5-氟尿嘧啶,和奥沙利铂(FOLFOX)。与化疗剂联合的疗法的具体例子包括例如CSF-1R抗体与紫杉烷类(例如多西他赛或帕利他赛)或经修饰的帕利他赛(例如Abraxane或Opaxio),多柔比星),卡培他滨(capecitabine)和/或贝伐单抗(bevacizumab)(Avastin),用于治疗乳腺癌;人CSF-1R抗体与卡铂,奥沙利铂,顺铂,帕利他赛,多柔比星(或经修饰的多柔比星(Caelyx或Doxil)),或拓扑替康(Hycamtin),用于卵巢癌;人CSF-1R抗体与多激酶抑制剂,MKI,(Sutent,Nexavar,或706)和/或多柔比星,用于治疗肾癌;CSF-1R抗体与奥沙利铂,顺铂和/或放射,用于治疗鳞状细胞癌;CSF-1R抗体与泰素和/或卡铂,用于治疗肺癌。因此,在一个实施方案中,化疗剂选自下组:紫杉烷类(多西他赛或帕利他赛或经修饰的帕利他赛(Abraxane或Opaxio),多柔比星,卡培他滨和/或贝伐单抗,用于治疗乳腺癌。在一个实施方案中,化疗剂选自下组:卡铂,奥沙利铂,顺铂,帕利他赛,多柔比星(或经修饰的多柔比星(Caelyx或Doxil)),或拓扑替康(Hycamtin),用于治疗卵巢癌。在一个实施方案中,化疗剂选自下组:多激酶抑制剂(舒尼替尼(Sutent),索拉非尼(Nexavar)或二磷酸莫替沙尼(motesanibdiphosphate)(AMG706)和/或多柔比星,用于治疗肾癌。在一个实施方案中,化疗剂选自下组:奥沙利铂,顺铂和/或放射,用于治疗鳞状细胞癌。在一个实施方案中,化疗剂选自下组:泰素和/或卡铂,用于治疗肺癌。在一个实施方案中,癌症免疫疗法(其可以与抗CSF-1R抗体组合施用)包括但不限于活化性T细胞或抑制性Treg细胞,活化性抗原呈递细胞,肿瘤微环境中的抑制性免疫抑制细胞,癌症疫苗和过继性细胞转移,T细胞接合剂。在一个实施方案中,癌症免疫疗法选自下组:a)T细胞结合剂,其选自结合人OX40,GITR,CD27,或4-1BB的激动性抗体,和T细胞双特异性抗体(例如T细胞结合性BiTETM抗体CD3-CD19,CD3EpCam,CD3-EGFR),IL-2(Proleukin),干扰素(IFN)alpha,结合人CTLA-4的拮抗性抗体(例如易普利姆玛(ipilimumab)),与PD-1,PD-L1,TIM-3,BTLA,VISTA,LAG-3,或CD25结合的拮抗性抗体,b)靶向免疫抑制:靶向STAT3或NFkB信号传导,阻断IL-6,IL-17,IL-23,TNFa功能的抗体或小分子,c)癌症疫苗/增强树突细胞功能:OncoVex(分泌GM-CSF的溶瘤病毒),激动性CD40抗体,Toll样受体(TLR)配体,TLR激动剂,编码MAGE-A3的重组融合蛋白,PROSTVAC;或d)过继性细胞转移:GVAX(表达GM-CSF的前列腺癌细胞系),树突细胞疫苗,过继性T细胞疗法,过继性CART细胞疗法。在一个实施方案中,癌症免疫疗法选自T细胞接合剂,其选自IL-2(Proleukin),和结合人CTLA-4的拮抗性抗体(例如易普利姆玛),结合PD-1或PD-L1的拮抗性抗体。在一个实施方案中,癌症免疫疗法是IL-2(Proleukin)。在一个实施方案中,癌症免疫疗法是结合人CTLA-4的拮抗性抗体(例如易普利姆玛)。本发明的又一个方面是结合人CSF-1R的抗体(包括结合D1-D3域的抗体和结合D4-D5域的抗体)与癌症免疫疗法的联合疗法,其中癌症免疫疗法选自下组:a)T细胞接合剂,其选自结合人OX40,GITR,CD27,或4-1BB的激动性抗体,和T细胞双特异性抗体(例如T细胞结合性BiTETM抗体CD3-CD19,CD3EpCam,CD3-EGFR),IL-2(Proleukin),干扰素(IFN)alpha,结合人CTLA-4的拮抗性抗体(例如易普利姆玛(ipilimumab)),与PD-1,PD-L1,TIM-3,BTLA,VISTA,LAG-3,或CD25结合的拮抗性抗体,b)靶向免疫抑制:靶向STAT3或NFkB信号传导,阻断IL-6,IL-17,IL-23,TNFa功能的抗体或小分子,c)癌症疫苗/增强树突细胞功能:OncoVex(分泌GM-CSF的溶瘤病毒),激动性CD40抗体,Toll样受体(TLR)配体,TLR激动剂,编码MAGE-A3的重组融合蛋白,PROSTVAC;或d)过继性细胞转移:GVAX(表达GM-CSF的前列腺癌细胞系),树突细胞疫苗,过继性T细胞疗法,过继性CART细胞疗法。本发明的又一个方面是用于治疗癌症的结合人CSF-1R的抗体的联合疗法(包括结合D1-D3域的抗体和结合D4-D5域的抗体),其中CSF-1R抗体与双特异性ANG-2-VEGF抗体(例如如WO2010/040508或WO2011/117329中描述的ANG2-VEGF抗体,在一个优选的实施方案中,与如WO2011/117329中描述的双特异性ANG-2-VEGF抗体XMab1)组合施用。在一个实施方案中,用于治疗癌症的结合人CSF-1R的抗体的特征在于与域D4-D5结合。在一个实施方案中,此类联合疗法包括结合人CSF-1R的抗体和如WO2011/117329中描述的双特异性ANG-2-VEGF抗体XMab1,所述结合人CSF-1R的抗体特征在于重链可变域是SEQIDNO:39,且轻链可变域是SEQIDNO:40。本发明的又一个方面是结合人CSF-1R的抗体(包括结合D1-D3域的抗体和结合D4-D5域的抗体)与癌症免疫疗法的联合疗法,其中癌症免疫疗法选自下组:癌症疫苗/增强树突细胞功能:OncoVex(分泌GM-CSF的溶瘤病毒),激动性CD40抗体,Toll样受体(TLR)配体,TLR激动剂,编码MAGE-A3的重组融合蛋白,PROSTVAC。本发明的一个优选的实施方案是结合人CSF-1R的抗体(包括结合D1-D3域的抗体和结合D4-D5域的抗体,优选如本文中描述的结合D4-D5域的抗体)与癌症免疫疗法的联合疗法,其中癌症免疫疗法是激动性CD40抗体。结合人CSF-1R的域D1-D3的CSF-1R抗体记载于例如WO2009/026303,并且WO2009/112245涉及在胞外域(CSF-1R-ECD)的前3个亚域(D1至D3)内结合CSF-1R的某些抗CSF-1R抗体。WO2011/123381(A1)涉及针对CSF-1R的抗体。及Sherr,C.J.等,Blood73(1989)1786-1793(通常这些抗体的特征在于抑制CSF-1R配体依赖性而非不依赖于CSF-1R配体的CSF-1R增殖和/或信号传导)。结合人CSF-1R的域D4-D5的CSF-1R抗体记载于例如本发明,PCT/EP2012/075241及Sherr,C.J.等,Blood73(1989)1786-1793(通常这些抗体的特征在于抑制CSF-1R配体依赖性和非不依赖于CSF-1R配体的CSF-1R增殖和/或信号传导)。如此,在本发明的一个方面还包括结合人CSF-1R的抗体,其用于治疗癌症,其中与化疗剂,放射,和/或癌症免疫疗法组合施用抗CSF-1R抗体。在一个实施方案中,癌症免疫疗法选自:a)T细胞结合剂,其选自针对GITR,CD27,或4-1BB的激动性抗体,和T细胞双特异性抗体(例如T细胞结合性BiTETM抗体CD3-CD19,CD3EpCam,CD3-EGFR),IL-2(Proleukin),干扰素(IFN)alpha,结合人CTLA-4的拮抗性抗体(例如易普利姆玛(ipilimumab)),与PD-1,PD-L1,TIM-3,BTLA,VISTA,LAG-3,或CD25结合的拮抗性抗体,b)靶向免疫抑制:靶向STAT3或NFkB信号传导,阻断IL-6,IL-17,IL-23,TNFa功能的抗体或小分子,(例如针对IL-1,IL-6,IL-17,IL-23,TNFa或针对相应受体例如IL-1R,IL-6R,IL-17R,IL-23R的抗体),c)癌症疫苗/增强树突细胞功能:OncoVex(分泌GM-CSF的溶瘤病毒),激动性CD40抗体(如记载于例如Beatty等,Science331(2011)1612-1616,R.H.Vonderheide等,JClinOncol25,876(2007);Khalil,M等,UpdateCancerTher.2007June1;2(2):61–65,临床试验中的例子是例如CP-870,893和达西珠单抗(dacetuzumab,激动性CD40抗体,CAS号880486-59-9,SGN-40;人源化S2C6抗体)(Khalil,M等,UpdateCancerTher.2007June1;2(2):61–65;作为模型抗体的激动性CD40大鼠抗小鼠IgG2amAbFGK45记载于S.P.Schoenberger等,Nature393,480(1998))。CP-870,893是一种由Pfizer开发的完全人IgG2CD40激动性抗体。它以3.48×10-10M的KD结合CD40,但是不阻断CD40L的结合(参见例如U.S.7,338,660或EP1476185,其中CP-870,893描述为抗体21.4.1)。CP-870,893(U.S.7,338,660的抗体21.4.1)特征在于包含(a)QVQLVQSGAEVKKPGASVKVSCKASGYTFTGYYMHWVRQAPGQGLEWMGWINPDSGGTNYAQKFQGRVTMTRDTSISTAYMELNRLRSDDTAVYYCARDQPLGYCTNGVCSYFDYWGQGTLVTVSS(SEQIDNO:88)的重链可变域氨基酸序列(其对应于US7,338,660的SEQIDNO:42),(b)DIQMTQSPSSVSASVGDRVTITCRASQGIYSWLAWYQQKPGKAPNLLIYTASTLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQANIFPLTFGGGTKVEIK(SEQIDNO:89)的轻链可变域氨基酸序列(其对应于US7,338,660的SEQIDNO:44);和/或具有由具有美国典型培养物保藏中心(ATCC)登录号PTA-3605的杂交瘤21.4.1生成的抗体的重链可变域和轻链可变域氨基酸序列。达西珠单抗及其他人源化S2C6抗体记载于US6946129和US8303955。人源化S2C6抗体例如基于鼠mABS2C6(以PTA-110保藏于ATCC)的重链可变域和轻链可变域的CDR1,2和3。鼠mABS2C6的重链可变域和轻链可变域的CDR1,2和3记载并披露于US6946129。在一个实施方案中,激动性CD40抗体是达西珠单抗。在一个实施方案中,激动性CD40抗体的特征在于包含(a)EVQLVESGGGLVQPGGSLRLSCAASGYSFTGYYIHWVRQAPGKGLEWVARVIPNAGGTSYNQKFKGRFTLSVDNSKNTAYLQMNSLRAEDTAVYYCAREGIYWWGQGTLVTVS(SEQIDNO:90)的重链可变域氨基酸序列(b)DIQMTQSPSSLSASVGDRVTITCRSSQSLVHSNGNTFLHWYQQKPGKAPKLLIYTVSNRFSGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCSQTTHVPWTFGQGTKVEIKR(SEQIDNO:91)的轻链可变域氨基酸序列。Toll样受体(TLR)配体,TLR激动剂,编码MAGE-A3的重组融合蛋白,PROSTVAC;或d)过继性细胞转移:GVAX(表达GM-CSF的前列腺癌细胞系),树突细胞疫苗,过继性T细胞疗法,过继性CART细胞疗法。在一个实施方案中,癌症免疫疗法选自T细胞接合剂,其选自IL-2(Proleukin),和结合人CTLA-4的拮抗性抗体(例如易普利姆玛)。在一个实施方案中,癌症免疫疗法是IL-2(Proleukin)。在一个实施方案中,癌症免疫疗法是结合人CTLA-4的拮抗性抗体(例如易普利姆玛)。在一个实施方案中,可以与抗CSF-1R抗体一起施用的癌症免疫疗法包括但不限于靶向疗法。靶向疗法的例子包括但不限于治疗性抗体的使用。例示性治疗性抗体包括但不限于小鼠的、小鼠-人嵌合的、嫁接有CDR的、人源化的和完全人的抗体,和合成抗体,包括但不限于那些通过筛选抗体文库选择的。例示性抗体包括但不限于如下那些抗体,其结合细胞表面蛋白Her2、CDC20、CDC33、粘蛋白样糖蛋白、和肿瘤细胞上存在的上皮生长因子受体(EGFR),且任选地诱导对展示这些蛋白质的肿瘤细胞的细胞抑制和/或细胞毒性作用。例示性的抗体还包括HERCEPTIN(曲妥珠单抗(trastuzumab))(其可以用于治疗乳腺癌和其它癌症形式),和RITUXAN(利妥昔单抗(rituximab)),ZEVAL1N(替伊莫单抗(ibritumomabtiuxetan)),GLEEVEC(甲磺酸伊马替尼(imatinibmesylate)),和LYMPHOCIDE(依帕珠单抗(epratuzumab))(其可以用于治疗非何杰金(Hodgkin)氏淋巴瘤和其它癌症形式)。某些例示性的抗体还包括ERBITUX(西妥昔单抗(cetuximab))(EMC-C225);ertinolib(Iressa);BEXXAR(TM)(碘131托西莫单抗(tositumomab));KDR(激酶域受体)抑制剂;抗VEGF抗体和拮抗剂(例如Avastin(贝伐单抗(bevacizumab))和VEGAF-TRAP);抗VEGF受体抗体和抗原结合区;抗Ang-1和Ang-2抗体和抗原结合区;Ang-2-VEGF双特异性抗体(如记载于例如WO2010/040508或WO2011/117329),针对Tie-2的抗体和其它Ang-1和Ang-2受体;Tie-2配体;针对Tie-2激酶抑制剂的抗体;Hif-la抑制剂,和Campath(TM)(Alemtuzumab)。在某些实施方案中,癌症治疗剂是选择性诱导肿瘤细胞凋亡的多肽,包括但不限于TNF相关多肽TRAIL。其它激酶的特异性抑制剂也可以与CSF1R抗体组合使用,包括但不限于MAPK途径抑制剂(例如ERK,JNK和p38的抑制剂),PB激酶/AKT抑制剂和Pim抑制剂。其它抑制剂包括Hsp90抑制剂,蛋白酶体抑制剂(例如Velcade)和多作用机制抑制剂诸如Trisenox。在一个实施方案中,癌症免疫疗法包括一种或多种降低血管生成的抗血管发生剂。某些此类药剂包括但不限于IL-8拮抗剂;Campath,B-FGF;FGF拮抗剂;Tek拮抗剂(Cerretti等,美国公开文本No.2003/0162712;Cerretti等,美国专利No.6,413,932,及Cerretti等,美国专利No.6,521,424,每篇通过提及收入本文用于所有目的);抗TWEAK剂(其包括但不限于抗体和抗原结合区);可溶性TWEAK受体拮抗剂(Wiley,美国专利No.6,727,225);拮抗整联蛋白与其配体结合的ADAM解整联蛋白(distintegrin)域(Fanslow等,美国公开文本No.2002/0042368);抗eph受体和抗ephrin抗体;抗原结合区,或拮抗剂(美国专利No.5,981,245;5,728,813;5,969,110;6,596,852;6,232,447;6,057,124及其专利家族成员);抗VEGF剂(例如特异性结合VEGF的抗体或抗原结合区,或可溶性VEGF受体或其配体结合区),诸如Avastin(贝伐单抗)或VEGF-TRAP和抗VEGF受体剂(例如对其结合特异性的抗体或抗原结合区),EGFR抑制剂(例如对其结合特异性的抗体或抗原结合区),诸如帕尼单抗(panitumumab),IRESSA(吉非替尼(gefitinib)),TARCEVA(厄洛替尼(erlotinib)),抗Ang-1和抗Ang-2剂(例如对其或对其受体(例如Tie-2/TEK)特异性结合的抗体或抗原结合区),和抗Tie-2激酶抑制剂(例如特异性结合并抑制生长因子活性的抗体或抗原结合区,诸如肝细胞生长因子(HGF,又称为Scatter因子)的拮抗剂,和特异性结合其受体“c-met”的抗体或抗原结合区;抗PDGF-BB拮抗剂;针对PDGF-BB配体的抗体和抗原结合区;和PDGFR激酶抑制剂。可以与抗原结合蛋白组合使用的其它抗血管生成剂包括如下的药剂,诸如MMP-2(基质金属蛋白酶2)抑制剂,MMP-9(基质金属蛋白酶9)抑制剂,和COX-II(环氧合酶II)抑制剂。有用的COX-II抑制剂的例子包括CELEBREX(塞莱昔布(celecoxib)),伐地昔布(valdecoxib),和罗非昔布(rofecoxib)。在某些实施方案中,癌症治疗剂是血管发生抑制剂。某些此类抑制剂包括但不限于SD-7784(Pfizer,USA);西仑吉肽(cilengitide)(MerckKGaA,Germany,EP0770622);哌加他尼钠(pegaptaniboctasodium)(GileadSciences,USA);Alphastatin(BioActa,UK);M-PGA,(Celgene,USA,美国专利No.5,712,291);伊洛马司他(ilomastat)(Arriva,USA,美国专利No.5,892,112);司马沙尼(semaxanib)(Pfizer,USA,美国专利No.5,792,783);瓦他拉尼(vatalanib)(Novartis,Switzerland);2-甲氧雌二醇(EntreMed,USA);TLCELL-12,(Elan,Ireland);乙酸阿奈可他(anecortaveacetate)(Alcon,USA);alpha-D148Mab,(Amgen,USA);CEP-7055,(Cephalon,USA);抗VnMab,(Crucell,Netherlands)DACrantiangiogenic,(ConjuChem,Canada);Angiocidin,(InKinePharmaceutical,USA);KM-2550,(KyowaHakko,Japan);SU-0879,(Pfizer,USA);CGP-79787,(Novartis,Switzerland,EP0970070);ARGENTtechnology,(Ariad,USA);YIGSR-Stealth,(Johnson&Johnson,USA);纤维蛋白原-E片段(BioActa,UK);血管发生抑制剂(Trigen,UK);TBC1635,(EncysivePharmaceuticals,USA);SC-236,(Pfizer,USA);ABT-567,(Abbott,USA);Metastatin,(EntreMed,USA);血管发生抑制剂(Tripep,Sweden);maspin,(Sosei,Japan);2-甲氧雌二醇,(OncologySciencesCorporation,USA);ER-68203-00,(IVAX,USA);Benefin,(LaneLabs,USA);Tz-93,(Tsumura,Japan);TAN-1120,(Takeda,Japan);FR-111142,(Fujisawa,Japan,JP02233610);血小板因子4,(RepliGen,USA,EP407122);血管内皮生长因子拮抗剂(Borean,Denmark);癌症疗法(UniversityofSouthCarolina,USA);贝伐单抗(pINN),(Genentech,USA);血管发生抑制剂(SUGEN,USA);XL784,(Exelixis,USA);XL647,(Exelixis,USA);MAb,alpha5beta3整联蛋白,第二代(AppliedMolecularEvolution,USAandMedlmmune,USA);基因疗法,视网膜病(OxfordBioMedica,UK);盐酸enzastaurin(USAN),(Lilly,USA);CEP7055,(Cephalon,USAandSanofi-Synthelabo,France);BC1,(GenoaInstituteofCancerResearch,Italy);血管发生抑制剂(Alchemia,Australia);VEGF拮抗剂(Regeneron,USA);rBPI21和BPI衍生的抗血管生成剂(XOMA,USA);PI88,(Progen,Australia);西仑吉肽(cilengitide)(pINN),(MerckKGaA,German;MunichTechnicalUniversity,Germany,ScrippsClinicandResearchFoundation,USA);西妥昔单抗(INN),(Aventis,France);AVE8062,(Ajinomoto,Japan);AS1404,(CancerResearchLaboratory,NewZealand);SG292,(Telios,USA);内皮他丁(Endostatin)(BostonChildrensHospital,USA);ATN161,(Attenuon,USA);ANGIOSTATIN,(BostonChildrensHospital,USA);2-甲氧雌二醇,(BostonChildrensHospital,USA);ZD6474,(AstraZeneca,UK);ZD6126,(AngiogenePharmaceuticals,UK);PPI2458,(Praecis,USA);AZD9935,(AstraZeneca,UK);AZD2171,(AstraZeneca,UK);瓦他拉尼(pINN),(Novartis,SwitzerlandandScheringAG,Germany);组织因子途径抑制剂(EntreMed,USA);pegaptanib(Pinn),(GileadSciences,USA);黄根醇(xanthorrhizol)(YonseiUniversity,SouthKorea);疫苗,基于基因的,VEGF-2,(ScrippsClinicandResearchFoundation,USA);SPV5.2,(Supratek,Canada);SDX103,(UniversityofCaliforniaatSanDiego,USA);PX478,(ProIX,USA);METASTATIN,(EntreMed,USA);肌钙蛋白1,(HarvardUniversity,USA);SU6668,(SUGEN,USA);OXI4503,(OXiGENE,USA);o-胍(DimensionalPharmaceuticals,USA);motuporamineC,(BritishColumbiaUniversity,Canada);CDP791,(CelltechGroup,UK);阿替莫德(atiprimod)(PINN),(GlaxoSmithKline,UK);E7820,(Eisai,Japan);CYC381,(HarvardUniversity,USA);AE941,(Aeterna,Canada);疫苗,血管发生(EntreMed,USA);尿激酶血纤维蛋白溶酶活化剂抑制剂(Dendreon,USA);oglufanide(pINN),(Melmotte,USA);HIF-Ialfa抑制剂(Xenova,UK);CEP5214,(Cephalon,USA);BAYRES2622,(Bayer,Germany);Angiocidin,(InKine,USA);A6,(Angstrom,USA);KR31372,(KoreaResearchInstituteofChemicalTechnology,SouthKorea);GW2286,(GlaxoSmithKline,UK);EHT0101,(ExonHit,France);CP868596,(Pfizer,USA);CP564959,(OSI,USA);CP547632,(Pfizer,USA);786034,(GlaxoSmithKline,UK);KRN633,(KirinBrewery,Japan);药物投递系统,眼内,2-甲氧雌二醇,(EntreMed,USA);anginex,(MaastrichtUniversity,Netherlands,andMinnesotaUniversity,USA);ABT510,(Abbott,USA);ML993,(Novartis,Switzerland);VEGI,(ProteomTech,USA);肿瘤坏死因子-alpha抑制剂(NationalInstituteonAging,USA);SU11248,(Pfizer,USAandSUGENUSA);ABT518,(Abbott,USA);YHl6,(YantaiRongchang,China);S-3APG,(BostonChildrensHospital,USAandEntreMed,USA);MAb,KDR,(ImCloneSystems,USA);MAb,alpha5betal,(ProteinDesign,USA);KDR激酶抑制剂,(CelltechGroup,UK,andJohnson&Johnson,USA);GFB116,(SouthFloridaUniversity,USAandYaleUniversity,USA);CS706,(Sankyo,Japan);考布他汀(combretastatin)A4前药(ArizonaStateUniversity,USA);软骨素酶AC,(IBEX,Canada);BAYRES2690,(Bayer,Germany);AGM1470,(HarvardUniversity,USA,Takeda,Japan,andTAP,USA);AG13925,(Agouron,USA);四硫钼酸盐(UniversityofMichigan,USA);GCS100,(WayneStateUniversity,USA)CV247,(IvyMedical,UK);CKD732,(ChongKunDang,SouthKorea);MAb,血管内皮生长因子(Xenova,UK);伊索格拉定(irsogladine)(INN),(NipponShinyaku,Japan);RG13577,(Aventis,France);WX360,(Wilex,Germany);角鲨胺(squalamine)(pINN),(Genaera,USA);RPI4610,(Sima,USA);癌症疗法(Marinova,Australia);肝素酶(heparanase)抑制剂(InSight,Israel);KL3106,(Kolon,SouthKorea);Honokiol,(EmoryUniversity,USA);ZKCDK,(ScheringAG,Germany);ZKAngio,(ScheringAG,Germany);ZK229561,(Novartis,Switzerland,andScheringAG,Germany);XMP300,(XOMA,USA);VGA1102,(Taisho,Japan);VEGF受体调控剂(Pharmacopeia,USA);VE-钙粘着蛋白-2拮抗剂,(ImCloneSystems,USA);Vasostatin,(NationalInstitutesofHealth,USA);疫苗,FIk-I,(ImCloneSystems,USA);TZ93,(Tsumura,Japan);TumStatin,(BethIsraelHospital,USA);截短的可溶性FLT1(血管内皮生长因子受体1),(Merck&Co,USA);Tie-2配体,(Regeneron,USA);血小板反应蛋白1抑制剂,(AlleghenyHealth,EducationandResearchFoundation,USA);2-苯磺酰胺,,4-(5-(4-氯苯基)-3-(三氟甲基)-lH-吡唑-l-基)-;Arriva;和C-MeLAVE8062((2S)-2-氨基-3-羟基-N-[2-甲氧基-5-[(lZ)-2-(3,4,5-tri-甲氧基苯基)乙烯基]苯基]丙酰胺单盐酸盐);美替木单抗(metelimumab)(pINN)(免疫球蛋白G4,抗(人转化生长因子.beta.l(人单克隆CAT192.gamma.4-链)),与人单克隆CAT192.kappa.-链二聚体的二硫化物);Flt3配体;CD40配体;白介素-2;白介素-12;4-1BB配体;抗4-IBB抗体;TNF拮抗剂和TNF受体拮抗剂,包括TNFR/Fc,TWEAK拮抗剂和TWEAK-R拮抗剂,包括TWEAK-R/Fc;TRAIL;VEGF拮抗剂,包括抗VEGF抗体;VEGF受体(包括VEGF-Rl和VEGF-R2,又称为Fltl和Flkl或KDR)拮抗剂;CDl48(又称为DEP-I,ECRTP,和PTPRJ,参见Takahashi等,J.Am.Soc.Nephrol.10(1999)2135-1245,在此通过提及并入用于任何目的)激动剂;血小板反应蛋白1抑制剂,和Tie-2或Tie-2配体(诸如Ang-2)之一或两者的抑制剂。许多Ang-2抑制剂是本领域中已知的,包括公开的美国专利公开申请No.2003/0124129(对应于PCT申请No.WO2003/030833)和美国专利No.6,166,185(其内容在此通过提及完整并入)中描述的抗Ang-2抗体。另外,Ang-2肽抗体(peptibody)也是本领域中已知的,并且可以参见例如公开的美国专利申请No.2003/0229023(对应于PCT申请No.WO2003/057134)和公开的美国专利申请No.2003/0236193,其内容在此通过提及完整并入用于所有目的。某些化疗性治疗剂包括但不限于:沙利度胺(thalidomide)和沙利度胺类似物(N-(2,6-二氧-3-哌啶基)苯邻二甲酰亚胺);tecogalan钠(tecogalansodium)(硫酸化多糖肽聚糖);TAN1120(S-乙酰基-V-l-O-四氢-ll-三羟基-l-甲氧基-10-[[八氢-5-羟基-2-(2-羟丙基)-4,10-二甲基.rho.yrano[3,4-d]-l,3,6-dioxazocin-8-基]氧]-5,12-并四苯二酮(S-acetyl-V-l-O-tetrahydro-ll-trihydroxy-l-methoxy-10-[[octahydro-5-hydroxy-2-(2-hydroxypropyl)-4,10-dimethyl.rho.yrano[3,4-d]-l,3,6-dioxazocin-8-yl]oxy]-5,12-naphthacenedione));suradista(7,7'-[羰基二[亚氨基(l-甲基-lH-吡咯-4,2-二基)羰基亚氨基(l-甲基-lH-吡咯-4,2-二基)羰基亚氨基]]二-l,3-萘二磺酸四钠盐);SU302;SU301;SU1498((E)-2-氰基-3-[4-羟基-3,5-二(l-甲基乙基)苯基]-N-(3--苯丙基)-2-丙烯酰胺);SU1433(4-(6,7-二甲基-2-喹喔啉基)-l-,2-苯二醇);ST1514;SR25989;可溶性Tie-2;SERM衍生物,Pharmos;司马沙尼(semaxanib)(pINN)(3-[(3,5-二甲基-lH-吡咯-2-基)亚甲基]-l,3"二氢-2H-吲哚-2-酮);S836;RG8803;RESTIN;R440(3-(l-甲基-lH-吲哚-3-基)-4-(l-甲基-6-硝基-lH-吲哚-3-基)-lH-吡咯--2,5-二酮);R123942(l-[6-(l,2,4-噻二唑-5-基)-3-哒嗪基]-N-[3-(三氟甲基)苯基]-4-.rho.iperidinamine(l-[6-(l,2,4-thiadiazol-5-yl)-3-pyridazinyl]-N-[3-(t-rifluoromethyl)phenyl]-4-.rho.iperidinamine));脯氨酰羟化酶抑制剂;进展升高的基因(progressionelevatedgene);普马司他(prinomastat)(INN)((S)-2,2-二甲基-4-[[p-(4-吡啶氧)苯基]磺酰基2]-3-硫代吗啉酸肟酸(thiomorpholinecarbohydroxamicacid));NV1030;NM3(8-羟基-6-甲氧基-alpha-甲基-l-氧-lH-2-苯并吡喃-3-乙酸);NF681;NF050;MIG;METH2;METH1;manassantinB(alpha-[l-[4-[5-[4-[2-(3,4-二甲氧基苯基)-2-羟基-l-甲基乙氧基]-3-甲氧基苯基]四氢-3,4-二甲基-2-呋喃基]-2-甲氧基苯氧基]乙基]-l,-3-苯并间二氧杂环戊烯(benzodioxole)-5-甲醇);KDR单克隆抗体;alpha5beta3整联蛋白单克隆抗体;LY290293(2-氨基-4-(3-吡啶基)-4H-萘并[l,2-b]-吡喃-3-腈);KP0201448;KM2550;整联蛋白特异性肽;INGN401;GYKI66475;GYKI66462;greenstatin(101-354-纤溶酶原(人));用于类风湿性关节炎、前列腺癌、卵巢癌、神经胶质瘤、内皮抑制素、结肠直肠癌、ATFBTPI、抗血管发生基因、血管发生抑制剂或血管发生的基因疗法;明胶酶抑制剂,FR111142(4,5-二羟基-2-乙烯酸5-甲氧基-4-[2-甲基-3-(3-甲基-2--丁烯基)环氧乙烷]-l-氧杂螺[2.5]辛-6-基酯);福酚美克(forfenimex)(PINN)(S)-alpha-氨基-3-羟基-4-(羟基甲基)苯乙酸);纤连蛋白拮抗剂(fibronectinantagonist)(1-乙酰基-L-脯氨酰-L-组氨酰-L-丝氨酰-L-半胱氨酰-L-天冬酰胺);成纤维细胞生长因子受体抑制剂;成纤维细胞生长因子拮抗剂;FCE27164(7,7'-[羰基二[亚胺(l-甲基-lH-吡咯-4,2-二基)羰基亚胺(l-甲基-lH-吡咯-4,2-二基)羰基亚胺]-]二-l,3,5-萘三磺酸六钠盐);FCE26752(8,8'-[羰基二[亚胺(l-甲基-lH-吡咯-4,2-二基)羰基亚胺(l-甲基-lH-吡咯-4,2-二基)羰基亚胺]]二-l,3,6-萘三磺酸);内皮单核细胞激活多肽II;VEGFR反义寡核苷酸;抗血管生成和营养因子;ANCHOR血管生成抑制剂(angiostaticagent);内皮抑制素(endostatin);DeI-I血管生成蛋白(angiogenicprotein);CT3577;contortrostatin;CM101;软骨素酶(chondroitinase)AC;CDP845;CanStatin;BST2002;BST2001;BLS0597;BIBF1000;ARRESTIN;apomigren(1304-1388-XV型胶原(人基因COL15A1alphal-链前体));血管生成抑制剂(angioinhibin);aaATIII;A36;9alpha-氟醋酸甲羟孕酮((6-alpha)-17-(乙酰基氧)-9-氟-6-甲基-孕-4-烯-3,20-二酮);2-甲基-2-苯并吡咯酮基(phthalimidino)-戊二酸(2-(l,3-二氢-l-氧-2H-异吲哚-2-基)-2-甲基戊二酸);钇90标记的单克隆抗体BC-I;司马沙尼(Semaxanib)(3-(4,5-二甲基吡咯-2-基亚甲基)吲哚满-2-酮)(C15H14N2O);PI88(磷酸甘露戊糖硫酸酯(phosphomannopentaosesulfate));Alvocidib(4H-1-苯并吡喃-4-酮,2-(2-氯苯基)-5,7-二羟基-8-(3-羟基-l-甲基-4-哌啶基)-顺式--(-)-)(C21-H20ClN05);E7820;SU11248(5-[3-氟-2-氧-l,2-二氢二氢亚吲哚-(3Z)-基甲基]-2,4-二甲基-lH-吡咯-3-羧酸(2-二乙基氨基乙基)酰胺)(C22H27FN4O2);角鲨胺(Squalamine)(胆甾烷-7,24-二醇,3-[[3-[(4-氨基丁基)氨基丙基]氨基]-,24-(硫酸氢),(3.beta.,5.alpha.,7.alpha.)-)(C34H65N3O.sub.5S);铬黑T;AGM1470(氨基甲酸,(氯乙酰基)-,5-甲氧基-4-[2-甲基-3-(3-甲基-2-丁烯基)环氧乙烷]-l-氧杂螺[2,5]辛-6-基酯,[3R-[3alpha,4alpha(2R,3R),5beta,6beta]])(C19H28ClN06);AZD9935;BIBF1000;AZD2171;ABT828;KS-白介素-2;子宫珠蛋白(Uteroglobin);A6;NSC639366(l-[3-(二乙氨基)-2-羟基丙基氨基]-4--(环氧乙烷-2-基甲基氨基)蒽醌延胡索酸酯(fumerate))(C24H29N3O4.C4H404);ISV616;抗ED-B融合蛋白;HUI77;肌钙蛋白I;BC-I单克隆抗体;SPV5.2;ER68203;CKD731(3-(3,4,5-三甲氧基苯基)-2(E)-.rho.ropenoicacid(3R,4S,5S,6R)-4-[2(R)-甲基-3(R)-3(R)-(3-甲基-2-丁烯基)环氧乙烷-2-基]-5-甲氧基-l-氧杂螺-[2.5]辛-6-基酯)(C28H38O8);IMC-ICl1;aaATIII;SC7;CM101;Angiocol;Kringle5;CKD732(3-[4-[2-(二甲基氨基)乙氧基]苯基]-2(E)-丙烯酸)(C29H41N06);U995;Canstatin;SQ885;CT2584(l-[ll-(十二烷基氨基)-10-羟基十一烷基]-3,7-二甲基黄嘌呤)(C30H55N5O3);Salmosin;EMAPII;TX1920(l-(4-甲基哌嗪)-2-(2-硝基-lH-l-咪唑基)-l-乙酮(ethanone))(ClOHl5N503);Alpha-vBeta-x抑制剂;CHER.11509(N-(I–丙炔基)甘氨酰-[N-(2-萘基)]甘氨酰-[N-(氨甲酰基甲基)]甘氨酸二(4-甲氧基苯基)甲基-酰胺)(C36H37N5O6);BST2002;BST2001;B0829;FR111142;4,5-二羟基-2(E)-己烯酸(3R,4S,5S,6R)-4-[l(R),2(R)-环氧-l,5-二甲基-4-己烯基]-5-甲氧基-l-氧杂螺[2.5]辛-6-基酯(C22H34O7);和激酶抑制剂,包括但不限于N-(4-氯苯基)-4-(4-吡啶基甲基)-l-酞嗪胺(phthalazinamine);4-[4-[[[[4-氯-3-(三氟甲基)苯基]氨基]羰基]氨基]苯氧基]-N-甲基-2-嘧啶羧酰胺;N-[2-(二乙基氨基)乙基]-5-[(5-氟-l,-2-二氢-2-氧-3H-二氢亚吲哚-3-基)甲基]-2,4-二甲基-lH-吡咯-3-羧酰胺;3-[(4-溴-2,6-二氟苯基)甲氧基]-5-[[[[4-(1-吡咯烷基)丁基]氨基]羰基]氨基]-4-异噻唑羧酰胺;N-(4-溴-2-氟苯基)-6-甲氧基-7-[(1-甲基-4-哌啶基)甲氧基]-4-喹唑啉胺;3-[5,6,7,13-四氢-9-[(1-甲基乙氧基)甲基]-5-氧--12H-茚并[2,1-a]吡咯并[3,4-c]咔唑-l2-基]丙基酯N,N-二甲基-甘氨酸;N-[5-[[[5-(l,l-二甲基乙基)-2-噁唑基]甲基]硫代]-2-噻唑基]-4-哌啶羧酰胺;N-[3-氯-4-[(3-氟苯基)甲氧基]苯基]-6-[5-[[[2-(甲基磺酰基)乙基]氨基]甲基]-2-呋喃基(furanyl)]4-喹唑啉胺;4-[(4-甲基-l-哌嗪基)甲基]-N-[4-甲基-3-[[4-(3-吡啶基)-2-嘧啶基]氨基]-苯基]苯甲酰胺;N-(3-氯-4-氟苯基)-7-甲氧基-6-[3-(4-吗啉基)丙氧基]-4-喹唑啉胺;N-(3-乙炔基苯基)-6,7-bis(2-甲氧基乙氧基)-4-喹唑啉胺;N-(3-((((2R)-l-甲基-2-吡咯烷基)甲基)-氧)-5-(三氟甲基)苯基)-2-((3-(1,3-恶唑-5-基)苯基)氨基)-3-嘧啶羧酰胺;2-(((4-氟苯基)甲基)氨基)-N-(3-((((2R)-l-甲基-2-吡咯烷基)甲基)氧)-5-(三氟甲基)苯基)-3-嘧啶羧酰胺;N-[3-(吖丁啶-3-基甲氧基)-5-三氟甲基-苯基]-2-(4-氟-苯甲基氨基)-烟碱;6-氟-N-(4-(1-甲基乙基)苯基)-2-((4-吡啶基甲基)氨基)-3-嘧啶羧酰胺;2-((4-吡啶基甲基)氨基)-N-(3-(((2S-)-2-吡咯烷基甲基)氧)-5-(三氟甲基)苯基)-3嘧啶羧酰胺;N-(3-(l,1-二甲基乙基)-lH-吡唑-5-基)-2-((4-吡啶基甲基)氨基)--3-嘧啶羧酰胺;N-(3,3-二甲基-2,3-二氢-1-苯并呋喃-6-基)-2-(-(4-吡啶基甲基)氨基)-3-嘧啶羧酰胺;N-(3-((((2S)-l-甲基-2-吡咯烷基)甲基)氧)-5-(三氟甲基)苯基)-2-((4-吡啶基甲基)氨基)-3-嘧啶羧酰胺;2-((4-吡啶基甲基)氨基)-N-(3-((2-(1-吡咯烷基)乙基)氧)-4-(三氟甲基)苯基)-3-嘧啶羧酰胺;N-(3,3-二甲基-2,3-二氢-lH-吲哚-6-基)-2-((4-吡啶基甲基)氨基)-3-嘧啶羧酰胺;N-(4-(五氟乙基)-3-(((2S)-2-吡咯烷基甲基)氧)苯基)-2-((4-吡啶基甲基)氨基)-3-嘧啶羧酰胺;N-(3-((3-吖丁啶基甲基)氧)-5-(三氟甲基)苯基)-2-((4-吡啶基-甲基)氨基)-3-嘧啶羧酰胺;N-(3-(4-哌啶基氧)-5-(三氟甲基)苯基)-2-((2-(3-吡啶基)乙基)氨基)-3-嘧啶羧酰胺;N-(4,4-二甲基-l,2,3,4-四氢异喹啉-7-基)-2-(lH-吲唑-6-基氨基)-烟碱;2-(1H-吲唑-6-基氨基)-N-[3-(1-甲基吡咯烷-2-基甲氧基)-5-三氟甲基-苯基]-烟碱;N-[l-(2-二甲基氨基-乙酰基)-3,3-二甲基-2,3-二氢-lH-吲哚-6-基]-2-(lH-吲唑-6-基氨基)-烟碱;2-(1H-吲唑-6-基氨基)-N-[3-(吡咯烷-2-基甲氧基)-5-三氟-甲基-苯基]-烟碱;N-(I-乙酰基-S-二甲基S-二氢-lH-吲哚--6-基)-2-(lH-吲唑-6-基氨基)-烟碱;N-(4,4-二甲基-l–氧-1,2,3,-4-四氢-异喹啉-7-基)-2-(1H-吲唑-6-基氨基)-烟碱;N-[4-(叔丁基)-3-(3-哌啶基丙基)苯基][2-(1H-吲唑-6-基氨基)(3-吡啶基)]羧酰胺;N-[5-(叔丁基)异恶唑-3-基][2-(lH-吲唑-6-基氨基)(3-吡啶基)]羧酰胺;andN-[4-(叔丁基)苯基][2-(1H-吲唑-6--基氨基)(3-吡啶基)]羧酰胺,和激酶抑制剂,其公开于美国专利No.6,258,812;6,235,764;6,630,500;6,515,004;6,713,485;5,521,184;5,770,599;5,747,498;5,990,141;美国公开文本No.U.S.2003/0105091;及专利合作条约公开文本no.WO01/37820;WO01/32651;WO02/68406;WO02/66470;WO02/55501;WO04/05279;WO04/07481;WO04/07458;WO04/09784;WO02/59110;WO99/45009;WO98/35958;WO00/59509;WO99/61422;WO00/12089;和WO00/02871,每篇公开文本在此通过提及并入用于所有目的。在一个实施方案中,可以与抗CSF-1R抗体一起施用的癌症免疫疗法包括但不限于生长因子抑制剂。此类药剂的例子包括但不限于可以抑制EGF-R(表皮生长因子受体)响应的药剂,诸如EGF-R抗体,EGF抗体,和作为EGF-R抑制剂的分子;VEGF(血管内皮生长因子)抑制剂,诸如可以抑制VEGF的VEGF受体和分子;和erbB2受体抑制剂,诸如结合erbB2受体的有机分子或抗体,例如HERCEPTIN(曲妥珠单抗)(Genentech,Inc.)。EGF-R抑制剂记载于例如美国专利No.5,747,498,WO98/14451,WO95/19970,及WO98/02434。在本发明的一个实施方案中,在抗CSF-1R抗体外,可以实施放射和/或可以使用放射性药物。放射源可以是治疗的患者外部的或内部的。在来源在患者外部时,已知疗法为外部束放射疗法(EBRT)。在放射源在患者内部时,治疗称作近程疗法(BT)。本发明的上下文中使用的放射性原子可以选自下组,包括但不限于镭、铯-137、铱-192、镅-241、金-198、钴-57、铜-67、锝-99、碘-123、碘-131、和碘-111。也有可能用此类放射性同位素标记抗体。放射疗法是一种用于控制不可切除的或不能手术的肿瘤和/或肿瘤转移的标准治疗。已经在组合放射疗法与化学疗法时看到改善的结果。放射疗法基于如下的原则,即对靶区域投递的高剂量放射会导致肿瘤和正常组织两者中的繁殖性细胞(reproductivecell)死亡。放射剂量方案一般在放射吸收剂量(Gy)、时间和分级方面限定,并且必须由肿瘤学家仔细限定。患者接受的放射量会取决于各种考虑因素,但是两项最重要的是肿瘤相对于身体的其它重要结构或器官的位置和肿瘤已经扩散的程度。患者经历放射疗法的典型治疗过程会是在1至6周时段里的治疗日程表,以单一每日分数约1.8至2.0Gy一周5天对患者施用10-80Gy的总剂量。在本发明的一个优选的实施方案中,在用本发明的联合治疗和放射治疗人患者中的肿瘤时存在着协同。换言之,在与放射,任选地有另外的化学治疗剂或抗癌剂组合时,依靠构成本发明的组合的药剂对肿瘤生长的抑制得到增强。例如,辅助放射疗法的参数包含在WO99/60023中。在本发明的一个实施方案中,抗CSF-1R抗体的特征在于:抗体以1:50或更低的比率结合人CSF-1R片段delD4(SEQIDNO:65)和人CSF-1R胞外域(SEQIDNO:64)。在本发明的一个实施方案中,抗体的特征在于抗体不结合人CSF-1R片段delD4(SEQIDNO:65)。在本发明的一个实施方案中,抗体的特征在于:a)重链可变域是SEQIDNO:7,且轻链可变域是SEQIDNO:8,b)重链可变域是SEQIDNO:15,且轻链可变域是SEQIDNO:16;c)重链可变域是SEQIDNO:75,且轻链可变域是SEQIDNO:76;d)重链可变域是SEQIDNO:83,且轻链可变域是SEQIDNO:84;或其人源化形式。在本发明的一个实施方案中,抗体的特征在于:a)重链可变域是SEQIDNO:7,且轻链可变域是SEQIDNO:8,b)重链可变域是SEQIDNO:15,且轻链可变域是SEQIDNO:16;或其人源化形式。在本发明的一个实施方案中,抗体的特征在于:a)重链可变域是SEQIDNO:23,且轻链可变域是SEQIDNO:24,或b)重链可变域是SEQIDNO:31,且轻链可变域是SEQIDNO:32,或c)重链可变域是SEQIDNO:39,且轻链可变域是SEQIDNO:40,或d)重链可变域是SEQIDNO:47,且轻链可变域是SEQIDNO:48,或e)重链可变域是SEQIDNO:55,且轻链可变域是SEQIDNO:56。在本发明的一个实施方案中,抗体的特征在于:a)重链可变域包含SEQIDNO:1的CDR3区,SEQIDNO:2的CDR2区,和SEQIDNO:3的CDR1区,且轻链可变域包含SEQIDNO:4的CDR3区,SEQIDNO:5的CDR2区,和SEQIDNO:6的CDR1区,或b)重链可变域包含SEQIDNO:9的CDR3区,SEQIDNO:10的CDR2区,和SEQIDNO:11的CDR1区,且轻链可变域包含SEQIDNO:12的CDR3区,SEQIDNO:13的CDR2区,和SEQIDNO:14的CDR1区,或c)重链可变域包含SEQIDNO:17的CDR3区,SEQIDNO:18的CDR2区,和SEQIDNO:19的CDR1区,且轻链可变域包含SEQIDNO:20的CDR3区,SEQIDNO:21的CDR2区,和SEQIDNO:22的CDR1区,或d)重链可变域包含SEQIDNO:25的CDR3区,SEQIDNO:26的CDR2区,和SEQIDNO:27的CDR1区,且轻链可变域包含SEQIDNO:28的CDR3区,SEQIDNO:29的CDR2区,和SEQIDNO:30的CDR1区,或e)重链可变域包含SEQIDNO:33的CDR3区,SEQIDNO:34的CDR2区,和SEQIDNO:35的CDR1区,且轻链可变域包含SEQIDNO:36的CDR3区,SEQIDNO:37的CDR2区,和SEQIDNO:38的CDR1区,或f)重链可变域包含SEQIDNO:41的CDR3区,SEQIDNO:42的CDR2区,和SEQIDNO:43的CDR1区,且轻链可变域包含SEQIDNO:44的CDR3区,SEQIDNO:45的CDR2区,和SEQIDNO:46的CDR1区,或g)重链可变域包含SEQIDNO:49的CDR3区,SEQIDNO:50的CDR2区,和SEQIDNO:51的CDR1区,且轻链可变域包含SEQIDNO:52的CDR3区,SEQIDNO:53的CDR2区,和SEQIDNO:54的CDR1区;或h)重链可变域包含SEQIDNO:69的CDR3区,SEQIDNO:70的CDR2区,和SEQIDNO:71的CDR1区,且轻链可变域包含SEQIDNO:72的CDR3区,SEQIDNO:73的CDR2区,和SEQIDNO:74的CDR1区,或i)重链可变域包含SEQIDNO:77的CDR3区,SEQIDNO:78的CDR2区,和SEQIDNO:79的CDR1区,且轻链可变域包含SEQIDNO:80的CDR3区,SEQIDNO:81的CDR2区,和SEQIDNO:82的CDR1区。在本发明的一个实施方案中,抗体是人IgG1亚类或人IgG4亚类的。本发明的又一个实施方案是包含依照本发明的抗体的药物组合物。本发明进一步包括依照本发明的抗体用于制造药物的用途,所述药物用于治疗CSF-1R介导的疾病。本发明进一步包括依照本发明的抗体用于制造药物的用途,所述药物用于治疗癌症。本发明进一步包括依照本发明的抗体用于制造药物的用途,所述药物用于治疗骨损失。本发明进一步包括依照本发明的抗体用于制造药物的用途,所述药物用于治疗转移。本发明进一步包括依照本发明的抗体用于制造药物的用途,所述药物用于治疗炎性疾病。本发明进一步包括依照本发明的抗体,其用于治疗CSF-1R介导的疾病。本发明进一步包括依照本发明的抗体,其用于治疗癌症。本发明进一步包括依照本发明的抗体,其用于治疗骨损失。本发明进一步包括依照本发明的抗体,其用于治疗转移。本发明进一步包括依照本发明的抗体,其用于治疗炎性疾病。本文中描述的抗体的联合疗法对需要CSF-1R靶向疗法的患者显示益处。依照本发明的抗体显示针对不依赖于配体的和配体依赖性的增殖的有效抗增殖活性,并且因此尤其可用于与化疗剂,放射和/或癌症免疫疗法联合治疗癌症和转移。本发明进一步提供了治疗患有癌症的患者的方法,其包括与化疗剂,放射和/或癌症免疫疗法组合对诊断为具有此类疾病(并且因此需要此类疗法)的患者施用有效量的依照本发明的抗体。优选地,抗体在药物组合物中施用。令人惊讶地,已经发现了使用其中缺失人CSF-1R-ECD的D4亚域的人CSF-1R片段delD4(SEQIDNO:65),可以选择抗CSF-1R抗体。这些抗体显示有价值的特性,如卓越的配体依赖性细胞生长抑制和同时不依赖于配体的对NIH3T3细胞的细胞生长抑制,所述NIH3T3细胞用全长野生型CSF-1R(SEQIDNO:62)或突变体CSF-1RL301SY969F(SEQIDNO:63)的表达载体以逆转录病毒感染,由此突变体CSF1R重组细胞能够形成不依赖于CSF-1配体的球状体。此外,这些抗体抑制人和猕猴巨噬细胞分化两者,因为它们抑制人和猕猴单核细胞的存活。可以通过筛选结合人CSF-1R(SEQIDNO:64)的完整胞外域(包括域D1至D5),并且不结合人CSF-1R胞外域的域D1至D3(SEQIDNO:66)的抗体,来选择结合(二聚化)域D4至D5的其它抗体。附图简述图1:在用10μg/ml浓度的不同抗CSF-1R单克隆抗体处理下3D培养中的BeWo肿瘤细胞的生长抑制。X轴:存活力标准化均值相对光单位(RLU),其对应于细胞的ATP含量(CellTiterGlo试验)。Y轴:受试探针:基本培养基(0.5%FBS),小鼠IgG1(mIgG1,10μg/ml),小鼠IgG2a(mIgG2a10μg/ml),仅CSF-1,Mab2F11,Mab2E10,Mab2H7,Mab1G10和SC2-4A5。用依照本发明的抗CSF-1R抗体观察到对CSF-1诱导的生长的最高抑制。图2a:不同抗CSF-1R抗体对固定化的人CSF-1R片段delD4(包含胞外亚域D1–D3和D5)(SEQIDNO:65)的结合的Biacore传感图(y轴:以响应单位(RU)计的结合信号,基线=0RU,x轴:以秒(s)计的时间):虽然抗体Mab3291和sc2-4A5清楚显示对此delD4片段的结合,但是依照本发明的抗体,例如Mab2F11和Mab2E10不结合CSF-1R片段delD4。对照抗-CCR5抗体m<CCR5>Pz03.1C5也不结合CSF-1R片段delD4。图2b:不同抗CSF-1R抗体对固定化的人CSF-1R胞外域(CSF-1R-ECD)(包含胞外亚域D1–D5)(SEQIDNO:64)的结合的Biacore传感图(y轴:以响应单位(RU)计的结合信号,基线=0RU,x轴:以秒(s)计的时间):所有抗CSF-1R抗体显示对CSF-1R-ECD的结合。对照抗CCR5抗体m<CCR5>Pz03.1C5不结合CSF-1R-ECD。图2c:不同抗CSF-1R抗体对固定化的人CSF-1R片段delD4(包含胞外亚域D1–D3和D5)(SEQIDNO:65)的结合的Biacore传感图(y轴:以响应单位(RU)计的结合信号,基线=0RU,x轴:以秒(s)计的时间):Mab1G10,Mab2H7和人源化的hMab2F11-e7不结合CSF-1R片段delD4。对照抗CCR5抗体m<CCR5>Pz03.1C5也不结合CSF-1R片段delD4。图2d:不同抗CSF-1R抗体对固定化的人CSF-1R胞外域(CSF-1R-ECD)(包含胞外亚域D1–D5)(SEQIDNO:64)的结合的Biacore传感图(y轴:以响应单位(RU)计的结合信号,基线=0RU,x轴:以秒(s)计的时间):抗CSF-1R抗体Mab1G10,Mab2H7和人源化hMab2F11-e7都显示对CSF-1R-ECD的结合。对照抗CCR5抗体m<CCR5>Pz03.1C5不结合CSF-1R-ECD。图2e:不同抗CSF-1R抗体对固定化的人CSF-1R片段delD4(包含胞外亚域D1–D3和D5)(SEQIDNO:65)的结合的Biacore传感图(y轴:以响应单位(RU)计的结合信号,基线=0RU,x轴:以秒(s)计的时间):抗CSF-1R抗体1.2.SM,CXIIG6,ab10676和MAB3291都显示对CSF-1R片段delD4的结合。对照抗CCR5抗体m<CCR5>Pz03.1C5还是不结合CSF-1R片段delD4。图2f:不同抗CSF-1R抗体对固定化的人CSF-1R胞外域(CSF-1R-ECD)(包含胞外亚域D1–D5)(SEQIDNO:64)的结合的Biacore传感图(y轴:以响应单位(RU)计的结合信号,基线=0RU,x轴:以秒(s)计的时间):抗CSF-1R抗体1.2.SM,CXIIG6,ab10676和MAB3291都显示对CSF-1R片段delD4的结合。对照抗CCR5抗体m<CCR5>Pz03.1C5不结合CSF-1R片段delD4。图3a-d:在应用不同剂量的依照本发明的抗CSF-1R抗体后猕猴中的CSF-1水平。图4:体内效力–在乳腺癌BT20异种移植物中依照本发明的抗CSF-1R抗体的肿瘤生长抑制。图5a-b:5a:人单核细胞在GM-CSF或CSF-1(100ng/ml配体)共培养的情况中分化成巨噬细胞。在6天的分化后,添加RO7155。在CTG活力测定法(Promega)中在抗体处理的第7天时测量细胞活力。%细胞活力的计算:用经处理的细胞的RLU信号除以没有抗体的未处理对照的RLU信号(n=4)。5b:人单核细胞在具有GM-CSF(M1)或M-CSF(M2)持续7天的情况中分化成巨噬细胞。通过间接荧光分析来分析的表型-用抗CD163-PE,抗CD80-PE或抗HLA-DR/DQ/DP-Zenon-Alexa647标记染色。每个直方图中的数目对应于均值比率荧光强度(MRFI);用选择的抗体染色的细胞(空的直方图)和相应的同种型对照(阴性对照;灰色填充的直方图)的均值荧光强度(MFI)间的计算比率(均值±SD;n≥5)图6a–c:<小鼠CSF1R>抗体组合在MC38小鼠CRC体内模型中的体内效力。图7:<CSF1R>抗体和<CD40>抗体组合的体内效力:CSF1RmAb+CD40mAbFGK45的组合在同基因MC38小鼠结肠癌模型中相对于单一疗法显示改善的抗肿瘤效力。发明详述许多肿瘤的特征在于显著的免疫细胞浸润物,包括巨噬细胞。最初,认为免疫细胞是针对肿瘤的防御机制的一部分,但是最近的数据支持如下的概念,即包括巨噬细胞在内的几种免疫细胞群体实际上可以促进肿瘤进展。巨噬细胞以其可塑性为特征。根据细胞因子微环境,巨噬细胞可以展现出所谓的M1或M2亚型。M2巨噬细胞参与对肿瘤免疫力的抑制。它们还在被肿瘤占用以支持生长的组织修复功能,诸如血管发生和组织重塑中发挥重要功能。与肿瘤促进性M2巨噬细胞形成对比,M1巨噬细胞展现出抗肿瘤活性,经由分泌炎性细胞因子及其参与抗原呈递和吞噬作用实现(Mantovani,A.等,Curr.Opin.Immunol.2(2010)231-237)。通过分泌各种细胞因子诸如集落刺激因子1(CSF-1)和IL10,肿瘤细胞能够将巨噬细胞募集并塑造成M2-亚型,而细胞因子诸如粒细胞巨噬细胞集落刺激因子(GMCSF),IFN-gamma将巨噬细胞向M1亚型设计。使用免疫组织化学,有可能区别共表达CD68和CD163的巨噬细胞亚群(其可能是M2巨噬细胞富集的)与显示CD68+/MHCII+,或CD68+/CD80+免疫表型的子集(可能包括M1巨噬细胞)。CD68和CD163阳性巨噬细胞的细胞形状、大小、和空间分布与关于M2巨噬细胞的肿瘤促进作用(例如通过其在肿瘤相交基质中的优先位置,和重要的肿瘤区域进行)的发表假说一致。比较而言,遍在发现CD68+/MHCII+类巨噬细胞。其在吞噬作用中的假设作用得到在凋亡细胞和坏死肿瘤区附近的CD68+/MHCII+类,但CD163-免疫表型的簇反映。不同巨噬细胞亚群的亚型和标志物表达与其功能状态联系起来。M2巨噬细胞可以如下支持肿瘤发生:a)通过分泌血管生成因子,诸如VEGF或bFGF增强血管发生,b)通过分泌基质金属蛋白酶(MMP)、生长因子和引导肿瘤细胞至血流并设立转移小生境的迁移因子支持转移形成(Wyckoff,J.等,CancerRes.67(2007)2649-2656),c)通过分泌免疫抑制性细胞因子,诸如IL-4,Il-13,IL-1ra和IL-10,其继而调节T调节细胞功能在建立免疫抑制环境中发挥作用。相反,已经显示了CD4阳性T细胞增强临床前模型中肿瘤促进巨噬细胞的活性(Mantovani,A.等,Eur.J.Cancer40(2004)1660-1667;DeNardo,D.等,CancerCell16(2009)91-102)。因而,在几类癌症(例如乳腺,卵巢,霍奇金(Hodgkin)氏淋巴瘤)中,M2亚型肿瘤关联巨噬细胞(TAM)的遍布已经与不良预后联系起来(Bingle,L.等,J.Pathol.3(2002)254-265;Orre,M.及Rogers,P.A.,Gynecol.Oncol.1(1999)47-50;Steidl,C.等,N.Engl.J.Med.10(2010)875-885)。最近的数据显示了肿瘤中的CD163阳性巨噬细胞浸润物和肿瘤等级的联系(Kawamura,K.等,Pathol.Int.59(2009)300-305)。从患者肿瘤中分离的TAM具有耐受性表型,并且对肿瘤细胞是没有细胞毒性的(Mantovani,A.等,Eur.J.Cancer40(2004)1660-1667)。然而,在存在细胞毒性T细胞的情况中TAM的浸润与非小细胞肺癌中的改善存活相关联,因此反映此肿瘤类型中更显著的M1巨噬细胞浸润物(Kawai,O.等,Cancer6(2008)1387-1395)。最近,已经显示了所谓的免疫标签(immunesignature)与乳腺癌患者中降低的总体存活(OS)相关联,并且代表独立的预后因子,所述免疫标签包含大量的巨噬细胞和CD4阳性T细胞,但少量的细胞毒性CD8阳性T细胞(DeNardo,D.等,CancerDiscovery1(2011)54-67)。与CSF-1在驱动M2巨噬细胞的促肿瘤发生功能中的作用一致,部分由于CSF-1基因易位所致的罕见肉瘤或局部攻击性结缔组织肿瘤,诸如色素沉着绒毛结节性滑膜炎(pigmentedvillonodularsynovitis,PVNS)和腱鞘巨细胞瘤(tenosynovialgiantcelltumor,TGCT)中的高CSF-1表达导致形成大部分肿瘤快的表达CSF-1受体集落刺激因子1受体(CSF-1R)的单核细胞和巨噬细胞的积累(West,R.B.等,Proc.Natl.Acad.Sci.USA3(2006)690-695)。随后,这些肿瘤用于通过基因表达序型分析限定CSF-1依赖性巨噬细胞标签。在乳腺癌和平滑肌肉瘤患者肿瘤中,此CSF-1响应基因标签预测不良预后(Espinosa,I.等,Am.J.Pathol.6(2009)2347-2356;Beck,A.等,Clin.CancerRes.3(2009)778-787)。CSF-1R属于III类受体酪氨酸激酶亚族,并且由c-fms原癌基因编码。CSF-1或IL-34的结合诱导受体二聚化,接着是自身磷酸化和下游信号传导级联的活化。CSF-1R的活化调节单核细胞和巨噬细胞的存活,增殖和分化(Xiong,Y.等,J.Biol.Chem.286(2011)952-960)。在单核谱系的细胞和破骨细胞(其与巨噬细胞衍生自相同的造血前体)外,还已经发现了CSF-1R/c-fms是由几种人上皮癌诸如卵巢和乳腺癌及在平滑肌肉瘤和TGCT/PVNS中表达的,尽管与巨噬细胞相比表达水平更低。与TGCT/PVNS一样,卵巢癌患者的血清及腹水中CSF-1(CSF-1R配体)的水平升高已经与不良预后联系起来(Scholl,S.等,Br.J.Cancer62(1994)342-346;Price,F.等,Am.J.Obstet.Gynecol.168(1993)520-527)。此外,CSF1R的组成型活性突变体形式能够转化NIH3T3细胞(癌基因的特性之一)(Chambers,S.,FutureOncol5(2009)1429-1440)。临床前模型提供了CSF-1R作为肿瘤学靶物的确认。CSF-1及CSF-1R活性的阻断导致降低的TAM募集。化学疗法导致肿瘤细胞中升高的CSF-1表达,从而导致增强的TAM募集。与帕利他赛组合的CSF-1R阻断导致CD8阳性细胞毒性T细胞的活化,从而导致自发性转基因乳腺癌模型中降低的肿瘤生长和转移负荷(DeNardo,D.等,CancerDiscovery1(2011)54-67)。本发明中描述的抗CSF-1R抗体结合构成受体二聚化界面的膜近端胞外域D4和D5。它们阻断CSF-1,IL-34介导的及不依赖于配体的受体活化,导致诱导在存在CSF-1的情况中体外分化的M2样巨噬细胞的凋亡,同时不损害M1样GM-CSF分化巨噬细胞。在人乳腺癌组织中,M2(CD68+/CD163+)巨噬细胞和CSF1R表达巨噬细胞是共定位的。在猕猴中,用hMab2F11-e7处理13周减少肝和结肠中的CD163阳性巨噬细胞,而不是肺的巨噬细胞。尽管有几种新药剂的引入,许多晚期实体瘤的临床管理仍然是挑战性的。为了改善结果,对分子癌症生物学的了解的进展已经刺激对更为靶向性的疗法的研究。CSF-1R是一种由CSF-1R基因编码的蛋白质。它控制M2巨噬细胞的生成、分化、和功能,这继而支持肿瘤生长和转移形成并分泌免疫抑制性细胞因子,从而导致患者的不良预后。此外,已经显示了几种人癌症(诸如卵巢和乳腺癌)中CSF-1R阳性巨噬细胞的存在不仅与升高的血管密度相关联,而且还恶化临床结果。CSF-1R抑制剂(其选择性抑制M2样TAM)已经在临床前模型中证明活性(DeNardo,D.等,CancerDiscovery1(2011)54-67;Lin,E.等,J.Exp.Med.193(2001)727-740)。CSF-1R活性的阻断导致降低的TAM募集,并且与化学疗法组合,协同作用导致降低的肿瘤生长和转移负荷。最近的数据已经显示了在PVNS和TGCT患者中,CSF-1的过表达是检出的,并且部分由CSF-1R基因的易位介导(West,R.B.等,Proc.Natl.Acad.Sci.USA3(2006)690-695)。在乳腺癌中,CSF-1响应基因标签的存在预测复发和转移的风险(Beck,A.等,Clin.CancerRes.3(2009)778-787)。基于本发明中描述的抗体的抗肿瘤单一药剂效力,似乎合理的是测试如下的假设:与紫杉烷类(如例如帕利他赛(泰素),多西他赛(Taxotere),经修饰的帕利他赛(例如Abraxane和Opaxio),多柔比星,舒尼替尼(Sutent),索拉非尼(Nexavar),和其它多激酶抑制剂,奥沙利铂,奥沙利铂,顺铂和卡铂,依托泊苷,吉西他滨,和长春碱组合的肿瘤关联巨噬细胞及其促肿瘤生物活性的阻断。在一个实施方案中,化疗剂选自下组:紫杉烷类(如例如泰素(帕利他赛),多西他赛(Taxotere),经修饰的帕利他赛(例如Abraxane和Opaxio)。本发明包括与结合人CSF-1R的抗体的联合疗法,所述抗体的特征在于抗体结合人CSF-1R胞外域(SEQIDNO:64)(包含域D1至D5),并且不结合人CSF-1R胞外域的域D1至D3(SEQIDNO:66)。本发明进一步包括与结合人CSF-1R的抗体的联合疗法,所述抗体的特征在于抗体以1:50或更低的比率结合人CSF-1R片段delD4(包含胞外亚域D1–D3和D5)(SEQIDNO:65)和人CSF-1R胞外域(CSF-1R-ECD)(包含胞外亚域D1–D5)(SEQIDNO:64)。本发明进一步包括与结合人CSF-1R的抗体的联合疗法,所述抗体的特征在于包含SEQIDNO:1,SEQIDNO:9,SEQIDNO:23,SEQIDNO:31,SEQIDNO:39,SEQIDNO:47或SEQIDNO:55的CDR3区作为重链可变域CDR3区。本发明进一步包括与结合人CSF-1R的抗体的联合疗法,所述抗体的特征在于a)重链可变域是SEQIDNO:7,且轻链可变域是SEQIDNO:8,b)重链可变域是SEQIDNO:15,且轻链可变域是SEQIDNO:16;或其人源化形式。本发明进一步包括与结合人CSF-1R的抗体的联合疗法,所述抗体的特征在于a)重链可变域是SEQIDNO:7,且轻链可变域是SEQIDNO:8,b)重链可变域是SEQIDNO:15,且轻链可变域是SEQIDNO:16;c)重链可变域是SEQIDNO:75,且轻链可变域是SEQIDNO:76;d)重链可变域是SEQIDNO:83,且轻链可变域是SEQIDNO:84;或其人源化形式。本发明进一步包括与结合人CSF-1R的抗体的联合疗法,所述抗体的特征在于重链可变域是SEQIDNO:7,且轻链可变域是SEQIDNO:8,或其人源化形式。在一个实施方案中,与结合人CSF-1R的抗体的联合疗法的特征在于:a)重链可变域是SEQIDNO:23,且轻链可变域是SEQIDNO:24,或b)重链可变域是SEQIDNO:31,且轻链可变域是SEQIDNO:32,或c)重链可变域是SEQIDNO:39,且轻链可变域是SEQIDNO:40,或d)重链可变域是SEQIDNO:47,且轻链可变域是SEQIDNO:48,或e)重链可变域是SEQIDNO:55,且轻链可变域是SEQIDNO:56。在一个实施方案中,与结合人CSF-1R的抗体的联合疗法的特征在于:a)重链可变域是SEQIDNO:23,且轻链可变域是SEQIDNO:24,或b)重链可变域是SEQIDNO:31,且轻链可变域是SEQIDNO:32,或c)重链可变域是SEQIDNO:39,且轻链可变域是SEQIDNO:40,或d)重链可变域是SEQIDNO:47,且轻链可变域是SEQIDNO:48。在一个实施方案中,依照本发明的抗体的特征在于:重链可变域是SEQIDNO:23,且轻链可变域是SEQIDNO:24。在一个实施方案中,与结合人CSF-1R的抗体的联合疗法的特征在于:重链可变域是SEQIDNO:31,且轻链可变域是SEQIDNO:32。在一个实施方案中,与结合人CSF-1R的抗体的联合疗法的特征在于:重链可变域是SEQIDNO:39,且轻链可变域是SEQIDNO:40。在一个实施方案中,与结合人CSF-1R的抗体的联合疗法的特征在于:重链可变域是SEQIDNO:47,且轻链可变域是SEQIDNO:48。本发明进一步包括与结合人CSF-1R的抗体的联合疗法,其特征在于:重链可变域是SEQIDNO:15,且轻链可变域是SEQIDNO:16,或其人源化形式。本发明进一步包括与结合人CSF-1R的抗体的联合疗法,其特征在于:重链可变域是SEQIDNO:75,且轻链可变域是SEQIDNO:76;或其人源化形式。本发明进一步包括与结合人CSF-1R的抗体的联合疗法,其特征在于:重链可变域是SEQIDNO:83,且轻链可变域是SEQIDNO:84;或其人源化形式。本发明进一步包括与结合人CSF-1R的抗体的联合疗法,其特征在于:a)重链可变域包含SEQIDNO:1的CDR3区,SEQIDNO:2的CDR2区,和SEQIDNO:3的CDR1区,且轻链可变域包含SEQIDNO:4的CDR3区,SEQIDNO:5的CDR2区,和SEQIDNO:6的CDR1区,或b)重链可变域包含SEQIDNO:9的CDR3区,SEQIDNO:10的CDR2区,和SEQIDNO:11的CDR1区,且轻链可变域包含SEQIDNO:12的CDR3区,SEQIDNO:13的CDR2区,和SEQIDNO:14的CDR1区,或c)重链可变域包含SEQIDNO:17的CDR3区,SEQIDNO:18的CDR2区,和SEQIDNO:19的CDR1区,且轻链可变域包含SEQIDNO:20的CDR3区,SEQIDNO:21的CDR2区,和SEQIDNO:22的CDR1区,或d)重链可变域包含SEQIDNO:25的CDR3区,SEQIDNO:26的CDR2区,和SEQIDNO:27的CDR1区,且轻链可变域包含SEQIDNO:28的CDR3区,SEQIDNO:29的CDR2区,和SEQIDNO:30的CDR1区,或e)重链可变域包含SEQIDNO:33的CDR3区,SEQIDNO:34的CDR2区,和SEQIDNO:35的CDR1区,且轻链可变域包含SEQIDNO:36的CDR3区,SEQIDNO:37的CDR2区,和SEQIDNO:38的CDR1区,或f)重链可变域包含SEQIDNO:41的CDR3区,SEQIDNO:42的CDR2区,和SEQIDNO:43的CDR1区,且轻链可变域包含SEQIDNO:44的CDR3区,SEQIDNO:45的CDR2区,和SEQIDNO:46的CDR1区,或g)重链可变域包含SEQIDNO:49的CDR3区,SEQIDNO:50的CDR2区,和SEQIDNO:51的CDR1区,且轻链可变域包含SEQIDNO:52的CDR3区,SEQIDNO:53的CDR2区,和SEQIDNO:54的CDR1区。本发明进一步包括与结合人CSF-1R的抗体的联合疗法,其特征在于:a)重链可变域包含SEQIDNO:1的CDR3区,SEQIDNO:2的CDR2区,和SEQIDNO:3的CDR1区,且轻链可变域包含SEQIDNO:4的CDR3区,SEQIDNO:5的CDR2区,和SEQIDNO:6的CDR1区,或b)重链可变域包含SEQIDNO:9的CDR3区,SEQIDNO:10的CDR2区,和SEQIDNO:11的CDR1区,且轻链可变域包含SEQIDNO:12的CDR3区,SEQIDNO:13的CDR2区,和SEQIDNO:14的CDR1区,或c)重链可变域包含SEQIDNO:17的CDR3区,SEQIDNO:18的CDR2区,和SEQIDNO:19的CDR1区,且轻链可变域包含SEQIDNO:20的CDR3区,SEQIDNO:21的CDR2区,和SEQIDNO:22的CDR1区,或d)重链可变域包含SEQIDNO:25的CDR3区,SEQIDNO:26的CDR2区,和SEQIDNO:27的CDR1区,且轻链可变域包含SEQIDNO:28的CDR3区,SEQIDNO:29的CDR2区,和SEQIDNO:30的CDR1区,或e)重链可变域包含SEQIDNO:33的CDR3区,SEQIDNO:34的CDR2区,和SEQIDNO:35的CDR1区,且轻链可变域包含SEQIDNO:36的CDR3区,SEQIDNO:37的CDR2区,和SEQIDNO:38的CDR1区,或f)重链可变域包含SEQIDNO:41的CDR3区,SEQIDNO:42的CDR2区,和SEQIDNO:43的CDR1区,且轻链可变域包含SEQIDNO:44的CDR3区,SEQIDNO:45的CDR2区,和SEQIDNO:46的CDR1区,或g)重链可变域包含SEQIDNO:49的CDR3区,SEQIDNO:50的CDR2区,和SEQIDNO:51的CDR1区,且轻链可变域包含SEQIDNO:52的CDR3区,SEQIDNO:53的CDR2区,和SEQIDNO:54的CDR1区;或h)重链可变域包含SEQIDNO:69的CDR3区,SEQIDNO:70的CDR2区,和SEQIDNO:71的CDR1区,且轻链可变域包含SEQIDNO:72的CDR3区,SEQIDNO:73的CDR2区,和SEQIDNO:74的CDR1区,或i)重链可变域包含SEQIDNO:77的CDR3区,SEQIDNO:78的CDR2区,和SEQIDNO:79的CDR1区,且轻链可变域包含SEQIDNO:80的CDR3区,SEQIDNO:81的CDR2区,和SEQIDNO:82的CDR1区。在一个实施方案中,与结合人CSF-1R的抗体的联合疗法的特征在于:a)重链可变域包含SEQIDNO:69的CDR3区,SEQIDNO:70的CDR2区,和SEQIDNO:71的CDR1区,且轻链可变域包含SEQIDNO:72的CDR3区,SEQIDNO:73的CDR2区,和SEQIDNO:74的CDR1区,或b)重链可变域包含SEQIDNO:77的CDR3区,SEQIDNO:78的CDR2区,和SEQIDNO:79的CDR1区,且轻链可变域包含SEQIDNO:80的CDR3区,SEQIDNO:81的CDR2区,和SEQIDNO:82的CDR1区。在一个实施方案中,与结合人CSF-1R的抗体的联合疗法的特征在于:a)重链可变域包含SEQIDNO:17的CDR3区,SEQIDNO:18的CDR2区,和SEQIDNO:19的CDR1区,且轻链可变域包含SEQIDNO:20的CDR3区,SEQIDNO:21的CDR2区,和SEQIDNO:22的CDR1区,或b)重链可变域包含SEQIDNO:25的CDR3区,SEQIDNO:26的CDR2区,和SEQIDNO:27的CDR1区,且轻链可变域包含SEQIDNO:28的CDR3区,SEQIDNO:29的CDR2区,和SEQIDNO:30的CDR1区,或c)重链可变域包含SEQIDNO:33的CDR3区,SEQIDNO:34的CDR2区,和SEQIDNO:35的CDR1区,且轻链可变域包含SEQIDNO:36的CDR3区,SEQIDNO:37的CDR2区,和SEQIDNO:38的CDR1区,或d)重链可变域包含SEQIDNO:41的CDR3区,SEQIDNO:42的CDR2区,和SEQIDNO:43的CDR1区,且轻链可变域包含SEQIDNO:44的CDR3区,SEQIDNO:45的CDR2区,和SEQIDNO:46的CDR1区,或e)重链可变域包含SEQIDNO:49的CDR3区,SEQIDNO:50的CDR2区,和SEQIDNO:51的CDR1区,且轻链可变域包含SEQIDNO:52的CDR3区,SEQIDNO:53的CDR2区,和SEQIDNO:54的CDR1区。在一个实施方案中,与结合人CSF-1R的抗体的联合疗法的特征在于:a)重链可变域包含SEQIDNO:17的CDR3区,SEQIDNO:18的CDR2区,和SEQIDNO:19的CDR1区,且轻链可变域包含SEQIDNO:20的CDR3区,SEQIDNO:21的CDR2区,和SEQIDNO:22的CDR1区,或b)重链可变域包含SEQIDNO:25的CDR3区,SEQIDNO:26的CDR2区,和SEQIDNO:27的CDR1区,且轻链可变域包含SEQIDNO:28的CDR3区,SEQIDNO:29的CDR2区,和SEQIDNO:30的CDR1区,或c)重链可变域包含SEQIDNO:33的CDR3区,SEQIDNO:34的CDR2区,和SEQIDNO:35的CDR1区,且轻链可变域包含SEQIDNO:36的CDR3区,SEQIDNO:37的CDR2区,和SEQIDNO:38的CDR1区,或d)重链可变域包含SEQIDNO:41的CDR3区,SEQIDNO:42的CDR2区,和SEQIDNO:43的CDR1区,且轻链可变域包含SEQIDNO:44的CDR3区,SEQIDNO:45的CDR2区,和SEQIDNO:46的CDR1区。在一个实施方案中,与结合人CSF-1R的抗体的联合疗法的特征在于:重链可变域包含SEQIDNO:17的CDR3区,SEQIDNO:18的CDR2区,和SEQIDNO:19的CDR1区,且轻链可变域包含SEQIDNO:20的CDR3区,SEQIDNO:21的CDR2区,和SEQIDNO:22的CDR1区。在一个实施方案中,与结合人CSF-1R的抗体的联合疗法的特征在于:重链可变域包含SEQIDNO:25的CDR3区,SEQIDNO:26的CDR2区,和SEQIDNO:27的CDR1区,且轻链可变域包含SEQIDNO:28的CDR3区,SEQIDNO:29的CDR2区,和SEQIDNO:30的CDR1区。在一个实施方案中,与结合人CSF-1R的抗体的联合疗法的特征在于:重链可变域包含SEQIDNO:33的CDR3区,SEQIDNO:34的CDR2区,和SEQIDNO:35的CDR1区,且轻链可变域包含SEQIDNO:36的CDR3区,SEQIDNO:37的CDR2区,和SEQIDNO:38的CDR1区。在一个实施方案中,与结合人CSF-1R的抗体的联合疗法的特征在于:重链可变域包含SEQIDNO:41的CDR3区,SEQIDNO:42的CDR2区,和SEQIDNO:43的CDR1区,且轻链可变域包含SEQIDNO:44的CDR3区,SEQIDNO:45的CDR2区,和SEQIDNO:46的CDR1区。在一个实施方案中,特征在于抗体以1:50或更低的比率结合人CSF-1R片段delD4(SEQIDNO:65)和人CSF-1R-ECD(SEQIDNO:64)的结合人CSF-1R的抗体的特征进一步在于不结合人CSF-1R片段D1-D3(SEQIDNO:66)。本发明的另一个方面是患者的选择,该患者可能受益于用抗CSF-1R抗体(包括所有结合人CSF-1R的CSF-1R抗体)治疗(单独或与化疗剂,或癌症免疫疗法,或照射组合施用)(包括所有结合人CSF-1R的CSF-1R抗体)。在一个实施方案中,此类患者选择涉及用CSF-1R抗体治疗,所述CSF-1R抗体结合人CSF-1R的胞外域的域D4至D5,即结合胞外域的域D4至D5。下列一种或多种生物标志物可用于用于选择可能响应此类治疗的患者的此类方法。用于生物标志物评估的基本原理生物标志物具有定形诊断策略和影响治疗管理的潜力。在未来,生物标志物Biomarker可以促进个人化的药物方法,例如导致患者分组,这根据其肿瘤及标志物在其血液中的分子标签,而不是癌症类型进行。我们将我们的工作集中于鉴定预测性生物标志物,其提供关于疗法的可能效力和安全性的信息。为了评估药物对肿瘤的的PD和机械效果,经常需要肿瘤活组织检查。用于临床测试中新鲜的前处理和治疗期(On-Treatment)肿瘤活组织检查的基本原理TAM浸润和分化依赖于原发性和转移性损伤中的相应肿瘤微环境。此外,患者的相应免疫状态和前处理可以影响患者的肿瘤微环境。因此,所有患者会经历强制性前处理活组织检查以在基线限定TAM浸润和CSF-1R表达水平,但是不会用于测定患者对试验的适任性(eligibility)。另外,强制性治疗期活组织检查会容许评估CSF-1R抗体的PD活性,其通过比较CSF-1R,CD68/CD163,CD68/MHCII类,CD31(微血管密度),Ki67和其他免疫浸润细胞(例如Tcells)剂量前和后的水平进行。细针抽吸(FineNeedleAspiration,FNA)不会不适合于替换肿瘤活组织检查,因为巨噬细胞亚群分布需要在组织中评估。归档肿瘤组织不能代替新鲜的活组织检查,因为巨噬细胞浸润和分化是微环境依赖性的。肿瘤微环境由于患者的预治疗在原发性肿瘤中可能是多变的,并且在转移性损伤中也是变化的。然而,若归档肿瘤组织是可用的,则鼓励进行临床样品操作(CSO)。样品会用于数据与新鲜活组织检查的探索性回顾关联。用于临床测试中伤口皮肤活组织检查的基本原理伤口愈合的不同阶段需要许多过程(例如嗜中性粒细胞募集,巨噬细胞浸润,血管发生(Eming,S.A.等,Prog.Histochem.Cytochem.42(2007)115-170)。皮肤创伤测定法已经用于获得替代组织以测定例如抗血管生成疗法的PD标志物(Zhang,D.等,Invest.NewDrugs25(2006)49-55;Lockhart,A.C.等,Clin.CancerRes.9(2003)586-593)。在伤口愈合期间,巨噬细胞发挥实质性作用,并且伤口相关巨噬细胞(WAM)的表型变化在皮肤修复阶段中起到不同作用(例如早期炎性阶段=强烈的噬菌活性;中间组织重塑阶段:伴有促血管生成因子的过表达的免疫调节状态)(Adamson,R.,JournalofWoundCare18(2009)349-351;Rodero,M.P.等,Int.J.Clin.Exp.Pathol.25(2010)643-653;Brancato,S.K.andAlbina,J.E.,WoundMacrophagesasKeyRegulatorsofRepair,Origin,Phenotype,andFunction.AJP(2011),Vol.178,No.1)。实际上,巨噬细胞的缺乏导致遗传工程化小鼠中延迟的伤口愈合(Rodero,M.P.等,Int.J.Clin.Exp.Pathol.25(2010)643-653)。临床前实验显示了CSF-1R处理MDA-MB231异种移植物小鼠模型的皮肤中显著的(F4/80阳性)巨噬细胞减少。然而,已经报告了小鼠和人之间的物种特异性差异(Daley,J.M.等,J.Leukoc.Biol.87(2009)1-9)。由于WAM和TAM起源于相同的祖细胞并且共享相似的功能和表型,可以使用系列的处理前和处理中(总共n=4)皮肤活组织检查在伤口愈合过程期间分析人源化的Mab2F11治疗对WAM的药效学影响。皮肤数据与CSF-1R抗体治疗对新鲜肿瘤活组织检查中TAM的PD影响的关联可以显著增加关于CSF-1R抗体如何起作用及肿瘤如何响应的分子基础的知识。另外,伤口皮肤组织巨噬细胞的评估可以潜在替代治疗中肿瘤活组织检查。因此,在后来试验中,WAM的评估可以充当替代组织以评估CSF-1R抗体效力。用于测量全血样品中的生物标志物以测量生物标志物或PD标志物的基本原理临床前实验已经显示了例如循环CSF-1,TRAP5b单核细胞亚群和组织巨噬细胞的变化与抗CSF-1R治疗剂的药物活性有关。另外,来自经CSF-1R抗体处理的猕猴的GLP-Tox数据揭示了均与骨代谢相关的骨形成(骨钙蛋白,P1NP),破骨细胞活性(TRAP5b)和副甲状腺激素的生物标志物的变化。因此,这些标志物和其它循环免疫刺激或免疫抑制因子及例如可溶性CD163(用于检测单核细胞/巨噬细胞的活化)可以用于监测药效变化及用于选择可能有利响应抗CSF-1R抗体治疗的患者。这些替代组织标本会用于研究目的以鉴定生物标志物,其预测对CSF-1R抗体治疗(就剂量,安全性和耐受性而言)的响应并且会有助于更好了解癌症及相关疾病的发病机理,过程和结果。分析可以包括测定与CSF-1R抗体的PD活性有关的循环标志物(例如评估细胞因子水平,循环免疫细胞和免疫效应细胞消减)。初步实验已经显示了例如循环CSF-1,TRAP5b单核细胞亚群和组织巨噬细胞的变化与药物活性有关。另外,来自经CSF-1R抗体处理的猕猴的GLP-Tox数据揭示了均与减少的破骨细胞数目相关的形成(骨钙蛋白,P1NP),破骨细胞活性(TRAP5b)和副甲状腺激素的骨标志物的变化。因此,这些标志物和其它循环免疫刺激或免疫抑制因子可以用于选择可能有利响应抗CSF-1R抗体治疗的患者。本发明的一个方面是用于测定具有癌症的受试者是否是用于基于抗CSF-1R抗体的癌症治疗方案的候选者的方法,其中所述抗体是本发明的抗体,所述方法包括:-在所述受试者的样品中离体或体外测定下列一种或多种标志物的体外水平:CSF-1R,CD68/CD163,CD68/MHCII类,CD31(微血管密度),和Ki67及其它标志物,如例如免疫浸润物;其中所述样品选自下组:组织,血液,血清,血浆,肿瘤细胞和循环肿瘤细胞;且-其中与未患有癌症的个体中的相应水平相比,下列一项或多项的水平变化指示所述受试者是基于抗CSF-1R抗体的癌症治疗方案的候选者:CSF-1R,CD68/CD163,CD68/MHCII类,CD31(微血管密度)和Ki67及其它标志物,如例如免疫浸润物(例如T细胞(例如CD4-和/或CD8-T细胞)。在一个实施方案中,对基于抗CSF-1R抗体的癌症治疗方案实施此方法,其中所述方案中使用的抗体是依照本发明的抗体。在此方法的一个实施方案中,与未患癌症的个体中的水平相比CSF-1R,CD68/CD163,CD68/MHCII类,CD31(微血管密度)和Ki67及其他标志物,如例如免疫浸润物(例如T细胞(例如CD4-和/或CD8-T细胞)的水平变化是这些中一种或多种标志物的水平升高。本发明的一个方面是用于测定具有癌症的受试者是否是用于基于抗CSF-1R抗体的癌症治疗方案的候选者的方法,其中所述抗体是本发明的抗体,所述方法包括:-在所述受试者的样品中离体或体外测定下列一种或多种标志物的水平:CSF-1R,CD68/CD163,CD68/MHCII类,CD31(微血管密度)和Ki67;其中所述样品选自下组:血液,血清,血浆,肿瘤细胞和循环肿瘤细胞;其中与未患有癌症的个体中的相应水平相比,CSF-1R,CD68/CD163,CD68/MHCII类,CD31(微血管密度)和Ki67的水平变化指示所述受试者是基于抗CSF-1R抗体的癌症治疗方案的候选者。本发明的一个方面是用于测定具有癌症的受试者是否是用于基于抗CSF-1R抗体的癌症治疗方案的候选者的方法,其中所述抗体是本发明的抗体,所述方法包括:-在所述受试者的样品中离体或体外测定下列一种或多种标志物的体外水平:CSF-1,Trap5b,sCD163,IL-34;其中所述样品选自下组:血液,血清,血浆,肿瘤细胞(例如为肿瘤组织样品形式)和循环肿瘤细胞;且-其中与未患有癌症的个体中的相应水平相比,CSF-1,Trap5b,sCD163,IL34中的一种或多种的水平变化指示所述受试者是基于抗CSF-1R抗体的癌症治疗方案的候选者。在一个实施方案中,对基于抗CSF-1R抗体的癌症治疗方案实施此方法,其中所述方案中使用的抗体是依照本发明的抗体。在此方法的一个实施方案中,与未患癌症的个体中的水平相比CSF-1,Trap5b,sCD163,IL-34的水平变化是这些中一种或多种标志物的水平变化。本发明的一个方面是用于测定具有癌症的受试者是否是用于基于抗CSF-1R抗体的癌症治疗方案的候选者的方法,其中所述抗体是本发明的抗体,所述方法包括:-在所述受试者的样品中离体或体外测定下列一种或多种标志物的水平:CSF-1,Trap5b,sCD163,IL-34;其中所述样品选自下组:血液,血清,血浆,肿瘤细胞和循环肿瘤细胞;且-其中与未患有癌症的个体中的相应水平相比,CSF-1,Trap5b,sCD163,IL-34的水平变化指示所述受试者是基于抗CSF-1R抗体的癌症治疗方案的候选者。本发明的一个方面是用于测定具有癌症的受试者是否是用于基于抗CSF-1R抗体的癌症治疗方案的候选者的方法,其中所述抗体是本发明的抗体,所述方法包括:-在所述受试者的样品中离体或体外测定下列一种或多种标志物的体外水平:sCD163;其中所述样品选自下组:血液,血清,血浆,肿瘤细胞和循环肿瘤细胞;且-其中与未患有癌症的个体中的相应水平相比,sCD163的水平变化指示所述受试者是基于抗CSF-1R抗体的癌症治疗方案的候选者。在一个实施方案中,对基于抗CSF-1R抗体的癌症治疗方案实施此方法,其中所述方案中使用的抗体是依照本发明的抗体。在此方法的一个实施方案中,与未患有癌症的个体中的水平相比sCD163的水平变化是此标志物的水平升高。本发明的一个方面是用于测定具有癌症的受试者是否是用于基于抗CSF-1R抗体的癌症治疗方案的候选者的方法,其中所述抗体是本发明的抗体,所述方法包括:-在所述受试者的样品中离体或体外测定下列一种或多种标志物的水平:sCD163;其中所述样品选自下组:血液,血清,血浆,肿瘤细胞和循环肿瘤细胞;且-其中与未患有癌症的个体中的相应水平相比,sCD163的水平变化指示所述受试者是基于抗CSF-1R抗体的癌症治疗方案的候选者。本发明的一个方面是用于测定具有癌症的受试者是否是用于基于抗CSF-1R抗体的癌症治疗方案的候选者的方法,其中所述抗体是本发明的抗体,所述方法包括:-在所述受试者的样品中离体或体外测定下列一种或多种标志物的体外水平:IFNγ,TNFα,IL-1β,IL-4,IL-6,IL-8,IL-10,IL-13,GM-CSF,VEGF,MCP-1,CCL18,CCL22,MIP-1,半乳凝素(Galectin)3,IL1Ra,TGFalpha;其中所述样品选自下组:血液,血清,血浆,肿瘤细胞和循环肿瘤细胞;且-其中与未患有癌症的个体中的相应水平相比,IFNγ,TNFα,IL-1β,IL-4,IL-6,IL-8,IL-10,IL-13,GM-CSF,VEGF,MCP-1,CCL18,CCL22,MIP-1,半乳凝素3,IL1Ra,TGFalpha中的一项或多项的水平变化指示所述受试者是基于抗CSF-1R抗体的癌症治疗方案的候选者。在一个实施方案中,对基于抗CSF-1R抗体的癌症治疗方案实施此方法,其中所述方案中使用的抗体是依照本发明的抗体。在此方法的一个实施方案中,与未患有癌症的个体中的水平相比,IFNγ,TNFα,IL-1β,IL-4,IL-6,IL-8,IL-10,IL-13,GM-CSF,VEGF,MCP-1,CCL18,CCL22,MIP-1,半乳凝素3,IL1Ra,TGFalpha的水平变化是这些中一种或多种标志物的水平升高。本发明的一个方面是用于测定具有癌症的受试者是否是用于基于抗CSF-1R抗体的癌症治疗方案的候选者的方法,其中所述抗体是本发明的抗体,所述方法包括:-在所述受试者的样品中离体或体外测定下列一种或多种标志物的水平:IFNγ,TNFα,IL-1β,IL-4,IL-6,IL-8,IL-10,IL-13,GM-CSF,VEGF,MCP-1,CCL18,CCL22,MIP-1,半乳凝素3,IL1Ra,TGFalpha;其中所述样品选自下组:血液,血清,血浆,肿瘤细胞和循环肿瘤细胞;且-其中与未患有癌症的个体中的相应水平相比IFNγ,TNFα,IL-1β,IL-4,IL-6,IL-8,IL-10,IL-13,GM-CSF,VEGF,MCP-1,CCL18,CCL22,MIP-1,半乳凝素3,IL1Ra,TGFalpha的水平变化指示所述受试者是基于抗CSF-1R抗体的癌症治疗方案的候选者。术语“抗体”涵盖各种形式的抗体,包括但不限于完整抗体、抗体片段、人抗体、人源化抗体、嵌合抗体、T细胞表位消减抗体、和别的遗传工程抗体,只要依照本发明的特征性特性得到保留。“抗体片段”包含全长抗体的一部分,优选其可变域,或至少其抗原结合位点。抗体片段的例子包括双抗体、单链抗体分子、和自抗体片段形成的多特异性抗体。scFv抗体例如记载于Houston,J.S.,MethodsinEnzymol.203(1991)46-88。另外,抗体片段包含单链多肽,其具有结合CSF-1R的VH域(即能够与VL域一起装配)或结合CSF-1R的VL域(即能够与VH域一起装配)装配成功能性抗原结合位点并由此提供该特性的特征。“抗体片段”包含全长抗体的一部分,优选其可变域,或至少其抗原结合位点。抗体片段的例子包括双抗体、单链抗体分子、和自抗体片段形成的多特异性抗体。scFv抗体例如记载于Houston,J.S.,MethodsinEnzymol.203(1991)46-88。另外,抗体片段包含单链多肽,其具有结合CSF-1R的VH域(即能够与VL域一起装配)或结合CSF-1R的VL域(即能够与VH域一起装配)装配成功能性抗原结合位点并由此提供该特性的特征。如本文中使用的,术语“单克隆抗体”或“单克隆抗体组合物”指单一氨基酸组成的抗体分子的制备物。术语“嵌合抗体”指通常通过重组DNA技术制备的包含来自小鼠的可变区,即结合区和自不同来源或物种衍生的恒定区的至少一部分的单克隆抗体。包含小鼠可变区和人恒定区的嵌合抗体是特别优选的。此类大鼠/人嵌合抗体是包含编码大鼠免疫球蛋白可变区的DNA区段和编码人免疫球蛋白恒定区的DNA区段的所表达免疫球蛋白基因的产物。本发明所涵盖的“嵌合抗体”的其它形式是那些其中类别或亚类已经自初始抗体的类别或亚类修饰或改变的。此类“嵌合”抗体又称为“类别转换抗体”。用于生成嵌合抗体的方法牵涉本领域现在公知的常规重组DNA和基因转染技术。参见例如Morrison,S.L.等,Proc.Natl.AcadSci.USA81(1984)6851-6855;US5,202,238和US5,204,244。术语“人源化抗体”指其中的框架或“互补决定区”(CDR)已经进行过修饰以包含与亲本免疫球蛋白的特异性相比不同特异性的免疫球蛋白的CDR的抗体。在一个优选的实施方案中,将鼠CDR嫁接入人抗体的框架区中以制备“人源化抗体”。参见例如Riechmann,L.等,Nature332(1988)323-327;及Neuberger,M.S.等,Nature314(1985)268-270。任选地,框架区可以通过进一步突变修饰。还有,可以通过一处或多处突变修饰CDR以生成依照本发明的抗体,例如通过诱变基于如由Riechmann,L.等,Nature332(1988)323-327和Queen,C.等,Proc.Natl.Acad.Sci.USA86(1989)10029-10033等描述的分子建模进行。特别优选的CDR对应于那些代表上文对嵌合抗体记录的识别抗原的序列的。“依照本发明的抗体的人源化形式”(其是例如小鼠起源的)指如下的抗体,其基于小鼠抗体序列,其中VH和VL通过标准技术(包括CDR嫁接和任选随后诱变框架区和CDR中的某些氨基酸)而人源化。优选地,此类人源化形式用人恒定区嵌合化(参见例如序列SEQIDNO:57-61)。本发明涵盖的“人源化抗体”的其他形式是其中的恒定区已经相对于初始抗体的恒定区另外经过修饰或改变以产生依照本发明的特性(特别是在C1q结合和/或Fc受体(FcR)结合方面)的那些形式。在以下例子中,术语“Mab”或“muMab”指鼠单克隆抗体,诸如Mab2F11或Mab2E10,而术语“hMab”指此类鼠抗体的人源化单克隆形式,诸如hMab2F11-c11,hMab2F11-d8,hMab2F11-e7,hMab2F11-f12,等等。如本文中所使用的,术语“人抗体”意图包括具有自人种系免疫球蛋白序列衍生的可变和恒定区的抗体。人抗体是现有技术中公知的(vanDijk,M.A.,andvandeWinkel,J.G.,Curr.Opin.Chem.Biol.5(2001)368-374)。也可以在转基因动物(例如小鼠)中生成人抗体,所述转基因动物在免疫后能够在没有内源免疫球蛋白生成的情况中生成人抗体的完整全集和选集。在此类种系突变体小鼠中转移人种系免疫球蛋白基因阵列会导致抗原攻击后生成人抗体(参见例如Jakobovits,A.等,Proc.Natl.Acad.Sci.USA90(1993)2551-2555;Jakobovits,A.等,Nature362(1993)255-258;Brueggemann,M.等,YearImmunol.7(1993)33-40)。人抗体也可以在噬菌体展示文库中生成(Hoogenboom,H.R.,andWinter,G.J.Mol.Biol.227(1992)381-388;Marks,J.D.等,J.Mol.Biol.222(1991)581-597)。Cole等及Boerner等的技术也可用于制备人单克隆抗体(Cole,S.P.C.等,MonoclonalAntibodiesandCancerTherapy,AlanR.Liss,p.77(1985);及Boerner,P.等,J.Immunol.147(1991)86-95)。如已经对依照本发明的人源化抗体所提及的,如本文中所使用的,术语“人抗体”还包括如下的抗体,其在恒定区中进行修饰以生成依照本发明的特性(特别地关于C1q结合/或FcR结合),例如通过“类转换”,即Fc部分的变化或突变(例如自IgG1至IgG4和/或IgG1/IgG4突变)来实现。如本文中所使用的,术语“重组人抗体”意图包括通过重组手段制备、表达、创建或分离的所有人抗体,诸如自宿主细胞诸如NS0或CHO细胞或者自对于使用转染入宿主细胞中的重组表达载体表达的人免疫球蛋白基因或抗体而言转基因的动物(例如小鼠)分离的抗体。此类重组人抗体具有重排形式的可变和恒定区。依照本发明的重组人抗体已经进行过体内体细胞超突变。如此,重组抗体的VH和VL区的氨基酸序列是虽然自人种系VH和VL序列衍生及与其相关,但可以不天然存在于体内的人抗体种系全集内的序列。另外,依照本发明的抗体包括如下的抗体,其具有“保守序列修饰”,不影响或改变上文所述依照本发明的抗体的特征的核苷酸和氨基酸序列修饰。可以通过本领域已知的标准技术来引入修饰,诸如定点诱变和PCR介导的诱变。保守氨基酸替代包括将某个氨基酸残基用具有相似侧链的氨基酸残基替换。本领域已经定义了具有相似侧链的氨基酸残基家族。这些家族包括具有碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷的侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸)、β-分支侧链(例如苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)的氨基酸。如此,优选地,人抗CSF-1R抗体中的预测非必需氨基酸残基可以用来自相同侧链家族的另一种氨基酸残基替换。可以基于分子建模通过诱变来实施氨基酸替代,如记载于Riechmann,L.,等人,Nature332(1988)323-327及Queen,C.,等人,Proc.Natl.Acad.Sci.USA86(1989)10029-10033。人CSF-1R(CSF-1受体;同义词:M-CSF受体;巨噬细胞集落刺激因子1受体,Fms原癌基因,c-fms,SEQIDNO:22))从1986年起是已知的(Coussens,L.,等人,Nature320(1986)277-280)。CSF-1R是一种生长因子且由c-fms原癌基因编码(综述见例如Roth,P.和Stanley,E.R.,Curr.Top.Microbiol.Immunol.181(1992)141-167)。CSF-1R是CSF-1R配体CSF-1(巨噬细胞集落刺激因子,也称作M-CSF)(SEQIDNo.:86)和IL-34(SEQIDNo.:87)的受体且介导这些细胞因子的生物学效应(Sherr,C.J.等,Cell41(1985)665-676;Lin,H.等,Science320(2008)807-811)。集落刺激因子-1受体(也称作c-fms)的克隆第一次记载于Roussel,M.F.,等人,Nature325(1987)549-552。在该出版物中,显示了CSF-1R具有依赖于该蛋白的C端尾中的变化(包括抑制性酪氨酸969磷酸化的丧失,其结合Cbl并由此调节受体下调)的转化潜力(Lee,P.S.,等人,EmboJ.18(1999)3616-3628)。CSF-1R是一种单链,跨膜受体酪氨酸激酶(RTK)和含有免疫球蛋白(Ig)基序的RTK家族的成员,其特征在于受体的胞外域(ECD)中的5个重复的Ig样亚域D1-D5(Wang,Z.等MolecularandCellularBiology13(1993)5348-5359)。人CSF-1R胞外域(CSF-1R-ECD)(SEQIDNO:64)包含所有5个胞外Ig样亚域D1–D5。人CSF-1R片段delD4(SEQIDNO:65)包含胞外Ig样亚域D1–D3和D5,但是缺少D4亚域。人CSF-1R片段D1-D3(SEQIDNO:66)包含相应的亚域D1-D3。列出了没有信号肽MGSGPGVLLLLLVATAWHGQG(SEQIDNO:67)的序列。人CSF-1R片段D4-D3(SEQIDNO:85)包含相应的亚域D4-D3。目前,结合CSF-1R胞外域的两种CSF-1R配体是已知的。第一种是CSF-1(集落刺激因子1,又称作M-CSF,巨噬细胞;人CSF-1,SEQIDNO:86),并且在胞外以二硫化物连接的同二聚体发现(Stanley,E.R.等,JournalofCellularBiochemistry21(1983)151-159;Stanley,E.R.等,StemCells12Suppl.1(1995)15–24)。第二种是IL-34(人IL-34;SEQIDNO:87)(Hume,D.A.等,Blood119(2012)1810-1820)。因此,在一个实施方案中,术语“CSF-1R配体”指人CSF-1(SEQIDNO:86)和/或人IL-34(SEQIDNO:87)。对于实验,经常使用人CSF-1的活性149氨基酸(aa)片段(SEQIDNO:86的aa33-181)。人CSF-1的此活性149aa片段(SEQIDNO:86的aa33-181)是CSF-1的所有3种主要形式中包含的,并且足以介导对CSF-1R的结合(Hume,D.A.等,Blood119(2012)1810-1820)。CSF-1R信号传导的主要生物学效果是造血前体细胞向巨噬细胞谱系(包括破骨细胞)的分化,增殖,迁移和存活。CSF-1R的活化由其CSF-1R配体CSF-1(M-CSF)和IL-34介导。CSF-1(M-CSF)对CSF-1R的结合诱导同二聚体形成和通过酪氨酸磷酸化对激酶的活化(Li,W.等,EMBOJournal.10(1991)277-288;Stanley,E.R.等,Mol.Reprod.Dev.46(1997)4-10)。胞内蛋白质酪氨酸激酶域被独特的插入域中断,所述独特的插入域也存在于其他相关RTKIII类家族成员,包括血小板衍生的生长因子受体(PDGFR)、干细胞生长因子受体(c-Kit)和fins样细胞因子受体(FLT3)。尽管此生长因子受体家族之间有结构同源性,它们具有截然不同的组织特异性功能。CSF-1R主要在单核细胞谱系细胞上及在女性生殖道和胎盘中表达。另外,已经在皮肤中的朗格汉斯细胞(平滑肌细胞的子集)(Inaba,T.等,J.Biol.Chem.267(1992)5693-5699),B细胞(Baker,A.H.等,Oncogene8(1993)371-378)和小神经胶质(Sawada,M.等,BrainRes.509(1990)119-124)中报告了CSF-1R的表达。已知具有突变体人CSF-1R((SEQIDNO:23)的细胞不依赖于配体刺激增殖。如本文中使用的,“结合人CSF-1R”或“特异性结合人CSF-1R”指于35℃以KD值为1.0x10-8mol/l或更低,在一个实施方案中于35℃KD值为1.0x10-9mol/l或更低的结合亲和力特异性结合人CSF-1R抗原的抗体。于35℃用标准结合测定法,诸如表面等离振子共振技术(GE-HealthcareUppsala,Sweden)测定结合亲和力。用于测定结合亲和力的KD值的方法记载于实施例9。因此,如本文中使用的“结合人CSF-1R的抗体”指以于35℃KD1.0x10-8mol/l或更低(优选1.0x10-8mol/l-1.0x10-12mol/l),优选于35℃KD1.0x10-9mol/l或更低(优选1.0x10-9mol/l-1.0x10-12mol/l)的结合亲和力特异性结合人CSF-1R抗原的抗体。如本文中使用的,“结合人CSF-1R片段delD4(SEQIDNO:65)和人CSF-1R胞外域(SEQIDNO:64)”通过表面等离振子共振测定法(Biacoreassay)测量,如实施例4中描述的。分别将人CSF-1R片段delD4(SEQIDNO:65)或人CSF-1R胞外域(SEQIDNO:64)捕获到表面(各自到不同的表面),并添加测试抗体(各在不同的测量中),并测定相应的结合信号(响应单位(RU))。扣除参照信号(空白表面)。若非结合测试抗体的信号略低于0,则数值设置为0。然后,测定相应结合信号的比率(对人CSF-1R片段delD4的结合信号(RU)/对人CSF-1R胞外域(CSF-1R-ECD)的结合信号(RU))。依照本发明的抗体具有1:50或更低,优选1:100或更低(更低包括的末端是0(例如如RU是0,则比率是0:50或:100))的结合信号比率(RU(delD4)/RU(CSF-1R-ECD)。这意味着依照本发明的此类抗CSF-1R抗体不结合人CSF-1R片段delD4(如抗CCR5抗体m<CCR5>Pz03.1C5(以DSMACC2683在18.08.2004保藏于DSMZ),并且具有在抗CCR5抗体m<CCR5>Pz03.1C5范围中的结合人CSF-1R片段delD4的结合信号,其在表面等离振子共振(BIAcore)测定法中低于20RU(响应单位),优选低于10RU,如实施例4中显示的。术语“结合人CSF-1R片段D1-D3”指通过表面等离振子共振测定法(Biacore测定法)的结合亲和力测定。将测试抗体捕获到表面,并添加人CSF-1R片段D1-D3(SEQIDNO:66),并测定相应的结合亲和力。术语“不结合人CSF-1R片段D1-D3”或“其不结合人CSF-1R片段D1-D3”表示在此类测定法中,检测信号在背景信号的不超过1.2倍的面积中,并且因此不能检出显著的结合且不能测定结合亲和力(参见实施例10)。本发明的一个实施方案是用于选择可用于依照本发明的联合疗法的抗体的筛选方法,其包括下列步骤:a)通过表面等离振子共振测定法(Biacoreassay)测量抗CSF-1R抗体对人CSF-1R胞外域(CSF-1R-ECD)(SEQIDNO:64)的结合,b)测量抗CSF-1R抗体对人CSF-1R片段D1-D3(SEQIDNO:66)(D1-D3)的结合,c)选择如下的抗体,其特异性结合人CSF-1R胞外域(CSF-1R-ECD),并且其不结合人CSF-1R片段D1-D3(SEQIDNO:66)(D1-D3)。本发明的一个实施方案是用于选择依照本发明的抗体的筛选方法,其包括下列步骤:a)通过表面等离振子共振测定法(Biacoreassay)测定抗CSF-1R抗体对人CSF-1R片段delD4(SEQIDNO:65)及对人CSF-1R胞外域(CSF-1R-ECD)(SEQIDNO:64)的结合信号(响应单位(RU)),b)选择具有50:1或更低的结合信号比率(人CSF-1R片段delD4/人CSF-1R胞外域(CSF-1R-ECD))的抗体。在一个实施方案中,于25℃实施测定。在一个实施方案中,筛选方法包括作为其它步骤,测量抗CSF-1R抗体对人CSF-1R片段D1-D3(SEQIDNO:66)(D1-D3)的结合并选择对所述片段不显示结合的抗体。术语“表位”表示人CSF-1R中能够特异性结合抗体的蛋白质决定簇。表位通常由分子诸如氨基酸或糖侧链的化学活性表面聚组组成,而且表位通常具有特定的三维结构特征,以及特定的电荷特征。构象性和非构象性表位的区别在于对前者而非后者的结合在变性溶剂存在下丧失。优选地,依照本发明的抗体特异性结合天然的CSF-1R及变性的CSF-1R。如本文中使用的,“可变域”(轻链的可变域(VL),重链的可变域(VH))表示轻和重链域对中的每一个,它们直接涉及抗体对抗原的结合。可变轻和重链域具有相同的整体结构,而且每个域包含四个框架(FR)区,它们的序列是广泛保守的,由三个“高变区”(或互补决定区,CDR)连接。框架区采取β-片层构象,而且CDR可以形成连接β-片层结构的环。每条链中的CDR通过框架区保持其三维结构,并且与来自另一条链的CDR一起形成抗原结合位点。抗体的重和轻链CDR3区在依照本发明的抗体的结合特异性/亲和力中发挥特别重要的作用,而且因此提供本发明的又一个目的。术语“抗体的抗原结合部分”在本文中使用时指抗体中负责抗原结合的氨基酸残基。抗体的抗原结合部分包含来自“互补决定区”或“CDR”的氨基酸残基。“框架”或“FR”区是可变域中那些与本文中定义的高变区残基不同的区。因此,抗体的轻和重链可变域自N至C端包含域FR1、CDR1、FR2、CDR2、FR3、CDR3、和FR4。尤其地,重链的CDR3是对抗原结合贡献最大且限定抗体特性的区。CDR和FR区依照Kabat,等人,SequencesofProteinsofImmunologicalInterest,第5版,PublicHealthService,NationalInstitutesofHealth,Bethesda,MD(1991)的标准定义和/或那些来自“高变环”的残基来确定。如本文中使用的,术语“核酸”或“核酸分子”意图包括DNA分子和RNA分子。核酸分子可以是单链的或双链的,但是优选是双链DNA。如本本申请内使用的,术语“氨基酸”表示天然存在的羧基α-氨基酸组,包括丙氨酸(三字母代码:ala,单字母代码:A)、精氨酸(arg,R)、天冬酰胺(asn,N)、天冬氨酸(asp,D)、半胱氨酸(cys,C)、谷氨酰胺(gln,Q)、谷氨酸(glu,E)、甘氨酸(gly,G)、组氨酸(his,H)、异亮氨酸(ile,I)、亮氨酸(leu,L)、赖氨酸(lys,K)、甲硫氨酸(met,M)、苯丙氨酸(phe,F)、脯氨酸(pro,P)、丝氨酸(ser,S)、苏氨酸(thr,T)、色氨酸(trp,W)、酪氨酸(tyr,Y)、和缬氨酸(val,V)。在一个实施方案中,依照本发明的抗体抑制CSF-1对CSF-1R的结合。在一个实施方案中,以200ng/ml或更低的IC50,在一个实施方案中,以50ng/ml或更低的IC50。对CSF-1结合CSF-1R的抑制的IC50可以如实施例3中显示的那样测定。在一个实施方案中,依照本发明的抗体抑制CSF-1诱导的CSF-1R磷酸化(在NIH3T3-CSF-1R重组细胞中)。在一个实施方案中,以800ng/ml或更低的IC50,在一个实施方案中,以600ng/ml或更低的IC50,在一个实施方案中,以250ng/ml或更低的IC50。CSF-1诱导的CSF-1R磷酸化的IC50可以如实施例3中显示的那样测定。在一个实施方案中依照本发明的抗体抑制表达人CSF-1R(SEQIDNo:62)的重组NIH3T3细胞的生长。在一个实施方案中,以10μg/ml或更低的IC50,在一个实施方案中,以5μg/ml或更低的IC50,在一个实施方案中,以2μg/ml或更低的IC50。在一个实施方案中,以10μg/ml或更低的IC30,在一个实施方案中,以5μg/ml或更低的IC30,在一个实施方案中,以2μg/ml或更低的IC30。如实施例5中显示的那样测定IC50值,IC30值或%生长抑制。在一个实施方案中,依照本发明的抗体抑制表达人突变体CSF-1RL301SY969F(SEQIDNo:63)的重组NIH3T3细胞生长。在一个实施方案中,以15μg/ml或更低的IC50,在一个实施方案中,以10μg/ml或更低的IC50。在一个实施方案中,以10μg/ml或更低的IC30,在一个实施方案中,以5μg/mlng/ml或更低的IC50;在一个实施方案中,以2μg/ml或更低的IC50。如实施例5中显示的那样测定IC50值,IC30值或%生长抑制。在一个实施方案中,依照本发明的抗体将BeWo肿瘤细胞(ATCCCCL-98)的生长抑制65%或更多(在10μg/ml的抗体浓度;且于抗体缺乏相比)。如实施例8中显示的那样测定%生长抑制。例如,Mab2F11显示70%的对BeWo肿瘤细胞的生长抑制。在一个实施方案中依照本发明的抗体抑制人和猕猴巨噬细胞分化(二者)(其通过对人和猕猴单核细胞的存活的抑制介导,如实施例7和8中显示的)。在一个实施方案中,依照本发明的抗体以0.15μg/ml或更低的IC50,在一个实施方案中以0.10μg/ml或更低的IC50抑制人单核细胞的存活。测定对人单核细胞存活的抑制,如实施例7中显示的。在一个实施方案中,依照本发明的抗体将猕猴单核细胞的存活抑制80%或更多,在一个实施方案中,90%或更多(在5μg/ml的抗体浓度;且与抗体缺乏相比)。测定对人单核细胞存活的抑制,如实施例8中显示的。本发明的又一个实施方案是用于生成针对CSF-1R的抗体的方法,所述抗体的特征在于将编码依照本发明的结合人CSF-1R的人IgG1类抗体的重链的核酸(所述经修饰的核酸)和编码所述抗体的轻链的核酸的序列插入表达载体中,在真核宿主细胞中插入所述载体,将编码的蛋白质表达并从宿主细胞或上清液中回收。优选地,通过重组手段生成依照本发明的抗体。因此,抗体优选是分离的单克隆抗体。此类重组方法是现有技术中公知的,并且包括在原核和真核细胞中的蛋白质表达,随后分离抗体多肽,通常纯化至药学可接受纯度。对于蛋白质表达,通过标准方法将编码轻链和重链或其片段的核酸插入表达载体中。在合适的原核或真核宿主细胞,如CHO细胞,NS0细胞,SP2/0细胞,HEK293细胞,COS细胞,酵母,或大肠杆菌细胞中实施表达,并且从细胞(上清液或裂解后的细胞)中回收抗体。抗体的重组生成是现有技术中公知的,并且记载于例如Makrides,S.C.,ProteinExpr.Purif.17(1999)183-202;Geisse,S.等,ProteinExpr.Purif.8(1996)271-282;Kaufman,R.J.,Mol.Biotechnol.16(2000)151-161;Werner,R.G.,DrugRes.48(1998)870-880的综述文章。抗体可以存在于完整细胞中、细胞溶胞物中、或部分纯化的或实质性纯的形式。通过标准技术,包括碱/SDS处理、CsCl成带、柱层析、琼脂糖凝胶电泳、和本领域公知的其它技术实施纯化,以消除其它细胞成分或其它污染物,例如其它细胞核酸或蛋白质。参见Ausubel,F.,等人编,CurrentProtocolsinMolecularBiology,GreenePublishingandWileyInterscience,NewYork(1987)。NS0细胞中的表达记载于例如Barnes,L.M.,等人,Cytotechnology32(2000)109-123;Barnes,L.M.,等人,Biotech.Bioeng.73(2001)261-270。瞬时表达记载于例如Durocher,Y.,等人,Nucl.Acids.Res.30(2002)E9。可变域的克隆记载于Orlandi,R.,等人,Proc.Natl.Acad.Sci.USA86(1989)3833-3837;Carter,P.,等人,Proc.Natl.Acad.Sci.USA89(1992)4285-4289;Norderhaug,L.,等人,J.Immunol.Methods204(1997)77-87。一种优选的瞬时表达系统(HEK293)记载于Schlaeger,E.-J.和Christensen,K.,Cytotechnology30(1999)71-83及Schlaeger,E.-J.,J.Immunol.Methods194(1996)191-199。适合于原核生物的控制序列包括例如启动子、任选的操纵基因序列、和核糖体结合位点。已知真核细胞利用启动子、增强子和聚腺苷酸化信号。在将核酸放置在与另一种核酸序列的功能性关系中时,它是“可操作连接的”。例如,若前序列或分泌前导的DNA以参与多肽分泌的前蛋白表达,则它与多肽的DNA可操作连接;若启动子或增强子影响序列的转录,则它与编码序列可操作连接;或者若核糖体结合位点定位为使得便于翻译,则它与编码序列可操作连接。一般而言,“可操作连接的”意指所连接的DNA序列是连续的,而且在分泌前导的情况中,是连续的且在读码框中。然而,增强子不必是连续的。通过在方便的限制性位点处的连接来实现连接。若不存在此类位点,则依照常规的实践使用合成的寡核苷酸衔接头或接头。通过常规免疫球蛋白纯化规程,诸如例如蛋白A-Sepharose、羟磷灰石层析、凝胶电泳、透析、或亲和层析,恰当地将单克隆抗体与培养液分开。使用常规规程,容易分离编码单克隆抗体的DNA和RNA及测序。杂交瘤细胞可充当此类DNA和RNA的来源。一旦分离,可以将该DNA插入表达载体中,然后将该表达载体转染入不另外生成免疫球蛋白蛋白质的宿主细胞(诸如HEK293细胞、CHO细胞、或骨髓瘤细胞)中,以获得该宿主细胞中重组单克隆抗体的合成。如本文中使用的,表述“细胞”、“细胞系”、和“细胞培养物”可互换使用,而且所有此类名称包括后代。如此,词语“转化子”和“经转化细胞”包括原代受试细胞及自其衍生的培养物,不管转移的次数。还理解,由于有意的或无意的突变,所有后代的DNA内容可以不是精确相同的。包括具有初始转化细胞所筛选的相同功能或生物学活性的变异后代。抗体的“Fc部分”不直接涉及抗体对抗原的结合,但是展现出多种效应器功能。“抗体的Fc部分”是熟练技术人员公知的术语,而且基于木瓜蛋白酶对抗体的切割定义。根据其重链恒定区的氨基酸序列,抗体或免疫球蛋白分成类:IgA、IgD、IgE、IgG和IgM,并且这些中的数种可以进一步分成亚类(同种型),例如IgG1、IgG2、IgG3、和IgG4、IgA1、和IgA2。依照重链恒定区,不同类的免疫球蛋白分别称作α、δ、ε、γ、和μ。抗体的Fc部分直接涉及基于补体激活、C1q结合和Fc受体结合的ADCC(抗体依赖性细胞介导的细胞毒性)和CDC(补体依赖性细胞毒性)。补体激活(CDC)是通过补体因子C1q结合大多数IgG抗体亚类的Fc部分启动的。虽然抗体对补体系统的影响依赖于某些条件,但是对C1q的结合是由Fc部分中的限定结合位点引起的。此类结合位点是本领域现有技术中已知的,而且记载于例如Boackle,R.J.,等人,Nature282(1979)742-743,Lukas,T.J.,等人,J.Immunol.127(1981)2555-2560,Brunhouse,R.,Cebra,J.J.,Mol.Immunol.16(1979)907-917,Burton,D.R.,等人,Nature288(1980)338-344,Thommesen,J.E.,等人,Mol.Immunol.37(2000)995-1004,Idusogie,E.E.,等人,J.Immunol.164(2000)4178-4184,Hezareh,M.,等人,J.Virology75(2001)12161-12168,Morgan,A.,等人,Immunology86(1995)319-324,EP0307434。此类结合位点是例如L234、L235、D270、N297、E318、K320、K322、P331和P329(依照Kabat,E.A.的EU索引的编号方式,参见下文)。亚类IgG1、IgG2和IgG3的抗体通常显示补体激活及C1q和C3结合,而IgG4不激活补体系统,而且不结合C1q和C3。在一个实施方案中,依照本发明的抗体包含源自人起源的Fc部分和优选人恒定区的所有其他部分。如本文中使用的,术语“源自人起源的Fc部分”表示如下的Fc部分,其是亚类IgG1,IgG2,IgG3或IgG4的人抗体的Fc部分,优选来自人IgG1亚类的Fc部分,来自人IgG1亚类的突变Fc部分(优选在L234A+L235A上具有突变),来自人IgG4亚类的Fc部分或来自人IgG4亚类的突变Fc部分(优选在S228P上具有突变)。最优选是SEQIDNO:58(人IgG1亚类),SEQIDNO:59(具有突变L234A和L235A的人IgG1亚类),SEQIDNO:60(人IgG4亚类),或SEQIDNO:61(具有突变S228P的人IgG4亚类)的人重链恒定区。优选地,依照本发明的抗体是人IgG1亚类的或人IgG4亚类的。在一个实施方案中,依照本发明的抗体是人IgG1亚类的。在一个实施方案中,依照本发明的抗体是人IgG4亚类的。在一个实施方案中,依照本发明的抗体的特征在于恒定链是人起源的。此类恒定链是现有技术中公知的,并且例如由Kabat,E.A.(参见例如Johnson,G.andWu,T.T.,NucleicAcidsRes.28(2000)214-218)描述。例如,有用的人重链恒定区包含SEQIDNO:58的氨基酸序列。例如,有用的人轻链恒定区包含SEQIDNO:57的kappa轻链恒定区的氨基酸序列。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于a)重链可变域是SEQIDNO:7,且轻链可变域是SEQIDNO:8,b)重链可变域是SEQIDNO:15,且轻链可变域是SEQIDNO:16;或其人源化形式。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于a)重链可变域是SEQIDNO:7,且轻链可变域是SEQIDNO:8,b)重链可变域是SEQIDNO:15,且轻链可变域是SEQIDNO:16;c)重链可变域是SEQIDNO:75,且轻链可变域是SEQIDNO:76;d)重链可变域是SEQIDNO:83,且轻链可变域是SEQIDNO:84;或其人源化形式。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于重链可变域是SEQIDNO:7,且轻链可变域是SEQIDNO:8,或其人源化形式。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于a)重链可变域是SEQIDNO:23,且轻链可变域是SEQIDNO:24,或b)重链可变域是SEQIDNO:31,且轻链可变域是SEQIDNO:32,或c)重链可变域是SEQIDNO:39,且轻链可变域是SEQIDNO:40,或d)重链可变域是SEQIDNO:47,且轻链可变域是SEQIDNO:48,或e)重链可变域是SEQIDNO:55,且轻链可变域是SEQIDNO:56。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于a)重链可变域是SEQIDNO:23,且轻链可变域是SEQIDNO:24,或b)重链可变域是SEQIDNO:31,且轻链可变域是SEQIDNO:32,或c)重链可变域是SEQIDNO:39,且轻链可变域是SEQIDNO:40,或d)重链可变域是SEQIDNO:47,且轻链可变域是SEQIDNO:48。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于重链可变域是SEQIDNO:23,且轻链可变域是SEQIDNO:24。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于重链可变域是SEQIDNO:31,且轻链可变域是SEQIDNO:32。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于重链可变域是SEQIDNO:39,且轻链可变域是SEQIDNO:40。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于重链可变域是SEQIDNO:47,且轻链可变域是SEQIDNO:48。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于重链可变域是SEQIDNO:15,且轻链可变域是SEQIDNO:16,或其人源化形式。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于重链可变域是SEQIDNO:75,且轻链可变域是SEQIDNO:76;或其人源化形式。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于重链可变域是SEQIDNO:83,且轻链可变域是SEQIDNO:84;或其人源化形式。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于a)重链可变域包含SEQIDNO:1的CDR3区,SEQIDNO:2的CDR2区,和SEQIDNO:3的CDR1区,且轻链可变域包含SEQIDNO:4的CDR3区,SEQIDNO:5的CDR2区,和SEQIDNO:6的CDR1区,或b)重链可变域包含SEQIDNO:9的CDR3区,SEQIDNO:10的CDR2区,和SEQIDNO:11的CDR1区,且轻链可变域包含SEQIDNO:12的CDR3区,SEQIDNO:13的CDR2区,和SEQIDNO:14的CDR1区,或c)重链可变域包含SEQIDNO:17的CDR3区,SEQIDNO:18的CDR2区,和SEQIDNO:19的CDR1区,且轻链可变域包含SEQIDNO:20的CDR3区,SEQIDNO:21的CDR2区,和SEQIDNO:22的CDR1区,或d)重链可变域包含SEQIDNO:25的CDR3区,SEQIDNO:26的CDR2区,和SEQIDNO:27的CDR1区,且轻链可变域包含SEQIDNO:28的CDR3区,SEQIDNO:29的CDR2区,和SEQIDNO:30的CDR1区,或e)重链可变域包含SEQIDNO:33的CDR3区,SEQIDNO:34的CDR2区,和SEQIDNO:35的CDR1区,且轻链可变域包含SEQIDNO:36的CDR3区,SEQIDNO:37的CDR2区,和SEQIDNO:38的CDR1区,或f)重链可变域包含SEQIDNO:41的CDR3区,SEQIDNO:42的CDR2区,和SEQIDNO:43的CDR1区,且轻链可变域包含SEQIDNO:44的CDR3区,SEQIDNO:45的CDR2区,和SEQIDNO:46的CDR1区,或g)重链可变域包含SEQIDNO:49的CDR3区,SEQIDNO:50的CDR2区,和SEQIDNO:51的CDR1区,且轻链可变域包含SEQIDNO:52的CDR3区,SEQIDNO:53的CDR2区,和SEQIDNO:54的CDR1区;或h)重链可变域包含SEQIDNO:69的CDR3区,SEQIDNO:70的CDR2区,和SEQIDNO:71的CDR1区,且轻链可变域包含SEQIDNO:72的CDR3区,SEQIDNO:73的CDR2区,和SEQIDNO:74的CDR1区,或i)重链可变域包含SEQIDNO:77的CDR3区,SEQIDNO:78的CDR2区,和SEQIDNO:79的CDR1区,且轻链可变域包含SEQIDNO:80CDR3区,SEQIDNO:81的CDR2区,和SEQIDNO:82的CDR1区。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于a)重链可变域包含SEQIDNO:17的CDR3区,SEQIDNO:18的CDR2区,和SEQIDNO:19的CDR1区,且轻链可变域包含SEQIDNO:20的CDR3区,SEQIDNO:21的CDR2区,和SEQIDNO:22的CDR1区,或b)重链可变域包含SEQIDNO:25的CDR3区,SEQIDNO:26的CDR2区,和SEQIDNO:27的CDR1区,且轻链可变域包含SEQIDNO:28的CDR3区,SEQIDNO:29的CDR2区,和SEQIDNO:30的CDR1区,或c)重链可变域包含SEQIDNO:33的CDR3区,SEQIDNO:34的CDR2区,和SEQIDNO:35的CDR1区,且轻链可变域包含SEQIDNO:36的CDR3区,SEQIDNO:37的CDR2区,和SEQIDNO:38的CDR1区,或d)重链可变域包含SEQIDNO:41的CDR3区,SEQIDNO:42的CDR2区,和SEQIDNO:43的CDR1区,且轻链可变域包含SEQIDNO:44的CDR3区,SEQIDNO:45的CDR2区,和SEQIDNO:46的CDR1区,或e)重链可变域包含SEQIDNO:49的CDR3区,SEQIDNO:50的CDR2区,和SEQIDNO:51的CDR1区,且轻链可变域包含SEQIDNO:52的CDR3区,SEQIDNO:53的CDR2区,和SEQIDNO:54的CDR1区。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于a)重链可变域包含SEQIDNO:17的CDR3区,SEQIDNO:18的CDR2区,和SEQIDNO:19的CDR1区,且轻链可变域包含SEQIDNO:20的CDR3区,SEQIDNO:21的CDR2区,和SEQIDNO:22的CDR1区,或b)重链可变域包含SEQIDNO:25的CDR3区,SEQIDNO:26的CDR2区,和SEQIDNO:27的CDR1区,且轻链可变域包含SEQIDNO:28的CDR3区,SEQIDNO:29的CDR2区,和SEQIDNO:30的CDR1区,或c)重链可变域包含SEQIDNO:33的CDR3区,SEQIDNO:34的CDR2区,和SEQIDNO:35的CDR1区,且轻链可变域包含SEQIDNO:36的CDR3区,SEQIDNO:37的CDR2区,和SEQIDNO:38的CDR1区,或d)重链可变域包含SEQIDNO:41的CDR3区,SEQIDNO:42的CDR2区,和SEQIDNO:43的CDR1区,且轻链可变域包含SEQIDNO:44的CDR3区,SEQIDNO:45的CDR2区,和SEQIDNO:46的CDR1区。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于重链可变域包含SEQIDNO:17的CDR3区,SEQIDNO:18的CDR2区,和SEQIDNO:19的CDR1区,且轻链可变域包含SEQIDNO:20的CDR3区,SEQIDNO:21的CDR2区,和SEQIDNO:22的CDR1区。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于重链可变域包含SEQIDNO:25的CDR3区,SEQIDNO:26的CDR2区,和SEQIDNO:27的CDR1区,且轻链可变域包含SEQIDNO:28的CDR3区,SEQIDNO:29的CDR2区,和SEQIDNO:30的CDR1区。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于重链可变域包含SEQIDNO:33的CDR3区,SEQIDNO:34的CDR2区,和SEQIDNO:35的CDR1区,且轻链可变域包含SEQIDNO:36的CDR3区,SEQIDNO:37的CDR2区,和SEQIDNO:38的CDR1区。本发明的另一个方面是与结合人CSF-1R的抗体的联合疗法,其特征在于重链可变域包含SEQIDNO:41的CDR3区,SEQIDNO:42的CDR2区,和SEQIDNO:43的CDR1区,且轻链可变域包含SEQIDNO:44的CDR3区,SEQIDNO:45的CDR2区,和SEQIDNO:46的CDR1区。本发明包括用于治疗需要治疗的患者的方法,其特征在于对患者施用治疗有效量的依照本发明的抗体。本发明包括依照本发明的抗体用于描述的疗法的用途。本发明的一个优选的实施方案是在治疗“CSF-1R介导的疾病”中使用的本发明的CSF-1R抗体或用于制备在治疗“CSF-1R介导的疾病”中使用的药物的本发明的CSF-1R抗体,所述CSF-1R介导的疾病可以如下描述:存在着肿瘤生长和转移中可能牵涉CSF-1R信号传导的3种截然不同的机制。第一种是已经在女性生殖系统(乳房,卵巢,子宫内膜,宫颈)中起源的肿瘤细胞中发现了CSF配体和受体的表达(Scholl,S.M.等,J.Natl.CancerInst.86(1994)120-126;Kacinski,B.M.,Mol.Reprod.Dev.46(1997)71-74;Ngan,H.Y.等,Eur.J.Cancer35(1999)1546-1550;Kirma,N.等,CancerRes67(2007)1918-1926),并且表达已经与乳腺癌异种移植物生长及不良的乳腺癌患者预后联系起来。两个点突变在一项研究中测试的约10-20%的急性髓细胞性白血病,慢性髓细胞性白血病和脊髓发育不良(myelodysplasia)患者中在CSF-1R中看到,并且发现突变之一破坏受体翻转(Ridge,S.A.等,Proc.Natl.Acad.SciUSA87(1990)1377-1380)。然而,突变的发生率在后来的研究中不能得到确认(Abu-Duhier,F.M.等,Br.J.Haematol.120(2003)464-470)。在肝细胞癌(Yang,D.H.等,HepatobiliaryPancreat.Dis.Int.3(2004)86-89)和特发性骨髓纤维化(idiopathicmyelofibrosis)(Abu-Duhier,F.M.等,Br.J.Haematol.120(2003)464-470)的一些病历中也发现了突变。最近,在自成髓单核细胞性白血病(myelomonoblasticleukemia)患者衍生的GDM-1细胞系中,鉴定出CSF-1R中的Y571D突变(Chase,A.等,Leukemia23(2009)358-364)。色素沉着绒毛结节性滑膜炎(PVNS)和腱鞘巨细胞瘤(TGCT)可以因使M-CSF基因与胶原基因COL6A3融合并导致M-CSF过表达的易位而发生(West,R.B.,等人,Proc.Natl.Acad.Sci.USA103(2006)690-695)。有人提出景观效应(landscapeeffect)与导致由受表达M-CSF的细胞吸引的单核细胞组成的肿瘤块有关。TGCT是较小的肿瘤,能相对容易地自指(主要发生处)切除。PVNS更具攻击性,因为它能在大关节中重现,而且不易通过手术来控制。第二种机制基于阻断骨中的转移位点处经由M-CSF/CSF-1R的信号传导,其诱导破骨细胞发生、骨再吸收和溶骨性骨损害。乳腺癌、多发性骨髓瘤和肺癌是已经发现转移至骨并引起溶骨性骨病导致骨骼并发症的癌症的例子。由肿瘤细胞和基质释放的M-CSF与受体活化物核因子κ-B配体-RANKL合作诱导造血髓样单核细胞祖先分化成成熟破骨细胞。在此过程中,M-CSF通过给予破骨细胞以存活信号来起许可因子的作用(Tanaka,S.,等人,J.Clin.Invest.91(1993)257-263)。在破骨细胞分化和成熟期间用抗CSF-1R抗体抑制CSF-1R活性有可能预防转移性疾病中引起溶骨性疾病及有关骨骼相关事件的破骨细胞活性失衡。虽然乳腺癌、肺癌和多发性骨髓瘤通常导致溶骨性损害,但是在前列腺癌中,转移至骨最初具有成骨细胞性外观,其中升高的骨形成活性产生与正常骨的典型层状结构不同的“编织骨”。在疾病进展期间,骨损害展示显著的溶骨成分以及高血清水平的骨再吸收,而且提示抗再吸收疗法可能是有用的。二膦酸盐已经显示出抑制溶骨性损害形成及减少骨骼相关事件数目(只在具有激素不应性转移性前列腺癌的男性中),但是在这点上,它们对成骨细胞损害的效果是有争议的,而且二膦酸盐至今未显示在预防骨转移或激素响应性前列腺癌中是有益的。抗再吸收剂在混合型溶骨/成骨细胞前列腺癌中的效果仍在进行临床研究(Choueiri,M.B.,等人,CancerMetastasisRev.25(2006)601-609;Vessella,R.L.和Corey,E.,Clin.CancerRes.12(20Pt2)(2006)6285s-6290s)。第三种机制基于最近在乳腺癌、前列腺癌、卵巢癌和宫颈癌的实体瘤中找到的肿瘤相关巨噬细胞(TAM)与较差的预后有关联的观察结果(Bingle,L.,等人,J.Pathol.196(2002)254-265;Pollard,J.W.,Nat.Rev.Cancer4(2004)71-78)。巨噬细胞被M-CSF和其它趋化因子募集至肿瘤。然后巨噬细胞可经由分泌血管发生性因子、蛋白酶和其它生长因子和细胞因子来促进肿瘤进展,而且可通过抑制CSF-1R信号传导来阻断。最近,Zins,K.,等人,CancerRes.67(2007)1038-1045)显示了肿瘤坏死因子α(TNFα)、M-CSF或二者组合的siRNA的表达会在小鼠异种移植物模型中在肿瘤内注射相应siRNA后将肿瘤生长降低34%到50%。由人SW620细胞分泌的靶向TNFα的siRNA降低小鼠M-CSF水平并导致肿瘤中的巨噬细胞减少。另外,用针对M-CSF的抗原结合片段处理MCF7肿瘤异种移植物在与化疗剂组合给予时确实导致40%肿瘤生长抑制,逆转对化疗剂的抗性及改善小鼠存活(Paulus,P.,等人,CancerRes.66(2006)4349-4356)。TAM是慢性炎症和癌症之间出现的联系的唯一例子。炎症和癌症之间的联系有别的证据,如许多慢性病与升高的癌症风险有关,在慢性炎症位点处发生癌症,在许多癌症中发现炎症的化学介导物;消除炎症的细胞或化学介导物则抑制实验性癌症的发生,而且长期使用抗炎剂降低一些癌症的风险。许多炎性状况存在与癌症的联系,其中有幽门螺旋杆菌(H.pylori)诱导的胃炎对于胃癌,血吸虫病对于膀胱癌,HHVX对于卡波西(Kaposi)氏肉瘤,子宫内膜异位对于卵巢癌和前列腺炎对于前列腺癌(Balkwill,F.,等人,CancerCell7(2005)211-217)。巨噬细胞是慢性炎症中的关键细胞且有差异地响应其微环境。有两类巨噬细胞被认为是连续的功能状态的极端:M1巨噬细胞涉及1型反应。这些反应涉及微生物产物引起的激活及因此对致病性微生物的杀伤,产生反应氧中介物。另一个极端是M2巨噬细胞,其涉及2型反应,促进细胞增殖,调节炎症和适应性免疫及促进组织重塑、血管发生和修复(Mantovani,A.,等人,TrendsImmunol.25(2004)677-686)。导致瘤形成建立的慢性炎症通常与M2巨噬细胞有关。介导炎性反应的一种关键细胞因子是TNFα,顾名思义能在高剂量刺激抗肿瘤免疫和出血性坏死,但最近还发现由肿瘤细胞表达且起肿瘤促进物的作用(Zins,K.,等人,CancerRes.67(2007)1038-1045;Balkwill,F.,CancerMetastasisRev.25(2006)409-416)。仍然需要更好地了解巨噬细胞关于肿瘤的具体作用,包括对其功能的潜在空间和时间依赖性及与特定肿瘤类型的关联。如此,本发明的一个实施方案是本发明的CSF-1R抗体,用于治疗癌症。如本文中使用的,术语“癌症”可以是例如肺癌、非小细胞肺(NSCL)癌、支气管肺泡细胞肺癌、骨癌、胰腺癌、皮肤癌、头颈癌、皮肤或眼内黑素瘤、子宫癌、卵巢癌、直肠癌、肛门区癌、胃癌、胃的癌症、结肠癌、乳腺癌、子宫的癌症、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、阴门癌、何杰金(Hodgkin)氏病、食管癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、前列腺癌、膀胱癌、肾或输尿管癌、肾细胞癌、肾盂癌、间皮瘤、肝细胞癌、胆囊癌、中枢神经系统(CNS)新生物、脊柱轴肿瘤、脑干胶质瘤、多形性成胶质细胞瘤、星形细胞瘤、施旺细胞瘤、室管膜瘤、髓母细胞瘤、脑脊膜瘤、鳞状细胞癌、垂体腺瘤、淋巴瘤、淋巴细胞性白血病,包括任何上述癌症的顽固形式,或一种或多种上述癌症的组合。优选地,此类癌症是乳腺癌、卵巢癌、宫颈癌、肺癌或前列腺癌。优选地,此类癌症进一步特征在于CSF-1或CSF-1R表达或过表达。本发明的又一个实施方案是本发明的CSF-1R抗体,用于同时治疗原发性肿瘤和新转移。如此,本发明的另一个方面是本发明的CSF-1R抗体,用于治疗牙周炎、组织细胞增多病X、骨质疏松症、佩吉特(Paget)氏骨病(PDB)、癌症治疗所致骨丢失、假体周围骨质溶解、糖皮质激素诱导的骨质疏松、类风湿性关节炎、银屑病关节炎、骨关节炎、炎性关节病(inflammatoryarthridities)、和炎症。Rabello,D.,等人,Biochem.Biophys.Res.Commun.347(2006)791-796证明了CSF1基因中的SNP展现与攻击性牙周炎(由于牙槽骨的再吸收引起牙丧失的一种牙周组织炎性疾病)的正关联。组织细胞增多病X(也称作朗格汉斯(Langerhans)氏细胞组织细胞增多病,LCH)是朗格汉斯树突细胞(其表现出在骨和额外的骨LCH损伤中分化成破骨细胞)的一种增殖性疾病。朗格汉斯细胞衍生自循环中的单核细胞。发现在血清和损伤中测量到的升高的M-CSF水平与疾病严重性有关联(daCosta,C.E.,等人,J.Exp.Med.201(2005)687-693)。该疾病主要发生于儿科患者群,而且在该疾病变成系统性或复发时不得不用化疗来治疗。骨质疏松的病理生理学是由形成骨的成骨细胞损失和破骨细胞依赖性骨再吸收升高介导的。支持性数据记载于Cenci等人,显示了抗M-CSF抗体注射在切除了卵巢的小鼠中保持骨密度且抑制骨再吸收(Cenci,S.,等人,J.Clin.Invest.105(2000)1279-1287)。最近,鉴定出雌激素缺乏所致绝经后骨丢失之间的一种潜在联系,而且发现生成TNFα的T细胞的存在影响骨代谢(Roggia,C.,等人,MinervaMed.95(2004)125-132)。一种可能的机制是在体内TNFα对M-CSF的诱导。M-CSF在TNF-α诱导的破骨细胞发生中的重要作用得到了下述效果的证实,即针对M-CSF的抗体在小鼠中阻断TNFα诱导的骨质溶解,由此使得CSF-1R信号传导的抑制物成为炎性关节炎的潜在靶物(Kitaura,H.,等人,J.Clin.Invest.115(2005)3418-3427)。佩吉特氏骨病(PDB)是骨质疏松之后第二位最常见的骨代谢病症,其中骨周转升高的灶性异常导致并发症诸如骨痛、畸形、病理性骨折和耳聋。已经鉴定了四种基因中的突变调节正常破骨细胞功能且使个体易患PDB及相关病症:编码核因子(NF)κB的受体激活物(RANK)-(破骨细胞功能的关键调节物)的TNFRSF11A中的插入突变,编码骨保护素(RANK配体的的诱饵受体)的TNFRSF11B的失活突变,编码NFκB途径中的一种重要支架蛋白的隔离体(sequestosome)1基因(SQSTM1)的突变,和含缬酪肽蛋白(VCP)基因中的突变。此基因编码VCP,其在使NFκB抑制剂靶向蛋白酶体所致降解中具有作用(Daroszewska,A.,Ralston,S.H.,Nat.Clin.Pract.Rheumatol.2(2006)270-277)。被靶向的CSF-1R抑制物提供机会来间接阻断RANKL信号传导的失调及对当前使用的二膦酸盐添加另外的治疗选项。癌症治疗诱导的骨丢失(尤其是在乳腺癌和前列腺癌患者中)是靶向CSF-1R抑制剂能预防骨丢失的另一种适应证(Lester,J.E.,等人,Br.J.Cancer94(2006)30-35)。随着早期乳腺癌的预后改善,辅助疗法的长期后果变得更加重要,因为一些疗法(包括化疗、照射、芳香酶抑制剂和卵巢切除)通过降低骨矿物质密度而影响骨代谢,导致骨质疏松及相关骨折风险升高(Lester,J.E.,等人,Br.J.Cancer94(2006)30-35)。与乳腺癌中的辅助芳香酶抑制剂疗法等同的是前列腺癌中的雄激素消融疗法,其导致骨矿物质密度损失和骨质疏松相关骨折风险显著升高(Stoch,S.A.,等人,J.Clin.Endocrinol.Metab.86(2001)2787-2791)。CSF-1R信号传导的靶向抑制在其它适应证中以及在靶定细胞类型包括破骨细胞和巨噬细胞(例如治疗响应类风湿性关节炎所致关节置换术的特定并发症)时可能是有益的。假体周骨丢失及因此假体松动所致植入失败是关节置换术的一种主要并发症,而且需要反复手术,给患者个人和保健系统带来较高的社会经济负担。至今,没有批准的药物疗法来预防或抑制假体周骨质溶解(Drees,P.,等人,Nat.Clin.Pract.Rheumatol.3(2007)165-171)。糖皮质激素诱导的骨质疏松(GIOP)是另一种适应证,其中CSF-1R抑制剂能预防因各种状况(例如慢性阻塞性肺病、哮喘和类风湿性关节炎)而给予长期使用糖皮质类固醇后的骨丢失(Guzman-Clark,J.R.,等人,ArthritisRheum.57(2007)140-146;Feldstein,A.C.,等人,Osteoporos.Int.16(2005)2168-2174)。类风湿性关节炎、银屑病关节炎和炎性关节病本身是CSF-1R信号传导抑制剂的潜在适应证,原因在于它们由巨噬细胞成分组成及不同程度的骨破坏(Ritchlin,C.T.,等人,J.Clin.Invest.111(2003)821-831)。骨关节炎和类风湿性关节炎是由巨噬细胞在结缔组织中积累和巨噬细胞浸润入滑液(这至少部分是由M-CSF介导的)引起的炎性自身免疫病。Campbell,I.K.,等人,J.Leukoc.Biol.68(2000)144-150证明了M-CSF在体外由人关节组织细胞(软骨细胞、滑液成纤维细胞)生成,而且发现于类风湿性关节炎患者的滑液,提示它有助于滑膜组织增殖和巨噬细胞浸润,这与该疾病的发病机制有关。抑制CSF-1R信号传导有可能控制关节中的巨噬细胞数目及减轻来自有关骨破坏的疼痛。为了使不利影响最小化及进一步了解CSF-1R信号传导在这些适应症中的影响,一种方法是特异性抑制CSF-1R,而不靶向无数的其它激酶,诸如Raf激酶。最近的文献报告将升高的循环M-CSF与慢性冠状动脉病中的动脉粥样硬化进展和较差的预后关联起来(Saitoh,T.,等人,J.Am.Coll.Cardiol.35(2000)655-665;Ikonomidis,I.,等人,Eur.Heart.J.26(2005)1618-1624);M-CSF通过帮助形成表达CSF-1R且代表初始斑的泡沫细胞(摄入了氧化型LDL的巨噬细胞)来影响动脉粥样硬化过程(Murayama,T.,等人,Circulation99(1999)1740-1746)。在激活的小胶质中发现M-CSF和CSF-1R的表达和信号传导。小胶质(即中枢神经系统的驻留巨噬细胞)可被多种损伤激活,包括感染和外伤。M-CSF被认为是脑中炎症应答的一种关键调节物,而且M-CSF水平在HIV-1、脑炎、阿尔茨海默(Alzheimer)氏病(AD)和脑瘤中升高。小胶质增生(microgliosis)(作为通过M-CSF/CSF-1R的自分泌信号传导的后果)导致对炎性细胞因子和氮氧化物释放的诱导,如通过例如使用实验性神经元损害模型证明的(Hao,A.J.,等人,Neuroscience112(2002)889-900;Murphy,G.M.,Jr.,等人,J.Biol.Chem.273(1998)20967-20971)。发现CSF-1R表达升高的小胶质在AD中及在AD的淀粉样前体蛋白V717F转基因小鼠模型中包围斑(Murphy,G.M.,Jr.,等人,Am.J.Pathol.157(2000)895-904)。另一方面脑中小胶质较少的op/op小鼠导致与正常对照相比A-β的小纤维沉积和神经元损失,提示小胶质确实在op/op小鼠中的AD缺失的发生中具有神经保护功能(Kaku,M.,等人,BrainRes.BrainRes.Protoc.12(2003)104-108)。M-CSF和CSF-1R的表达和信号传导与炎性肠病(IBD)有关(WO2005/046657)。术语“炎性肠病”指严重的、慢性的肠道病症,特征在于胃肠道中多个位点处的慢性炎症,而且具体包括溃疡性结肠炎(UC)和克罗恩(Crohn)氏病。本发明包括用于治疗癌症的与结合人CSF-1R的抗体的联合疗法,所述抗体特征在于上文提及的表位结合特性或备选地上文提及的氨基酸序列和氨基酸序列片段。本发明包括用于治疗骨损失的与结合人CSF-1R的抗体的联合疗法,所述抗体特征在于上文提及的表位结合特性或备选地上文提及的氨基酸序列和氨基酸序列片段。本发明包括用于预防或治疗转移的与结合人CSF-1R的抗体的联合疗法,所述抗体特征在于上文提及的表位结合特性或备选地上文提及的氨基酸序列和氨基酸序列片段。本发明包括用于治疗炎性疾病的与结合人CSF-1R的抗体的联合疗法,所述抗体特征在于上文提及的表位结合特性或备选地上文提及的氨基酸序列和氨基酸序列片段。本发明包括抗体用于如本文中描述的癌症的联合治疗或备选用于制造药物的用途,所述药物用于如本文中描述的癌症的联合治疗,所述抗体特征在于上文提及的表位结合特性或备选地上文提及的氨基酸序列和氨基酸序列片段。本发明包括抗体用于骨损失的如本文中描述的联合治疗或备选用于制造药物的用途,所述药物用于骨损失的如本文中描述的联合治疗,所述抗体特征在于上文提及的表位结合特性或备选地上文提及的氨基酸序列和氨基酸序列片段。本发明包括抗体用于用如本文中描述的组合预防或治疗转移或备选用于制造药物的用途,所述药物用于用如本文中描述的组合预防或治疗转移,所述抗体特征在于上文提及的表位结合特性或备选地上文提及的氨基酸序列和氨基酸序列片段。本发明包括抗体用于如本文中描述的炎性疾病的联合治疗或备选用于制造药物的用途,所述药物用于如本文中描述的炎性疾病的联合治疗,所述抗体特征在于上文提及的表位结合特性或备选地上文提及的氨基酸序列和氨基酸序列片段。优选地,通过重组手段来生成依照本发明的抗体。此类方法是本领域现有技术中广泛知道的,而且包括原核和真核细胞中的蛋白质表达及随后分离抗体多肽和通常纯化至药学可接受纯度。为了蛋白质表达,通过标准方法将编码轻和重链或其片段的核酸插入表达载体中。在适宜的原核或真核宿主细胞中实施表达,诸如CHO细胞、NS0细胞、SP2/0细胞、HEK293细胞、COS细胞、酵母、或大肠杆菌细胞,并自细胞(自上清液或在细胞裂解后)回收抗体。抗体的重组生成是本领域现有技术中公知的,而且记载于例如综述性论文Makrides,S.C.,ProteinExpr.Purif.17(1999)183-202;Geisse,S.,等人,ProteinExpr.Purif.8(1996)271-282;Kaufman,R.J.,Mol.Biotechnol.16(2000)151-161;Werner,R.G.,DrugRes.48(1998)870-880。抗体可以存在于完整细胞中、细胞溶胞物中、或部分纯化的或实质性纯的形式。通过标准技术,包括碱/SDS处理、CsCl成带、柱层析、琼脂糖凝胶电泳、和本领域公知的其它技术实施纯化,以消除其它细胞成分或其它污染物,例如其它细胞核酸或蛋白质。参见Ausubel,F.,等人编,CurrentProtocolsinMolecularBiology,GreenePublishingandWileyInterscience,NewYork(1987)。NS0细胞中的表达记载于例如Barnes,L.M.,等人,Cytotechnology32(2000)109-123;Barnes,L.M.,等人,Biotech.Bioeng.73(2001)261-270。瞬时表达记载于例如Durocher,Y.,等人,Nucl.Acids.Res.30(2002)E9。可变域的克隆记载于Orlandi,R.,等人,Proc.Natl.Acad.Sci.USA86(1989)3833-3837;Carter,P.,等人,Proc.Natl.Acad.Sci.USA89(1992)4285-4289;Norderhaug,L.,等人,J.Immunol.Methods204(1997)77-87。一种优选的瞬时表达系统(HEK293)记载于Schlaeger,E.-J.和Christensen,K.,Cytotechnology30(1999)71-83及Schlaeger,E.-J.,J.Immunol.Methods194(1996)191-199。通过本领域已知的多种技术来制备编码抗CSF-1R抗体氨基酸序列变体的核酸分子。这些方法包括但不限于自天然来源分离(在天然存在氨基酸序列变体的情况中)或通过对先前制备的变体或非变体形式的人源化抗CSF-1R抗体进行的寡核苷酸介导的(或定点)诱变、PCR诱变、和盒式诱变来制备。将依照本发明的重和轻链可变域与启动子、翻译起始、恒定区、3'非翻译区、聚腺苷酸化、和翻译终止的序列组合以形成表达载体构建物。可以将重和轻链表达构建物组合入单一载体中,共转染,序贯转染,或分开转染入宿主细胞中,然后融合以形成表达双链的单一宿主细胞。在另一个方面,本发明提供含有一种或一组本发明的单克隆抗体或其抗原结合部分,与药学可接受载体一起配制的组合物,例如药物组合物。如本文中使用的,“药学可接受载体”包括任何和所有生理学相容的溶剂、分散介质、涂层、抗细菌和抗真菌剂、等张和吸收/再吸收延迟剂、等等。优选地,载体适合于注射或输注。可以通过本领域已知的多种方法来施用本发明的组合物。正如技术人员会领会的,施用的路径和/或模式会随期望的结果而变化。药学可接受载体包括无菌水溶液或分散体和用于制备无菌可注射溶液或分散体的无菌粉末。此类介质和药剂对药学活性物质的使用是本领域已知的。在水之外,载体可以是例如等张缓冲盐水溶液。不管选择的施用路径,通过本领域技术人员知道的常规方法将可以以合适水合形式使用的本发明的化合物和/或本发明的药物组合物配制成药学可接受剂量形式。本发明的药物组合物中活性组分的实际剂量水平可以变化以获得对特定患者、组合物、和施用模式有效实现期望治疗响应,对患者没有毒性的活性组分量(有效量)。选择的剂量水平会取决于多种药动学因素,包括采用的本发明特定组合物或其酯、盐或酰胺的活性、施用路径、施用时间、采用的特定化合物的排泄速率、与采用的特定组合物组合使用的其它药物、化合物和/或材料、治疗的患者的年龄、性别、重量、状况、一般健康和在先医学史、及医学领域公知的类似因素。术语“治疗方法”或其等同形式在应用于例如癌症时指设计为减少或消除患者中的癌细胞数目,或减轻癌症症状的作用方案或过程。“治疗癌症或另一种增殖性病症的方法”不一定意味着癌细胞或其他病症实际上会被消除,细胞数目或病症实际上会被减少,或癌症或其他病症的症状实际上会被减轻。经常,治疗癌症的方法甚至会以较低的成功概率实施,但是鉴于患者的医学史和评估的存活期望,仍然视为诱导总体有益的作用过程。术语“组合施用”或“共施用”指施用抗CSF-1R,和化疗剂,放射疗法和/或癌症免疫疗法,例如以分开的配制剂/应用(或作为一种单一配制剂/应用)。共施用可以使同时或以任何次序序贯的,其中优选存在着两种(或所有)活性剂同时施加其生物学活性的时间段。所述抗体和所述其他药剂同时或序贯共施用(例如静脉内(i.v.)通过连续输注)。在序贯施用两种治疗剂时,剂量或是在同一天在两次分开施用中施用,或是在第1天施用一种药剂,而在第2天至第7天,优选在第2天至第4天施用第二种。如此,在一个实施方案中,术语“序贯”意味着在第一种组分的剂量后7天内,优选在第一种组分的剂量后4天内;且术语“同时”意味着在相同时间。术语“共施用”就抗CSF-1R抗体的维持剂量而言,意味着若治疗周期适合于两种药物,维持剂量可以同时共施用,例如每周。或者例如别的药剂例如每第一至第三天施用,而所述抗体每周施用。或者,序贯共施用维持剂量,在一天或几天内。不证自明的是抗体以“治疗有效量”(或仅“有效量”)对患者施用,所述治疗有效量是会引发由研究人员、兽医、医生或其他临床医生寻求的组织、系统、动物或人的生物学或医学响应的相应化合物或组合的量。共施用的量和共施用的时机会取决于治疗患者的类型(人种,性别,年龄,重量,等等)和状况以及治疗的疾病或状况的严重性。所述抗CSF-1R抗体和其他药剂适合于一次或在一系列治疗里,例如在同一天或在以后的日子对患者共施用。根据疾病的类型和严重性,约0.1mg/kg至50mg/kg(例如0.1-20mg/kg)的所述抗CSF-1R抗体是对患者共施用两种药物的初始候选剂量。本发明包括依照本发明的抗体用于治疗患有癌症,特别是患有结肠、肺或胰腺癌的患者的用途。本发明还包括用于治疗患有此类疾病的患者的方法。本发明进一步包括制造药物组合物的方法及依照本发明的抗体用于此类方法的用途,所述药物组合包含有效量的依照本发明的抗体以及药学可接受载体。本发明进一步提供了有效量的依照本发明的抗体用于制造药剂,优选与药学可接受载体一起的用途,所述药剂用于治疗患有癌症的患者。本发明还提供了有效量的依照本发明的抗体用于制造药剂,优选与药学可接受载体一起的用途,所述药剂用于治疗患有癌症的患者。提供以下实施例,序列表和图以帮助理解本发明,其真正的范围在所附权利要求书中列出。应当理解,可以在不偏离本发明精神的前提下对列出的方案进行修改。序列描述SEQIDNO:1重链CDR3,Mab2F11SEQIDNO:2重链CDR2,Mab2F11SEQIDNO:3重链CDR1,Mab2F11SEQIDNO:4轻链CDR3,Mab2F11SEQIDNO:5轻链CDR2,Mab2F11SEQIDNO:6轻链CDR1,Mab2F11SEQIDNO:7重链可变域,Mab2F11SEQIDNO:8轻链可变域,Mab2F11SEQIDNO:9重链CDR3,Mab2E10SEQIDNO:10重链CDR2,Mab2E10SEQIDNO:11重链CDR1,Mab2E10SEQIDNO:12轻链CDR3,Mab2E10SEQIDNO:13轻链CDR2,Mab2E10SEQIDNO:14轻链CDR1,Mab2E10SEQIDNO:15重链可变域,Mab2E10SEQIDNO:16轻链可变域,Mab2E10SEQIDNO:17重链CDR3,hMab2F11-c11SEQIDNO:18重链CDR2,hMab2F11-c11SEQIDNO:19重链CDR1,hMab2F11-c11SEQIDNO:20轻链CDR3,hMab2F11-c11SEQIDNO:21轻链CDR2,hMab2F11-c11SEQIDNO:22轻链CDR1,hMab2F11-c11SEQIDNO:23重链可变域,hMab2F11-c11SEQIDNO:24轻链可变域,hMab2F11-c11SEQIDNO:25重链CDR3,hMab2F11-d8SEQIDNO:26重链CDR2,hMab2F11-d8SEQIDNO:27重链CDR1,hMab2F11-d8SEQIDNO:28轻链CDR3,hMab2F11-d8SEQIDNO:29轻链CDR2,hMab2F11-d8SEQIDNO:30轻链CDR1,hMab2F11-d8SEQIDNO:31重链可变域,hMab2F11-d8SEQIDNO:32轻链可变域,hMab2F11-d8SEQIDNO:33重链CDR3,hMab2F11-e7SEQIDNO:34重链CDR2,hMab2F11-e7SEQIDNO:35重链CDR1,hMab2F11-e7SEQIDNO:36轻链CDR3,hMab2F11-e7SEQIDNO:37轻链CDR2,hMab2F11-e7SEQIDNO:38轻链CDR1,hMab2F11-e7SEQIDNO:39重链可变域,hMab2F11-e7SEQIDNO:40轻链可变域,hMab2F11-e7SEQIDNO:41重链CDR3,hMab2F11-f12SEQIDNO:42重链CDR2,hMab2F11-f12SEQIDNO:43重链CDR1,hMab2F11-f12SEQIDNO:44轻链CDR3,hMab2F11-f12SEQIDNO:45轻链CDR2,hMab2F11-f12SEQIDNO:46轻链CDR1,hMab2F11-f12SEQIDNO:47重链可变域,hMab2F11-f12SEQIDNO:48轻链可变域,hMab2F11-f12SEQIDNO:49重链CDR3,hMab2F11-g1SEQIDNO:50重链CDR2,hMab2F11-g1SEQIDNO:51重链CDR1,hMab2F11-g1SEQIDNO:52轻链CDR3,hMab2F11-g1SEQIDNO:53轻链CDR2,hMab2F11-g1SEQIDNO:54轻链CDR1,hMab2F11-g1SEQIDNO:55重链可变域,hMab2F11-g1SEQIDNO:56轻链可变域,hMab2F11-g1SEQIDNO:57人kappa轻链恒定区SEQIDNO:58源自IgG1的人重链恒定区SEQIDNO:59源自L234A和L235A上突变的IgG1的人重链恒定区SEQIDNO:60源自IgG4的人重链恒定区SEQIDNO:61源自S228P上突变的IgG4的人重链恒定区SEQIDNO:62人野生型CSF-1R(wtCSF-1R)SEQIDNO:63人突变体CSF-1RL301SY969FSEQIDNO:64人CSF-1R胞外域(域D1-D5)SEQIDNO:65人CSF-1R片段delD4SEQIDNO:66人CSF-1R片段域D1-D3SEQIDNO:67信号肽SEQIDNO:68引物SEQIDNO:69重链CDR3,Mab1G10SEQIDNO:70重链CDR2,Mab1G10SEQIDNO:71重链CDR1,Mab1G10SEQIDNO:72轻链CDR3,Mab1G10SEQIDNO:73轻链CDR2,Mab1G10SEQIDNO:74轻链CDR1,Mab1G10SEQIDNO:75重链可变域,Mab1G10SEQIDNO:76轻链可变域,Mab1G10SEQIDNO:77重链CDR3,Mab2H7SEQIDNO:78重链CDR2,Mab2H7SEQIDNO:79重链CDR1,Mab2H7SEQIDNO:80轻链CDR3,Mab2H7SEQIDNO:81轻链CDR2,Mab2H7SEQIDNO:82轻链CDR1,Mab2H7SEQIDNO:83重链可变域,Mab2H7SEQIDNO:84轻链可变域,Mab2H7SEQIDNO:85人CSF-1R片段域D4-D5SEQIDNO:86人CSF-1SEQIDNO:87人IL-34SEQIDNO:88CP-870,893(U.S.7,338,660的抗体21.4.1)的重链可变域SEQIDNO:89CP-870,893(U.S.7,338,660的抗体21.4.1)的轻链可变域SEQIDNO:90人源化S2C6重链可变域变体SEQIDNO:91人源化S2C6轻链可变域变体在下文中描述了本发明的实施方案:1.A)一种结合人CSF-1R的抗体,其特征在于结合人CSF-1R的胞外域的(二聚化)域D4至D5(SEQIDNo:85)以用于a)抑制CSF-1R配体依赖性和/或CSF-1R配体不依赖性CSF-1R表达型肿瘤细胞的细胞增殖;b)抑制具有CSF-1配体依赖性和/或CSF-1配体不依赖性CSF-1R表达型巨噬细胞浸润物的肿瘤的细胞增殖;c)抑制(CSF-1R配体依赖性和/或CSF1R配体不依赖性)CSF-1R表达型单核细胞和巨噬细胞的细胞存活;和/或d)抑制(CSF-1R配体依赖性和/或CSF-1R配体不依赖性)CSF-1R表达型单核细胞向巨噬细胞的细胞分化;其中所述抗CSF-1R抗体与化疗剂、放射、和/或癌症免疫疗法组合施用;或B)一种结合人CSF-1R的抗体,其特征在于结合人CSF-1R的胞外域的域D4至D5(SEQIDNo:85)以用于治疗具有CSF-1R表达肿瘤或具有含CSF-1R表达型巨噬细胞浸润物的肿瘤的患者,其中所述肿瘤特征在于CSF-1R配体增加,其中所述抗CSF-1R抗体与化疗剂、放射、和/或癌症免疫疗法组合施用。2.A)结合人CSF-1R的抗体用于制造药物的用途,所述抗体特征在于结合人CSF-1R的胞外域的(二聚化)域D4至D5(SEQIDNo:85),所述药物用于a)抑制CSF-1R配体依赖性和/或CSF-1R配体不依赖性CSF-1R表达肿瘤细胞的细胞增殖;b)抑制具有CSF-1配体依赖性和/或CSF-1配体不依赖性CSF-1R表达型巨噬细胞浸润物的肿瘤的细胞增殖;c)抑制(CSF-1R配体依赖性和/或CSF1R配体不依赖性)CSF-1R表达型单核细胞和巨噬细胞的细胞存活;和/或d)抑制(CSF-1R配体依赖性和/或CSF-1R配体不依赖性)CSF-1R表达型单核细胞向巨噬细胞的细胞分化;其中所述抗CSF-1R抗体与化疗剂、放射、和/或癌症免疫疗法组合施用;或B)结合人CSF-1R的抗体用于制造药物的用途,所述抗体特征在于结合人CSF-1R的胞外域的域D4至D5(SEQIDNo:85),所述药物用于治疗具有CSF-1R表达肿瘤或具有含CSF-1R表达型巨噬细胞浸润物的肿瘤的患者,其中所述肿瘤特征在于CSF-1R配体增加,其中所述抗CSF-1R抗体与化疗剂、放射、和/或癌症免疫疗法组合施用。3.依照实施方案1或2的抗体或用途,其中所述化疗剂选自下组:紫杉烷类(taxanes)(帕利他赛(paclitaxel)(Taxol)、多西他赛(docetaxel)(Taxotere)、经修饰的帕利他赛(Abraxane和Opaxio))、多柔比星(doxorubicin)、经修饰的多柔比星(Caelyx或Doxil))、舒尼替尼(舒尼替尼)(Sutent)、索拉非尼(索拉非尼)(Nexavar)、和其它多激酶(multikinase)抑制剂、奥沙利铂(oxaliplatin)、顺铂(cisplatin)、卡铂、依托泊苷(etoposide)、吉西他滨(gemcitabine)、和长春碱(vinblastine)。4.依照实施方案1或2的抗体或用途,其中所述癌症免疫疗法选自下组:a)T细胞接合剂(engagingagent),其选自接合人OX40、GITR、CD27、或4-1BB的激动性抗体,和T细胞双特异性抗性(例如T细胞接合性BiTETM抗体CD3-CD19、CD3-EpCam、CD3-EGFR)、IL-2(Proleukin)、干扰素(IFN)alpha、结合人CTLA-4的拮抗性抗体(例如易普利姆玛)、与PD-1、PD-L1、TIM-3、BTLA、VISTA、LAG-3、或CD25结合的拮抗性抗体,b)靶向性免疫抑制:靶向STAT3或NFkB信号传递,阻断IL-6,IL-17,IL-23,TNFa功能的抗体或小分子,c)癌症疫苗/增强树突细胞功能:OncoVex(分泌GM-CSF的溶瘤病毒)、激动性CD40抗体、Toll样受体(TLR)配体、TLR激动剂、编码MAGE-A3的重组融合蛋白、PROSTVAC;或d)过继性细胞转移:GVAX(表达GM-CSF的前列腺癌细胞系)、树突细胞疫苗、过继性T细胞疗法、过继性CART细胞疗法。5.依照实施方案4的抗体或用途,其中所述癌症免疫疗法是激动性CD40抗体(在一个实施方案中,激动性CD40抗体是CP-870,893或SGN-40)。6.依照实施方案1或2的抗体或用途,其中所述化疗剂选自下组:用于治疗乳腺癌的紫杉烷类(多西他赛或帕利他赛或经修饰的帕利他赛(Abraxane或Opaxio))、多柔比星、卡培他滨(capecitabine)和/或贝伐单抗(bevacizumab)。7.依照实施方案1或2的抗体或用途,其中所述化疗剂选自下组:用于治疗卵巢癌的卡铂、奥沙利铂、顺铂、帕利他赛、多柔比星(或经修饰的多柔比星(Caelyx或Doxil))、或拓扑替康(topotecan)(Hycamtin)。8.依照实施方案1或2的抗体或用途,其中所述化疗剂选自下组:用于治疗肾癌的多激酶抑制剂(舒尼替尼(Sutent)、索拉非尼(sorafenib)(Nexavar)或二磷酸莫替沙尼(motesanibdiphosphate)(AMG706)和/或多柔比星。9.依照实施方案1或2的抗体或用途,其中所述化疗剂选自下组:用于治疗鳞状细胞癌的奥沙利铂、顺铂、和/或放射。10.依照实施方案1或2的抗体或用途,其中所述化疗剂选自下组:用于治疗肺癌的泰素和/或卡铂。11.依照前述实施方案中任一项的抗体,其中所述抗体的特征在于所述抗体不结合人CSF1R片段delD4(SEQIDNO:65)。12.依照前述实施方案中任一项的抗体或用途,其中所述抗体的特征在于:所述抗体以1:50或更低的比率结合人CSF-1R片段delD4(SEQIDNO:65)和人CSF-1R胞外域(SEQIDNO:64)。13.依照前述实施方案中任一项的抗体或用途,其中所述抗体的特征在于:a)重链可变域是SEQIDNO:7,且轻链可变域是SEQIDNO:8;b)重链可变域是SEQIDNO:15,且轻链可变域是SEQIDNO:16;c)重链可变域是SEQIDNO:75,且轻链可变域是SEQIDNO:76;d)重链可变域是SEQIDNO:83,且轻链可变域是SEQIDNO:84,或其人源化形式。14.依照前述实施方案中任一项的抗体,其特征在于:a)重链可变域是SEQIDNO:23,且轻链可变域是SEQIDNO:24,或b)重链可变域是SEQIDNO:31,且轻链可变域是SEQIDNO:32,或c)重链可变域是SEQIDNO:39,且轻链可变域是SEQIDNO:40,或d)重链可变域是SEQIDNO:47,且轻链可变域是SEQIDNO:48,或e)重链可变域是SEQIDNO:55,且轻链可变域是SEQIDNO:56。15.依照前述权利要求中任一项的抗体,其特征在于:a)重链可变域包含SEQIDNO:1的CDR3区,SEQIDNO:2的CDR2区,和SEQIDNO:3的CDR1区,且轻链可变域包含SEQIDNO:4的CDR3区,SEQIDNO:5的CDR2区,和SEQIDNO:6的CDR1区,或b)重链可变域包含SEQIDNO:9的CDR3区,SEQIDNO:10的CDR2区,和SEQIDNO:11的CDR1区,且轻链可变域包含SEQIDNO:12的CDR3区,SEQIDNO:13的CDR2区,和SEQIDNO:14的CDR1区,或c)重链可变域包含SEQIDNO:17的CDR3区,SEQIDNO:18的CDR2区,和SEQIDNO:19的CDR1区,且轻链可变域包含SEQIDNO:20的CDR3区,SEQIDNO:21的CDR2区,和SEQIDNO:22的CDR1区,或d)重链可变域包含SEQIDNO:25的CDR3区,SEQIDNO:26的CDR2区,和SEQIDNO:27的CDR1区,且轻链可变域包含SEQIDNO:28的CDR3区,SEQIDNO:29的CDR2区,和SEQIDNO:30的CDR1区,或e)重链可变域包含SEQIDNO:33的CDR3区,SEQIDNO:34的CDR2区,和SEQIDNO:35的CDR1区,且轻链可变域包含SEQIDNO:36的CDR3区,SEQIDNO:37的CDR2区,和SEQIDNO:38的CDR1区,或f)重链可变域包含SEQIDNO:41的CDR3区,SEQIDNO:42的CDR2区,和SEQIDNO:43的CDR1区,且轻链可变域包含SEQIDNO:44的CDR3区,SEQIDNO:45的CDR2区,和SEQIDNO:46的CDR1区,或g)重链可变域包含SEQIDNO:49的CDR3区,SEQIDNO:50的CDR2区,和SEQIDNO:51的CDR1区,且轻链可变域包含SEQIDNO:52的CDR3区,SEQIDNO:53的CDR2区,和SEQIDNO:54的CDR1区;或h)重链可变域包含SEQIDNO:69的CDR3区,SEQIDNO:70的CDR2区,和SEQIDNO:71的CDR1区,且轻链可变域包含SEQIDNO:72的CDR3区,SEQIDNO:73的CDR2区,和SEQIDNO:74的CDR1区,或i)重链可变域包含SEQIDNO:77的CDR3区,SEQIDNO:78的CDR2区,和SEQIDNO:79的CDR1区,且轻链可变域包含SEQIDNO:80的CDR3区,SEQIDNO:81的CDR2区,和SEQIDNO:82的CDR1区。16.依照前述权利要求中任一项的抗体,其特征在于:所述抗体是人IgG1亚类的或人IgG4亚类的。17.依照前述权利要求中任一项的抗体或用途,其用于治疗癌症,骨损失,转移,炎性疾病的方法,或用于预防转移。18.A)用于下列各项的方法:a)抑制CSF-1R配体依赖性和/或CSF-1R配体不依赖性CSF-1R表达肿瘤细胞的细胞增殖;b)抑制具有CSF-1配体依赖性和/或CSF-1配体不依赖性CSF-1R表达型巨噬细胞浸润物的肿瘤的细胞增殖;c)抑制(CSF-1R配体依赖性和/或CSF1R配体不依赖性)CSF-1R表达型单核细胞和巨噬细胞的细胞存活;和/或d)抑制(CSF-1R配体依赖性和/或CSF-1R配体不依赖性)CSF-1R表达型单核细胞向巨噬细胞的细胞分化;其中结合人CSF-1R的抗体与化疗剂、放射、和/或癌症免疫疗法组合施用,所述抗体特征在于结合人CSF-1R的胞外域的(二聚化)域D4至D5(SEQIDNo:85);或B)一种治疗具有CSF-1R表达肿瘤或具有含CSF-1R表达型巨噬细胞浸润物的肿瘤的患者的方法,其中所述肿瘤特征在于CSF-1R配体增加,其中结合人CSF-1R的抗体与化疗剂、放射、和/或癌症免疫疗法组合施用,所述抗体特征在于结合人CSF-1R的胞外域的(二聚化)域D4至D5(SEQIDNo:85)。19.一种结合人CSF-1R的抗体,其用于:治疗具有表达CSF-1R的肿瘤或具有含CSF-1R表达性巨噬细胞浸润物的肿瘤的患者,其中所述肿瘤的特征在于CSF-1R配体增加,其中与癌症免疫疗法组合施用抗CSF-1R抗体,其中所述癌症免疫疗法选自下组:a)T细胞结合剂,其选自结合人OX40,GITR,CD27,或4-1BB的激动性抗体,和T细胞双特异性抗体(例如T细胞结合性BiTETM抗体CD3-CD19,CD3EpCam,CD3-EGFR),IL-2(Proleukin),干扰素(IFN)alpha,结合人CTLA-4(例如易普利姆玛(ipilimumab)),PD-1,PD-L1,TIM-3,BTLA,VISTA,LAG-3,或CD25的拮抗性抗体,b)靶向免疫抑制:靶向STAT3或NFkB信号传导,阻断IL-6,IL-17,IL-23,TNFa功能的抗体或小分子,c)癌症疫苗/增强树突细胞功能:OncoVex(分泌GM-CSF的溶瘤病毒),激动性CD40抗体,Toll样受体(TLR)配体,TLR激动剂,编码MAGE-A3的重组融合蛋白,PROSTVAC;或d)过继性细胞转移:GVAX(表达GM-CSF的前列腺癌细胞系),树突细胞疫苗,过继性T细胞疗法,过继性CART细胞疗法。20.依照实施方案19的抗体,其中癌症免疫疗法选自下组:癌症疫苗/增强树突细胞功能:OncoVex(分泌GM-CSF的溶瘤病毒),激动性CD40抗体,Toll样受体(TLR)配体,TLR激动剂,编码MAGE-A3的重组融合蛋白,PROSTVAC。21.依照实施方案19的抗体或用途,其中所述癌症免疫疗法是激动性CD40抗体(在一个实施方案中,激动性CD40抗体是CP-870,893或SGN-40)。22.一种用于测定具有癌症的受试者是否是用于基于抗CSF-1R抗体的癌症治疗方案的候选者的方法,该方法包括:-在所述受试者的样品中离体(exvivo)或体外(invitro)测定下列一种或多种标志物的体外水平:CSF-1R,CD68/CD163,CD68/MHCII类,CD31(微血管密度),和Ki67及其它标志物,如例如免疫浸润物;其中所述样品选自下组:组织,血液,血清,血浆,肿瘤细胞和循环肿瘤细胞;且-其中与未患有癌症的个体中的相应水平相比,下列一项或多项的水平变化指示所述受试者是基于抗CSF-1R抗体的癌症治疗方案的候选者:CSF-1R,CD68/CD163,CD68/MHCII类,CD31(微血管密度)和Ki67及其它标志物,如例如免疫浸润物(例如T细胞(例如CD4-和/或CD8-T细胞)。23.实施方案22的方法,其中所述方案中使用的所述抗体是依照前述实施方案中任一项的抗体。24.实施方案21或22的方法,其中在此方法中,与未患有癌症的个体中的水平相比CSF-1R,CD68/CD163,CD68/MHCII类,CD31(微血管密度)和Ki67及其它标志物,如例如免疫浸润物(例如T细胞(例如CD4-和/或CD8-T细胞)水平的变化是这些标志物中一种或多种的水平升高。25.一种用于测定具有癌症的受试者是否是用于基于抗CSF-1R抗体的癌症治疗方案的候选者的方法,该方法包括:-在所述受试者的样品中离体或体外测定下列一种或多种标志物的体外水平:CSF-1,Trap5b,sCD163,IL-34;其中所述样品选自下组:组织,血液,血清,血浆,肿瘤细胞和循环肿瘤细胞;且-其中与未患有癌症的个体中的相应水平相比,下列一项或多项的水平变化指示所述受试者是基于抗CSF-1R抗体的癌症治疗方案的候选者:CSF-1,Trap5b,sCD163,IL-34。26.实施方案25的方法,其中所述方案中使用的所述抗体是依照前述实施方案中任一项的抗体。27.实施方案25或26的方法,其中在此方法中,与未患有癌症的个体中的水平相比CSF-1,Trap5b,sCD163,IL-34水平变化是这些标志物中一种或多种的水平升高。28.实施方案25至27中任一项的方法,其中在此方法中,离体或体外测定sCD163的水平和水平变化。29.一种用于测定具有癌症的受试者是否是用于基于抗CSF-1R抗体的癌症治疗方案的候选者的方法,该方法包括:-在所述受试者的样品中离体或体外测定下列一种或多种标志物的体外水平:IFNγ,TNFα,IL-1β,IL-4,IL-6,IL-8,IL-10,IL-13,GM-CSF,VEGF,MCP-1,CCL18,CCL22,MIP-1,半乳凝素3,IL1Ra,TGFalpha;其中所述样品选自下组:组织,血液,血清,血浆,肿瘤细胞和循环肿瘤细胞;且-其中与未患有癌症的个体中的相应水平相比,下列一项或多项的水平变化指示所述受试者是基于抗CSF-1R抗体的癌症治疗方案的候选者:IFNγ,TNFα,IL-1β,IL-4,IL-6,IL-8,IL-10,IL-13,GM-CSF,VEGF,MCP-1,CCL18,CCL22,MIP-1,半乳凝素3,IL1Ra,TGFalpha。30.实施方案29的方法,其中所述方案中使用的所述抗体是依照前述实施方案中任一项的抗体。31.实施方案29或30的方法,其中在此方法中,与未患有癌症的个体中的水平相比IFNγ,TNFα,IL-1β,IL-4,IL-6,IL-8,IL-10,IL-13,GM-CSF,VEGF,MCP-1,CCL18,CCL22,MIP-1,半乳凝素3,IL1Ra,TGFalpha水平变化是这些标志物中一种或多种的水平升高。32.一种结合人CSF-1R的抗体,其用于治疗癌症,其中与双特异性ANG-2-VEGF抗体组合施用所述抗体。33.一种结合人CSF-1R的抗体,其用于治疗癌症,其中与激动性CD40抗体组合施用所述抗CSF-1R抗体。34.依照实施方案33的结合人CSF-1R的抗体,其中所述抗CSF-1R抗体包含(a)SEQIDNO:39的重链可变域氨基酸序列和(b)SEQIDNO:40的轻链可变域氨基酸序列;且其中激动性CD40抗体是CP-870,893(U.S.7,338,660的抗体21.4.1)。35.依照实施方案33的结合人CSF-1R的抗体,i)其中所述抗CSF-1R抗体包含(a)SEQIDNO:39的重链可变域氨基酸序列和(b)SEQIDNO:40的轻链可变域氨基酸序列;且ii)其中所述激动性CD40抗体包含(a)SEQIDNO:88的重链可变域氨基酸序列和(b)SEQIDNO:89的轻链可变域氨基酸序列。36.依照实施方案33的结合人CSF-1R的抗体,其中所述抗CSF-1R抗体包含(a)SEQIDNO:39的重链可变域氨基酸序列和(b)SEQIDNO:40的轻链可变域氨基酸序列;且其中所述激动性CD40抗体是达西珠单抗(dacetuzumab)。37.依照实施方案33的结合人CSF-1R的抗体,i)其中所述抗CSF-1R抗体包含(a)SEQIDNO:39的重链可变域氨基酸序列和(b)SEQIDNO:40的轻链可变域氨基酸序列;且ii)其中所述激动性CD40抗体包含(a)SEQIDNO:90的重链可变域氨基酸序列和(b)SEQIDNO:91的轻链可变域氨基酸序列。38.依照实施方案33的结合人CSF-1R的抗体,其中所述激动性CD40抗体是i)CP-870,893;ii)a)包含(a)SEQIDNO:88的重链可变域氨基酸序列和(b)SEQIDNO:89的轻链可变域氨基酸序列;iii)是达西珠单抗;或iv)包含(a)SEQIDNO:90的重链可变域氨基酸序列和(b)SEQIDNO:91的轻链可变域氨基酸序列。39.结合人CSF-1R的抗体用于制造用于治疗癌症的药物的用途,其中抗CSF-1R抗体与激动性CD40抗体组合施用。40.依照实施方案39的用途,其中所述抗CSF-1R抗体包含(a)SEQIDNO:39的重链可变域氨基酸序列和(b)SEQIDNO:40的轻链可变域氨基酸序列;且其中激动性CD40抗体是CP-870,893(U.S.7,338,660的抗体21.4.1)。41.依照实施方案39的用途,i)其中抗CSF-1R抗体包含(a)SEQIDNO:39的重链可变域氨基酸序列和(b)SEQIDNO:40的轻链可变域氨基酸序列;且ii)其中激动性CD40抗体包含(a)SEQIDNO:88的重链可变域氨基酸序列和(b)SEQIDNO:89的轻链可变域氨基酸序列。42.依照实施方案39的用途,其中抗CSF-1R抗体包含(a)SEQIDNO:39的重链可变域氨基酸序列和(b)SEQIDNO:40的轻链可变域氨基酸序列;且其中激动性CD40抗体是达西珠单抗。43.依照实施方案39的用途,i)其中抗CSF-1R抗体包含(a)SEQIDNO:39的重链可变域氨基酸序列和(b)SEQIDNO:40的轻链可变域氨基酸序列;且ii)其中激动性CD40抗体包含(a)SEQIDNO:90的重链可变域氨基酸序列和(b)SEQIDNO:91的轻链可变域氨基酸序列。44.依照实施方案39的用途,其中激动性CD40抗体是i)CP-870,893;ii)a)包含(a)SEQIDNO:88的重链可变域氨基酸序列和(b)SEQIDNO:89的轻链可变域氨基酸序列;iii)是达西珠单抗;或iv)包含(a)SEQIDNO:90的重链可变域氨基酸序列和(b)SEQIDNO:91的轻链可变域氨基酸序列。提供以下实施例,序列表和图以帮助理解本发明,其真正的范围在所附权利要求书中列出。应当理解,可以在不偏离本发明精神的前提下对列出的方案进行修改。实施例实施例1生成抗CSF-1R抗体的杂交瘤细胞系的产生NMRI小鼠的免疫方法通过利用电穿孔用编码huCSF-1R胞外域的表达载体pDisplayTM(Invitrogen,USA)免疫NMRI小鼠。用100μgDNA将每只小鼠免疫4次。在发现抗huCSF-1R的血清滴度足够时,用200μlPBS中50μg1:1混合的huCSF-1RECD/huCSF-1RECDhuFc嵌合物对小鼠静脉(i.v.)再加强一次,4天和3天后进行融合。抗原特异性ELISA通过抗原特异性ELISA测定经免疫小鼠的血清中的抗CSF-1R滴度。在具有0.1mg/ml生物素化的抗Fcγ(JacksonImmunoResearch.,Cat.No.109-066-098)的链霉亲合素板(MaxiSorb;MicroCoat,DE,Cat.No.11974998/MC1099)上捕捉0.3μg/mlhuCSF1R-huFc嵌合物(可溶性胞外域),并添加在PBS/0.05%Tween20/0.5%BSA中以1/800稀释的缀合有辣根过氧化物酶(HRP)的F(ab’)2抗小鼠IgG(GEHealthcare,UK,Cat.No.NA9310V)。将通过所有轻敲(tap)得到的血清在PBS/0.05%Tween20/0.5%BSA中以1/40稀释,并且连续稀释直至1/1638400。将经稀释的血清添加至孔。轻敲前的血清用作阴性对照。500ng/ml至0,25ng/ml稀释系列的小鼠抗人CSF-1RMab3291(R&DSystems,UK)用作阳性对照。将所有组分一起温育1,5小时。将孔用PBST(PBS/0.2%Tween20)清洗6次,并于RT用新鲜制备的溶液(1mg/ml)(ABTS:2,2’-连氮基-双(3-乙基苯并噻唑啉-6-磺酸))将测定法显现10分钟。于405nm测量吸光度。杂交瘤生成可以将小鼠淋巴细胞分离,并使用基于PEG的标准方案与小鼠骨髓瘤细胞系融合以生成杂交瘤。然后,对所得的杂交瘤筛选抗原特异性抗体的生成。例如,用50%PEG将来自经免疫小鼠的脾衍生淋巴细胞的单细胞悬浮液与Ag8非分泌性小鼠淋巴瘤细胞P3X63Ag8.653(ATCC,CRL-1580)融合。将细胞以约104个在平底96孔微量滴定板中分配,接着在选择培养基中温育约2周。然后,通过ELISA对各个孔筛选人抗CSF-1R单克隆IgM和IgG抗体。在发生广泛的杂交瘤生长后,将抗体分泌性杂交瘤再分配,再次筛选,并且如果对人IgG仍然呈阳性,则可以通过FACS对抗CSF-1R单克隆抗体亚克隆。然后,体外培养稳定的亚克隆,以在组织培养基中生成抗体进行表征。可以使用如实施例4中所述的抗CSF-1R抗体对人CSF-1R片段delD4及对人CSF-1R胞外域(CSF-1R-ECD)结合的测定,以及如实施例5中所述的在用抗CSF-1R单克隆抗体处理下对用野生型CSF-1R(配体依赖性信号传导)或突变体CSF-1RL301SY969F(不依赖于配体的信号传导)转染的NIH3T3细胞的生长抑制的测定选择依照本发明的抗体。杂交瘤的培养将生成的muMAb杂交瘤在补充有2mML-谷氨酰胺(GIBCO-Cat.No.35050-038),1mM丙酮酸钠(GIBCO-Cat.No.11360-039),1xNEAA(GIBCO-Cat.No.11140-035),10%FCS(PAA-Cat.No.A15-649),1xPenStrep(Roche-Cat.No.1074440),1xNutridomaCS(Roche-Cat.No.1363743),50μM巯基乙醇(GIBCO-Cat.No.31350-010)和50U/mlIL6小鼠(Roche-Cat.No.1444581)的RPMI1640(PAN–CatalogueNo.(Cat.No.)PO4-17500)中于37℃和5%CO2培养。已经将一些所得的小鼠抗体人源化(例如Mab2F11),并且重组表达。实施例2对CSF-1结合CSF-1R的抑制(ELISA)通过将此测定法设立为首先容许抗CSF-1R抗体结合CSF-1R-ECD,接着检测不与受体结合的配体,可以测试配体置换抗体和二聚化抑制剂抗CSF-1R抗体两者。将测试在384孔微量滴定板(MicroCoat,DE,Cat.No.464718)上于RT测试。在每个温育步骤后,将板用PBST清洗3次。在开始时,将板用0.5mg/ml山羊F(ab’)2生物素化的抗Fcγ(JacksonImmunoResearch.,Cat.No.109-006-170)包被1小时(h)。此后,将孔用补充有0.2%-20和2%BSA(RocheDiagnosticsGmbH,DE)的PBS封闭0.5h。将75ng/mlhuCSF1R-huFc嵌合物(其形成huCSF-1R的二聚体可溶性胞外域)固定至板达1小时。然后,将PBS/0.05%Tween20/0.5%BSA中的纯化的抗体的稀释液温育1小时。在添加3ng/mlhuCSF-1(人CSF-1的活性149aa片段(SEQIDNO:86的aa33-181);Biomol,DE,Cat.No.60530),50ng/ml生物素化的抗CSF-1克隆BAF216(R&DSystems,UK)和1:5000稀释的链霉亲合素HRP(RocheDiagnosticsGmbH,DE,Cat.No.11089153001)的混合物达1小时后,将板用PBST清洗6次。抗CSF-1RSC2-4A5(SantaCruzBiotechnology,US)(其抑制配体-受体相互作用)用作阳性对照。将板用新鲜制备的BMPOD底物溶液(BM3,3’-5,5’-四甲基联苯胺,RocheDiagnosticsGmbH,DE,Cat.No.11484281001)于RT显现30分钟。于370nm测量吸光度。如果抗CSF-1R抗体引起CSF-1从二聚体复合物释放,那么发现吸光度的降低。所有抗CSF-1R抗体显示对CSF-1与CSF-1R相互作用的显著抑制(参见表1)。抗CSF-1RSC2-4A5(SantaCruzBiotechnology,US,还可参见Sherr,C.J.等,Blood73(1989)1786-1793)(其抑制配体-受体相互作用)用作参照对照。表1:抑制CSF-1/CSF-1R相互作用的IC50计算值实施例3对NIH3T3-CSF-1R重组细胞中CSF-1诱导的CSF-1R磷酸化的抑制将4.5x103个用全长CSF-1R的表达载体以逆转录病毒感染的NIH3T3细胞在DMEM(PAACat.No.E15-011),2mML-谷氨酰胺(Sigma,Cat.No.G7513,2mM丙酮酸钠,1x非必需氨基酸,10%FKS(PAA,Cat.No.A15-649)和100μg/mlPenStrep(Sigma,Cat.No.P4333[10mg/ml])中培养,直到它们达到汇合。此后,将细胞用补充有亚硒酸钠[5ng/ml](Sigma,Cat.No.S9133),转铁蛋白[10μg/ml](Sigma,Cat.No.T8158),BSA[400μg/ml](RocheDiagnosticsGmbH,Cat.No.10735078),4mML-谷氨酰胺(Sigma,Cat.No.G7513),2mM丙酮酸钠(Gibco,Cat.No.11360),1x非必需氨基酸(Gibco,Cat:11140-035),2-巯基乙醇[0,05mM](Merck,Cat.No.M7522),100μg/mlandPenStrep(Sigma,Cat.No.P4333)的无血清DMEM培养基(PAACat.No.E15-011)清洗,并在30μl相同培养基中温育16小时以容许受体上调。将10μl稀释的抗CSR-1R抗体添加至细胞达1.5小时。然后,用10μl100ng/mlhuCSF-1(人CSF-1的活性149aa片段(SEQIDNO:86的aa33-181);Biomol,DE,Cat.No.60530)对细胞刺激5分钟。在温育后,将上清液除去,将细胞用80μl冰冷却的PBS清洗两次,并添加50μl新鲜制备的冰冷却的裂解缓冲液(150mMNaCl/20mMTrispH7.5/1mMEDTA/1mMEGTA/1%TritonX-100/每10ml缓冲液1个蛋白酶抑制剂片剂(RocheDiagnosticsGmbHCat.No.1836170)/10μl/ml磷酸酶抑制剂混合物1(SigmaCat.No.P-2850,100x储液)/10μl/ml蛋白酶抑制剂1(SigmaCat.No.P-5726,100x储液)/10μl/ml1MNaF)。冰上30分钟后,将板在摇板仪上有力摇动3分钟,然后以2200rpm(HeraeusMegafuge10)离心10分钟。用Elisa分析细胞裂解物中磷酸化的和总的CSF-1受体的存在。为了检测磷酸化的受体,依照供应商的用法说明使用来自R&DSystems的试剂盒(Cat.No.DYC3268-2)。为了检测总的CSF-1R,通过使用试剂盒中含有的捕捉抗体将10μl裂解物在板上固定化。此后,添加1:750稀释的生物素化的抗CSF-1R抗体BAF329(R&DSystems)和1:1000稀释的链霉亲合素-HRP缀合物。60分钟后,板用新鲜制备的溶液显色,并检测吸光度。数据以没有抗体的阳性对照的%计算,并且以磷酸/总受体的比率数值表示。在不添加M-CSF-1的情况下定义阴性对照。抗CSF-1RSC2-4A5(SantaCruzBiotechnology,US,还可见Sherr,C.J.等,Blood73(1989)1786-1793)(其抑制配体-受体相互作用)用作参照对照。表2:抑制CSF-1受体磷酸化的IC50计算值。实施例4测定抗CSF-1R抗体对人CSF-1R片段delD4及对人CSF-1R胞外域(CSF-1R-ECD)的结合制备人CSF-1R胞外域(CSF-1R-ECD)(其包含胞外亚域D1–D5,hCSF-1R-ECD)SEQIDNO:64:pCMV-preS-Fc-hCSF-1R-ECD(7836bp)编码人CSF-1R的完整ECD(SEQIDNO:64),其在C端与PreScission蛋白酶切割位点融合,接着是人IgG1的aa100-330和6xHis-Tag,在CMV启动子控制下。天然信号肽已经通过在第一个M后插入氨基酸G和S以创建BamHI限制性位点而改变。制备人CSF-1R片段delD4(其包含胞外亚域D1–D3和D5,hCSF-1R-delD4)SEQIDNO:65:用StratageneQuikChangeXL定点诱变方案从pCMV-preS-Fc-hCSF-1R-ECD克隆hCSF1R-delD4-V1-PreSc-hFc-His,其使用具有序列CACCTCCATGTTCTTCCGGTACCCCCCAGAGGTAAG(SEQIDNO:68)的delD4-for作为正向引物和具有反向互补序列的delD4-rev作为反向引物。使用BioTechniques26(1999)680中发表的改良方案在进行常规Stratagene方案的三个循环中在分开的反应中延长这两种引物:依照制造商的手册设立两个不同的50μl反应混合物,其各含有10ng质粒pCMV-preS-Fc-hCSF1R-ECD作为模板和10pM引物delD4-for或delD4-rev之一,和0,5μl如该试剂盒提供的PfuDNA聚合酶。运行95℃30秒/55℃60秒/68℃8分钟的3个PCR循环,然后将两个反应混合物中的每个25μl在新管中组合,并添加0,5μl新鲜的PfuDNA聚合酶。实施试剂盒手册中如Stratagene规定的具有18个温度循环的常规PCR方案,接着用该试剂盒提供的Dpn1限制酶进行2小时最终消化。通过用CelII和NotI消化来检测携带缺失的克隆,并通过测序确认。依照制造商的规定通过在Hek293FreeStyle悬浮细胞系统(Invitrogen)中瞬时转染制备蛋白质。在1周后,将500ml上清液过滤,并加载到1mlHiTrapMabSelectXtra(GEhealthcare)蛋白A柱上(0,2ml/min)。将该柱首先用PBS,然后用50mMTris/150mMNaCl/1mMEDTA/pH7,3清洗。将375μl相同缓冲液中稀释的75μlPreScission蛋白酶(GE#27-0843-01)加载到该柱上,并将密闭柱于4℃在旋转的情况下温育过夜。将该柱在1mlGSTrapFF柱(GEhelthcare)顶部安放,并将期望的蛋白质洗脱(0,2ml/min,0,2ml级分)。通过经由3kNanosep的离心超滤将合并的级分从1,8ml浓缩到0,4ml,并在PBS(0,5ml/min)中在S200HRSEC上层析。人CSF-1R片段delD4在作为二聚体分子(合并物1,V=1,5ml;c=0,30mg/ml;在SDSpage上的表观质量83kDa,还原时62kDa)和作为单体(合并物2,V=1,4ml;c=0,25mg/ml,SDSpage上的表观质量62kDa)的两个级分中获得。二聚体形式用于所有实验。测定抗CSF-1R抗体对人CSF-1R片段delD4及对人CSF-1R胞外域(CSF-1R-ECD)的结合(结合信号为响应单位(RU)):仪器:BiacoreT100(GEHealthcare)软件:T100Control,版本2.0.1T100评估,版本2.0.2测定形式芯片:CM5温度:25℃经由胺偶联来固定CSF-1R片段。为了比较依照本发明的不同抗CSF-1R抗体的结合,注射1个浓度的测试抗体。抗CSF-1RMab3291(R&D-Systems)和SC24A5(SantaCruzBiotechnology,US-还可参见Sherr,C.J.等,Blood73(1989)1786-1793)用作参照对照,抗CCR5m<CCR5>Pz03.1C5(以DSMACC2683在18.08.2004保藏于DSMZ)用作阴性对照,均在与依照本发明的抗CSF-1R抗体相同的条件下。CSF-1R片段的胺偶联依照制造商的用法说明的标准胺偶联:运行缓冲液:PBS-T(Roche:11666789+0.05%Tween20:11332465),通过EDC/NHS混合物活化,以流速10μl/min注射人CSF-1R片段delD4(其包含胞外亚域D1–D3和D5)(SEQIDNO:65)和人CSF-1R胞外域(CSF-1R-ECD)(其包含胞外亚域D1–D5)(SEQIDNO:64)600秒;在偶联缓冲液NaAc,pH5.0中稀释,c=10μg/mL;最后通过注射1M乙醇胺封闭剩余的活化的羧基基团。<CSF-1R>Mab2F11,Mab2E10,Mab3291和sc2-4A5及其他抗CSF-1R抗体于25℃对人CSF-1R片段delD4和人CSF1R胞外域(CSF-1R-ECD)的结合运行缓冲液:PBS-T(Roche:11666789+0.05%Tween20:11332465)分析物样品:通过具有浓度c=10nM的分析物的一次注射以30μL/min的流速测量结合。(对于Mab1G10,Mab2H7和人源化的hMab2F11-e7在第二项实验中)每次注射长为700秒,接着是180秒的解离相。在每个循环后使用50mMNaOH,接触时间60秒,流速30μL/min实施最终的再生。在注射结束的10秒后的报告点测量信号。扣除参照信号(来自空白参照流动池(仅用EDC/NHS和乙醇胺处理)的信号)以给出结合信号(以RU计)。当非结合抗体的结合信号略低于0(Mab2F11=-3;Mab2E10=-2;Mab1G10=-6,Mab2H7=-9;及人源化hMab2F11-e7=-7)时,将这些数值设置为0。表3a:25℃时<CSF-1R>MAbs对人CSF-1R片段delD4和CSF-1R-ECD的结合和比率,通过SPR测量Mab2F11和Mab2E10显示了对人CSF-1R胞外域(CSF-1R-ECD)的结合(参见图2b);然而,对CSF-1R片段delD4没有检出结合。(参见图2a)。Sc2-4A5和MAB3291显示对CSF-1R-ECD及对delD4的结合(参见图2b和2a)。因此,抗CSF1R抗体Mab2F11和Mab2E10对CSF1R片段delD4/CSF-1R-ECD结合的比率明显低于1:50(=0.02),而MAB3291和Sc2-4A5的结合比率分别是1.61和1.50,高于1:50(=0.02)。阴性对照抗体m<CCR5>Pz03.1C5没有显示任何结合(如预期的)。Mab1G10,Mab2H7和人源化的hMab2F11-e7显示对人CSF-1R胞外域(CSF-1R-ECD)的结合(参见图2d);然而,没有检测到对CSF-1R片段delD4的结合。(参见图2c)。因此,抗CSF1R抗体Mab1G10,Mab2H7和人源化的hMab2F11-e7对CSF1R片段delD4/CSF-1R-ECD的结合比率明显低于1:50(=0.02)。在又一个实验中,调查抗CSF-1R抗体1.2.SM(WO2009026303中描述的配体置换型CSF-1R抗体),CXIIG6(WO2009/112245中描述的配体置换型CSF-1R抗体),山羊多克隆抗CSF-1R抗体ab10676(abcam)。抗CSF-1R抗体Mab3291(R&D-Systems)用作参照对照。抗CCR5m<CCR5>Pz03.1C5(以DSMACC2683在18.08.2004保藏于DSMZ)用作阴性对照。表3b:25℃时<CSF-1R>Mab对人CSF-1R片段delD4和CSF-1R-ECD的结合和比率,通过SPR测量1.2.SM,CXIIG6,ab10676和MAB3291显示对CSF-1R-ECD及对delD4的结合(参见图2f和2e)。1.2.SM,CXIIG6,ab10676和MAB3291的结合比率高于1:50(=0.02)。阴性对照抗体m<CCR5>Pz03.1C5没有显示任何结合(如预期的)。实施例5用抗CSF-1R单克隆抗体处理的3D培养中NIH3T3-CSF-1R重组细胞的生长抑制(CellTiterGlo测定法)将用全长野生型CSF-1R(SEQIDNO:62)或突变体CSF-1RL301SY969F(SEQIDNO:63)的表达载体以逆转录病毒感染的NIH3T3细胞在聚HEMA(聚(2-羟乙基甲基丙烯酸酯))(Polysciences,Warrington,PA,USA))包被皿上在补充有2mML-谷氨酰胺,2mM丙酮酸钠和非必需氨基酸和10%胎牛血清(Sigma,Taufkirchen,Germany)的DMEM高葡萄糖培养基(PAA,Pasching,Austria)中培养以阻止对塑料表面的粘着。将细胞在用5ng/ml亚硒酸钠,10mg/ml转铁蛋白,400μg/mlBSA和0.05mM2-巯基乙醇替换血清的培养基中接种。在用100ng/mlhuCSF-1(人CSF-1的活性149aa片段(SEQIDNO:86的aa33-181);Biomol,DE,Cat.No.60530)处理时,wtCSF-1R表达细胞形成三维生长的密集球状体,即一种称作锚着非依赖性的特性。这些球状体极其类似原位实体瘤的三维结构和构造。不依赖于CSF-1,突变体CSF-1R重组细胞能够形成球状体。将球状体培养物在存在不同浓度的抗体的情况下温育3天以测定IC50(对细胞存活力的50%抑制的浓度)。使用CellTiterGlo测定法通过测量细胞的ATP含量检测细胞存活力。表5a:参照对照MabR&D-Systems3291没有显示对突变体CSF-1R重组细胞增殖的抑制。在又一个实验中,调查依照本发明的抗CSF-1R抗体hMab2F11-e7和抗CSF-1R抗体1.2.SM(WO2009/026303中描述的配体置换型CSF-1R抗体),CXIIG6(WO2009/112245中描述的配体置换型CSF-1R抗体),山羊多克隆抗CSF-1R抗体ab10676(abcam),和SC2-4A5(SantaCruzBiotechnology,US-还可参见Sherr,C.J.等,Blood73(1989)1786-1793)。将球状体培养物在存在不同浓度的抗体的情况下温育3天以测定IC30(对细胞活力有30%抑制的浓度)。最大浓度是20μg/ml。使用CellTiterGlo测定法通过测量细胞的ATP含量检测细胞存活力。表5b:实施例6在用抗CSF-1R单克隆抗体处理的3D培养中BeWo肿瘤细胞的生长抑制(CellTiterGlo测定法)将BeWo绒膜癌细胞(ATCCCCL-98)在补充有10%FBS(Sigma)和2mML-谷氨酰胺的F12K培养基(Sigma,Steinheim,Germany)中培养。将5x104个细胞/孔在96孔聚HEMA(聚(2-羟乙基甲基丙烯酸酯))包被板中接种,该包被板含有补充有0.5%FBS和5%BSA的F12K培养基。伴随地,将200ng/mlhuCSF-1(人CSF-1的活性149aa片段(SEQIDNO:86的aa33-181))和10μg/ml不同抗CSF-1R单克隆抗体,并温育6天。使用CellTiterGlo测定法通过以相对光单位(RLU)测量细胞的ATP含量检测细胞存活力。在用不同抗CSF-1R抗体(10μg/ml)处理BeWo球状体培养物时,观察到对CSF-1诱导的生长的抑制。为了计算抗体介导的抑制,从所有样品扣除未刺激的BeWo细胞的平均RLU数值。经CSF-1刺激的细胞的平均RLU数值任意设置为100%。用CSF-1刺激并用抗CSF-1R抗体处理的细胞的平均RLU数值以经CSF-1刺激的RLU的%计算。表6显示了在用抗CSF-1R单克隆抗体处理的3D培养中BeWo肿瘤细胞的生长抑制的计算数据;图1a和b描绘了标准化的平均RLU数值。表6:实施例7在用抗CSF-1R单克隆抗体处理下对人巨噬细胞分化的抑制(CellTiterGlo测定法)使用RosetteSepTM人单核细胞富集混合物(StemCellTech.-Cat.No.15028)从外周血分离人单核细胞。将富集的单核细胞群体接种到补充有10%FCS(GIBCO-Cat.No.011-090014M),4mML-谷氨酰胺(GIBCO-Cat.No.25030)和1xPenStrep(RocheCat.No.1074440)的100μlRPMI1640(Gibco-Cat.No.31870)中于37℃和5%CO2在湿润的气氛中的96孔微量滴定板(2.5x104个细胞/孔)中。在将150ng/mlhuCSF-1添加至培养基时,可以观察到向粘附巨噬细胞的清楚分化。此分化可以通过添加抗CSF-1R抗体抑制。此外,单核细胞存活受到影响,并且可以通过CellTiterGlo(CTG)分析来分析。从抗体处理对单核细胞存活的浓度依赖性抑制计算IC50(参见表7)。表7:CSF-1RMabIC50[μg/ml]Mab2F110.08Mab2E100.06Mab2H70.03Mab1G100.06SC2-4A50.36在不同的测试系列中,Mab2F11的人源化形式,例如hMab2F11-c11,hMab2F11-d8,hMab2F11-e7,hMab2F11-f12显示0.07μg/ml(hMab2F11-c11),0.07μg/ml(hMab2F11-d8),0.04μg/ml(hMab2F11-e7)和0.09μg/ml(hMab2F11-f12)的IC50值。实施例8在用抗CSF-1R单克隆抗体处理下对猕猴巨噬细胞分化的抑制(CellTiterGlo测定法)使用CD14微珠非人灵长类试剂盒(MiltenyiBiotec-Cat.No.130-091-097)依照制造商的描述从外周血分离猕猴单核细胞。将富集的单核细胞群体接种到补充有10%FCS(GIBCO-Cat.No.011-090014M),4mML-谷氨酰胺(GIBCO-Cat.No.25030)和1xPenStrep(RocheCat.No.1074440)的100μlRPMI1640(Gibco-Cat.No.31870)中于37℃和5%CO2在湿润的气氛中的96孔微量滴定板(1-3x104个细胞/孔)中。在将150ng/mlhuCSF-1添加至培养基时,可以观察到向粘附巨噬细胞的清楚分化。此分化可以通过添加抗CSF-1R抗体抑制。此外,单核细胞存活受到影响,并且可以通过CellTiterGlo(CTG)分析来分析。在5μg/ml抗体处理的浓度分析存活力(参见表8)。表8:*四个实验的均值(使用鼠mAb的3个实验,使用嵌合mAb的1个实验)**仅使用鼠mAb的两个实验的均值实施例9在用抗CSF-1R单克隆抗体处理下对人M1和M2巨噬细胞分化的抑制(CellTiterGlo测定法)使用RosetteSepTM人单核细胞富集混合物(StemCellTech.-Cat.No.15028)从外周血分离人单核细胞。将富集的单核细胞群体接种到补充有10%FCS(GIBCO-Cat.No.011-090014M),4mML-谷氨酰胺(GIBCO-Cat.No.25030)和1xPenStrep(RocheCat.No.1074440)的100μlRPMI1640(Gibco-Cat.No.31870)中于37℃和5%CO2在湿润的气氛中的96孔微量滴定板(2.5x104个细胞/孔)中。在将100ng/mlhuCSF-1添加至培养基6天时,可以观察到向粘附的具有延长形态学的M2巨噬细胞的清楚分化。在将100ng/mlhuGM-CSF添加至培养基6天时,可以观察到向粘附的具有圆形形态学的M1巨噬细胞的清楚分化。此分化与某些标志物诸如CD163(对于M2巨噬细胞)和CD80或高MHCII类(对于M1巨噬细胞)表达有关,如通过流式细胞术评估的。将细胞用PBS清洗,并且若粘着的话,使用PBS中的5mMEDTA溶液分开(于37℃20分钟)。然后,将细胞充分重悬,用染色缓冲液(PBS中的5%FCS)清洗,并以300xg离心5分钟。将团粒在1ml染色缓冲液中重悬,将细胞在Neubauer室中计数。将约1x10e5个细胞在每个FACS管中转移,以300xg离心5分钟,并在染色缓冲液中重悬。通过在冰上与染色缓冲液中的1μg人IgG/2,5x10e4个细胞(JIRCat.No.009-000-003)一起温育20分钟封闭Fcγ受体。然后,将细胞与1,5μl抗体/2,5x10e4个细胞混合以进行CD80和CD163检测,而使用5μl抗体/2,5x10e4个细胞以进行MHCII类检测:PE标记的小鼠抗人CD163(BDBioscienceCat.No.556018),PE标记的小鼠抗人CD80(BDBioscienceCat.No.557227)和Alexa647标记的小鼠抗人MHCII类(Dako-Cat.No.M0775)。通过使用ZenonAlexa647小鼠IgG标记试剂盒(InvitrogenCat.No.Z25008)将Alexa647标记物与抗体缀合。在冰上温育1小时后,将细胞用染色缓冲液清洗两次,重悬,并在FACSCantoII测量。可以专门通过添加人源化的抗CSF-1R抗体hMab2F11-e7抑制M2巨噬细胞分化,其特征在于CD163的表达,CD80的缺乏和低MHCII类表达。此外,M2而非M1巨噬细胞存活受到影响,并且可以通过CellTiterGlo(CTG)分析来分析。图5a中描绘了通过抗体处理7天对巨噬细胞存活的浓度依赖性抑制。图5b中显示了通过流式细胞术评估的M1和M2巨噬细胞标志物的表达。实施例10测定抗CSF-1R抗体对人CSF-1R的结合亲和力仪器:A100芯片:CM5(BiacoreBR-1006-68)偶联:胺偶联缓冲液:PBS(BiacoreBR-1006-72),pH7.4,35℃对于亲和力测量,已经将36μg/ml抗小鼠Fcγ抗体(来自山羊,JacksonImmunoResearchJIR115-005-071)与芯片表面偶联以捕捉针对CSF-1R的抗体。在溶液中以多个浓度添加人CSF-1R胞外域(CSF-1R-ECD)(其包含胞外亚域D1–D5)(SEQIDNO:64)(R&D-Systems329-MR或亚克隆的pCMV-presS-HisAvitag-hCSF-1R-ECD)。通过于35℃注射CSF-1R1.5分钟测量结合;通过于35℃将芯片表面用缓冲液清洗10分钟测量解离。为了计算动力学参数,使用Langmuir1:1模型。表9:通过SPR测量的亲和力数据在使用CSF-1RECD的不同biacore结合测定法中(数据未显示),显示了抗体Mab2F11和Mab2E10与抗体AbSC-2-4A5的一些竞争。然而,Mab2F11/Mab2E10不结合人CSF1R片段delD4,而AbSC-2-4A5结合此delD4片段(参见实施例4和图2a)。因此,Mab2F11/Mab2E10的结合区明显不同于AbSC-2-4A5的结合区,但是可能位于邻近的区域中。在此类竞争测定法中,抗体Mab2F11和Mab2E10两者不与来自R&D-Systems的Mab3291竞争(数据未显示)。实施例11测定抗CSF-1R抗体对人CSF-1R片段D1-D3的结合仪器:BiacoreT100(GEHealthcare)软件:T100Control,第1.1.11版B3000评估,第4.01版Scrubber,第2.0a版测定形式芯片:CM5芯片经由胺偶联的捕捉分子捕捉针对CSF-1R的抗体。使用单一循环动力学,注射5个增加浓度的人CSF-1R片段D1-D3(SEQIDNO:66)。将人CSF-1R片段D1-D3亚克隆到pCMV-presS-HisAvitag表达载体中。抗CSF-1RSC2-4A5(SantaCruzBiotechnology,US;Sherr,C.J.等,Blood73(1989)1786-1793)(其抑制配体-受体相互作用)和Mab3291(R&D-Systems)用作参照对照。捕捉分子:抗小鼠Fcγ抗体(来自山羊,JacksonImmunoReasearchJIR115-005-071)(对于依照本发明的抗体)和R&D-Systems对照Mab3291和抗大鼠Fcγ抗体(来自山羊,JacksonImmunoReasearchJIR112-005-071)(对于参照对照抗CSF-1RSC2-4A5)。捕捉分子的胺偶联依照制造商的用法说明的标准胺偶联:运行缓冲液:HBS-N缓冲液,通过EDC/NHS混合物活化,2000RU的配体密度的目标;将捕捉Ab在偶联缓冲液NaAc,pH4.5中稀释,c=10μg/mL;最后,通过注射1M乙醇胺封闭剩余的活化的羧基基团。37℃时人CSF-1R片段D1-D3与MAbs<CSF-1R>结合的动力学表征运行缓冲液:PBS(BiacoreBR-1006-72)在流动池2至4上捕捉Mab<CSF-1R>:流动20μL/min,接触时间90秒,c(Abs<CSF-1R>)=50nM,用运行缓冲液+1mg/mLBSA稀释;分析物样品:通过在不再生的情况下具有浓度c=7.8,31.25,125500和2000nM的分析物的5次连续注射以30μL/min的流速测量单一循环动力学。每次注射长30秒,接着是120秒的解离相(对于前四次注射),及最终对于最高的浓度(=最后一次注射为1200秒。使用10mM甘氨酸pH1.5(BiacoreBR-1003-54),接触时间60秒,流速30μL/min在每个循环后实施最终的再生。动力学参数通过使用通常的双重参照(对照参照:分析物对捕捉分子的结合;流动池:亚域CSF-1R浓度“0”为空白)和模型“具有斜度的滴定动力学1:1结合(titrationkinetics1:1bindingwithdraft)”计算来计算。表10:通过SPR测量的对人CSF-1R片段D1-D3结合的亲和力数据抗体Mab2F11,Mab2E10和Mab1G10没有显示对人CSF-1R片段D1-D3的结合。参照对照AbSC-2-4A5也不结合人CSF-1R片段D1-D3。参照对照MabR&D-Systems3291显示对人CSF1R片段D1-D3的结合。实施例12在猕猴中CSF-1R抑制期间CSF-1水平升高血清CSF-1水平提供抗人CSF-1R二聚化抑制剂hMab2F11-e7的CSF-1R中和活性的药效学标志物。对每个剂量组(1和10mg/kg)的一只雄性和一只雌性猕猴静脉内施用抗CSF1R抗体hMab2F11-e7。在处理前1周(剂量前),剂量后2,24,48,72,96,168小时及每周一次再持续两周收集用于分析CSF-1水平的血液样品。使用商品化ELISA试剂盒(人M-CSF)依照制造商的用法说明(R&DSystems,UK)测定CSF-1水平。通过与试剂盒中提供的CSF-1标准曲线样品比较测定猴CSF-1水平。hMab2F11-e7的施用诱导CSF-1显著升高约1000倍,其取决于持续施用48小时(1mg/kg)或15天(10mg/kg)的剂量。因此,CSF-1R的二聚化抑制剂提供了一些优点,使得与配体置换型抗体相比,不直接与显著上调的配体在受体结合方面竞争。实施例13体内功效–SCID褐鼠中乳腺癌BT20异种移植物肿瘤细胞中抗CSF-1R抗体的肿瘤生长抑制人乳腺癌细胞系BT-20表达人CSF-1R,但是缺乏CSF-1表达(Sapi,E.等CancerRes59(1999)5578-5585)。由于小鼠衍生的CSF-1不能活化肿瘤细胞上的人CSF-1R,经由渗透微型泵(ALZET,Cupertino,CA)补充重组人CSF-1(人CSF-1的活性149aa片段(SEQIDNO:86的aa33-181)(Biomol,Hamburg,Germany),所述渗透微型泵提供2μg/天的连续CSF-1输注速率(Martin,T.A.,Carcinogenesis24(2003)1317-1323)。为了与配体置换CSF-1R抗体直接比较抗体干扰CSF-1R二聚化的效力,我们在BT-20异种移植物模型中测试嵌合抗CSF-1RMab2F11(干扰CSF-1R二聚化的抗体)和1.2.SM(WO2009/026303中描述的配体置换CSF-1R抗体)。给SCID褐鼠(CharlesRiver,Sulzfeld,Germany)在皮下共注射1x107个细胞BT-20细胞(ATCCHTB-19)和100μl基质胶。在随机化当天在100mm3的平均肿瘤体积开始动物处理。用20mM组氨酸,140mMNaClpH6.0缓冲液中的相应抗体(参见图4)每周一次i.p.处理小鼠。在分级日开始并且随后在整个处理期期间每周2次通过测径器测量肿瘤尺寸。依照NCI方案(肿瘤重量=1/2ab2,其中“a”和“b”分别是肿瘤的长和短的直径)计算肿瘤体积。图4中显示了肿瘤生长分析。用嵌合抗CSF-1RMab2F11对肿瘤细胞上人CSF-1R的抑制比抗CSF-1R抗体1.2.SM(WO2009/026303中描述的CSF-1R抗体)在介导肿瘤生长抑制方面是统计学更有效的。在分开的实验中,将3mg/kgi.v.多西他赛(SanofiAventis,UK)处理与抗小鼠CSF-1R抗体(30mg/kgi.p/每周)组合。将多西他赛每周施用3次作为1个周期,接着是3周药物休假期。在2个周期的多西他赛处理后,抗体单一疗法抑制原发性肿瘤生长(TGI:83%,npTCR:0.5,CI:0.1-1.8),其与3mg/kg多西他赛组(TGI:75%,npTCR:0.55,CI:0.2-1.5)相当。多西他赛和抗CSF-1R抗体的组合比单一疗法(TGI:94%,npTCR:0.3,CI:0.1-0.8)产生优越的效力。在后来的时间点,组合和单一疗法组之间的TGI差异由于每种单一疗法的强烈抑制而不太显著。不过,中值存活时间的分析揭示了组合的优越性(抗体159d,多西他赛154d,组合180d)。实施例14结合胞外域人CSF-1R的域D4至D5的抗CSF-1R抗体与帕利他赛的组合处理。2.1主要目的部分I(分组A:抗CSF-1RMab2F11的人源化形式(hMab2F11-e7)单一药剂[SA]剂量增加;分组B:人源化的CSF-1R抗体Mab2F11(hMab2F11-e7)剂量增加组合[CD]固定剂量的帕利他赛):·为了评估在单独和与帕利他赛组合施用时Mab2F11的人源化形式的安全性、耐受性和PK·为了通过观察剂量限制毒性(DLT)测定单独(MTD1/OBD1)和与帕利他赛(MTD2/OBD2)组合施用时人源化Mab2F11的最大耐受剂量(MTD)和/或最佳生物剂量(OBD)。部分II(延长分组/人源化Mab2F11仅单一药剂):为了在基于研究的部分I中的观察结果具有特别感兴趣的肿瘤实体的患者(他们都不适合标准治疗)中延长安全性评估并调查人源化Mab2F11临床活性。2.2次要目的部分I(剂量递增/分组A+B)·为了探索单独的和与帕利他赛组合的人源化的Mab2F11在肿瘤和替代组织中的PK和PD效果·为了评估单独的和与帕利他赛组合的人源化的Mab2F11的PD和生物标志物效果,如通过18F氟代-脱氧-葡萄糖正电子发射断层摄影术(FDG-PET)和动态对比增强超声(DCE-US)(在可得到的情况中)的变化测量的。·为了鉴定对单独的和与帕利他赛组合的人源化CSF-1R抗体Mab2F11推荐的2期剂量(RP2D)和日程表·为了探索单独的和与帕利他赛组合的人源化Mab2F11的初步临床活性,其使用主观响应率(ORR),临床益处率(CBR),无进展存活(PFS),响应持续时间进行。部分II(扩展分组/仅分组A)·为了进一步表征人源化的Mab2F11在肿瘤和替代组织中的PK和PD效果2.3探索目的会分析收集的患者以:·回顾鉴定TAM依赖性肿瘤·在替代组织如皮肤和血液中探索可能的响应预测标志物·研究生物标志物与医用产品相关的效力和/或不利事件(AE)的联系;和/或·开发生物标志物或诊断测定法;3.研究设计3.1研究设计的概述这是一个开放标签、多中心、Ia/b期剂量增加研究,其设计为评估人源化Mab2F11的每两周(Q2W)i.v.剂量给药的安全性、耐受性、PK和PD。人源化Mab2F11会单独对实体瘤患者(其不适合标准治疗)及在局部晚期和/或转移性癌症(其不适合标准治疗)中与帕利他赛组合施用。部分I–剂量增加在周期1中第一次施用人源化Mab2F11后的28天DLT评估期期间会对剂量增加分组中登记的所有患者评估DLT。会替换在DLT评估期期间由于不同于DLT的任何原因而中断的患者。人源化的Mab2F11单一疗法施用模式。会将人源化的Mab2F11在1.5小时内以i.v.输注以Q2W施用,除非患者经历输注相关反应(IRR),其会需要输注的缓慢或短暂停止。会实施治疗,直到疾病进展,不可接受的毒性,死亡或患者拒绝,以首先发生为准。人源化的Mab2F11和帕利他赛组合施用模型(部分I,仅分组B)。会将人源化的Mab2F11在1.5小时里以i.v.输注每Q2W施用,除非患者经历IRR,其会需要输注的缓慢或短暂停止。会实施治疗,直到疾病进展,不可接受的毒性,死亡或患者拒绝,以首先发生为准。80mg/m2剂量的帕利他赛会以QW与人源化Mab2F11组合施用,直到12周为止。帕利他赛输注在人源化Mab2F11输注结束就会开始,并且会依照地方规定信息施用。若患者经历直接可归因于帕利他赛的毒性,则他/她可以停止帕利他赛治疗,但是继续接受人源化的Mab2F11。MTD1/OBD1和MTD2/OBD2的试验定义的部分I会认为周期1中第一次施用人源化Mab2F11后的前28天是用于测定DLT的治疗时间间隔以定义MTD1和MTD2。MTD定义为6名患者中不超过1名经历DLT的最高剂量水平。在下一分组的每个剂量增加决定前会持续收集并审阅安全性数据和任何可用的PK/PD数据。3.1.1-3.1.3研究设计的基本原理来自具有不同恶性肿瘤的不同患者的肿瘤活组织检查样品的内部筛选已经显示了浸润性巨噬细胞密度和一致的CSF-1R表达的显著异质性(请参见IB的非临床药理学部分)。靶物介导的药物布置(TMDD)(即经由结合药理学靶物的分布和消除)在猴和肿瘤携带和非肿瘤携带小鼠两者中也是明显得清楚的。由于人源化Mab2F11的药动学受到其对靶物的结合影响,可以使用非线性PK的量化作为接近靶物饱和的生物标志物。为了表征基线患者人口统计学因素(包括肿瘤质量和TAM密度)可以以何种程度影响人源化Mab2F11的非线性药动学,会在从分组2向前(即会是至少200mg或更高的其周期1剂量前1周)的所有患者中在单一低(100mg)“试行”剂量(周期0)后的前几天内测量血液水平。在此低剂量,预期非线性PK,并且这会容许量化癌症患者中的TMDD。试行剂量的数值在于它会提供对在试验的延长期(或未来的研究)中基于患者人口统计学和基线因素(包括肿瘤类型、大小和炎性状态),不同剂量在不同延长分组(即不同恶性肿瘤)中是否可以更有效的了解。由于已经证明了CSF-1R阻断选择性抑制TAM,因此提供阻止或事件反转TAM介导的化学抗性的潜力[10],会启动与帕利他赛组合给予的人源化Mab2F11的同时评估。选择帕利他赛作为对这些患者组通常规定的化学疗法,并且预期不产生显著的重叠毒性,因为帕利他赛的最常报告的毒性(骨髓抑制,神经毒性和关节痛或肌痛)尚未在以QW给予直至12周为止的固定剂量的帕利他赛的毒性研究中报告,会对晚期乳腺或卵巢癌患者与上升剂量的人源化Mab2F11组合调查。最近的数据已经显示了在PVNS和TGCT患者中,CSF-1的过表达被检出,并且在30-60%病历中部分由牵涉CSF-1R基因的易位介导。此外,已经显示了几种其它人癌症(诸如卵巢癌和乳腺癌)中的CSF-1R阳性巨噬细胞的存在不仅与增加的血管密度,而且还与恶化的临床结果相联系。在乳腺癌中,CSF-1响应基因标签的存在预测发生和转移的风险。基于这些发现和我们的临床前模型,测试如下的假设似乎是合理的:用单独的或与帕利他赛组合的人源化Mab2F11阻断肿瘤相关巨噬细胞及其促肿瘤生物活性具有减缓某些实体瘤类型的患者中的临床活性的潜力。此研究含有多次抽血以评估PK和PD参数及强制的新鲜和归档肿瘤组织收集。这些在实现对PK特性,作用机制和预测性响应生物标志物的潜力的全面了解中是重要的。3.1.4用于生物标志物评估的基本原理生物标志物具有定形诊断策略并影响治疗管理的潜力。在未来,生物标志物可以促进个体化医药方法,即通过其肿瘤及在血液中的标志物的分子标签而非通过癌症类型对患者分组。我们将我们的努力集中于鉴定预测性生物标志物,其提供关于疗法的可能效力和安全性的信息。为了评估药物对肿瘤的PD和机械影响,经常需要肿瘤活组织检查。3.1.4.1用于新鲜的预治疗和治疗期肿瘤活组织检查的基本原理TAM浸润和分化依赖于原发性和转移性损伤中的相应肿瘤微环境。此外,患者的相应免疫状态和预治疗可能影响患者的肿瘤微环境。因此,所有患者会经历强制的预治疗活组织检查以在基线时限定TAM浸润和CSF-1R表达水平,但是不会用于测定患者对试验的适任性。另外,强制的治疗中活组织检查会容许通过比较剂量前后的水平评估人源化Mab2F11的PD活性。细针抽吸(FNA)会不适合于替代肿瘤活组织检查,因为巨噬细胞亚群分布需要在组织中评估。归档肿瘤组织不能代替新鲜的活组织检查,因为巨噬细胞浸润和分化是微环境依赖性的。肿瘤微环境由于患者的预治疗在原发性肿瘤中可能是多变的,并且在转移性损伤中也是变化的。然而,若归档肿瘤组织是可用的,则样品会用于数据与新鲜活组织检查的探索性回顾关联。3.1.4.2用于创伤皮肤活组织检查的基本原理伤口愈合的不同阶段需要许多过程(例如嗜中性粒细胞募集,巨噬细胞浸润,血管发生(Eming,S.A.等,Prog.Histochem.Cytochem.42(2007)115-170)。皮肤创伤测定法已经用于获得替代组织以测定例如抗血管生成疗法的PD标志物(Zhang,D.等,Invest.NewDrugs25(2006)49-55;Lockhart,A.C.等,Clin.CancerRes.9(2003)586-593)。在伤口愈合期间,巨噬细胞发挥实质性作用,并且伤口相关巨噬细胞(WAM)的表型变化在皮肤修复阶段中起到不同作用(例如早期炎性阶段=强烈的噬菌活性;中间组织重塑阶段:伴有促血管生成因子的过表达的免疫调节状态)(Adamson,R.,JournalofWoundCare18(2009)349-351;Rodero,M.P.等,Int.J.Clin.Exp.Pathol.25(2010)643-653;Brancato,S.K.andAlbina,J.E.,WoundMacrophagesasKeyRegulatorsofRepair,Origin,Phenotype,andFunction.AJP(2011),Vol.178,No.1)。实际上,巨噬细胞的缺乏导致遗传工程化小鼠中延迟的伤口愈合(Rodero,M.P.等,Int.J.Clin.Exp.Pathol.25(2010)643-653)。临床前实验显示了aCSF-1R处理MDA-MB231异种移植物小鼠模型的皮肤中显著的(F4/80阳性)巨噬细胞减少。然而,已经报告了小鼠和人之间的物种特异性差异(Daley,J.M.等,J.Leukoc.Biol.87(2009)1-9)。由于WAM和TAM起源于相同的祖细胞并且共享相似的功能和表型,会使用系列的处理前和处理中(总共n=4)皮肤活组织检查在伤口愈合过程期间分析人源化的Mab2F11治疗对WAM的药效学影响。皮肤数据与人源化Mab2F11治疗对新鲜肿瘤活组织检查中TAM的PD影响的关联可以显著增加关于人源化Mab2F11如何起作用及肿瘤如何响应的分子基础的知识。另外,伤口皮肤组织的评估可以潜在替代后来试验中的治疗中肿瘤活组织检查,因此充当替代组织以评估人源化的Mab2F11功效。3.1.4.3全血样品测量PD标志物的基本原理这些替代组织标本会用于研究目的以鉴定生物标志物,其预测对人源化Mab2F11治疗(就剂量,安全性和耐受性而言)的响应并且会有助于更好了解癌症及相关疾病的发病机理,过程和结果。分析可以包括测定与人源化Mab2F11的PD活性有关的循环标志物(例如评估细胞因子水平,循环免疫细胞和免疫效应细胞消减)。初步实验已经显示了例如循环CSF-1,TRAP5b单核细胞亚群和组织巨噬细胞的变化与药物活性有关。另外,来自经人源化Mab2F11处理的猕猴的GLP-Tox数据揭示了均与减少的破骨细胞数目相关的形成(骨钙蛋白,P1NP),破骨细胞活性(TRAP5b)和副甲状腺激素的骨标志物的变化。因此,会在研究期间评估这些探索性PD标志物和其它循环免疫刺激或免疫抑制因子。肿瘤响应标准会依照RECIST1.1标准评估肿瘤响应。在此研究中,会使用螺旋CT扫描(包括胸扫描)或CT扫描测量肿瘤响应。X-射线和超声对于监测靶损伤是不可接受的。对于每名受试者,贯穿整个研究必须使用相同评估方法和相同技术评估每个损伤。若使用超过一种方法,则在记录数据时选择依照RECIST的最正确方法。在记录初始响应后最少4周,或者若其在初始响应后超过4周发生,则在下一次安排的肿瘤评估时确认肿瘤响应。会通过比较治疗后扫描与最后一次可用的研究前扫描(若可用的话)进行肿瘤生长动力学的评估。药动学(PK)/药效学(PD)评估收集血液样品以评估PK和/或PD的药动学,如下表中描述的。用于PK评估,直到周期4结束的总体积血液损失会是约58mL(对于部分I,分组A和部分II)和约86mL(对于部分I,分组B)。在每个随后的周期,进一步收集6mL血液以对每个治疗组进行PK评估。用于PD评估,直到周期4结束(治疗后8周)的总体积血液损失会是约161mL。在每个随后的周期,进一步收集9ml血液样品(1x5ml,1x2ml和2x1ml;关于详情,参见表2)以进行计量前PD评估。PK评估收集血液以分析人源化Mab2F11,针对人源化Mab2F11的人源化抗人抗体(HAHA)和帕利他赛的浓度。另外,单一血液样品会在相当大幅度的输注相关反应时且若输注被中断或输注速率减缓,则根据研究人员的判断采集。使用确认的测定法测量血清人源化Mab2F11和HAHA。还会对为了HAHA测定而收集的所有血清样品分析RO5509554。从与接受输注的系不同的i.v.系收集用于PK评估的所有血液样品。将意图用于人源化Mab2F11暴露和HAHA分析的样品分成两个不同的等份试样,各用于人源化Mab2F11和HAHA测定。使用确认的液体层析串联质谱术(LC/MS/MS)方法测量血浆帕利他赛浓度。PD评估从参与试验的所有受试者收集用于动态(非遗传)和遗传生物标志物(遗传)发现和确认的标本。用于PD和生物标志物的全血样品收集作为来源组织的血液以测定人源化Mab2F11的PD效果。从与接受输注的系不同的i.v.系收集用于PD评估的所有血液样品。包括但不限于全血样品的PD评估:·使用流式细胞术测定免疫表型(单核细胞/巨噬细胞和淋巴细胞子集)。对于单核细胞/巨噬细胞子集,这些标志物包括但不限于CD14,CD16,CD45,MHCII类及对于淋巴细胞,CD3,CD4,CD8,CD16,CD19,CD45,CD56。·对于前4个周期,用于单核细胞/巨噬细胞和淋巴细胞细胞群体的药效学评估的总体积血液损失会是约17x5ml=85mL。·三份额外的血液样品会用于制备血清以测定可溶性标志物的PD相关变化。这些标志物包括但不限于:细胞因子评估A:CSF-1,Trap5b,sCD163,IL-34对于前4个周期,用于PD细胞因子评估A的总体积血液损失会是约25x2ml=50mL。细胞因子评估B:IFNγ,TNFα,IL-1β,IL-4,IL-6,IL-8,IL-10,IL-13,GM-CSF,VEGF,MCP-1,CCL18,CCL22,MIP-1,半乳凝素3,IL1Ra,TGFalpha对于前4个周期,用于PD细胞因子评估B的总体积血液损失会是约21x1ml=21mL。骨生物标志物:评估骨生物标志物诸如骨钙蛋白,P1NP和副甲状腺激素(PTH)。对于前4个周期,总体积血液损失会是约5x1mL=5mL。用于PD/生物标志物评估的每个周期的总体积血液损失的最大量会是约51mL。伤口愈合皮肤组织活组织检查分析替代伤口愈合皮肤组织以进行与伤口愈合过程(包括但不限于嗜中性粒细胞募集,巨噬细胞浸润和血管生成)有关的探索性PD生物标志物分析(还可见下文)。在局部麻醉后从正常皮肤(优选位于没有毛囊的背部)的镜面区采集两份皮肤成对样品。它们通过使用2和4mm直径冲压机活组织检查装置获得2个重复样品(其不会需要缝合)获得。2mm活组织检查会产生损伤,并且7天后完全重复的4mm活组织检查会收集伤口愈合材料。基于与伤口愈合过程有关的相关生物标志物(嗜中性粒细胞募集,巨噬细胞浸润,血管发生)的变化的时间过程的了解,2份活组织检查间选择的时间间隔认为是足够的(Eming,S.A.等,Prog.Histochem.Cytochem.42(2007)115-170;Zhang,D.等,Invest.NewDrugs25(2006)49-55;Lockhart,A.C.等,Clin.CancerRes.9(2003)586-593)。所有皮肤样品会经历以下的分析:·苏木精和曙红染色(H&E)·会对免疫组织化学(IHC)标志物分析以下参数:CSF-1R,CD68/CD163,CD68/MHCII类,CD31(微血管密度)和Ki67。将标本用福尔马林固定并用石蜡包埋,并运到中心实验室进行分析。肿瘤活组织检查新鲜的肿瘤活组织检查将新鲜的治疗前和治疗中肿瘤活组织检查收集以评估TAM浸润和其它肿瘤标志物的药效学变化(还可见上文)。活组织检查应当优先从最大的转移损伤采集,可以来自原发性肿瘤,或若可能的话来自原发性肿瘤和转移性部位两者,并且若可能的话,在肿瘤-基质界面处进行活组织检查。使用18号针提供长度至少20mm的核心通过超声或CT扫描引导肿瘤活组织检查的收集。在每个时间点获得至少2个,理想的是4个核心活组织检查。将标本的一半用福尔马林固定并用石蜡包埋。将第二个半份快速冷冻,并收集,用于长期贮存以进行生物标志物的回顾探索性分析(参见5.5.3.1.2部分)。会对经福尔马林固定的,经石蜡包埋的活组织检查样品分析:·苏木精和曙红染色(H&E)。·免疫组织化学(IHC)评估包括但不限于以下标志物:CSF-1R,CD68/CD163,CD68/MHCII类,CD31(微血管密度),Ki67和其它探索性标志物。用于生物标志物的成像形式DCE-超声基于临床前结果,我们预期用人源化Mab2F11处理可以调控肿瘤中的微血管密度和血管腔及因此调控血管发生和营养物对肿瘤的转毛细管运输。为了监测这些端点,我们假设使用DCE-超声作为成像形式的选择(若可能的话)。FDG-PETFDG-PET可以通过在肿瘤大小缩小前早期鉴定响应者来改善患者管理;非响应者可以中断无用的疗法(Weber,W.A.,J.Nucl.Med.50(2009)1S–10S)。此外,启动疗法的几天或几周内的FDG-PET信号降低(例如在乳腺(Avril,N.等,J.Nucl.Med.50(2009)55S-63S),卵巢(Schwarz,J.K.等,J.Nucl.Med.50(2009)64S-73S),和非小细胞肺(Zander,T.等,J.Clin.Oncol.(2011)1701-1708)中)与延长的存活和现在使用的其它临床端点显著相关联。可以用FDG-PET评估人源化Mab2F11处理诱导的肿瘤代谢变化。另外,人源化Mab2F11诱导的巨噬细胞消减可以导致FDG-PET扫描中SUVmax下降。实施例15在皮下同基因MC38结肠癌模型中抗CSF-1R单克隆抗体与化学疗法或癌症免疫疗法组合治疗时的肿瘤生长抑制将鼠结肠直肠腺癌细胞系MC-38(获自BeckmanResearchInstituteoftheCityofHope,California,USA)的细胞在补充有10%FCS和2mML-谷氨酰胺的Dulbecco氏改良Eagle培养基(DMEM,PANBiotech)于37℃在水饱和气氛中于5%CO2培养。在接种当天,将MC38肿瘤细胞从培养烧瓶中用PBS收获,并转移到培养基中,离心,清洗一次并在PBS中重悬。为了注射细胞,将最终的滴度调节至1×107个细胞/ml。随后,将100μl此悬浮液(1×106个细胞)皮下接种到7-9周龄雌性C57BL/6N小鼠(获自CharlesRiver,Sulzfeld,Germany)中。在肿瘤得到建立并且已经达到50mm3的平均大小后开始用对照抗体(MOPC-21;BioXCell,WestLebanon),单独或与IL-2(Proleukin,Novartis,100000IU/动物i.p.每天两次),或FOLFIRI(5-氟尿嘧啶,Medac,100mg/kg,i.p.,1x/亚叶酸,Pfizer,40mg/kg,i.p.,1x/依立替康,HEXAL,20mg/kg,i.p.,1x)或奥沙利铂(Eloxatin,Sanofi-Aventis5mg/kg,i.p.1x)组合的每周剂量30mg/kgi.p.的抗鼠CSF-1RmAb<小鼠CSF1R>抗体的处理。一周两次测量肿瘤体积,并且平行监测动物重量。在具有相当设置的不同研究中,将来自指定治疗组的原发性肿瘤切出,称重,并经受FACS分析。在研究日20-25间收集原发性肿瘤材料,如指示的。为了获得适合于流式细胞术分析的单细胞悬浮液,通过使用McIlwain组织切碎机切碎肿瘤。随后,将肿瘤碎块在补充有胶原酶I,分散酶II和DNA酶I的RPMI培养基中重悬,于37℃温育,并且将细胞悬浮液通过网孔(mash)。通过磁性细胞分离依照制造商的用法说明(Miltenyi)富集CD45阳性细胞。简言之,将细胞用与APC缀合的抗小鼠CD45(BD,Cat.No559864)标记,并用抗APC微珠分离。为了分析CD8+T细胞,将这些CD45阳性细胞用0,2μg/mlDAPI(Roche,Cat.No10236276001和缀合有PE的CD8抗体(eBioscienceCat.No.12-0081-83)或缀合有PE的CD4抗体(eBioscience,Cat.No.2-0041-83)染色。将数据采集用FACSCantoII实施,随后用FlowJo软件分析。仅分析活细胞(对DAPI阴性细胞门控)以排除细胞碎片和死细胞。当与对照抗体处理(TGI:61%,TCR:0.39CI:0.15-0.68)相比时,用<小鼠CSF1R>抗体的单一疗法抑制原发性肿瘤生长。还有,IL2单一疗法对MC38原发性肿瘤生长具有影响(TGI:47%,TCR:0.53CI:0.27-0.85)。与单独的IL-2治疗(TGI:78%,TCR:0.21CI:0.02-0.48)相比,对IL-2疗法添加<小鼠CSF1R>抗体导致优越的抗肿瘤效力。用化学治疗方案FOLFIRI的治疗还显著抑制肿瘤生长(TGI:66%,TCR:0.34CI:0.11-0.61),并且<小鼠CSF1R>抗体的添加导致进一步改善的结果(TGI:77%,TCR:0.23CI:0.001-0.48)。奥沙利铂对MC38肿瘤生长也显示一些但不太明显的效力(TGI:46%,TCR:0.54CI:0.29-0.86),不过,所述MC38肿瘤生长可以通过与<小鼠CSF1R>抗体的组合增强(TGI:69%,TCR:0.31CI:0.07-0.59)。在着眼于高于700mm3大小的各个肿瘤进展时,用<小鼠CSF-1R>抗体与IL-2组合处理的动物的进展前中值时间(mediantimetoprogression)在此模型中优于与化学疗法的组合(参见表11)。表11:<小鼠CSF1R>抗体组合在MC38小鼠CRC体内模型中的抗肿瘤效力用<小鼠CSF-1R抗体>处理的肿瘤的流式细胞术分析揭示了与奥沙利铂单一疗法相比CD8+T细胞数目的3倍增加及CD4+T细胞的略微增加。用CSF-1R中和性抗体和奥沙利铂的组合处理的肿瘤显示了与用单独的抗体处理时相当的T细胞增加。对与FOLFIRI的组合获得相似的结果。图5中也显示了结果。实施例16在皮下同基因MC38结肠癌模型中抗CSF-1R单克隆抗体与抗CD40单克隆抗体组合治疗时的肿瘤生长抑制将鼠结肠直肠腺癌细胞系MC-38(获自BeckmanResearchInstituteoftheCityofHope,California,USA)的细胞在补充有10%FCS和2mML-谷氨酰胺的Dulbecco氏改良Eagle培养基(DMEM,PANBiotech)于37℃在水饱和气氛中于5%CO2培养。在接种当天,将MC38肿瘤细胞从培养烧瓶中用PBS收获,并转移到培养基中,离心,清洗一次并在PBS中重悬。为了注射细胞,将最终的滴度调节至1×107个细胞/ml。随后,将100μl此悬浮液(1×106个细胞)皮下接种到6-10周龄雌性C57BL/6N小鼠中。用对照抗体(MOPC-21(30mg/kgi.p.每周一次)和2A3(100μgi.p.一次);BioXCell,WestLebanon),单独或与抗CD40单克隆抗体FGK45(针对CD40大鼠抗小鼠IgG2amAbFGK45(S.P.Schoenberger等,Nature,393,480(1998),可获自BioXcell)CD40(FGK45))(100μg,i.p.,1x)组合的抗鼠CSF-1RmAb<小鼠CSF1R>抗体(30mg/kgi.p.每周一次)处理动物组。在肿瘤得到建立并且达到50mm3的平均大小时开始处理。将肿瘤体积一周测量两次,并且平行监测动物重量。图7中显示了结果。CSF1RmAb+CD40mAbFGK45的组合在同基因MC38小鼠结肠癌模型中比单一疗法显示改善的抗肿瘤效力。实施例17在皮下同基因MC38结肠癌模型中抗CSF-1R单克隆抗体与抗Ang2/VEGF单克隆抗体和/或FOLFIRI组合治疗时的肿瘤生长抑制将鼠结肠直肠腺癌细胞系MC-38(获自BeckmanResearchInstituteoftheCityofHope,California,USA)的细胞在补充有10%FCS和2mML-谷氨酰胺的Dulbecco氏改良Eagle培养基(DMEM,PANBiotech)于37℃在水饱和气氛中于5%CO2培养。在接种当天,将MC38肿瘤细胞从培养烧瓶中用PBS收获,并转移到培养基中,离心,清洗一次并在PBS中重悬。为了注射细胞,将最终的滴度调节至1×107个细胞/ml。随后,将100μl此悬浮液(1×106个细胞)皮下接种到7周龄雌性C57BL/6N小鼠中。在肿瘤得到建立并且已经达到50mm3的平均大小后开始用对照抗体(MOPC-21;BioXCell,WestLebanon),单独或与FOLFIRI(5-氟尿嘧啶,Medac,100mg/kg,i.p.,1x/亚叶酸,Pfizer,40mg/kg,i.p.,1x/依立替康,HEXAL,20mg/kg,i.p.,1x)或抗Ang2/VEGF单克隆抗体(如WO2011/117329中描述的双特异性ANG-2-VEGF抗体XMab1)(10mg/kg,i.p.,1xweekly)组合的每周剂量30mg/kgi.p.的抗鼠CSF-1RmAb<小鼠CSF1R>抗体的处理。如表13中描述的,实施三重组合处理。一周两次测量肿瘤体积,并且平行监测动物重量。在与对照抗体处理相比时,用<小鼠CSF1R>抗体,抗Ang2/VEGF抗体或FOLFIRI的单一疗法在最小程度上抑制原发性肿瘤生长(TGI:28%,35%或11%)。与对照抗体相比,<小鼠CSF1R>抗体与抗Ang2/VEGF抗体或FOLFIRI的组合导致更明显的且统计学显著的抗肿瘤效力(TGI:64%或67%)。三重组合,即,<小鼠CSF-1R>抗体加FOLFIRI,再于2天或9天后用抗Ang2/VEGF抗体处理,显示出最好的抗肿瘤活性(TGI:68%或70%)。3种化合物的同时处理,或者抗Ang2/VEGF抗体先与FOLFIRI组合、再于9天后用<小鼠CSF-1R>抗体处理,仅分别产生61%或56%的抗肿瘤活性。在着眼于高于700mm3大小的各个肿瘤的进展时,用<小鼠CSF-1R>抗体与FOLFIRI组合,接着在2天或9天后用抗Ang2/VEGF抗体处理,如此治疗的动物的进展前中值时间在此模型中也优于所有其他处理的进展前中值时间(参见表12)。表13:与抗Ang2/VEGF单克隆抗体和/或FOLFIRI组合的<小鼠CSF1R>抗体在MC38小鼠CRC体内模型中的抗肿瘤功效当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1