免疫原性WT-1肽和其使用方法与流程
本申请得到来自美国国立卫生研究院的资助P01 23766的支持。政府享有本发明的权利。
技术领域
本发明提供肽、包含所述肽的组合物和疫苗,和治疗表达WT1的癌症、降低表达WT1的癌症的发病率和诱导表达WT1的癌症的免疫反应的方法,所述方法包括施用所述肽、包含所述肽的组合物和疫苗。
背景技术:
维尔姆斯瘤(Wilms tumor,WT)是在新生儿中以万分之一的频率出现的儿科肾母细胞瘤,数年来其一直是深入的临床和基础研究的主题。所述肿瘤具胚胎源性,其通常在年龄不到5岁的儿童中检测到并且可以单侧或双侧发生。当发育中的肾脏的浓缩后肾间质细胞不能适当分化时,出现WT。在WT的病因学中涉及维尔姆斯瘤1(WT1)肿瘤抑制基因,这说明了遗传改变可能对发育和肿瘤发生具有影响。
维尔姆斯瘤蛋白I(WT1)是在正常个体发育期间例如在胎儿肾脏、睾丸和卵巢中表达的锌指转录因子。在成人中,WTI表达在造血干细胞、肌上皮祖细胞、肾足细胞以及睾丸和卵巢中的一些细胞上局限于低水平。近来证明WTI在若干类型的白血病中过度表达,这表明WTI对于各种癌症的免疫疗法将是有吸引力的靶标。
维尔姆斯瘤致癌基因蛋白(WT1)对于白血病和多种癌症的免疫疗法是有吸引力的靶标。已鉴定了由WT1蛋白衍生的肽,其诱导能够杀死肿瘤细胞的HLA-A0201限制的细胞毒性CD8 T细胞。两种结合于HLA-A0201(RMFPNAPYL;SEQ ID NO:56)或HLA-A2402(CMTWNQMNL;SEQ ID NO:57)的肽在世界范围内已得到广泛研究并且已经在白血病和其他实体肿瘤患者中进行临床试验(Oka等,科学世界杂志(Scientific World Journal)2007;7:649-665;Mundlos等,发育(Development)1993;119:1329-41;Keilholz等,白血病(Leukemia)2005;19:1318-1323)。这些结果是鼓舞人心的并且已对于针对白血病和多种人类癌症而治疗性靶向WT1源T细胞表位提供了强有力的证据和合理性。
上述两种WT1衍生肽的治疗性应用局限于HLA-A0201型(在约40%的白种人中存在的HLA单倍型)和HLA-A2402型(在约40%的日本人和其他亚洲群体中存在的单倍型)人群。因此,对于可能用于世界上大部分群体的WT1衍生肽存在未满足的需求。为了扩展在更广泛群体范围中的治疗性应用,需要结合多种HLA单倍型的源自WT1蛋白的新型肽。这些肽因此将能够刺激来自较大百分比的目标群体的T细胞,从而允许将处理大部分群体的疫苗策略,其具有持久性细胞毒性记忆细胞。
技术实现要素:
本发明提供肽、组合物和免疫原性组合物如包含免疫原性肽的疫苗,以及治疗表达WT1的癌症、降低表达WT1的癌症的发病率和诱导表达WT1的癌症的免疫反应的方法,所述方法包括施用免疫原性肽,或刺激人类患者外部的T细胞,其然后可以输注至所述患者中进行治疗。
在一个实施方案中,本发明提供一种分离肽,其具有由以下序列中的任一个组成的氨基酸(AA)序列:SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55。在一个实施方案中,本发明提供一种分离的HLA I类结合肽,其具有由以下序列中的任一个组成的氨基酸(AA)序列:SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48。在一个实施方案中,本发明提供一种分离的HLA II类结合WT1肽,其具有由以下序列中的任一个组成的氨基酸(AA)序列:SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55。
在一个实施方案中,本发明提供一种分离肽,其具有由序列SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中的任一个组成的氨基酸(AA)序列,或前述中的任一个的片段。在一个实施方案中,本发明提供一种分离的HLA I类结合肽,其具有由序列SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48中的任一个组成的氨基酸(AA)序列,或前述中的任一个的片段。在一个实施方案中,本发明提供一种分离的HLA II类结合WT1肽,其具有由序列SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55中的任一个组成的氨基酸(AA)序列,或前述中的任一个的片段。
在另一个实施方案中,本发明提供一种组合物,其包含(a)抗原呈递细胞和(b)选自SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的肽。在另一个实施方案中,本发明提供一种组合物,其包含(a)抗原呈递细胞和(b)选自SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48的HLA I类结合肽。在另一个实施方案中,本发明提供一种组合物,其包含(a)抗原呈递细胞和(b)选自SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55的HLA II类结合肽。
在另一个实施方案中,本发明提供一种疫苗,其包含SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的一种或多种肽。在另一个实施方案中,本发明提供一种疫苗,其包含选自SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48的一种或多种HLA I类结合肽。在另一个实施方案中,本发明提供一种疫苗,其包含选自SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55的一种或多种HLA II类结合肽。在另一个实施方案中,本发明提供一种疫苗,其包含选自SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的一种或多种HLA I类结合肽,和选自SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55的一种或多种HLA II类结合肽。
在另一个实施方案中,本发明提供一种治疗具有表达WT1的癌症的受试者的方法,所述方法包括向所述受试者施用本发明的肽或疫苗,从而治疗具有表达WT1的癌症的受试者。
在另一个实施方案中,本发明提供一种降低受试者中的表达WT1的癌症的发病率或其复发的方法,所述方法包括向所述受试者施用本发明的肽或疫苗,从而降低受试者中表达WT1的癌症的发病率或其复发。
在另一个实施方案中,本发明提供一种诱导受试者中的抗癌免疫反应的方法,所述方法包括使所述受试者与免疫原性组合物接触的步骤,所述免疫原性组合物包含(a)WT1蛋白;(b)WT蛋白的修饰片段;(c)编码WT1蛋白的核苷酸分子;或(d)编码WT1蛋白的修饰片段的核苷酸分子,从而在受试者中诱导抗间皮瘤免疫反应。在一个实施方案中,WT1蛋白的修饰片段由如下的肽组成或包含如下的肽,所述肽来自SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55。
在另一个实施方案中,本发明提供一种治疗具有癌症的受试者的方法,所述方法包括向所述受试者施用免疫原性组合物的步骤,所述免疫原性组合物包含(a)WT1蛋白;(b)WT蛋白的修饰片段;(c)编码WT1蛋白的核苷酸分子;或(d)编码WT1蛋白的修饰片段的核苷酸分子,从而治疗具有间皮瘤的受试者。在一个实施方案中,WT1蛋白的修饰片段是来自SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的肽。
在另一个实施方案中,本发明提供一种降低受试者中的癌症发病率或其复发的方法,所述方法包括向所述受试者施用免疫原性组合物的步骤,所述免疫原性组合物包含(a)WT1蛋白;(b)WT蛋白的修饰片段;(c)编码WT1蛋白的核苷酸分子;或(d)编码WT1蛋白的修饰片段的核苷酸分子,从而降低受试者中的间皮瘤发病率或其复发。在一个实施方案中,WT1蛋白的片段是来自SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的肽。
在另一个实施方案中,所述癌症是表达WT1的癌症。在一个实施方案中,所述表达WT1的癌症是急性骨髓性白血病(AML)。在另一个实施方案中,所述表达WT1的癌症与骨髓增生异常综合征(MDS)相关。在另一个实施方案中,所述表达WT1的癌症是MDS。在另一个实施方案中,所述表达WT1的癌症是非小细胞肺癌(NSCLC)。在另一个实施方案中,所述表达WT1的癌症是维尔姆斯瘤。在另一个实施方案中,所述表达WT1的癌症是白血病。在另一个实施方案中,所述表达WT1的癌症是血液科癌症。在另一个实施方案中,所述表达WT1的癌症是淋巴瘤。在另一个实施方案中,所述表达WT1的癌症是结缔组织增生性小圆细胞瘤。在另一个实施方案中,所述表达WT1的癌症是间皮瘤。在另一个实施方案中,所述表达WT1的癌症是恶性间皮瘤。在另一个实施方案中,所述表达WT1的癌症是胃癌。在另一个实施方案中,所述表达WT1的癌症是结肠癌。在另一个实施方案中,所述表达WT1的癌症是肺癌。在另一个实施方案中,所述表达WT1的癌症是乳腺癌。在另一个实施方案中,所述表达WT1的癌症是生殖细胞肿瘤。在另一个实施方案中,所述表达WT1的癌症是卵巢癌。在另一个实施方案中,所述表达WT1的癌症是子宫癌。在另一个实施方案中,所述表达WT1的癌症是甲状腺癌。在另一个实施方案中,所述表达WT1的癌症是肝细胞癌。在另一个实施方案中,所述表达WT1的癌症是甲状腺癌。在另一个实施方案中,所述表达WT1的癌症是肝癌。在另一个实施方案中,所述表达WT1的癌症是肾癌。在另一个实施方案中,所述表达WT1的癌症是卡波西氏肉瘤(Kaposi's sarcoma)。在另一个实施方案中,所述表达WT1的癌症是肉瘤。在另一个实施方案中,所述表达WT1的癌症是任何其他癌瘤或肉瘤。
在另一个实施方案中,所述表达WT1的癌症是实体肿瘤。在另一个实施方案中,所述实体肿瘤与表达WT1的癌症相关。在另一个实施方案中,所述实体肿瘤与骨髓增生异常综合征(MDS)相关。在另一个实施方案中,所述实体肿瘤与非小细胞肺癌(NSCLC)相关。在另一个实施方案中,所述实体肿瘤与肺癌相关。在另一个实施方案中,所述实体肿瘤与乳腺癌相关。在另一个实施方案中,所述实体肿瘤与结肠直肠癌相关。在另一个实施方案中,所述实体肿瘤与前列腺癌相关。在另一个实施方案中,所述实体肿瘤与卵巢癌相关。在另一个实施方案中,所述实体肿瘤与肾癌相关。在另一个实施方案中,所述实体肿瘤与胰腺癌相关。在另一个实施方案中,所述实体肿瘤与脑癌相关。在另一个实施方案中,所述实体肿瘤与胃肠癌相关。在另一个实施方案中,所述实体肿瘤与皮肤癌相关。在另一个实施方案中,所述实体肿瘤与黑色素瘤相关。
在另一个实施方案中,本发明提供一种组合物,其包含本发明的分离肽与至少1种另外的肽。在某些实施方案中,提供包含至少2种不同的本发明的分离肽的组合物。在某些实施方案中,提供包含至少3种或至少4种不同的本发明的分离肽的组合物。每种可能性代表着本发明的独立实施方案。在某些实施方案中,本发明的组合物是疫苗。
在另一个实施方案中,本发明提供一种治疗具有表达WT1的癌症的受试者的方法,所述方法包括向所述受试者施用本发明的肽或组合物,从而治疗具有表达WT1的癌症的受试者。
在另一个实施方案中,本发明提供一种降低受试者中的表达WT1的癌症的发病率或其复发的方法,所述方法包括向所述受试者施用本发明的肽或组合物,从而降低受试者中的表达WT1的癌症的发病率或其复发。
在另一个实施方案中,本发明提供一种诱导WT1蛋白特异性CTL的形成和增殖的方法,所述方法包括使淋巴细胞群体与本发明的肽或组合物接触,从而诱导WT1蛋白特异性CTL的形成和增殖。这种方法可以在体外、离体或体内进行。当在体外或离体进行时,这些CTL然后可以输注至患者中用于治疗作用。
在另一个实施方案中,本发明提供一种诱导(a)WT1蛋白特异性CD8+淋巴细胞;或(b)对WT1蛋白具特异性的CD4+淋巴细胞;或其组合的形成和增殖的方法,所述方法包括使淋巴细胞群体与本发明的肽或组合物接触,从而诱导(a)WT1蛋白特异性CD8+淋巴细胞;或(b)对WT1蛋白具特异性的CD4+淋巴细胞;或其组合的形成和增殖。这种方法可以在体外、离体或体内进行。当在体外或离体进行时,这些CTL然后可以输注至患者中用于治疗作用。
附图说明
因此获得本发明的上述特征、优点和目的以及其他将变得显而易见的主题并且可以详细理解,简要概述本发明的更具体描述。可通过参考其某些实施方案获得上述的细节,所述实施方案在附图中进行说明。这些附图构成说明书的一部分。然而,应注意,附图说明本发明的优选实施方案并且因此不被认为限制其范围。在本文附图中,每种肽的图表中的丛集数据条集从左至右以与从顶部到底部的附图说明中所示相同的顺序呈现。
图1示出T2稳定化测定法的结果,其示出NLMNLGATL肽与HLA-A2分子的结合相比于NQMNLGATL和NYMNLGATL肽更强。将天然NQMNLGATL、变态NLMNLGATL或NYMNLGATL在如材料和方法中所述的指定浓度下脉冲至T2细胞上。通过HLA-A2分子的表达来测量肽对HLA-A2分子的稳定化;
图2 A-B示出NLMNLGATL肽诱导强烈的肽特异性T细胞反应,所述肽与其天然序列NQMNLGATL交叉反应。对于每种肽,条柱从左到右分别代表CD14、天然肽、NLMNLGATL和PSMA。来自健康的HLA-A0201纯合供体的CD3T细胞用NQM或NLMNLGATL肽刺激3(A)或5(B)个回合。在用单独的肽激发后,通过IFN-g分泌测量肽特异性反应。每个数据点代表来自一式三份培养物的平均值+/-SD;
图3示出NLMNLGATL肽诱导T细胞针对WT1+HLA-A0201+白血病细胞的细胞毒性。来自HLA-A0201阳性供体的T细胞用NLMNLGATL肽刺激5个回合。通过针对来自HLA-A2阳性患者的AML细胞系SET-2(WT1+,HLA-A0201+)、HL-60(WT1+,HLA-A0201-)或原发性白血病胚细胞的5小时51Cr释放测定法来测量所述细胞的细胞毒性。每个数据点代表来自一式三份培养物的平均值+/-SD;
图4 A-B示出HLA-A2402供体中的肽特异性T细胞反应。来自健康的HLA-A2402纯合供体的CD3T细胞用NQMNLGATL、NLMNLGATL或NYMNLGATL肽刺激3(A)或5(B)个回合。对于每种肽,条柱从左到右分别代表CD14、天然肽、NLMNLGATL、NYMNLGATL和不相关的肽。在用单独的肽激发后,通过IFN-g分泌测量肽特异性反应。每个数据点代表来自一式三份培养物的平均值+/-SD;
图5 A-B示出HLA-DR.B1肽特异性T细胞反应。(A).CD3T细胞用DR-het-1或DR-het-2肽刺激5个回合并且通过IFN-g Elispot测定法测量表位特异性反应。对于每种肽,条柱从左到右分别代表CD14、天然肽、NLMNLGATL、WT1-CMT、PSMA、DR-Nat-1/Nat-2、DR-het-1/het-2、B2A2L、BA25和HL-60。(B).CD3T细胞用短肽NQMNLGATL、NLMNLGATL和长肽DR-native-1、DR-native-2、DR-het-1或DR-het-2肽刺激5个回合并且通过针对白血病细胞系BA-25(HLA-A2+/A24+,WT1+)和对照HL-60细胞的51Cr释放测定法来测量细胞毒性。每个数据点代表来自一式三份培养物的平均值+/-SD;
图6描绘来自HLA-B0702阳性供体的CD3T细胞在体外用2组肽(总计五种)刺激5次。通过针对单独的肽的IFN-γELISPOT测定法来测量肽特异性反应;从左到右测试的肽是SEQ ID NO:34、37、38、30和31;并且对于每种肽,条柱从左到右分别代表对CD14、Native-1肽、Native-1的Het-1、Native-1的Het-2、Native-2、Native-2的Het-1和对照的反应;和
图7描绘相比于天然序列(SEQ ID NO:5),对于Het-1(SEQ ID NO:6)和Het-2(SEQ ID NO:7)A24肽使用供体SA(5次刺激)的ELISPOT测定法的结果。对于每种肽,条柱从左到右分别代表CD14、A24-天然肽、A24-het-1、A24-het-2、A24-235和PSMA。变态肽产生交叉反应性反应。
具体实施方式
本发明提供免疫原性肽,和包含免疫原性肽的组合物和疫苗,以及治疗表达WT1的癌症、降低表达WT1的癌症的发病率和诱导表达WT1的癌症的免疫反应的方法,所述方法包括施用一种或多种免疫原性肽。
本发明提供合成肽以及治疗表达WT1的癌症、降低表达WT1的癌症的发病率和诱导针对表达WT1的癌症的免疫反应的方法,其包括免疫原性肽。
在另一个实施方案中,衍生本发明的肽的WT1分子具有如下序列:
WT-1蛋白的前述序列是由Gessler等(Gessler M,Poustka A,Cavenee W,Neve RL,Orkin SH,Bruns GA.Homozygous deletion in Wilms tumours of a zinc-finger gene identified by chromosome jumping.自然(Nature).1990;343(6260):774-778.在1990/02/22以DOI 10.1038/343774a0预公布。)公布,其包含575个氨基酸并包括在WT-116的(外显子5+,KTS+)同种型中缺失的N端中的前126个氨基酸。
在另一个实施方案中,WT1序列是
MGSDVRDLNALLPA
VPSLGGGGGCALPVSGAAQWAPVLDFAPPGASAYGSLGGPAPPPAPP
PPPPPPPHSFIKQEPSWGGAEPHEEQCLSAFTVHFSGQFTGTAGACRYGPFGPPPPSQASSGQA
RMFPNAPYLPSCLESQPAIRNQGYSTVTFDGTPSYGHTPSHHAAQFPNHSFKHEDPMGQQGS
LGEQQYSVPPPVYGCHTPTDSCTGSQALLLRTPYSSDNLYQMTSQLECMTWNQMNLGATLK
GVAAGSSSSVKWTEGQSNHSTGYESDNHTTPILCGAQYRIHTHGVFRGIQDVRRVPGVAPTL
VRSASETSEKRPFMCAYPGCNKRYFKLSHLQMHSRKHTGEKPYQCDFKDCERRFSRSDQLK
RHQRRHTGVKPFQCKTCQRKFSRSDHLKTHTRTHTGKTSEKPFSCRWPSCQKKFARSDELVR HHNMHQRNMTKLQLAL(GenBank保藏号AY245105;SEQ ID NO:52)。
在另一个实施方案中,WT1分子具有如下序列:
AAEASAERLQGRRSRGASGSEPQQMGSDVRDLNALLPAVPSLGGGGGCALPVSGAAQWAP
VLDFAPPGASAYGSLGGPAPPPAPPPPPPPPPHSFIKQEPSWGGAEPHEEQCLSAFTVHFSGQF
TGTAGACRYGPFGPPPPSQASSGQARMFPNAPYLPSCLESQPAIRNQGYSTVTFDGTPSYGHT
PSHHAAQFPNHSFKHEDPMGQQGSLGEQQYSVPPPVYGCHTPTDSCTGSQALLLRTPYSSDN
LYQMTSQLECMTWNQMNLGATLKGHSTGYESDNHTTPILCGAQYRIHTHGVFRGIQDVRRV
PGVAPTLVRSASETSEKRPFMCAYPGCNKRYFKLSHLQMHSRKHTGEKPYQCDFKDCERRF
SRSDQLKRHQRRHTGVKPFQCKTCQRKFSRSDHLKTHTRTHTGEKPFSCRWPSCQKKFARS DELVRHHNMHQRNMTKLQLAL(GenBank保藏号NM_000378;SEQ ID NO:53)。
在另一个实施方案中,WT1分子具有如下序列:
MQDPASTCVPEPASQHTLRSGPGCLQQPEQQGVRDPGGIWAKLGAAEASAERLQGRRSRGA
SGSEPQQMGSDVRDLNALLPAVPSLGGGGGCALPVSGAAQWAPVLDFAPPGASAYGSLGGP
APPPAPPPPPPPPPHSFIKQEPSWGGAEPHEEQCLSAFTVHFSGQFTGTAGACRYGPFGPPPPSQ
ASSGQARMFPNAPYLPSCLESQPAIRNQGYSTVTFDGTPSYGHTPSHHAAQFPNHSFKHEDP
MGQQGSLGEQQYSVPPPVYGCHTPTDSCTGSQALLLRTPYSSDNLYQMTSQLECMTWNQM
NLGATLKGVAAGSSSSVKWTEGQSNHSTGYESDNHTTPILCGAQYRIHTHGVFRGIQDVRRV
PGVAPTLVRSASETSEKRPFMCAYPGCNKRYFKLSHLQMHSRKHTGEKPYQCDFKDCERRF
SRSDQLKRHQRRHTGVKPFQCKTCQRKFSRSDHLKTHTRTHTGEKPFSCRWPSCQKKFARS DELVRHHNMHQRNMTKLQLAL(GenBank保藏号NP_077742;SEQ ID No:54)。
在另一个实施方案中,WT1蛋白具有GenBank保藏#NM_024426中所示的序列。在其他实施方案中,WT1蛋白具有或包含以下序列条目中的一个所示的一种序列:NM_024425、NM_024424、NM_000378、S95530、D13624、D12496、D 12497或X77549。在另一个实施方案中,WT1蛋白具有本领域中已知的任何其他WT1序列。本发明提供肽、组合物和免疫原性组合物如包含免疫原性肽的疫苗,以及治疗表达WT1的癌症、降低表达WT1的癌症的发病率和诱导表达WT1的癌症的免疫反应的方法,所述方法包括施用免疫原性肽。在一些情况下,本文所述的肽是衍生自作为WT1的天然序列的肽,并且在本文可被称为WT1衍生肽或WT1肽。
在一个实施方案中,本发明提供一种分离的WT1肽,其具有由序列SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中的任一个组成的氨基酸(AA)序列。在一个实施方案中,本发明提供一种分离的HLA I类结合WT1肽,其具有由序列SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48中的任一个组成的氨基酸(AA)序列。在一个实施方案中,本发明提供一种分离的HLA II类结合WT1肽,其具有由序列SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55中的任一个组成的氨基酸(AA)序列。在另一个实施方案中,HLA I类肽由以下组成或包含以下:SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48,并且HLA II类肽由以下组成或包含以下:SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55。
在一个实施方案中,本发明提供一种分离的WT1肽,其具有包含序列SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中的任一个的氨基酸(AA)序列,或其片段。在一个实施方案中,本发明提供一种分离的HLA I类结合WT1衍生肽,其具有包含序列SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48中的任一个的氨基酸(AA)序列。在一个实施方案中,本发明提供一种分离的HLA II类结合WT1肽,其具有包含序列SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55中的任一个的氨基酸(AA)序列。在另一个实施方案中,HLA I类肽由以下组成或包含以下:SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48,并且HLA II类肽由以下组成或包含以下:SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55。
在另一个实施方案中,本发明提供一种组合物,其包含(a)抗原呈递细胞和(b)选自SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的肽。在另一个实施方案中,本发明提供一种组合物,其包含(a)抗原呈递细胞和(b)选自SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48的HLA I类结合肽。在另一个实施方案中,本发明提供一种组合物,其包含(a)抗原呈递细胞和(b)选自SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55的HLA II类结合肽。在另一个实施方案中,HLA I类肽由以下组成或包含以下:SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48,并且HLA II类肽由以下组成或包含以下:SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55。
在另一个实施方案中,本发明提供一种疫苗,其包含SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的一种或多种肽。在另一个实施方案中,本发明提供一种疫苗,其包含选自SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48的一种或多种HLA I类结合肽。在另一个实施方案中,本发明提供一种疫苗,其包含选自SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55的一种或多种HLA II类结合肽。在另一个实施方案中,本发明提供一种疫苗,其包含选自SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48的一种或多种HLA I类结合肽,和选自SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55的一种或多种HLA II类结合肽。在另一个实施方案中,HLA I类肽由以下组成或包含以下:SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48,并且HLA II类肽由以下组成或包含以下:SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55。
在另一个实施方案中,本发明提供一种治疗具有表达WT1的癌症的受试者的方法,所述方法包括向所述受试者施用本发明的WT1肽或疫苗,从而治疗具有表达WT1的癌症的受试者。
在另一个实施方案中,本发明提供一种降低受试者中的表达WT1的癌症的发病率或其复发的方法,所述方法包括向所述受试者施用本发明的WT1肽或疫苗,从而降低受试者中的表达WT1的癌症的发病率或其复发。
在另一个实施方案中,本发明提供一种诱导受试者中的抗癌免疫反应的方法,所述方法包括使所述受试者与免疫原性组合物接触的步骤,所述免疫原性组合物包含(a)WT1蛋白;(b)WT蛋白的片段;(c)编码WT1蛋白的核苷酸分子;或(d)编码WT1蛋白的片段的核苷酸分子,从而在受试者中诱导抗间皮瘤免疫反应。在一个实施方案中,WT1蛋白的片段由如下的肽组成或包含如下的肽,所述肽来自SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55。在另一个实施方案中,所述片段由如下的肽组成或包含如下的肽,所述肽来自SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48,或SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55。
在另一个实施方案中,本发明提供一种治疗具有癌症的受试者的方法,所述方法包括向所述受试者施用免疫原性组合物的步骤,所述免疫原性组合物包含(a)WT1蛋白;(b)WT蛋白的片段;(c)编码WT1蛋白的核苷酸分子;或(d)编码WT1蛋白的片段的核苷酸分子,从而治疗具有间皮瘤的受试者。在一个实施方案中,WT1蛋白的片段是来自SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的肽。在另一个实施方案中,所述片段由如下的肽组成或包含如下的肽,所述肽来自SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48,或SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55。在另一个实施方案中,HLA I类肽由以下组成或包含以下:SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48,并且HLA II类肽由以下组成或包含以下:SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55。
在另一个实施方案中,本发明提供一种降低受试者中的癌症发病率或其复发的方法,所述方法包括向所述受试者施用免疫原性组合物的步骤,所述免疫原性组合物包含(a)WT1蛋白;(b)WT蛋白的片段;(c)编码WT1蛋白的核苷酸分子;或(d)编码WT1蛋白的片段的核苷酸分子,从而降低受试者中的间皮瘤发病率或其复发。在一个实施方案中,WT1蛋白的片段是来自SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的肽。在另一个实施方案中,所述片段由如下的肽组成或包含如下的肽,所述肽来自SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48,或SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55。在另一个实施方案中,HLA I类肽由以下组成或包含以下:SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48,并且HLA II类肽由以下组成或包含以下:SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55。
在另一个实施方案中,本发明提供一种治疗具有表达WT1的癌症的受试者的方法,所述方法包括向所述受试者施用本发明的WT1肽或疫苗,从而治疗具有表达WT1的癌症的受试者。
在另一个实施方案中,本发明提供一种降低受试者中的表达WT1的癌症的发病率或其复发的方法,所述方法包括向所述受试者施用本发明的WT1肽或疫苗,从而降低受试者中的表达WT1的癌症的发病率或其复发。
在另一个实施方案中,本发明提供一种在受试者中诱导抗癌免疫反应的方法,所述方法包括使所述受试者与免疫原性组合物接触的步骤,所述免疫原性组合物包含(a)WT1蛋白;(b)WT蛋白的片段;(c)编码WT1蛋白的核苷酸分子;或(d)编码WT1蛋白的片段的核苷酸分子,从而在受试者中诱导抗间皮瘤免疫反应。在一个实施方案中,WT1蛋白的片段是来自SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的肽。在另一个实施方案中,所述片段由如下的肽组成或包含如下的肽,所述肽来自SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48,或SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55。在另一个实施方案中,HLA I类肽由以下组成或包含以下:SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48,并且HLA II类肽由以下组成或包含以下:SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55。
在另一个实施方案中,本发明提供一种治疗具有癌症的受试者的方法,所述方法包括向所述受试者施用免疫原性组合物的步骤,所述免疫原性组合物包含(a)WT1蛋白;(b)WT蛋白的片段;(c)编码WT1蛋白的核苷酸分子;或(d)编码WT1蛋白的片段的核苷酸分子,从而治疗具有间皮瘤的受试者。在一个实施方案中,WT1蛋白的片段是来自SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的肽。
在另一个实施方案中,本发明提供一种降低受试者中的癌症发病率或其复发的方法,所述方法包括向所述受试者施用免疫原性组合物的步骤,所述免疫原性组合物包含(a)WT1蛋白;(b)WT蛋白的片段;(c)编码WT1蛋白的核苷酸分子;或(d)编码WT1蛋白的片段的核苷酸分子,从而降低受试者中的间皮瘤发病率或其复发。在一个实施方案中,WT1蛋白的片段是来自SEQ ID NO:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的肽。
在另一个实施方案中,所述癌症是表达WT1的癌症。在一个实施方案中,所述表达WT1的癌症是急性骨髓性白血病(AML)。在另一个实施方案中,所述表达WT1的癌症与骨髓增生异常综合征(MDS)相关。在另一个实施方案中,所述表达WT1的癌症是MDS。在另一个实施方案中,所述表达WT1的癌症是非小细胞肺癌(NSCLC)。在另一个实施方案中,所述表达WT1的癌症是维尔姆斯瘤。在另一个实施方案中,所述表达WT1的癌症是白血病。在另一个实施方案中,所述表达WT1的癌症是血液科癌症。在另一个实施方案中,所述表达WT1的癌症是淋巴瘤。在另一个实施方案中,所述表达WT1的癌症是结缔组织增生性小圆细胞瘤。在另一个实施方案中,所述表达WT1的癌症是间皮瘤。在另一个实施方案中,所述表达WT1的癌症是恶性间皮瘤。在另一个实施方案中,所述表达WT1的癌症是胃癌。在另一个实施方案中,所述表达WT1的癌症是结肠癌。在另一个实施方案中,所述表达WT1的癌症是肺癌。在另一个实施方案中,所述表达WT1的癌症是乳腺癌。在另一个实施方案中,所述表达WT1的癌症是生殖细胞肿瘤。在另一个实施方案中,所述表达WT1的癌症是卵巢癌。在另一个实施方案中,所述表达WT1的癌症是子宫癌。在另一个实施方案中,所述表达WT1的癌症是甲状腺癌。在另一个实施方案中,所述表达WT1的癌症是肝细胞癌。在另一个实施方案中,所述表达WT1的癌症是甲状腺癌。在另一个实施方案中,所述表达WT1的癌症是肝癌。在另一个实施方案中,所述表达WT1的癌症是肾癌。在另一个实施方案中,所述表达WT1的癌症是卡波西氏肉瘤。在另一个实施方案中,所述表达WT1的癌症是肉瘤。在另一个实施方案中,所述表达WT1的癌症是任何其他癌瘤或肉瘤。
在另一个实施方案中,所述表达WT1的癌症是实体肿瘤。在另一个实施方案中,所述实体肿瘤与表达WT1的癌症相关。在另一个实施方案中,所述实体肿瘤与骨髓增生异常综合征(MDS)相关。在另一个实施方案中,所述实体肿瘤与非小细胞肺癌(NSCLC)相关。在另一个实施方案中,所述实体肿瘤与肺癌相关。在另一个实施方案中,所述实体肿瘤与乳腺癌相关。在另一个实施方案中,所述实体肿瘤与结肠直肠癌相关。在另一个实施方案中,所述实体肿瘤与前列腺癌相关。在另一个实施方案中,所述实体肿瘤与卵巢癌相关。在另一个实施方案中,所述实体肿瘤与肾癌相关。在另一个实施方案中,所述实体肿瘤与胰腺癌相关。在另一个实施方案中,所述实体肿瘤与脑癌相关。在另一个实施方案中,所述实体肿瘤与胃肠癌相关。在另一个实施方案中,所述实体肿瘤与皮肤癌相关。在另一个实施方案中,所述实体肿瘤与黑色素瘤相关。
在另一个实施方案中,本发明提供一种组合物,其包含本发明的分离肽与至少1种另外的WT1衍生肽。在某些实施方案中,提供包含本发明的至少2种不同的分离肽的组合物。在某些实施方案中,提供包含本发明的至少3种或至少4种不同的分离肽的组合物。每种可能性代表着本发明的独立实施方案。在某些实施方案中,本发明的组合物是疫苗。
在另一个实施方案中,本发明提供一种治疗具有表达WT1的癌症的受试者的方法,所述方法包括向所述受试者施用本发明的肽或组合物,从而治疗具有表达WT1的癌症的受试者。
在另一个实施方案中,本发明提供一种降低受试者中的表达WT1的癌症的发病率或其复发的方法,所述方法包括向所述受试者施用本发明的肽或组合物,从而降低受试者中的表达WT1的癌症的发病率或其复发。
在另一个实施方案中,本发明提供一种诱导WT1蛋白特异性CTL的形成和增殖的方法,所述方法包括使淋巴细胞群体与本发明的肽或组合物接触,从而诱导WT1蛋白特异性CTL的形成和增殖。这种方法可以在体外、离体或体内进行。当在体外或离体进行时,然后可以将这些CTL输注至患者中用于治疗作用。
在另一个实施方案中,本发明提供一种诱导(a)WT1蛋白特异性CD8+淋巴细胞;或(b)对WT1蛋白具特异性的CD4+淋巴细胞;或其组合的形成和增殖的方法,所述方法包括使淋巴细胞群体与本发明的肽或组合物接触,从而诱导(a)WT1蛋白特异性CD8+淋巴细胞;或(b)对WT1蛋白具特异性的CD4+淋巴细胞;或其组合的形成和增殖。这种方法可以在体外、离体或体内进行。当在体外或离体进行时,然后可以将这些CTL输注至患者中用于治疗作用。
在本发明的方法和组合物的另一个实施方案中,“肽”是指由肽键连接的亚单位AA的化合物。在另一个实施方案中,所述肽包含AA类似物。在另一个实施方案中,所述肽包含肽模拟物。下文列举可以包括于本发明的方法和组合物的肽中的不同的AA类似物和肽模拟物。在另一个实施方案中,所述亚单位由肽键连接。在另一个实施方案中,所述亚单位由另一种类型的键、例如酯、醚等连接。每种可能性代表着本发明的独立实施方案。
本发明的未改变肽(如上文和下文所述)在本文中统称为“WT1肽”。下文关于“WT1肽”列举的每种实施方案适用于本发明的未改变WT1肽和HLA I类和II类变态肽。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明的WT1肽结合于HLA I类分子或II类分子。在另一个实施方案中,所述肽结合于I类和II类分子。在另一个实施方案中,所述HLA II类分子是HLA-DRB分子。在另一个实施方案中,所述HLA II类分子是HLA-DRA分子。在另一个实施方案中,所述HLA分子是HLA-DQA1分子。在另一个实施方案中,所述HLA分子是HLA-DQB1分子。在另一个实施方案中,所述HLA分子是HLA-DPA1分子。在另一个实施方案中,所述HLA分子是HLA-DPB1分子。在另一个实施方案中,所述HLA分子是HLA-DMA分子。在另一个实施方案中,所述HLA分子是HLA-DMB分子。在另一个实施方案中,所述HLA分子是HLA-DOA分子。在另一个实施方案中,所述HLA分子是HLA-DOB分子。在另一个实施方案中,所述HLA分子是本领域中已知的任何其他HLA II类分子。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,结合基序包含于本发明的肽中或者在另一个实施方案中包含本发明的肽的HLA I类分子是HLA-A分子。在另一个实施方案中,所述HLA I类分子是HLA-B分子。在另一个实施方案中,所述HLA I类分子是HLA-C分子。在另一个实施方案中,所述HLA I类分子是HLA-A0201分子。在另一个实施方案中,所述分子是HLA A1。在另一个实施方案中,所述HLA I类分子是HLA A2。在另一个实施方案中,所述HLA I类分子是HLA A2.1。在另一个实施方案中,所述HLA I类分子是HLA A3。在另一个实施方案中,所述HLA I类分子是HLA A3.2。在另一个实施方案中,所述HLA I类分子是HLA A11。在另一个实施方案中,所述HLA I类分子是HLA A24。在另一个实施方案中,所述HLA I类分子是HLA B7。在另一个实施方案中,所述HLA I类分子是HLA B27。在另一个实施方案中,所述HLA I类分子是HLA B8。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明的方法和组合物的HLA I类分子结合WT1衍生肽结合于HLA I类分子的超家族。在另一个实施方案中,所述超家族是A2超家族。在另一个实施方案中,所述超家族是A3超家族。在另一个实施方案中,所述超家族是A24超家族。在另一个实施方案中,所述超家族是B7超家族。在另一个实施方案中,所述超家族是B27超家族。在另一个实施方案中,所述超家族是B44超家族。在另一个实施方案中,所述超家族是C1超家族。在另一个实施方案中,所述超家族是C4超家族。在另一个实施方案中,所述超家族是本领域中已知的任何其他超家族。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,所述HLA分子是A0101、A0201、A0203、A2402、A6901、B0702、A3101、B3501、B3503、B3508、B3802、B3801、B3901、B4001、B4402、B4701、B5701、C0401、C1701、DRB10101、DRB10402、DRB10402、DRB10401或DRB11104分子。在另一个实施方案中,SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48,以及SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55的肽结合于下表中关于每种肽所述的HLA I类或II类分子。在另一个实施方案中,所述HLA I类肽由以下组成或包含以下:SEQ ID NO:6、7、30、31、32、33、34、35、36、37、38、41、42、47和48,并且HLA II类肽由以下组成或包含以下:SEQ ID NO:8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、39、43、44、46、49、50和55,并且结合于下表中关于每种肽所示的一种或多种相应的HLA分子。在一个实施方案中,某些肽可以结合于一种以上的HLA等位基因。
在另一个实施方案中,提供本发明的肽的修饰。在一个实施方案中,所述修饰包含至少一种变态氨基酸改变,也称为突变或突变的,或锚残基突变(参见下文)。本发明的修饰肽的HLA I类分子结合基序相对于所述肽的未突变对应物展现对于HLA I类分子的亲和力增加。在另一个实施方案中,点突变增加分离的突变WT1衍生肽对于HLA I类分子的亲和力。在另一个实施方案中,亲和力增加是相对于衍生分离的突变的WT1衍生肽的分离的未突变WT1衍生肽的亲和力(对于相同的HLA I类分子)。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明的方法和组合物的WT1肽经过如此设计以展现对于HLA分子的亲和力。在另一个实施方案中,所述亲和力是如本文所述的高亲和力。
在另一个实施方案中,被称为主要组织相容性复合物(MHC)分子的HLA分子结合肽并将其呈递至免疫细胞。因此,在另一个实施方案中,肽的免疫原性由其对于HLA分子的亲和力部分地确定。HLA I类分子与通常存在于细胞毒性T淋巴细胞(CTL)上的CD8分子相互作用。HLA II类分子与通常存在于辅助T淋巴细胞上的CD4分子相互作用。
在另一个实施方案中,本发明的肽具免疫原性。在另一个实施方案中,“免疫原性”是指刺激、引起或参与免疫反应的能力。在另一个实施方案中,所引起的免疫反应是细胞介导的免疫反应。在另一个实施方案中,所述免疫反应是细胞介导的反应与体液反应的组合。
在另一个实施方案中,结合于MHC分子-肽复合物的T细胞变得激活并诱导以增殖和溶解表达包含所述肽的蛋白质的细胞。T细胞通常最初由“专门的”抗原呈递细胞(“APC”;例如树突细胞、单核细胞和巨噬细胞)激活,相对于无反应性或细胞凋亡,所述抗原呈递细胞呈递鼓励T细胞活化的共刺激分子。在另一个实施方案中,如本文所述,反应是变态的,以使得CTL溶解赘生细胞,其表达具有与本发明的肽、或不同于用于首先刺激T细胞的肽同源的AA序列的蛋白质。
在另一个实施方案中,T细胞与本发明的肽的遭遇诱导其分化成效应细胞和/或记忆T细胞。效应细胞或记忆T细胞与相同的肽、或在另一个实施方案中与本发明的相关肽之间的后续遭遇导致更快和更强烈的免疫反应。在另一个实施方案中,通过测量暴露于肽的T细胞群体的增殖程度来计量这些反应。在另一个实施方案中,利用下文列举的任何方法来计量这些反应。
在另一个实施方案中,本发明的方法和组合物的肽以高亲和力结合HLA II类分子。在其他实施方案中,所述HLA II类分子是本文列举的任何HLA II类分子。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明的方法和组合物的肽的衍生物以高亲和力结合HLA I类分子。在其他实施方案中,所述MHC I类分子是本文列举的任何MHC I类分子。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明的方法和组合物的肽以显著亲和力结合HLA II类分子,而衍生自原始肽的肽以显著亲和力结合HLA I类分子。
在另一个实施方案中,“亲和力”是指将标准肽与所示MHC分子的结合抑制50%所需的肽浓度。在另一个实施方案中,“高亲和力”是指所述亲和力使得将标准肽的结合抑制50%需要浓度为约500纳摩尔(nM)或更小的肽。在另一个实施方案中,需要浓度为约400nM或更小的肽。在另一个实施方案中,结合亲和力为300nM。在另一个实施方案中,结合亲和力为200nM。在另一个实施方案中,结合亲和力为150nM。在另一个实施方案中,结合亲和力为100nM。在另一个实施方案中,结合亲和力为80nM。在另一个实施方案中,结合亲和力为60nM。在另一个实施方案中,结合亲和力为40nM。在另一个实施方案中,结合亲和力为30nM。在另一个实施方案中,结合亲和力为20nM。在另一个实施方案中,结合亲和力为15nM。在另一个实施方案中,结合亲和力为10nM。在另一个实施方案中,结合亲和力为8nM。在另一个实施方案中,结合亲和力为6nM。在另一个实施方案中,结合亲和力为4nM。在另一个实施方案中,结合亲和力为3nM。在另一个实施方案中,结合亲和力为2nM。在另一个实施方案中,结合亲和力为1.5nM。在另一个实施方案中,结合亲和力为1nM。在另一个实施方案中,结合亲和力为0.8nM。在另一个实施方案中,结合亲和力为0.6nM。在另一个实施方案中,结合亲和力为0.5nM。在另一个实施方案中,结合亲和力为0.4nM。在另一个实施方案中,结合亲和力为0.3nM。在另一个实施方案中,结合亲和力小于0.3nM。
在另一个实施方案中,“亲和力”是指与MHC分子的结合强度的量度。在另一个实施方案中,使用本领域中已知的方法测量亲和力以测量竞争性结合亲和力。在另一个实施方案中,使用本领域中已知的方法测量亲和力以测量相对结合亲和力。在另一个实施方案中,所述方法是竞争性结合测定法。在另一个实施方案中,所述方法是放射免疫测定法或RIA。在另一个实施方案中,所述方法是BiaCore分析。在另一个实施方案中,所述方法是本领域中已知的任何其他方法。在另一个实施方案中,所述方法得到的IC50是相对于具有已知亲和力的参考肽的IC50。
每种类型的亲和力和测量亲和力的方法代表着本发明的独立实施方案。
在另一个实施方案中,“高亲和力”是指0.5-500nM的IC50。在另一个实施方案中,IC50是1-300nM。在另一个实施方案中,IC50是1.5-200nM。在另一个实施方案中,IC50是2-100nM。在另一个实施方案中,IC50是3-100nM。在另一个实施方案中,IC50是4-100nM。在另一个实施方案中,IC50是6-100nM。在另一个实施方案中,IC50是10-100nM。在另一个实施方案中,IC50是30-100nM。在另一个实施方案中,IC50是3-80nM。在另一个实施方案中,IC50是4-60nM。在另一个实施方案中,IC50是5-50nM。在另一个实施方案中,IC50是6-50nM。在另一个实施方案中,IC50是8-50nM。在另一个实施方案中,IC50是10-50nM。在另一个实施方案中,IC50是20-50nM。在另一个实施方案中,IC50是6-40nM。在另一个实施方案中,IC50是8-30nM。在另一个实施方案中,IC50是10-25nM。在另一个实施方案中,IC50是15-25nM。每种亲和力和亲和力范围代表着本发明的独立实施方案。
在另一个实施方案中,本发明的方法和组合物的肽结合于HLA分子的超家族。HLA分子的超家族共用非常类似或相同的结合基序。在另一个实施方案中,所述超家族是HLA I类超家族。在另一个实施方案中,所述超家族是HLA II类超家族。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,术语“HLA结合肽”、“HLA I类分子结合肽”和“HLA II类分子结合肽”是指以可测量的亲和力结合HLA分子的肽。在另一个实施方案中,所述术语是指以高亲和力结合HLA分子的肽。在另一个实施方案中,所述术语是指以足够亲和力结合HLA分子以激活T细胞前体的肽。在另一个实施方案中,所述术语是指以足够亲和力结合HLA分子以介导T细胞识别的肽。在其他实施方案中,HLA分子是本文列举的任何HLA分子。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,“变态的”是指产生识别衍生变态肽的原始肽(例如不含锚残基或其他残基突变的肽)的免疫反应的肽。在另一个实施方案中,“原始肽”是指本发明的肽。在另一个实施方案中,“变态的”是指产生识别衍生变态肽的原始肽的免疫反应的肽,其中由变态肽疫苗接种所产生的免疫反应大于由原始肽疫苗接种所产生的免疫反应。在另一个实施方案中,“变态的”免疫反应是指识别衍生改进肽的原始肽(例如不含锚残基突变的肽)的免疫反应。在另一个实施方案中,“变态的”免疫反应是指识别衍生变态肽的原始肽的免疫反应,其中由变态肽疫苗接种所产生的免疫反应的量值大于由原始肽疫苗接种所产生的免疫反应。在另一个实施方案中,由变态肽疫苗接种所产生的免疫反应的量值大于大体上等于原始肽疫苗接种反应的免疫反应。在另一个实施方案中,由变态肽疫苗接种所产生的免疫反应的量值大于免疫反应且小于用原始肽疫苗接种的反应。在另一个实施方案中,本发明的变态肽是HLA I类变态肽。如下文所述,用于鉴定HLA I类和II类残基以及用于改进通过残基突变的HLA结合的方法是本领域中众所周知的。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明的变态肽相对于衍生变态肽的WT1肽(“天然肽”)诱导增加至少2倍的免疫反应。在另一个实施方案中,相对于天然肽增加3倍。在另一个实施方案中,相对于天然肽增加5倍。在另一个实施方案中,相对于天然肽增加7倍。在另一个实施方案中,相对于天然肽增加10倍。在另一个实施方案中,相对于天然肽增加15倍。在另一个实施方案中,相对于天然肽增加20倍。在另一个实施方案中,相对于天然肽增加30倍。在另一个实施方案中,相对于天然肽增加50倍。在另一个实施方案中,相对于天然肽增加100倍。在另一个实施方案中,相对于天然肽增加150倍。在另一个实施方案中,相对于天然肽增加200倍。在另一个实施方案中,相对于天然肽增加300倍。在另一个实施方案中,相对于天然肽增加500倍。在另一个实施方案中,相对于天然肽增加1000倍。在另一个实施方案中,相对于天然肽增加1000倍以上。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明提供一种由本发明的分离WT1肽衍生的HLA II类变态肽。在另一个实施方案中,衍生方法包括引入增强所述肽与HLA II类分子的结合的突变。在另一个实施方案中,衍生方法由引入增强所述肽与HLA I类分子的结合的突变组成。在另一个实施方案中,所述突变在HLA II类锚残基中。在另一个实施方案中,以与如本文所示例的HLA I类变态肽的鉴定和测试类似的方式鉴定和测试本发明的变态II类肽。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,通过HLA II类基序锚残基的突变产生或改进本发明的肽中的HLA II类结合位点。在另一个实施方案中,被修饰的锚残基在P1位置。在另一个实施方案中,所述锚残基在P2位置。在另一个实施方案中,所述锚残基在P6位置。在另一个实施方案中,所述锚残基在P9位置。在另一个实施方案中,所述锚残基选自P1、P2、P6和P9位置。在另一个实施方案中,所述锚残基在P3位置。在另一个实施方案中,所述锚残基在P4位置。在另一个实施方案中,所述锚残基在P5位置。在另一个实施方案中,所述锚残基在P6位置。在另一个实施方案中,所述锚残基在P8位置。在另一个实施方案中,所述锚残基在P10位置。在另一个实施方案中,所述锚残基在P11位置。在另一个实施方案中,所述锚残基在P12位置。在另一个实施方案中,所述锚残基在P13位置。在另一个实施方案中,所述锚残基在本领域中已知的HLA II类分子的任何其他锚残基处。在另一个实施方案中,除P1、P2、P6和P9之外的残基充当次要锚残基;因此,使其突变可以改进HLA II类结合。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,通过引入产生锚基序的突变来产生变态肽。在另一个实施方案中,“锚基序”或“锚残基”是指在HLA结合序列中的特定位置处的1个或一组优选残基。在另一个实施方案中,
HLA结合序列是HLA II类结合序列。在另一个实施方案中,所述HLA结合序列是HLA I类结合序列。在另一个实施方案中,对应于锚基序的位置是在结合HLA分子中起显著作用的那些。在另一个实施方案中,所述锚残基是主要锚基序。在另一个实施方案中,所述锚残基是次要锚基序。每种可能性代表着本发明的独立实施方案。
用于预测MHC I类和II类表位的方法是本领域中众所周知的。在一个实施方案中,可在http://bimas.dcrt.nih.gov/cgi-bin/molbio/ken parker comboform获得的Bioinformatics&Molecular Analysis Section(National Institutes of Health,Washington,DC)的软件是有用的。这种软件在来自HLA I类分子的预测半衰期解离系数上评定9-mer或10-mer肽(Pinilla等,免疫学当前观点(Curr Opin Immunol),11(2):第193-202页(1999))。在另一个实施方案中,使用TEPITOPE(Meister GE,Roberts CG等,疫苗(Vaccine)1995 13:581-91)预测MHC II类表位。在另一个实施方案中,使用EpiMatrix(De Groot AS,Jesdale BM等,艾滋病研究和人类逆转录病毒(AIDS Res Hum Retroviruses)1997 13:529-31)预测MHC II类表位。在另一个实施方案中,使用Predict法(Yu K,Petrovsky N等,分子医学(Mol Med.)2002 8:137-48)预测MHC II类表位。在另一个实施方案中,使用SYFPEITHI表位预测算法预测MHC II类表位(实施例)。在另一个实施方案中,使用Rankpep预测MHC II类表位。在另一个实施方案中,使用本领域中已知的任何其他方法预测MHC II类表位。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,在HLA II类结合肽(例如HLA-DR结合肽)的情况下,被修饰的锚残基在P1位置中。在另一个实施方案中,所述锚残基在P2位置中。在另一个实施方案中,所述锚残基在P6位置中。在另一个实施方案中,所述锚残基在P9位置中。在其他实施方案中,所述锚残基在P3、P4、P5、P6、P8、P10、P11、P12或P13位置中。在另一个实施方案中,所述锚残基是本领域中已知的HLA II类分子的任何其他锚残基。在另一个实施方案中,除了P1、P2、P6和P9之外的残基充当次要锚残基;因此,使其突变可以改进HLA II类结合。在另一个实施方案中,使上述残基的任何组合突变。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明的WT1肽结合于2种不同的HLA II类分子。在另一个实施方案中,所述肽结合于三种不同的HLA II类分子。在另一个实施方案中,所述肽结合于四种不同的HLA II类分子。在另一个实施方案中,所述肽结合于五种不同的HLA II类分子。在另一个实施方案中,所述肽结合于六种不同的HLA II类分子。在另一个实施方案中,所述肽结合于六种以上不同的HLA II类分子。
在另一个实施方案中,由本发明的WT1肽结合的HLA II类分子由给定HLA II类基因座处的两种或更多种不同的等位基因编码。在另一个实施方案中,HLA II类分子由基因座处的3种不同等位基因编码。在另一个实施方案中,HLA II类分子由基因座处的4种不同等位基因编码。在另一个实施方案中,HLA II类分子由基因座处的5种不同等位基因编码。在另一个实施方案中,HLA II类分子由基因座处的6种不同等位基因编码。在另一个实施方案中,HLA II类分子由基因座处的6种以上不同等位基因编码。
在另一个实施方案中,由WT1肽结合的HLA II类分子被2种不同基因座处的HLA II类基因编码。在另一个实施方案中,所结合的HLA分子由2种或更多种不同基因座处的HLA II类基因编码。在另一个实施方案中,所结合的HLA分子被3种不同基因座处的HLA II类基因编码。在另一个实施方案中,所结合的HLA分子被3种或更多种不同基因座处的HLA II类基因编码。在另一个实施方案中,所结合的HLA分子被4种不同基因座处的HLA II类基因编码。在另一个实施方案中,所结合的HLA分子被4种或更多种不同基因座处的HLA II类基因编码。在另一个实施方案中,所结合的HLA分子被4种以上不同基因座处的HLA II类基因编码。在其他实施方案中,所述基因座选自HLA-DRB基因座。在另一个实施方案中,所述HLA II类结合肽是HLA-DRA结合肽。在另一个实施方案中,所述肽是HLA-DQA1结合肽。在另一个实施方案中,所述肽是HLA-DQB1结合肽。在另一个实施方案中,所述肽是HLA-DPA1结合肽。在另一个实施方案中,所述肽是HLA-DPB1结合肽。在另一个实施方案中,所述肽是HLA-DMA结合肽。在另一个实施方案中,所述肽是HLA-DMB结合肽。在另一个实施方案中,所述肽是HLA-DOA结合肽。在另一个实施方案中,所述肽是HLA-DOB结合肽。在另一个实施方案中,所述肽结合于本领域中已知的任何其他HLA II类分子。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明的WT1肽结合于2种不同的HLA-DRB分子。在另一个实施方案中,所述肽结合于3种不同的HLA-DRB分子。在另一个实施方案中,所述肽结合于4种不同的HLA-DRB分子。在另一个实施方案中,所述肽结合于5种不同的HLA-DRB分子。在另一个实施方案中,所述肽结合于6种不同的HLA-DRB分子。在另一个实施方案中,所述肽结合于6种以上不同的HLA-DRB分子。
在另一个实施方案中,本发明的WT1肽结合于由2种不同HLA-DRB等位基因编码的HLA-DRB分子。在另一个实施方案中,所述HLA-DRB分子由3种不同HLA-DRB等位基因编码。在另一个实施方案中,所述HLA-DRB分子由4种不同HLA-DRB等位基因编码。在另一个实施方案中,所述HLA-DRB分子由5种不同HLA-DRB等位基因编码。在另一个实施方案中,所述HLA-DRB分子由6种不同HLA-DRB等位基因编码。在另一个实施方案中,所述HLA-DRB分子由6种以上不同HLA-DRB等位基因编码。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明的WT1肽结合于由选自DRB 101、DRB 301、DRB 401、DRB 701、DRB 1101和DRB 1501的2种不同HLA-DRB等位基因编码的HLA-DRB分子。在另一个实施方案中,所述WT1肽结合于由选自DRB 101、DRB 301、DRB 401、DRB 701、DRB 1101和DRB 1501的3种不同HLA-DRB等位基因编码的HLA-DRB分子。在另一个实施方案中,所述WT1肽结合于由选自DRB 101、DRB 301、DRB 401、DRB 701、DRB 1101和DRB 1501的4种不同HLA-DRB等位基因编码的HLA-DRB分子。在另一个实施方案中,所述WT1肽结合于由选自DRB 101、DRB 301、DRB 401、DRB 701、DRB 1101、DRB 1104和DRB 1501的5种不同HLA-DRB等位基因编码的HLA-DRB分子。在另一个实施方案中,所述WT1肽结合于由以下HLA-DRB等位基因:DRB 101、DRB 301、DRB 401、DRB 701、DRB 1101和DRB 1501中的每个编码的HLA-DRB分子。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明提供一种包含2种不同的本发明WT1肽的组合物。在另一个实施方案中,2种不同的WT1肽都是未改变的。在另一个实施方案中,1种WT1肽是未改变的,而另一种是变态的。在另一个实施方案中,两种WT1肽都是变态的。
在另一个实施方案中,所述组合物包含3种不同的本发明的WT1肽。在另一个实施方案中,所述组合物包含4种不同的本发明的WT1肽。在另一个实施方案中,所述组合物包含5种不同的本发明的WT1肽。在另一个实施方案中,所述组合物包含5种以上不同的本发明的分离WT1肽。
在另一个实施方案中,组合物中的2种WT1肽是未改变的。在另一个实施方案中,组合物中的2种WT1肽是变态的。在另一个实施方案中,组合物中的2种WT1肽是未改变的,并且2种是变态的。在另一个实施方案中,组合物中的2种以上WT1肽是未改变的。在另一个实施方案中,组合物中的2种以上WT1肽是变态的。在另一个实施方案中,组合物中的2种以上WT1肽是未改变的,并且2种以上是变态的。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明组合物中的1种另外的WT1肽具有选自SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中所示序列的序列。在另一个实施方案中,2种另外的WT1肽具有选自SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中所示序列的序列。在另一个实施方案中,3种另外的WT1肽具有选自SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中所示序列的序列。
在另一个实施方案中,本领域中已知的任何其他免疫原性WT1肽被用作另外的WT1肽。在另一个实施方案中,利用本领域中已知的免疫原性WT1肽的任何组合。其他WT1肽的非限制性来源包括WO2005053618、WO2007047764和WO2007120673。
每种另外的WT1肽和其每种组合代表着本发明的独立实施方案。
在另一个实施方案中,本发明的组合物含有衍生自本发明的相同分离WT1肽的2种HLA II类变态肽。在另一个实施方案中,所述2种HLA II类变态肽在不同的HLA II类分子锚残基中含有突变。在另一个实施方案中,2种HLA II类变态肽在相同的锚残基中含有不同的突变。在另一个实施方案中,2种HLA II类变态肽衍生自本发明的不同分离WT1肽。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,2种本发明WT1肽或对应于两种本发明HLA II类变态肽的WT1肽彼此重叠。在另一个实施方案中,肽之间的重叠为至少7个氨基酸(AA)。在另一个实施方案中,重叠为至少8个AA。在另一个实施方案中,重叠为至少9个AA。在另一个实施方案中,重叠为7个AA。在另一个实施方案中,重叠为8个AA。在另一个实施方案中,重叠为9个AA。在另一个实施方案中,重叠为10个AA。在另一个实施方案中,重叠为11个AA。在另一个实施方案中,重叠为12个AA。在另一个实施方案中,重叠为13个AA。在另一个实施方案中,重叠为14个AA。在另一个实施方案中,重叠为15个AA。在另一个实施方案中,重叠为16个AA。在另一个实施方案中,重叠为多于16个AA。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明组合物中的肽结合于2种不同的HLA II类分子。在另一个实施方案中,所述肽结合于3种不同的HLA II类分子。在另一个实施方案中,所述肽结合于4种不同的HLA II类分子。在另一个实施方案中,所述肽结合于5种不同的HLA II类分子。在另一个实施方案中,所述肽结合于5种以上不同的HLA II类分子。在另一个实施方案中,所述组合物中的肽结合于相同的HLA II类分子。
在另一个实施方案中,本发明组合物中的每种WT1肽结合于一组HLA II类分子。在另一个实施方案中,每种WT1肽结合于不同组的HLA II类分子。在另一个实施方案中,组合物中的WT1肽结合于相同组的HLA II类分子。在另一个实施方案中,2种WT1肽结合于不同但重叠组的HLA II类分子。在另一个实施方案中,2种或更多种WT1肽结合于相同组的HLA II类分子,而另一种WT1肽结合于不同组。在另一个实施方案中,2种或更多种WT1肽结合于重叠组的HLA II类分子,而另一种WT1肽结合于不同组。
在另一个实施方案中,本发明组合物中的2种或更多种WT1肽各自结合于1种以上HLA-DRB分子。在另一个实施方案中,由组合物中的肽结合的4种或更多种HLA-DRB分子彼此不同。在另一个实施方案中,所述HLA-DRB分子由不同的HLA-DRB等位基因编码。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,由本发明组合物中的WT1肽结合的2种或更多种HLA II类分子是HLA-DRB分子。在另一个实施方案中,所结合的3种或更多种HLA II类分子是HLA-DRB分子。在其他实施方案中,所结合的HLA II类分子可以是本文列举的任何HLA II类分子。在另一个实施方案中,所结合的HLA II类分子由给定基因座处的2种或更多种不同的HLA II类等位基因编码。在另一个实施方案中,所结合的HLA II类分子由2个或更多个不同基因座处的HLA II类基因编码。
上述组合物中的每种代表着本发明的独立实施方案。
在另一个实施方案中,“一组HLA II类分子”是指由特定基因座处的不同等位基因编码的HLA II类分子。在另一个实施方案中,所述术语是指具有特定结合特异性的HLA II类分子。在另一个实施方案中,所述术语是指具有特定肽一致序列的HLA II类分子。在另一个实施方案中,所述术语是指HLA II类分子的超家族。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明提供一种组合物,其包含本发明的未改变HLA II类分子结合WT1肽和第二HLA I类分子结合WT1肽。在另一个实施方案中,除了HLA I类分子结合WT1肽之外,所述组合物包含1种以上本发明的HLA II类分子结合WT1肽。在另一个实施方案中,除了HLA II类分子结合WT1肽之外,所述组合物包含1种以上HLA I类分子结合WT1肽。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,HLA I类分子结合WT1肽的AA序列包含选自SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的序列。在另一个实施方案中,HLA I类分子结合WT1肽的AA序列选自SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中所示的序列。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,HLA I类分子结合WT1肽是HLA I类变态肽。在另一个实施方案中,HLA I类分子结合WT1肽在如本文进一步描述的其HLA I类分子锚残基中含有突变。如本文所提供,WT1衍生肽在HLA锚残基中得到修饰以产生与HLA-A0201和HLA-A0301的结合预测增加的变态肽。具有增加的预测结合的肽也展现结合HLA I类分子的能力增强和增加的免疫原性。
在另一个实施方案中,增强MHC结合的突变是在HLA I类变态肽的位置1处的残基中。在另一个实施方案中,残基变为酪氨酸。在另一个实施方案中,残基变为甘氨酸。在另一个实施方案中,残基变为苏氨酸。在另一个实施方案中,残基变为苯丙氨酸。在另一个实施方案中,残基变为本领域中已知的任何其他残基。在另一个实施方案中,位置1中的取代(例如变为酪氨酸)使位置2锚残基的结合稳定化。
在另一个实施方案中,突变在HLA I类变态肽的位置2中。在另一个实施方案中,残基变为亮氨酸。在另一个实施方案中,残基变为缬氨酸。在另一个实施方案中,残基变为异亮氨酸。在另一个实施方案中,残基变为甲硫氨酸。在另一个实施方案中,残基变为本领域中已知的任何其他残基。
在另一个实施方案中,突变在HLA I类变态肽的位置6中。在另一个实施方案中,残基变为缬氨酸。在另一个实施方案中,残基变为半胱氨酸。在另一个实施方案中,残基变为谷氨酰胺。在另一个实施方案中,残基变为组氨酸。在另一个实施方案中,残基变为本领域中已知的任何其他残基。
在另一个实施方案中,突变在HLA I类变态肽的位置9中。在另一个实施方案中,突变改变了其C端位置处的残基。在另一个实施方案中,残基变为缬氨酸。在另一个实施方案中,残基变为苏氨酸。在另一个实施方案中,残基变为异亮氨酸。在另一个实施方案中,残基变为亮氨酸。在另一个实施方案中,残基变为丙氨酸。在另一个实施方案中,残基变为半胱氨酸。在另一个实施方案中,残基变为本领域中已知的任何其他残基。
在另一个实施方案中,点突变在主要锚残基中。在另一个实施方案中,HLA I类主要锚残基是位置2和9。在另一个实施方案中,点突变在次要锚残基中。在另一个实施方案中,HLA I类次要锚残基是位置1和8。在另一个实施方案中,HLA I类次要锚残基是位置1、3、6、7和8。在另一个实施方案中,点突变在选自位置4、5和8的位置中。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,点突变在选自HLA I类结合基序的位置1、2、8和9的位置中的1个或多个残基中。在另一个实施方案中,点突变在选自位置1、3、6和9的位置中的1个或多个残基中。在另一个实施方案中,点突变在选自位置1、2、6和9的位置中的1个或多个残基中。在另一个实施方案中,点突变在选自位置1、6和9的位置中的1个或多个残基中。在另一个实施方案中,点突变在选自位置1、2和9的位置中的1个或多个残基中。在另一个实施方案中,点突变在选自位置1、3和9的位置中的1个或多个残基中。在另一个实施方案中,点突变在选自位置2和9的位置中的1个或多个残基中。在另一个实施方案中,点突变在选自位置6和9的位置中的1个或多个残基中。每种可能性代表着本发明的独立实施方案。
上述锚残基和取代中的每种代表着本发明的独立实施方案。
在另一个实施方案中,HLA I类分子结合WT肽具有9个AA的长度。在另一个实施方案中,所述肽具有10个AA的长度。如本文所提供,具有9-10个AA的天然和变态的肽展现与HLA I类分子的实质结合和引起细胞因子分泌和CTL细胞溶解的能力。
在另一个实施方案中,由HLA I类分子结合WT1肽结合的HLA I类分子是HLA-A分子。在另一个实施方案中,HLA I类分子是HLA-A2分子。在另一个实施方案中,HLA I类分子是HLA-A3分子。在另一个实施方案中,HLA I类分子是HLA-A11分子。在另一个实施方案中,HLA I类分子是HLA-B8分子。在另一个实施方案中,HLA I类分子是HLA-0201分子。在另一个实施方案中,HLA I类分子结合本领域中已知的任何其他HLA I类分子。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明的方法和组合物的WT1肽具有8-30个氨基酸的长度。在另一个实施方案中,所述肽具有9-11个AA的长度。在另一个实施方案中,肽的长度尺寸范围为7-25个AA,或在另一个实施方案中8-11个,或在另一个实施方案中8-15个,或在另一个实施方案中9-20个,或在另一个实施方案中9-18个,或在另一个实施方案中9-15个,或在另一个实施方案中8-12个,或在另一个实施方案中9-11个AA。在另一个实施方案中,肽的长度为8个AA,或在另一个实施方案中长度为9个AA,或在另一个实施方案中10个AA,或在另一个实施方案中12个AA,或在另一个实施方案中25个AA,或在另一个实施方案中为其间的任何长度。在另一个实施方案中,肽具有更大长度,例如50个或100个或更多个。在这种实施方案中,细胞将肽加工成长度为7和25个AA的长度。在这种实施方案中,细胞将肽加工成9-11个AA的长度。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,肽的长度为15-23个AA。在另一个实施方案中,长度为15-24个AA。在另一个实施方案中,长度为15-25个AA。在另一个实施方案中,长度为15-26个AA。在另一个实施方案中,长度为15-27个AA。在另一个实施方案中,长度为15-28个AA。在另一个实施方案中,长度为14-30个AA。在另一个实施方案中,长度为14-29个AA。在另一个实施方案中,长度为14-28个AA。在另一个实施方案中,长度为14-26个AA。在另一个实施方案中,长度为14-24个AA。在另一个实施方案中,长度为14-22个AA。在另一个实施方案中,长度为14-20个AA。在另一个实施方案中,长度为16-30个AA。在另一个实施方案中,长度为16-28个AA。在另一个实施方案中,长度为16-26个AA。在另一个实施方案中,长度为16-24个AA。在另一个实施方案中,长度为16-22个AA。在另一个实施方案中,长度为18-30个AA。在另一个实施方案中,长度为18-28个AA。在另一个实施方案中,长度为18-26个AA。在另一个实施方案中,长度为18-24个AA。在另一个实施方案中,长度为18-22个AA。在另一个实施方案中,长度为18-20个AA。在另一个实施方案中,长度为20-30个AA。在另一个实施方案中,长度为20-28个AA。在另一个实施方案中,长度为20-26个AA。在另一个实施方案中,长度为20-24个AA。在另一个实施方案中,长度为22-30个AA。在另一个实施方案中,长度为22-28个AA。在另一个实施方案中,长度为22-26个AA。在另一个实施方案中,长度为24-30个AA。在另一个实施方案中,长度为24-28个AA。在另一个实施方案中,长度为24-26个AA。
各种上述肽、肽长度和肽类型代表着本发明的独立实施方案。
在另一个实施方案中,利用本领域中众所周知的原则,在不降低对于HLA分子的亲和力或改变TCR特异性的情况下对本发明的肽进行少量修饰。在HLA I类结合肽的情况下,“少量修饰”在另一个实施方案中是指例如一个AA(包括端点)的插入、缺失或取代,或2与9之间(包括端点)的残基外部的1-3个AA的缺失或添加。虽然本文所述的计算机算法可用于预测肽的MHC I类结合电位,但它们具有60-80%预测精确性;并且因此,应该在进行MHC I类结合亲和力的最终测定之前根据经验评估肽。因此,本发明的肽不限于由算法判定展现强烈的MHC I类结合亲和力的肽。下文列出可进行修饰的类型。每种修饰代表着本发明的独立实施方案。
在另一个实施方案中,通过将锚残基突变为MHC I类优选锚残基(其在其他实施方案中可以是本文列举的任何锚残基)来进一步修饰本发明实施例中列举的肽。在另一个实施方案中,通过将锚残基突变为所述位置的不同MHC I类优选残基来进一步修饰含有MHC I类优选锚残基的本发明的肽。不同的优选残基在其他实施方案中可以是本文列举的任何优选残基。
在另一个实施方案中,进一步修饰的锚残基在1位置中。在另一个实施方案中,锚残基在2位置中。在另一个实施方案中,锚残基在3位置中。在另一个实施方案中,锚残基在4位置中。在另一个实施方案中,锚残基在5位置中。在另一个实施方案中,锚残基在6位置中。在另一个实施方案中,锚残基在7位置中。在另一个实施方案中,锚残基在8位置中。在另一个实施方案中,锚残基在9位置中。在HLA I类结合肽的情况下,除了2和9之外的残基可以充当次要锚残基;因此,使其突变可以改进MHC I类结合。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明的方法和组合物的肽是实施例中列举的肽的长度变体。在另一个实施方案中,长度变体比来自实施例的肽短一个氨基酸(AA)。在另一个实施方案中,长度变体比来自实施例的肽短两个AA。在另一个实施方案中,长度变体比来自实施例的肽短两个以上AA。在另一个实施方案中,在N端末端上截取较短的肽。在另一个实施方案中,在C端末端上截取较短的肽。在另一个实施方案中,在N端和C端末端上截取截短肽。在另一个实施方案中,如本领域中众所周知,肽适于在不改变对于HLA分子的亲和力的情况下截短。
每种上述截短肽代表着本发明的独立实施方案。
在另一个实施方案中,长度变体长于本发明实施例中列举的肽。在另一个实施方案中,根据周围WT1序列在N端末端上延伸较长的肽。在另一个实施方案中,如本领域中众所周知,肽适于在N端末端上延伸而不改变对于HLA分子的亲和力。这些肽因此相当于在实施例中列举的肽。在另一个实施方案中,N端延伸肽延伸一个残基。在另一个实施方案中,N端延伸肽延伸两个残基。在另一个实施方案中,N端延伸肽延伸三个残基。在另一个实施方案中,N端延伸肽延伸三个以上残基。
在另一个实施方案中,根据周围WT1序列在C端末端上延伸较长的肽。在另一个实施方案中,如本领域中众所周知,肽适于在C端末端上延伸而不改变对于HLA分子的亲和力。这些肽因此相当于在本发明实施例中列举的肽。在另一个实施方案中,C端延伸肽延长一个残基。在另一个实施方案中,C端延伸肽延长两个残基。在另一个实施方案中,C端延伸肽延长三个残基。在另一个实施方案中,C端延伸肽延长三个以上残基。
在另一个实施方案中,根据周围WT1序列,延伸肽在N端和C端末端上延伸。
每种上述延伸肽代表着本发明的独立实施方案。
在另一个实施方案中,本发明的截短肽在第二残基和C端残基上保留HLA锚残基(例如HLA I类锚残基),其具有比本发明实施例中列举的肽更小数目的插入残基(例如,5个)。在另一个实施方案中,肽适于这些突变而不改变
对于HLA分子的亲和力。在另一个实施方案中,通过除去上述序列之一的一个插入残基来设计这种截短肽。在另一个实施方案中,在第二和第八残基上保留HLA锚残基。在另一个实施方案中,在第一和第八残基上保留HLA锚残基。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明的延伸肽在第二残基和C端残基上保留HLA锚残基(例如HLA I类锚残基),其具有比本发明实施例中列举的肽更大数目的插入残基(例如,7或8个)。在另一个实施方案中,通过在一种上述序列的两个插入残基之间添加一个或多个残基来设计这种延伸肽。本领域中众所周知的是,可以在HLA结合肽的插入序列之间除去或添加残基而不改变对于HLA的亲和力。这些肽因此相当于本发明实施例中列举的肽。在另一个实施方案中,在第二和第九残基上保留HLA锚残基。在另一个实施方案中,在第一和第八残基上保留HLA锚残基。在另一个实施方案中,在间隔六个插入残基的两个残基上保留HLA锚残基。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,“片段”是指长度为11个或更多个AA的肽。在另一个实施方案中,本发明的肽片段的长度为16个或更多个AA。在另一个实施方案中,片段长度为12个或更多个AA。在另一个实施方案中,片段为13个或更多个AA。在另一个实施方案中,片段为14个或更多个AA。在另一个实施方案中,片段为15个或更多个AA。在另一个实施方案中,片段为17个或更多个AA。在另一个实施方案中,片段为18个或更多个AA。在另一个实施方案中,片段为19个或更多个AA。在另一个实施方案中,片段为22个或更多个AA。在另一个实施方案中,片段为8-12个AA。在另一个实施方案中,片段为约8-12个AA。在另一个实施方案中,片段为16-19个AA。在另一个实施方案中,片段为约16-19个AA。在另一个实施方案中,片段为10-25个AA。在另一个实施方案中,片段为约10-25个AA。在另一个实施方案中,片段具有任何其他长度。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,“WT1蛋白的片段”是指本文存在的“片段”的任何定义。每个定义代表着本发明的独立实施方案。
在另一个实施方案中,本发明的肽与实施例中列举的肽同源。当关于任何蛋白质或肽时,术语“同源性”、“同源的”等在另一个实施方案中是指在比对序列和必要时引入空位以达到最大同源性百分比之后并且不考虑任何保守性取代作为序列同一性的一部分,候选序列中与相应天然多肽的残基相同的氨基酸残基的百分比。本领域中众所周知用于比对的方法和计算机程序。
在另一个实施方案中,术语“同源性”当关于任何核酸序列相似性时指示候选序列中与相应天然核酸序列的核苷酸相同的核苷酸百分比。
在另一个实施方案中,利用本领域中充分描述的方法,利用关于序列比对的计算机算法来确定同源性。在其他实施方案中,核酸序列同源性的计算机算法分析包括利用任何数目的可用软件套装,例如,BLAST、DOMAIN、BEAUTY(BLAST Enhanced Alignment Utility)、GENPEPT和TREMBL套装。
在另一个实施方案中,“同源性”是指与选自SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的序列的同一性大于70%。在另一个实施方案中,“同源性”是指与选自SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的序列的同一性大于72%。在另一个实施方案中,“同源性”是指与SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中的一个的同一性大于75%。在另一个实施方案中,“同源性”是指与选自SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的序列的同一性大于78%。在另一个实施方案中,“同源性”是指与SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中的一个的同一性大于80%。在另一个实施方案中,“同源性”是指与SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中的一个的同一性大于82%。在另一个实施方案中,“同源性”是指与选自SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的序列的同一性大于83%。在另一个实施方案中,“同源性”是指与SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中的一个的同一性大于85%。在另一个实施方案中,“同源性”是指与SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中的一个的同一性大于87%。在另一个实施方案中,“同源性”是指与选自SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的序列的同一性大于88%。在另一个实施方案中,“同源性”是指与SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中的一个的同一性大于90%。在另一个实施方案中,“同源性”是指与SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中的一个的同一性大于92%。在另一个实施方案中,“同源性”是指与选自SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的序列的同一性大于93%。在另一个实施方案中,“同源性”是指与SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中的一个的同一性大于95%。在另一个实施方案中,“同源性”是指与选自SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55的序列的同一性大于96%。在另一个实施方案中,“同源性”是指与SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中的一个的同一性大于97%。在另一个实施方案中,“同源性”是指与SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中的一个的同一性大于98%。在另一个实施方案中,“同源性”是指与SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中的一个的同一性大于99%。在另一个实施方案中,“同源性”是指与SEQ ID No:6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、30、31、32、33、35、36、37、38、39、41、42、43、44、46、47、48、49、50和55中的一个的同一性为100%。每种可能性代表着本发明的独立实施方案。[00114]在另一个实施方案中,经由测定候选序列杂交来确定同源性,其方法在本领域中充分描述(参见例如"核酸杂交(Nucleic Acid Hybridization)"Hames,B.D.和Higgins S.J.编,(1985);Sambrook等,2001,分子克隆:实验室手册(Molecular Cloning,A Laboratory Manual),Cold Spring Harbor Press,N.Y.;和Ausubel等,1989,现代分子生物学实验技术(Current Protocols in Molecular Biology),Green Publishing Associates and Wiley Interscience,N.Y)。在另一个实施方案中,在中等至严格条件下进行杂交方法,以补充编码天然半胱天冬酶的DNA。杂交条件是例如在42℃下在包含以下的溶液中温育过夜:10-20%甲酰胺、5X SSC(150mM NaCl、15mM柠檬酸三钠)、50mM磷酸钠(pH 7.6)、5X邓哈特溶液(Denhardt's solution)、10%硫酸葡聚糖和20μg/ml变性的剪切鲑鱼精DNA。
在实施例中列举的上述同源性肽和肽变体各自代表着本发明的独立实施方案。
在另一个实施方案中,本发明提供一种包含本发明的肽的组合物。在另一个实施方案中,所述组合物进一步包含药学上可接受的载体。在另一个实施方案中,所述组合物进一步包含佐剂。在另一个实施方案中,所述组合物包含2种或更多种本发明的肽。在另一个实施方案中,所述组合物进一步包含下文所述的任何添加剂、化合物或赋形剂。在另一个实施方案中,佐剂是KLH、QS21、弗式完全或不完全佐剂、磷酸铝、氢氧化铝、BCG或明矾。在其他实施方案中,载体是本文列举的任何载体。在其他实施方案中,佐剂是本文列举的任何佐剂。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明提供一种包含本发明的肽的疫苗。在另一个实施方案中,本发明提供一种包含抗原呈递细胞(APC)和本发明的肽的疫苗。在另一个实施方案中,所述疫苗进一步包含载体。在另一个实施方案中,所述疫苗进一步包含佐剂。在另一个实施方案中,所述疫苗进一步包含APC。在另一个实施方案中,所述疫苗进一步包含抗原、载体和/或APC中的1种以上的组合。在另一个实施方案中,所述疫苗是基于细胞的组合物。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,术语“疫苗”是指当引入受试者中时提供对于其特定疾病、病状或症状的预防性或治疗性反应的材料或组合物。在另一个实施方案中,本发明包含基于肽的疫苗,其中所述肽包含本文列出的任何实施方案,包括免疫调节化合物如细胞因子、佐剂等。
在另一个实施方案中,本发明的方法和组合物的疫苗进一步包含佐剂。在另一个实施方案中,所述佐剂是Montanide ISA 51。Montanide ISA 51含有天然代谢油和精炼乳化剂。在另一个实施方案中,所述佐剂是GM-CSF。重组GM-CSF是在另一个实施方案中在酵母(酿酒酵母(S.cerevisiae))载体中生长的人类蛋白。GM-CSF促进造血祖细胞、APC以及树突细胞和T细胞的克隆扩增和分化。
在另一个实施方案中,佐剂是细胞因子。在另一个实施方案中,佐剂是生长因子。在另一个实施方案中,佐剂是细胞群体。在另一个实施方案中,佐剂是QS21。在另一个实施方案中,佐剂是弗式不完全佐剂。在另一个实施方案中,佐剂是磷酸铝。在另一个实施方案中,佐剂是氢氧化铝。在另一个实施方案中,佐剂是BCG。在另一个实施方案中,佐剂是明矾。
在另一个实施方案中,佐剂是白介素。在另一个实施方案中,佐剂是趋化因子。在另一个实施方案中,佐剂是本领域中已知的任何其他类型的佐剂。在另一个实施方案中,WT1疫苗包含两种上述佐剂。在另一个实施方案中,WT1疫苗包含两种以上上述佐剂。每种可能性代表着本发明的独立实施方案。
在其他实施方案中,本发明的疫苗或组合物可以包含本发明的WT1肽的任何实施方案和其组合。每种可能性代表着本发明的独立实施方案。
应理解,本文关于本发明的肽、疫苗和组合物所述的任何实施方案可以用于本发明的任何方法中。肽、疫苗或组合物与方法的每种组合代表着其实施方案。
在另一个实施方案中,本发明提供一种治疗具有表达WT1的癌症的受试者的方法,所述方法包括向所述受试者施用本发明的WT1疫苗,从而治疗具有表达WT1的癌症的受试者。
在另一个实施方案中,本发明提供一种治疗具有MDS的受试者的方法,所述方法包括向所述受试者施用本发明的WT1疫苗,从而治疗具有MDS的受试者。
在另一个实施方案中,本发明提供一种抑制或停止受试者中的表达WT1的癌症的进展的方法,所述方法包括向所述受试者施用本发明的WT1疫苗,从而抑制或停止表达WT1的癌症的进展。
在另一个实施方案中,本发明提供一种降低受试者中的表达WT1的癌症的发病率的方法,所述方法包括向所述受试者施用本发明的WT1疫苗,从而降低受试者中的表达WT1的癌症的发病率。
在另一个实施方案中,本发明提供一种降低受试者中的AML的发病率的方法,所述方法包括向所述受试者施用本发明的WT1疫苗,从而降低AML的发病率。
在另一个实施方案中,本发明提供一种降低受试者中的表达WT1的癌症的复发发病率的方法,所述方法包括向所述受试者施用本发明的WT1疫苗,从而降低受试者中的表达WT1的癌症的复发发病率。
在另一个实施方案中,本发明提供一种降低受试者中的AML的复发发病率的方法,所述方法包括向所述受试者施用本发明的WT1疫苗,从而降低受试者中的AML的复发发病率。
在另一个实施方案中,本发明提供一种破坏受试者对于表达WT1的癌症的T细胞耐受的方法,所述方法包括向所述受试者施用本发明的WT1疫苗,从而破坏对于表达WT1的癌症的T细胞耐受。
在另一个实施方案中,本发明提供一种治疗具有表达WT1的癌症的受试者的方法,其包括(a)利用本发明的方法在供体中诱导识别癌症恶性细胞的人类细胞毒性T淋巴细胞(CTL)的形成和增殖;和(b)将人类CTL输注至受试者中,从而治疗具有癌症的受试者。
在另一个实施方案中,本发明提供一种治疗具有表达WT1的癌症的受试者的方法,其包括(a)利用本发明的方法离体诱导识别癌症恶性细胞的人类CTL的形成和增殖,其中从供体获得人类免疫细胞;和(b)将人类CTL输注至受试者中,从而治疗具有癌症的受试者。
用于离体免疫疗法的方法是本领域中众所周知的并且描述于例如美国专利申请序号2006/0057130、2005/0221481、2005/0214268、2003/0175272、2002/0127718,和美国专利号5,229,115中,所述文献以引用的方式并入本文中。其他方法是本领域中众所周知的并且描述于例如Davis ID等(Blood dendritic cells generated with Flt3ligand and CD40ligand prime CD8+ T cells efficiently in cancer patients.J Immunother.2006年9月-10月;29(5):499-511)和Mitchell MS等(The cytotoxic T cell reponse to peptide analogs of the HLA-A*0201-restricted MUCl signal sequence epitope,Ml.2.Cancer Immunol Immunother.2006年7月28日)中。每种方法代表着本发明的独立实施方案。
在另一个实施方案中,本发明提供一种诱导对于表达WT1的癌症的细胞具特异性的CTL的形成和增殖的方法,所述方法包括使淋巴细胞群体与本发明的疫苗接触。在另一个实施方案中,所述疫苗是与本发明的肽相关的APC。在另一个实施方案中,所述疫苗是与本发明的肽的混合物相关的APC。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明提供一种在受试者中产生变态免疫反应的方法,其中所述变态免疫反应是针对表达WT1的癌症,所述方法包括向所述受试者施用本发明的疫苗,从而产生变态免疫反应。
在另一个实施方案中,本发明提供一种诱导受试者中的抗间皮瘤免疫反应的方法,所述方法包括使所述受试者与免疫原性组合物接触的步骤,所述免疫原性组合物包含(a)WT1蛋白;或(b)WT蛋白的片段,从而在受试者中诱导抗间皮瘤免疫反应。在另一个实施方案中,所述间皮瘤是恶性间皮瘤。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明提供一种在受试者中诱导抗间皮瘤免疫反应的方法,所述方法包括使所述受试者与包含编码(a)WT1蛋白;或(b)WT1蛋白的片段的核苷酸分子的免疫原性组合物接触的步骤,从而在受试者中诱导抗间皮瘤免疫反应。在另一个实施方案中,所述间皮瘤是恶性间皮瘤。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明提供一种治疗具有间皮瘤的受试者的方法,所述方法包括向所述受试者施用包含(a)WT1蛋白;或(b)WT蛋白的片段的免疫原性组合物的步骤,从而治疗具有间皮瘤的受试者。在另一个实施方案中,所述间皮瘤是恶性间皮瘤。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明提供一种治疗具有间皮瘤的受试者的方法,所述方法包括向所述受试者施用包含编码(a)WT1蛋白;或(b)WT1蛋白的片段的核苷酸分子的免疫原性组合物的步骤,从而治疗具有间皮瘤的受试者。在另一个实施方案中,所述间皮瘤是恶性间皮瘤。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明提供一种降低受试者中的间皮瘤发病率或其复发的方法,所述方法包括向所述受试者施用包含(a)WT1蛋白;或(b)WT蛋白的片段的免疫原性组合物的步骤,从而降低受试者中的间皮瘤发病率或其复发。在另一个实施方案中,所述间皮瘤是恶性间皮瘤。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明提供一种降低受试者中的间皮瘤发病率或其复发的方法,所述方法包括向所述受试者施用包含编码(a)WT1蛋白;或(b)WT1蛋白的片段的核苷酸分子的免疫原性组合物的步骤,从而降低受试者中的间皮瘤发病率或其复发。在另一个实施方案中,所述间皮瘤是恶性间皮瘤。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,由本发明的方法引起的免疫反应的靶细胞在HLA分子上呈递本发明的WT1肽或相应的WT1片段。在另一个实施方案中,所述HLA分子是HLA I类分子。在其他实施方案中,所述HLA分子是本领域中已知的任何HLA I类亚型或HLA I类分子。在另一个实施方案中,针对WT1肽或片段的免疫反应是变态免疫反应。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,所述表达WT1的癌症是急性骨髓性白血病(AML)。在另一个实施方案中,所述表达WT1的癌症与骨髓增生异常综合征(MDS)相关。在另一个实施方案中,所述表达WT1的癌症是MDS。在另一个实施方案中,所述表达WT1的癌症是非小细胞肺癌(NSCLC)。在另一个实施方案中,所述表达WT1的癌症是维尔姆斯瘤。在另一个实施方案中,所述表达WT1的癌症是白血病。在另一个实施方案中,所述表达WT1的癌症是血液科癌症。在另一个实施方案中,所述表达WT1的癌症是淋巴瘤。在另一个实施方案中,所述表达WT1的癌症是结缔组织增生性小圆细胞瘤。在另一个实施方案中,所述表达WT1的癌症是间皮瘤。在另一个实施方案中,所述表达WT1的癌症是恶性间皮瘤。在另一个实施方案中,所述表达WT1的癌症是胃癌。在另一个实施方案中,所述表达WT1的癌症是结肠癌。在另一个实施方案中,所述表达WT1的癌症是肺癌。在另一个实施方案中,所述表达WT1的癌症是乳腺癌。在另一个实施方案中,所述表达WT1的癌症是生殖细胞肿瘤。在另一个实施方案中,所述表达WT1的癌症是卵巢癌。在另一个实施方案中,所述表达WT1的癌症是子宫癌。在另一个实施方案中,所述表达WT1的癌症是甲状腺癌。在另一个实施方案中,所述表达WT1的癌症是肝细胞癌。在另一个实施方案中,所述表达WT1的癌症是甲状腺癌。在另一个实施方案中,所述表达WT1的癌症是肝癌。在另一个实施方案中,所述表达WT1的癌症是肾癌。在另一个实施方案中,所述表达WT1的癌症是卡波西氏肉瘤。在另一个实施方案中,所述表达WT1的癌症是肉瘤。在另一个实施方案中,所述表达WT1的癌症是任何其他癌瘤或肉瘤。
在另一个实施方案中,所述表达WT1的癌症是实体肿瘤。在另一个实施方案中,所述实体肿瘤与表达WT1的癌症相关。在另一个实施方案中,所述实体肿瘤与骨髓增生异常综合征(MDS)相关。在另一个实施方案中,所述实体肿瘤与非小细胞肺癌(NSCLC)相关。在另一个实施方案中,所述实体肿瘤与肺癌相关。在另一个实施方案中,所述实体肿瘤与乳腺癌相关。在另一个实施方案中,所述实体肿瘤与结肠直肠癌相关。在另一个实施方案中,所述实体肿瘤与前列腺癌相关。在另一个实施方案中,所述实体肿瘤与卵巢癌相关。在另一个实施方案中,所述实体肿瘤与肾癌相关。在另一个实施方案中,所述实体肿瘤与胰腺癌相关。在另一个实施方案中,所述实体肿瘤与脑癌相关。在另一个实施方案中,所述实体肿瘤与胃肠癌相关。在另一个实施方案中,所述实体肿瘤与皮肤癌相关。在另一个实施方案中,所述实体肿瘤与黑色素瘤相关。
在另一个实施方案中,通过本发明的方法治疗的癌症或肿瘤疑似表达WT1。在另一个实施方案中,WT1表达尚未通过实际肿瘤样品的测试来验证。在另一个实施方案中,癌症或肿瘤在许多情况下具有已知表达WT1的类型。在另一个实施方案中,在大多数情况下所述类型表达WT1。
每种类型的表达WT1的癌症或肿瘤,和疑似表达WT1的癌症或肿瘤,代表着本发明的独立实施方案。
本文关于本发明的肽、疫苗和组合物列举的任何实施方案可以用于本发明的任何方法中,并且各自代表着其实施方案。
在另一个实施方案中,本发明的多种肽用于刺激本发明方法中的免疫反应。
本文所公开的方法将为本领域技术人员所理解以能够实现其他WT1衍生肽的设计。所述方法进一步能够实现结合于其他HLA分子的肽的设计。所述方法进一步能够实现组合本发明的WT1衍生肽的疫苗的设计。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明的疫苗具有激活或引起含有多种不同HLA II类等位基因的WT1特异性CD4<+>T细胞的优点。在另一个实施方案中,所述疫苗具有在相当大比例的群体(例如,在不同实施方案中,50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或大于95%)中激活或引起WT1特异性CD4<+>T细胞的优点。在另一个实施方案中,所述疫苗在相当大比例的特定群体(例如美国白种人)中激活或引起WT1特异性CD4<+>T细胞。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明的方法提供已经由受试者增加的免疫反应的改进。在另一个实施方案中,本发明的方法包括施用肽、组合物或疫苗2次或更多次。在另一个实施方案中,所述肽的组成、浓度或其组合改变。在另一个实施方案中,所述肽在尚未引起针对相关抗原的免疫反应的受试者中引起针对所述抗原的免疫反应。在另一个实施方案中,所诱导的CTL回应于肽在APC或癌细胞上的呈递而增殖。在其他实施方案中,对于免疫反应调节的提及涉及免疫系统的体液和细胞介导组中的任一种或两种,其分别伴随着Th2和ThI T辅助细胞的存在,或在另一个实施方案中,单独地每个组。
在其他实施方案中,影响肿瘤生长的方法导致(1)肿瘤细胞分化的直接抑制,或(2)免疫细胞介导的肿瘤细胞溶解,或两者,其导致肿瘤细胞的净增殖的抑制。
本领域普通技术人员基于多种众所周知的方法可以容易地确定通过这两种机制中的任一种对肿瘤生长的抑制。在另一个实施方案中,通过在一段时间内测量实际肿瘤尺寸来确定肿瘤抑制。在另一个实施方案中,通过利用本领域技术人员众所周知的方法估算肿瘤的尺寸(在一段时间内)来确定肿瘤抑制。更具体地,多种放射成像方法(例如,单光子和正电子发射计算机化断层扫描;通常参见"临床肿瘤学中的核医学(Nuclear Medicine in Clinical Oncology)",Winkler,C.(编)Springer-Verlag,New York,1986)可用于估算肿瘤尺寸。这些方法也可以利用多种成像剂,包括例如常规的成像剂(例如,柠檬酸镓-67),以及用于代谢物成像、受体成像或免疫成像的专门试剂(例如,放射性标记的单克隆抗体特异性肿瘤标志物)。另外,也可以利用非放射性方法如超声(参见"肿瘤的超声鉴别诊断(Ultrasonic Differential Diagnosis of Tumors)",Kossoff和Fukuda(编),Igaku-Shoin,New York,1984)来估算肿瘤尺寸。
除了上文讨论的用于确定肿瘤抑制的体内方法之外,可利用多种体外方法来预测体内肿瘤抑制。代表性实例包括例如由51Cr释放测定法(实施例)测定的淋巴细胞介导的抗肿瘤细胞溶解活性、肿瘤依赖性淋巴细胞增殖(Ioannides等,免疫学杂志(J.Immunol.)146(5):1700-1707,1991)、肿瘤特异性抗体的体外生成(Herlyn等,免疫学方法杂志(J.Immunol.Meth.)73:157-167,1984)、细胞(例如,CTL、辅助T细胞)或体液(例如抗体)介导的体外细胞生长抑制(Gazit等,癌症免疫学与免疫疗法(Cancer Immunol Immunother)35:135-144,1992)和对于这些测定法中的任一种测定细胞前体频率(Vose,国际癌症杂志(Int.J.Cancer)30:135-142(1982))和其他。
在另一个实施方案中,抑制肿瘤生长的方法指示相比于在不与本发明的肽接触或暴露于本发明的肽的情况下的生长相比缩减的生长状态。可以通过本领域中已知的任何方式来评估肿瘤细胞生长,包括但不限于测量肿瘤尺寸、使用3H-胸苷并入测定法来测定肿瘤细胞是否增殖,或计数肿瘤细胞。在其他实施方案中,“抑制”肿瘤细胞生长是指减缓、延迟或终止肿瘤生长,或者是指肿瘤收缩。每种可能性代表着本发明的独立实施方案。
在本发明的方法和组合物的另一个实施方案中,测量WT1表达。在另一个实施方案中,测量WT1转录物表达。在另一个实施方案中,测量肿瘤中的WT1蛋白水平。每种可能性代表着本发明的独立实施方案。
测定免疫反应的存在和量值的方法是本领域中众所周知的。在另一个实施方案中,淋巴细胞增殖测定法,其中作为细胞增殖的函数测量放射性物质例如3H-胸苷的T细胞吸收。在其他实施方案中,通过测量白介素-2(IL-2)产生、Ca2+通量或染料吸收例如3-(4,5-二甲基噻唑-2-基)-2,5-二苯基-四唑鎓的增加来实现T细胞增殖的检测。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,通过本领域技术人员已知的方式测定CTL刺激,包括检测细胞增殖、细胞因子产生和其他。在接触配体脉冲靶标后由T细胞分泌的细胞因子的类型和数量的分析可以是功能活性的量度。可通过ELISA或ELISPOT测定法测量细胞因子以确定细胞因子产生的速率和总量。(Fujihashi K.等,(1993)免疫学方法杂志(J.Immunol.Meth.)160:181;Tanguay S.和Killion J.J.(1994)淋巴因子细胞因子研究(Lymphokine Cytokine Res.)13:259)。
在另一个实施方案中,通过51Cr释放溶解测定法来确定CTL活性。对于用对照肽脉冲的靶细胞,可以比较抗原特异性T细胞对于肽脉冲51Cr标记靶标的溶解。在另一个实施方案中,用本发明的肽刺激T细胞,并且可以确定在MHC情形下表达天然肽的靶细胞的溶解。在另一个实施方案中,使用溶解动力学以及固定时间点(例如,4小时)下的总靶标溶解,来评估配体性能。(Ware C.F.等,(1983)免疫学杂志(J Immunol)131:1312)。
测定肽对于HLA分子的亲和力的方法是本领域中众所周知的。在另一个实施方案中,通过TAP稳定化测定法来测定亲和力。
在另一个实施方案中,通过竞争放射免疫测定法来测定亲和力。在另一个实施方案中,利用以下方案:在具有1%牛血清白蛋白(BSA;Fisher Chemicals,Fairlawn,NJ)的PBS中洗涤靶细胞两次。将细胞以107/ml再次悬浮在冰上,并且在0℃下使用柠檬酸盐-磷酸盐缓冲液在3mg/mlβ2微球蛋白存在下将天然细胞表面结合肽汽提2分钟。在3mg/mlβ2微球蛋白和30mg/ml脱氧核糖核酸酶存在下将球粒以5×106个细胞/毫升再次悬浮在PBS/1%BSA中,并且将200ml等分试样在存在或不存在HLA特异性肽的情况下在20℃下温育10分钟,然后在20℃下与125I标记的肽一起温育30分钟。在用PBS/2%BSA洗涤两次并用PBS洗涤一次后测定总结合125I。通过比较递增浓度的测试肽与已知结合肽来确定相对亲和力。
在另一个实施方案中,进行活细胞(例如SKLY-16细胞)表面上肽与HLA的结合的特异性分析以证实与适当HLA分子的结合并表征其限制。在另一个实施方案中,这包括与已知结合于相同或不同HLA分子的过量未标记肽的竞争和表达相同或不同HLA类型的靶细胞的使用。在另一个实施方案中,在活的新鲜或0.25%多聚甲醛固定的人类PBMC、白血病细胞系和特定HLA类型的EBV转化T细胞系上进行这种测定法。通过如上文针对对于相关HLA分子例如酪氨酸酶或HBV肽序列具有已知高亲和力的125I标记肽所述的竞争测定法来测定发现在特定细胞上结合MHC分子的肽的相对亲合力。[00165]在另一个实施方案中,本发明的方法和组合物的HLA II类结合肽的长度大于结合于HLA II类分子的最小长度(在另一个实施方案中,其为约12个AA)。在另一个实施方案中,增加HLA II类结合肽的长度能够结合于一个以上HLA II类分子。在另一个实施方案中,增加所述长度能够结合于结合基序未知的HLA II类分子。在另一个实施方案中,增加所述长度能够结合于HLA I类分子。在另一个实施方案中,HLA I类分子的结合基序是已知的。在另一个实施方案中,HLA I类分子的结合基序是未知的。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,用于本发明的方法和组合物中的肽包含非经典氨基酸,例如:1,2,3,4-四氢异喹啉-3-甲酸酯(Kazmierski等,(1991)美国化学会志(J.Am Chem.Soc.)113:2275-2283);(2S,3S)-甲基-苯丙氨酸、(2S,3R)-甲基-苯丙氨酸、(2R,3S)-甲基-苯丙氨酸和(2R,3R)-甲基-苯丙氨酸(Kazmierski和Hruby(1991)四面体通讯(Tetrahedron Lett.)32(41):5769-5772);2-氨基四氢萘-2-甲酸(Landis(1989),博士论文,亚利桑那大学);羟基-1,2,3,4-四氢异喹啉-3-甲酸酯(Miyake等,(1984)武田研究实验室杂志(J.Takeda Res.Labs.),43:53-76);组氨酸异喹啉甲酸(Zechel等,(1991)国际肽与蛋白质研究杂志(Int.J.Pep.Protein Res.),38(2):131-138);和HIC(组氨酸环脲)(Dharanipragada等,(1993)国际肽与蛋白质研究杂志(Int.J.Pep.Protein Res.),42(1):68-77)和((1992)结晶学报:晶体结构通讯(Acta.Crst.,Crystal Struc.Comm.),48(IV):1239-124)。
在另一个实施方案中,本发明的肽包含AA类似物或肽模拟物,其在其他实施方案中诱导或促成特定二级结构。在其他实施方案中,这些肽包含以下:LL-Acp(LL-3-氨基-2-二丙烯酮(propenidone)-6-甲酸)、诱导[β]-转角的二肽类似物(Kemp等,(1985)有机化学杂志(J.Org.Chem.)50:5834-5838);诱导[β]-折叠的类似物(Kemp等,(1988)四面体通讯(Tetrahedron Lett.)29:5081-5082);诱导[β]-转角的类似物(Kemp等,(1988)四面体通讯(Tetrahedron Lett.)29:5057-5060);诱导α-螺旋的类似物(Kemp等,(1988)四面体通讯(Tetrahedron Lett.)29:4935-4938);诱导γ-转角的类似物(Kemp等,(1989)有机化学杂志(J.Org.Chem.)54:109:115);由以下参考文献提供的类似物:Nagai和Sato(1985)四面体通讯(Tetrahedron Lett.)26:647-650;和DiMaio等,(1989)英国化学会志普尔金会刊(J.Chem.Soc.Perkin Trans),第1687页;Gly-Ala转角类似物(Kahn等,(1989)四面体通讯(Tetrahedron Lett.)30:2317);酰胺键等排体(Jones等,(1988)四面体通讯(Tetrahedron Lett.)29(31):3853-3856);四唑(Zabrocki等,(1988)美国化学会志(J.Am.Chem.Soc.)110:5875-5880);DTC(Samanen等,(1990)国际蛋白质与肽研究杂志(Int.J.Protein Pep.Res.)35:501:509);以及Olson等,(1990)美国化学科学杂志(J.Am.Chem.Sci.)112:323-333和Garvey等,(1990)有机化学杂志(J.Org.Chem.)55(3):936-940中教导的类似物。β转角和β凸起的构型限制模拟物以及含有其的肽描述于1995年8月8日颁予Kahn的美国专利No.5,440,013。
在其他实施方案中,本发明的肽结合于如下文所述的各种其他分子之一,所述结合可以经由共价或非共价键(复合),其性质在另一个实施方案中根据特定目的而改变。在另一个实施方案中,所述肽与大分子载体(例如免疫原性载体)共价或非共价复合,所述载体包括但不限于天然和合成聚合物、蛋白质、多糖、多肽(氨基酸)、聚乙烯醇、聚乙烯吡咯烷酮和脂质。在另一个实施方案中,本发明的肽与底物连接。在另一个实施方案中,所述肽结合于脂肪酸,以引入脂质体中(美国专利No.5,837,249)。在另一个实施方案中,本发明的肽与固体支撑物共价或非共价复合,其中多种是本领域中已知的。在另一个实施方案中,肽与载体、底物、脂肪酸或固体支撑物的连接用于增加所引起的免疫反应。
在其他实施方案中,载体是甲状腺球蛋白、白蛋白(例如人类血清白蛋白)、破伤风类毒素、聚氨基酸如聚(赖氨酸:谷氨酸)、流感蛋白、乙型肝炎病毒核心蛋白、匙孔血蓝蛋白、白蛋白、或另一种载体蛋白或载体肽;乙型肝炎病毒重组疫苗,或APC。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,术语“氨基酸”(AA)是指天然的,或在另一个实施方案中非天然或合成的AA,并且在其他实施方案中可以包括甘氨酸、D或L光学异构体、AA类似物、肽模拟物或其组合。
在另一个实施方案中,术语“癌症”、“赘瘤”、“赘生物”或“肿瘤”可互换使用并且是指已经历使其对宿主生物呈病理性的恶性转化的细胞。原发性癌细胞(即,从接近恶性转化位点处获得的细胞)可以通过充分建立的技术、特别是组织学检查而容易与非癌性细胞区分。如本文所用的癌细胞的定义不仅包括原发性癌细胞,而且包括源自癌细胞祖先的任何细胞。这包括转移的癌细胞,以及源自癌细胞的体外培养物和细胞系。在另一个实施方案中,可基于肿瘤质量检测肿瘤;例如,通过诸如CAT扫描、磁共振成像(MRI)、X射线、超声或触诊等程序,并且在另一个实施方案中通过生物化学或免疫研究结果鉴定,后者在其他实施方案中也用于鉴定癌细胞。
用于合成肽的方法是本领域中众所周知的。在另一个实施方案中,使用适当的固态合成程序合成本发明的肽(参见例如Steward和Young,固相肽合成(Solid Phase Peptide Synthesis),Freemantle,San Francisco,Calif.(1968);Merrifield(1967)激素研究中的最新进展(Recent Progress in Hormone Res)23:451)。在其他实施方案中,使用如本文所述的测定法来测试这些肽的活性。
在另一个实施方案中,通过包括色谱法(例如,离子交换、亲和力和定尺寸柱色谱法)、离心、差异溶解度的标准方法,或通过用于蛋白质纯化的任何其他标准技术来纯化本发明的肽。在另一个实施方案中,使用免疫亲和力色谱法,由此通过使表位与包含针对所述肽或本发明的相关肽而产生的抗体的亲和柱结合来分离所述表位,并且固定至固定支撑物。
在另一个实施方案中,亲和标签如六组氨酸(Invitrogen)、麦芽糖结合结构域(New England Biolabs)、流感涂层序列(Kolodziej等,(1991)酶学方法(Meth.Enzymol.)194:508-509)、谷胱甘肽-S-转移酶或其他连接至本发明的肽以允许通过穿过适当的亲和柱而容易纯化。在其他实施方案中,分离肽也可以使用诸如蛋白水解、核磁共振和x射线晶体学等技术来物理表征。
在另一个实施方案中,本发明的肽是经由如本领域技术人员将显而易见的已知技术通过体外翻译产生的。在另一个实施方案中,在翻译期间或之后有差异地修饰肽,例如,通过磷酸化、糖基化、交联、酰化、蛋白水解裂解、连接至抗体分子、膜分子或其他配体(Ferguson等,(1988)生物化学年评(Ann.Rev.Biochem.)57:285-320)。
在另一个实施方案中,本发明的肽进一步包含可检测标记,其在另一个实施方案中是发荧光的,或在另一个实施方案中是发光的,或在另一个实施方案中具放射性,或在另一个实施方案中是电子密集的。在其他实施方案中,可检测标记包含例如绿色荧光蛋白(GFP)、DS-Red(红色荧光蛋白)、分泌型碱性磷酸酶(SEAP)、β-半乳糖苷酶、荧光素酶、32P、125I、3H和14C、荧光素和其衍生物、若丹明和其衍生物、丹酰基和伞形酮、荧光素或本领域技术人员已知的任何数目的其他此类标记。所用的特定标记将取决于所用免疫测定法的类型。
在另一个实施方案中,本发明的肽连接于底物,其在另一个实施方案中充当载体。在另一个实施方案中,肽与底物的连接用于增加所引起的免疫反应。
在另一个实施方案中,使用常规交联剂如碳化二亚胺将本发明的肽连接至如本文所述的其他分子。碳化二亚胺的实例是1-环己基-3-(2-吗啉基-(4-乙基)碳化二亚胺(CMC)、1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺(EDC)和1-乙基-3-(4-氮阳离子-4,4-二甲基戊基)碳化二亚胺。
在其他实施方案中,交联剂包含溴化氰、戊二醛和琥珀酸酐。一般来说,可以使用多种同型双功能剂中的任一种,包括同型双功能醛、同型双功能环氧化物、同型双功能亚氨基酯、同型双功能N-羟基琥珀酰亚胺酯、同型双功能马来酰亚胺、同型双功能烷基卤化物、同型双功能吡啶基二硫化物、同型双功能芳基卤化物、同型双功能酰肼、同型双功能重氮鎓衍生物和同型双功能光反应性化合物。在其他实施方案中,也设想异型双功能化合物,例如,具有胺反应性和巯基反应性基团的化合物、具有胺反应性和光反应性基团的化合物以及具有羰基反应性和巯基反应性基团的化合物。
在其他实施方案中,同型双功能交联剂分别包括双功能N-羟基琥珀酰亚胺酯二硫代双(琥珀酰亚胺基丙酸酯)、二琥珀酰亚胺基辛二酸酯和二琥珀酰亚胺基酒石酸酯;双功能酰亚胺酯己二亚氨酸二甲酯、庚二亚氨酸二甲酯和辛二亚氨酸二甲酯;双功能巯基反应性交联剂1,4-二-[3'-(2'-吡啶基二硫基)丙酰胺基]丁烷、双马来酰亚氨基己烷和双-N-马来酰亚氨基-1,8-辛烷;双功能芳基卤化物1,5-二氟-2,4-二硝基苯和4,4'-二氟-3,3'-二硝基苯基砜;双功能光反应性剂如双-[b-(4-叠氮基水杨基酰氨基)乙基]二硫化物;双功能醛甲醛、丙二醛、丁二醛、戊二醛和己二醛;双功能环氧化物如1,4-丁二醇二缩水甘油醚;双功能酰肼己二酸二酰肼、碳酰肼和琥珀酸二酰肼;双功能重氮鎓邻联甲苯胺、重氮化和双重氮化联苯胺;双功能烷基卤化物NlN'-亚乙基-双(碘乙酰胺)、NlN'-六亚甲基-双(碘乙酰胺)、NlN'-十一亚甲基-双(碘乙酰胺),以及苄基卤化物和卤基氮芥,如ala'-二碘基-对二甲苯磺酸和三(2-氯乙基)胺。
在其他实施方案中,如本文所述,用于将肽连接至其他分子的异型双功能交联剂包括但不限于SMCC(琥珀酰亚胺基-4-(N-马来酰亚胺基甲基)环己烷-1-甲酸酯)、MBS(间马来酰亚胺基苯甲酰基-N-羟基琥珀酰亚胺酯)、SIAB(N-琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯)、SMPB(琥珀酰亚胺基-4-(对马来酰亚胺基苯基)丁酸酯)、GMBS(N-(γ-马来酰亚胺基丁酰氧基)琥珀酰亚胺酯)、MPBH(4-(4-N-马来酰亚胺基苯基)丁酸酰肼)、M2C2H(4-(N-马来酰亚胺基甲基)环己烷-1-羧基-酰肼)、SMPT(琥珀酰亚胺基氧基羰基-a-甲基-a-(2-吡啶基二硫基)甲苯)和SPDP(N-琥珀酰亚胺基3-(2-吡啶基二硫基)丙酸酯)。
在另一个实施方案中,本发明的肽被配制为通过离子性、吸附性或生物特异性相互作用进行单体的非共价连接。在另一个实施方案中,在低离子强度环境下,例如在去离子水中,通过盐桥形成,可以实现肽与高度带正电荷或带负电荷分子的复合物。在另一个实施方案中,可以使用分别含有众多负电荷和正电荷的带电荷聚合物如聚(L-谷氨酸)或聚(L-赖氨酸)来产生大的复合物。在另一个实施方案中,肽吸附至表面如微粒乳胶珠粒或吸附至其他疏水性聚合物,在其他实施方案中,形成有效模拟交联的或化学聚合的蛋白质的非共价相关肽-超抗原复合物。在另一个实施方案中,经由使用其他分子之间的生物特异性相互作用,使肽非共价连接。例如,生物素对于蛋白质如抗生物素蛋白或抗生蛋白链菌素或其衍生物的强烈亲和力的利用可用于形成肽复合物。根据这个方面并且在另一个实施方案中,使用常见的生物素化试剂如D-生物素的N-羟基琥珀酰亚胺基酯(NHS-生物素)(其与可用的胺基反应),肽可以经修饰以具有生物素基团。
在另一个实施方案中,本发明的肽连接至载体。在另一个实施方案中,所述载体是KLH。在其他实施方案中,所述载体是本领域中已知的任何其他载体,包括例如甲状腺球蛋白、白蛋白如人类血清白蛋白、破伤风类毒素、聚氨基酸如聚(赖氨酸:谷氨酸)、流感、乙型肝炎病毒核心蛋白、乙型肝炎病毒重组疫苗等。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明的肽结合至脂质,如P3CSS。在另一个实施方案中,本发明的肽结合至珠粒。
在另一个实施方案中,本发明的组合物进一步包含免疫调节化合物。在其他实施方案中,所述免疫调节化合物是细胞因子、趋化因子、或增强免疫系统辅助或粘附分子表达的补体成分、其受体或其组合。在一些实施方案中,免疫调节化合物包括白介素例如白介素1至15、干扰素α、β或γ、肿瘤坏死因子、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、巨噬细胞集落刺激因子(M-CSF)、粒细胞集落刺激因子(G-CSF)、趋化因子如嗜中性粒细胞激活蛋白(NAP)、巨噬细胞趋化和活化因子(MCAF)、RANTES、巨噬细胞炎性肽MIP-Ia和MIP-Ib、补体成分,或其组合。在其他实施方案中,免疫调节化合物刺激OX40、OX40L(gp34)、淋巴细胞趋化因子、CD40、CD40L、B7.1、B7.2、TRAP、ICAM-1、2或3、细胞因子受体或其组合的表达或增强表达。
在另一个实施方案中,免疫调节化合物诱导或增强参与免疫反应的共刺激分子(其在一些实施方案中包括CD40或其配体、CD28、CTLA-4或B7分子)的表达。在另一个实施方案中,免疫调节化合物诱导或增强如下的表达:热稳定性抗原(HSA)(Liu Y.等,(1992)实验医学杂志(J.Exp.Med.)175:437-445)、硫酸软骨素修饰的MHC不变链(Ii-CS)(Naujokas M.F.等,(1993)细胞(Cell)74:257-268)、或胞内粘附分子1(ICAM-I)(Van R.H.(1992)细胞(Cell)71:1065-1068),其在另一个实施方案中通过与其在T细胞上的同源配体相互作用而辅助共刺激。
在另一个实施方案中,所述组合物包含溶剂,其包括水、分散介质、细胞培养介质、等张剂等。在另一个实施方案中,所述溶剂是具有约7.0的pH的水性等张缓冲溶液。在另一个实施方案中,所述组合物包含稀释剂如水、磷酸盐缓冲盐水或盐水。在另一个实施方案中,所述组合物包含非水性溶剂,例如丙基乙二醇、聚乙二醇和植物油。
在另一个实施方案中,所述组合物经配制以通过本领域技术人员已知的许多技术中的任一种施用。例如,本发明提供经肠胃外、经静脉内、经皮下、经皮内、经粘膜内、经局部、经口或通过吸入施用药物组合物。
在另一个实施方案中,包含本发明的肽的疫苗进一步包含细胞群体,其在另一个实施方案中包含淋巴细胞、单核细胞、巨噬细胞、树突细胞、内皮细胞、干细胞或其组合,其在另一个实施方案中相对于彼此是自体的、同基因的或异基因的。在另一个实施方案中,所述细胞群体包含本发明的肽。在另一个实施方案中,所述细胞群体吸收肽。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明的细胞群体获自体内来源,例如,外周血、白细胞去除血液制品、单采血液制品、外周淋巴结、肠相关淋巴组织、脾脏、胸腺、脐带血、肠系膜淋巴结、肝脏、免疫病变位点,例如滑液、胰腺、脑脊髓液、肿瘤样品、肉芽肿组织或可以获得这些细胞的任何其他来源。在另一个实施方案中,所述细胞群体获自人类来源,其在其他实施方案中获自人类胎儿、新生儿、儿童或成人来源。在另一个实施方案中,本发明的细胞群体获自动物来源,例如猪或猿,或任何其他相关动物。在另一个实施方案中,本发明的细胞群体获自正常的受试者,或在另一个实施方案中患病的受试者,或在另一个实施方案中易患上相关疾病的受试者。
在另一个实施方案中,本发明的细胞群体经由基于亲和力的分离方法分离。在其他实施方案中,亲和力分离技术包括使用抗体涂布磁性珠粒的磁性分离、亲和色谱法、结合至单克隆抗体(例如,补体和细胞毒素)或结合单克隆抗体使用的细胞毒性剂,和与连接至固体基质如板的抗体“分区(panning)”,或任何其他适宜技术。在其他实施方案中,分离技术包括使用荧光激活细胞分选机,其可具有不同程度的复杂性,例如多颜色通道、低角度和钝角光散射检测通道、阻抗通道等。在其他实施方案中,可以使用能够分离本发明的细胞群体的任何技术,并且其被视为本发明的一部分。
在另一个实施方案中,树突细胞来自如此限定的在多种淋巴和非淋巴组织中存在的形态类似的细胞类型的多种群体(Steinman(1991)免疫学年评(Ann.Rev.Immunol.)9:271-296)。在另一个实施方案中,本发明中使用的树突细胞是从骨髓分离的,或在另一个实施方案中源自骨髓祖细胞,或在另一个实施方案中从外周血分离/源自外周血,或在另一个实施方案中源自细胞系或为细胞系。
在另一个实施方案中,本文所述的细胞群体是从哺乳动物如鼠类、猿或人类的白血细胞级分分离的(参见例如WO 96/23060)。在另一个实施方案中,白血细胞级分可以从哺乳动物的外周血分离。
分离树突细胞的方法是本领域中众所周知的。在另一个实施方案中,经由包括以下步骤的方法分离DC:(a)通过本领域中已知的方法如白细胞去除提供从哺乳动物来源获得的白血细胞级分;(b)通过逆流离心淘析将步骤(a)的白血细胞级分分成四种或更多种子级分;(c)通过使细胞与钙离子载体、GM-CSF和IL-13或GM-CSF和IL-4接触来刺激来自步骤(b)的一种或多种级分中的单核细胞转化为树突细胞;(d)鉴定来自步骤(c)的富集树突细胞的级分;和(e)优选在约4℃下,收集步骤(d)的富集级分。
在另一个实施方案中,通过荧光激活细胞分选来鉴定富集树突细胞的级分,其鉴定以下标志物HLA-DR、HLA-DQ或B7.2中的至少一种,和以下标志物CD3、CD14、CD16、56、57和CD 19、20的同时不存在。
在另一个实施方案中,所述细胞群体包含淋巴细胞,其在另一个实施方案中包含T细胞,或在另一个实施方案中包含B细胞。在其他实施方案中,所述T细胞表征为NK细胞、辅助T细胞、细胞毒性T淋巴细胞(CTL)、TBL、天然T细胞或其组合。应理解,原发性T细胞、或细胞系、克隆等应视为本发明的一部分。在另一个实施方案中,T细胞是CTL、或CTL系、CTL克隆、或从肿瘤、炎性或其他渗透物分离的CTL。
在另一个实施方案中,造血干细胞或早期祖细胞包含本发明中使用的细胞群体。在另一个实施方案中,这些群体是通过白细胞去除分离或衍生的。在另一个实施方案中,在细胞因子施用后从骨髓、外周血(PB)或新生儿脐带血去除白细胞。在另一个实施方案中,干细胞或祖细胞的特征为其被称为CD34<+>的表面抗原标志物的表面表达,和表面谱系抗原标志物Lin-的表达的排除。
在另一个实施方案中,向受试者施用本发明的肽、组合物或疫苗,以及骨髓细胞。在另一个实施方案中,在受试者的先前辐照后,施用以及骨髓细胞实施方案,作为治疗过程的一部分,以抑止、抑制或治疗受试者中的癌症。
在另一个实施方案中,短语“接触细胞”或“接触群体”是指在其他实施方案中可能是直接或间接的暴露方法。在另一个实施方案中,这种接触包括通过本领域中众所周知的任何方式直接注射细胞,例如微注射。在另一个实施方案中,此外设想,向细胞的供应是间接的,例如经由提供于围绕细胞的培养基中,或经由本领域中众所周知并且如本文中所述的任何途径施用至受试者。
在另一个实施方案中,本发明方法的CTL生成是在体内实现的,并且通过向受试者中引入在体外与本发明的肽接触的抗原呈递细胞来实现(参见例如Paglia等,(1996)实验医学杂志(J.Exp.Med.)183:317-322)。
在另一个实施方案中,本发明的方法和组合物的肽被递送至APC。在另一个实施方案中,肽脉冲APC被施用至受试者以引起免疫反应或者治疗或抑制肿瘤的生长或复发。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,所述肽以编码所述肽的cDNA形式递送至APC。在另一个实施方案中,术语“抗原呈递细胞”(APC)是指树突细胞(DC)、单核细胞/巨噬细胞、B淋巴细胞或表达必要的MHC/共刺激分子的其他细胞类型,其有效允许所呈递肽的T细胞识别。在另一个实施方案中,所述APC是癌细胞。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,使CTL与2种或更多种APC群体接触。在另一个实施方案中,所述2种或更多种APC群体呈递不同的肽。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,使用在APC(例如DC)的细胞溶质中导致抗原表达的技术将肽递送至APC。用于表达APC上的抗原的方法是本领域中众所周知的。在另一个实施方案中,所述技术包括(1)将编码本发明的肽的裸DNA引入APC中,(2)使APC感染表达本发明的肽的重组载体,和(3)使用脂质体将本发明的肽引入APC的细胞溶质中。(参见Boczkowski D.等,(1996)实验医学杂志(J.Exp.Med.)184:465-472;Rouse等,(1994)病毒学杂志(J.Virol.)68:5685-5689;和Nair等,(1992)实验医学杂志(J.Exp.Med.)175:609-612)。
在另一个实施方案中,如本文所示例,使用培养APC,例如源自人类细胞系174xCEM.T2(被称为T2)的那些,其在限制内源肽与细胞表面MHC I类分子的缔合的抗原加工路径中含有突变(Zweerink等,(1993)免疫学杂志(J.Immunol.)150:1763-1771)。
在另一个实施方案中,如本文所述,使受试者暴露于肽,或包含本发明的肽的组合物/细胞群体,其不同于所表达的天然蛋白,其中随后出现与天然蛋白质/抗原交叉反应的宿主免疫。
在另一个实施方案中,如在本发明的任何方法或实施方案中所提及的受试者是人类。在其他实施方案中,受试者是哺乳动物,其可以是小鼠、大鼠、兔、仓鼠、豚鼠、马、牛、绵羊、山羊、猪、猫、狗、猴或猿。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,本发明的肽、疫苗和组合物刺激导致肿瘤细胞坏死的免疫反应。
在另一个实施方案中,使用本文所述的任何方法来引起CTL,其是在体外引起的。在另一个实施方案中,CTL是离体引起的。在另一个实施方案中,CTL是体外引起的。在另一个实施方案中,将所得CTL施用至受试者,从而治疗与肽、包含所述肽的表达产物或其同源物相关的病状。每种可能性代表着本发明的独立实施方案。
在另一个实施方案中,所述方法要求使用例如一种或多种核酸递送技术引入编码本发明的肽的遗传序列。在另一个实施方案中,本发明的核酸包括单独地或结合非核酸成分的DNA、RNA和DNA与RNA的混合物。在另一个实施方案中,所述方法包括向受试者施用包含编码本发明的的肽的核苷酸序列的载体(Tindle,R.W.等,病毒学(Virology)(1994)200:54)。在另一个实施方案中,所述方法包括向受试者施用编码一种本发明的肽、或在另一个实施方案中两种或更多种本发明的肽的裸DNA(Nabel等,PNAS-USA(1990)90:11307)。在另一个实施方案中,利用多表位的基于类似物的癌症疫苗(Fikes等,Design of multi-epitope,analogue-based cancer vaccines.生物疗法专家评论(Expert Opin Biol Ther.)2003年9月;3(6):985-93)。每种可能性代表着本发明的独立实施方案。
可经由如本领域中已知的任何方式将核酸施用至受试者,包括肠胃外或静脉内施用,或在另一个实施方案中,借助于基因枪。在另一个实施方案中,以组合物形式施用核酸,其在其他实施方案中对应于本文列出的任何实施方案。
根据本发明的方法使用的载体可以包含促进或允许本发明的肽的表达的任何载体。在一些实施方案中,载体包含减毒病毒如牛痘或禽痘,例如以引用的方式并入本文中的美国专利No.4,722,848中所述。在另一个实施方案中,载体是卡介苗(BCG,Bacille Calmette Guerin),例如Stover等(自然(Nature)351:456-460(1991))中所述。根据本文的描述,本领域技术人员将显而易见可用于本发明的肽的治疗性施用或免疫化的多种其他载体,例如,伤寒沙门氏菌(Salmonella typhi)载体等。
在另一个实施方案中,所述载体进一步编码如本文所述的免疫调节化合物。在另一个实施方案中,在向受试者施用编码本发明的肽的载体的同时、之前或之后,向受试者施用另一种编码其的载体。
在另一个实施方案中,将本发明的肽、组合物和疫苗与其他抗癌化合物和化学治疗剂(包括针对替代性癌症抗原的单克隆抗体,或在另一个实施方案中,由对应于或部分对应于衍生本发明的肽的AA序列组成的表位)组合施用至受试者,或用于本发明的方法中。
本发明涵盖剂量范围的各种实施方案。μ是指微;μg是指微克。在另一个实施方案中,剂量是每天每种肽20μg。在另一个实施方案中,剂量是10μg/肽/天。在另一个实施方案中,剂量是30μg/肽/天。在另一个实施方案中,剂量是40μg/肽/天。在另一个实施方案中,剂量是60μg/肽/天。在另一个实施方案中,剂量是80μg/肽/天。在另一个实施方案中,剂量是100μg/肽/天。在另一个实施方案中,剂量是150μg/肽/天。在另一个实施方案中,剂量是200μg/肽/天。在另一个实施方案中,剂量是300μg/肽/天。在另一个实施方案中,剂量是400μg/肽/天。在另一个实施方案中,剂量是600μg/肽/天。在另一个实施方案中,剂量是800μg/肽/天。在另一个实施方案中,剂量是1000μg/肽/天。在另一个实施方案中,剂量是1500μg/肽/天。在另一个实施方案中,剂量是2000μg/肽/天。
在另一个实施方案中,剂量是10μg/肽/剂。在另一个实施方案中,剂量是30μg/肽/剂。在另一个实施方案中,剂量是40μg/肽/剂。在另一个实施方案中,剂量是60μg/肽/剂。在另一个实施方案中,剂量是80μg/肽/剂。在另一个实施方案中,剂量是100μg/肽/剂。在另一个实施方案中,剂量是150μg/肽/剂。在另一个实施方案中,剂量是200μg/肽/剂。在另一个实施方案中,剂量是300μg/肽/剂。在另一个实施方案中,剂量是400μg/肽/剂。在另一个实施方案中,剂量是600μg/肽/剂。在另一个实施方案中,剂量是800μg/肽/剂。在另一个实施方案中,剂量是1000μg/肽/剂。在另一个实施方案中,剂量是1500μg/肽/剂。在另一个实施方案中,剂量是2000μg/肽/剂。
在另一个实施方案中,剂量是10-20μg/肽/剂。在另一个实施方案中,剂量是20-30μg/肽/剂。在另一个实施方案中,剂量是20-40μg/肽/剂。在另一个实施方案中,剂量是30-60μg/肽/剂。在另一个实施方案中,剂量是40-80μg/肽/剂。在另一个实施方案中,剂量是50-100μg/肽/剂。在另一个实施方案中,剂量是50-150μg/肽/剂。在另一个实施方案中,剂量是100-200μg/肽/剂。在另一个实施方案中,剂量是200-300μg/肽/剂。在另一个实施方案中,剂量是300-400μg/肽/剂。在另一个实施方案中,剂量是400-600μg/肽/剂。在另一个实施方案中,剂量是500-800μg/肽/剂。在另一个实施方案中,剂量是800-1000μg/肽/剂。在另一个实施方案中,剂量是1000-1500μg/肽/剂。在另一个实施方案中,剂量是1500-2000μg/肽/剂。
在另一个实施方案中,每剂或每天的肽的总量为上述量之一。在另一个实施方案中,每剂的总肽剂量为上述量之一。
上述剂量各自代表着本发明的独立实施方案。
本发明涵盖剂量范围的各种实施方案。在另一个实施方案中,剂量是每天每种肽20mg。在另一个实施方案中,剂量是10mg/肽/天。在另一个实施方案中,剂量是30mg/肽/天。在另一个实施方案中,剂量是40mg/肽/天。在另一个实施方案中,剂量是60mg/肽/天。在另一个实施方案中,剂量是80mg/肽/天。在另一个实施方案中,剂量是100mg/肽/天。在另一个实施方案中,剂量是150mg/肽/天。在另一个实施方案中,剂量是200mg/肽/天。在另一个实施方案中,剂量是300mg/肽/天。在另一个实施方案中,剂量是400mg/肽/天。在另一个实施方案中,剂量是600mg/肽/天。在另一个实施方案中,剂量是800mg/肽/天。在另一个实施方案中,剂量是1000mg/肽/天。
在另一个实施方案中,剂量是10mg/肽/剂。在另一个实施方案中,剂量是30mg/肽/剂。在另一个实施方案中,剂量是40mg/肽/剂。在另一个实施方案中,剂量是60mg/肽/剂。在另一个实施方案中,剂量是80mg/肽/剂。在另一个实施方案中,剂量是100mg/肽/剂。在另一个实施方案中,剂量是150mg/肽/剂。在另一个实施方案中,剂量是200mg/肽/剂。在另一个实施方案中,剂量是300mg/肽/剂。在另一个实施方案中,剂量是400mg/肽/剂。在另一个实施方案中,剂量是600mg/肽/剂。在另一个实施方案中,剂量是800mg/肽/剂。在另一个实施方案中,剂量是1000mg/肽/剂。
在另一个实施方案中,剂量是10-20mg/肽/剂。在另一个实施方案中,剂量是20-30mg/肽/剂。在另一个实施方案中,剂量是20-40mg/肽/剂。在另一个实施方案中,剂量是30-60mg/肽/剂。在另一个实施方案中,剂量是40-80mg/肽/剂。在另一个实施方案中,剂量是50-100mg/肽/剂。在另一个实施方案中,剂量是50-150mg/肽/剂。在另一个实施方案中,剂量是100-200mg/肽/剂。在另一个实施方案中,剂量是200-300mg/肽/剂。在另一个实施方案中,剂量是300-400mg/肽/剂。在另一个实施方案中,剂量是400-600mg/肽/剂。在另一个实施方案中,剂量是500-800mg/肽/剂。在另一个实施方案中,剂量是800-1000mg/肽/剂。
在另一个实施方案中,每剂或每天的肽的总量为上述量之一。在另一个实施方案中,每剂的总肽剂量为上述量之一。
上述剂量各自代表着本发明的独立实施方案。
在另一个实施方案中,本发明提供一种包含本发明的肽、组合物或疫苗的试剂盒。在另一个实施方案中,所述试剂盒进一步包含标记或包装插页。在另一个实施方案中,经由使用延迟型超敏性测试,使用试剂盒来检测WT1特异性CD4反应。在另一个实施方案中,将试剂盒用于本文列举的任何其他方法。在另一个实施方案中,将试剂盒用于本领域中已知的任何其他方法。每种可能性代表着本发明的独立实施方案。
实施例1.材料和方法
肽设计.使用三种基于计算机的预测算法BIMAS(http://www-bimas.cit.nih.gov/cgi-bin/molbio/ken_parker_combo form)、SYFPEITHI(http://www.syfpeithi.de/)和RANKPEP(http://bio.dfci.harvard.edu/Tools/rankpep.html),通过用能够在正常供体中诱导免疫反应的天然WT1蛋白序列起始而针对CD8和CD4T细胞选择表位。通过改变I类天然肽的锚残基中的单个氨基酸来设计变态肽,其导致比其天然序列更高的预测结合。通过向I类肽添加侧接残基来设计II类肽,以同时刺激CD4和CD8 T细胞。虽然可通过所述算法预测许多序列,但在30%的情况中,当在肝细胞上测试时,这些模型不预测与MHC的结合(Gomez-Nunez等,白血病研究(Leuk Res.)2006;30(10):1293-8),因此体外测试是必要的。另外,即使证实了结合,也可能不存在细胞毒性T细胞反应,从而需要另外的体外研究。
肽合成.所有肽是通过Genemed Synthesis,Inc.(San Antonio,TX)购买和合成。肽是无菌的,纯度为70%至90%。将肽溶解于DMSO中并以5mg/mL稀释于盐水中并储存在-80℃下。所用的对照肽是:对于HLA-DR.B1:JAK-2衍生的DR.B1-结合肽JAK2-DR(GVCVCGDENILVQEF;SEQ ID NO:59)或BCR.ABL衍生肽(IVHSATGFKQSSKALQRPVASDFEP;SEQ ID NO:60);对于HLA-A0201:尤因肉瘤衍生肽EW(QLQNPSYDK;SEQ ID NO:61),和对于HLA-A2402:前列腺特异性膜抗原(PMSA)衍生肽624-632(TYSVSFDSL;SEQ ID NO:62)。
细胞系、细胞因子和抗体.使用人类白血病细胞系BA25和HL-60作为用于测量T细胞的细胞毒性的靶标。人类粒细胞-巨噬细胞集落刺激因子(GM-CSF)、白介素(IL)-1β、IL-4、IL-6、IL-15、肿瘤坏死因子(TNF)-α和前列腺素E2(PGE2)是购自R&D Systems(Minneapolis,MN)。β2-微球蛋白(b2-m)是购自Sigma(St.Louis,MO)。用于免疫荧光测定法的抗体,包括人类CD3、CD4、CD8、HLA-A2(克隆BB7.2)的mAb和同种型对照是获自BD Biosciences(San Diego,CA)。用于CD14和CD3的细胞分离试剂盒是购自Miltenyi Biotec.(Bergisch Gladbach,Germany)。
用于肽结合的T2测定法.在各种最终浓度(50、10和2ug/ml)的肽不存在(阴性对照)或存在的情况下,将T2细胞(TAP-,HLA-A0201+)在37℃下以1×106个细胞/毫升在补充有10ug/ml人类β-2m的不含FCS的RPMI培养基(Sigma,St Louis,MO,USA)中温育过夜。对于最后两个小时的温育,将Brefeldin A(Sigma)以5μg/ml添加至培养物中。然后将T2细胞在4℃下用结合至FITC的抗HLA-A2.1(BB7.2)mAb洗涤并染色30分钟,并且接着用染色缓冲液(PBS+1%FBS和0.02%叠氮化物)洗涤。在FACScalibur(Becton Dickinson)上通过流式细胞术测量HLA-A2在细胞表面上的表达并且用FlowJo 9.6.3软件进行分析。
体外刺激和人类T细胞培养物.通过Ficoll密度离心获得来自HLA型健康供体的外周血单核细胞(PBMC)。使用与磁性珠粒偶合的人类CD14的mAb(Miltenyi Biotec)通过阳性选择分离CD14+单核细胞并且将其用于T细胞的首次刺激。使用全T细胞分离试剂盒(Miltenyi Biotec)通过阴性免疫磁性细胞分离,将PBMC的CD14-级分用于CD3的分离。细胞的纯度总是大于98%。在补充有5%自体血浆(AP)、20μg/mL合成肽、1μg/mL B2-m和10ng/mL IL-15的RPMI 1640的存在下,将T细胞刺激7天。通过在补充有1%AP、500单位/毫升重组IL-4和1,000单位/毫升GM-CSF的RPMI 1640培养基中培养细胞,从CD14+细胞产生单核细胞衍生的树突细胞(DC)。在温育的第2天和第4天,添加具有IL-4和GM-CSF的新鲜培养基或替换一半的培养基。第5天,将20μg/mL II类肽添加至不成熟的DC,用于加工。第6天,添加成熟细胞因子混合液(Dao等,Plos One 2009;4(8):e6730)。第7天或第8天,用具有IL-15的成熟DC再次刺激T细胞。在大多数情况下,使用DC或CD14+细胞作为抗原呈递细胞(APC),以相同方式将T细胞刺激3次。在最终刺激后的一周,通过IFN-g酶联免疫斑点(ELISPOT)测定法研究肽特异性T细胞反应并且通过51铬(Cr)释放测定法测试细胞毒性。
IFN-g ELISPOT.将HA-Multiscreen板(Millipore)涂以含100μL小鼠抗人类IFN-g抗体(10Ag/mL;克隆1-D1K;Mabtech)的PBS,在4℃下温育过夜,用PBS洗涤以除去未结合的抗体,并且在37℃下用RPMI 1640/10%自体血浆(AP)阻断2小时。将纯化的CD3+ T细胞(纯度>98%)涂以自体CD14+(10:1 E:APC比率)或自体DC(30:1E:APC比率)。以20μg/mL向孔中添加各种测试肽。阴性对照孔含有不具有肽或具有不相关肽的APC和T细胞。阳性对照孔含有T细胞+APC+20μg/mL植物血球凝集素(PHA,Sigma)。一式三份地进行所有条件。将微量滴定板在37℃下温育20小时并且然后用PBS/0.05%Tween充分洗涤,并且添加100μl/孔的针对人类IFN-g的生物素标记的检测抗体(2μg/mL;克隆7-B6-1;Mabtech)。将板在37℃下再温育2小时并且如所述进行斑点显色(Dao等,同前)。通过使用计算机辅助的视频图像分析仪用KS ELISPOT 4.0软件(Carl Zeiss版)自动化测定斑点数目。
51铬释放测定法.在如所述的标准铬释放测定法中测量特异性CTL的存在(Dao等,同前)。简言之,将单独地或在37℃下用50μg/mL的合成肽脉冲2小时(在一些情况下过夜)的靶细胞用每百万个细胞50uCi的Na251CrO4(NEN Life Science Products,Inc.)标记。在充分洗涤后,以100:1至10:1范围内的E:T比率用T细胞温育靶细胞。一式三份地进行所有条件。将板在37℃下在5%CO2中温育4-5小时。收集上清液流体并在γ计数器中测量放射性。根据下式确定特异性溶解百分比:[(实验释放-自发释放)/(最大释放-自发释放)]x100%。通过放射性标记的靶标在1%SDS中的溶解来确定最大释放。
实施例2.天然和其类似物肽与HLA-A0201和HLA-A2402的结合
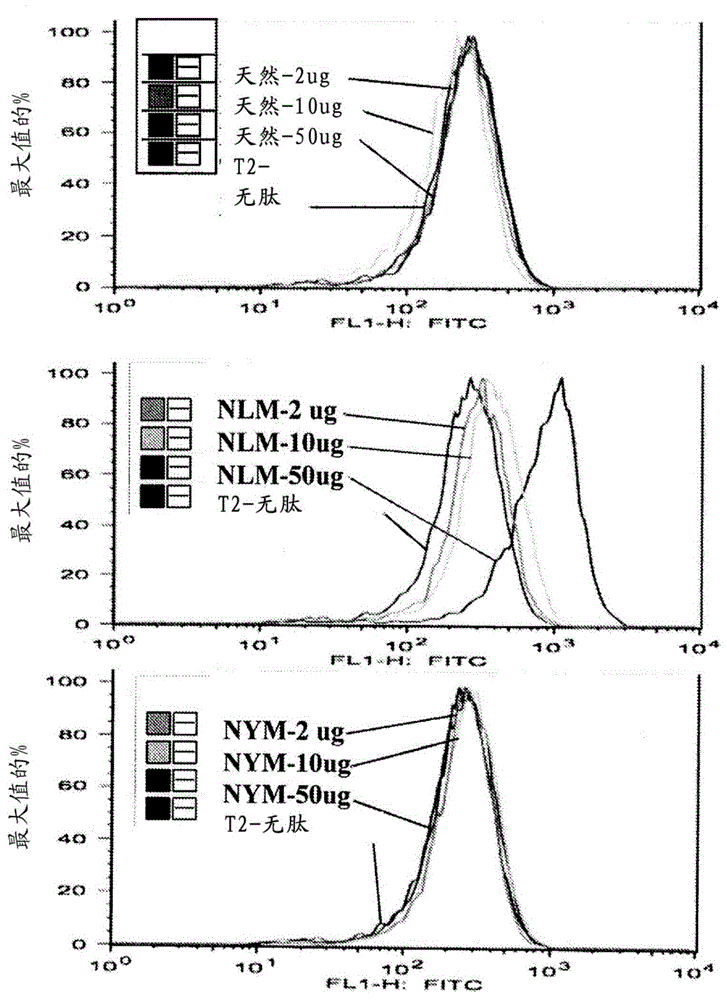
使用跨越人类WT1蛋白的15mer重叠肽的汇集物以在体外敏化人类T细胞,在HLA-A2402的情况下,序列239-248(NQMNLGATL;SEQ ID NO:5;本文缩写为NQM或)近来已鉴定为免疫原性CD8 T细胞表位(Doubrovina等,血液(Blood)2012;123(8):1633-46)。为了生成具有更强免疫原性的类似肽,使用三个在线可用的数据库(BIMAS、RANKPEP和SYFPEITHI),筛选天然肽和在位置2和9(I类锚残基)中具有各种氨基酸取代的可能类似物的预测评分。来自所有三个数据库的预测结合评分显示天然NQMNLGATL(SEQ ID NO:5)肽与HLA-A0201的结合优于与HLA-A2402分子的结合(表I)。当位置2处的谷氨酰胺被亮氨酸取代时,根据所有3个预测程序,与HLA-A2402的结合评分保持在类似水平。然而,对于HLA-A0201,预测到显著更强的结合评分。另一方面,当位置2处的谷氨酰胺被酪氨酸取代时,与HLA-A2402的结合评分急剧改进,通过BIMAS预测显示约90倍的结合增加。通过RANKPEP算法,预测所有三种肽在c端裂解,表明肽片段的加工。通过在位置9处用各种氨基酸取代来检查结合评分,但它们相比于位置2处的取代都不显示显著改进的结合。因此,选择两种类似物肽NLMNLGATL(SEQ ID NO:6;本文缩写为NLM或A24-het-1)和NYMNLGATL(SEQ ID NO:7;本文缩写为NYM或A24-het-2)用于进一步研究。
表1.肽与HLA-A0201和A2402的预测结合评分
实施例3.肽与HLA-A0201和HLA-A2402分子的结合
MHC I类限制肽的免疫原性需要在活细胞表面上结合并稳定化MHC I类分子的能力。此外,计算机预测仅具有至多70%精确度;因此,利用使用抗原传输缺乏(TAP2阴性)HLA-A0201人类T2细胞的常规结合和稳定化测定法,对于肽与HLA-A0201分子之间的相互作用的强度寻求直接测量。T2细胞缺乏TAP功能并且因此在细胞溶质中产生的具有抗原肽的I类分子适当装载中有缺陷。外源添加肽与热不稳定的空HLA-A0201分子的缔合使其稳定化并且导致可由特异性抗HLA-A0201 mAb如BB7.2识别的表面HLA-A0201的水平增加。
T2结合测定法显示天然NQMNLGATL(SEQ ID NO:5)肽不增加T2细胞上的HLA-A2表达(图1,上图)。然而,通过相比于不具有肽脉冲的T2细胞,显示HLA-A2表达的剂量依赖性增加,NLMNLGATL(SEQ ID NO:6)类似物肽将HLA-A2分子稳定化(图1,中图)。与天然肽NQMNLGATL类似,NYMNLGATL(SEQ ID NO:7)肽不增加HLA-A2表达(图1,下图)。通过基于计算机的算法,这些数据证实HLA-A2结合评分。
实施例4.HLA-A0201和A2402分子情形下的肽特异性CD8 T细胞反应的诱导
虽然肽呈递需要对于MHC分子的亲和力,由HLA分子呈递的肽的T细胞识别是引起肽特异性反应的另一个重要需求。因此,使用体外刺激方案,对于新型合成WT1肽类似物评估其在HLA-A0201和A2402供体中刺激肽特异性T细胞反应的能力。
当用单独的肽激发时,为了扩增肽特异性T细胞前体,进行三次至五次体外刺激并且通过IFN-g产生测量特异性T细胞反应。NLMNLGATL肽诱导强烈IFN-g分泌,其与天然NQMNLGATL肽交叉反应。T细胞的五次刺激增强反应,其相比于3次刺激(图2A)显示更多IFN-g斑点(图2B)。也使用51Cr释放测定法对于用NLMNLGATL肽刺激5次后的T细胞测试细胞毒性。针对WT1阳性但HLA-A2阴性的HL-60细胞未观察到杀死。然而,T细胞杀死WT1+和HLA-A0201+AML细胞系SET-2和源自HLA-A0201阳性患者的原发性白血病胚细胞(图3)。测定NLMNLGATL和NYMNLGATL变态肽是否可在HLA-A2402供体中诱导更好的CD8 T细胞反应。NLMNLGATL肽可诱导针对NLMNLGATL和天然NQMNLGATL肽的T细胞反应,但相比于由天然NQMNLGATL肽诱导的T细胞反应,不存在显著增强。相比之下,NYMNLGATL肽诱导针对自身的强烈T细胞反应并且天然肽在3次刺激后诱导(图4A),但在5个回合刺激后反应消亡(图4B),其也显示与天然序列的弱交叉反应性。这些数据显示,在HLA-A0201分子情形下,NLMNLGATL变态肽是CD8 T细胞的强表位。另一方面,NYMNLGATL肽在HLA-A0201阳性供体中诱导CD8 T细胞反应,但所述反应并不显著优于NQMNLGATL肽。
实施例5.由识别NQMNLGATL CD8 T细胞表位的HLA-DR.B1肽诱导T细胞反应
已显示,组合CD4和CD8表位的肽相比于单个I类表位在引起对于疫苗设计有效的免疫反应方面更有效,这是因为CD4T细胞通过经由CD40/CD40L信号传导完全活化DC以及通过产生IL-2和IFN-g可以促进CD8CTL。另外,如果用嵌入CD8 T细胞表位的较长肽刺激的T细胞可识别短肽,则其可证实CD8 T细胞表位的加工。因此,设计分别跨越NQMNLGATL和NLMNLGATL表位的四种HLA-DR.B1-结合肽:
DR-Native-1:cmtwNQMNLGATLkg(SEQ ID NO:8)
DR-Native-2:wNQMNLGATLkgvaa(SEQ ID NO:9)
DR-het-1:cmtwNLMNLGATLkg(SEQ ID NO:14)
DR-het-2:wNLMNLGATLkgvaa(SEQ ID NO:17)
因为对于预测II类肽裂解不存在确定的方法,所以使用BIMAS、SYFPEITHI和RANKPEP算法设计两种不同形式的II类肽(表2)。
表2.HLA-DRB结合肽的预测结合评分。
当用跨越NLMNLGATL表位的两种“变态”DR.B1肽刺激T细胞时,它们诱导对短肽和长肽具特异性的T细胞反应,这通过IFN-g分泌显示。因为CD4肽由于其大量产生细胞因子而诱导更有效的反应,所以背景通常高于CD8 T细胞肽刺激。因此,虽然两种DR变态肽诱导特异性反应,但DR-het-2肽相比于DR-het-1肽在图5A中所示的供体中显示更明显的反应。显而易见,DR-het-2肽诱导的反应对两种短肽NQMNGATL和NLMNGATL以及DR-native 2和het-2肽具特异性。更重要的是,反应是针对受辐照肿瘤细胞系BA-25(WT1+A2+),而非针对WT1+但A0201阴性的HL-60细胞。类似地,当如图5B中所示用短肽(NQMNLGATL或NLMNGATL)或长肽刺激T细胞时,仅BA-25而非HL-60细胞被杀死。
实施例6.识别NQMNLGATL CD8 T细胞表位的其他HLA-DR.B1结合肽
除了上述那些DR肽之外,设计并评估跨越NQMNLGATL、NLMNLGATL和NLMNLGATL表位的其他HLA-DR.B1-结合肽(表3):
表3.肽与HLA-DR.B1的预测结合评分
实施例7.由结合于人类HLA-B7I类和HLA-Dr II类分子的WT1肿瘤蛋白衍生的肽的生成
也设计结合于HLA-B0702的肽(表4)。设计以下肽序列:RQRPHPGAL(B7-Native 1;SEQ ID NO:34)、RLRPHPGAL(B7-het-1;SEQ ID NO:37)、RIRPHPGAL(B7-het-2;SEQ ID NO:38)、GALRNPTAC(Native 2;SEQ ID NO:29)和GALRNPTAL(B7-het-3;SEQ ID NO:31)。这些和其他变体的预测结合评分示于表4中。这些肽是在体外测试的并刺激变态T细胞反应(图6)。在体外用2组肽(总共五种)刺激来自HLA-B0702阳性供体的CD3T细胞5次。通过IFN-γELISPOT测定法测量针对单独的肽的肽特异性反应。
对于第一组肽,变态-1和2都诱导肽特异性反应,但het-2肽相比于het-1肽与天然1(N1)肽的交叉反应性更强。对于第二组肽,当用刺激肽激发时,变态肽诱导强烈的IFN-g产生,但发现与天然序列无交叉反应性。
表4.B7肽与HLA-B7和其他单倍型的预测结合评分。
基于在HLA-B7分子的情形下天然肽RQRPHPGAL(p-125至-117;SEQ ID NO:34)和GALRNPTAC(p-118至-110;SEQ ID NO:29)诱导T细胞反应的研究结果,使用HLA结合预测算法,设计GALRNPTAC肽的一种变态肽(SEQ ID NO:31),和RQRPHPGAL的两种变态肽(SEQ ID NO:37和38)。基于结合预测,在其他HLA单倍型如A0201、A0301、B8、B1501、B37和B5101情形下,这些肽也可能能够刺激T细胞(表4)。
实施例8.由结合于人类HLA-B35、A0101、A0301、A1101 I类和HLA-DR II类分子的WT1肿瘤蛋白衍生的肽的生成
在HLA-DR.B1 0301和0401的情形下,肽QFPNHSFKHEDPMGQ(p170-182)(SEQ ID NO:39)诱导T细胞反应。在B3501的情形下,嵌入长肽HSFKHEDPM内的短序列诱导T细胞反应。基于利用HLA结合预测算法进行的预测,设计一种变态长肽,其是het-B35-1短肽的延伸。
肽的序列是:II类肽:DR.B1-03/04-Native:QFPNHSFKHEDPM(SEQ ID NO:42),DR.B1-03/04-Het:QFPNHSFKHEDPY(SEQ ID NO:43;I类肽:1.天然:HSFKHEDPM(SEQ ID NO:40),2.Het-01/03-1:HSFKHEDPY(对于A0101和A0301)(SEQ ID NO:41),和3.Het-03/11-1HSFKHEDPK(对于A0301和A1101)(SEQ ID NO:42)。通过计算机测试HLA-B3501单倍型的变态肽(表5)。
表5.天然肽与HLA-DR.B1-0301、0402和B3501、A0101、A0301和A1101的预测结合评分。
实施例9.由结合于人类HLA-A1、A3、A11 I类和HLA-DR.B1-0401II类分子的WT1肿瘤蛋白衍生的肽的生成
在HLA-DR.B1 0401的情形下,显示肽KRPFMCAYPGCNK(320-332)(SEQ ID NO:44)诱导T细胞反应。在B35、B7和A0101的情形下,嵌入长肽FMCAYPGCN(SEQ ID NO:45)内的短序列诱导T细胞反应(表6)。使用预测算法研究肽的结合评分以倍增HLA单倍型。设计一种变态长肽,其是het-1短肽的延伸。设计更好地结合于HLA-A0101、0301和1101的两种变态短肽。所述肽的序列是:II类肽:DR.B1-04 Native:KRPFMCAYPGCNK(SEQ ID NO:44)、DR.B1-04 het:KRPFMCAYPGCYK(SEQ ID NO:46);I类肽:1.天然:FMCAYPGCN(SEQ ID NO:45),2.DR.B1-04-Het-1 short:FMCAYPGCY(对于A0101)(SEQ ID NO:47),3.DR.B1-04-Het-2-short:FMCAYPGCK(对于A0301和A1101)(SEQ ID NO:48)。KRPFMCAYPGCYK(SEQ ID NO:46)是DR.B1-04-het 1short FMCAYPGCN(SEQ ID NO:45)的延伸,其中序列CN的末端变成CY。
表6.肽与HLA-DR.B1-0401和B35、B7、A0101、A0301和A1101的预测结合评分。
实施例10.其他交叉反应性研究
与天然序列(SEQ ID NO:5)相比,对于Het24-1(SEQ ID NO:6)和Het24-2(SEQ ID NO:7)A24肽,在5次刺激后使用供体SA进行ELISPOT测定法。如图7中所示,变态肽产生交叉反应性反应。
- 还没有人留言评论。精彩留言会获得点赞!