新颖中空微米粒子的制作方法
本发明涉及一种微米粒子,特别涉及一种连接多肽的中空微米粒子,其可作为一种细胞培养装置以培养细胞。此外,本发明中空微米粒子也可作为一功能性生医材料载体,进行体内的组织修复。
背景技术:
:目前,已有针对人工组织移植及再生医学进行各种基础研究和技术开发,例如,干细胞增生与分化的研究、细胞可接受且生物可降解支架的开发、以及各种组织工程工具的建立。以上皆为现今再生医学重要的课题,其中以开发可传送干细胞或组织细胞的支架最为重要。组织再生的支架材料为一平台,其可吸附细胞以形成组织。支架材料可作为移植细胞与宿主细胞间的暂时性屏障,其无毒且具生物兼容性。此外,当所欲移植的细胞已在特定位置上充足地生长时,支架材料可在个体内降解。一般来说,支架可由合成、天然聚合物或其复合材料制备。支架可制造成有各种形态和功能的结构。最常使用的生物可降解聚合物包括,乙醇酸(PGA)、聚乳酸(PLA)、聚(乳酸-共-乙醇酸)(PLGA)、聚己内酯(PCL)及其衍生物与聚合物。天然的生物可降解材料包括胶原蛋白、藻酸盐、透明质酸、明胶、脱乙酰壳多醣与纤维素等。在支架的制造中,可添加各种不同形式的材料,如海绵、凝胶、纤维素或微珠等。Wang,M.,etal揭露以PLGA支架培养ADSC,并辅以诱导分化的培养基促使干细胞分化。ADSC于PLGA支架上培养,一般的培养基无法促使大量增生。显示PLGA载体不利于ADSC贴附生长的缺点。KimSE,etal揭露以PLGA多孔性微球培养ADSC,并辅以改质肝素-多巴胺(Hep)及乳铁蛋白(LF)促使细胞生长及分化。定量数据显示,虽微球经修饰改质,但细胞于微球上之增生数量并不明显。由上述可知,目前在组织工程技术中仍有许多困难需要克服。例如,细胞培养的空间过小、产量过低、所能携带的细胞量过少、移植成功的机会过低等。因此,业界急需一种生医材料载体,可同时作为体外培养支架及体内移植载体。技术实现要素:有鉴于上述先前技术所存在的问题,本发明提供一种中空微米粒子、其制备方法以及一种含有本发明中空微米粒子的细胞载体。本发明中空微米粒子为中空多孔状可大量培养细胞,并透过多肽与标靶分子,以提升载体功能。本发明提供一种微米粒子,包括:a)中空微球;b)复数个连结分子,连接在所述中空微球的表面;c)多肽,连接至少一个连结分子;以及d)标靶分子,连接至少一个连结分子。在本发明的实施例中,中空微球为中空结构。在本发明的实施例中,中空微球的材质选自:聚乳酸、聚(丁二酸丁二醇酯)、聚(丁二酸丁二醇酯-共-己二酸丁二醇酯)、聚(己二酸丁二醇酯-共-对苯二甲酸酯)、聚乙醇酸、聚(乳酸-共-乙醇酸)、聚己内酯、及聚乙烯醇或其混合物中的一种或多种。在本发明的实施例中,连结分子包括胺基、醇基(OH)、羧基(COOH)或腈基(CN)。在本发明的实施例中,多肽包括IKVAV、RGD、YIGSR、REDV、DGEA、VGVAPG、GRGDS、LDV、RGDV、PDSGR、RYWLPR、LGTIPG、LAG、RGDS、RGDF、HHLGGALQAGDV、VTCG、SDGD、GREDVY、GRGDY、GRGDSP、VAPG、GGGGRGDSP、GGGGRGDY、FTLCFD、Poly-Lysine或MAX-1。在本发明的实施例中,标靶分子包括透明质酸、氧化透明质酸、Colleagen、Glucocorticoid、Galectin或osteopontin。本发明另一方面提供一种中空微米粒子的制造方法,包括(a)提供中空微球;(b)将所述中空微球浸泡在胺类溶液中,使所述中空微球的表面产生胺基;(c)加入多肽,使所述多肽接枝至所述中空微球表面的胺基;以及(d)加入标靶分子,使所述标靶分子连接至所述中空微球表面的胺基。本发明更提供一种细胞载体,包括如本发明上述中空微米粒子与细胞。附图说明图1为本发明中空微米粒子的结构示意图。图2为本发明中空微米粒子的制备方法示意图。图3a-3e为本发明PLGA微球、PLGA-NH2微球、PLGA-NH2-IKVAV、PLGA-NH2-IKVAV-oHA、实心PLGA-IKVAV微球的外部及内部形态。图4为本发明中空微米粒子与实心微米粒子的悬浮状况。图5为本发明中空微米粒子的胺基改质程度。图6为本发明中空微米粒子的IKAVA接枝程度,IKAVA的接枝程度为11.5mmole/mg。图7为本发明中空微米粒子的oHA接枝程度,中空微米粒子的oHA接枝量约为每毫克微球有10.5mmole的oHA。图8为傅立叶红外线光谱仪的分析结果,PLGA、PLGA-NH2、PLGA-NH2-IKVAV及PLGA-NH2-IKVAV-oHA微球分别具有不同的官能基。图9为核磁共振仪的分析结果;其中图9a为PLGA的核磁共振仪的分析结果;图9b为、PLGA-NH2的核磁共振仪的分析结果;图9c为PLGA-NH2-IKVAV的核磁共振仪的分析结果图9d为PLGA-NH2-IKVAV-oHA的核磁共振仪的分析结果;PLGA、PLGA-NH2、PLGA-NH2-IKVAV及PLGA-NH2-IKVAV-oHA微球分別具有不同的官能基。图10a-10b为以显微镜镜检ADSC于各中空微米粒子表面的附着情形。图11为ADSC于各中空微米粒子的表面附着情形的细胞数量。图12a-12b为以显微镜镜检ADSC于各中空微米粒子表面的生长情形。图13为ADSC于各中空微米粒子的表面生长情形的细胞数量。图14a-14b显示以显微镜镜检HepG2于各中空微米粒子表面的附着情形。图15显示为HepG2于各中空微米粒子的表面附着情形的细胞数量。附图标记说明:11中空微球;13连结分子;15多肽;17标靶分子;100微米粒子。具体实施方式图1、2为本发明的中空微米粒子及其制造方法。应注意的是,为了清楚描述本发明的特征,21、图仅为本发明实施例的简单图示,在实际应用时,此技艺人士可依不同的需求增加或修改图1、2的结构。在本发明第一范畴中,本发明提供一种中空微米粒子,包括:a)中空微球;b)复数个连结分子,连接所述的中空微球;c)多肽,连接至少一个连结分子;以及d)标靶分子,连接至少一个连结分子。参照图1,中空微米粒子100包括中空微球11。本发明中所述的“中空微球”为一种微粒,包括一种或多种聚合物,所述微米粒子颗粒直径介于50~180μm,其中最佳为120μm。本发明的微米粒子为球体状,颗粒的形状和尺寸并无特别限制。本发明的中空微米粒子具有3D中空结构,可用于培养及/或传送细胞。由于3D细胞培养模式可仿真体内的3D结构微环境,以及提供更多的培养空间,因此可降低培养成本并增加细胞产量。本发明所述的“细胞”是指任何来自动物个体的细胞,其可传送至相同或不同的个体。细胞可为异种细胞、自体细胞或同种异体细胞。细胞可直接来自于动物个体的初代细胞,也可为由经培养后所生成的细胞。本发明的细胞较佳为“干细胞”。干细胞是指任何具有分裂成未分化状态且生成特定细胞。本发明的干细胞可包括,但不限于,神经、肝、肾、脂肪、成骨细胞、破骨、肺泡、心脏、肠道或内皮干细胞。本发明中空微米粒子的的材质包括,但不限于,生物稳定性聚合物、生物可降解聚合物、富勒烯、脂质或它们的组合。生物稳定系指在生物体内不会降解的聚合物。生物可分解系指可使用于人体的某部位中,如暴露于体液(如血液),可逐渐地被人体所吸收及/或消除。在实施例中,生物可分解聚合物包括脂肪族聚脂类、脂肪族共聚脂类、或脂肪族及芳香族共聚脂类的物质。生物可分解聚合物较佳为聚乳酸(PLA)、聚(丁二酸丁二醇酯)(PBS)、聚(丁二酸丁二醇酯-共-己二酸丁二醇酯)(PBSA)、聚(己二酸丁二醇酯-共-对苯二甲酸酯)(PBAT)、聚乙醇酸(PGA)、聚(乳酸-共-乙醇酸)(PLGA)、聚己内酯(PCL)、及聚乙烯醇(PVOH)或上述组合。参照图1,在中空微球11表面上具有至少一个连结分子13。本发明中所述的“连结分子”是指基团,包括胺基(NH2)、醇基(OH)、羧基(COOH)或腈基(CN),较佳为胺基。在实施例中,为了在中空微米粒子的表面生成至少一个胺基,可将中空微米粒子置于胺类溶液中。生成胺基的方法并无特别限制,此
技术领域:
人士自可选择适当的方式。参照图1,连结分子13与多肽15连结。本发明的“多肽”是指2个或以上氨基酸以肽键结合在一起的肽或蛋白质。多肽可为一种短链胜肽、寡胜肽或寡聚物。本发明多肽的长度一般介于2至20个氨基酸,较佳2至10个氨基酸。本发明多肽可包括,但不限于2、3、4、5、6、7、8或9个氨基酸。在实施例中,多肽包括IKVAV、RGD、YIGSR、REDV、DGEA、VGVAPG、GRGDS、LDV、RGDV、PDSGR、RYWLPR、LGTIPG、LAG、RGDS、RGDF、HHLGGALQAGDV、VTCG、SDGD、GREDVY、GRGDY、GRGDSP、VAPG、GGGGRGDSP、GGGGRGDY、FTLCFD、Poly-Lysine或MAX-1,较佳为IKVAV。参照图1,连结分子13与标靶分子17连结。本发明的“标靶分子”是指任何专一性结合至特定目标物的物质(例如,胜肽、蛋白质、核酸聚合物、适体或小分子化合物)。目标物可为组织、细胞、细胞结构(例如,胞器)、蛋白质、胜肽、多醣类、或核酸聚合物。本发明所述的适体是指随机地择自于依据与目标分子亲合力所获得的DNA或RNA分子(参照CoxandEllington,Bioorg.Med.Chem.9:2525-2531(2001);Leeetal,Nuc.AcidsRes.32:D95-D100(2004))。适体可为核酸、蛋白质、小分子有机化合物、微生素、无机化合物、细胞及所有有机体。本发明的标靶分子17包括,但不限于,抗体、抗体片段、双特异性抗体、亲和体、双抗体、微抗体、ScFv、适体,avimer、标靶肽、生长抑素、RGD肽、透明质酸、叶酸、叶酸类似物或已知可结合到与疾病相关的任何其它分子。此
技术领域:
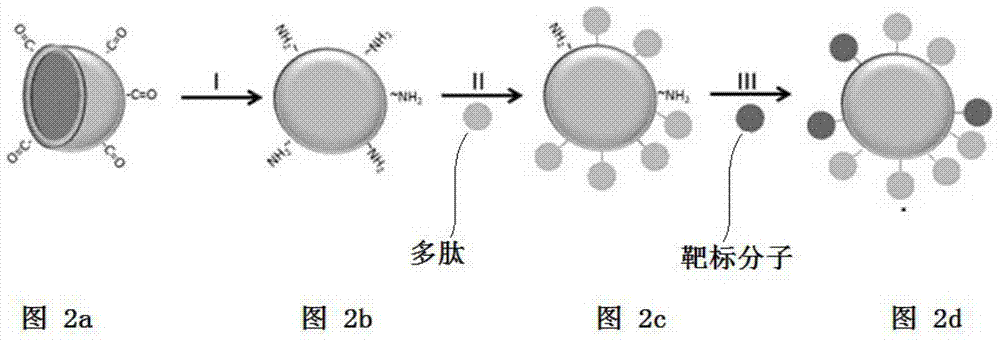
人士自可依据目标分子选择适当的标靶分子。本发明的中空微米粒子100可传送细胞至特定组织或器官。在实施例中,将中空微球100用于培养细胞(如干细胞)以及体内移植支撑物。中空微米粒子100具有连结分子13。由于连结分子13可被特定细胞的受器所辨识,因此可提升细胞的贴附能力。另外,标靶分子15可与特定组织或器官的受体蛋白结合,可提升中空微米粒子100的载体功能性。藉此,本发明提供一种医疗用的细胞载体、组成物或制剂等,特别是针对肝纤维化的组织修复。在本发明另一范畴中,本发明另一方面提供一种中空微米粒子的制造方法,包括:(a)提供中空微球;(b)将所述中空微球浸泡在胺类溶液中,使所述中空微球的表面产生胺基;(c)加入多肽,使所述多肽接接枝至该中空微球表面的胺基;以及(d)加入标靶分子,使该标靶分子连接至所述中空微球表面的胺基。详细的制造程序可参照本发明实施例1。参照图2a,提供一中空微球。此中空微球为一种微粒,且为微球体状以及直径约为120μm。中空微球的材料应具有生物可分解性,且中空微球可用于培养细胞以及作为细胞的载体。参照图2b,将中空微球浸泡在胺类溶液中,使所述微米粒子的表面产生胺基。本发明中所使用的胺类溶液包括1,6-己二胺的异丙醇溶液甘氨酸水溶液(Glycine)、己二酸二酰肼水溶液(adipicdihydrazide,ADH)、聚乙二醇胺化水溶液((Polyethyleneglycol,PEG)、双氨基聚乙二醇(NH2-PEG-NHS)或双氨基聚乙二醇(NH2-PEG-NH2)的DMSO溶液。本
技术领域:
人士自可依据所使用的胺类溶液选择适当的浸泡的时间及条件。参照图2c,加入一多肽,使多肽接枝至中空微球表面的胺基。在添加多肽前,可将中空微球置于一缓冲液中,以活化中空微球表面的胺基。本发明中所述之缓冲液包括,但不限于MES缓冲液、EDC水溶液或NHS水溶液。接着加入多肽,多肽会与被活化的胺基反应而键结。缓冲液的pH值可介于2-10之间,较佳为3-9之间,更佳为4-8之间。本
技术领域:
人士自可依据所使用的缓冲液来调整pH值,以活化胺基。多肽在反应溶液中的浓度为约0.01wt%至50wt%,较佳为1wt%至40wt%,更为10wt%至30wt%。参照图2d,加入标靶分子,使标靶分子连接至所述中空微球表面未与多肽结合的胺基。在实施例中,标靶分子可自行与胺基反应。例如,以透明质酸(oHA)作为标靶分子,而透明质酸的醛基会与中空微球上的胺基反应,藉由亚胺键的生成而接枝。在另一实施例,先将标靶分子置于缓冲液中,以活化标靶分子上的羧基,再加入中空微球,使中空微球上胺基与活化的羧基键结。本发明另提供一种细胞载体,包括本发明的中空微米粒子以及细胞。如上所述,“细胞”是指任何来自动物个体的细胞。细胞可为异种细胞、自体细胞或同种异体细胞。细胞可直接来自于动物个体的初代细胞,也可为由经培养后所生成的细胞。本发明的细胞可为体细胞、人工细胞或干细胞。由上述可知,本发明中空微米粒子的中空结构有助于悬浮培养细胞,可增加细胞产量。比较传统的细胞培养装置及模式,可以更低的成本培养更多的细胞。中空微米粒子的多肽可被特定细胞所辨识,以提升细胞的贴附力,进而增加每单位中空微米粒子所能携带的细胞量。所以相对于传统或市售的细胞载体,本发明中空微米粒子所能携带的细胞量更多。另一方面,在中空微米粒子上更具有标靶分子,可专一性地结合至所欲的目标上,例如,特定组织、器官、部位或细胞。在实施例中,标靶分子为透明质酸,使中空微米粒子可专一性地与肝细胞结合。综上所述,本发明的中空微米粒子利用中空结构与多肽增加细胞负载量,并利用标靶分子使中空微米粒子专一性地结合至目标位置,将细胞移植至目标位置。藉由中空结构、多肽与标靶分子,可显著地提升细胞移植的效力。实施例1、中空微米粒子的制备1.1、PLGA微球的制备以二次乳化法制备PLGA中空微球。取0.9gPLGA溶于40ml二氯甲烷(2.25%)中,再加入20ml二次水后均匀震荡进行第一次乳化。取2.5g的PVA与250ml的二次水配制1%PVA水溶液,冷却至10℃后,以500rpm搅拌1%PVA水溶液。将上述第一次乳化产物以滴管缓慢滴入搅拌中的1%PVA水溶液,以500rpm搅拌2小时使二氯甲烷挥发后停止。去除水溶液,以二次水清洗3次。以冷冻干燥机,冻干3天获得PLGA微球,以筛网筛PLGA微球,筛出直径约100-200μm之PLGA微球。参照图3a,以扫描式电子显微镜(SEM)观察PLGA微球外部及内部形态,内部呈中空多孔状。1.2、PLGA微球的胺基改质将PLGA微球浸泡于10%的1,6-己二胺的异丙醇溶液中,反应3小时后,离心以获得PLGA-NH2微球。保留上清液,做实施例2中的胺基接枝检测(Ninhydrin分析)。以二次水清洗微球3次进行真空干燥。PLGA微球表面上形成胺基(NH2),为PLGA-NH2微球。参照第3b图,PLGA-NH2微球表面呈现粗糙状。1.3、PLGA-IKVAV(SEQIDNO.1)接枝配制0.1M的MES缓冲液(pH5.5),加入N,N-二甲基氨基丙基碳二亚胺(EDC)与羟基琥珀酰亚胺(NHS)(比例为1:1),接着加入IKVAV胜肽,使IKVAV:EDC:NHS的比例为5:5:1并且反应2小时活化羧基。加入PLGA-NH2微球进行接枝反应。,反应溶液中IKVAV重量百分浓度约14%,反应24小时后,形成PLGA-NH2-IKVAV微球。保留反应溶液进行实施例3的IKAVA接枝程度分析(TNBS分析)。参照第3c图,IKVAV覆盖于PLGA-NH2微球上,表面呈现较为平滑状态。1.4、PLGA-oHA接枝最后,将150mg透明质酸(oHA)溶于8ml二次水,并缓慢地加入32ml的99.5%酒精。加入150mgPLGA-NH2-IKVAV微球后,于pH11下,以150rpm震荡24小时。保留上清做实施例4中的oHA接枝检测(TNBS分析)。以二次水清洗微球2次,再分别以30%、95%酒精浸泡10分钟后进行真空干燥。透明质酸的醛基与PLGA-NH2-IKVAV微球上胺基反应,藉由亚胺键的生成而接枝形成本发明之微米粒子(PLGA-NH2-IKVAV-oHA),如图3d所示。1.5、PLGA空心微球与PLGA实心微球悬浮状态将细胞悬浮液(5x105cells/1mlmedium)放入试管内,再将已无菌处理过后的微球放入,并分别观察放入后0小时的PLGA空心微球与PLGA实心微球悬浮状态。由图4可得知空心微球均匀悬浮于液体中,而实心微球则沉淀在管底部2、胺基接枝检测使用Ninhydrin分析来检测胺基的接枝程度。将PLGA-NH2微球与ninhydrin药剂反应后,隔水加热20分钟,试剂会与自由胺基反应产成深紫色溶液,再以UV-visible量测570nm波段的吸光质,以计算PLGA-NH2微球的胺基接枝程度。参照图4,胺基的接枝程度大于50%。3、IKVAV接枝程度的分析以TNBS分析(ACSChem.Neurosci.,2013,4,1229-1235)来检测IKVAV胺基与PLGA-NH2羧基的聚合反应。取1ml的PLGA-NH2-IKVAV微球与10mM的t-肼基甲酸叔丁酯(t-butycarbazate)于pH=9下反应24小时后,与2ml的TNBS溶液反应30分钟。取1ml的反应溶液与1ml的0.5NHCl均匀混合,以UV侦测器测量340nm的吸光值。比较接枝前、后的吸光值以得知IKVAV的接枝程度。参照图5,IKAVA的接枝程度为11.5mmole/mg。4、oHA接枝程度的分析以TNBS分析来检测oHA的接枝程度。取1ml微米粒子与10mM的t-肼基甲酸叔丁酯(PH=9)反应24hr。取出100μl与2mlTNBS溶液反应30分钟后,再抽出1ml与1ml0.5NHCl混合均匀,以UV侦测器量测340nm波段的吸光质,以计算微米粒子醛基接枝程度。参照图6,接枝量约为每毫克微球有10.5mmole的oHA。5、化学检测利用傅立叶红外线光谱仪(FTIR)侦测PLGA、PLGA-NH2、PLGA-NH2-IKVAV、PLGA-NH2-IKVAV-oHA等微体的震动或旋转的频率,以红外线光检测材料的官能基,藉以推判氨基、oHA及IKVAV的接枝。参照图7,傅立叶红外线光谱仪可分辨出PLGA、PLGA-NH2、PLGA-NH2-IKVAV、PLGA-NH2-IKVAV-oHA微球不同的官能基。由于本发明的微球是由PLA与PGA组成的聚合物,可在1090、1185、1375、1745、2943cm-1位置可观察到吸收峰。此外,由于PLGA接枝NH2会有酰胺键,因此可在1550、1650、3358cm-1位置观察到酰胺键的吸收峰,证明PLGA接枝上胺基。由于IKVAV的接枝中,羧基同样也会与胺基反应生成酰胺键,因此酰胺键的数量大幅增加。证明微球上有IKVAV。而oHA的接枝过程中,oHA上的醛基会与胺基反应生成亚胺键,因此可在1614cm-1处观察到亚胺键的吸收峰,此外1414cm-1处也可观察到oHA上的羧基,由此两吸收峰的生成可间接证明oHA的接枝。表一、FTIR的官能基吸收峰6、利用核磁共振仪(NMR)侦测PLGA、PLGA-NH2、PLGA-NH2-IKVAV、PLGA-NH2-IKVAV-oHA等微体的氢质子带电度,藉以推判氨基、oHA及IKVAV的接枝。参照图9,核磁共振仪可分辨出PLGA、PLGA-NH2、PLGA-NH2-IKVAV、PLGA-NH2-IKVAV-oHA微球不同的官能基。由于本发明的微球是由PLA与PGA组成的聚合物,可在约1.5(CH3)、4.8(CH2)及5.3(CH)ppm位置可观察到波峰。此外,由于PLGA接枝NH2及IKVAV会有胺基及酰胺键的产生,因此可在2.1(NH2)及3.8(amide)ppm处看到波峰位置观察到胺基及酰胺键的波峰,证明PLGA接枝上胺基及IKVAV。而oHA的接枝过程中,oHA上的醛基会与胺基反应生成亚胺键,因此可在8.5(Schiffbase)ppm处观察到亚胺键的波峰,由上所述的波峰的生成可间接证明胺基、IKVAV及oHA的接枝。7、物理检测利用Zetapotential及雷射粒径分析仪侦测PLGA、PLGA-NH2、PLGA-NH2-IKVAV、PLGA-NH2-IKVAV-oHA等微体的表面电位及粒径大小,以分散液与粒子间的电位差、光散射的散射条变化,藉以推判微球体表面电荷电性分布、各组微球体平均粒径及平均表面积。参照表二,Zetapotentia可分辨出PLGA、PLGA-NH2、PLGA-NH2-IKVAV、PLGA-NH2-IKVAV-oHA微球不同的电位及电荷分布。PLGA微球为-12.3mv,而经胺基改质接枝后,胺基上的正电会中和PLGA上的负电,因此整体呈现一个电中性的状态;IKVAV胜肽序列含有正电残基的胺基酸(Lys、Arg)胺基酸,因此胜肽序列经改质上微球后,微球表面电荷略呈正电,此结果也利于说明经改质后细胞贴附量增加的结果。最后,将PLGA-IKVAV改质oHA上去,oHA上的醛基与胺基形成亚胺键,消耗掉了带正电的胺基,也因oHA带有一个羧基残基,故PLGA-IKVAV-oHA表面电位略微降低为1.09mv。根据此结果,微球经IKVAV及oHA改质后,呈现电中性偏正电荷的情形,此结果可利于细胞贴附,并且由于细胞上受器与IKVAV及oHA之间的特异性相互作用影响力,因此,对于细胞贴附的结果可看出有不小的差异。根据表三,微球以雷射粒径分析仪做粒径及表面积测定。分析结果如上图及表二,根据粒径分析结果,微球大小分布约在50μm-200μm之间,平均粒径约在120μm左右。微球在接枝及改质过程中,会于反应溶液中摇晃搅拌,造成粒径较小的颗粒可能聚集成为较大颗的颗粒;相反的,聚集成较大颗的颗粒也可能会分散成小颗粒。因此,各组别中粒径较大与较小之微球所占比例会有差异。表面积代表细胞可贴附的平面空间,因微球表面为多孔状,故表面积略低于理想值的0.045cm2/颗微球(以微球直径120μm计算)。PLGA-NH2经过胺基改质,表面呈现粗糙状,因此表面积略为提升;而经过改质接枝后,IKVAV及oHA因覆盖在微球表面,故表面呈现较为光滑,表面积下降。表二、微球表面电位材料表面电位PLGA-12.3mVPLGA-NH20.31mVPLGA-IKVAV3.03mvPLGA-IKVAV-oHA1.09mv表三、微球平均粒径及平均表面积材料平均粒径分布平均表面积PLGA120.05μm0.0371cm2/颗微球PLGA-NH2120.04μm0.0483cm2/颗微球PLGA-IKVAV120.03μm0.0391cm2/颗微球PLGA-IKVAV-oHA120.03μm0.0401cm2/颗微球8.细胞生长将脂肪干细胞(ADSC)分别培养在Tissueculturepolystyrene(TCPS)、空心PLGA、PLGA-NH2、PLGA-NH2-IKVAV及实心PLGA-NH2-IKVAV微球上。24小时后,再以SEM、荧光显微镜及WST-1assay做细胞的定性及定量检测,藉以比较不同培养载体及环境细胞的贴附程度。微米粒子的细胞安全性检测将ADSC分别种入细胞培养液中(每组细胞数2x105),待4小时细胞贴附完全,将不同阶段的微球放入共同培养。培养48小时后,以Trypanblue做细胞数及存活率计算,做细胞毒性及材料适应性等细胞兼容性的检测。由结果得知,各阶段微球细胞的状况皆与控制组(TCPS)无明显别,可得知此各阶段微球不影响ADSC细胞的生长,因此微米粒子不对ADSC具有毒性。表四,ADSC贴附于微米粒子的存活测试组别细胞数TCPS9.23*105PLGA9.12*105PLGA-NH29.02*105PLGA-IKVAV9.17*105PLGA-IKVAV-oHA9.21*105NC09、ADSC贴附微米粒子将微米粒子加入细胞悬浮液(1x106cells/1mlmedium)中,放入37度培养箱进行细胞贴附与培养。每间隔10分钟即将细胞-微球悬浮液拿出轻摇,使细胞能充分与微球均匀接触并贴附。待细胞贴附后(约摸4-6小时),将微球取出以PBS沖掉未貼附之細胞,并以paraformaldehyde进行细胞固定。以酒精对细胞及微球进行脱水处理。图10a为镜检下观察细胞贴附PLGA及PLGA-NH2的数量并不多;而实心PLGA-IKVAV,因微球沉淀在试管底部,故大部分面积皆被遮蔽,因而产生细胞堆栈在同一表面的形态;相反的,空心微球经改质IKVAV或是IKVAV-oHA后,细胞可大量均匀的贴附在微球表面(细胞以白键头标注)。图10b为细胞以DAPI进行染色,并以荧光显微镜观察,观察结果与SEM镜检下观察相似,其中细胞以白键头标注。图11为细胞以WST-1检测的定量结果。结果可得知,经改质IKVAV胜肽的空心微球,细胞贴附在微球上的倍数明显增加。10、ADSC贴附于微米粒子的生长情形将微球加入细胞悬浮液(1x106cells/mlmedium)中,放入37度培养箱进行细胞贴附与培养。每间隔10分钟即将细胞-微球悬浮液拿出轻摇,使细胞能充分与微球均匀接触并贴附。约莫24小时后,每间隔约2小时将试管拿出轻摇,使沉淀的微球翻面,增加细胞生长空间及面积。约过72小时后,细胞已贴附于微米粒子并生长,将微球取出以PBS沖掉未貼附之細胞,并以paraformaldehyde进行细胞固定。以酒精对细胞及微球进行脱水处理。进行SEM、DAPI染色及WST-1检测及Trypanblue细胞计数。细胞贴附上微球72小时后,进行定性与定量检测。图12a为以SEM观察细胞生长在PLGA、PLGA-NH2、PLGA-IKVAV及PLGA-IKVAV-oHA等组别。镜检下观察细胞生长在PLGA及PLGA-NH2之形态,虽部分包覆但未布满整颗微球;实心PLGA-IKVAV,则因微球沉淀在试管底部,故大部分面积皆被遮蔽,因而细胞呈现一个堆栈在同一表面生长的形态;PLGA-IKVAV及PLGA-IKVAV-oHA,细胞则因大量均匀的贴附在微球表面,故细胞均匀的分布生长在微球上(细胞以白键头标注)。图12b为细胞以DAPI进行染色,并以荧光显微镜观察,观察结果与SEM镜检下观察相似,其中细胞以白键头标注。图13为细胞以WST-1检测的定量结果。结果可得知,经改质IKVAV胜肽的空心微球,细胞在微球上生长的倍数明显增加。11、HepG2细胞CD44标靶分子与oHA作用贴附于微米粒子将微米粒子加入HepG2细胞悬浮液(1x106cells/1mlmedium)中,放入37度培养箱进行细胞贴附与培养。每间隔10分钟即将细胞-微球悬浮液拿出轻摇,使细胞能充分与微球均匀接触并贴附。待细胞贴附后(约莫4-6小时),将微球取出,以PBS冲掉未贴附之细胞,并以paraformaldehyde进行细胞固定。以酒精对细胞及微球进行脱水处理。图14a为镜检下观察细胞贴附PLGA及PLGA-NH2的数量并不多;而PLGA经改质接枝上oHA及IKVAV-oHA后则可观察到细胞大量均匀的贴附在微球表面(图14a为细胞以DAPI进行染色,并以荧光显微镜观察,观察结果与图14bSEM镜检下观察相似。图15为细胞以WST-1检测的定量结果),由此证明,经由oHA与CD44的媒介,可大量促使CD44positive的细胞贴附,间皆证实了oHA与CD44标靶的作用。根据图14b的SEM结果分析,PLGA上的细胞数并不多,因此可观察到细胞贴附的形态;相对于其他组别,因细胞数量相对较多,而HepG2细胞有容易聚合在一起的特性,故呈现圆形的聚合形态。所有说明书中所揭示的发明技术特点可以任意方式组合。说明书中揭示的每一技术特点可以提供相同、等同或相似目的之其他方式替换。因此,除非另有特别说明,文中所有揭示的特点均只是等同或相似特点的一般系列的实例。由上述可知,熟习此技艺者能轻易地了解本发明的必要特征,在不脱离其精神与范围之下能就本发明做许多改变与调整以应用于不同用途与条件。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1