化合物AJ-2在制备治疗或预防流感病毒的药物中的应用的制作方法
本发明涉及化合物AJ-2在制备治疗或预防流感病毒的药物中的应用。
背景技术:
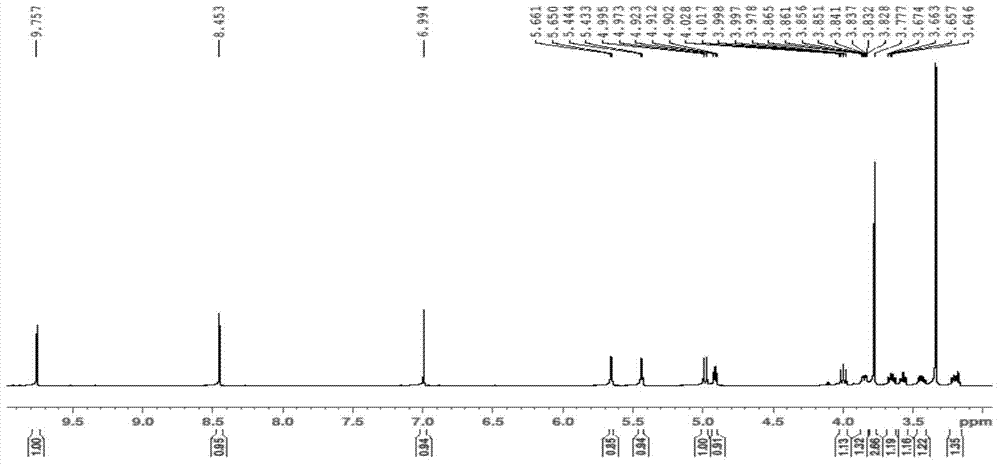
:流感病毒属于正粘病毒科(Orthomyxoviridae)流感病毒属。根据病毒粒子核蛋白(NP)和基质蛋白(M)的抗原特性及基因特性的不同,流感病毒分为A、B、C三型。A型流感病毒全基因组由8条大小不等的单股负链RNA组成,分别以节段1至节段8命名。根据病毒粒子表面糖蛋白血凝素(HA)和神经氨酸酶(NA)的不同,A型流感病毒可进一步分为17个H(H1-H17)和10个N(N1-N10)亚型。人流感病毒主要是H1、H2和H3亚型。而目前危害严重的高致病性禽流感多为H5、H7和H9亚型,其中以H5N1亚型致死率最高。流感病毒的整个生活周期需要在细胞质和细胞核内完成。感染的起始是病毒颗粒表面的刺突HA识别和结合宿主细胞表面的唾液酸受体,与受体结合后病毒粒子以内吞体的形式进入到宿主细胞。在内吞体的酸性pH条件下病毒HA蛋白的构象发生变化,位于轻链N端的融合肽暴露,病毒囊膜与细胞膜融合。低pH环境也致使大量H+经由M2离子通道进入病毒粒子内部,导致M1蛋白与vRNP的解离。两者的共同结果致使病毒粒子的vRNP释放到被感染细胞的胞浆。vRNP随后转到细胞核内进行基因组的复制和转录,复制时病毒首先以自身RNA为模板合成互补RNA(cRNA),然后以cRNA为模板再合成vRNA。转录生成的mRNA由核内转移到胞浆,翻译出病毒的结构蛋白和非结构蛋白。一部分合成蛋白(如NP)需要重新转移到核内与新生成的vRNA组成vRNP,vRNP出核后与其余的病毒蛋白开始组装成新的病毒粒子,新生成的子代病毒通过神经氨酸酶(NA)水解细胞表面的糖蛋白,释放N-乙酰神经氨酸,促使病毒粒子从出芽位点释放出来。防治流感的基本手段分为疫苗注射以及药物治疗两种。疫苗的有效性建立在制备疫苗的毒株与环境中存在的或者是将要造成流行的流感病毒毒株的相似性,而由于流感病毒极易发生变异,给预测的准确性增加了困难,进而使疫苗防治的效果受到极大的影响。在疫苗有效性难以把握的情况下,抗流感病毒的药物研究就显得尤为重要。而目前FDA批准上市的抗流感药物只有四种:金刚烷胺、金刚乙胺、奥司他韦、扎那米韦。前两种属于M2离子通道抑制剂,通过抑制病毒RNA释放到胞质抑制病毒的复制。后两种属于NA活性抑制剂,通过抑制病毒粒子的释放和扩散抑制病毒的复制。然而,随着病毒对这些药物抗药性的产生以及这些药物引起的副反应等问题使得新型抗流感病毒药物的研发迫在眉睫。技术实现要素:本发明的目的是提供化合物AJ-2在制备治疗或预防流感病毒的药物中的应用。化合物AJ-2即为式(Ⅰ)所示化合物。本发明首先要求保护式(Ⅰ)所示化合物在制备抑制流感病毒的药物中的应用。所述抑制流感病毒可体现为抑制流感病毒复制和/或抑制流感病毒颗粒核蛋白体(vRNP)的活性。所述流感病毒可为A型流感病毒,具体可为A型流感病毒H1N1亚型,更具体可为A/WSN/33毒株。本发明还保护一种抑制流感病毒的药物,其活性成分为式(Ⅰ)所示化合物。所述抑制流感病毒可体现为抑制流感病毒复制和/或抑制流感病毒颗粒核蛋白体(vRNP)的活性。所述流感病毒可为A型流感病毒,具体可为A型流感病毒H1N1亚型,更具体可为A/WSN/33毒株。本发明还保护式(Ⅰ)所示化合物在制备的药物中的应用;所述药物的功能为如下(a)和/或(b)和/或(c):(a)抗流感病毒;(b)治疗流感;(c)预防流感。所述(b)和/或(c)中,所述流感可为A型流感病毒引起的流感,具体可为A型流感病毒H1N1亚型引起的流感,更具体可为A/WSN/33毒株引起的流感。本发明还保护一种药物,其活性成分为式(Ⅰ)所示化合物;所述药物的功能为如下(a)和/或(b)和/或(c):(a)抗流感病毒;(b)治疗流感;(c)预防流感。所述(b)和/或(c)中,所述流感可为A型流感病毒引起的流感,具体可为A型流感病毒H1N1亚型引起的流感,更具体可为A/WSN/33毒株引起的流感。以上任一所述式(Ⅰ)所示化合物具体可为式(Ⅱ)所示化合物。本发明对于流感病毒的防治具有重大价值。附图说明图1为实施例2中步骤一得到的产物的1H-NMR谱。图2为实施例2中步骤一得到的产物的13C-NMR谱。图3为实施例3的结果。图4为实施例4的结果。具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。紫金牛,学名:Ardisiajaponica(Thunb)Blume,为紫金牛科、紫金牛属小灌木或亚灌木植物。矮地茶为紫金牛的干燥全株。实施例中所用的矮地茶购自河北安国药材市场。PBS缓冲液(pH7.0-7.2):NaCl8g、KCl0.2g、Na2HPO4·12H2O3.58g、KH2PO40.27g,超纯水定容至1L。Hela细胞(子宫颈癌细胞):ATCC,编号为CCL-2。A549细胞(人肺腺癌细胞):ATCC,编号为CCL-185。293T细胞(人肾上皮细胞):ATCC,编号为CRL-11268。DMEM培养基(Dulbecco’sModifiedEagle’sMedium):Gibco公司。转染试剂PEI(按说明书操作):Polyscience公司。荧光素酶活性测量试剂盒:Promega公司。三氮唑核苷病毒唑(利巴韦林):Sigma公司。MTT:Sigma。蛋白酶抑制剂:购自Roche公司。A/WSN/33流感病毒毒株(简称A/WSN/33毒株):为A型流感病毒H1N1亚型毒株,该毒株记载于“NeumannG1,WatanabeT,ItoH,etal.GenerationofinfluenzaAvirusesentirelyfromclonedcDNAs.PNAS,1999(16):9345-9350”一文,公众可从中国科学院微生物学研究所获得。表达流感病毒PA基因的质粒、表达流感病毒PB1基因的质粒、表达流感病毒PB2基因的质粒和表达流感病毒NP基因的质粒(即文献中“表达流感病毒PA、PB1、PB2和NP基因质粒”,“Plasmidsforexpressingnon-taggedPB1,PB2,PAandNP”):记载于“ZhangJ,LiuT,TongX,etal.IdentificationofnovelvirusinhibitorsbyinfluenzaAvirusspecificreportercellbasedscreening.AntiviralRas,2012(1):48-54”一文,公众可从中国科学院微生物学研究所获得。pRL-TK质粒:Promega公司。pREP4载体:记载于“李云芳,张幼怡,侯嵘等.质粒转染对HEK293和DDT1—MF2细胞天然β2—肾上腺素受体表达的影响.北京大学学报:医学版,2001年底5期”一文,公众可从中国科学院微生物学研究所获得。pHH21载体:参考文献:GenerationofinfluenzaAvirusesentirelyfromclonedcDNAs。实施例1、293T-IAV-Luc细胞的制备一、pREP4-IAV-Luc质粒的构建人工合成序列表中序列1所示DNA片段。序列1共由1748个核苷酸组成,第14-58位记为片段1,第59-1711位为萤火虫荧光素酶编码基因(报告基因),第1712-1734位记为片段2,两端为BsmBI的识别位点序列。其中,片段1和片段2均为流感病毒NP蛋白的启动子,在流感病毒存在的情况下,位于该融合质粒上的该启动子可被启动,萤火虫荧光素酶才能够表达。用限制性内切酶BsmBI酶切序列表中序列1所示的DNA片段,回收酶切片段后与经过同样酶切的pHH21载体的骨架大片段正向相连,将测序验证正确的中间质粒命名为pHH21-IAV-Luc质粒。将pHH21-IAV-Luc质粒以NheI和PciI内切酶(Takara)酶切,回收酶切片段,以Klenow酶(购自Takara公司)补平末端后连入PvuII内切酶消化的pREP4载体,将测序验证正确的重组质粒命名为pREP4-IAV-Luc。二、293T-IAV-Luc细胞的制备将重组质粒pREP4-IAV-Luc导入293T细胞,得到重组细胞,命名为293T-IAV-Luc细胞。实施例2、化合物AJ-2的制备和表征一、化合物AJ-2的制备1、矮地茶70%乙醇提取物的获得取4.7kg矮地茶,粉碎,加入9.4kg70%(体积比)乙醇水溶液,加热回流提取2次(每次2h),用旋转蒸发仪减压回收溶剂,从而去除乙醇和水,获得矮地茶70%乙醇提取物。2、矮地茶乙酸乙酯萃取物的获得取步骤1所得的矮地茶70%乙醇提取物,加入与其重量相等的水,混悬,再向其中加入与矮地茶70%乙醇提取物重量相等的乙酸乙酯,萃取2h,收集有机相;再向水相中加入与矮地茶70%乙醇提取物重量相等的乙酸乙酯,萃取2h,收集有机相;取两次萃取得到的有机相并合并,用旋转蒸发仪减压回收溶剂,从而去除乙酸乙酯,获得矮地茶乙酸乙酯萃取物。3、矮地茶乙酸乙酯萃取物的硅胶柱层析硅胶柱层析条件如下:硅胶柱(减压柱)规格:60×300mm(海门市华凯实验玻璃仪器有限公司);柱温为27℃;硅胶(200-300目;青岛海洋化工厂)填充量为200g;矮地茶乙酸乙酯萃取物的上样量为40g;洗脱液及洗脱程序如表1所示;流速为20ml/min;连续收集过柱后洗脱液,每200mL收集一管。表1矮地茶乙酸乙酯萃取物的硅胶柱层析的洗脱程序洗脱液编号洗脱液成分洗脱体积洗脱液1正己烷:乙酸乙酯(体积比100:5)第1-1000mL洗脱液2正己烷:乙酸乙酯(体积比100:10)第1001-2000mL洗脱液3正己烷:乙酸乙酯(体积比100:20)第2001-3000mL洗脱液4正己烷:乙酸乙酯(体积比0:100)第3001-4000mL洗脱液5甲醇第4001-5000mL对所收集的各管洗脱液进行薄层层析(TLC)检测,以各管洗脱液进行硅胶柱层析洗脱时采用的相应组分的洗脱液作为展开剂,以粒度为200-300目的硅胶作为固定相,操作温度为27℃。计算五种洗脱液对应的5个流份的比移值(Rf)。将所收集的5个流份分别记为Fra.A、Fra.B、Fra.C、Fra.D和Fra.E。Fra.A为用洗脱液1洗脱得到的,比移值(Rf)为0.35-0.55。Fra.B为用洗脱液2洗脱得到的,比移值(Rf)为0.29-0.50。Fra.C为用洗脱液3洗脱得到的,比移值(Rf)为0.22-0.48。Fra.D为用洗脱液4洗脱得到的,比移值(Rf)为0.18-0.46。Fra.E为用洗脱液5洗脱得到的,比移值(Rf)为0.39-0.55。4、化合物AJ-2的制备取流份Fra.E,以二氯甲烷:甲醇(体积比1:1)重结晶,得到粗品。取粗品,以二氯甲烷:甲醇(体积比1:1)重结晶,得到产物(15mg)。二、化合物AJ-2的表征步骤一得到的产物的形态:无定型白色粉末,易溶于甲醇,丙酮等有机溶剂。步骤一得到的产物的表征数据见表2。步骤一得到的产物的1H-NMR谱见图1。步骤一得到的产物的13C-NMR谱见图2。表2步骤一得到的产物的1H-NMR和13C-NMR谱各峰归属注:“a”:溶剂为DMSO-d6。NMR测试采用Bruker500MHz仪器(1H500MHz;13C125MHz)(溶剂峰校正δH2.50,3.30/δC39.5)。以上表征数据表明,步骤一得到的产物的化学式为C14H16O9,分子量为328,结构式如下:步骤一得到的产物即为化合物AJ-2。将化合物AJ-2溶于DMSO,得到浓度为1mg/ml的AJ-2溶液。后续实施例中的化合物AJ-2均是以AJ-2溶液的形式加入的。实施例3、化合物AJ-2抑制H1N1亚型流感病毒的复制1、将A/WSN/33毒株、DMEM培养基和化合物AJ-2混合,得到化合物AJ-2浓度为10μmol/L的混合液。2、将293T-IAV-Luc细胞均匀的铺于96孔板上(每孔20000个细胞),37℃静置培养12小时,弃上清,用PBS缓冲液清洗孔中的细胞。3、完成步骤2后,取所述96孔板,加入步骤1得到的混合液(MOI=0.5),37℃静置孵育1小时,弃上清。4、完成步骤3后,取所述96孔板,加入含10%(体积比)胎牛血清和10μmol/L化合物AJ-2的DMEM培养基,37℃静置培养12小时,弃上清,用PBS缓冲液清洗孔中的细胞。5、完成步骤4后,取所述96孔板,加入荧光素酶活性测量试剂盒中的裂解液,37℃静置孵育30分钟,取上清。6、取步骤5得到的上清,采用荧光素酶活性测量试剂盒检测荧光素酶报告基因的表达水平。将DMSO作为化合物AJ-2的阴性对照。进行三次重复试验,结果取平均值。结果见图3(图3中,DV代表阴性对照)。结果表明,化合物AJ-2可以抑制流感病毒的复制。实施例4、化合物AJ-2抑制流感病毒vRNP活性1、将293T-IAV-Luc细胞均匀的铺于24孔板上,37℃静置培养14小时,弃上清。2、完成步骤1后,取24孔板,加入含10μmol/L化合物AJ-2的DMEM培养基,37℃静置孵育1小时,弃上清。3、完成步骤2后,取24孔板,借助转染试剂PEI转染表达流感病毒PA、PB1、PB2和NP基因质粒和pRL-TK质粒(每孔的转染剂量如下:表达流感病毒PA基因的质粒、表达流感病毒PB1基因的质粒、表达流感病毒PB2基因的质粒和表达流感病毒NP基因的质粒各0.15μg,pRL-TK质粒0.005μg),37℃静置孵育6小时,弃上清。4、完成步骤3后,取24孔板,加入含10%(体积比)胎牛血清和10μmol/LAJ-2的DMEM培养基,37℃静置培养24小时,弃上清,用PBS缓冲液清洗孔中的细胞。5、完成步骤4后,取24孔板,加入荧光素酶活性测量试剂盒中的裂解液,4℃静置孵育30分钟,取上清。6、取步骤5得到的上清,采用荧光素酶活性测量试剂盒检测荧光素酶报告基因的表达水平。将DMSO作为化合物AJ-2的阴性对照。进行三次重复试验,结果取平均值。结果见图4。化合物AJ-2具有抑制流感病毒聚合酶复合体的活性。实施例5、细胞毒性试验1、将细胞铺于96孔板(每孔10000个细胞),37℃静置培养14小时,弃上清。2、完成步骤1后,取96孔板,加入含梯度浓度化合物AJ-2的DMEM培养基,37℃静置培养48小时,弃上清。3、完成步骤2后,取96孔板,加入含0.5mg/mlMTT的DMEM培养基,37℃静置孵育4小时,弃上清。4、完成步骤3后,取96孔板,每孔加入100μlDMSO,避光裂解10min,然后采用酶标仪检测570nm处的吸光值。CC50(50%的细胞发生病变时的药物浓度)见表3。表3化合物AJ-2的细胞毒性结果(CC50,μM)A549细胞293T-IAV-Luc细胞Hela细胞>40>40>40当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1