ECG评估的制作方法
本发明涉及一种用于评估心脏功能的方法,特别是一种利用心电图所提供的信息的方法。本发明还涉及可以实施上述方法(包括计算机程序)的设备。
背景技术:
心脏的固有传导系统允许源自窦房结的电脉冲以受控方式行进通过心脏组织。这种电脉冲经过心脏组织产生通过心脏组织的收缩波。收缩波之后是心脏组织中的相对电平静的时期,其对应于心脏组织的松弛。当心脏的这种正常的、有组织的电活动被破坏时,出现心律失常。全世界每年有300万人死于心脏性猝死。在大多数情况下,没有警告,心脏因突然的心律失常而停止。一些人处于心脏性猝死的高风险中,但是这可以通过以小手术植入的植入式心脏复律除颤器来防止。
在英国,使用国家健康和临床优化研究所(NICE)指南(基于生理和电生理测量的混合以及对受试者的临床史的理解的筛选)来关于心脏性猝死的风险筛选受试者。然而,大多数死于心脏性猝死的人都没有被这些指南所识别出。
通过测量心脏的电活动来评估心脏的健康是已知的。例如,可以使用直接施加到心脏组织的心脏内电极来测量心脏的电活动。
然而,这是一种特别侵入性的技术,其对于受试者的常规评估来说不是优选的,并且没有清楚地显示为展示出对评估心脏功能(诸如心律失常的风险)的任何临床相关性。心电图(ECG)已经被开发作为用于研究心脏的电活动的非侵入性程序。ECG涉及在受试者的皮肤表面上放置多个电极。可以从多个电极的组合之间的电位差(即,导联)来识别对心脏的电活动的理解。传统上,ECG导联的集体评估提供了经典的ECG跟踪,其包括P波、QRS复合波和T波,并且其展示出从等电位线变化的电活动的周期。已经建议,通过测量ECG跟踪上的QT持续时间的离散度,ECG对于识别心脏的心律失常可能是有用的。然而,测量该QT持续时间的变化作为心律失常的指标已经被认为是不可信的;到了心脏病学社群不再将QT离散度评估视为建立心律失常风险的临床相关方式的程度(参见例如Malik等人;JACC;2000;36:1749-66)。
本发明人已经认识到分析ECG输出的另一种方法,其已经证明在评估心脏功能中是有用的。称为“区域恢复不稳定性指数或R2I2”的分析本质上评估ECG输出中的导联差异作为心脏功能的指标(参见国际专利公开号WO 2011/117608A1和Nicolson等人的“A Novel Surface Electrocardiogram Based Marker of ventricular Arrhythmia Risk in Patients with Ischemic Cariomyopathy“J.American Heart Association,2012)。
然而,仍然需要能够识别因心律失常引起的心脏性猝死的风险的其它方法和设备。这种方法和设备对于识别那些最可能从植入式心脏复律除颤器的植入或用抗心律失常治疗学进行的治疗中受益的个体特别有用。
本发明人惊奇地发现,对通过ECG的每个导联在多个时间段上获得的动作电位持续时间和心脏舒张间隔之间的关系的变化进行分析,呈现出能够指示被分析的个体是否可能继续发展心律失常。
技术实现要素:
因此,在本发明的第一方面,提供了一种用于评估心脏的电功能的方法,包括以下步骤:
a.对于ECG的多个导联中的每一个导联,在多个时间点,确定
从该导联的输出导出的并且对应于动作电位持续时间的值;
b.对于ECG的所述多个导联中的每一个导联,在所述多个时间点,确定从该导联的输出导出的并且对应于舒张间隔的值;
c.对于ECG的所述多个导联中的每一个导联,使用所确定的在所述多个时间点上的动作电位持续时间的值和舒张间隔的值来确定由该导联看到的动作电位持续时间与舒张间隔之间的关系;
d.定义每一个所确定的动作电位持续时间与舒张间隔之间的关系的至少一个关注特性,并且将关于来自由所述多个导联看到的关系的该特性的信息进行组合,以导出组合值;
e.通过分析所述组合值来导出评估结果。
ECG提供心脏的电功能的皮肤心电图测量。如本领域技术人员所知,ECG包括放置在身体的特定外部位置上的多个电极。ECG的导联是这些电极的两个或更多个之间的电位差。因此,导联提供对应于形成导联的电极之间变化的电位差的电输出。
在ECG中可用的多个导联对于本领域技术人员来说是已知的(参见例如“The ECG made easy”,第4版,John R.Hampton,Churchill Livingstone,1997)。例如,导联可以包括或由如下组成:肢体导联、胸导联、后壁导联、前壁导联、侧壁导联、下壁导联或其任何组合。例如,肢体导联可以包括或由如下组成:右臂(红色)、左臂(黄色)、左腿(绿色)、右腿(黑色)或其任何组合。例如,胸导联可以包括或由如下组成:V1(右胸骨边缘,第四肋间间隙)、V2(左胸骨边缘、第四肋间间隙)、V3(V2和V4之间的中间)、V4(顶点搏动的位置-例如第五肋间间隙和中锁骨线的交叉)、V5(前腋线)、V6(中腋线)或其任何组合。例如,后壁导联可以包括或由如下组成:V7(左后腋窝线,来自V6的直线)、V8(左中间中线,来自V7的直线)和V9(左侧脊旁线,来自V8的直线)。例如,前壁导联可以包括或由如下组成:V1、V2、V3、V4或其任何组合。例如,侧壁导联可以包括或由如下组成:V5、V6、I、aVL或其任何组合。例如,下壁导联可以包括或由以下组成:II、III、aVF或其任何组合。
在根据本发明的方法中使用的导联的数量必须超过2,并且可以是5或更多,10或更多,或12或更多。可选地,导联的数量不超过4096。本方法的多个导联可以是5、12、128或256个导联配置。
对“多个时间点”的引用要求在多个时间点执行的步骤被重复多次。换句话说,本发明的方法需要多于一个的用于确定从导联的输出导出的并且对应于动作电位(或舒张间隔)的值的实例。由于评估动作电位持续时间和由心跳在不同速率下获得的舒张间隔之间的关系的变化可以是有益的,因此每个时间点可以在心率变化的时段期间选择。心率可以通过以下方式引起改变:-向拥有待分析心脏的受试者施加变时性治疗药(即,改变心率的药物);通过对拥有待分析心脏的受试者进行身体锻炼;通过向心脏提供变化频率的电起搏脉冲(通常称为“起搏尖峰”)。替代地,可以在一段时间(例如48小时)内分析心脏的电功能,并且在本申请的方法下选择用于分析的多个时间点是经历心率极值的那些实例(例如,在心律失常的时段期间)。
动作电位持续时间是肌细胞电活动的周期,其将被理解为包括初始去极化、平台期和最终的复极化期。当肌细胞处于电静态时,舒张间隔是动作电位之间的间隔。来自ECG的每个导联的输出提供了心脏电活动的足够的信息,以便本领域技术人员从其导出动作电位持续时间和舒张间隔两者的值。例如,ECG导联的输出可以被转换成ECG跟踪,例如,包括P波、QRS复合波和T波。本领域技术人员在预选对应于动作电位持续时间和舒张间隔的ECG跟踪的相关部分方面没有困难。通过测量这些预选部分的持续时间,可以根据导联的输出确定对应于动作电位持续时间和舒张间隔的值。
对应于动作电位持续时间的预选部分可以例如是QT或JT间隔。对应于舒张间隔的预选部分可以例如是TQ间隔。在步骤a中确定每个导联的值的过程应该是一致的。在步骤b中确定每个导联的值的过程应该是一致的。
应当理解,如何精确地计算这些间隔中的每一个的开始和结束(以便识别它们的持续时间)与如下事实相比并不重要:对于JT、QT和TQ间隔的值每一个在本发明的方法中以一致的方式测量。例如,可以从如下测量QT间隔:-从QRS复合波的开始到T波的结束;从R波的开始到T波的结束;从QRS复合波的开始到T波的峰值,或;从R波的开始到T波的峰值。例如,JT间隔可以从如下测量:-从QRS复合波与T波的结束之间的分离点,或;从QRS复合波与T波峰值之间的分离点。例如,可以从如下测量TQ间隔:-从T波的结束到QRS复合波的开始;从T波的结束到R波的开始;从T波的峰值到QRS复合波的开始,或;从T波的峰值到R波的开始。(参见,例如,Malik等人;JACC;2000;36:1749-66)。当心率在电起搏脉冲的影响下时,在捕获本方法的值期间,出现在ECG中并且对应于每个起搏脉冲的起搏尖峰可以被认为是动作电位持续时间的开始,和/或舒张间隔的结束。
可以以本领域技术人员将理解的多种方式来确定多个时间点上的所确定的动作电位持续时间和舒张间隔的确定值之间的关系。例如,可以在图表上绘制每个导联的恢复曲线(通常,Y轴对应于动作电位持续时间,而x轴对应于舒张间隔)。个体心脏细胞的恢复曲线描述舒张间隔和动作电位持续时间之间的非线性关系。建立恢复曲线处于本领域的普通技术范围内。例如,关于如何建立适用于本发明的恢复曲线的解释可见于Taggart等人,“Effect of Adrenergic Stimulation on Action Potential Duration Restitution in Humans”Circulation,30December 2002(通过引用并入本文),即,使用最小二乘回归拟合40ms数据段内的线性梯度的方法。然后沿着x轴(TpQ)以10ms的增量移动该段。
关注特性可选地是定义由每个导联看到的动作电位持续时间与舒张间隔之间的前述关系的变化的任何特性。因此,关注特性可以是每个导联的恢复曲线的一个或多个梯度,可选地,是每个导联的该曲线上的每个时间点的恢复曲线的梯度。绘制以建立每个导联的恢复曲线的每个点表示在从该导联接收到输出的时间点处的动作电位持续时间与舒张间隔之间的关系。可以计算通过该点的曲线的梯度作为关注特性。代替分析每个导联在该曲线上的每个时间点,可以改为分析每个导联的曲线的仅一部分上的时间点。例如,仅分析第一个四分之一(quarter)的时间点、第二个四分之一的时间点、第三个四分之一的时间点和/或第四个四分之一的时间点。代替分析该曲线上的每个时间点或该曲线的一部分,可以仅分析时间点的代表性选择。例如,可以仅分析曲线或曲线部分中的每2、3、4、5或6个时间点。实际上,该方法不必限于曲线上的每个导联的时间点是从导联的输出导出的舒张间隔和动作电位持续时间值直接导出的时间点。一旦建立了曲线,沿着曲线的每个点可以被作为时间点(包括曲线中的位于从导联的输出导出的动作电位持续时间和舒张间隔直接导出的点之间的点)。组合值可以是多个组合值,每个组合值是针对每个时间点的特性的信息的组合。组合值可以是关注特性对每个时间点在导联上的平均值,并且因此可以导出一个或多个时间点的组合值。这与建立每个时间点的特性之间的差异的量非常不同。例如,当关注特性是在时间点处的恢复曲线的梯度时,通过建立梯度在导联上的平均值来获得组合值或组合值中的一个,可选地,组合值是通过对于每个时间点建立梯度对一个时间点在导联上的平均值而获得的。这将例如要求建立由每个导联建立的时间点的梯度,然后建立那些梯度的平均值。建立平均值处于普通人的技能之内。可以使用任何方法,只要它被一致地使用。例如,可以将所有值相加在一起,并且将总和除以值的数量,以便识别平均值。
步骤d)的分析可以包括:从组合值中识别最陡的梯度。例如,如果分析多个时间点并且因此确定多个组合值,则最陡峭梯度的值(即,最高组合值)可以是在步骤e中使用的组合值。
已经发现,梯度越陡,受试者越可能发展成心力衰竭,因此更有可能需要可植入式心脏复律除颤器或需要施用抗心律失常药。例如,梯度大于1.21被认为表示与正常(通过本发明的方法分析)相比发展心律失常或心力衰竭的风险升高,例如根据峰值心电图恢复梯度(PERG),如稍后在方法部分所述。
已经发现,当与R2I2方法组合时使用上述方法的分析得到更准确的心脏功能的评估。R2I2识别在步骤c中识别的关系之间的差异量,并且每个导联之间的差异量越大,发展心律失常的风险越大。因此,本发明的方法可以包括根据R2I2进行分析的另外的步骤(如WO95/2011/117608 A1或Nicolson et al。“A Novel Surface Electrocardiogram-Based Marker of Ventricular Arrhythmia Risk in Patients with Ischemic Cariomyopathy“J.American Heart Association,2012,并且通过引用并入本文),并将该分析与本发明的步骤e中进行的分析结合。
例如,本发明的方法可以另外包括以下步骤:-
f.评估所述多个导联中的每一个导联的从步骤c)确定的关系之间的差异。
g.通过分析步骤e和步骤f的组合评估来评估心脏的心脏功能,确定受试者对植入可植入式心脏复律除颤器的需求或施用抗心律失常药的需求。
存在许多方法可以在步骤f中评估在步骤c中识别的关系之间的差异。例如,单个动作电位持续时间和单个舒张间隔之间的关系可以被确定为每个导联的两者的比率,可以数值地评估每个导联的比率之间的差异。例如,当为每个导联确定多个动作电位持续时间和舒张间隔时,可以通过识别或量化通过在图上绘制每个导联的动作电位持续时间值对舒张间隔值(或反之亦然)而建立的曲线(即恢复曲线)的一个或多个梯度中的差异,来评估所确定的关系之间的差异。该差异可以在视觉上从每个导联的曲线在曲线长度上的分离程度而显而易见,或者通过每个导联的曲线在曲线长度上的分离程度的变化而显而易见。
曲线的数值分析也可用于量化差异。例如,可以应用以下过程:-(1)对数据集应用逻辑回归以导出多项式方程,(2)应用该多项式方程,调整线性常数以进而实现对每个导联最佳拟合,(3)使用逻辑回归来计算该技术对每个导联产生的残差,(4)对残差求和将产生关系之间的差异的度量。在点(1)处,可以使用样条代替多项式方程。在点(1)处,可以对来自每个心脏区域的导联组单独使用线性回归,然后可以如步骤(2)、(3)和(4)中所述将得到的方程式从其相应的区域施加到导联。在另一个示例中,可以应用以下过程:-(1)针对每个确定的舒张间隔长度计算来自所有导联的动作电位差的标准偏差,(2)将该值的平均值作为数据的异质性的标记。
例如,评估步骤f中的差异。可以包括,对于每个时间点:-
(i)对于多个导联中的每一个导联,建立在步骤c中确定的关系之间的平均点,
(ii)对于每个导联,计算从该平均点到针对该导联确定的关系的残差的平方(例如,从平均值的变化的平方);
在步骤f中评估差异可以进一步包括:-
(iii)对于每个导联,针对每个时间点计算在步骤(ii)中计算出的残差的平方的平均值。
在步骤f中评估差异可以进一步包括:-
(iv)通过将步骤(iii)中计算出的平均值除以当从正常发展心律失常风险的受试者的评估计算时的相同平均值,或者除以针对所有所述多个导联的步骤(iii)的值,来计算归一化平均值。
在步骤f中评估差异可以进一步包括:-
(v)从针对多个导联中的每一个导联计算出的归一化平均值中识别步骤(iv)中计算出的最大归一化平均值。
在步骤(v)中计算出的值已被指定为区域再极化不稳定性指数(R212)。
已经发现,为每个导联识别出的关系之间的差异越大(其可以由相对较大的R212证明),被评估的心脏是异常的风险就越大,例如将发展成心脏心律失常。因此,本发明的方法在被应用于从施加于受试者的ECG导出的输出时,可以用作评估受试者发展心律失常的风险的预后方法。因此,本质上,在为每个导联确定的关系之间的异质性增加水平(其可以由相对较大的R212证明)导致心律失常的风险增加。
因此,在本发明的一个实施例中,本发明的步骤可以对从应用于待针对发展心律失常的风险进行检查的受试者的ECG导出的输出进行。该方法可以进一步包括:对从施加于已经确定具有发展心律失常的正常风险的受试者的ECG导出的输出执行步骤,以及将在步骤f中对来自待检查受试者的输出所评估的差异与在步骤f中确定为处于发展心律失常的正常风险的受试者的输出所评估的差异(或者与在步骤d中针对被确定为处于发展心律失常的正常风险的受试者的输出所评估的差异对应的预定值)。当确定待检查的受试者的差异大于被确定为处于正常风险(或预定值)的受试者的差异时,待检查的受试者处于发展心律失常的风险增加(增加,风险高于正常,反之亦然)。关于正常受试者的相似分析可以关于步骤e执行。
预定值是从对确定为处于发展心律失常的正常风险(即一组正常受试者的平均值)的受试者的评估导出的。因此,正常受试者代表对照组。确定个体受试者相对于其心律失常的风险是否正常是本领域技术人员能力范围内的临床问题。然而,为了清楚起见,但不希望进一步限制,这种组中的个体的特征在于通过超声心动图确定的结构正常的心脏,并且没有心悸、晕厥或其它心脏问题的病史。可选地,正常受试者没有心脏死亡的家族史。
如果步骤e和g二者都得出心脏具有小于正常功能的风险增加(即,心脏的受试者处于发展心律失常的风险高于正常),则风险被确定为大于仅步骤e或g得出的该结论。
在本发明的第二方面中,提供了一种用于确定受试者对植入可植入式心脏复律除颤器的需求或施用抗心律失常药的需求的方法,包括以下步骤:
a.对于针对受试者的ECG的多个导联中的每一个导联,在多个时间点,确定从该导联的输出导出的并且对应于动作电位持续时间的值;
b.对于针对受试者的ECG的所述多个导联中的每一个导联,在所述多个时间点,确定从该导联的输出导出的并且对应于舒张间隔的值;
c.对于针对受试者的ECG的所述多个导联中的每一个导联,使用所确定的在多个时间点上的动作电位持续时间的值和舒张间隔的值来确定由该导联看到的动作电位持续时间与舒张间隔之间的关系;
d.定义每一个所确定的动作电位持续时间与舒张间隔之间的关系的至少一个关注特征,并且将关于来自由所述多个导联看到的关系的该特征的信息进行组合,由导出组合值;
e.基于对组合值的分析,导出受试者对植入可植入式心脏复律除颤器的需求或施用抗心律失常药的需求的评估。
这种方法可以用于引导被确定为需要治疗的受试者通过施用有效量的一种或多种抗心律失常药来治疗和/或通过植入心脏复律除颤器来治疗的方法。
这种方法可以用于治疗患有心律失常的受试者的方法,并且进一步包括以下步骤:如果通过步骤d评估受试者需要这种治疗,则向受试者施用有效量的一种或多种抗心律失常药,和/或植入心脏复律除颤器。
可以使用任何临床相关的抗心律失常药,例如胺碘酮。
为了监视任何抗心律失常药的功效,本发明的方法可以首先在没有用抗心律失常药治疗的情况下进行,然后在施用一个或多个剂量的抗心律失常药之后重复一次或多次。以这种方式,本发明的方法可以用于跟踪使用试剂的治疗的功效。
本发明的第一方面的所有可选特征可以包括在本发明的第二方面中。为了避免疑问,应当理解,当该方法识别出受试者处于发展心律失常的风险增加时,对在受试者中植入可植入式心脏复律除颤器或者施用抗心律失常药物的需求增加(例如与具有发展心律失常的正常风险的个体相比)。
在本发明的第三方面中,提供了一种用于评估心脏的功能的设备,包括计算机,其被布置成从EGG的多个导联中的每一个导联接收输入并且布置成:
a.对于ECG的多个导联中的每一个导联,在多个时间点,确定从该导联的输出导出的并且对应于动作电位持续时间的值;
b.对于ECG的所述多个导联中的每一个导联,在所述多个时间点,确定从该导联的输出导出的并且对应于舒张间隔的值;
c.对于ECG的所述多个导联中的每一个导联,使用所确定的在所述多个时间点上的动作电位持续时间的值与舒张间隔的值来确定由该导联看到的动作电位持续时间与舒张间隔之间的关系;
d.定义每一个所确定的动作电位持续时间与舒张间隔之间的关系的至少一个关注特征,并且将关于来自由所述多个导联看到的关系的该特征的信息进行组合,由导出组合值;
e.通过分析组合值来导出评估结果。
根据本发明第三方面的设备布置为以便能够操作根据本发明的先前方面的方法。因此,本发明的第一和第二方面的所有特征可以包括在本发明的第三方面中。例如:-
该设备可以包括ECG装置。ECG装置可以包括被配置为提供针对本发明的第一方面描述的任何导联组合的多个电极。
来自ECG的每个导联的输出提供关于心脏的电活动的足够的信息,以便计算机从其导出动作电位持续时间和舒张间隔两者的值。例如,计算机可以被配置为将ECG导联的输出转换成ECG跟踪,例如,包括P波、QRS复合波和T波。计算机可以被配置为预选对应于动作电位持续时间和舒张间隔的ECG跟踪的相关部分。上面关于本发明的第一方面讨论了适当的预选标准。
计算机可以被布置为以多种方式确定动作电位持续时间和舒张间隔之间的关系,参见例如在本发明的第一方面中讨论的确定。
本发明的设备在应用于从施加于受试者的ECG导出的输出时,可以用于预测该受试者发展心律失常的风险的方法中。
该设备可以进一步包括能够向心脏组织提供电激发的电生理导管。
该设备可以进一步包括计算机程序产品,当在计算机上运行时,该计算机程序产品使得其以上述方式被配置。
在本发明的第四方面中,提供了一种计算机程序产品,当运行在布置成从EGG的多个导联中的每一个导联接收输入的计算机上时使计算机:
a.对于ECG的多个导联中的每一个导联,在多个时间点,确定从该导联的输出导出的并且对应于动作电位持续时间的值;
b.对于ECG的所述多个导联中的每一个导联,在所述多个时间点,确定从该导联的输出导出的并且对应于舒张间隔的值;
c.对于ECG的所述多个导联中的每一个导联,使用所确定的在多个时间点上的动作电位持续时间与舒张间隔的值来确定由该导联看到的动作电位持续时间与舒张间隔之间的关系;
d.定义每一个所确定的动作电位持续时间与舒张间隔之间的关系的至少一个关注特征,并且将关于来自由所述多个导联看到的关系的该特征的信息进行组合,以导出组合值;
e.通过分析组合值来导出评估结果。
根据本发明第四方面的计算机程序可以包括在本发明第三方面的设备中。因此,本发明的前述方面的所有特征可以包括在本发明的第四方面中。
在本发明的另一方面,提供了基本上如上所述并参照附图的方法。
在本发明的另一方面,提供了基本上如上所述并参照附图的设备。
在本发明的另一方面,提供了基本上如上所述并参照附图的计算机程序。
附图说明
现在将参考附图通过示例来描述本发明,其中:
图1a示出了来自患有心律失常的受试者的皮肤APD恢复图。
图1b示出了来自不患有心律失常的受试者的皮肤APD恢复图。
图2a示出了来自患有心律失常的受试者的连续皮肤APD恢复图。
图2b显示了来自不患有心律失常的受试者的皮肤APD恢复图。
图3示出了在1000Hz下使用来自ECG的12位分辨率数据(从图4所示的部分放大)数字化和记录的模拟图。
图4示出了在1000Hz下使用来自ECG的12位分辨率数据数字化和记录的模拟图。
图5示出了进行TpQ和QTp测量的技术:当S2在T波峰值之后到达时,如图左侧所示测量TpQ和QTp。然而,如果S2出现在T波峰之前,则TpQ等效为负。在这种情况下,它是通过从QTp2减去QTpl间隔(驱动周期搏动的QTp)来测量的,在上面的示例中,这将给出TpQ接近零。
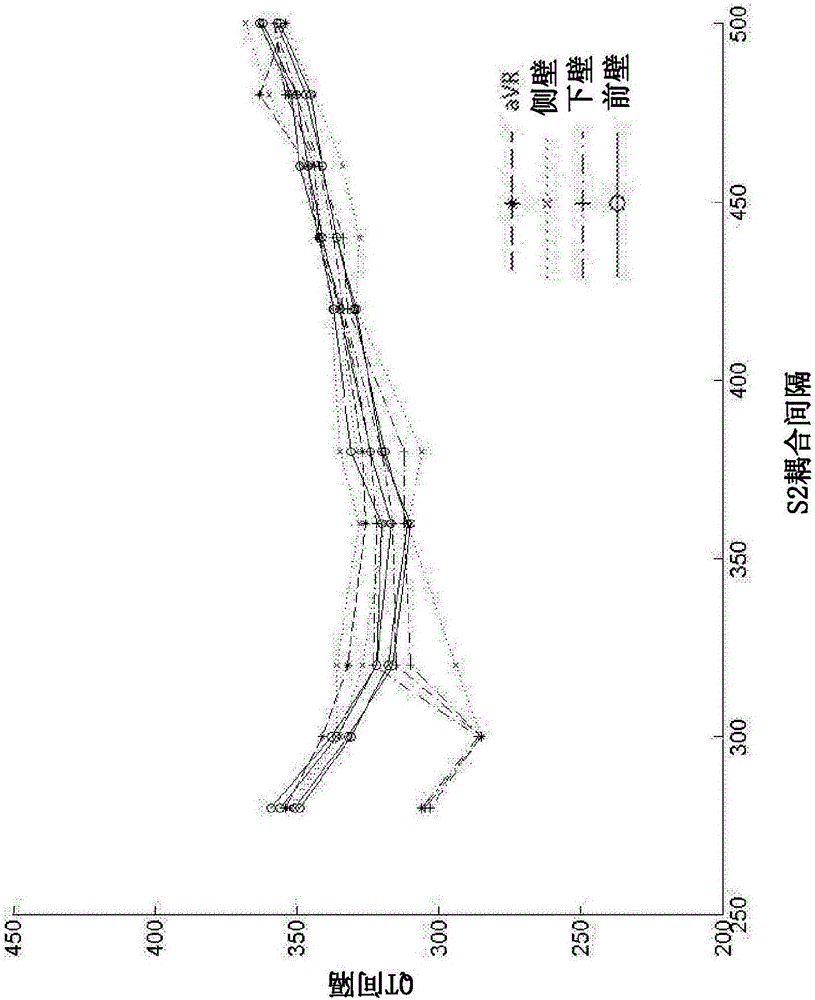
图6是示出12个导联的QTp间隔与TpQ间隔之间的动态关系的曲线图,12个导联标记为示出4个侧壁导联、3个下壁导联、4个前壁导联和1个aVR导联。图上示出研究中所有患者的群体平均值的结果。
图7是示出为评估单个患者的R2I2而准备的12个导联的QTp间隔和TpQ间隔之间的动态关系的曲线图。
图8提供了为评估R2I2而准备的、图7的曲线图的仅前壁导联的选集。
图9提供了在图8的曲线图中提供的框的放大图像。该图还示出了如何建立为每个前壁导联的该重复所确定的关系之间的平均点,然后如何计算从平均点到为每个导联所确定的关系(例如,来平均值的变化的平方)的残差的平方;
图10表示图8的曲线图,其中在曲线图中提供每次重复的平均点,下面提供附图。
图11提供了R2I2计算的解释:A中的曲线图示出对于达到室性心律失常(VA)/死亡的终点的患者的前壁导联、下壁导联和侧壁导联。单独分析每个区域,如对B中的前壁导联所见;通过产生它们的S1S2耦合间隔(coupling interval)来对点进行分组,并且在每个S1S2耦合间隔处针对每个导联计算来自最佳拟合点(黑点)的残差的平方(窄黑线)。然后对每个导联计算这些残差的平均值。导联的扩展存在差异,特别是侧壁导联倾向于比前壁导联和下壁导联更宽地间隔开。因此采取了一定比例:每个导联的值除以该导联的总体平均值。然后将R2I2求取为最大前壁值、下壁值和侧壁值的平均值。该患者(C)的LGE CMR扫描显示大的前间壁心肌梗死和心尖部心肌梗死,其中前壁为16%的梗死边缘区(PIZ),下臂为13%,侧壁为4%,它们对应于R2I2分量:前壁3.6、下壁1.3和侧壁0.25。
图12示出了心脏磁共振扫描。A)首先绘制心内膜边界和心外膜边界;接着选择“正常心肌”的大代表性区域和“峰值瘢痕(peak scar)”的小区域。B)软件分析识别信号强度在“正常心肌”平均强度之上>2标准偏差(SD)的所有体素,并且从其中减去信号强度>50%的“峰值瘢痕”的体素以获得PIZ。识别出的不在梗死区域中的体素被丢弃。与图11C中的示例相比,B中的示例示出了具有相对小的PIZ的梗死。
图13示出在R2I2>中值的“高风险”组和R2I2<=中值的“低风险”组中无室性心律失常(VA)/死亡的存活概率的Kaplan-Meier曲线。VA/死亡的差异是显著的(p=0.017,对数秩检验)。
图14示出配对数据可供用于的22名患者的R2I2相对PIZ的图。在两个参数的中值处绘制线。最小二乘回归线展示出一定程度的相关性(r=0.41,p=0.057)。
图15示出了对于导联V2和III的传动系统(drive train)的最后搏动和在400,380,360和340ms的S1S2耦合间隔的图。在复极化下展示出区域异质性:在V2中看到很小的变化,并且QTp是稳定的,而导联III可见分段有两个峰和可变QTp。在随访期间发展VA的患者的2/4中看到这种总变化。
图16示出在R2I2maxR>中值的“高风险”组和R2I2maxR<=中值的“低风险”组中存在无VA/死亡的生存概率的Kaplan-Meier曲线。VA/死亡的差异是显著的(P=0.051对数秩检验)。这里,使用TpS代替TpQ并使用JTe代替QTp来计算R2I2maxR。此外,已经采用最大归一化平均值,而不是区域归一化平均最大值的平均值。
图17示出R212的测量。图17A:ECG基准点的识别的导联III示例。示出了传动系统(S1)和额外刺激(S2)搏动的最后3次搏动。示出了APD/DI的配对代替;QTe和TpTe均与TeQ配对。缩写:TpQ为T波峰到QRS起始,TeQ为T波端(wave end)到QRS起始,QTp为QRS起始到T波峰,QTe为QRS起始到T波端,TpTe为T波峰到T波端。图1B:代表性ECG导联的QTp/TpQ图:V2(前壁)、II(下壁)和aVL(侧壁),以解释在典型研究患者中的区域恢复不稳定性指数(R2I2)计算。对于每个导联,在TpQ范围的40ms分段上计算QTp/TpQ梯度(最小二乘回归)。然后使用可用数据在TpQ的范围上扫描该分段以产生10ms间隔的梯度(数值梯度以与对应线相邻的条示出,关于最左边梯度的注释可用于导联II,但不用于V2和aVL)。计算每个40ms分段中梯度与平均梯度的差异。将这些值的标准偏差作为每个导联内的动作电位持续时间恢复异质性的量度。然后将其平均值作为R2I2。
图18示出了对于4名患者的QTp/TpQ图:A.高的R2I2和高的PERG,B.高的R2I2和低的PERG,C.低的R2I2和高的PERG,D.低的R2I2和低的PERG。对于每个示例患者,12个ECG导联具有由ECG区域编码的分开的线条样式。线被绘制为点对点而不是梯度,以允许区分ECG导联。R2I2在其ECG导联遵循不一致的QTp/TpQ路径的患者中更高。PERG反映了作为对于所有12个ECG导联的平均值的最陡梯度。
图19示出R212与室性心律失常/心脏性猝死的风险的关联。图3A:Kaplan Meier曲线,示出由R2I2值为1.03(p<0.0001,对数秩)分割的患者的没有室性心律失常/心脏性猝死的存活的曲线的显著分离。图3B.区域恢复不稳定指数(R2I2)的受试者操作特征曲线:VA/SCD与无事件生存率比较(曲线下面积=0.770)
图20示出了区域恢复不稳定性指数对峰值ECG恢复梯度的图。对于在12个导联平均峰值恢复梯度和R2I2(r=0.290,p=0.025)之间的PERG.Spearman秩相关分析最小相关性,在预选的R2I2的截止值处并且在1.21的最佳截止值处绘制线。
图21示出Kaplan Meier曲线,其示出患者没有心室性心律失常/心脏性猝死的存活的曲线的显著分离,所述患者分为:R2I2<1.03且PERG<1.21/R2I2≥1.03或PERG≥1.21/值R212≥1.03且PERG≥1.21(p<0.0001,对数秩)。
具体实施方式
1.示例1:入选标准:
正在考虑进行新的ICD植入的患者具有NYHA II-III级心力衰竭症状和记录的左心室功能障碍。
2.示例:排除标准
●不稳定的冠心病,可能需要经皮或外科手术
●恒定心脏起搏的要求(例如高度AV阻滞或心脏再同步)
●最近冠状动脉旁路移植术(3个月内)
●近期瓣膜手术(3个月内)
●近期心肌梗死(通过适当的ECG和生化分析记录)(3个月内)
2.1主要结果指标:ICD治疗在2年随访期内室性心律失常或死亡
3.示例3:对从示例1和2分析后包括的患者进行的研究
A)将受试者分为在吸收后状态下研究的两组(第一组是确定为心律失常高风险的患者;第二组是确定为心律失常风险低的患者)。
B)整个过程使用适当的无菌技术。
C)将皮肤ECG导联应用于标准位置并连接到适当的电生理记录仪(用于研究标准12导联ECG位置的Bard系统)。
D)选择适当的经静脉途径,并使用Seldinger技术插入6F静脉鞘。
E)将适当的电生理学导管,例如6F Josephon四极导管,插入穿过鞘。
F)使用荧光镜引导来操纵导管进入右心室心尖,这里获得稳定的位置。
G)优选经由舒张方法获得心室刺激阈值。
H)用设定得足够大于阈值的2ms持续时间的矩形脉冲来递送适当的起搏方案,以实现优选值为舒张阈值的3倍的可靠刺激。所使用的起搏方案对于研究中的每个患者是相同的。
I)以12位分辨率在1000Hz下对模拟数据进行数字化并记录,如图3和4所示。低通滤波器设定为50Hz,且高通滤波器设定为0.01Hz。
J)使用MATLAB 2009a语言中的定制写入分析程序进行数据分析。
K)为了一致性,从起搏尖峰的起点到T波的峰值进行QT测量,并且从T波的峰值到起搏尖峰的起点进行TQ测量。
L)通过根据前面的TQ绘制QT并通过根据S2耦合间隔绘制QT(参见图1a、1b、2a和2b)来确定QT/TQ恢复曲线图。
4.示例4:探索与心肌异质性和室性心律失常和死亡的预测相关的区域复极化不稳定性指数的前导研究。
4.1方法
4.1.1.通过筛查部门审核数据库,寻找已经在2005年1月1日至2009年7月31日之间进行程序化电刺激(PES)作为ICD植入的临床风险分层的一部分并在他们的6个月的PES内具有CMR扫描的、带IHD历史的患者,来识别受试者。这识别了43个患者。9个患者无法获得PES记录,并且排除4个以上的患者,因为只记录了6个ECG。在30个其PES数据可用的患者中,1个不能被分析,因为它们的驱动周期长度(DCL)在方案中途改变。然后,寻找这30个患者的CMR数据。由于门控困难(1)和屏气(2),3个患者未获得LGE图像,并且由于采集与梗死区域分析软件之间不兼容,无法分析4个患者。LGE CMR图像可用于23/30个患者。
4.2电生理研究
4.2.1.根据在研究持续时间内不改变的标准部门方案进行研究。研究在程序之前,镇静最小且抗心律失常药物停止4-5个半衰期的空腹受试者。6F Josephson四极导管首先经静脉前进到右心室心尖(RVA),然后到右心室流出道(RVOT)。使用LabSystem Pro(BARD,Lowell)在1kHz的采样速率下记录心电图,低通滤波器设定为50Hz,高通滤波器设定为0.01Hz。心室刺激测试遵循修改过的Wellens方案,在RVA处使用驱动周期长度(DCL)为600ms和400ms的两个8搏动传动系统,并且使用DCL为400ms的一个8搏动RVOT传动系统。如果在传动系统中看到突发性搏动,则减小DCL。每个传动系统使用最多3个额外刺激;额外刺激通常开始于500/360ms并且以20ms的步长减小。持续时间大于30秒或与血液动力学损害相关的单形性VT记录为阳性;否则该试验记录为阴性。S1S2耦合间隔是传动系统的最后一个搏动和第一额外刺激之间的周期,PES的这一部分用于导出R2I2。
4.3 R2I2的分析
4.3.1.心电图以16位数字分辨率输出,用于以MatLab(Math works,Natick)编写的定制软件中进行分析。自动分析QRS起始(QRSo)和T波峰(Tp)的定时,并手动验证所有数据点,资深的电生理研究员不理会CMR数据、PES结果和终点数据。由于在测量Te中已知的困难,选择Tp优先于T波(Te)的结束。
使用来自数据集的48个起搏ECG点的代表性样本评估术中和术间再现性(8名心脏病学专家意味着10.1年的心脏病学训练)。QRSo和Tp的测量的平均操作员间变异性为6.3ms(SD 16.3ms)与操作员间6.4ms(SD 16.7ms)。
4.3.2.根据预定规则对数据点进行检查:1.突发性搏动发生在传动系统的第6搏动之后(51/316传动系统被检查),2.点由于人工因素、基线漂移或不清楚的形态(256/3089点截尾)而不确定。对于每个SI S2耦合间隔,DI被取作从DCL的最后搏动上的Tp到S2QRSo的周期,如图5中详细所示,并且被称为TpQ间隔,注意到如以该方式所测量的负TpQ的可能性。将APD的皮肤代替视为从S2QRSo到S2Tp(QTp)的周期。在RVA执行的每个S2测量TpQ间隔和QTp;在可能的情况下,使用DCL 600ms传动系统,但是如果由于突发性搏动不存在或不可用,则选择替代的DCL。
4.3.3.图6示出了对于多种导联类型的TQ间隔和QT间隔的动态关系的代表图。研究的焦点是区域电异质性,并因此将ECG导联分为基于前壁(V1-4)、下壁(II、III、aVF)和侧壁(I、aVL、V5、V6)导联的区域。对于每个导联,QTp作为TpQ的函数绘制,然后将点按ECG区域和S1S2耦合间隔进行分组,并且对于每个导联,记录来自最佳拟合点的平方残差的平均值(图11)。然后将该数量表示为所有患者上的每个导联的平均值的比例,以考虑导联分布的差异。将最大区域值的平均值作为R2I2,并作为VA或死亡的标记进行研究。图7至10进一步示出了如何计算该分析,表3提供了对图7和10中所示的研究的最终分析,其中计算了结果的归一化值。
4.4.晚期钆增强的心脏磁共振成像方案
4.4.1.根据用于选择患者的回顾性标准,患者在其PES研究的63±63天内(根据PES研究之前,所有患者中仅一名患者进行CMR)按照部门方案进行LGE CMR。使用具有ECG触发和6通道相控阵心脏线圈的1.5-T扫描仪(Siemens Magnetom,Avanto)执行综合CMR成像。在侦察成像后,在4、3和2室视图中获取稳态自由进动(TrueFISP)电影图像,并且使用SSFP电影成像获得一系列短轴切片,其覆盖从基部到顶点的LV,每隔10mm具有1个切片。以大剂量在静脉内施用基于钆的造影剂(0.1-0.2mmol/kg),并且在约10分钟后使用反转恢复的分段梯度回波序列获得(LGE)图像。
4.5.CMR分析
4.5.1.使用市售软件对患者细节盲法离线进行所有分析。通过手动追踪心内膜和心外膜轮廓进行体积分析;计算左室舒张末体积(LVEDV)、收缩末体积(LVESV)、行程体积(SV)、LV射血分数(LVEF)和LV舒张末体积(LVM)。使用Schmidt等人技术的修改来针对瘢痕和PIZ质量分析LGE图像。所有信号强度大于峰值梗死核心50%的体素记录为瘢痕。PIZ定义为MI区域中的以下所有像素,其信号强度比正常心肌区域中的平均强度高>2标准偏差(SD),低于峰强度的50%(图12)。
CMR体积和质量被指数化为高度。瘢痕大小表示为LV质量的%,并且PIZ表示为质量(以克为单位),LV质量的%以及梗死大小的%。
4.6.统计分析
4.6.1.主要终点是VA或死亡的时间。参数数据表示为平均值±标准偏差(SD)并使用Student's t检验分析;非参数数据作为中值[四分位间距](IQR),并使用Mann-Whitney U检验分析;使用单侧Fisher精确检验分析比例。群体R2I2中值用于分离R2I2的“高风险”和“低风险”结果,并且与基于对数转换的累积VA/死亡的比较,对于R2I2>中值与R2I2<中值绘制Kaplan-Meier存活曲线。使用Pearson秩相关来寻找R2I2和PIZ之间的相关性。使用单个Cox比例风险模型来寻找R2I2>中值、PES结果、LVEF和QRS持续时间(QRSD)的独立性。p值<0.05被认为在统计学上是显著的。所有分析使用STATA(StataCorp LP,College Station)执行。
4.7.结果
4.7.1.30个患者的临床特征、R2I2和PIZ数据总结在表1中。29个患者的R2I2数据和CMR体积分析可用,23个患者的LGE CMR数据可用,22个患者的两者均可用。每个患者的R2I2max3和R2I2maxR数据可以在表2中找到。R2I2max3是基于TpQ和QTp分析的测量,并且计算为最大区域标准化均值的平均值。R2I2maxR是基于TpS和JTe的分析的测量,并且计算为最大归一化平均值。14个患者有阳性PES,其中13个有ICD植入,在研究随访期,没有阴性PES患者植入ICD。中位随访时间为725天(IQR 553天)。7个患者在随访期间达到了VA/死亡的主要终点,4VA和4个死亡(1个患者已成功进行了冠心病的ICD治疗,随后死亡)。将存活记录为第一终点的时间/跟踪结束。
4.7.2.当使用群体中位数R2I2max3值分析数据时,R2I2>中位数的患者比R2I2≤中位数的患者具有明显更高的VA/死亡率(6/14vs.1/15p=0.031)。2组的Kaplan-Meier存活曲线显示在图13中,其中群体显著分叉(p=0.017,对数秩检验)。如预期的,年龄和PES结果与疗效(outcome)显著相关,但与R2I2不相关。PIZ的程度示出与VA/死亡(13.59,IQR 8.51对7.51,IQR 8.39,p=0.093)的相关性和与R2I2的适度相关性(r=0.41p=0.057)的趋势,图14。对R2I2中位数、PES结果、LVEF和QRSD的Cox多变量分析表明,R2I2中位数是VA/死亡的独立预测因子(p=0.032)。与R2I2maxR分析相同的组的Kaplan-Meier存活曲线在图16中示出。
表1
表2
表3
4.8.讨论
4.8.1.这项试点调查表明,R2I2可能是在患有SCD风险的患者上有用的预后标记分层器。随后患有VA或死亡的缺血性心肌病患者,其R2I2高于没有事件的患者。风险的R2I2电气测量示出与心律失常底物的解剖学测量、PIZ的程度的中等强的相关性。在概念上,R2I2具有与QTp色散的表面相似性,因为它们都涉及QTp间隔持续时间内的导联间差异的测量。R2I2是在考虑到QTp色散的弱点的情况下开发的。首先,它是一种动态测量:由于S1S2耦合间隔缩短,因此恢复和解剖因素的复杂相互作用将影响QRS和T环,由此产生的ECG将部分地反映改变的QRS和T环的投影,但是这种效应可能与因复极化异质性而引起的变化分离。图15示出了在继续发展VA的患者中S1S2耦合间隔缩短时在复极化发展中的12个区域差异的示例。其次,R2I2基于区域QTp变化,并被设计为最小化由基线QTp色散的影响。第三,R2I2测量是从起搏的ECG进行的,并且T波峰已被用于最佳再现性。
缩写
5.PERG方法
研究群体和方案
这是一项前瞻性、单中心研究,在2010年1月至2012年3月期间纳入62例连续缺血性心肌病(ICM)患者。该研究是盲目的(blinded),因为在确定VA/SCD的终点之前,对所有受试者的电学数据进行分析。入选标准是18岁以上的、进行ICD植入或用程序化的电刺激进行SCD风险分层的患者。排除标准是:心脏再同步治疗的指征、自急性冠状动脉综合征/心脏手术起小于28天、怀孕、不能给予知情同意和对电生理学研究的禁忌症(例如血液动力学不稳定性)。伦理审批由德比郡研究伦理委员会(09/H0401/70)授予,并且研究方案由莱斯特大学医院国家卫生服务信托基金(UHL-10824)(英国莱斯特)的研究和开发办公室批准。所有患者给予书面知情同意。招募后,两名患者被排除:1名患者没有收集的电生理数据,因为他在征募后拒绝ICD植入(电生理数据通常在ICD植入期间获取),1名患者的电生理数据被破坏且不可分析。主要终点为室性心律失常/心脏性猝死(VA/SCD)。室性心律失常被认为是持续时间大于30秒的心室纤维性颤动或室性心动过速,或者通过ICD休克/抗心动过速起搏适当地终止。为了本研究的目的,ACC/AHA/ESC 2006对SCD的定义是:“意外循环停止导致的死亡,通常是由于心律失常在症状发作后一小时内发生”。(12)终点由三人独立委员会获得临床记录。8
电生理学研究
研究具有最小镇静的空腹受试者。电生理学研究(EPS)方案用程序化的电刺激在RV顶点通过6F四极导管(St Jude Medical,Minnesota,USA)或65cm 7F Durata ICD导联(St Jude Medical,Minnesota,USA)来进行。采用设定为50Hz的低通滤波器和设定为0.01Hz的高通滤波器,以1kHz采样率记录信号来记录标准12导联ECG。双极或单极刺激方案分别通过四极导管的近端两极或使用ICD导联的近端极递送。根据以下方案递送舒张阈值3倍的2ms持续时间的矩形脉冲。在600ms和400ms的驱动周期长度的10个搏动传动之后是在500/360ms的单个额外刺激,具有20ms到300ms和10ms到有效不应期的递减。如果在传动系统中看到突发性搏动,则驱动周期长度减小到500ms,并且额外刺激开始于460ms。S1-S2耦合间隔是传动系统的最后一个搏动与第一额外刺激之间的时段,R2I2从最后S1和S2搏动中获得的测量导出。使用修改的Wellens方案在右心室顶点处进行执行程序化电刺激(两个传动系统,驱动周期长度600ms和400ms,达到3个额外刺激)。(13)持续时间大于30秒或与血液动力学损害相关的单形室性心动过速记录为阳性;否则该试验记录为阴性。由于抗凝要求,有必要延迟7名患者的EPS;这些患者具有通过其ICD递送的如上详述的相同方案,其中双极起搏设定为接近编程者允许的舒张阈值的三倍。9
R2I2的分析
表面心电图以16位数字分辨率输出,用于由WBN编写的MATLAB版本R2009a(Mathworks,Natick,USA)中的定制软件中的分析,进一步通过Madeiro等人改进软件的工作(14)。自动分析QRS起始、T波峰(Tp)和T波结束(Te)的定时,并由WBN手动验证所有数据点。使用用于APD的ECG替代物(surrogate)(即QRS起始到T波峰(QTp)和DI(即T波峰到QRS起始(TpQ))来推导R2I2。公开的R2I2分析已经使用QTp/TpQ,并且这主要用作主要度量,其中进行对QRS起始到T波结束(QTe)/T波结束到QRS起始((TeQ)(QTe/TeQ)的附加评估,以查看这是否提供了等同或更好的分辨率(图17A并且见下文)。对于ECG的每个导联,APD替代物绘制为DI替代物的函数,并且如先前由Taggart等人所述使用40ms重叠的最小二乘线性段拟合梯度(图17B)(15)。在每个40ms分段中的ECG导联上计算梯度与平均梯度的差。将每个ECG导联内的这些值的标准偏差作为每个导联中APD异质性的度量。然后将其平均值作为R2I2(无单位)(11)。补充文件中示出了完全工作的R2I2计算的示例。根据预定规则对数据点进行检查:1.突发性搏动发生在传动系统的搏动8之后或与Tp/Te(73/859驱动链搏动被检查)的测量进行重复性心室反应搏动干扰,2.由于低振幅T波,低信噪比导致点不确定、基线漂移、伪像或不清楚的形态(340/9432点)。少量非生理上陡峭的梯度源自具有接近或相同的TpQ(测量到最接近的毫秒)的点。为了避免数据的偏移,删掉超过±10的梯度,删掉1.6%(198/12511)的梯度。对于在Tp和Te之间的比较的10的一致性,相同的数据集用于两个基准点:分析其中Tp和Te是可测量的ECG复合波。
使用来自数据集(856个QTp和TpQ间隔)的5名患者的代表性样品评估R2I2的观察者内和操作者间变异性,并由两个电生理学研究员(WBN和MIS)独立地进行。对于观察者内和观察者间方案(p<0.05),分类内相关系数分别为0.86和0.93。与操作者间平均值2.8ms(标准偏差6.1ms)相比,TpQ值的观察者内变异性是平均-1.2ms(标准偏差5.5ms);与操作者间平均-2.6ms(标准偏差6.7ms)相比,QTp值的观察者内变异性为平均-0.9ms(标准偏差6.0ms)。对于用于APD/DI的动作电位持续时间心电图替代物的心电图替代物的选择用在R 2I2计算中。到目前为止,由于在精确可重复标识上的已知挑战,R2I2研究有利于使用QTp/TpQ优于QTe/TeQ的更自然选择(16)。没有用于APD/DI的明确ECG替代物,虽然有矛盾的观点,但有强的理论基础来提出QTe间隔的TpTe部分反映复极化的色散(17,18)。可以说,QTe更能反映APD,并且因此可能改善R2I2。在R2I2计算中将QTe/TeQ替换为QTp/TpQ并没有区分VA/SCD终点,并且似乎不为标准R2I2提供额外的值。11
峰值心电图恢复梯度的计算
根据R2I2中使用的梯度,在12个ECG导联上计算每个S1-S2耦合间隔处的平均梯度,然后将峰值取作PERG。具有低和高R2I2以及低和高PERG的患者的示例QTp/TpQ图在图18中给出。在这些示例的每一个示例中,绘制12条线,每个连接用于一个ECG导联的QTp/TpQ点。这允许区分不同的ECG导联,并且在视觉上比包含所有梯度的图(在补充文件中给出梯度图的示例)更清楚。Tp的定时在12个ECG导联上变化,并且这导致不同ECG导联的TpQ和QTp偏移,这种效果在图18A和C中采用侧壁导联(特别是导联I)最好地看到。在具有低R2I2(图18C和D)的患者中,与其ECG导联遵循不协调的不稳定过程的高R2I2(图18A和B)的患者相比,ECG导联运行相对平行的进程。在具有高PERG的患者中(图18A和C),与具有更多水平ECG导联路径且具有更短TpQ间隔的QTp中几乎没有减少的低PERG患者(图18B和D)相比,梯度在更短的TpQ间隔陡峭。
样本大小和统计分析
通过两次样本t检验功效计算,使用用于不等方差的Satterthwaite近似和使用来自我们先前的回顾性研究的R2I2数据(R2I2在VA/死亡组中相比于无VA/死亡组(平均值±SD:1.30±0.25对1.03±0.27))来通知样本大小(11)。为了在5%显著水平达到80%的功效,示出该R2I2在达到VA/SCD终点的ICM患者中对无需达到终点的10个患者显著更高。对我们的ICD服务的审核发现,每年适当的ICD治疗率为15%。因此,为了在12-18个月期间实现足够的事件(>10个事件),确定约60个患者的样本大小。12
参数数据表示为平均值±SEM并使用Student's t检验分析;非参数数据作为中位数[四分位间距],并使用Mann-Whitney U检验进行分析。使用双侧Fisher精确检验分析群体。在研究队列中构建使用R2I2的受试者操作者特性曲线,并计算曲线下的面积。R2I2的回顾性研究以前发现,R2I2的临界值为1.03提供了终点与未达到终点的最佳区分(11)。选择1.21的最佳峰值ECG恢复梯度(PERG)截止值将患者分为“高”和“低”风险组。对于由该R2I2截止划分的患者亚组和由R2I2和PERG截止的组合划分的患者亚组绘制Kaplan-Meier存活曲线;累积端点的比较基于对数变换。存活率记录为第一终点的时间或随访结束。分段泊松模型用于评估R2I2≥1.03/PERG≥1.21的发生率比(IRR,等效危险比),并且从程序化电刺激结果、左心室射血分数和QRS持续时间评估R2I2≥1.03/PERG≥1.21的独立性。分段泊松模型也用于比较和评估PERG≥1.21下的标准R2I2≥1.03的独立性。分段泊松模型是广义线性模型,并且等价于Cox比例风险模型,但允许控制由于不成比例的危险引起的时间相关效应。在整个时间帧上进行分析,在9个月时分割数据,然后使用逆方差作为权重对每个时间段的估计值进行平均。对于使用QTe/TeQ的R2I2,中位值用于将患者分为“高”和“低”风险组。Pearson秩相关用于查找参数数据之间的相关性,并且Spearman秩相关用于非参数数据。使用用于绝对一致性的类内相关系数来计算R2I2的观察者内13和观察员间一致性。p值<0.05被认为是统计学上显著的。所有分析使用STATA版本11(StataCorp LP,College Station,USA)执行。
结果
区域恢复不稳定性指数
中位随访时间为22个月(3-34个月),在该期间16个患者达到VA/SCD的终点,15个具有VA,2个具有SCD(1个患者有VA和SCD)。其他死亡,不计为终点,原因是:1个破裂的主动脉瘤,1个心力衰竭和1个室性心动过速暴发(计为VA,该患者在入院前具有VA)。ICD拟合在51/60患者中;在没有拟合ICD的患者中没有达到终点。
基于主要终点分割的患者特征显示在表1中。达到终点的患者更可能具有二级预防ICD指示(p=0.04),但是具有与未达到终点的患者类似的临床特征。达到VA/SCD(16/60)终点的患者比没有达到的患者具有显著更高的平均值R2I2(1.11±0.09与0.84±0.04,p=0.003)。基于1.03的预定义R2I2值和构建的Kaplan Meier曲线将患者分成“高风险”和“低风险”组(图19A)。R2I2≥1.03的患者具有VA/SCD比具有R2I2<1.03(p<0.0001)的患者显著更高的比率。接收器操作特征分析发现,R2I2显著区分经历VA/SCD的那些和随访期间没有的那些(0.770的曲线下面积,图19B)。R2I2的分段泊松模型发现,具有R2I2≥1.03的患者的VA/SCD发生率比率是具有R2I2<1.03(p=0.004)的患者的7.5倍。包括R2I2、程序化电刺激结果、左心室射血分数和QRS持续时间的第二个分段泊松模型表明,R2I2≥1.03是VA/SCD的独立预测因子,其中发生率比率为6.5(p=0.008)。R2I2的截止值为1.03给出灵敏度为63%,特异度为82%,阳性预测值为56%,阴性预测值为86%。
峰值心电图恢复梯度(PERG-也可以称为PERS;峰值心电图恢复斜率)
峰值ECG恢复梯度在经历VA/SCD的患者中显著高于没有经历的患者(1.35[0.60]对1.08[0.52],p=0.014)。PERG的分段泊松模型发现,具有PERG>1.21的患者的VA/SCD发生率比率是具有PERG<1.21(p=0.017)的患者的4.1倍。包括PERG、程序电刺激结果、左心室射血分数和QRS持续时间的第二个分段泊松模型表明,PERG≥1.21是VA/SCD的独立预测因子,其中发生率比率为4.9(p=0.006)。
Spearman秩相关分析发现峰值ECG恢复梯度和R2I2之间的最小正相关(r=0.290,p=0.025,图20)。包括R2I2≥1.03和PERG≥1.21的分段泊松模型表明,R2I2≥1.03(IRR5.8,p=0.001)和PERG≥1.21(IRR 3.7,p=0.027)是VA/SCD的独立预测因子。构建了由R2I2≥1.03和PERG≥1.21划分的患者的Kaplan Meier曲线,并且示出显著的分离(p<0.0001,图21)。分段泊松模型发现,R2I2≥1.03和PERG≥1.21的患者的VA/SCD发生率比率为R2I2<1.03和PERG<1.21的患者的21.6倍(p<0.0001)。组合R2I2≥1.03和PERG≥1.21给出灵敏度50%,特异性95%,阳性预测值80%,阴性预测值84%。15
讨论
这项盲法研究成功地复制了R2I2的回顾性研究的结果,该研究使用了为R2I2分析和相同终点开发的相同技术(11)。具有高R2I2值患者的VA/SCD的相对风险是低风险R2I2的6.5倍。PERG也被发现在经历VA/SCD的患者中比在那些没有的患者中显著更陡峭;在PERG≥1.21的患者中VA/SCD的相对风险是PERG<1.21患者的4.9倍。重要的是,R2I2和PERG二者独立于程序化电刺激结果、左心室射血分数和QRS持续时间,表明他们可以向VA/SCD风险的现有标记添加值。此外,在组合模型中,对于R2I2(IRR5.8)和PERG(IRR3.7)二者,保留了与VA/SCD的强关联。在R2I2≥1.03和PERG≥1.21阳性的患者中,VA/SCD的相对风险是两者阴性的患者的21.6倍。在R2I2≥1.03和PERG≥1.21的患者中,VA/SCD的阳性预测值为80%,特异性为95%。
R2I2和PERG的优点在于它们识别非常高风险的组,甚至在ICM患者中,在其中ICD是目前由指南推荐的。使用先前确定的1.03的R2I2截止值,在18个月时高于该阈值的VA/SCD的比率为63%;对于具有R2I2≥1.03和PERG≥1.21的17个患者,18个月时VA/SCD的发生率为82%。这大大高于招募到MADIT II和SCD-heft试验的患者,其具有每年低于10%的适当ICD治疗率的(25)。具有高R2I2和/或PERG的个体因此代表在那些接收ICD的组中特别但实质性的组,其中进一步的研究应集中于尝试和减少风险。此外,这些发现提高了R2I2和PERG在应用于风险较低的群体(例如LVEF超过35%)(对于他们,风险分层目前非常有限)的临床效用方面可能保留足够的阳性预测价值的可能性(26)。这需要进一步评估。
结论
R2I2和PERG是ICM患者VA/SCD风险的独立生物标记。在组合中,在该研究中,它们提供了80%的阳性预测值和95%的特异性。
- 还没有人留言评论。精彩留言会获得点赞!