基于组织激活体积针对电刺激治疗进行治疗程序选择的制作方法
本公开涉及电刺激治疗。
背景技术:
可植入医疗设备(如电刺激器或治疗剂递送设备)已经被提出用于不同的治疗应用中,如脑深部刺激(DBS)、脊髓刺激(SCS)、骨盆刺激、胃刺激、外周神经刺激、功能性电刺激或将治疗剂、胰岛素、止痛剂或消炎剂递送至患者内的目标组织位点。在一些治疗系统中,可植入电刺激器借助于一个或多个电极将电治疗递送至患者体内的目标组织位点,所述电极可以由医疗引线部署、在电刺激器的外壳上,或者两者。
在可能发生在医疗设备植入期间的编程会话期间、在试验会话期间、或者在医疗设备被植入患者体内之后的诊所内或远程随访会话期间,临床医生可以生成向患者提供有效治疗的一个或多个治疗程序(也被称为治疗参数集合),其中,每个治疗程序可以定义治疗参数集合的值。医疗设备可以根据所存储的一个或多个治疗程序将治疗递送至患者。在电刺激的情况下,治疗参数可以定义有待递送的电刺激波形的特性。例如,在以电脉冲的形式递送电刺激的示例中,治疗参数可以包括电极组合、振幅(其可以是电流或电压振幅)、脉冲宽度以及脉冲速率。
技术实现要素:
总体上,本公开涉及用于基于预期由根据治疗程序递送的电刺激激活的组织体积来确定特定治疗程序的治疗疗效的设备、系统和方法。预期由电刺激激活的组织体积还可以被称为组织激活体积(“VTA”)。在一些示例中,治疗疗效由基于VTA确定的分数指示,所述VTA基于治疗程序和疗效图生成。可以基于特定于患者(正对所述患者的治疗程序进行评估)的数据生成疗效图,或者可以基于来自多个患者的信息生成疗效图。
在一些示例中,疗效图是包括表示组织体积的多个体素的三维(3D)网格。可以为体素中的一些或所有体素指定值。在一些示例中,为体素指定的值与临床评级量表相关联。例如,可以基于对接收电刺激治疗的多个患者的回顾性研究以及针对患者的指示根据治疗程序的电刺激治疗的效果的临床评级量表分数来确定所述值。为特定体素指定的值可以基于针对接收对该体素进行激活的刺激治疗的每个患者的临床评级分数的组合。在一些示例中,临床评级量表可以是用于在存在或不存在电刺激治疗的情况下评估患者病情的临床评级量表。在一些示例中,可以基于患者病情或症状从多个疗效图中选择疗效图。疗效图中的每个疗效图将电刺激对不同患者病情或症状的影响量化。
在一些示例中,医疗系统的处理器可以基于治疗程序生成VTA,向疗效图登记VTA,并且基于为疗效图的与VTA重叠的体素指定的值来确定治疗程序的疗效分数。例如,疗效分数可以是所述值之和。处理器可以基于以此方式确定的疗效分数来选择一个或多个治疗程序。
在一个示例中,本公开涉及一种方法,包括:由处理器基于治疗程序生成组织激活体积(VTA);基于患者病情或患者症状从所存储的多个疗效图中选择疗效图;以及基于所述所选疗效图确定所述治疗程序的疗效分数。
在另一个示例中,本公开涉及一种系统,包括:存储器,所述存储器被配置成存储多个疗效图;以及处理器,所述处理器被配置成:基于治疗程序生成组织激活体积(VTA);基于患者病情或患者症状选择所述多个疗效图之一;以及基于所述所选疗效图确定所述治疗程序的疗效分数。
在另一个示例中,本公开涉及一种方法,包括:由处理器生成针对多个治疗程序的多个组织激活体积(VTA);控制医疗设备以根据所述治疗程序中的每个治疗程序向患者递送电刺激;针对所述治疗程序中的每个治疗程序接收所述患者的临床评级量表分数;将每个临床评级量表分数与疗效图的被引起所述临床评级量表分数的所述治疗程序相对应的所述VTA重叠的每个体素相关联;以及基于所述相关联的临床评级量表分数确定所述疗效图的所述多个体素的值。
在另一个示例中,本公开涉及一种系统,包括:医疗设备,所述医疗设备被配置成根据多个治疗程序中的每个治疗程序向患者递送刺激;用户界面,所述用户界面被配置成针对所述多个治疗程序中的每个治疗程序接收所述患者的临床评级量表分数;以及处理器,所述处理器被配置成:针对所述多个治疗程序中的每个治疗程序生成多个组织激活体积(VTA);将每个临床评级量表分数与疗效图的被引起所述临床评级量表分数的所述治疗程序相对应的所述VTA重叠的每个体素相关联;以及基于所述相关联的临床评级量表分数确定所述疗效图的所述多个体素的值。
以下附图和说明中阐述了一个或多个示例的细节。根据本说明书和附图以及根据权利要求书,其他特征、目的和优点将显而易见。
附图说明
图1是概念图,展示了被配置成向患者大脑内的组织位点递送电刺激治疗的示例脑深部刺激(DBS)系统。
图2是功能框图,展示了示例医疗设备的部件。
图3是功能框图,展示了示例医疗设备编程器的部件。
图4是流程图,展示了生成VTA的示例方法。
图5是流程图,展示了生成VTA的疗效分数的示例方法。
图6是流程图,展示了生成临床评级量表疗效图的示例方法。
图7是流程图,展示了确定治疗程序的估计的临床评级量表分数的示例方法。
图8是流程图,展示了用于基于疗效分数调整基于解剖结构的分数的示例技术。
图9是流程图,展示了使用目标VTA基于疗效图确定疗效分数的示例技术。
具体实施方式
本公开描述了用于基于预期由经由治疗程序递送的电刺激激活(“VTA”)的组织体积来量化特定治疗程序的治疗疗效的示例设备、系统和方法。对治疗疗效的量化可以用于确定可以向患者提供有效DBS的一个或多个治疗程序。治疗程序可以限定例如一个或多个电刺激参数(例如,频率、电流或电压振幅、和电刺激脉冲的情况下的脉冲宽度)的值、电极组合(选择用于递送电刺激的一个或多个电极、和对应极性)、或一个或多个电刺激参数值和电极组合两者。在一些示例中,当电刺激引起动作电位沿着组织的神经元传播时可以“激活”组织,这可以指示神经元的跨膜电位达到了特定的水平,比如,大于0毫伏(mV)的电位。可以使用建模算法确定针对特定治疗程序(本文中还被称为“电刺激参数值集合”)的VTA,所述建模算法基于患者的靠近所述一个或多个电极的组织的特性。以此方式,可以估计VTA。
在一些示例中,通过基于VTA和疗效图确定的疗效分数来量化特定治疗程序的治疗疗效。可以基于特定于患者(正对所述患者的治疗程序进行评估)的数据生成疗效图,或者可以基于来自多个患者的信息生成疗效图。在一些示例中,可以基于患者病情、一个或多个患者症状、或患者病情和至少一个症状两者来从所存储的多个疗效图中选择(例如,由设备的处理器)疗效图。疗效图可以表示例如已知在激活时提供有效结果(例如,特定的期望功能)的组织体积(例如,在患者的大脑内)、已知在激活时提供不良反应的组织体积、或者具有混合有效和不良结果的体积组织。
在一些示例中,疗效图是包括多个体素的3D网格,所述多个体素中的每个体素表示离散组织体积。可以向体素中的一些或所有体素指定值。在一些示例中,向体素指定的值可以基于体素所表示的解剖区域的功能。例如,可以向表示患者的区域中与相对高治疗疗效相关联的组织(当被激活时)的体素指定相对高值,而向表示区域中与相对低治疗效果或不良反应相关联的组织的体素指定相对低值或甚至负值。
在一些示例中,疗效图可以提供VTA分数与临床医生可能熟悉的临床评级量表之间的关系。例如,临床评级量表可以是例如统一帕金森病评级量表(UPDRS)、耶鲁-布朗强迫量表(YBOCS)、汉密顿抑郁评级量表(HDRS)或伯克-法恩马斯登肌张力障碍评级量表(BFMDRS)。适合于确定一个或多个治疗程序的治疗疗效的评级量表可以基于经由电刺激治疗来治疗的患者病情和/或患者症状。例如,当针对帕金森病的症状而正对患者进行治疗时,可以使用UPDRS;当针对强迫症(OCD)而正对患者进行治疗时,可以使用YBOCS;当针对抑郁而正对患者进行治疗时,可以使用HDRS;并且当针对肌张力障碍而正对患者进行治疗时,可以使用BFMDRS。
在一些示例中,处理器基于临床评级量表确定向疗效图的体素指定的值。例如,可以基于对接收刺激治疗的多个患者的回顾性研究来确定所述值。在所述研究期间,可以收集所述多个患者的信息,所述信息包括治疗程序和与治疗程序的治疗效果相关联的临床评级量表分数。处理器可以接收临床评级量表分数并将临床评级分数与疗效图的一个或多个体素相关联,基于对应治疗程序(与临床评级分数相关联的治疗程序)确定的VTA与所述一个或多个体素重叠。在一些示例中,向特定体素指定的值可以基于与特定体素相关联的临床评级分数。例如,所述值可以是临床评级量表分数的平均值、相关联的临床评级量表分数的最高值、相关联的临床评级量表分数的最低值、相关联的临床评级量表分数的中间值、或者基于使用相关联的临床评级量表分数的任何其他算法的值。
在其他示例中,可以基于单个患者确定每个体素的值。例如,可以根据多个治疗程序向患者施加电刺激。对于每个治疗程序,临床医生可以确定表征治疗程序的治疗效果的临床评级量表分数,并且处理器可以将所述分数与疗效图的每个体素相关联,由治疗程序产生的VTA与所述体素重叠。
在一些示例中,处理器可以被编程成用于将连续治疗程序之间的临床评级量表分数变化与疗效图的体素相关联,与当前治疗程序相关联的VTA最近与所述体素重叠或者不再与所述体素重叠。这可能导致与疗效图内的特定体素的附加功能值更加准确地对应的疗效图。例如,处理器可以确定之前VTA与疗效图之间的重叠以及当前VTA与疗效图的重叠的变化。处理器可以向与所述变化相关联的每个体素指定临床评级量表分数。在一些示例中,可以向疗效图的最近与当前VTA重叠的每个体素指定临床评级分数。在一些示例中,处理器可以确定关联于之前VTA的临床评级量表分数与关联于当前VTA的临床评级量表分数之间的变化量。将临床评级量表分数的变化量可以与疗效图内的当前VTA与之前VTA之间不同的每个体素相关联。在一些示例中,如果当前VTA的临床评级量表分数相对于之前VTA增大,则疗效图的最近与VTA重叠的每个体素与或者新临床评级量表分数或者临床评级量表分数的正变化量相关联。如果之前VTA与疗效图的不再与当前VTA重叠的体素重叠,则那些体素可以与对应于临床评级量表分数的变化量的负值相关联。在一些示例中,不再与VTA重叠的体素可以与之前的临床评级量表分数相关联。如果临床评级量表分数已经减小,则疗效图的最近与VTA重叠的每个体素可以与新的临床评级量表分数或临床评级量表分数的负变化量相关联。如果之前VTA与疗效图的不再与当前VTA重叠的体素重叠,则那些体素可以与对应于临床评级量表分数的变化量的正值相关联。在一些示例中,向特定体素指定的最终值可以基于已经与特定体素相关联的多个VTA的评级分数的组合。例如,所述组合可以是临床评级量表分数的平均值、高值、低值、中间值或均值。
在一些示例中,可以将特定临床评级量表分数与患者的解剖区域组合以便创建临床评级量表疗效图(CRSEM),在所述CRSEM中,基于与体素相关联的一个或多个临床评级量表分数和向特定体素登记的解剖区域来确定体素值。疗效图可以是基于解剖区域的功能向解剖区域内的各种体素指定值的结果。如以上所讨论的,在一些示例中,多个治疗程序中的每个治疗程序的临床评级量表分数可以用于描述大脑内与特定体素相关联的兴趣解剖区域(当被激活时)的临床效益或功能。例如,与特定体素相关联的值描述了临床效益。在一些示例中,特定体素的临床效益可以是来自治疗程序的平均临床评级量表分数、治疗程序的最大临床评级量表分数、治疗程序的最低临床评级量表分数、或治疗程序的临床分数的中间值。
在一些示例中,CRSEM可以包括可以用于生成治疗程序的估计的临床评级量表分数的信息,以及涉及特定症状或功能的一个或多个子分数。例如,与UPDRS相关联的CRSEM还可以包括涉及言语、运动和震颤控制的子分数。在一些示例中,子分数可以采取与特定体素相关联的生活质量点的形式。特定体素的生活质量点可以将该体素对特定功能的估计的UPDRS贡献了多少量化。例如,与大脑的关联于言语的部分重叠的CRSEM区域可以具有生活质量点或者另一种类型的子分数,涉及将对关于言语的该区域的激活的效果量化。
在其他示例中,可以从大量患者中回顾性地创建CRSEM。例如,可以收集与关联于特定治疗程序的临床评级量表分数相关的信息、连同关联于由根据特定治疗程序进行的治疗刺激产生的临床评级量表分数而激活的大脑区域。可以基于所收集的信息生成CRSEM。此外,可以通过添加新的患者结果来增量地更新和改进CRSEM。这可以允许用于基于CRSEM生成分数的算法智能地适应所述分数。在一些示例中,CRSEM数据可以处于数据库中,所述数据库允许临床医生或研究人员基于大患者人群确定大脑的疗效区域和副作用。这可以允许临床医生或研究人员确定可以如何基于患者的特定疾病状态调整电刺激治疗。这可以允许基于特定患者最有兴趣减轻的症状来选择各种治疗程序。
在一些示例中,在将医疗设备编程成用于创建患者特定CRSEM期间,由先前的患者数据创建的CRSEM被用作基线。例如,编程器可以使用基线CRSEM来基于来自CRSEM的估计的临床分数选择治疗程序的子集。在编程期间,临床医生可以确定针对患者的患者特定的临床评级量表分数以便量化基于基线CRSEM选择的治疗程序的治疗效果。临床医生可以将估计的临床评级量表分数输入到编程器中。编程器可以基于患者特定的临床评级分数更新与CRSEM的每个体素相关联的分数。编程器或临床医生可以基于患者特定的CRSEM做出对治疗程序的编程选择。
在一些示例中,处理器可以使用基于先前的患者数据的CRSEM来生成目标VTA。目标VTA可以表示与相对高疗效分数相对应的VTA。在一些示例中,可以基于将除了将高疗效分数以外的如电池耗竭等考虑因素考虑在内的算法来生成目标VTA。在一些示例中,目标VTA可以是与基于疗效图的最高可实现疗效分数相对应的VTA。在编程期间,实施算法的处理器可以生成多个治疗程序的VTA,并且基于所生成的VTA与目标VTA的比较来确定分数。可以选择所述多个治疗程序用于提供可能的刺激参数值的范围内的覆盖。所述分数可以基于目标VTA与所生成的VTA之间的重叠的量。在一些示例中,评分函数可以从基线开始增大与目标VTA重叠的所生成的VTA体素的分数并且减小与目标VTA不重叠的所生成的VTA的那些体素的分数。
在一些示例中,所述分数还可能受所生成的VTA与大脑图谱之间的重叠的影响。例如,如果已知目标VTA内的某些区域对患者的临床评级量表分数或者电刺激治疗的整体治疗结果具有更大的正面影响,则体素与该区域的重叠在所生成的VTA的最终分数中可能具有更重的权重。相反,如果已知大脑内的特定区域对临床分数或整体患者结果具有极其负面的影响,则疗效图的区域可能对基于疗效图生成的分数具有负面影响。在一些示例中,与相对最高分数相关联的多个治疗程序可以用于向患者递送有效电刺激治疗或者用于对患者进行进一步测试。
例如,对于多个电极组合中的每个刺激电极组合,导致最高疗效分数的刺激参数值可以存储在患者编程器中。在一些示例中,这可以允许患者根据需要在高评分治疗程序之间切换。例如,对于患有帕金森病的患者,一个电极组合可以在与针对言语的更多疗效结果相关联的大脑区域中提供电刺激。切换到由负责言语的大脑部分附近的一组电极递送的最高评分程序可以允许患者的更大言语功能。例如,当患者打算行走时,可由患者选择单独的电极组合和相应治疗程序。在其他示例中,可以基于哪些治疗程序为每个期望功能提供相对最高结果来选择高评分治疗程序。例如,编程器可以显示将言语功能最大化的治疗程序、将运动最大化的治疗程序、以及将震颤最小化的治疗程序,并且患者可以与编程器交互以便选择治疗程序之一。响应于接收选择治疗程序之一的输入,编程器可以控制医疗设备以根据所选治疗程序向患者递送治疗。
在一些示例中,可以创建针对特定疾病、疾病症状或期望功能的疗效图。疗效图可以包括与特定疾病、症状或功能的电刺激治疗的正面或负面影响相关联的每个组织区域(例如,具体地,大脑的解剖结构)。在一些示例中,疗效图内的每个区域可以基于所述区域对期望结果贡献了多少而具有不同的权重。
在一些示例中,基于由治疗程序产生的VTA与疗效图的比较来生成治疗程序的疗效分数。在一些示例中,处理器生成多个治疗程序的疗效分数以便确定可以提供最有效刺激(在所述多个被测治疗程序内)的治疗程序的子集(例如,特定电极组合)。在一些示例中,最有效刺激被定义为提供具有相对最小的副作用的最大治疗效益。在一些示例中,基于疗效图的疗效分数可以将与患者解剖区域重叠的VTA以及重叠的解剖区域的功能两者考虑在内。例如,与体素相关联的值可以结合归属于解剖区域的部分和归属于该区域的功能的部分两者。在一些示例中,与体素相关联的值根据期望结果而变化。例如,如果期望的功能刺激结果正将震颤最小化,则体素的值可以是一个数,而如果期望的功能结果正将运动最大化,则体素的值可以是另一个数。在一些示例中,所述值的与解剖区域相关联的部分可以保持不变,而所述值的与功能相关联的部分可能变化。
在一些示例中,编程器将针对大脑的所生成的VTA与疗效图进行比较以便确定用于生成VTA的治疗程序的分数。例如,可以在逐体素的层面上将VTA与疗效图进行比较。在一些示例中,不同组织区域中由疗效图表示的体素可以具有不同的单独值。例如,对于期望区域,每个重叠体素可以将治疗程序的整体疗效分数加“一”,而对于非期望区域,每个重叠体素可以将治疗程序的整体疗效分数减“一”。在一些示例中,一些期望区域可能比其他区域具有更重的权重。例如,在与正面结果相关联的某些组织区域(当被激活时)中,疗效网格的与所述区域相对应的并且与VTA重叠的每个体素可以将整体分数加“2”或“3”。类似地,当VTA与疗效图的与发现对整体患者状态具有特别负面影响的组织区域(当被激活时)相对应的体素重叠时,这种体素可能导致整体疗效分数的更大量的减小。在一些示例中,可以基于患者反馈调整特定体素的值。在一些示例中,可以向临床医生显示治疗程序的疗效分数和治疗程序的估计的临床评级量表分数两者。
使用本文中所公开的设备、系统和技术来量化治疗疗效可以帮助提高针对脑深部刺激(DBS)的术后设备编程的准确性和效率。例如,使用本文中所公开的技术来确定的疗效分数可以用于确定在使副作用最小化的同时向患者提供有效治疗的一个或多个治疗程序。
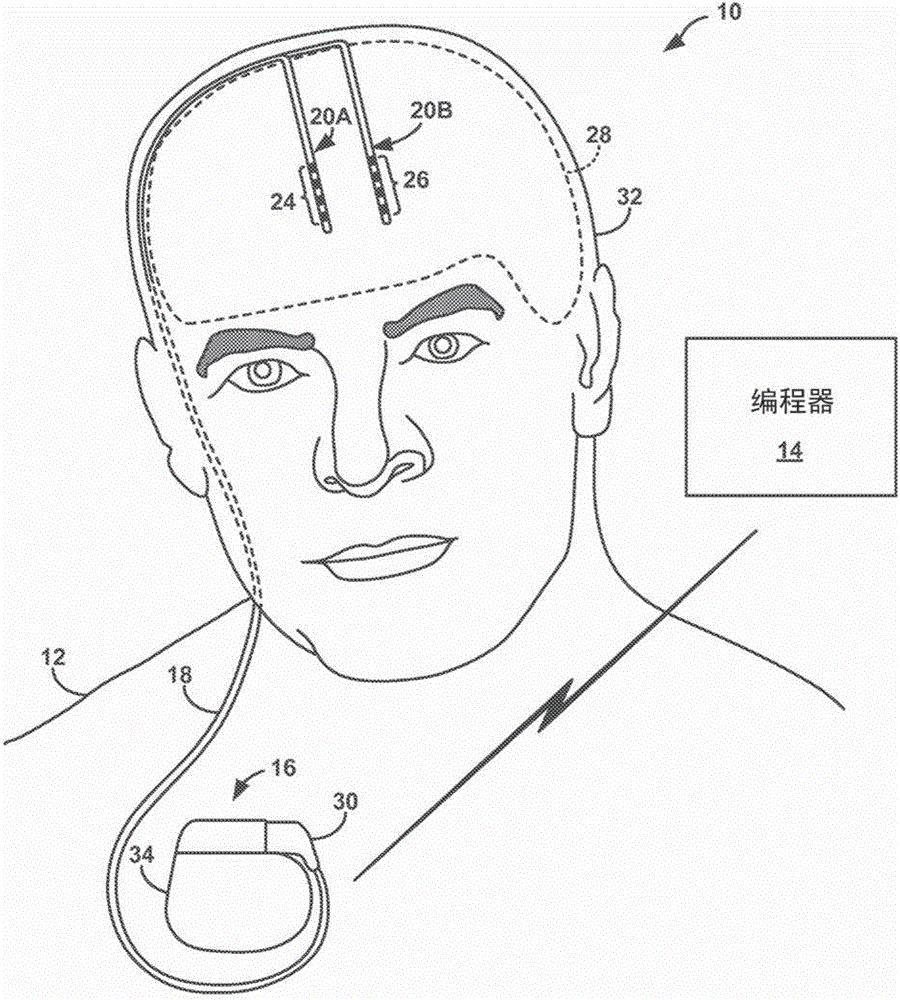
图1是概念图,展示了被配置成向患者12递送治疗以便管理患者12的障碍的示例治疗系统10。患者12通常将是人类患者。然而,在一些情况中,治疗系统10可以应用于其他哺乳类或非哺乳类非人类患者。在图1中所示出的示例中,治疗系统10包括医疗设备编程器14、可植入医疗设备(IMD)16、引线延伸段18以及具有对应多组电极24、26的一根或多根引线20A和20B(统称为“引线20”)。IMD 16包括刺激发生器,所述刺激发生器被配置成生成电刺激治疗并分别经由引线20A和20B的一个或多个电极24、26将电刺激治疗递送至患者12的大脑28的一个或多个区域。
在图1中所示出的示例中,治疗系统10可以被称为脑深部刺激(DBS)系统,因为IMD 16被配置成将电刺激治疗直接递送至大脑28内的组织,例如,在大脑28的硬脑膜下的组织位点或者一个或多个分支或节点、或者纤维轨迹的交汇点。在其他示例中,引线20可以被定位成用于将治疗递送至大脑28的表面(例如,大脑28的皮质表面)。例如,在一些示例中,IMD 16可以例如通过将电刺激递送至在大脑28皮质中的一个或多个组织位点而将皮质刺激治疗提供给患者12。作为另一个示例,IMD 16可以通过将电刺激递送至一个或多个迷走神经组织位点而向患者12提供迷走神经刺激(VNS)治疗。
DBS可以用于治疗或管理患者12的各种患者病情,比如,但不限于,痉挛疾病(例如,癫痫)、疼痛、偏头痛、精神疾病(例如,重度抑郁症(MDD))、躁郁症、焦虑症、创伤后压力心理障碍症、轻郁症、强迫症(OCD)、行为障碍、情绪障碍、记忆障碍、心理状态障碍、移动障碍(例如,特发性震颤或帕金森氏病)、亨廷顿病、阿尔茨海默症或其他神经学或精神科疾病和损害。
被配置成用于通过将治疗递送至大脑28或者患者12体内的另一个合适的目标治疗递送位点来治疗其他患者病情的治疗系统还可以根据所述技术用于确定如本文中所公开的一个或多个疗效图。例如,在治疗系统10的其他应用中,患者12体内的目标治疗递送位点可以是靠近患者12体内的脊髓或骶神经(例如,S2、S3或S4骶神经)或者患者12体内的任何其他合适的神经、器官、肌肉或肌群的位置,所述位置可以例如是基于患者病情选择的。例如,治疗系统10可以用于将电刺激或治疗剂递送至靠近神经系统的阴部神经、会阴神经或其他区域的组织,在这种情况下,引线20将被植入或基本上固定靠近于对应的神经。作为进一步示例,电刺激系统可以被定位成用于递送刺激从而帮助管理周围神经病或术后疼痛缓解、髂腹股沟神经刺激、肋间神经刺激、用于治疗胃流动障碍和肥胖的胃刺激、肌肉刺激,从而缓解其他周围和局部化疼痛(例如,腿疼或背疼)。
在图1所示的示例中,IMD 16可以被植入在患者12的胸肌区中的皮下袋(Subcutaneous Pocket)内。在其他示例中,IMD 16可以被植入患者12的其他区域内,如在患者12的腹部或臀部中或者靠近患者12的颅骨的皮下袋。植入的引线延伸段18经由连接器块30(也被称为连接头)耦合至IMD 16,所述连接器块可以包括例如电耦合至引线延伸段18上对应的电触头的电触头。电触头将由引线20承载的电极24、26电耦合至IMD 16。引线延伸段18从IMD 16在患者12的胸腔内的植入位点沿着患者12的颈部并穿过患者12的颅骨行进以进入大脑28。IMD 16可以由来自体液的抗腐蚀和降解的生物相容性材料构造。IMD 16可以包括用于基本上封闭部件(比如,处理器、治疗模块和存储器)的气密外壳34。
在图1中所示出的示例中,引线20分别被植入大脑28的右半脑和左半脑内以便将电刺激递送至大脑28的一个或多个区域,所述区域可以是基于许多因素选择的,比如,治疗系统10被实施成用于对其进行管理的患者病情的类型。设想了针对引线20和IMD 16的其他植入位点。例如,IMD 16可以被植入在颅骨32之上或之内,或者引线20可以在多个目标组织位点处被植入同一半脑,或者IMD 16可以耦合至被植入大脑28的一个或两个半脑中的单根引线。
引线20可以被定位以将电刺激递送至大脑28内的一个或多个目标组织位点从而管理与患者12的疾病相关联的患者症状。引线20可以被植入以经由任何合适的技术将电极24、26定位在大脑28的期望位置处,比如,通过患者12的头骨中对应的颅骨钻孔或者通过颅骨32中常见的颅骨钻孔。引线20可以被放置在大脑28内的任何位置处,从而使得电极24、26能够在治疗过程中将电刺激提供至大脑28内的目标治疗递送位点。不同的神经或精神疾病可以与大脑28的一个或多个区域的活性相关联,所述疾病在患者之间有所差异。因此,由以引线20递送的电刺激治疗的目标治疗递送位点可以是基于患者病情选择的。例如,在大脑28内用于控制患者12的移动障碍的合适的目标治疗递送位点可以包括以下各项中的一项或多项:脚桥核(PPN)、丘脑、基底核结构(例如,苍白球、黑质或底丘脑核)、未定带、纤维束、豆核束(及其分支)、豆状核袢或Forel区(Field of Forel)(丘脑束)。PPN还可以被称为脑桥脚被盖核。
作为另一个示例,在MDD、躁郁症、OCD或其他焦虑疾病的情况下,引线20可以被植入以将电刺激递送至大脑28的内囊前肢、以及仅内囊前肢的腹侧部分(也被称为VC/VS)、扣带皮层的膝下部分(其可以被称为CG25)、前扣带皮层布罗德曼区32和34、前额皮质的各部位(包括背外侧和内侧前额叶皮质(PFC)(例如,布罗德曼区9)、腹正中前额皮质(例如,布罗德曼区10)、外侧和内侧眶额皮层(例如,布罗德曼区11))、内侧或伏隔核、丘脑、丘脑髓板内核、杏仁核、海马体、外侧下丘脑、蓝斑核、中缝背核、中脑腹侧被盖区、黑质、丘脑底核、丘脑下脚、丘脑的背内侧核、松果体缰、终纹的床核、或其任意组合。
作为另一个示例,在惊厥症或阿尔茨海默病的情况中,例如,引线20可以被植入以将电刺激递送至在巴贝兹回路(Papez Circuit)内的区域,如,例如,丘脑前核、内囊、扣带回、穹窿、乳头体、乳头丘脑束(乳头体丘脑纤维束)或海马体中的一者或多者。还设想了并不位于患者12的大脑28中的目标治疗递送位点。
尽管引线20在图1中被示出为被耦合至公共引线延伸段18,但是在其他示例中,引线20可以经由单独的引线延伸段耦合至IMD 16或者直接耦合至IMD 16。此外,尽管图1将系统10展示为包括经由引线延伸段18耦合至IMD 16的两根引线20A和20B,但是在一些示例中,系统10可以包括一根引线或多于两根引线。
在图1中所示的示例中,引线20的电极24、26被示出为环形电极。环形电极可以相对易于编程并且可能能够将电场递送至与引线20相邻的任何组织。在其他示例中,引线20的电极24、26可以具有不同的配置。例如,引线20的电极24、26中的一者或多者可以具有复杂的电极阵列几何结构,所述几何结构能够产生某种形状的电场,包括交叉刺激。复杂电极阵列几何结构的示例可以包括定位在沿着引线的长度的不同轴向位置处以及绕圆周(例如,引线的周长)在不同角度位置处的电极阵列。复杂电极阵列几何结构可以包括除了环形电极之外的或者代替其的绕每根引线20的圆周的多个电极(例如,部分环形或分段式电极)。以此方式,电刺激可以涉及来自引线20的特定方向以从刺激较大的组织体积中增强治疗疗效并减小可能的不良副作用。
在一些示例中,IMD 16的外壳34可以包括一个或多个刺激和/或感测电极。例如,外壳34可以包括当IMD 16被植入患者12体内时暴露于患者12的组织的导电材料或者可以附接于外壳34的电极。在其他示例中,引线20可以具有除了如图1中所示出的具有主动或被动尖端构型的细长柱形体之外的形状。例如,引线20可以是扁条形引线、球形引线、可弯曲式引线或者在治疗患者12中有效的任何其他类型的形状。
IMD 16可以根据一个或多个刺激治疗程序(本文中也被称为“刺激参数值集合”)将电刺激治疗递送至患者12的大脑28。刺激治疗程序可以定义针对由IMD 16的刺激发生器生成的并且从IMD 16经由一个或多个电极24、26递送至患者12体内的目标治疗递送位点的治疗的一个或多个电刺激参数值。电刺激参数可以定义电刺激治疗的方面,并且可以包括例如,电刺激信号的电压或电流振幅、电刺激的电荷电平、电刺激信号的频率、波形形状、接通/断开循环状态(例如,如果循环“断开”,则刺激总是接通,并且如果循环接通,则刺激循环接通或断开)、以及在电刺激脉冲的情况下的脉冲速率、脉冲宽度、和其他适当的参数(比如,持续时间或占空比)。此外,如果不同的电极可用于递送刺激,那么治疗程序的治疗参数可以进一步由电极组合表征,所述电极组合可以定义所选的电极24、26以及其对应的极性。在一些示例中,可以使用连续的波形来递送刺激并且刺激参数与定义此波形。
除了被配置成递送治疗以管理患者12的疾病,治疗系统10还被配置成感测患者12的生物电大脑信号或另一个生理参数。例如,IMD 16可以包括感测模块,所述感测模块被配置成经由电极24、26的子集、另一组电极或者两者来感测在大脑28的一个或多个区域内的生物电大脑信号。因此,在一些示例中,电极24、26可以用于将电刺激从治疗模块递送至大脑28内的目标位点以及感测在大脑28内的大脑信号。然而,IMD 16还可以使用单独的一组感测电极来感测生物电大脑信号。在一些示例中,IMD 16的感测模块可以经由一个或多个电极24、26来感测生物电大脑信号,所述电极还用于将电刺激递送至大脑28。在其他示例中,一个或多个电极24、26可以用于感测生物电大脑信号,而一个或多个不同的电极24、26可以用于递送电刺激。
外部医疗设备编程器14被配置成根据需要与IMD 16进行无线通信以提供或检索治疗信息。编程器14是用户(例如,临床医生和/或患者12)可以用来与IMD 16进行通信的外部计算设备。例如,编程器14可以是临床医生用来与IMD 16进行通信并针对IMD 16编程一个或多个治疗程序的临床医生编程器。此外或替代地,编程器14可以是患者编程器,所述患者编程器允许患者12选择程序和/或查看并修改治疗参数值。临床医生编程器相比患者编程器可以包括更多的编程特征。换言之,更加复杂或敏感的任务可以仅由临床医生编程器所允许以防止未经训练的患者对IMD 16作出非期望的改变。
编程器14可以是具有可由用户观看的显示器以及用于将输入提供给编程器14的接口(即,用户输入机构)的手持式计算设备。例如,编程器14可以包括用于将信息呈现给用户的较小的显示屏(例如,液晶显示器(LCD)或发光二极管(LED)显示器)。此外,编程器14可以包括触摸屏显示器、键盘、按钮、外围指向设备、语音激活或者允许用户通过编程器14的用户界面进行导航并且提供输入的另一个输入机构。如果编程器14包括按钮和键盘,则按钮可以专用于执行特定的功能(例如,电源按钮),按钮和键盘可以是软按键,所述软按键根据用户界面的由用户目前观看的部分或其任意组合在功能方面进行改变。
在其他示例中,编程器14可以是较大的工作站或者在另一个多功能设备内的单独应用,而不是专用的计算设备。例如,多功能设备可以是笔记本计算机、平板计算机、工作站、蜂窝电话、个人数字助理或者可以运行应用的另一个计算设备,所述应用使计算设备能够作为安全医疗设备编程器14运作。耦合至计算设备的无线适配器可以使计算设备与IMD 16之间的安全通信成为可能。
当编程器14被配置成由临床医生使用时,编程器14可以用于将编程信息传输给IMD 16。例如,编程信息可以包括:硬件信息(比如,引线20的类型、电极24、26在引线20上的安排、引线20在大脑28内的位置)、定义了治疗参数值的一个或多个治疗程序、针对一个或多个电极24、26的治疗窗、以及可用于编程到IMD 16中的任何其他信息。编程器14还可能能够完成功能测试(例如,测量引线20的电极24、26的阻抗)。
临床医生还可以借助于编程器14生成治疗程序并将其存储在IMD 16内。编程器14可以通过提供用于标识潜在有益的治疗参数值的系统而辅助临床医生创建/标识治疗程序。例如,在编程会话期间,编程器14可以生成针对多个治疗程序中的每个治疗程序的VTA。在一些示例中,治疗程序中的至少一些治疗程序可以具有相同电极组合(但是至少一个其他治疗参数的不同值),并且可以将这些治疗程序组织到子集中,每个子集具有相同的电极组合。编程器14的处理器可以为每个子集选择最有效的治疗程序并且显示所选治疗程序的列表。临床医生可以从所述列表中选择治疗程序以便向患者12提供治疗,从而解决与患者病情相关联的症状。
如以下进一步详细地讨论的,在一些示例中,编程器14(或另一个计算设备)被配置成确定治疗系统10递送的至少一个治疗程序的疗效分数。治疗程序可以包括例如电极组合、刺激振幅、刺激脉冲宽度、和刺激频率。在一些示例中,所述分数可以是基于临床评级量表疗效图(CRSEM)确定的疗效分数。在一些示例中,疗效分数可以是估计的临床评级量表分数。CRSEM可以是患者特定的。在一些示例中,患者特定的CRSEM可以基于基线CRSEM(所述基线CRSEM基于大量患者而回顾性地创建)并且然后基于患者对刺激的反应和/或患者特定大脑结构来对其进行更新。
在一些示例中,CRSEM可以用于生成目标VTA。可以基于在治疗程序的基础上生成的VTA与目标VTA之间的比较来确定特定治疗程序的分数。在一些示例中,目标VTA可以基于CRSEM和大脑内的兴趣区域的组合。例如,兴趣区域可以基于对与DBS相关的目标大脑核进行标识的患者特定大脑解剖图。目标VTA可以包括与导致高估计临床评级分数的兴趣区域重叠的区域。在一些示例中,编程器14可以对治疗程序进行比较,并且生成和显示关于针对每个治疗方案的VTA的信息。例如,编程器14可以生成显示,所述显示列举了每个电极24、26,或者电极24、26的子集,以及导致最高分数的(多个)治疗程序(对于每个电极或电极组合)。在一些示例中,可以显示估计的临床评级量表分数。
在一些示例中,CRSEM可以用于基于所生成的VTA与大脑内的各种兴趣区域的比较来调整分数。例如,可以在逐体素的基础上将所生成的VTA与疗效地图进行比较。每次比较可能影响所生成的VTA的整体分数。
在一些示例中,可以在将引线20植入患者12体内之前(例如,术前地)确定估计的临床评级量表分数。例如,可以基于引线20在患者12体内的预期植入位点确定估计的临床评级量表分数。在这些示例中,可以基于部分地通过使用患者12的图像来生成的CRSEM(例如,基于特定于患者12的大脑图谱)来确定多个VTA的估计的临床评级量表分数,从而使得可以对患者12特别定制对电极24、26中的每个电极的估计的临床分数进行标识的信息。引线20和电极24、26的目标位置可以例如由编程器14的处理器选择并建模,以便如果引线20被植入患者12则确定预期由引线20的(多个)选择电极24、26递送电刺激所引起的VTA。此外,编程器14(或另一个设备)可以基于电极24、26的不同目标位置确定估计的临床评级量表分数,例如,以便术前地选择引线20的实际植入位点。在将引线16植入患者12体内的过程中,临床医生可以尝试将引线20的电极24、26定位成靠近或在目标解剖区域内。患者12体内的充当由IMD 14递送的刺激的目标组织位点的解剖区域可以是基于患者病情选择的。例如,刺激大脑18的特殊结构(比如,黑质)可以帮助减小由患者12经历的震颤的数量和大小。针对DBS的其他解剖区域可以包括黑质、苍白球内侧、腹侧中间体和未定带。在其他示例中,处理器14可以例如选择导致相对最高的估计的临床评级量表分数的植入位点或者与大于或等于预定阈值的估计的临床评级量表分数相关联的相对最大数量的电极。
编程器14还可以被配置成由患者12使用。当配置成患者编程器时,编程器14可以具有有限的功能(相比于临床医生编程器)以便防止患者12变更IMD 16的关键功能或者可能对患者12有害的应用。
无论编程器14被配置成用于临床医生还是患者使用,编程器14被配置成经由无线通信与IMD 16以及可选地另一个计算设备进行通信。编程器14例如可以使用本领域中已知的射频(RF)和/或感应遥测技术经由无线通信与IMD 16通信,所述技术可以包括用于近端、中距离、或更长距离通信。编程器14还可以使用各种局部无线通信技术(如根据802.11或蓝牙规范设置的RF通信、根据IRDA规范设置的红外(IR)通信、或者其他标准或专有遥测协议)中的任何局部无线通信技术经由有线或无线连接与另一个编程器或计算设备通信。编程器14还可以经由可拆卸介质(比如,磁盘或光盘、存储卡或记忆棒)的交换与其他编程或计算设备通信。此外,编程器14可以经由本领域已知的远程遥测技术与IMD 16和另一个编程器进行通信,经由例如局域网(LAN)、广域网(WAN)、公共交换电信网络(PSTN)或蜂窝式电话网通信。
治疗系统10可以被植入以为患者12提供经历几个月或几年的疗程的慢性刺激治疗。然而,还可以试验性地采用系统10以在完全植入之前评估治疗。如果被临时地植入,则系统10的一些部件可以不被植入患者12体内。例如,患者12可以装配有外部医疗设备(比如,试验刺激器)而不是IMD 16。外部医疗设备可以耦合至经皮引线或者经由经皮延伸耦合至植入皮下的引线。如果试验刺激器指示DBS系统10为患者12提供了有效的治疗,则临床医生可以将慢性刺激器植入患者12体内以进行相对长期的治疗。
图1中所示出的系统10仅是治疗系统的一个示例,针对所述治疗系统可以确定一个或多个治疗程序的疗效分数。本文中所描述的技术可以用于确定导致其他治疗系统的高疗效分数的治疗程序,如具有其他引线或电极配置的治疗系统、具有多于一个IMD的治疗系统、以及包括一个或多个无引线电刺激器(例如,具有比IMD 16更小的形状因子并且可以不耦合至任何单独的引线的微刺激器)的治疗系统。无引线电刺激器可以被配置成生成电刺激治疗并经由电刺激器的外壳上的一个或多个电极将其递送至患者12。
虽然DBS可以成功地减轻某些神经疾病的症状,所述刺激还可以引起不期望的副作用(本文中所也被称为副作用)。副作用可以包括失禁、刺痛、失衡、瘫痪、言语不清、失忆、失去自制力以及许多其他神经问题。副作用可以从轻度到严重。DBS可以通过无意地将电刺激脉冲提供给靠近目标解剖区域的解剖区域而引起一个或多个副作用。这些解剖区域可以被称为与不良刺激作用相关联的区域。由于这个原因,临床医生可以用一个治疗程序(或多个治疗程序)对IMD 16进行编程,所述治疗程序定义了平衡有效治疗并使副作用最小化的刺激参数值。
借助于编程器14或另一个计算设备,临床医生可以选择针对治疗系统10的治疗参数的值,包括电极组合。通过选择用于将电刺激治疗递送至患者12的特定的电极24、26,临床医生可以修改至大脑28内的一个或多个目标特定组织区域(例如,特定的解剖结构)且避免大脑28内的其他组织区域的电刺激治疗。此外,通过选择定义了电刺激信号的其他刺激参数值(例如,振幅、脉冲宽度和脉冲速率)的值,临床医生可以生成用于患者12的经由所选电极子集递送的有效治疗。由于生理差异、病情差异以及引线布置的不准确性,参数值可以在患者之间变化。
在编程会话过程中,临床医生可以确定一个或多个治疗程序,所述治疗程序可以为患者12提供有效的治疗。患者12可以向临床医生提供关于被评估的特定程序的疗效的反馈,所述反馈可以包括与根据特定程序递送治疗的副作用有关的信息。在一些示例中,患者反馈可以用于确定临床评级量表分数。一旦临床医生已经标识了可能对患者12有益的一个或多个程序,患者12就可以继续评估过程并确定哪个程序最佳地缓解了患者12的病情或者以其他方式将有效的治疗提供给患者12。编程器14可以通过提供标识潜在有益的治疗参数值的医疗系统而辅助临床医生创建/标识治疗程序。
在本文中所描述的一些示例中,治疗系统10的处理器(例如,IMD 16或编程器14的处理器)被配置成基于预期由根据治疗程序递送的电刺激产生的VTA来自动地确定治疗程序的疗效分数或估计临床评级量表分数中的至少一者。在示例中,处理器可以确定包括经由最靠近目标位置的电极配置来递送的刺激的治疗程序的疗效分数。使用计算机建模,而不是基于由IMD 16利用所选的刺激参数值递送至患者12的实际电刺激的结果来确定疗效分数或估计临床评级量表分数。因此,在一些示例中,处理器可以确定最可能将患者结果最大化的刺激参数值,而不需要患者12出现在诊所,这帮助减小要求患者12在诊所中的时间量以便对IMD 16进行编程。此外,在一些示例中,可以在将引线20植入患者12之前对疗效分数或临床评级量表分数进行评估,这可以在将引线20植入患者12体内之后提供用于对针对IMD 16的电刺激参数进行编程的起始点。
如以下进一步详细地描述的,在一些示例中,编程器14基于预期由根据治疗程序递送的电刺激激活的组织体积来确定多个治疗程序中的每个治疗程序的疗效分数或估计临床评级量表分数。编程器14可以被配置成使用任何适当的技术(比如,以下关于图4而描述的技术中的任何一种技术)来生成针对治疗程序的VTA。在一些示例中,编程器14的处理器通过将VTA与疗效地图进行比较来自动地确定疗效分数或估计临床评级量表分数中的至少一者。在一些示例中,将预期由根据电刺激参数值集合来进行的对电刺激的递送产生的VTA与CRSEM进行比较,以便生成估计临床评级量表分数。疗效分数或估计临床评级量表分数可以将VTA是否与已知当被刺激时导致副作用的大脑区域重叠考虑在内。
在一些示例中,生成疗效分数或估计临床评级量表分数可以包括向患者的各种疗效区域和不同的副作用区域提供不同的权重。在这种示例中,当VTA首先与一个或多个副作用区域重叠时,可能不会发生最大分数。在其他示例中,疗效分数或估计临床评级量表分数可以包括多个子分数,其中,每个子分数可以与不同的期望有效结果相对应。例如,对于患有帕金森病的患者,一个子分数可以量化刺激促进运动的疗效的一个子分数,另一个子分数可以量化刺激将震颤最小化的疗效,并且第三个子分数可以量化促进言语的疗效。
在确定多个治疗程序中的每个治疗程序的疗效分数和/或估计临床评级量表分数之后,编程器14的处理器可以存储具有对治疗程序以及用于递送治疗程序的电极组合的指示的最大分数。在一些示例中,编程器14生成并呈现显示,所述显示包括多个电极的列表以及对应最大分数和治疗程序,或其任何组合。
图2是功能框图,展示了示例IMD 16的部件。在图2示出的示例中,IMD 16包括处理器60、存储器62、信号发生器64、感测模块66、切换模块68、遥测模块70和电源72。存储器62以及本文中所描述的其他存储器可以包括任何易失性或非易失性介质,比如,随机存取存储器(RAM)、只读存储器(ROM)、非易失性RAM(NVRAM)、电可擦除可编程ROM(EEPROM)、闪存等。存储器62可以存储计算机可读指令,所述计算机可读指令在由处理器60执行时使IMD 16执行本文中所描述的各种功能。
在图2中所示出的示例中,存储器62将治疗程序74和操作指令76存储在例如存储器62内的单独存储器或者存储器62内的单独区域中。所存储的每个治疗程序74依据电刺激参数(比如,电极组合、电流或电压振幅)的对应值定义特定的治疗程序,并且,如果刺激发生器64生成并递送刺激脉冲,则治疗程序可以定义针对刺激信号的脉冲宽度和脉冲速率的值。每个存储的治疗程序74还可以被称为刺激参数值集合。操作指令76在处理器60的控制下指导IMD 16的一般性操作,并且可以包括用于经由电极24、26监测在一个或多个大脑区域内的大脑信号并将电刺激治疗递送至患者12的指令。
刺激发生器64在处理器60的控制下生成刺激信号以经由所选的电极24、26的组合递送至患者12。在一些示例中,刺激发生器64基于一个或多个存储的治疗程序74生成刺激信号并经由电极24、26的所选组合将刺激信号递送至大脑28(图1)的一个或多个目标区域。针对刺激信号或其他类型的治疗和刺激参数值在大脑28内的目标组织位点可以取决于治疗系统10被实施成用于对其进行管理的患者病情。虽然描述的是刺激脉冲,刺激信号可以具有任何形式,如连续时间信号(例如,正弦波)等。
在本公开中所描述的处理器(包括处理器60)可以包括一个或多个数字信号处理器(DSP)、通用微处理器、专用集成电路(ASIC)、现场可编程逻辑阵列(FPGA)、或其他等效集成或离散逻辑电路、或其组合。归属于本文中所描述的处理器的功能可以由硬件设备提供并且具体化为软件、固件、硬件或其任意组合。处理器60被配置成根据由存储器62存储的治疗程度74控制刺激发生器64以应用由一个或多个程序指定的特定刺激参数值,如,振幅、脉冲宽度和脉冲速率。
在图2中所示出的示例中,引线20A的电极24的集合包括电极24A、24B、24C和24D,并且引线20B的电极26的集合包括电极26A、26B、26C和26D。处理器60可以控制切换模块68以将由刺激发生器64生成的刺激信号应用于所选的电极24、26的组合。具体地,切换模块68可以将刺激信号耦合至在引线20内选择的导体,这进而块所选的电极24、26对刺激信号进行传递。切换模块68可以是切换阵列、切换矩阵、多路复用器、或者被配置成将刺激能量选择性地耦合至所选的电极24、26并且利用所选的电极24、26选择性地感测生物电大脑信号的任何其他类型的切换模块。因此,刺激发生器64经由切换模块68和引线20内的导体耦合至电极24、26。在一些示例中,然而,IMD 16不包括切换模块68。
刺激发生器64可以是单通道或多通道刺激发生器。具体地,刺激发生器64可能能够在给定的时间处经由单个电极组合递送单个刺激脉冲、多个刺激脉冲或者连续的信号,或者在给定的时间处经由多个电极组合递送多个刺激脉冲。然而,在一些示例中,刺激发生器64和切换模块68可以被配置成在时间交叉的基础上传递多个通道。例如,切换模块68可以用于在不同的时间处跨不同的电极组合对刺激发生器64的输出进行时分以将多个程序或多通道的能量传递至患者12。
感测模块66在处理器60的控制下被配置成经由所选的电极24、26的子集或者利用一个或多个电极24、26以及IMD 16的导电外壳34的至少一部分、IMD 16的外壳上的电极或另一个参照物来感测患者12的生物电大脑信号。处理器60可以控制切换模块68以将感测模块66电连接至所选的电极24、26。以此方式,感测模块66可以利用电极24、26(和/或除了电极24、26之外的参照物)的不同组合选择性地感测生物电大脑信号。
尽管在图2中感测模块66与刺激发生器64和处理器60一起被并入公共外壳34中,但是在其他示例中,感测模块66是在与IMD 16的外壳34分开的外壳中并且经由有线或无线通信技术与处理器60通信。
遥测模块70在处理器60的控制下被配置成支持IMD 16与外部编程器14或另一个计算设备之间的无线通信。IMD 16的处理器60可以经由遥测模块70从编程器14接收针对各刺激参数(比如,振幅和电极组合)的值作为程序的更新。针对治疗程序的更新可以被存储在存储器62的治疗程序74部分内。IMD 16中的遥测模块70以及在本文所描述的其他设备和系统(比如,编程器14)中的遥测模块可以通过RF通信技术完成通信。此外,遥测模块70可以利用编程器14经由IMD 16的邻近诱导交互作用与外部医疗设备编程器14通信。因此,遥测模块70可以在连续的基础上或者基于来自IMD 16或编程器14的请求以周期性间隔将信息发送至外部编程器14。
电源72将操作功率传递至IMD 16的各部件。电源72可以包括较小的可再充电或不可再充电电池以及用于产生操作功率的功率生成电路。可以通过外部充电器与IMD 16内的导电充电线圈之间的邻近诱导交互作用完成再充电。在一些示例中,功率要求可以足够小以允许IMD 16利用患者运动并实施动能提取设备以对可充电电池进行涓流充电。在其他示例中,传统的电池可以被使用有限的一段时间。
图3是功能框图,展示示例医疗设备编程器14(图1)的部件。编程器14包括处理器80、存储器82、遥测模块84、用户界面86和电源88。处理器80控制用户界面86和遥测模块84,并且来往于存储器82存储并检索信息和指令。编程器14可以被配置成用作临床医生编程器或者患者编程器。处理器80可以包括一个或多个处理器的任意组合,包括一个或多个微处理器、DSP、ASIC、FPGA或其他等效的集成的或离散的逻辑电路。因此,处理器80可以包括任何适合的结构,无论是硬件、软件、固件或其任何组合,以便执行本文中归属于处理器80的功能。
用户(如临床医生或患者12)可以通过用户界面86与编程器14进行交互。用户界面86包括显示器(未示出),如LCD或LED显示器或其他类型的屏幕,利用所述显示器处理器80可以呈现与治疗相关的信息(例如,电极和相关联的治疗窗)。此外,用户界面86可以包括输入机构以便从用户接收输入。输入机构可以包括以下各项中的任一项或多项,例如,按钮、键盘(例如,字母数字键盘)、外围指向设备、触摸屏或者允许用户通过由编程器14的处理器80呈现的用户界面导航并且提供输入的另一输入机构。在其他示例中,用户界面86还包括用于为患者12提供可听通知、指令或其他声音、从患者12接收话音命令或两者的音频电路。
存储器82还可以包括用于操作用户界面86和遥测模块84并且用于管理电源88的指令。在图3所示的示例中,存储器82还存储区域90、患者解剖学数据92、治疗程序94、VTA算法96以及疗效地图信息98。
区域90存储标识大脑28的与有效治疗递送相关联的一个或多个组织区域(或者患者身体的另一个部位)的信息。这些区域可以被称为疗效区域。区域90还存储标识大脑28的与不利刺激效果相关联的一个或多个组织区域(或者患者身体的另一个部位)的信息。这些区域可以被称为副作用区域。可以使用任何合适的惯例标识区域90。在一些示例中,疗效区域或副作用区域是由特定的大脑结构或大脑结构的多个部分、引线20和大脑28所注册的任何合适的坐标系的坐标、其他解剖结构、大脑28或患者12的身体的另一个部位所注册的二维(2D)网格的像元、大脑28或患者12的身体的另一个部位所注册的三维(3D)网格的体素或其任意组合标识的。
由区域90存储的疗效区域和副作用区域可以根据患者病情有所不同。例如,如果治疗系统10被实施用于管理由患者12经历的震颤,那么区域90可以包括黑质,因为针对一些患者,刺激黑质可以帮助减小由患者经历的震颤的数量和大小。
在一些示例中,临床医生选择存储的区域90。在其他示例中,预选区域90并将其与患者病情相关联;处理器80或临床医生可以通过选择系统10被实施以对其进行管理的患者病情而确定与患者12相关的区域90。
处理器80被配置成针对特定的刺激参数值集合生成VTA,其中,VTA代表患者12的预期通过由特定的电极(或电极组合)根据刺激参数集将电刺激递送至患者12的组织而激活的组织体积。处理器80被配置成针对特定的电极或电刺激参数值集合使用VTA算法96和由存储器82存储的用于生成VTA的患者解剖学数据92来生成VTA。患者解剖学数据92可以例如包括植入式电极24、26在大脑28中的位置、患者12的解剖结构以及靠近植入式电极24、26的组织的特性(如,阻抗或神经元方向)。在将引线20植入患者12中之前已经生成了目标VTA的示例中,患者解剖学数据92可以不包括植入式电极24、26在大脑28中的实际位置,而是电极24、26在大脑28中的目标位置。患者解剖学数据92可以由任何类型的成像模式创建,如,但不限于,计算机断层摄影术(CT)、磁共振成像(MRI)、弥散张量成像(DTI)、X线、荧光镜检查等等。
VTA算法96可以包括处理器80可以实施以针对特定电刺激参数值集合和一个或多个活性电极生成VTA的一个或多个算法。当IMD 16经由电极(或电极的组合)将电刺激递送至患者12的组织时,电场可以传播远离电极。处理器80可以实施算法96以估计在由电极递送电刺激的过程中哪个神经元将由远离电极24、26传播的电场激活。
在一些示例中,VTA算法96可以包括例如定义了电场如何远离原点位置进行传播的电场模型方程式。此外,VTA算法96还可以包括方程组、查找表或者定义了如由患者解剖学数据定义的受电场影响的组成解剖结构的特定神经元的阈值动作电位的任何类型的模型。在一些情况下,此信息可以将神经元相对于电场的取向考虑在内。如果电场的电压或电流振幅高于在电场内的任何神经元的阈值动作电位,则该神经元将被激活(例如,引起神经冲动)。由于电流传播和激活神经元所需的阈值动作电位(例如,阈值电压)的变化,神经元的激活可以随着组织在引线周围的位置而变化。一些神经元可以利用较小的电压更加远离引线激活而其他神经元可以由于高电压阈值和/或神经元取向靠近引线被激活。
在一些示例中,存储器82还存储与引线20的硬件特性有关的信息并且存储器80基于硬件特性生成VTA。硬件特性可以包括例如被植入患者12体内的引线20的数量和类型、电极24、26的数量、每个电极324、26的大小、电极24、26的类型(例如,环形电极、部分环形电极、分段式电极)等等。
在一些示例中,处理器80被配置成将所确定的疗效图存储在存储器82中作为疗效图信息98。临床医生可以例如在IMD 16的编程过程中查看存储的疗效图信息98以选择一个或多个治疗程序,利用所述电极组合IMD 16可以将有效的电刺激递送至患者12。例如,临床医生可以与用户界面86进行交互以检索所存储的疗效图信息98。在其他示例中,临床医生可以与用户界面86交互,以便基于临床评级分数在各种刺激参数集合或电极组合之间进行选择。在一些示例中,处理器80被配置成生成并显示图形用户界面,所述图形用户界面指示针对至少一个电极24、26(例如,每个电极24、26或者至少两个电极24、26)的对应估计临床评级量表分数。然后,临床医生可以从所显示的信息中相对快速地确定哪些电极具有最高估计临床评级量表分数,所述电极可以是与刺激参数值相关联的最有可能为患者12提供有效电刺激治疗的电极。
在一些示例中,临床医生(或另一个用户)可以经由用户界面86提供输入以便操纵分数、疗效分数、临床评级量表分数、或疗效图信息。例如,响应于接收请求按疗效分数或估计临床评级量表分数来对治疗程序列表极性排序的用户输入,处理器80可以基于疗效分数、估计临床评级量表分数、或其组合来重组电极列表(例如,从大到小或反之亦然)。在一些示例中,临床医生可以基于患者反馈更新疗效图信息98。
处理器80可以被配置成生成其他类型的界面。例如,处理器80可以被配置成生成显示,所述显示包括基于相关联疗效分数或估计的临床评级分数来排序的多个电极组合(例如,可以向每个电极组合指定唯一的字母数字标识符或图形标识符)的列表,而无需显示相关联疗效分数或估计临床评级量表分数。例如,可以显示具有最高相关联疗效分数或估计临床评级量表分数的5个电极组合。然后,临床医生可以经由用户界面86提供请求关于特定电极组合的附加信息的输入。响应于接收用户输入,处理器80可以呈现具有关于所选电极组合、疗效分数、估计临床评级量表分数、或多个子分数的进一步细节的另一个用户界面。
在一些示例中,患者12、临床医生或另一个用户可以以其他方式与编程器14的用户接口86进行交互以手动地选择治疗程序、生成新的治疗程序、修改治疗程序、将新程序传输至IMD 16或其任意组合。
存储器82可以包括任何易失性或非易失性存储器,如RAM、ROM、EEPROM或闪存。存储器82还可以包括可移除存储器部分,所述可移除存储器部分可以用于提供存储更新或存储容量的增加。可移除存储器还可以允许敏感患者数据在编程器14被不同的患者使用之前被移除。
编程器14中的无线遥测可以由RF通信或外部编程器14与IMD 16的邻近诱导交互作用完成。此无线通信通过使用遥测模块84是可能的。因此,遥测模块84可以类似于包含在IMD 16内的遥测模块。在其他示例中,编程器14可能能够通过有线连接进行红外通信或直接通信。以此方式,其他外部装置可能能够在不需要建立安全无线连接的情况下与编程器14通信。
电源88被配置成将操作功率传递至编程器14的部件。电源88可以包括电池以及用于产生操作功率的功率生成电路。在一些示例中,电池可以是可再充电的以允许延长的操作。可以通过将电源88电耦合至连接至交流电(AC)出口的托架或插头而完成再充电。此外,可以通过外部充电器与编程器14内的导电充电线圈之间的邻近诱导交互作用完成再充电。在其他示例中,可以使用传统的电池(例如,镉镍蓄电池或锂离子电池)。此外,编程器14可以直接耦合至交流电出口以运作。
疗效图信息98可以存储一个或多个疗效图。在一些示例中,存储在疗效图98中的每个疗效图可以与不同患者病情或症状相关联。在一些示例中,疗效图可以是临床评级量表分数疗效图(CRSEM),每个临床评级量表分数疗效图与特定患者病情或症状相关联。例如,疗效图信息98可以包括针对如UPDRS、YBOCS和HDRS等各种临床评级量表中的每个临床评级量表的CRSEM。CRSEM信息可以用于标识大脑28内的功能位置。例如,CRSEM信息可以包括关于大脑的哪些区域(当针对特定病情而被激活时)提供最好治疗效果的信息。此信息可以是例如与CRSEM内的特定体素相关联的值。在一些示例中,在对治疗程序进行评分时,当基于存储在与特定患者病情相关联的疗效图信息98中的CRSEM来选择治疗程序时,可以将区域90考虑在内。在一些示例中,CRSEM可以用于生成目标VTA,所述目标VTA也可以存储在疗效图信息98中。
虽然各种信息被显示为存储在编程器14的存储器82中,但是将理解的是,此信息中的一些或全部信息可以可替代地或另外地存储在IMD 16的存储器62内。仅作为一个示例,为了可携带性,可以将原始或经编码的患者解剖学数据92存储在IMD 16的存储器62内。此外,如以下所讨论的,归属于编程器14的处理器80的功能中的至少一些功能可以相反或另外地归属于IMD的处理器60。
图4是用于确定VTA的示例技术的流程图。尽管图4的技术以及图5至图9的技术被主要描述为由编程器14的处理器80执行,但是在其他示例中,另一个处理器(单独地或结合处理器80)可以执行图4至图9的技术的任何部分。例如,IMD 16的处理器60或另一个计算设备的处理器(单独地或结合处理器80)可以执行图4至图9的技术的任何部分。
根据图4中所示出的技术,处理器80接收用于创建电场模型所需的患者解剖学数据(102)。患者解剖学数据指示靠近所选电极的组织的一个或多个特性。在一些情况下,可以将这种患者特定数据拟合到表示如大脑结构等解剖结构的标准解剖图谱中。靠近所选电极的组织可以是基于引线20在患者12内的已知位置或者如果引线20未被植入患者12内时引线20的目标位置被标识的。例如,给出患者的MRI和术后CT扫描,处理器80可以确定引线20在大脑28内的位置并且因此靠近植入的电极24、26的解剖结构。作为另一个示例,考虑到患者的MRI和术后CT扫描,处理器80可以确定靠近引线20的电极24、26的目标位置的解剖结构(即使引线20还未被植入患者12体内)。
患者解剖学数据可以是特定于或者定制于患者12的,或者可以是更普遍的(例如,可适用于多个患者的人类组织的通用物理特性)。在一些示例中,患者解剖学数据包括:在患者12体内的目标治疗递送位点的解剖图像、并非特定于患者12的参考解剖图像、指示患者的解剖的特定结构的解剖图或者靠近引线20的电极24、26的组织特性(例如,传导率或密度)图。患者解剖学数据可以是基于由医疗成像生成的数据创建的,比如,但不限于,CT、MRI或任何其他测定体积的成像系统。处理器60可以将患者解剖学数据存储在存储器82(图3)的分区92内。
处理器80可以对由所选电极递送的电刺激对患者12的组织的效果进行建模。在图4中所所示出的示例中,处理器80确定电场模型(104),所述电场模型指示当由电刺激参数值集合定义的电刺激信号由所述电极传递时将远离电极传播的电场。处理器80可以例如实施算法(例如,存储在编程器14的存储器82中的VTA算法96)以确定电场模型。所述算法可以将所接收的患者解剖学数据连同电场模型方程式考虑在内,所述电场模型方程式定义了电流传播以便确定电流将如何远离所选的电极进行传播。
在大脑28(或患者12体内的其他位点)内的组织变异可以在某些方向上改变来自电极的电流传播。这些变异可以有助于改变引线20的电极24、26的VTA。因此,电场模型方程式将可以包括在患者解剖学数据92中的与引线20的电极24、26相邻的组织的物理组织特性考虑在内。处理器80基于被治疗的患者12的实际解剖结构和组织特性确定电场的特性。根据此信息,当IMD 16根据电刺激参数值集合生成电刺激信号时,处理器80可以估计将在经由所选的电极递送治疗的过程中产生的电场。
在另一个实施例中,可以使用采用各种类型的组织的标准组织特性的标准电场模型,而不是确定基于患者特定解剖学数据的电场模型。在这种示例中,处理器80基于人类组织的通用物理特性以及引线20的电极24、26的已知的物理特性确定电场的特性(例如,大小、形状和功率分布)。由此,处理器80可以仅通过从存储器中检索电场模型来确定电场模型(已经预生成了所述电场模型)。在使用患者特定的或更通用的电场模型的任一示例中,电场模型可以提供电场在特定患者12的大脑28中将是什么的近似估计。然而,基于患者12的实际解剖结构确定的电场模型可以是将由经由所选电极递送电刺激产生的电场的更准确表示。
在图4中所示出的示例中,处理器80确定神经元模型(106)。所述神经元模型针对患者12的多个组织体积中的每个组织体积指示刺激所述组织所需的电压或电流振幅。例如,神经元模型可以是体素的3D网格,并且每个体素可以与刺激在特定体素内的组织所需的电压或电流振幅相关联。作为另一个示例,神经元模型可以包括2D区域的网格,其中,所述网格的每个区域可以与刺激在特定区域内的组织所需的电压或电流振幅相关联。在一些示例中,处理器80例如基于患者12的使用医疗成像确定的并且存储为患者解剖学数据92(图3)的组织阻抗特性或者基于针对大脑28的总图集的组织阻抗特性通过生成神经元模型来确定神经元模型。在其他示例中,处理器80可以基于从DTI成像中获得的且存储为患者解剖学数据92(图3)的大脑纤维几何结构来确定神经元模型。在其他示例中,神经元模型是由另一个处理器预先确定的并且由编程器14的存储器82(或另一个设备的另一个存储器)存储;处理器80可以通过从存储器中检索神经元模型而确定神经元模型。例如,可以根据于2013年3月14日提交的转让给莫尔纳(Molnar)等人的题为“VISUALIZING TISSUE ACTIVATED BY ELECTRICAL STIMULATION(使电刺激激活的组织可视化)”的美国专利号2013/028966中公开的技术来确定神经元模型。
处理器80基于电场模型和神经元模型确定组织激活体积(VTA)(108)。VTA可以指示患者12的哪个组织将被预期从电刺激的递送中生成的电场激活(例如,刺激)。在一些示例中,处理器80通过将神经元模型应用于电场模型所确定的电场来确定VTA。神经元模型将指示哪些神经元将由电场激活。预期由所选电极并根据特定的电刺激参数集合递送电刺激所引起的电场可以具有太低的强度而不能激活靠近所选电极的至少一些组织中的神经元。因此,通过将神经元模型应用于由电场模型确定的电场,处理器80可以在由所选电极利用特定的电刺激参数值将电刺激递送至目标组织位置时确定预期被激活的组织体积。
图5是用于基于在治疗程序的基础上生成的VTA来确定治疗程序的疗效分数的示例技术的流程图。处理器80生成针对治疗程序的组织激活体积(VTA)(110)。可以基于VTA算法96以及采用如以上关于图4而进一步详细地讨论的方式来生成VTA。处理器80将所生成的VTA与疗效图进行比较(112)。疗效图可以存储在疗效图信息98中。在一些示例中,处理器80可以经由用户界面86基于用户输入从疗效图信息98中选择疗效图。例如,可以基于被治疗的患者12的症状选择疗效图。用户输入可以包括例如对患者病情或一个或多个患者症状的指示。
疗效图可以包括关于大脑区域的信息,在所述大脑区域处,刺激对治疗症状最有效。在一些示例中,可以基于患者病情选择疗效图。例如,对于具有相应临床评级量表的患者病情,可以选择包括基于该临床评级量表确定的值的疗效图。结合了临床评级量表的疗效图可以是CRSEM。例如,可以结合到疗效图中的临床评级量表包括UPDRS、YBOCS、和HDRS。一些临床评级量表可以包括涉及特定患者症状的子分数。在一些示例中,CRSEM可以包括关于整体临床评级量表分数和针对每个子分数的临床评级量表分数两者的信息。子分数可以量化治疗程序对特定症状或功能的影响。例如,CRSEM可以包括针对言语、动作技能、运动、和震颤最小化的子分数。在其他示例中,针对特定病情的疗效图可以包括关于在大脑的哪些区域中刺激对治疗与特定病情相关联的多个症状最有效的信息。与特定病情相关联的疗效图可以结合多个疗效图,一个疗效地图针对每个被治疗的症状。
处理器80可以使用任何适当技术来向3D网格登记所生成的VTA,比如,通过至少部分地将所生成的VTA和3D网格变换成共同坐标系,例如,由此将所生成的VTA与3D网格所表示的组织体积对准。例如,如果3D网格表示患者12的大脑,则编程器14可以根据需要旋转、缩放和转换3D网格、所生成的VTA、或两者,以便将所生成的VTA在患者12的大脑28内的预期位置与3D网格的与这种位置相对应的部分基本上对准。因此,一旦被登记,所生成的VTA和3D网格的相对位置就表示VTA在患者12内(例如,如果3D网格表示大脑28,则在患者的大脑28内)的预期位置。3D网格可以是疗效图。在一些示例中,针对VTA内的每个体素,处理器80在逐体素的基础上对VTA和疗效图进行比较。在其他示例中,处理器80可以将VTA周长周围的体素与疗效图进行比较。在一些示例中,可以基于所生成的VTA与目标VTA的比较来进行对疗效图的比较。例如,如以下关于图9而进一步详细地描述的,可以基于疗效图中的信息生成将治疗疗效最大化的目标VTA。可以在逐体素的基础上将所生成的VTA与目标VTA进行比较。在其他示例中,可以将所生成的VTA与目标VTA进行比较以便确定两个VTA之间的重叠量。
基于所述比较,处理器80确定刺激参数集合的疗效分数(114)。在疗效图是CRSEM的一些示例中,疗效分数可以是估计的临床评级量表分数。在一些示例中,疗效分数可以基于所述VTA与基于疗效图生成的目标VTA多么紧密地类似。疗效分数可以用于量化相比于导致目标VTA的假设治疗程序的治疗程序的相对有效性,或者治疗程序相对于其他治疗程序的相对有效性。例如,所述分数的范围可以为从0到100。在一些示例中,在例如VTA指示根据治疗程序的刺激将导致大量副作用的情况下,所述分数可以为负。
处理器80可以使用任何适当技术来确定疗效分数。例如,疗效分数可以是针对VTA的每个体素的单独值(如疗效图所定义的)之和、单独体素值的平均值、最大体素值、最小体素值、中值体素值、目标VTA与所生成的VTA之间的重复的百分比、或者VTA与所疗效图之间的关系的任何其他量化。在一些示例中,疗效分数可以是加权子分数之和。例如,疗效分数可以是对患者的言语能力的期望影响的子分数以及对患者的吞咽能力的非期望影响的子分数之和,为了得出最终整体疗效分数,对患者的吞咽能力的非期望影响接收两倍于对患者的言语能力的期望影响的权重。在一些示例中(未示出),可以针对多个治疗程序而重复图5的技术。在一些示例中(未示出),也可以针对多个患者症状或病情而重复图5的技术。在这种示例中,处理器80可以确定针对所述多个症状或病情的最高评级治疗程序。
图6是流程图,展示了确定向疗效图的体素指定的值的示例方法。处理器80针对治疗程序生成组织激活体积(116)。在一些示例中,可以基于VTA算法96以及采用如以上关于图4而进一步详细地讨论的方式来生成VTA。在一些示例中,处理器80将所生成的VTA与大脑28内的存储在区域90中的兴趣区域相关联。在其他示例中,所生成的VTA可以与存储在疗效图信息98中的疗效图相关联。在一些示例中,VTA可以与特定于患者12的大脑图谱或疗效图相关联。对VTA与兴趣区域或与疗效图进行的关联可以包括向表示疗效图的3D网格登记VTA。在一些示例中,疗效图可以是总体疗效图,并且在其他示例中,疗效图可以是患者特定的。例如,可以向针对总体疗效图的3D网格登记患者特定VTA。
处理器80可以使用任何适当技术来向3D网格登记所生成的VTA,比如,通过至少部分地将所生成的VTA和3D网格变换成共同坐标系,例如,由此将所生成的VTA与3D网格所表示的体积对准。例如,如果3D网格表示患者12的大脑,则编程器14可以根据需要旋转、缩放和转换3D网格、所生成的VTA、或两者,以便将所生成的VTA在患者12的大脑28内的预期位置与3D网格的与这种位置相对应的部分基本上对准。因此,一旦被登记,所生成的VTA和3D网格的相对位置就表示VTA在患者12内(例如,如果3D网格表示大脑28,则在患者的大脑28内)的预期位置。
处理器80控制IMD 16根据治疗程序向患者12施加刺激(118)。处理器80接收由根据治疗程序由IMD 16递送的电刺激治疗产生的针对患者的临床评级量表分数(120)。在一些示例中,临床医生确定根据治疗程序而向患者应用的治疗的治疗效果的临床评级量表分数。在一些示例中,临床医生在向患者12递送治疗的同时做出确定。在其他示例中,在向患者12递送电刺激之后做出确定。可以基于患者反馈确定临床评级量表分数。例如,临床评级量表分数可以是基于如UPDRS、YBOCS、或HDRS等临床评级量表来表征患者病情的分数。处理器80可以经由用户界面86接收临床评级量表分数。例如,对于患有帕金森病的患者,临床医生可以评估心理状态、行为、情绪、运动功能、和如言语和手写等日常活动。在一些示例中,评估可以包括关于某些日常活动的患者反馈。在一些示例中,可以在某个时间段内给出刺激,在所述时间段内,患者评估他们的当前病情。基于所述评估,临床医生可以基于UPDRS指定数值分数。
处理器80确定与疗效图重叠的VTA同之前VTA之间的变化(122)。在一些示例中,处理器80可以判定疗效图的哪些体素最近与VTA重叠以及疗效图的哪些体素之前与VTA重叠并且不再与当前VTA重叠。处理器80将与所接收的临床评级量表分数相关的信息与疗效图的被标识为发生了变化的体素相关联(123)。在一些示例中,如果临床评级量表分数已经增大,则所接收的临床评级量表分数与最近与当前VTA重叠的每个体素相关联。相反,如果临床评级量表分数已经减小,则当前VTA分数可以与不再与当前VTA重叠的体素中的每个体素相关联。在一些示例中,处理器80还可以或可替代地确定之前VTA与当前VTA之间的临床评级量表分数变化。临床评级量表分数变化量可以与在疗效图内的当前VTA与之前VTA之间不同的每个体素相关联。在一些示例中,如果临床评级量表分数相对于之前VTA增大,则疗效图的最近与VTA重叠的每个体素与或者新的临床评级量表分数或者临床评级量表分数的正变化量相关联。如果不再与当前VTA重叠的但是与之前VTA重叠的体素可以与对应于临床评级量表分数变化量的负值相关联。在一些示例中,处理器80可以将之前的临床评级量表分数与不再与VTA重叠的体素相关联。在临床评级量表分数已经减小的示例中,处理器80可以将与临床评级量表分数变化相对应的负值与最近与当前VTA重叠的体素相关联。
处理器80判定是否存在未经测试的治疗程序(124)。在一些示例中,对预定数量的治疗程序进行测试。例如,可以基于预定刺激参数值集合或治疗程序集合来确定向疗效图的体素指定的值。在一些示例中,预定治疗程序包括针对多个电极组合中的每个电极组合的至少一个刺激参数值集合。在一些示例中,待测试的预定治疗程序可以包括针对每个电极组合的多个刺激程序集合。例如,对于每个电极组合,导致近似于有可能激活有源电极周围的区域中的一个或多个神经元的最低总能量的总刺激能量的治疗程序以及导致近似于IMD 16能够产生的最大总能量的总刺激能量的第二治疗程序可以是预定治疗程序的一部分。通过确定覆盖治疗程序参数的范围的疗效图的每个体素的值,处理器80可能能够对在初始编程期间未测试的参数值插入疗效分数。
在其他示例中,可以对具有以预定增量值从低参数设置增大到高参数设置的刺激参数中的一个或多个刺激参数的治疗程序进行测试。可以对待测试的治疗程序中的每个治疗程序进行预定义。在一些示例中,可由临床医生经由编程器14输入程序。在一些示例中,处理器80可以通过移动通过刺激参数集合列表来判定是否存在未经测试的刺激参数集合。
如果存在未经测试的集合(框124的“是”分支),则处理器80生成针对不同刺激参数集合的新VTA(116),编程器14指导IMD 16根据新刺激参数集合向患者12施加电刺激(118),处理器80接收针对患者的指示根据新参数集合递送的电刺激治疗的效果的临床评级量表分数(120),并且处理器80将所述分数与疗效图的与VTA重叠的每个体素相关联(122)。可以重复此过程,直到已经对所述多个治疗程序中的每个治疗程序进行测试为止。
一旦已经对所述多个中的所有刺激参数集合进行了测试(框124的“否”分支),则处理器80基于与每个体素相关联的所述多个临床评级分数来生成所述体素的值以便创建CRSEM(126)。所述值描述了激活特定体素的临床效益。在一些示例中,所述值是临床评级量表分数的组合。例如,所述值可以是与体素相关联的临床评级量表分数的平均值。描述所述效益可以是所述分数的其他方法可以包括例如找出最大分数、最小分数、或每个体素的中值分数。描述所述效益的另一种方法可以是向体素指定作为临床评级量表分数的对数函数、指数函数、或其他非线性函数的值,从而使得,例如,与更高临床评级量表分数相关联的体素接收比仅与更低临床评级量表分数相关联的体素不成比例地更高的体素分数。CRSEM包括每个体素的值。CRSEM可以存储在疗效图信息98中。所存储的CRSEM稍后可用于(例如,使用关于图5而描述的技术)基于CRSEM生成所选治疗程序的估计临床评级量表分数。在一些示例中,所存储的CRSEM可以用于生成与可能的最高估计临床评级量表分数相对应的目标VTA。
在一些示例中,存储在疗效图信息98中的CRSEM用于生成针对患者的治疗程序的与用于生成CRSEM的临床量表评级分数不同的临床量表评级分数。在一些示例中,可以收集CRSEM信息作为研究的一部分并且可以将其与来自附加患者的CRSEM信息一起用于生成基线CRSEM以供用于其他患者。在一些示例中,CRSEM可以用于在针对用于生成CRSEM的相同患者的随访或附加编程对话期间生成估计的临床评级量表分数。
图7是流程图,展示了基于多个患者生成CRSEM以及基于CRSEM生成估计的临床评级量表分数的示例方法。如本文中所描述的,使用编程器14来生成CRSEM。然而,在其他示例中,可由另一个计算设备生成CRSEM,并且将其存储在编程器的疗效图信息98中。尽管关于CRSEM而进行了描述,但是图7的方法也可以用于生成不与特定临床评级量表相关联的疗效图。临床医生或其他用户从多个患者处收集临床评级量表分数和相应治疗程序(130)。在图7的方法用于生成不与临床评级量表相关联的疗效图的示例中,所收集的信息以其他某种方式量化治疗程序的疗效。例如,所述信息可以量化治疗程序之间的功能差异。对于每个临床评级量表分数/治疗程序组合,如编程器14的处理器80等处理器将所述分数与疗效图的与基于治疗程序生成的VTA重叠的每个体素相关联(132)。在一些示例中,可以使用如以上关于图4而讨论的一般电场模型来生成用于生成一般CRSEM的VTA。
处理器80组合每个体素的分数以便确定体素的值并创建CRSEM(134)。例如,处理器80可以通过确定每个体素的平均分数、中值分数、最大分数或最小分数来确定每个体素的值。在一些示例中,最大分数、最小分数和中值分数全部可以与体素相关联。CRSEM由每个体素的组合分数组成。在一些示例中,多个分数可以与特定体素相关联。例如,特定临床评级量表可以包括涉及特定疾病症状的子量表。每个体素可以具有整体临床评级量表分数,以及针对与其相关联的子量表中的每个子量表的分数。CRSEM可以存储在疗效图信息98中。
在生成CRSEM之后,处理器80针对刺激参数集合生成患者特定VTA(136)。可以根据以上关于图4而讨论的技术生成VTA。处理器80基于CRSEM针对VTA确定估计的临床评级量表分数(138)。在一些示例中,通过以下方式来确定估计的临床评级量表分数:将VTA的每个体素与CRSEM进行比较,以及然后基于与CRSEM的与VTA重叠的每个体素相关联的值来生成估计的临床评级量表分数。例如,可以通过将CRSEM的与VTA重叠的体素的值相加、对其求平均、或者找出其中的最大值或最小值来计算估计的临床评级量表分数。处理器80可以将估计的临床评级量表分数存储在存储器82中或者向另一个设备传输所述分数,或者两者。
在其他示例中,处理器80通过至少将基于特定治疗程序生成的VTA与目标VTA进行比较来确定估计的临床评级量表分数。目标VTA可以是导致来自CRSEM的可能的最高估计临床评级量表分数的VTA。可以基于患者特定VTA与目标VTA多么紧密地对准来确定患者特定VTA的估计临床评级量表分数。例如,如果患者特定VTA的某个比例的体素与目标VTA对准,则可以向患者特定VTA指定作为与目标VTA相关联的分数的此相同比例的分数。
在一些示例中,处理器80经由用户界面86的显示向用户显示估计的临床评级量表分数(140)。可以针对多个刺激参数集合中的每个刺激参数集合而重复生成患者特定VTA(136)和确定估计的临床评级量表分数(138)的步骤。在一些示例中,编程器可以显示单个估计的临床评级量表分数。所显示的估计临床评级量表分数可以是被测试的所述多个刺激参数集合中的每个刺激参数集合实现的最高分数。在一些示例中,可以连同估计的临床评级量表分数一起显示刺激参数集合。在一些示例中,可以向用户显示多个估计临床评级量表分数/刺激参数集合对。例如,还可以显示将多个子分数中的每个子分数最大化的刺激参数集合。在其他示例中,可以显示每个电极组合或电极组合的子集的最高估计临床评级量表分数。在一些示例中,为患者显示多个估计临床评级子分数分数/参数集合组合,所述患者可以基于患者最想要控制那个症状来在刺激参数之间进行选择。例如,患有帕金森病的患者可以在说话时选择一个程序,并且在行走时选择另一个程序。
图8是流程图,展示了显示基于兴趣解剖区域的分数和基于疗效图的疗效分数两者的示例技术。处理器80(例如,使用以上关于图4而讨论的技术)针对刺激参数集合确定VTA(142)。处理器80可以生成VTA的两个分数:指示VTA与兴趣解剖区域之间的重叠的分数;以及结合大脑的每个区域的功能并提供如可以使用疗效图来实现的生理上或者临床上有意义的数字的疗效分数。疗效分数可以是例如与如UPDRS、YBOCS、或HDRS等已知临床评级量表相关联的估计临床评级量表分数。在其他示例中,疗效分数可以指示刺激参数集合在治疗特定症状或患者病情时的相对疗效。
处理器80将VTA与存储在区域90中的兴趣解剖区域进行比较(144)。例如,可以基于患者病情选择所述区域。在其他示例中,可以基于引线20的位置选择所述区域。处理器80基于所述比较选择治疗程序的基于解剖结构的分数(146)。在一些示例中,所述分数可以是简单的加法/减法计算。对于VTA的与期望区域重叠的每个体素,处理器80可以将分数增大1个单位,并且对于与非期望区域重叠的每个体素,处理器80可以将分数减小1个单位。在某个示例中,增大/减小的量可能根据区域而变化。
处理器80还将VTA与疗效图进行比较(148)。疗效图将所述图的每个体素如何贡献于特定刺激治疗的整体疗效量化。在一些示例中,疗效图可以是CRSEM。处理器80基于所述比较确定治疗程序的疗效分数(150)。在疗效图是CRSEM的示例中,疗效分数可以是估计的临床评级量表分数。疗效图内的每个体素可以具有与其相关联的不同值。在一些示例中,单独值的组合可以基于疗效图特定算法。
编程器14可以向用户(比如,临床医生或患者)显示基于解剖结构的分数和疗效分数(152)。对基于解剖结构的分数和疗效分数的显示可以允许临床医生获得使用临床医生并不熟悉的评分系统的信心。此外,对两个分数的显示可以使临床医生能够依赖于使用仅显示一种类型或另一种类型的分数的编程器的以往经验。在一些示例中,处理器可以在向用户显示疗效分数的同时基于所述分数选择最有可能提供适当治疗的刺激程序。
图9是流程图,展示了使用目标VTA基于疗效图确定疗效分数的示例技术。处理器80基于存储在疗效图信息98中的疗效图生成目标VTA(156)。在一些示例中,之前可能已经生成了目标VTA,并且可能已经将其连同疗效图存储在疗效图信息98中。为了生成目标VTA,处理器80可以标识当针对疗效图而进行评分时导致相对高疗效分数(例如,如大于或等于所存储的疗效分数阈值的分数所指示的)的连续体积。在一些示例中,处理器80基于将各种因素考虑在内的算法来生成目标VTA。例如,所述算法基于用于生成目标VTA的电池电力的量来约束目标VTA。在其他示例中,当确定目标VTA时,可以向疗效图之外或者不具有所指定的值的体素给出负权重。在一些示例中,用于生成目标VTA的算法可以向具有大于某个阈值的值的体素给出附加权重。在一些示例中,可以基于关于疗效图之下的大脑区域的信息来约束此体积。例如,如果已知一个区域中的刺激将不会传播至大脑的另一个区域,则处理器80可以实施基于此信息限制边界的算法。用于生成目标VTA的算法可以尝试包括积疗效图的正面地影响整体疗效分数的许多体素,同时避免疗效图的负面地影响整体疗效分数的体素和/或与对整体疗效分数的正面或负面影响相关联的体素。在一些示例中,用于生成目标VTA的算法可以将目标VTA约束为可以使用与IMD 16相关联的治疗程序和电极配置来实现的形状。例如,目标VTA可以受可由当前编程到IMD 16内的治疗程序和电极配置实现的形状的约束。在一些示例中,目标VTA可以受更大的可用治疗程序和电极配置集合的约束。在一些示例中,可以不如此限制目标VTA,并且可能不可使用可由IMD 16实现的治疗程序来实现目标VTA。在一些示例中,处理器80还可以确定并保存目标VTA的疗效分数。
处理器80针对治疗程序生成VTA(158)。可以使用任何适当技术(包括以上关于图4而讨论的技术)来生成VTA。然后,处理器80将目标VTA与针对治疗程序的VTA进行比较(160)。处理器80可以使用任何适当技术来向目标VTA登记所生成的VTA,比如,通过至少部分地将所生成的VTA和目标VTA变换成共同坐标系,例如,由此将所生成的VTA与目标VTA对准。例如,编程器14可以根据需要旋转、缩放和转换目标VTA、所生成的VTA、或两者,以便将所生成的VTA和患者12的大脑28的预期位置与目标VTA的与这种位置相对应的部分基本上对准。处理器80基于所生成的VTA与目标VTA的比较来生成疗效分数(162)。在一些示例中,处理器80可以在逐体素的的层面上将目标VTA与所生成的VTA进行比较,并且生成指示了所生成的VTA与目标VTA多么紧密对准的分数。例如,处理器80可以确定两个VTA之间的重叠的百分比。在一些示例中,处理器80基于目标VTA与所生成的VTA之间的重叠的百分比来确定治疗程序的估计的临床评级分数。可以通过将百分比重叠乘以目标VTA的估计的临床评级分数来确定估计的临床评级分数。在一些示例中,处理器80可以确定所生成的VTA中在目标VTA内的体素的数量以及所生成的VTA中在目标VTA之外的体素的数量,并且可以针对目标VTA内的每个体素将基线分数增大某个单位并且可以针对目标VTA之外的每个体将基线分数减小某个单位。
处理器80可以确定指示了基于特定治疗程序生成的VTA与针对多个治疗程序的目标VTA多么紧密对准(例如,重叠)的值。处理器80可以将所述多个治疗程序的值进行比较,并且确定哪个治疗程序与目标VTA最紧密地对准。此治疗程序可以被考虑为最有效治疗程序,并且处理器80可以选择所述治疗程序用于对IMD 16进行的慢性治疗递送进行编程,或者用于对患者12进行进一步测试。在一些示例中,处理器80被配置成生成图形用户界面,所述图形用户界面呈现多个治疗程序(例如,通过标识符)和使用图9中所示出的技术来确定的对应值。
虽然以上描述的技术主要被描述为由IMD 16的处理器60或者编程器14的处理器80执行,但是在其他示例中,一个或多个其他处理器可以执行本文中单独地或者除了处理器60或处理器80之外描述的技术的任何部分。因此,对“处理器”的引用可以指“一个或多个处理器”。同样地,“一个或多个处理器”可以指在不同示例中的单个处理器或多个处理器。
可以至少部分地在硬件、软件、固件或其任何组合中实施本公开中所描述的技术,包括附属于IMD 16、编程器14或各种组成部件的技术。例如,可以在一个或多个处理器中实施技术的不同方面,包括一个或多个微处理器、DSP、ASIC、FPGA或任何其他等效集成或离散逻辑电路以及这种部件的任何组合,在如临床医生或患者编程器等编程器、医疗设备或其他设备中将这些部件具体化。
在一个或多个示例中,可以在硬件、软件、固件或其任何组合中实施在本公开中所描述的功能。如果是在软件中实施,那么所述功能可以作为一个或多个指令或代码被存储在计算机可读介质上并且由基于硬件的处理单元执行。计算机可读介质可以包括形成有形、非易失性介质的计算机可读存储介质。指令可以由一个或多个处理器执行,如一个或多个DSP、ASIC、FPGA、通用微处理器或其他等效集成或离散逻辑电路。因此,如本文中所使用的,术语“处理器”可以指上述结构或适合于实施本文中所描述的这些技术的任何其他结构中的任何结构中的一个或多个结构。
此外,在一些方面中,本文中所描述的功能可以在专用硬件和/或软件模块内提供。将不同的特征描绘成模块或单元旨在突显不同的功能方面并且不是必然地暗示这种模块或单元必须由单独的硬件或软件部件实现。而是,与一个或多个模块或单元相关联的功能可由单独的硬件或软件部件执行,或者集成在公共或单独的硬件或软件部件内。此外,可以在一个或多个电路或逻辑元件中完全实施所述技术。可以在宽范围的设备或装置中实施本公开的技术,包括IMD、外部编程器、IMD和外部编程器的组合、集成电路(IC)或IC集合、和/或驻留在IMD和/或外部编程器中的离散电路。
已经对本公开的多个不同示例进行了描述。这些实施例和其他实施例在以下权利要求书的范围内。
- 还没有人留言评论。精彩留言会获得点赞!