核磁共振引导直线加速器中的运动管理的制作方法
优先权要求
本专利申请要求
本公开涉及医疗系统,更具体地,涉及核磁共振或其他成像或放射治疗系统。
背景技术:
放射治疗(也被称作放射疗法)可用于癌症或其它疾病的治疗。在放射疗法中可以使用直线加速器(“linac”)以使放射束指向患者身上的期望的位置。直线加速器可以使光子(例如,作为x射线)、电子或其它亚原子粒子指向诸如癌性肿瘤的靶。例如,放射束可以通过使用多叶准直器而被成形为匹配肿瘤的形状(例如,多叶准直器可以包括可以彼此独立地移动以产生一个或更多指定的放射束形状的多个钨叶)。
由于健康细胞在指定的靶的放射治疗期间可能受到伤害或死亡,因此使对健康组织的放射最小化可能是期望的。医学成像可能有助于这种追求。可以使用诸如计算机断层摄影(ct)、荧光透视和核磁共振成像(“mri”或“mr成像”)的成像系统来确定(定位)或追踪靶的位置。与成像系统集成的放射治疗系统的示例可以包括mri-linac系统(诸如可用于mri引导放射治疗),其可被配置为在放射疗法中使用诸如肿瘤的靶的三维(3d)图像以在减少或最小化对其他组织的放射的同时向靶提供放射。
mri-linac系统可以包括加速器,诸如可以被配置为在围绕mri系统的环形台架上旋转。例如,待治疗的患者可以位于在mri-linac系统内居中的表面(例如,检查床、床或检查台)上。mri可以提供患者的组织中氢核的空间图,并且可以在二维(2d)平面或3d体积中获取图像。由于mri可以在不使用电离放射的情况下提供极好的软组织对比度,因此诸如肿瘤学家之类的医护人员可能喜欢mri-linac成像技术。
例如,在mri引导的linac中,可以期望在治疗期间对靶的靶位置和危及器官(oar)进行定位。这可以使得能够进行门控或追踪策略来补偿射束开启时的运动。在一些操作模式中,这可以通过采集顺序的2dmri切片来实现,例如交替的轴状、冠状和矢状切片。这些2d切片可以用于使用直接分割或配准技术直接推理3d靶运动。这些方法可能具有以下限制:1)可能存在显著的平面外运动,这可能难以利用2d切片进行定位;2)切片通常以靶为中心,使得难以同时追踪(多个)oar;以及3)在治疗期间仅收集2d切片中的信息,这使得难以执行剂量计算,例如,用于自适应放射疗法的剂量测定的离线回顾计算(剂量补偿利用随时间推移的患者解剖结构的完整3d信息)。
技术实现要素:
mr成像可以在放射治疗期间“实时”(例如,“在线”,“正在进行”或“连续”)进行,例如提供靶位置和运动信息,例如3d变形和/或3d旋转,用于放射束传送。待追踪的靶可以包括诸如前列腺的器官、或与器官全部或部分有关的肿瘤。在图像处理中,可以确定靶在运动的一种方式是如果靶的定位相对于其在图像中的背景而改变。用于定位、追踪或预测靶位置的图像处理技术可以包括图像减法,例如可以包括使用一个或更多绝对差,或者使用边缘、角落或关注区域(roi)图像特征检测。
在放射治疗期间对靶进行快速且准确的3d定位和追踪可能是重要的,以便考虑患者运动(例如,器官运动和/或肿瘤运动)。诸如3d变形和/或3d旋转的靶的运动,可以由一个或更多的来源,例如患者呼吸(例如,呼吸周期)、反射(例如咳嗽、放屁等)、有意或无意的患者运动或其他预期或意外的靶运动。
本公开描述了可以从一系列2dmri切片估计3d运动的技术。如下面详细描述的那样,这些技术可以包括两个主要阶段:1)学习阶段,其中构建将2d切片链接到3d运动的转换模型;以及2)追踪阶段,其中基于在学习阶段中构建的转换模型执行3d实时追踪。这些技术可以从2d切片估计全3d运动,以实时提供靶的当前变化,诸如靶的3d位置、3d变形和/或3d旋转中的一个或更多。
在一个示例中,本公开旨在提供一种控制患者的区域的至少一部分的实时图像引导自适应放射治疗的计算机实现的方法。所述计算机实现的方法包括:获取对应于包括所述区域的至少一部分的二维(2d)核磁共振成像(mri)图像的多个实时图像数据;对所述多个图像数据执行2d运动场估计;对三维(3d)运动场估计进行近似,包括将转换模型应用于2d运动场估计;基于所近似的3d运动场估计来确定所述区域的至少一部分的至少一个实时变化;并且使用所确定的至少一个变化来控制所述区域的至少一部分的治疗。
在一个示例中,本公开旨在提供一种用于控制患者的区域的至少一部分的实时图像引导自适应放射治疗的系统。所述系统包括治疗自适应系统以及治疗控制器电路。治疗自适应系统被配置为:获得对应于包括所述区域的至少一部分的二维(2d)核磁共振成像(mri)图像的多个实时图像数据;对所述多个图像数据进行2d运动场估计;对三维(3d)运动场估计进行近似,包括将转换模型应用于2d运动场估计;并且基于所近似的3d运动场估计来确定所述区域的至少一部分的至少一个实时变化。治疗控制器电路被配置为:使用所确定的至少一个变化来控制所述区域的至少一部分的治疗。
本概述是本申请的一些教导的概述,并不旨在作为本主题的排他或穷尽的治疗。关于本主题的进一步细节在具体实施方式和所附权利要求中找到。在阅读并理解以下具体实施方式并参见形成具体实施方式的一部分的附图之后,本发明的其它方案对于本领域技术人员将是显而易见的,其中每一个不被视为限制性的。本发明的范围由所附权利要求及其依照法律的等同物限定。
附图说明
在不一定按比例绘制的附图中,相同的附图标记可以在不同的视图中描述相似的构件。具有不同字母后缀的相同附图标记可以表示相似构件的不同实例。附图大体上通过举例而不是限制的方式示出本文档中讨论的各种实施例。这样的实施例是示例性的,并且不旨在作为本装置、系统或方法的穷尽性的或排他性的实施例。
图1a是能够用于实现本公开的各种技术的放射治疗装置的示例;
图1b是根据本公开的各种技术的可以用于提供实时图像引导的系统的部分的示例;
图2是示出可以用于构建可以将2d切片链接到先前获得的3d图像数据体积的转换模型的技术的示例的流程图;
图3是示出可以使用根据图2的流程图构建的转换模型来估计患者的实时3d图像的技术的示例的流程图;
图4示出了放射治疗系统的部分的示例。
具体实施方式
图1a示出根据本公开的一些实施例的诸如直线加速器10的放射治疗装置的示例。使用直线加速器10,患者42可以定位在患者台43上以接收由治疗计划确定的放射剂量。直线加速器10可以包括产生放射束46的放射头45。例如,整个放射头45可以是围绕水平轴线47可旋转的。在一个示例中,在患者台43的下面,例如可以设置可以诸如围绕等中心41与放射头45同步旋转的平板闪烁体检测器44。轴线47与放射头45产生的射束46的中心的交点可以称为“等中心”。患者台43可以被机动化,使得患者42可以被定位为使得肿瘤部位处于等中心41处或靠近等中心41。放射头45可围绕台架47旋转,例如按照治疗计划提供给患者42多种不同剂量的放射。
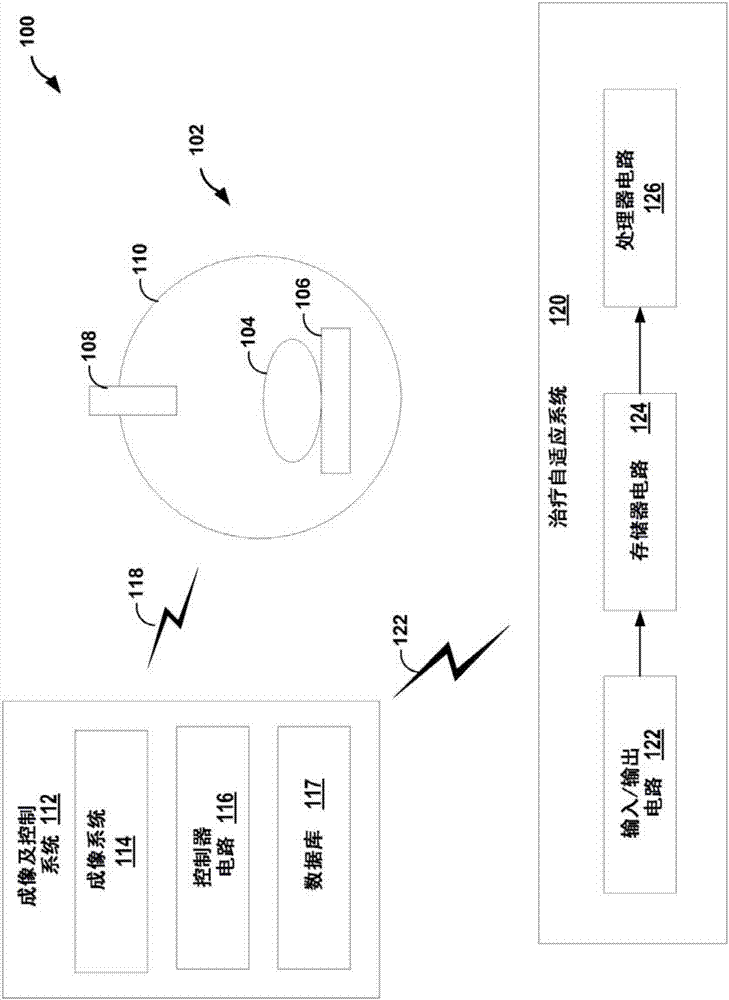
图1b是例如mri引导linac的可用于根据本公开的各种技术提供实时图像引导的成像或放射治疗系统100的部分的示例。更具体地,图1b的系统100可以使用实时获取的图像以实时地控制或适应性调整放射治疗治疗计划。系统100可以包括治疗装置102(例如,可以包括直线加速器(“linac”)的放射治疗装置)。
患者104可以定位在诸如检查床、检查台或其它表面的患者支撑件106上。例如,患者支撑件106可被构造为相对于治疗装置102的一个或更多其他组件改变位置,例如提升或改变患者104的纵向位置。可以从治疗放射源108(例如,诸如x射线或质子的加速粒子)朝向患者104照射放射线。在一个示例中,放射源108可以被构造为移动,例如通过使用旋转支撑件110(例如,台架)而围绕患者104旋转,治疗放射源108可附接到该旋转支撑件110。治疗放射源108可以被配置为例如通过使用可连接到治疗设备102和治疗放射源108的构件或机械臂进行诸如旋转的移动。实施例中的治疗设备102可以是直线加速器“linac”(例如,如关于图1a所示和所描述的),其可以被配置为使x射线束指向患者104的靶(例如,癌肿瘤)。
此外,系统102可以包括成像及控制系统112(例如,核磁共振成像(mri)机器),其包括成像系统114和治疗控制器电路116(在本公开中也被称为“控制器电路116”或“控制器116”),如闪电图标118所示(例如,闪电图标118可以是有线或无线连接),成像及控制系统112与治疗设备102通信。例如,成像及控制系统112还可以包括数据库117以存储所获取的图像。成像系统114可以包括可与治疗装置102组合使用的核磁共振成像(mri)机器(例如,提供mri直线加速器(“mri-linac”),mri装置可以是用于提供可用于控制或适应性调整患者104的治疗的成像信息。诸如计算机断层摄影(ct)系统的一个或更多的其它成像系统可附加地或替代地包括在系统102或成像系统114中,或者与系统102或成像系统114一起使用。
例如,成像系统114可以获取患者的三维(3d)图像。例如,在治疗计划阶段期间,诸如医师、护士、物理学家或技术人员的医护人员可以在治疗患者之前控制系统102例如经由成像系统114获取3d计划图像数据。该3d计划图像数据可用于确定患者关注区域(例如,靶)的精确位置。作为另一个例子,在治疗紧前,例如在获取3d计划图像之后若干天,医护人员可以控制系统102以获取可以在治疗期间使用的新的3d图像。另外,在患者104的治疗期间,成像系统114可以获取包括该区域的至少一部分的mri图像的多个一维(1d)线或二维(2d)切片或3d体积(当组合时可以形成该区域的3d图像)。
控制器116可以控制系统102的一个或更多方面。例如,控制器116可以例如经由患者支撑件106控制患者的位置,控制从放射源发射的放射剂量108,控制或适应性调整射束孔径形状以追踪靶,和/或控制放射源108的移动和/或定位。
如上所述,mri-linac系统可以具有其自己的控制器电路116来控制成像和直线加速器二者。然而,在成像系统114是ct系统的示例实现中,ct系统的控制器可能不控制直线加速器。因此,分立的控制器控制ct系统和直线加速器。
如闪电图标122所示,系统102可以包括与成像及控制系统112通信的治疗适应系统(tas)120。例如,tas120可以从mri或ct扫描接收先前获得的3d图像数据体积,其对应于由成像系统114获取的3d图像。tas可以包括用于接收和发送数据的输入/输出电路122,用于缓冲和/或存储数据的存储器电路124以及处理器电路126。可以是任何适当组织的数据存储设施的存储器电路124可以从成像及控制系统112接收图像数据。存储器电路124可以经由无线或有线连接通过常规数据端口接收图像数据并且还可以包括用于接收模拟图像数据的电路和用于数字化图像数据的模拟-数字转换电路。存储器电路124可以将图像数据提供给处理器电路126,处理器电路126可以在通用计算机上以硬件或软件或两者的组合来实现本发明的功能。在一个实施例中,处理器电路126可以是图形处理单元(gpu)。
如下文和根据本公开所详细描述的那样,例如,tas120可以例如使用mri从实时获取的一系列2d切片估计3d运动,以实时地适应性调整放射疗法治疗计划。在学习阶段,tas120可以构建转换模型,该转换模型将2d切片联系到例如使用mri或ct获取的先前获取的3d图像数据体积。在追踪阶段,tas120可以基于在学习阶段构建的转换模型执行3d实时追踪。tas120可以确定诸如靶的区域是否已经改变位置,然后将信息输出到成像及控制系统112,其可以允许治疗控制器电路116响应于所确定的位置改变来控制治疗。
图2是示出可以用于构建可以将2d切片联系到先前获得的3d图像数据体积的转换模型的技术的示例的流程图。图2的流程图可以表示其中tas120可以构建可以将2d切片联系到3d运动的转换模型的学习阶段。首先,tas120可以从成像及控制系统112获得一组获取的4d图像数据(框200)。可以使用mr或ct成像技术来获取图像数据。4d图像数据包括在一段时间内获得的3d图像数据体积。可选地,tas120可以使用来自学习阶段的4d图像数据来填充当tas120之后在追踪阶段期间使用2d切片时丢失的图像的任何部分。
从4d图像数据,tas120可以提取2d切片(框202)并且在诸如可以用作时间帧的端点的时间之间执行3d运动场估计(框204)。首先关于3d运动场估计(框204),为了量化4d图像数据200中的运动,tas120可以提取第一参考3d图像数据体积。由于3d图像数据体积随着时间改变,两个图像数据体积之间的变化可以表征为由变形向量场定义的变形。tas120可以通过例如计算变形向量场(dvf)来执行3d运动场估计,以找到每个连续的3d图像数据体积与参考3d图像数据体积之间的变形。在一些示例中,变形可以随时间的像素到像素(或体素到体素)变形,其中每个像素(或体素)可以具有限定其从一个3d图像到下一个3d图像的移动的变形向量,例如,如果患者具有非常小的钙化,则向量可以限定钙化如何移动。如果没有变形,所有像素(或体素)变形向量点都为空。如果存在变形,像素(或体素)变形向量指向各个方向。
在一个示例中,tas120的处理器电路126可以使用非线性配准技术来确定变形。在一个示例中,处理器电路126可以计算图像中的每个像素(或体素)的dvf。在一个示例中,处理器电路126可以计算诸如分割的或其他图像中的例如针对靶或危及器官的关注区域中像素(或体素)的dvf。在一些情况下,为了缩减计算复杂度,tas120可以使用刚性配准而不是可形变配准。
在tas120计算dvf之后,tas120具有描述器官如何在呼吸期间移动(例如平移和/或旋转、和/或变形)的一组dvf。这一组dvf可以包含大量信息,这在计算上难以处理。为了简化计算,必要时,tas120的处理器电路126可以缩减该组dvf的维度。
首先,tas120的处理器电路126可以将降维技术应用于dvf。如图2所示,降维技术可以包括将主成分分析(pca)应用于3d运动场数据(框206)。pca应用于dvf得到一组定义向量的主成分或系数。然后,使用诸如预定义的变化量、或重构变形场的预定义的期望精度的预定义准则,tas120可以通过从该组主成分中选择一个或更多个pca成分来降低维度(框208)。在一个示例中,精度可以被定义为重构变形场与由配准给出的变形场之间的差的度量。
降维技术不限于使用pca。降维技术的其他非限制性示例包括独立成分分析(ica)、核主成分分析、典型相关分析、局部线性嵌入(lle)、hessianlle、拉普拉斯特征映射、局部切空间排列、最大方差延展和最大信息维度。
如上所述,tas120可以从4d图像数据体积提取2d切片(框202)。与对3d图像数据体积一样,tas120可以通过例如计算dvf来执行2d运动场估计以找到连续的2d图像数据(2d切片)之间的变形(框210)。
在一些示例中,tas120可以选择4d图像数据体积内的任意切片。在其他示例中,tas120可以确定和选择诸如矢状面、轴状面、冠状面、例如具有最多运动信息的平面的取向,并且从该平面或其他取向选择切片。与具体mri切片相关联的“平面”不需要是严格的平面,并且可以包括某些曲率,例如由于mri失真伪影,或者已经至少部分地补偿mri失真的切片。例如,tas120可以在三个平面上训练,并确定哪个平面提供更好的3d运动预测。在一些示例中,tas120可以在三个正交方向上从平面中选择切片,并计算那些平面中各个平面的dvf。
在tas120计算2d图像数据的dvf之后,tas120具有一组dvf。为了简化计算,tas120的处理器电路126可以通过对dvf应用降维技术来缩减该组dvf的维度。降维技术可以包括tas120将pca应用于2d运动场数据(框212)以生成一组主成分。然后,使用预定义的准则,例如预定义的差异性的量或重构变形场的预定义的期望精度,tas120可以通过从该组主成分中选择一个或更多pca成分来缩减维度(框214)。
例如,在pca分析期间,tas120可以确定主要成分变化。作为具体示例,第一主成分可以是最大的并且可以解释75%的差异性,第二主成分可以解释10%的差异性。如果预定义的差异性的量为85%,则tas120可以选择第一主成分和第二主成分。
在一个示例中,精度可以被定义为重构变形场与由配准给出的变形场之间的差的度量。
在tas120可选地缩减3d运动场pca和2d运动场pca两者的维度之后,tas120的处理器126可以产生在2dpca成分与3dpca成分之间建立关系或者联系2dpca成分与3dpca成分的多变量多维函数f。例如,该函数f可以是在包含变形向量场的3dpca成分的y列与包含2dpca成分的x列之间的线性回归,如下所示:
其中yij是3dpca中i时间序列的以主成分为基础的j坐标,
xij是2dpca中i时间序列的以主成分为基础的j坐标,
m是时间序列中的样本数,
n是3dpca的成分的数量,
p是所考虑的切片的2dpca的成分的数量。
线性回归可以通过以下示出:
其中j是对于所有时间序列的3dpca中的j分量的坐标,
β是回归系数的向量。
在一些示例中,线性回归技术是主成分回归。虽然描述了线性回归技术,但是可以使用任何类型的回归分析,例如一种或更多种非线性回归技术。该过程不限于线性回归,例如f是多变量多元函数。
一旦tas120计算了该函数f(框216),则tas可以计算将2d切片联系到3d运动的模型(在框218处)。该模型可以包括2dpca和3dpca的成分以及将它们联系起来的函数f。
在追踪阶段期间,tas120可以获得任意取向的2d切片,例如矢状的、矢状-轴状的、矢状-轴状-冠状的,只要切片与在学习阶段期间使用的切片位于相同的解剖位置。然后,tas120可以计算所获得的图像数据的pca,并使用模型将图像数据映射回来,以查看完整3d运动的估计应该如何。
在一些示例中,可以由一组4dmri数据构建学习阶段中的模型。在一些这样的示例中,可以从更早时或刚好在治疗之前获取的相位或振幅分箱的4dmri扫描获得该组4dmri数据。可以在多个呼吸周期中获得图像数据,其中单个呼吸周期包括多个部分,并且tas120可以使用相似部分中的图像数据的集中趋势来生成至少两个3d图像数据体积。例如,呼吸周期可以分箱,并且tas120可以通过从不同呼吸时期的相同箱中获取信息来生成3d图像。以这种方式,tas120可以产生多个呼吸周期中平均的4d图像。
在其他示例中,可以从一系列快速3dmri扫描获得4dmri数据。在一些情况下,例如,如果4d图像数据不可用,则可以从静态3dmri图像来模拟4dmri数据,例如使用一些诸如对运动动力学进行建模的附加假设。
图3是示出可以用于使用根据图2的流程图构建的转换模型来估计患者的实时3d图像的技术的示例的流程图。图3的流程图表示实时追踪阶段,其中tas120可以对3d运动场估计进行近似,包括将转换模型应用于2d运动场估计,并且基于所近似的3d运动场确定靶或区域的至少一部分的诸如3d位置、3d变形、和/或3d旋转的至少一个实时变化。
在图3中,tas120可以获得对应于诸如2dmri切片的2d图像的多个实时图像数据(框300)。在一些示例中,数据图像可以包括靶的至少一部分。例如,tas120可以通过估计实时dvf(并且因此估计患者的实时3d图像)来对多个图像数据执行2d运动场估计,以找出诸如2d切片的连续2d图像数据之间的变形(框302)。接下来,tas120可以对3d运动场估计进行近似,其可以包括将转换模型应用于2d运动场估计。例如,tas120可以计算刚获得的诸如2d切片的2d图像数据的2dpca(框304)。使用通过联系2dpca与3dpca的函数f所估计的转换模型(框306),tas120可以估计3dpca成分(框308)。使用估计的3dpca成分,tas120可以近似患者区域的实时3d运动场估计(框310),并且由此估计诸如危及器官的靶的运动(框312)。
在一些示例中,tas120可以确定在治疗期间对患者成像的2d切片的最佳取向和位置。例如,tas120可以确定包含每个3dpca成分的最大信息的子空间。该子空间可以包含与3d图像数据体积最相关的变形信息,并且该变形信息提供最准确的运动预测。使用该变形信息,tas120可以自动选择用于选择2d切片的最佳取向。
在一些示例中,tas120可以实现2dpca成分的实时估计。例如,tas120可以执行可以直接估计2dpca中当前切片的坐标的优化处理,而不计算2d切片之间的可变形配准,这将产生将当前切片变形到模型切片的最佳坐标。
通过确定靶的估计运动,tas120可以通过如果该区域的至少一部分在预定义的空间门控窗口之外则准确地门控治疗来控制治疗。此外,tas120可以通过控制治疗递送装置的发出的放射线方向来追踪该区域以控制治疗。
应当注意,虽然技术被描述为受检者特异性的,但是本公开的技术可以扩展到一般的统计3dpca。在这种情况下,可以在若干个受检者上确定在学习阶段确定的3dpca。
在实时追踪之前,期望tas120在预处理阶段执行预对准,以确保从其确定转换模型的原始获取的4d图像数据与患者的当前位置对准。可以期望确保在追踪阶段期间使用的切片与在学习阶段期间使用的切片相同。例如,如果4d图像数据是在前一天获取的,则可能发生失配。
在预对准动作中,tas120可以确定对于在第一时间(例如,第一天的学习阶段)的第一患者分次(治疗)与第二时间(例如,第二天的追踪阶段)的第二患者分次(治疗)之间的患者移动的校正。tas120可以执行3dpca与当前患者的刚性对准。在学习阶段的非线性配准的情况下,tas120可以通过各种重新定向策略来校正3dpca成分。在一个示例中,tas120可以基于在建模阶段期间使用的切片确定在追踪阶段期间使用哪些切片以确保一致性。
图4示出了例如mri引导的linac的放射治疗系统400的部分的示例。放射治疗系统400可以包括治疗系统402、成像系统412和终端用户界面434。治疗系统402可以包括治疗装置,例如治疗装置可以包括直线加速器(“linac”)。直线加速器可以被配置为向患者408递送放射治疗。患者408可以定位在诸如检查床、检查台或其它表面的患者支撑件410上。患者支撑件410可以被构造为例如相对于linac的一个或更多其他组件改变位置,例如提升或改变患者408的纵向位置。在一个示例中,患者支撑件410可被构造被机动化,使得患者408可以被定位为使得靶处于治疗设备的中心处或靠近治疗设备的中心。
可以从放射源406朝向患者408发射放射线。在一个示例中,放射源406可以被构造为移动,例如通过使用放射源406可被附接到的旋转支撑件404(例如,台架或机械臂)而围绕患者408旋转。放射源406可以被配置为将x射线(或其他粒子)束指向患者408的靶(例如,癌肿瘤)。放射源406可以被配置为旋转,从而例如根据治疗计划向患者408提供多个放射剂量(例如,不同的剂量)。
成像系统412可以包括可与治疗系统402一起使用的诸如核磁共振成像(mri)机器的成像装置414(例如,以提供mri直线加速器(“mri-linac”))。mri装置可以用于提供可用于确定患者408中的靶的位置的成像信息,例如将放射治疗指向到患者408的诸如靶的指定位置。成像系统412可以附加地或替代地包括计算机断层摄影(ct)系统或另一像系统。成像系统412可以包括一个或更多传感器416。一个或更多传感器416可以包括平板检测器(例如,x射线检测器),例如平板检测器可以布置成与x射线源相对。成像系统412可以包括一个或更多输入418、一个或更多输出420、处理器电路422、存储器电路424、数据库426、通信电路428、计时器电路430和控制器电路432。
例如,成像系统412可以获取患者408的具有至少三个维度(例如,3dmr参考图像或4dmr参考图像)的参考图像(例如,治疗计划图像)。在一个示例中,可以由成像系统获取关于3dmr参考图像的信息。3dmr参考图像可以用于确定患者的关注区域(例如,靶)的位置。在一个示例中,在患者408的治疗分次期间,成像系统412可以获取多个一维(1d)线、二维(2d)切片或投影图像、3dmr图像(例如,体积的3d图像)、或4dmr图像(例如,随着时间的推移的一系列3dmr图像)。
治疗系统402可以通信地联接到成像系统412和终端用户界面434。成像系统412可以包括或者可通信地联接到终端用户界面434。这种通信联接可以包括使用一个或更多通信链路(例如,通信链路438),诸如可以包括有线或无线发射器、接收器或收发器电路(例如在通信链路的每一端)、通信总线、通信网络或计算机网络。
处理器电路422可以被配置为确定关于患者408中靶的定位(例如,位置)的信息。例如,在患者408的分次放射治疗期间,输出420可以被配置为将诸如关于靶的位置的信息提供到诸如治疗系统402。终端用户界面434可以被诸如放射肿瘤学家、放射剂量测试员或放射治疗师(例如,技师)的医护人员使用。在一个示例中,终端用户界面434可以包括音频/视觉指示器(例如,监视器)。控制器电路432可以被配置为控制成像系统412的一个或更多方面。在一个示例中,控制器电路432可以控制成像设备414的梯度线圈的使用或操作,以便指定实时2dmr图像切片的取向。存储器电路424可以将信息提供到处理器电路422,处理器电路422可以在通用计算机上以硬件或软件或两者的组合来实现本文描述的技术。在一个示例中,处理器电路422可以包括图形处理单元(gpu)。
此外,该文件描述了将转换模型应用于2d靶或oar运动估计以获得估计的3d靶或oar运动估计,用于3d运动估计的一个或更多其它技术可以与本文所述的技术结合。例如,本公开中描述的各种技术的一个或更多方案可以与以下美国专利申请中描述的一个或更多方案相结合,其全部内容通过引用并入本文中:1)于2014年12月10日提交的题目为“magneticresonanceprojectionimaging”(“核磁共振投影成像”)的序列号为62/090,115的美国专利申请(代理人案卷号4186.006prv);2)于2014年10月27日提交的题目为“realtimeorganmotionpredictionduetobreathingformri-linac”(“对于核磁共振直线加速器的由于呼吸导致的实时器官运动预测”)的序列号为62/069,066的美国专利申请(代理人案卷号4186.003prv);3)于2014年12月9日提交的题目为“magneticresonanceimagingtargetlocalization”(“核磁共振成像靶定位”)的序列号为62/089,482的美国专利申请(代理人案卷号4186.009prv);4)于2014年10月27日提交的题目为“mri-linacreal-timeimageguidancetechniques”(核磁共振直线加速器实时图像引导技术)的序列号为62/069,145的美国专利申请(代理人案卷号4186.005prv)。
补充注释
示例1包括控制患者区域的至少一部分的实时图像引导自适应放射治疗的主题(例如方法、用于执行动作的装置、包括当由机器执行时使机器执行动作的指令的机器可读介质(例如计算机可读介质)、或配置为执行的设备),所述方法包括:获取对应于包括所述区域的至少一部分的二维(2d)核磁共振成像(mri)图像的多个实时图像数据;对所述多个图像数据执行2d运动场估计;对三维(3d)运动场估计进行近似,包括将转换模型应用于2d运动场估计;基于所近似的3d运动场估计来确定所述区域的至少一部分的至少一个实时变化;并且使用所确定的至少一个变化来控制所述区域的至少一部分的治疗。
在示例2中,示例1的主题可以可选地包括:使用转换模型,其中转换模型由以下指定:在第一时间帧期间获得至少两个3d图像数据体积,所述至少两个3d图像数据体积包括所述区域的至少一部分;对在第一时间帧期间获得的至少两个3d图像数据体积执行3d运动场估计;在第一时间帧期间获得与至少两个2d图像对应的2d图像数据,所述2d图像数据包括区域的至少一部分;对在第一时间帧期间获得的2d图像数据执行2d运动场估计;并且使用缩减的3d运动场和2d运动场来确定转换模型。
在示例3中,示例2的主题可以可选地包括,其中执行3d运动场估计和执行2d运动场估计中的至少一个包括计算变形向量场。
在示例4中,示例2和3中的一个或更多的主题可以可选地包括,缩减估计的3d运动场和估计的2d运动场中的至少一个的维度。
在示例5中,示例4的主题可以可选地包括执行主成分分析以确定多个主成分;并且其中缩减估计的3d运动场和估计的2d运动场中的至少一个的维度包括基于预定准则选择主成分中的至少一个。
在示例6中,示例2至5中的一个或更多的主题可以可选地包括,使用缩减的3d运动场和2d运动场来确定转换模型包括执行主成分回归。
在示例7中,示例1至6中的一个或更多的主题可以可选地包括,其中控制治疗包括:如果区域的至少一部分在预定义的空间门控窗口之外,则对治疗进行门控。
在示例8中,示例1至7中的一个或更多的主题可以可选地包括,其中控制治疗包括:控制治疗递送装置的发射的放射线方向以追踪区域。
在示例9中,示例1至8中的一个或更多的主题可以可选地包括:确定对在第一时间的第一患者分次与第二时间的第二患者分次之间的患者移动的校正。
在示例10中,示例2至9中的一个或更多的主题可以可选地包括,其中在第一时间帧期间获得至少两个3d图像数据体积包括:在多个呼吸周期中获得图像数据,其中单个呼吸周期包括多个部分;并且使用相似部分中的图像数据的集中趋势来生成所述至少两个3d图像数据体积。
在示例11中,示例1至10中的一个或更多的主题可以可选地包括,其中至少一个实时变化包括至少一个实时3d变形。
在示例12中,示例1至11中的一个或更多的主题可以可选地包括,其中至少一个实时变化包括至少一个实时3d位置。
在示例13中,示例1至12中的一个或更多的主题可以可选地包括,其中至少一个实时变化包括至少一个实时3d旋转。
示例14包括用于控制患者区域的至少一部分的实时图像引导自适应放射治疗的主题(例如装置、设备、系统、或机器),包括:治疗自适应系统,其被配置为:获得对应于包括所述区域的至少一部分的二维(2d)核磁共振成像(mri)图像的多个实时图像数据;对所述多个图像数据进行2d运动场估计;对三维(3d)运动场估计进行近似,包括将转换模型应用于2d运动场估计;基于所近似的3d运动场估计来确定所述区域的至少一部分的至少一个实时变化;以及治疗控制器电路,其被配置为:使用所确定的至少一个变化来控制所述区域的至少一部分的治疗。
在示例15中,示例14的主题可以可选地包括,其中治疗自适应系统被配置为:使用转换模型,其中转换模型由以下指定:在第一时间帧期间获得至少两个3d图像数据体积,所述至少两个3d图像数据体积包括区域的至少一部分;对在第一时间帧期间获得的至少两个3d图像数据体积执行3d运动场估计;在第一时间帧期间获得与至少两个2d图像对应的2d图像数据,所述2d图像数据包括区域的至少一部分;对在第一时间帧期间获得的2d图像数据执行2d运动场估计;并且使用缩减的3d运动场和2d运动场来确定所述转换模型。
在示例16中,示例15的主题可以可选地包括,其中执行3d运动场估计和执行2d运动场估计中的至少一个包括计算变形向量场。
在示例17中,示例15和16中的一个或更多的主题可以可选地包括,其中治疗自适应系统被配置为:缩减估计的3d运动场和估计的2d运动场中的至少一个的维度。
在示例18中,示例17的主题可以可选地包括,其中治疗自适应系统被配置为:执行主成分分析以确定多个主成分;并且其中,治疗自适应系统配置为缩减估计的3d运动场和估计的2d运动场中的至少一个的维度包括基于预定义准则选择主成分中的至少一个。
在示例19中,示例15至18中的一个或更多的主题可以可选地包括,其中所述治疗自适应系统配置为使用缩减的3d运动场和2d运动场来确定转换模型包括执行主成分回归。
在示例20中,示例14至19中的一个或更多的主题可以可选地包括,其中配置成控制治疗的治疗控制器电路被配置为:如果区域的至少一部分在预定义的空间门控窗口之外,则对治疗进行门控。
在示例21中,示例14至20中的一个或更多的主题可以可选地包括,其中被配置为控制治疗的治疗控制器电路被配置为:控制治疗递送装置的发射的放射线方向以追踪区域。
在示例22中,示例14至21中的一个或更多的主题可以可选地包括,其中治疗自适应系统被配置为:确定对于在第一时间的第一患者分次与第二时间的第二患者分次之间的患者移动的校正。
在示例23中,示例15至22中的一个或更多的主题可以可选地包括,其中被配置为在第一时间帧期间获得至少两个3d图像数据体积的治疗自适应系统被配置为:在多个呼吸周期中获得图像数据,其中单个呼吸周期包括多个部分;并且使用相似部分中的图像数据的集中趋势来生成所述至少两个3d图像数据体积。
在示例24中,示例14至23中的一个或更多的主题可以可选地包括,其中至少一个实时变化包括至少一个实时3d变形。
在示例25中,示例14至24中的一个或更多的主题可以可选地包括,其中至少一个实时变化包括至少一个实时3d位置。
在示例26中,示例14至25中的一个或更多的主题可以可选地包括,其中至少一个实时变化包括至少一个实时3d旋转。
上述详细描述包括对于构成详细描述的一部分的附图的参考。附图通过图示的方式示出了可以实施本发明的具体实施例。这些实施例在本文中也称为“示例”。这样的示例可以包括除了所示出或所描述的元件之外的元件。然而,本发明人还预期到仅提供所示出或所描述的那些元件的示例。
此外,或者关于本文中示出或描述的特定示例(或其一个或更多方案),或者关于本文中示出或描述的其它示例(或其一个或更多方案),本发明人还预期到使用所示出或所描述的那些元件(或其一个或更多方案)的任何组合或排列的示例。
本文件中提及的所有出版物、专利和专利文献通过引用整体并入本文,如同通过引用单独并入。如果本文献与通过引用并入的那些文献之间的用法不一致,则引用的参考文献中的用法应被视为对本文档的补充;对于不可调和的不一致,则以本文件中的用法为准。
在本文献中,使用了术语“a”或“an”,如专利文件中常用的,其包括一个或多于一个,独立于“至少一个”或“一个或更多”的任何其它实例或用途。在本文献中,术语“或”用于表示非排他性的“或”,除非另有说明,否则“a或b”包括“有a没有b”、“有b没有a”、以及“a和b”。在本文献中,术语“包括”和“其中(inwhich)”用作各个术语“包括”和“其中(wherein)”的通俗易懂的等效。此外,在下列权利要求中,术语“包括”是开放式的,即,包括除了在权利要求中的这样的术语之后列出的那些元件之外的元件的设备、系统、装置、物品、构成、构想或过程仍被视为落入该权利要求的范围。此外,在下面的权利要求中,术语“第一”、“第二”和“第三”等仅用作标记,并不意图对其对象施加数值要求。
本文描述的方法示例至少部分地可以是机器或计算机实现的。一些示例可以包括编码有指令的计算机可读介质或机器可读介质,该指令可经操作以配置电子装置来执行如上述示例中所描述的方法。这些方法的实现可以包括例如微代码、汇编语言代码、更高级语言代码等的代码。这样的代码可以包括用于执行各种方法的计算机可读指令。这种代码可以形成计算机程序产品的一部分。此外,在一个示例中,例如在运行期间或在其它时间,代码可以有形地存储在一个或更多易失性、非暂时性、或非易失性有形计算机可读介质上。这些有形的计算机可读介质的示例可以包括但不限于硬盘、可移动磁盘、可移动光盘(例如,压缩光盘和数字视频盘)、磁带、存储卡或存储棒、随机存取存储器(ram)、只读存储器(rom)等。
以上描述旨在是说明性的而不是限制性的。例如,上述示例(或其一个或更多方案)可以彼此组合使用。例如本领域普通技术人员在阅读上述描述时可以使用其它实施例。提供摘要以允许读者快速确定技术公开的实质。提交时应该理解是:它不会用于解释或限制权利要求的范围或含义。另外,在上述具体实施方式的说明书部分中,各种特征可以被分组在一起以简化本公开。这不应解释为一种使不要求保护的公开的特征对于任一权利要求都是必要的意图。相反,本发明的主题可以少于公开的特定实施例的全部特征。因此,以下权利要求书作为示例或实施例并入具体实施方式中,其中每个权利要求自身独立地作为单独的实施例,并且认为这些实施例可以以各种组合或排列彼此组合。本发明的范围应参照所附权利要求以及这些权利要求赋权的等同形式的全部范围来确定。
- 还没有人留言评论。精彩留言会获得点赞!