涉及增生性疾病的组合物和方法与流程
相关申请的引用
本申请要求2014年12月3日提交的序列号为62/087,023美国临时申请的优先权,该临时申请的全部内容以引用的方式纳入本文。
本申请总体上涉及用于抑制异常增生的细胞的方法和组合物。根据具体的方面,本发明的方法和组合物涉及在体外和体内检测和影响选择性翻译选择性翻译。
背景技术:
癌症的特征为上皮、结缔组织、血液和淋巴细胞以及其他罕见细胞类型(例如神经胶质瘤)的异常、加速生长,其需要扩散到远距离器官并导致患者过早死亡的潜能。在2014年,将诊断出约170万个新的癌症病例,并且585700名美国人将死亡,相当于每天近1600名患者。今年,癌症将成为仅次于心脏病的美国第二常见的死亡原因,几乎占每4例死亡中的1例。持续需要涉及增生性疾病(包括癌症)的治疗的组合物和方法。
技术实现要素:
本发明一方面提供了治疗患者的增生性疾病的方法,包括给予患者治疗有效量的选择性翻译(set)治疗剂。本文使用的术语“set治疗剂”是指与选择性翻译(set)复方药物相结合的细胞毒性剂,其与可药用载体或赋形剂一起被递送。根据本发明的方面,将set治疗剂给予需要其的患者以预防和/或治疗多种肿瘤性疾病(neoplasticdisorder),例如癌症,特别是耐药性癌症和/或转移癌。
set复方药物包括set响应的激动剂(set激动剂)和set核糖体的拮抗剂(set核糖体拮抗剂)。
可用该药物结合物治疗和/或预防的非限制性的代表性癌症包括耐药性结肠直肠癌、乳腺癌、淋巴瘤、白血病、黑色素瘤和前列腺癌。可用成对结合的或作为复方药物(例如cmf、fec、folfiri、capoxiri、xeliri、capox、xelox、capoxiri)的一部分的set治疗剂(包含卡培他滨(capecitabine)或5-fu/甲酰四氢叶酸(leucovorin))治疗的癌症的非限制性列表包括转移性乳腺癌、转移性结肠和直肠癌、胰腺癌、肛门癌、胃和食管癌、胆管和胆囊癌、胆管癌(cholangiocarcinoma)、肝细胞癌、神经胶质瘤、室管膜瘤、卵巢子宫内膜和宫颈癌、膀胱癌、转移性肾细胞癌、非小细胞肺癌、头颈癌、鼻咽癌、光化性(日光)角化病和一些类型的基底细胞癌(博温氏病(bowen’sdisease)。可用成对结合的或作为复方药物(例如tch、tc、ac、tip、tpf)的一部分的set治疗剂(包含紫杉醇(paclitaxel)或多西他赛(docetaxel))治疗的癌症的非限制性列表包括乳腺癌、卵巢癌、前列腺癌、睾丸癌、非小细胞肺癌、小细胞肺癌、头颈癌、卡波西肉瘤、胰腺癌、胆道癌、膀胱癌、子宫内膜癌和胃癌。可用成对结合的或作为复方药物(例如folfiri、capoxiri和xeliri)的一部分的set治疗剂(包含伊立替康(irinotecan)或托泊替康(topotecan))治疗的癌症的非限制性列表包括转移性结肠直肠癌、转移性卵巢癌、iv-b期复发性或持续性宫颈癌、小细胞肺癌、间变性星形细胞瘤、混合型恶性神经胶质瘤、少突神经胶质瘤、非小细胞肺癌、小细胞肺癌、成神经细胞瘤、乳腺癌、白血病和淋巴瘤,其作为单一疗法或与其他药物结合。可用成对结合的或作为复方药物(例如folfox、capox、xelox和capoxiri)的一部分的set治疗剂(包含奥沙利铂(oxaliplatin))治疗的癌症的非限制性列表包括胰腺腺癌、壶腹和壶腹周围癌、肛门腺癌、阑尾癌、转移性结肠和直肠癌、卵巢癌、食管癌、胃癌、小肠癌、睾丸癌、慢性淋巴细胞白血病、非霍奇金淋巴瘤、周围t细胞淋巴瘤、大b细胞淋巴瘤和胆囊癌。可用成对结合的或作为复方药物(例如ac、ap、cmf和fec)的一部分的set治疗剂(包含环磷酰胺(cyclophosphamide))治疗的癌症的非限制性列表包括乳腺癌、成神经细胞瘤(弥散性疾病)、视网膜母细胞瘤、卵巢腺癌、恶性淋巴瘤(annarbor分期系统的iii和iv期)、霍奇金病、淋巴细胞性淋巴瘤(结节性或弥散性)、混合细胞型淋巴瘤、组织细胞性淋巴瘤、伯基特淋巴瘤、多发性骨髓瘤、慢性淋巴细胞白血病、慢性粒细胞性白血病、急性骨髓性和单核细胞性白血病、儿童的急性成淋巴细胞(干细胞)白血病。
tch:紫杉醇、卡铂(carboplatin)和曲妥珠单抗(trastuzumab);tc:多西他赛和环磷酰胺;ac:多柔比星(doxorubicin)和环磷酰胺;tac:多西他赛和多柔比星;ap:紫杉醇和多柔比星以及环磷酰胺(cytoxan)500mg/m2ivdl;tip:紫杉醇、异环磷酰胺(ifosfamide)和顺铂(cisplatin);tpf:多西他赛、顺铂和氟尿嘧啶(fluorouracil)(5-fu);gtx:吉西他滨(gemcitabine)、卡培他滨和多西他赛;cmf:环磷酰胺、甲氨蝶呤(methotrexate)和5-fu;fec:5-fu、表柔比星(epirubicin)和环磷酰胺;xelox(也称为capox):与奥沙利铂结合的卡培他滨;xeliri:与伊立替康结合的卡培他滨;capoxiri:卡培他滨、奥沙利铂和伊立替康;fl(也称为mayo):5-fu和甲酰四氢叶酸(亚叶酸);folfox:5-fu/、甲酰四氢叶酸和奥沙利铂;folfiri:5-fu、甲酰四氢叶酸和伊立替康(若干药物,例如单克隆抗体,有时被添加至folfiri);gtx:吉西他滨、卡培他滨和多西他赛;pexg:盐酸吉西他滨、顺铂、盐酸表柔比星和卡培他滨;folfirinox:5-fu、甲酰四氢叶酸、伊立替康和奥沙利铂;ecf:表柔比星、顺铂和5-fu;tpf:多西他赛、顺铂和5-fu。
已知给予药物结合物tch、tc、ac、tac、ap、tip、tpf、gtx、cmf、fec、xelox、xeliri、capoxiri、fl、folfox、folfiri、gtx、pexg、folfirinox、ecf、tpf的治疗法可与给予受试者set治疗剂结合使用,或根据受试者的特征和待治疗疾病的临床评估而改变。
一方面,set治疗剂包括细胞毒性剂,包括在患者体内被转化为5-氟尿嘧啶(5-fu)的化合物。卡培他滨是在患者体内被转化为5-fu的细胞毒性剂的实例。
根据本发明的方面,细胞毒性剂包括以下物质中的一种或多种:卡培他滨、5-fu/甲酰四氢叶酸、紫杉醇、多西他赛、环磷酰胺、托泊替康、伊立替康和奥沙利铂。
根据本发明的方面,所包含的set激动剂为以下物质中的一种或多种:佛波酯、佛波酯衍生物、苔藓抑素(bryostatin)和聚氧乙烯氢化蓖麻油。
根据本发明的方面,所包含的set核糖体拮抗剂为茴香霉素(anisomycin)、放线菌酮(cycloheximide)和/或依米丁(emetine)。
根据本发明的方面,提供了在用细胞毒性剂治疗的受试者中增强细胞毒性剂功效的方法。在这方面,set复方药物刺激细胞周期进程并在促使细胞死亡的细胞毒性损伤之后阻止耐药肿瘤的恢复。
根据本发明的方面,将set复方药物与细胞毒性剂同时给予。根据本发明的方面,在与给予患者细胞毒性剂的时间不同的时间给予set复方药物。此外,任选地一起或分开给予set复方药物的set激动剂和set核糖体拮抗剂组分,并且其与细胞毒性剂一起给予或分开给予。在一个优选的方面中,在给予set复方药物之前给予细胞毒性剂。
根据本发明的方面,其中在与给予患者细胞毒性剂的时间不同的时间给予set复方药物,优选地在给予细胞毒性剂之后10分钟、30分钟、1小时、2小时、3小时、4小时、8小时、12小时、24小时、48小时、72小时、4天、5天、6天或7天之内给予set复方药物。当将set复方药物的set激动剂和set核糖体拮抗剂组分彼此分开给予时,优选地将它们在彼此的10分钟、30分钟、1小时、2小时、3小时、4小时、8小时、12小时、24小时、48小时、72小时、4天、5天、6天或7天之内给予。
根据本发明的方面,将set复方药物与5-fu/甲酰四氢叶酸、卡培他滨、环磷酰胺、托泊替康、伊立替康、奥沙利铂、多西他赛和/或紫杉醇同时给予患者。
根据本发明的方面,在与将5-fu/甲酰四氢叶酸、卡培他滨、环磷酰胺、托泊替康、伊立替康、奥沙利铂、多西他赛和/或紫杉醇给予患者的时间不同的时间将set复方药物给予患者。
可通过任何可药用途径给予set治疗剂。根据本发明的方面,通过口服和/或胃肠外途径将set治疗剂给予患者。根据本发明的方面,通过静脉内或皮下途径将set治疗剂给予患者。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,所述方法包括给予药学有效量的细胞毒性剂、set激动剂和set核糖体拮抗剂的结合物。异常细胞包括有丝分裂异常细胞和非有丝分裂异常细胞,其中有丝分裂异常细胞和非有丝分裂异常细胞均由于给予药学有效量的细胞毒性剂、set激动剂和set核糖体拮抗剂的结合物而被诱导死亡,其中与单独给予细胞毒性剂相比,所述结合物促使g2期的异常细胞死亡增加。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,其中细胞毒性剂、set激动剂和set核糖体拮抗剂的结合物是有效的,从而使得与通过给予细胞毒性剂而不给予set激动剂和set核糖体拮抗剂的治疗相比,需要更低剂量的细胞毒性剂来杀死异常细胞。
根据本发明的治疗方法的方面,细胞毒性剂选自:卡培他滨、环磷酰胺、托泊替康、紫杉醇、5-fu/甲酰四氢叶酸、多西他赛、伊立替康和奥沙利铂,其可药用的盐,以及其任意两种或更多种的结合物。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,其中set激动剂是g2进程的刺激剂。根据本发明的其他方面,set激动剂选自聚氧乙烯氢化蓖麻油、佛波酯、苔藓抑素,其可药用的盐,以及其任意两种或更多种的结合物。
根据本发明的其他方面,聚氧乙烯氢化蓖麻油选自聚氧乙烯30氢化蓖麻油、聚氧乙烯35氢化蓖麻油、聚氧乙烯40氢化蓖麻油、聚氧乙烯50氢化蓖麻油、聚氧乙烯60氢化蓖麻油,以及其任意两种或更多种的结合物。
根据本发明的其他方面,聚氧乙烯氢化蓖麻油为聚氧乙烯35氢化蓖麻油、聚氧乙烯40氢化蓖麻油,或聚氧乙烯35氢化蓖麻油和聚氧乙烯40氢化蓖麻油的结合物。
根据本发明的其他方面,苔藓抑素是苔藓抑素1和/或苔藓抑素2,或其可药用的盐。
根据本发明的其他方面,佛波酯是12-o-十四烷酰佛波醇-13-乙酸酯或其可药用的盐。
根据本发明的方面所给予的set核糖体拮抗剂抑制set核糖体的蛋白质合成。根据本发明的方面,set核糖体拮抗剂选自:茴香霉素、放线菌酮、依米丁,其可药用的盐以及其结合物。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,所述方法包括给予药学有效量的以下试剂的结合物:1)5-氟尿嘧啶/甲酰四氢叶酸、卡培他滨、环磷酰胺、伊立替康、托泊替康、紫杉醇、多西他赛、奥沙利铂,其可药用的盐或其任意两种或更多种的结合物;2)聚氧乙烯35氢化蓖麻油、聚氧乙烯40氢化蓖麻油,或二者的结合物;和3)依米丁、放线菌酮、茴香霉素,其任一种的可药用的盐,或其任意两种或更多种的结合物。异常细胞包括有丝分裂异常细胞和非有丝分裂异常细胞,其中有丝分裂异常细胞和非有丝分裂异常细胞均由于给予药学有效量的1)、2)和3)而被诱导死亡。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,其中以下试剂的结合物是有效的:1)5-氟尿嘧啶/甲酰四氢叶酸、卡培他滨、环磷酰胺、伊立替康、托泊替康、紫杉醇、多西他赛、奥沙利铂,其可药用的盐或其任意两种或更多种的结合物;2)聚氧乙烯35氢化蓖麻油、聚氧乙烯40氢化蓖麻油,或二者的结合物;和3)依米丁、放线菌酮、茴香霉素,其任一种的可药用的盐,或其任意两种或更多种的结合物,从而使得与通过给予细胞毒性剂而不给予2)聚氧乙烯35氢化蓖麻油、聚氧乙烯40氢化蓖麻油,或二者的结合物;和3)依米丁、放线菌酮、茴香霉素,其任一种的可药用的盐,或其任意两种或更多种的结合物的治疗相比,需要更低剂量的细胞毒性剂来杀死异常细胞,所述细胞毒性剂选自:5-氟尿嘧啶/甲酰四氢叶酸、卡培他滨、伊立替康、托泊替康、紫杉醇、多西他赛、奥沙利铂、环磷酰胺,其可药用的盐或其任意两种或更多种的结合物。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,其中细胞毒性剂、set激动剂和set核糖体拮抗剂的结合物为如表13中refnos:1-96所示的任一种结合物,包括其中如refno:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95或96,具体想到的其任意一种或多种所示的细胞毒性剂、set激动剂和set核糖体拮抗剂的结合物。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,其中所述受试者为人。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,其中所述增生性疾病为耐药性癌症。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,其中所述增生性疾病为转移癌。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,其中所述增生性疾病选自:乳腺癌、转移性乳腺癌、结肠癌、转移性结肠癌、肛门癌、转移性直肠癌、胰腺癌、胃癌、食管癌、胆管癌(bileductcancer)、胆囊癌、胆管癌(cholangiocarcinoma)、肝细胞癌、神经胶质瘤、室管膜瘤(ependyoma)、转移性卵巢癌、子宫内膜癌、宫颈癌、复发性或持续性宫颈癌、膀胱癌、肾细胞癌、转移性肾细胞癌、非小细胞肺癌、头颈癌、鼻咽癌、卵巢癌、视网膜母细胞瘤、神经母细胞瘤、间变性星形细胞瘤、混合型恶性神经胶质瘤、少突神经胶质瘤、前列腺癌、胰腺腺癌、壶腹和壶腹周围癌、肛门腺癌、卵巢腺癌、阑尾癌、睾丸癌、小细胞肺癌、小肠癌、白血病、慢性淋巴细胞白血病、淋巴瘤、混合细胞型淋巴瘤、非霍奇金淋巴瘤、外周t细胞淋巴瘤、大b细胞淋巴瘤、卡波西肉瘤、恶性淋巴瘤(annarbor分期系统的iii和iv期)、霍奇金病、淋巴细胞性淋巴瘤(结节性或弥散性)、混合细胞型淋巴瘤、组织细胞性淋巴瘤、伯基特淋巴瘤、多发性骨髓瘤、慢性淋巴细胞白血病、慢性粒细胞白血病、急性骨髓性和单核细胞性白血病、儿童急性成淋巴细胞(干细胞)白血病、胆道癌(biliarytractcacner)、基底细胞癌、再狭窄(restenosis)、瘢痕性和光化性角化病。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,其中同时给予细胞毒性剂、set激动剂和set核糖体拮抗剂。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,其中在不同的时间给予细胞毒性剂、set激动剂和set核糖体拮抗剂。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,其中set激动剂和set核糖体拮抗剂是在药物制剂中一起给予的。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,其中set激动剂和set核糖体拮抗剂是在药物制剂中一起经口服给予的。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,其中所述方法还包括附加的治疗性治疗。
任选地,所述附加的治疗性治疗包括对受试者的辐射治疗。
在另一种选择中,所述附加的治疗性治疗包括给予一种或多种另外的化疗药物。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,其中通过注射给予细胞毒性剂。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,其中经静脉内给予细胞毒性剂。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,其中将患有特征为异常细胞的增生性疾病的受试者的异常细胞与细胞毒性剂接触,然后与set激动剂或set核糖体拮抗剂接触。
根据本发明的方面,提供了在哺乳动物受试者中治疗癌症的方法,其中患有癌症的受试者的癌细胞与细胞毒性剂接触,然后与set激动剂或set核糖体拮抗剂接触。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,其中将患有特征为异常细胞的增生性疾病的受试者的异常细胞与细胞毒性剂接触,然后与set激动剂或set核糖体拮抗剂接触。
根据本发明的方面,提供了在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,所述方法包括给予药学有效量的细胞毒性剂、set激动剂和set核糖体拮抗剂的结合物,其中set激动剂的剂量为产生最大set核糖体活性的浓度,并且set核糖体拮抗剂的剂量为产生范围在ld50的1/2500-1/5000内的set核糖体活性ic100的浓度。异常细胞包括有丝分裂异常细胞和非有丝分裂异常细胞,其中异常细胞和非有丝分裂异常细胞均由于给予药学有效量的细胞毒性剂、set激动剂和set核糖体拮抗剂的结合物而被诱导死亡,其中set激动剂的剂量为产生最大set核糖体活性的浓度,并且set核糖体拮抗剂的剂量为产生范围在ld50的1/2500-1/5000内的set核糖体活性ic100的浓度。
根据本发明的方面,提供了药物组合物,其包括set激动剂和set核糖体拮抗剂。
根据本发明的方面,提供了药物组合物,其包括set激动剂和set核糖体拮抗剂,其中所述set激动剂是g2期进程的刺激剂。
根据本发明的方面,提供了药物组合物,其包括set激动剂和set核糖体拮抗剂,其中所述set激动剂选自:聚氧乙烯氢化蓖麻油、佛波酯、苔藓抑素,其任一种的可药用的盐,以及其任意两种或更多种的结合物。
根据本发明的方面,提供了药物组合物,其包括set激动剂和set核糖体拮抗剂,其中所述聚氧乙烯氢化蓖麻油选自:聚氧乙烯30氢化蓖麻油、聚氧乙烯35氢化蓖麻油、聚氧乙烯40氢化蓖麻油、聚氧乙烯50氢化蓖麻油、聚氧乙烯60氢化蓖麻油,以及其任意两种或更多种的结合物。
根据本发明的方面,提供了药物组合物,其中所述set激动剂选自苔藓抑素1、苔藓抑素2,其任一种的可药用的盐,以及其任意两种或更多种的结合物。
根据本发明的方面,提供了药物组合物,其包括set激动剂,所述set激动剂为12-o-十四烷酰佛波醇-13-乙酸酯或其可药用的盐。
根据本文所述的本发明的方面,set核糖体拮抗剂抑制set核糖体的蛋白质合成。
根据本发明的方面,提供了包括set核糖体拮抗剂的药物组合物,所述set核糖体拮抗剂选自:茴香霉素、放线菌酮、依米丁,其任一种的可药用的盐,以及其任意两种或更多种的结合物。
根据本发明的方面,提供了药物组合物,其包括聚氧乙烯35氢化蓖麻油和茴香霉素,或其可药用的盐。
根据本发明的方面,提供了药物组合物,其包括聚氧乙烯35氢化蓖麻油和依米丁,或其可药用的盐。
根据本发明的方面,提供了药物组合物,其包括聚氧乙烯35氢化蓖麻油和放线菌酮,或其可药用的盐。
根据本发明的方面,提供了药物组合物,其被配制用于对受试者的口服给药。
细胞毒性剂、set激动剂和/或set核糖体拮抗剂的衍生物可用于根据本发明的方面的组合物和方法并且被具体地想到包含于其中。术语“衍生物”指经修饰的组合物,其保留了未修饰的组合物的可识别的结构关系并且保留了未修饰的组合物的功能或相对于未修饰的组合物具有改进的功能。
根据本发明的方面,方法和组合物包括编码tr元件的表达盒。根据本发明的方面,所编码的tr元件选自人或小鼠tr元件。根据本发明的优选方面,所述tr元件选自由seqidno:1、seqidno:2、seqidno:3、seqidno:4、seqidno:17、seqidno:18、seqidno:19、seqidno:20或其任一种的变体编码的那些,其中所编码的tr元件赋予对mrna中可操作连接的编码序列的选择性翻译。
根据本发明的方面,鉴定有效作为治疗增生性疾病的set复方药物的组分的试剂的方法包括:提供特征为tr3类异常(outlier)set响应的细胞,其中所述细胞包含编码tr元件和报告蛋白(reporter)的表达盒,并且其中所述表达盒被稳定地整合到细胞基因组中;将所述细胞与试验物质接触;以及测量与对照相比,试验物质对set核糖体的蛋白质合成的作用,其中试验物质对set核糖体的蛋白质合成的抑制鉴定出所述物质为有效作为治疗增生性疾病的set复方药物的组分的试剂。
根据本发明的方面,鉴定有效作为治疗增生性疾病的set复方药物的组分的试剂的方法包括:提供细胞,其特征在于tr3类异常set响应并且其特征还在于在体外作为非粘附3d在悬浮培养物中生长的能力和/或在体内启动并生长成原代异基因(xenogeneic)肿瘤的能力,其中所述原代异基因肿瘤可被分割成亚碎片(subfragment)并且作为继发肿瘤增殖。
根据本发明的方面,提供了分离的非天然存在的tr4类细胞,其特征在于tr3类异常set响应。
根据本发明的方面,提供了分离的非天然存在的tr4类细胞,其特征在于tr3类异常set响应,其特征还在于在体外作为非粘附3d在悬浮培养物中长的能力和在体内启动并生长成原代异基因肿瘤的能力,所述原代异基因肿瘤可被分割成亚碎片并且作为继发肿瘤增殖。
根据本发明的方面,提供了产生转移癌细胞系模型的方法,所述方法包括:将编码tr元件和报告蛋白的表达盒引入细胞,产生亲代细胞群,其中所述表达盒被稳定整合到细胞的基因组中;分离亲代群的亚克隆;将set激动剂给予每个亚克隆的细胞群以在每个亚克隆的细胞群中诱导settr响应;通过检测报告蛋白的表达来测定每个亚克隆的细胞群中的trset响应;对与每个其他亚克隆相比的每个亚克隆的trset响应进行排序,建立一系列特征在于平均响应的trset响应;选择特征为大于平均响应至少两个标准差的报告蛋白表达的可检测增加的亚克隆,从而确定所选择的亚克隆为tr3类set响应亚克隆;将set激动剂给予每个tr3类set响应亚克隆的细胞群以在每个tr3类set响应亚克隆的细胞群中诱导settr响应;通过检测报告蛋白的表达来测定每个tr3类set响应亚克隆的细胞群中的trset响应;对与每个其他tr3类set响应亚克隆相比的每个tr3类set响应亚克隆的trset响应进行排序,建立一系列特征在于平均响应的trset响应;选择特征为大于平均响应至少两个标准差的报告蛋白表达的可检测增加的tr3类set响应亚克隆,从而确定所选择的tr3类set响应亚克隆为tr3类set响应异常;将一种或多种毒素给予一种或多种特征为tr3类set响应异常的亚克隆的细胞;检测一种或多种特征为tr3类set响应异常的亚克隆的细胞响应,所述响应指示出由于所述亚克隆的细胞中升高的set核糖体活性而导致的药物和应激抗性,从而确定所述细胞为tr4类细胞;并且从而产生转移癌细胞系模型。
根据本发明的方面,提供了产生转移癌细胞系模型的方法,所述方法还包括在低密度条件下培养tr4类细胞至少50个细胞周期,产生tr4类亚克隆并且能够形成低密度集落(colony);选择能够形成低密度集落的tr4类亚克隆;将set激动剂给予能够形成低密度集落的每个tr4类亚克隆的细胞群以诱导trset响应;通过检测报告蛋白的表达来测定能够形成低密度集落以诱导trset响应的每个tr4类亚克隆的细胞群的set响应;对与每个其他能够形成低密度集落的tr4类亚克隆相比的能够形成低密度集落的每个tr4类亚克隆的trset响应进行排序,建立一系列特征为平均响应的set响应;选择能够形成低密度集落的tr4类亚克隆,其特征为大于平均响应至少两个标准差的报告蛋白表达的可检测增加。
根据本发明的方面,提供了产生转移癌细胞系模型的方法,所述方法还包括在非粘附低密度培养条件下培养tr4类细胞并选择作为悬浮聚集物生长的tr4类细胞的亚克隆,从而选择能够以10个或更少的细胞启动肿瘤球而形成离体肿瘤球的tr4类细胞的亚克隆;将一种或多种毒素给予能够以10个或更少的细胞启动肿瘤球响应而形成离体肿瘤球的tr4类亚克隆的细胞;检测能够以10个或更少的细胞启动肿瘤球而形成离体肿瘤球的tr4类亚克隆的细胞的响应,所述响应指示出由于所述亚克隆的细胞中升高的set核糖体活性而导致的药物和应激抗性,从而确定所述tr4类亚克隆的细胞能够以10个或更少的细胞形成离体肿瘤球,所述细胞的特征在于tr4类trset响应。
根据本发明的方面,提供了鉴定有效促进或抑制体内g2进程的试剂的方法,所述方法包括提供tr4类细胞系的细胞,该细胞系的特征为tr3类异常set响应,其中所述细胞包含编码tr元件和报告蛋白的tr核酸表达盒;将所述细胞给予非人动物,在非人动物中产生异体移植肿瘤;将试验物质给予所述非人动物;测量试验物质对set响应的作用,其中set响应增加将试剂鉴定为有效促进体内g2进程的set激动剂。
根据本发明的方面,提供了鉴定有效促进或抑制体内g2进程的试剂的方法,所述方法还包括将set激动剂给予非人动物以促进体内g2进程,其中set响应减少将所述试剂鉴定为有效抑制体内g2进程的set拮抗剂。
根据本发明的方面,提供了鉴定有效促进或抑制体内g2进程的试剂的方法,所述方法还包括测量试验物质对异体移植肿瘤的作用。
所述非人动物是任何适合的动物。根据本发明的方面,所述非人动物是啮齿类动物、兔、猴或其他非人灵长类动物。根据本发明的方面,所述非人动物是大鼠或小鼠。
根据本发明的方面,鉴定有效促进或抑制体内g2进程的试剂的方法包括提供特征为tr3类异常set响应的tr4类细胞系的细胞,其中所述细胞包含编码tr元件和报告蛋白的tr核酸表达盒,所述表达盒被稳定整合到细胞的基因组中;将所述细胞给予非人动物,在所述非人动物中产生异体移植肿瘤;将试验物质给予所述非人动物;测量所述试验物质对异体移植肿瘤的作用;测量所述试验物质对set响应的作用,其中set响应增加将所述试剂鉴定为有效促进体内g2进程的set激动剂。
根据本发明的方面,鉴定有效促进或抑制体内g2进程的试剂的方法包括提供特征为tr3类异常set响应的tr4类细胞系的细胞,其中所述细胞包含编码tr元件和报告蛋白的tr核酸表达盒,所述表达盒被稳定整合到细胞的基因组中;将所述细胞给予非人动物,在所述非人动物中产生异体移植肿瘤;将试验物质给予所述非人动物;将set激动剂给予所述非人动物;测量所述试验物质对细胞的set响应的作用,其中set响应减少将所述试剂鉴定为有效抑制体内g2进程的set拮抗剂。
根据本发明的方面,鉴定有效促进或抑制体内g2进程的试剂的方法任选地还包括测量试验物质对异体移植肿瘤的作用。
附图说明
图1a为示意图,示出了阻止cap依赖性翻译并调节set核糖体翻译的tr表达盒中的序列元件。tr表达盒来自哺乳动物蛋白脂质蛋白质(plp)基因。它包含多个上游起始密码子、终止密码子(如箭头所示)和阻止从5’帽结构到报告基因起始密码子的核糖体扫描的短开放阅读框(uorfs1-9,如框所示)。定点诱变确定了外显子4中的rna区段,其作为翻译内部pirporf的核糖体加载位点(trires表1)。该位点包含18srna互补序列,该互补序列与gtxires中指导核糖体加载的序列是高度同源的(比对示于表1)。外显子5和6中的序列似乎不是内部翻译起始所必需的,而基因盒(外显子7)的3’端包含ires功能的关键调节基因(keyregulator)(tr调节因子,表1)。该区域的缺失和点突变影响起始密码子选择的保真性和trires翻译的应激特异性,这可能是由于rna二级结构的破坏(总结于表2中)。调节序列也包含不同的18srna互补序列,其与杯状病毒(caliciviral)翻译终止-再起始基序是高度同源(比对如图1所示),这表明报告基因翻译是通过再起始机制发生。
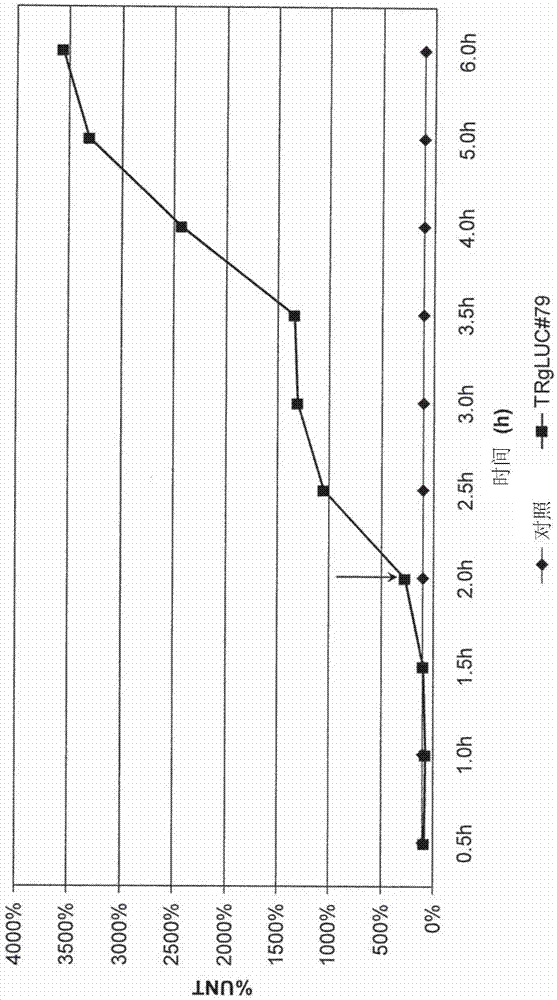
图1b示出了测量从hek293htrdm-gluc#79细胞系释放的分泌性gaussia荧光素酶(gluc)报告蛋白的set时间过程,将所述细胞系用100nμ12-o-十四烷酰佛波醇-13-乙酸酯(tpa)连续处理6hr。在处理后2小时、当cap依赖性翻译降低时(箭头),统计分析(学生双尾t检验)发现显著的set增加。gluc蛋白质合成的时机表明,快速复制细胞在g1/s或s早期细胞周期阶段并不显示出来自tr表达盒的set,但是在s晚期(处理后>2小时)激活set核糖体。随着细胞进入g2细胞周期阶段(3.5-6小时),观察到增加的set核糖体活性,证实gluc合成、转运和分泌并未受到set的tpa激活的阻碍。
图2示出了cap依赖性和set核糖体特异性翻译的热休克调节。将表达萤火虫荧光素酶(fluc)报告蛋白的hek293衍生细胞系——所述表达为组成型表达(cmv细胞系)或作为tr表达盒的一部分(htr和mtr细胞系)——在42℃下连续加热6小时(图2a)或3小时(图2b),并且以每小时为间隔测定fluc活性。如所预期的,连续的致死性热处理阻断了cmv细胞系中的cap依赖性fluc表达,并且由于连续的更新(turnover),fluc活性在整个测定中持续下降。cap依赖性翻译抑制的时机与用致死性温度(41℃)处理的小鼠的存活的时间依赖性降低紧密相关,其在45min之内达到统计学上的显著性。相比之下,tr系中的set依赖性fluc表达在2hr之内成为可检测的,并且在整个测定期间继续增加。图2b示出了set诱导发生在热暴露的1-2小时之间。到处理后4小时,tr细胞系set响应根据固有的热存活力(对致死性热休克的抗性)分成之前定义的trset类别。tr3类细胞的亚组(称为tr4类;htrdm-fluc#122)与3类平均值相比显示出热诱导set活性的统计学显著增加,并且在处理后8小时显示出增强的细胞存活力(如锥虫蓝染色所测量的)。这些结果举例说明了离体和体内热存活力与能够恢复蛋白质合成的核糖体(称为set核糖体)的不同群体的存在相关。
图3示出了cap依赖性和set核糖体翻译的热调节。
缩写:tpa:12-o-十四烷酰佛波醇-13-乙酸酯;tax:紫杉醇;mg:mg132;cal:钙离子载体(calciumlonophore)a23187;topo:托泊替康。
图3a和3b示出了趋势图,其证明在低环境温度(23℃)和高温(42℃)下对五种参考标准试剂(表3)的tr类别特异性set响应。将表达fluc报告蛋白的hek293衍生细胞系——所述表达为组成型表达(cmv细胞系)或作为tr表达盒的一部分(htr和mtr细胞系)——用参考标准试剂(全称和剂量总结于表3中)处理,在指定的温度下孵育6小时,并且测定fluc活性。在cmv细胞系中,当fluc报告蛋白通过cap依赖性核糖体被翻译时,全部参考标准响应均被热和冷抑制。在tr细胞系中,当fluc报告蛋白通过set核糖体被翻译时,一些参考标准响应显示出不可预期的改变,这些改变根据trset类别而不同。tr2类htrdm-fluc#8细胞显示出响应于热的set核糖体的最低激活(图3a)。尽管42℃趋势线显示出与37℃相同的特征,仅有tpa、tpa+tax和tpa+cal证明了与未处理样品相比增加的fluc活性。尽管tax响应并未升至基线以上,但是其在42℃时并未像在23℃和37℃时那样下降,这与tr3类趋势图中的42℃tax峰一致。在该细胞系中,冷处理的作用的显著性小得多,其影响了参考标准响应的大小(magnitude)而不是性质。与htrdm-fluc#8细胞系相比,tr3类mtrdm-fluc#12和htrdm-fluc#122细胞中的set核糖体在23℃下的活性比37℃和42℃下的活性更低。热对tpa、tpa+tax、tpa+cal、tax、tax+cal和cal响应具有刺激作用。如上文所述,两种tr3类细胞系之一在37℃和42℃下显示出增加的set核糖体活性。tr2-3类响应仅在23℃下显示出类似的set大小和对tax、tax+cal和cal响应的抑制。
如图3b所示,23℃set趋势图表明,在htr和mtr细胞系中,在23℃下保持了tpa对set核糖体的激活,而tax响应似乎需要更高温度。尽管由于高温和低温响应之间大小的差异而不能容易地检测到cal响应,然而可观察到cal响应,只是以非常弱的方式。cmv趋势线表明,与set核糖体不同,环境温度使cap依赖性核糖体完全失活。
图4表明,雷帕霉素(rapamycin)对mtorc1的失活刺激了set核糖体活性。
缩写:t/t:12-o-十四烷酰佛波醇-13-乙酸酯+taxol;t/t/r:12-o-十四烷酰佛波醇-13-乙酸酯+taxol+雷帕霉素。
图4示出了mcf7衍生细胞系的雷帕霉素剂量响应图表,所述细胞系表达fluc报告蛋白,所述表达为组成型地(cmv细胞系)或作为tr表达盒的一部分(htr和mtr细胞系)。雷帕霉素通过阻断mtorc1(功能为营养物/能量/氧化还原传感器并在g1细胞周期阶段控制细胞生长的蛋白复合物)来抑制生长核糖体活性。雷帕霉素也影响mtorc2(在g2细胞周期阶段参与应激信号转导的复合物)的活性,但是仅在高浓度下和长时间暴露之后。为了区分开生长和应激响应,用不同剂量的雷帕霉素处理细胞,在37℃下孵育细胞6小时,并且测定fluc活性。出乎意料的是,cmv细胞系——其中fluc报告蛋白由生长核糖体翻译——仅显示出蛋白质合成中的适度(modest)阻断。相对于未处理的细胞,fluc表达稍微增加,并且在测试的雷帕霉素剂量范围内显示出很小的改变。相反,mtr和htr细胞——其中fluc报告蛋白由set核糖体翻译——的响应与tr类别结构相一致。1类htrdm-fluc#6的响应类似于cmv细胞系。在3类细胞(mtrdm-fluc#27,mtrdm-fluc#45)中,mtrdm-fluc#8细胞系显示出fluc表达(推定的tr4类响应因子(responder))的最大增加。在雷帕霉素浓度为1nm至20nm时,set激活的程度是稳定的,在50nm雷帕霉素样品中fluc活性出现峰值,随后在100nμ-1μm样品中set活性降低。这种fluc活性降低与完全的mtorc1(而非mtorc2)失活有关,这确定了set核糖体、mtorc2应激信号转导和g2细胞周期阶段之间的关联。
在其他研究中,在mcf7衍生细胞系中,结合tpa+taxol参考标准响应,测量不同雷帕霉素浓度的作用,所述mcf7衍生细胞系表达fluc报告蛋白,所述表达为组成型地(cmv细胞系)或作为tr表达盒的一部分(htr和mtr细胞系)。选择该参考药物结合物是因为其在mcf7细胞中特别强的set诱导。用100nμtpa、500nm紫杉醇和不同浓度的雷帕霉素处理细胞,在37℃下孵育细胞6小时,并测定fluc活性。由于tpa+taxol参考标准试剂的set诱导在cmv细胞系(其仅显示出生长核糖体响应)中无法检测到,并且在tr1类htrdm-fluc#6细胞系中是可忽略不计的,最有用的信息来自于tr3类(mtrdm-fluc#27和mtrdm-fluc#45)和tr4类(mtrdm-fluc#8)细胞,其中雷帕霉素在最高达50nm雷帕霉素剂量下在tpa+taxol处理的样品中引起剂量依赖性set超诱导,随后在100nm和更高的雷帕霉素浓度下set降低。这些结果与图4中所示的结果一致,并且证实了set核糖体和mtorc2之间的关联。
图5a和5b示出了使用tr修饰剂(modifier)测定来检测钴(cobalt)对set核糖体的选择性调节。
缩写:tpa:12-o-十四烷酰佛波醇-13-乙酸酯;topol:低剂量托泊替康;topoh:高剂量托泊替康;cocl:氯化钴。
图5a示出了tr3类hek293mtrdm-fluc#12细胞系的钴(ii)剂量响应图,并且举例说明了不同的钴(ii)浓度对taxol、mg132和托泊替康(高剂量和低剂量)参考标准响应的作用。图5b示出了结合tpa参考标准试剂的不同钴剂量的类似图。可溶性钴(ii)广泛用于治疗贫血症,并且被用作模拟与癌症、脑卒中和心肌缺血相关的缺氧的研究试剂。长时间暴露于钴(ii)导致重金属毒性,其阻断dna复制和细胞周期进程。用不同浓度的cocl2单独地或与参考标准试剂(全称和剂量示于表3中)结合来处理细胞,在37℃下孵育细胞6小时,并测定fluc活性。当单独施用时(图5a),所测试的钴剂量均未诱导set核糖体。然而,>50μμ的剂量以剂量依赖的方式抑制了背景set核糖体活性。当钴与已知激活set的参考标准试剂(taxol和tpa)结合时,这种set核糖体阻断作用显著得多。从50μmcocl2开始,taxol响应被抑制,而从200μmcocl2开始,tpa激活(图5b)被抑制。可获得的毒性数据表明,50μμ-200μμ钴浓度与长时间暴露之后影响多个器官的人中的慢性毒性有关,而200μμ以上的剂量与线粒体的活性氧簇产生及细菌/动物死亡(小鼠和大鼠ld50)有关。因此,药物或化学品阻断set核糖体激活的能力可以是体内毒性和副作用的良好的预测指标。
图6a示出了托泊替康的类别依赖性set核糖体调节。在该图中,在mcf7衍生细胞系上进行托泊替康剂量响应测定,所述细胞系表达fluc报告蛋白,所述表达为组成型地(cmv细胞系)或作为tr表达盒的一部分(htr和mtr细胞系)。托泊替康是成熟的一线口服治疗剂,其破坏拓扑异构酶i蛋白功能、dna复制和细胞周期进程,通常用于治疗卵巢癌、宫颈癌和小细胞肺癌。用不同剂量的托泊替康处理细胞,在37℃下孵育细胞6小时,并测定fluc活性。在cmv细胞系中——其中fluc报告蛋白由生长核糖体翻译,托泊替康在剂量<500nm时对蛋白质合成的作用很小。mtr和htr细胞——其中fluc报告蛋白由set核糖体翻译——的响应与tr类别结构相一致。1类htrdm-fluc#6和htrdm-fluc#15与cmv对照系的响应类似。tr3类(mtrdm-fluc#27和mtrdm-fluc#45)和tr4类(mtrdm-fluc#8)在10nμ-100nμ托泊替康下显示出最大set值,随后降低到set最大值以下(由>100nm-5μm托泊替康剂量产生),以及完全的set核糖体阻断(5μm和更高的托泊替康浓度),该阻断通过6小时中没有set蛋白质合成和报告蛋白更新来证明。这种高剂量set抑制与已知的内部s细胞周期检查点处dna复制的浓度依赖性阻断有关,其有效阻断cap依赖性和set核糖体活性。
图6b举例说明在hek293衍生细胞系中不同的托泊替康浓度对tpa参考标准响应的作用,所述细胞系表达fluc报告蛋白,所述表达为组成型地(cmv细胞系)或作为tr表达盒的一部分(htrdm-fluc#13和mtrdm-fluc#45细胞系)。用100nμtpa和不同浓度的托泊替康处理细胞,在37℃下孵育细胞6小时,并测定fluc活性。在cmv对照细胞中,tpa或托泊替康对cap依赖性核糖体活性均没有显著作用。虽然与tpa单独引起的set超诱导相比,低剂量的托泊替康在htr和mtr细胞系中仅产生较弱的set超诱导,但100nμ至5μm的剂量导致set激活减弱,>5μm的剂量完全阻断set核糖体活性,如图6a所示。
图6c示出了托泊替康诱导的trset核糖体活性如何与体内毒性相关。将图6a中的结果与可获得的托泊替康的大量临床前和临床药物剂量和毒性数据相比,揭示出托泊替康剂量、set响应、dna复制损伤和慢性/急性毒性之间的强相关性。产生快速set核糖体诱导的低剂量(<10nm)与细胞应激有关,但是与死亡无关。导致最大set稳定期(plateau)的剂量(10nμ至100nμ)与慢性离体毒性和体内毒性相关,例如培养细胞的缓慢死亡、人临床治疗剂量和人最大耐受剂量(mtd)。导致set降低的高剂量(100nm-5μm)总是与急性离体毒性和体内毒性(培养细胞中即时g2/m细胞周期阻断及小鼠ld50)相关。最终,阻断set核糖体诱导的最高剂量范围(5μm至25μm)的特征在于,与内部s检查点相关的严重细胞死亡。离体研究发现,如果药物持续保持与细胞接触,则这些剂量产生即时的致死性(<24hr);然而,在约6小时之前除去药物的方案导致72小时内延迟但是显著的凋亡性细胞死亡(90-95%)。tr4类mtrdm-fluc#8细胞显示出最大的set诱导和增强的对药物毒性的抗性,如标准细胞存活力测定所确定的,并且需要更高的药物浓度来完全阻断set核糖体活性。
图7示出了用于鉴定tr转移癌症细胞系模型的关键步骤。
晚期(advanced)和侵袭性肿瘤被认为包含表现出干细胞特性的癌细胞的独特群体,所述特性例如自我更新的能力、进化并产生新的干细胞子代的能力、增强的对细胞损伤的抗性、以及肿瘤启动能力。尽管癌干细胞(csc)占任何肿瘤的一小部分,它们构成需要产生远距离、异源转移的群体。因为高tr类别编号(以及升高的set核糖体活性)与增加的g2/m损伤修复潜能、提高的细胞存活力和抗药性相关;多种mtr和htr细胞系用于比较具有确定的体外和体内csc特性的set核糖体响应。例如,tr转移癌细胞模型将表现出一系列可测量的特性,包括:(1)它衍生自亲代tr细胞系的一小部分异常群体(排序前1-5%set诱导);(2)它证明了药物和应激抗性,其与基于细胞的tr测定中统计学上升高的set核糖体活性(称为4类响应)相关;(3)它表现出克隆进化,其由于低密度选择性生长(例如重复的单细胞集落形成及从少量细胞产生非粘附的肿瘤球)而导致set核糖体活性的高度显著的改变(产生新的tr异常响应);(4)在连续异种移植到裸小鼠中之后,它表现出体内肿瘤启动活性;(5)它形成异基因肿瘤,其表现出对tr表达盒的set特异性翻译的体内调节;和(6)它形成异基因肿瘤,其具有升高的生长率和对细胞毒性药物处理的抗性。例如,tr转移结直肠癌(crc)细胞模型克隆是从亲代crc细胞系(例如hct116)中分离,并且表现出这些特性中的每一种。如随后的部分所示,tr转移crc细胞模型的一个实例是htrdm-fluc#32。
图7a示出了set核糖体活性的大小如何与转移生长的体外培养模型中生长的肿瘤细胞的遗传不稳定性相关。每种人肿瘤均由许多表现出独特生物学特性(成瘤性(tumorgenicity)、转移潜能、药物抗性等)的不同细胞亚群组成。由于遗传不稳定性,这些群体能够在肿瘤进展期间相互转化,这允许部分肿瘤修复抗肿瘤药物产生的复制损伤,并在处理周期结束后再次生长。尽管目前的技术能够检测肿瘤细胞转化,但是这个过程耗时长、昂贵,并且使用的细胞特异性生物标记物排除了癌症类型之间广泛的相互关联。为了研究trset响应和肿瘤细胞转化事件(与转移生长的体外模型相关)之间的关系,将hek293tr细胞组(panel)系以低密度铺于平板上并使其形成集落(约2个月;进行50个生长周期来选择升高的细胞粘附和集落形成能力),然后用于产生每个细胞系的子代亚克隆细胞组。将新的亚克隆用100nμtpa处理,孵育6小时,测定fluc活性,并将亚克隆的细胞响应与亲代细胞系进行比较。图7a示出了在从htrdm-fluc#122(tr4类)亲代系产生的子代组中,对tpa参考标准试剂的fluc响应的排序图。子代细胞中的大范围响应表明肿瘤细胞转化已经改变了可遗传的set活性,这意味着set核糖体在选择过程中能够适应并表现出遗传异质性,也称为克隆进化。箭头表示中位数响应,表明两侧的亚克隆数大致相等。然而,特别重要的是,tr4类htrdm-fluc#122系产生了具有异常set诱导活性的子代细胞(与异常子代亚克隆的6568%响应相比,中位数响应为1788%,或set诱导的3.7倍增加)。线的斜率反映了异质性程度,tr2类cmv#74和tr3类mtrdm-fluc#12表现出最大的不稳定性。这些结果提供了令人信服的证据,即在稳定细胞系中传导(propagate)的set响应提供了肿瘤细胞转化的简单、功能性标记物。在高和低trset类别中转化事件的更低的频率可通过这些细胞群体中g2/m细胞周期阶段恢复潜能的差异来解释。例如,低tr类别细胞表现出最低的set核糖体活性,并且容易在毒素处理过程中在s或g2/m检查点处被杀死,而高tr类别细胞表达升高的set核糖体活性(与应激抗性相关)、高存活力和从复制损伤恢复的能力。因此,肿瘤细胞转化并不是存活可能性的绝对量度,而是针对给定应激源的存活的量度。tr4类细胞系表现出将转化活性与恢复、存活力和药物抗性关联起来的能力证实了被设计以降低肿瘤细胞恢复潜能的新治疗法的重要性。在转移生长的第二体外细胞培养模型中,图7b和7c示出了hct116tr4类trset细胞系,其易于形成肿瘤球并表现出不依赖锚定(anchorage)的生长。尽管高trset响应并不是肿瘤球形成绝对必需的(tr1-3类细胞通常表现出这一特性,参见表4),真正的转移细胞候选物必须表现出非粘附生长,其被定义为在非包被的组织培养皿上的生长(粘附或非粘附的)(图7b和7c)。如所示,肿瘤球在若干世代中形成(游离的漂浮的细胞团),并且表现出新形成的克隆肿瘤球活性(从单个细胞的非粘附细胞生长)。图7c示出了用箭头标记的克隆肿瘤球,其包含少于10个细胞核(使用dapi细胞核染色确定)。
如表4所示,hct116细胞组在32天中在未处理的组织培养皿中生长为肿瘤球,并重新铺于标准组织培养皿上14天,然后使用tpatrset参考标准物进行trset测定。在该研究中,三种细胞系表现出增强的set诱导水平,其与异常trset响应(mtrdm-fluc#25、#28和#75)一致。对于这些推定的tr转移癌细胞模型,trset响应增加至未处理对照的19413%-26675%(15倍至79倍)。
图8a-8d和表5测试了4类trset细胞系的肿瘤启动表型。为了检查tr4类hct116htrdm-fluc#32细胞系在裸小鼠(nu/nu)中形成肿瘤的能力,将hct116htrdm-fluc#32或亲代hct116细胞(5×106个细胞)植入10只动物,并测试肿瘤生长(定义为达到750mg的时间)。亲代hct116细胞表现出一系列肿瘤生长响应,包括一例侵袭性肿瘤和一例未占位(no-take)移植(达到750mg的时间为8.6天)。相比之下,10个tr细胞肿瘤的生长并未表现出显著的组差异性(达到750mg的时间为8.8天)。这些结果与tr细胞是克隆自亲代hct116的事实相一致。在第二个研究中,从细胞衍生的肿瘤切下30-60mg肿瘤碎片,并从两侧植入到6只裸小鼠中,产生12个肿瘤事件(表5)。双侧植入物的最终大小(研究的第21天)是可变的。例如,hct1163r植入物生长到2138mg,而3l植入物仅138mg。此外,在每个研究组中,大肿瘤和小肿瘤之间有显著的大小差异。两个最大的亲代hct116肿瘤与其余的10个肿瘤显著不同(p=0.00034,双尾t检验)。类似地,4个最大的hct116htrdm-fluc#32肿瘤与其余的8个植入物显著不同(p=0.00001,双尾t检验)。然而,观察到两组之间肿瘤大小没有显著差异,肿瘤大小分布是不对称的(skewed),因此hct116htrdm-fluc#32细胞大于hct116对照(表5)。例如,12个tr植入物中的4个产生大于1.25g的肿瘤,与之相比,12个对照样品中的2个产生大于1.25g的肿瘤。类似地,12个tr植入物中的6个大于550mg,与之相比,12个hct116肿瘤中的4个大于550mg。增强的体内hct116htrdm-fluc#32肿瘤生长率证实了它是trset转移肿瘤模型的适合选择。图8a-8d和表6提供了htrdm-fluc#32细胞系作为tr转移结直肠癌(crc)细胞模型的进一步支持。在该研究中,用hct116htrdm-fluc#32或亲代hct116细胞注射58只裸小鼠,并使肿瘤生长到约125mg(研究的第8天)。动物被分成6组(每组6只动物或n=36),其余的22只动物被分类为对照。在第一个试验中,在试验试剂注射之前,通过对fluc报告蛋白活性的非侵入式生物发光成像来测定trset动物(n=18)的set核糖体活性(图8a和8c和表6的预处理动物)。使动物恢复,在组1中用载体(vehicle)注射动物(聚氧乙烯35蓖麻油或cremophorel(聚氧乙烯蓖麻油),0.5mg/kg或75.8mg/sqm/天),在组3中用120mg/kg环磷酰胺(对hct116肿瘤没有作用的化疗药物)注射动物,或在组2中用溶于cremophorel的20mg/kg/天紫杉醇(taxol)注射动物,并且在6小时后重新测试fluc活性(以模拟基于细胞的trset测定的时机)。图8a-8d和表6示出了小肿瘤(约125mg)中不可预期的慢性、g2细胞周期阶段应激。预处理生物发光水平分成两种不同的肿瘤类型:低应激组(18个肿瘤中的8个表现出低set核糖体活性),其通过图8a来说明;和高应激组(18个肿瘤中的10个表达高set核糖体活性),其由图8c表示。如表6所示,当治疗后6小时对动物进行重新成像时,与预处理表达水平相比,低应激肿瘤显著增加了fluc活性(7192%至46600%)。出乎意料的是,这不仅发生在紫杉醇/cremophorel治疗的组中,还发生在cremophorel和环磷酰胺肿瘤中。相比之下,高应激肿瘤(图8c-8d)不能进行fluc超诱导(即不能激活set核糖体)。随后的研究发现,预处理g2细胞周期阶段应激的频率与肿瘤大小相关。如表6所示,包含hct116htrdmfluc-#32肿瘤的11只分类动物中的9只被分配到3个测试组,并且如上文所述测定生物发光。由于处理这些动物时的延迟,肿瘤大小已增加到约500mg并且9个肿瘤中仅1个表现出低set核糖体活性。因为该肿瘤在用紫杉醇/cremophorel治疗时表现出显著的set诱导(20500%),set核糖体的激活未受到肿瘤大小的影响。
图9a和9b示出了tr转移crc细胞模型htrdm-fluc#32表现出对紫杉醇的应激依赖性药物抗性。为了测定set核糖体的激活如何在体内调节肿瘤恢复和生长,在每个测试组监测肿瘤大小,共63天。因肿瘤负荷(>2g)或在试验结束时(63天)处死动物。
如所预期的,聚氧乙烯35蓖麻油(cremophorel)对肿瘤生长和恢复没有作用。与cremophorel对照相比,环磷酰胺治疗减缓了肿瘤生长,但是未带来肿瘤消退。在taxol组中,观察到预处理g2细胞周期阶段肿瘤应激与紫杉醇/聚氧乙烯35蓖麻油的表观治疗指数之间的强相关性(图9a和表6)。尽管3种低应激肿瘤(动物#4、#5和#6)在10天紫杉醇治疗期间表现出生长停止和适度的肿瘤消退(大小减小约33%)(图9a),但是在治疗中断后14-18天,每个肿瘤的大小都增加。在第50天和第57天,3只低应激动物中的两只因肿瘤负荷而被处死,其余的肿瘤在第63天时>600mg并且生长迅速。相比之下,在紫杉醇治疗期间观察到高应激肿瘤大小的显著减小(大小减小>59%)。这种趋势持续到第29天,那时肿瘤变得太小而无法测量(大小<50mg)。对于该组,仅1只动物表现出任何肿瘤再生长,导致第63天肿瘤为100mg。在试验期结束时,尸检在其余2只高应激动物中未发现明显的肿瘤。考虑到所有肿瘤均来自相同的耐药性tr转移ctc细胞模型(htrdm-fluc#32细胞系),显而易见的是,由g2细胞周期阶段翻译所产生的预处理set核糖体激活在调节对一线肿瘤学药物紫杉醇的体内肿瘤响应中发挥主要作用。
图9b示出了tr转移ctc细胞模型表现出增加的细胞生长,这与动物存活的降低有关。临床前体内存活是自发性动物死亡、动物消耗(总重减轻>20%之后将动物处死)和允许的最大肿瘤负荷(肿瘤大小>2g之后将动物处死)的函数。在该特定的试验中,所有动物均由于肿瘤负荷而被处死。该图示出了kaplan-meier图,其中将动物数量(%存活)相对于试验天数(时间)作图,并提供了每个治疗组的存活函数的估计值。尽管相比cremophorel对照,环磷酰胺对动物存活具有一些影响,但是在试验结束前所有动物都由于肿瘤负荷而被处死。仅紫杉醇/cremophorel治疗组显示出延长的动物存活(6只动物中的4只存活到第63天)。重要的是,注意到与亲代hct116衍生肿瘤相比,tr转移肿瘤细胞模型衍生的肿瘤(组1-3)生长得更具侵袭性,这导致在所有治疗组中更早的动物处死。肿瘤和动物存活结果共同表明,除了紫杉醇和cremophorel之外,还需要不确定的肿瘤应激源以诱导慢性g2检查点,其与增加的肿瘤响应和延长的动物存活有关。
图10a示出了使用trset测定检查体内set激动剂在体外激活set核糖体的能力。如表6的组1所示,0.5mg/kgcremophor(聚氧乙烯蓖麻油)(口服剂量等于62.5mg/ml)在静脉内(iv)递送后6小时,在异基因肿瘤中诱导set。为了在基于细胞的tr测定中检查该体内响应,将剂量范围为2.5mg/ml-100mg/ml的cremophorel连续施用到hek293mtrdm-fluc#12(潜在的tr转移crc细胞模型)和cmv-fluc#73细胞,持续6小时和24小时。相对于100nμtpa产生的>2000%set增加,出乎意料地,用cremophorel处理的mtrdm-fluc#12细胞在24小时时仅显示出60%set增加(2.5-10mg/ml)。此外,cmv响应表明,cremophorel是cap依赖性核糖体的抑制剂。这些结果表明,cremophorel能够在体内激活set核糖体,但是施用至培养细胞时并未诱导g2细胞周期检查点。尽管表面活性剂通常用于溶解疏水性药物,但cremophorel并非惰性载体并且产生许多体内生物学作用。该研究提供了证据,即细胞模型可显示出在体外无法观察到的体内药物响应。
如表3所示,已鉴定多种set拮抗剂;然而,这些试剂中的大多数只是在s期阻止细胞周期进程并且在g2阻止set核糖体激活。图10b示出了检查可直接结合于set核糖体的set拮抗剂的体外tr测定结果,所述拮抗剂在亚毒性剂量下选择性阻断g2翻译并阻止细胞周期进程。该作用应当模拟内源应激对肿瘤学药物的表观治疗指数的作用。已使用tpa参考标准响应修饰剂测定来测试多种化合物阻断set核糖体激活的能力,其中将高tr类别hek293细胞用100nμtpa和不同浓度的候选set核糖体阻断剂处理,在37℃下孵育6小时,并测定fluc活性(例如图5b)。
对于该研究,选择4种结合于不同核糖体结构的化合物。茴香霉素在a位点结合于60s核糖体亚基,这是氨酰基trna的进入点(除了第一氨酰基trna,其在p位点进入)。嘌呤霉素(puromycin)在p位点与40s和60s亚基相互作用,此时肽基trna在核糖体中形成。放线菌酮在e位点结合于60s亚基,这是不带电的trna将它们的氨基酸卸载至生长中的肽链之后的离开点。依米丁在靠近e位点的核糖体支架结构处结合,但是不同于放线菌酮,依米丁结合于40s亚基rps14核糖体蛋白。在这些试验化合物中,仅依米丁表现出显著的水溶性,这在高剂量测定中需要溶剂如dmso。
图10b举例说明了在3类hek293htrdm-fluc#13细胞系中不同浓度的候选set拮抗剂对tpa参考标准响应的影响。最显著的结果是,检测低剂量的茴香霉素对set的线性剂量依赖性抑制(在浓度为10nμ至250nm时,set核糖体活性稳定地降低,ic50约为35nm,剂量>500nm时,set核糖体活性被完全阻断)。在hek293cmv#3细胞系中,相同的处理对cap依赖性翻译具有最小的影响。因此,茴香霉素必须通过激活p38mapk应激激酶,在s/g2抑制dna复制和细胞周期进程,所述激酶与pkc信号转导系统相互作用。依米丁和放线菌酮在50nm至1μm剂量下抑制set,然后在2.5μm以上的剂量下阻断set活性。类似于茴香霉素,还已知依米丁与应激激酶相互作用。嘌呤霉素对set的抑制效率最低,在1μm至2.5μm剂量下发挥作用,已知嘌呤霉素由于破坏多聚核糖体结构而具有毒性。
当选择set拮抗剂的最佳生物学有效剂量时,确定导致对set核糖体活性的完全和立即抑制的最低剂量(ic100)。考虑到已知的fluc蛋白半衰期,任何立即阻断set蛋白质合成的处理将导致fluc活性在6小时之内(标准trset测定的时间)降低约15%,这意味着需要连续的蛋白质合成以产生>85%fluc活性。相比之下,任何增加fluc蛋白更新的处理均将导致6小时时<85%fluc活性。图10b示出了与未处理的对照相比,500nm茴香霉素的处理导致98%fluc活性。考虑到在该测定期间15%fluc已经降解,这个值代表6小时的约15%残余翻译或翻译阻断之前蛋白质合成的短期爆发。相比之下,1μm茴香霉素导致立即阻断或ic100(87%fluc活性),不同的是,更高的剂量似乎表现出增加的蛋白降解(预期的fluc更新率的约2倍)。因此,500nm茴香霉素是有效的(但是不完全的)set抑制剂,而1μm茴香霉素产生完全或ic100set拮抗剂响应。进一步的剂量增加不仅增强set拮抗剂活性,还可促使蛋白质降解(其可负面影响正常细胞恢复并产生不可预期的全身性副作用)。然而,在体内无法观察到许多基于细胞的作用。因此,第一动物试验检查了两种茴香霉素剂量以在动物中测试亚ic100剂量作用。如表7所示,选择500nm等价剂量(低剂量=0.000027mg/kg/天)和1μm等价剂量(高剂量=0.000054mg/kg/天)。在随后的试验中,将1μm等价剂量与2.5μm等价剂量(非常高的茴香霉素剂量)和依米丁的2.5μm等价剂量进行比较以测试优选的剂量方案。
图11a-11c、表8和表9示出了set复方药物的第一异基因动物试验结果。为了测试set阻断剂药物提高一线抗crc肿瘤学药物卡培他滨功效的能力,将hct116htrdm-fluc#32转移crc肿瘤细胞模型注射到裸小鼠(无胸腺的裸foxn1nu)中,使其形成肿瘤,并使用5个治疗组,用不同的set组分结合物通过口服qd进行治疗(表7)。当肿瘤大小达到约125mg(研究的第7天)时开始治疗并且每日施用,持续18天,然后再监测动物45天。研究中每组的药物浓度列于表7中。使用标准称重方法来测量全部体重和肿瘤重量。动物由于消耗(总重量减轻>20%之后)或由于肿瘤负荷(>2g)而被处死。
图11a、表8和表9示出了当与高剂量卡培他滨一起施用时,set复方药物将诱导显著的肿瘤消退。组1载体(cremophorel)或组2茴香霉素/cremophorel的治疗均对肿瘤生长没有任何作用,但是在组2动物中第10天观察到统计学上显著的重量增加(表9)。尽管本研究中选择的组3卡培他滨(cape)剂量(500mg/kg/天,1500mg/sqm/天)在细胞毒性范围内(标准人剂量的78%),但它仅产生了1例自发性死亡。然而,如表9所示,该毒性确实导致显著的动物重量减轻以及因重量减轻>20%而致的处死(组#3中4只动物,组#4中5只动物,和组#5中2只动物)。尽管该卡培他滨剂量未产生过多的肿瘤消退(平均大小减小56%,表8),但是与组#1和#2相比确实显著延缓了(第10天至第35天)肿瘤生长。在组#4中加入低剂量的茴香霉素和cremophorel并未显著提高卡培他滨肿瘤响应。相比之下,在组#5中加入高剂量的茴香霉素/cremophorel在每只动物中导致相当大的肿瘤尺寸消退(图11a,平均尺寸消退76.7%,表8)。组#3和组#5中的相关肿瘤响应检测了统计学上显著的(双尾t检验)大小差异,其首先在治疗期间达到显著性(第15天,p=0.0047)并且持续,直到组#3中动物的处死阻止了进一步的统计分析(第31天之后)。组#5中的肿瘤消退在治疗后持续,并且在第38天肿瘤大小达到最小值,此时每个肿瘤均小于最小的可测量大小(理论上的治愈)。
图11b示出了第一动物研究中的卡培他滨依赖性异基因肿瘤响应分成3种类型的延迟肿瘤生长响应(通过组3动物#3、#5和#8来证明),并且与卡培他滨治疗的动物相比,低剂量的茴香霉素治疗(组4)未产生任何新的肿瘤响应。明显的差异是由于动物c3中特别具侵袭性的肿瘤(图11b)。图11c表示对单独的组#3和组#5肿瘤的类似比较。与图11b中所示的三种卡培他滨依赖性生长延迟相比,组5动物表现出肿瘤再生长模式,其与最低再生长率或新的肿瘤响应(其中肿瘤未表现出任何显著的再生长)相关(通过动物#1、#3、#6和#7来证明)。在治疗周期后存活的6只组#5动物中,所有动物在第70天仍存活(因为没有肿瘤达到2g的大小限制)。仅检测了3个肿瘤再生长事件,动物h5表现出最大再生长活性(在第70天<1900mg),这非常类似于组#3的动物c5(最有利的卡培他滨响应)。对于动物h1、h3和h7,验尸检查确定,通过治疗已完全杀死了tr转移肿瘤细胞(在细胞植入点没有可见的肿瘤且仅有小瘢痕),表明组5中到第38天最大肿瘤消退为约450mg,平均肿瘤消退为76.7%(表8)。这些结果验证了与卡培他滨结合的set调节组分的辅助活性,确定了茴香霉素的临床前生物学有效剂量(bed)为0.000054mg/kg/天或0.00016mgsqm/天,并且确保了将set复方药物用于提高一线肿瘤学药物功效的进一步研究。
图12a、12b和表9示出了与set复方药物相关的剂量依赖性可逆性重量减轻。将在整个研究中记录的全部动物重量通过减去肿瘤重量来归一化并表示为初始重量(研究的第7天)的百分数。
术语和缩写:对照药物(con):载体(cremophorel),或组#1;c或cape:卡培他滨或组#3;c+l、l或c+ld:卡培他滨/低剂量的茴香霉素/cremophorel,或组#4;c+h、h或c+hd:卡培他滨/高剂量的茴香霉素/cremophorel,或组#5(表7)。
图12a比较了用低剂量(组4)和高剂量(组5)set复方药物治疗的各个动物的重量改变。这个图说明了在38天的研究中小鼠的药物治疗期和随后的动物恢复期的动物重量动力学。总的说来,动物通过表现出重量减轻(组4和5中显著的重量减轻,表9)而对治疗做出响应,然后进入恢复期,在第31天之后出现统计学上显著的重量增加或对照动物重量模式,其产生了双阶段重量响应。考虑这种重量减轻似乎是无毒性的,因为这两组动物都得以恢复并且在研究结束时赶上其他动物。当将组3卡培他滨动物与组5高剂量的茴香霉素动物进行比较时,这种双阶段响应并不明显(图12b),这表明动物表现出全身性的set复方药物响应,其能够可逆地影响动物重量并促使随后的重量增加。卡培他滨治疗的小鼠(c8和c5)似乎刚好落在两个c+hd重量响应的中间,而动物c3的重量从未增加。表9示出了,组1载体(cremophorel)治疗的动物和组3卡培他滨治疗的动物的重量在治疗期间没有显著改变。大多数动物在治疗阶段早期表现出适度的平均重量改变,但是之后由于肿瘤生长,随着它们总体健康水平下降,重量缓慢减轻。详细分析表明,卡培他滨治疗的动物分成两类。动物c6、c5、c8和c3的重量改变类似于载体对照,而c1、c2、c4和c7在治疗期间重量减轻,并且在第22天至第24天被处死。添加低剂量的茴香霉素/cremophorel似乎增强了重量减轻作用(在第10、13和15天观察到显著的重量减轻,表9),导致在第18天5只动物死亡(c+l2、4、5、7和8),尽管对肿瘤尺寸消退没有作用。三种存活中的动物(c+l1、3和6)看起来类似于载体对照或高剂量响应(图12a)。相比之下,添加高剂量的茴香霉素/cremophorel似乎具有保护性作用,因为仅2只动物(c+h2和8)在第22天和第24天由于消耗而被处死。因此,似乎必须选择这样的set复方药物组分的剂量,即,使保护性重量减轻作用治疗剂量最大化,因为低剂量重量减轻可能具有预料不到的临床后果,其与药物治疗活性关系很小。
图13示出了,优选的set复方药物(组5)在与高剂量的卡培他滨一起施用时将增强动物存活。临床前体内存活是自发性动物死亡、动物消耗(总重量减轻>20%之后将动物处死)和允许的最大肿瘤负荷(肿瘤大小>2g之后将动物处死)的函数。该图示出了kaplan-meier图,其中将动物数量(%存活)相对于试验天数(时间)作图,并提供了对每个治疗组的总体存活函数的估计值。
载体(组#1)和茴香霉素/cremophorel(组#2)治疗并未影响存活,并且所有的动物到第36天被处死(由于肿瘤负荷)。尽管低剂量的茴香霉素set复方药物组#4在第15天表现出早期失去5只动物(由于重量减轻),在卡培他滨组#3检测到类似的存活降低(在第22天和第24天共有5只动物被处死)。因此到了治疗结束时(第24天),治疗组#3和#4中的动物消耗没有差异。尽管在第70天与组#4中的两只活动物相比,组#3中肿瘤生长的轻微变化导致仅有一只动物存活,这种差异是不显著的,因为动物l6中的肿瘤是1.8g,因此在第71天将其处死。总的来说,所有的肿瘤和动物响应表明,0.000027mg/kg/天或0.00008mg/sqm/天的茴香霉素剂量低于生物学有效剂量,并且未提供对卡培他滨的辅助药物活性。
相比之下,在高剂量茴香霉素set复方药物组#5中,仅两只动物表现出卡培他滨毒性,并且在治疗期间(第22天和第24天)被处死。这种动物消耗的低比率(仅为卡培他滨对照的40%)与治疗结束之前的动物重量增加一致(参见图12a)。由于研究的其余动物的重量下降,预料不到的重量增加导致没有动物减少(100%存活率)。尽管组#5中存在肿瘤再生长显著延迟(参见图11c),存活函数明显地表明,该延迟等同于增加的动物存活——人药物响应的优选的度量(总体患者存活增加)。
尽管目前不可能将动物和人存活相关联,这种临床前试验明显证明,用0.5mg/kg/天cremophorel和0.000054mg/kg/天茴香霉素在18天周期中治疗的动物表现出辅助或同时的致敏药物响应,其提高了高剂量卡培他滨(500mg/kg/天)治疗的治疗指数。
图14a、14b、表10和11描述了第二异基因动物试验,其证实了当两种set复方药物与低剂量的亚治疗水平的卡培他滨一起施用时,诱导肿瘤消退并延迟肿瘤再生长。对于第二动物试验,将hct116htrdm-fluc#32转移肿瘤细胞注射到裸小鼠(无胸腺的裸foxn1nu)中,使其形成肿瘤并分成5个治疗组(表10)。当肿瘤大小达到约125mg时(研究的第6天)开始进行治疗,并每天施用治疗,持续10天,然后再监测动物56天。所述研究的每个组的药物浓度列于表10中。使用标准测量法来测量全部体重和肿瘤重量。动物由于消耗(总重量减轻>20%之后)或由于肿瘤负荷(>2g)而被处死。
术语和缩写:载体:cremophor或组#1;c或cape:卡培他滨或组#2;c+e:卡培他滨/依米丁/cremophorel或组#3;c+h:卡培他滨/高剂量茴香霉素/cremophorel(与第一动物试验相同)或组#4;c+vh:卡培他滨/非常高剂量的茴香霉素/cremophorel或组#5。
图14a示出了在试验过程中的平均肿瘤重量。如所预期的,组1载体对照(cremophorel)治疗的肿瘤表现出线性生长,并且该组中的所有动物均在第25天至第40天之间因肿瘤负荷而被处死。为了尝试减少由于重量减轻导致的动物死亡,选择用于该试验的卡培他滨剂量(400mg/kg/天或1200mg/sqm/天)是第一研究的抑制细胞生长范围(标准人剂量的35%)而非细胞毒性范围。因此,在该试验中卡培他滨仅产生较小的肿瘤消退(表11;平均肿瘤大小减小35.2%),并且肿瘤生长在治疗终止之后几乎立即重新开始。将组#2动物(卡培他滨)的肿瘤消退与组#3、组#4和组#5相关联,检测到统计学上显著(双尾t检验,p<0.05)的肿瘤大小差异,其在治疗期结束(第14天)之前首先达到显著性,并且持续直到动物被处死而不能进行统计分析。因此,全部三种set复方药物组证明了与卡培他滨对照相比减少的肿瘤生长、广泛的肿瘤消退和延迟的肿瘤再生长。矛盾的是,如图14a和表11所示,相对于低剂量的茴香霉素,使用非常高剂量的茴香霉素并没有益处,因为组#4和组#5的肿瘤响应是相同的,这确定了茴香霉素的优选的临床前生物学有效剂量(bed)为0.000054mg/kg/天。如图14b和表11所示,最大的肿瘤消退和最慢的肿瘤再生长是由低剂量卡培他滨、依米丁和cremophorel的组合产生(组#3)。尽管8只组5动物中的7只表现出显著的肿瘤作用(最大肿瘤消退为90%),但是没有“治愈”事件(肿瘤消退到可检测大小以下并且不再重新生长)。然而,两个异基因肿瘤动物研究都表明,多种set复方药物(独特的组成和剂量)作为辅助性药物发挥功能,其能够增强高毒性的一线肿瘤学药物(即使在亚治疗浓度下)的治疗指数。
图15示出了set复方药物诱导单阶段重量改变特征。将整个研究过程中记录的全部动物重量通过减去肿瘤重量进行归一化并表示为初始重量(研究的第6天)的百分数。
术语和缩写:载体:cremophor或组#1;c或cape:卡培他滨或arm#2;c+e:卡培他滨/依米丁/cremophorel或arm#3;c+h:卡培他滨/高剂量茴香霉素/cremophorel(与第一研究相同)或组#4;c+vh:卡培他滨/非常高剂量的茴香霉素/cremophorel或arm#5;c+h7:来自第一研究、c+hd组的动物7;c+h1:来自第一研究、c+hd组的动物1;c+l3:来自第一研究、c+ld组的动物3。
图15示出了到研究的第36天每组的平均%重量改变。对于第一动物试验,组1载体(cremophorel)治疗的动物的重量没有显著改变。大多数动物在早期继续生长,但是随后由于肿瘤生长(即恶病质(cachexia))导致的总体健康水平下降,它们的重量缓慢减少。然而,不同于第一异基因动物研究中高剂量卡培他滨治疗的动物——其中一些动物因毁灭性的重量减轻而被处死,组#2中低剂量卡培他滨(400mg/kg/天)治疗的动物未出现足以导致需要被处死的重量改变。如上文所述,卡培他滨治疗的动物在治疗期间显示出一致(concerted)的重量减轻,随后回升到治疗前的重量。如在第一动物研究中,组#3、#4和#5的set复方药物增强了这个作用。在组5卡培他滨/非常高剂量的茴香霉素/cremophorel治疗的组中,重量减轻最大,其中8只动物中的4只在第11天至第20天因重量减轻而被处死。相比之下,对于更低茴香霉素剂量的组#4动物而言,6只动物中仅有2只被处死,这与第一研究中的动物数量相同。尽管在卡培他滨/依米丁/cremophorel治疗的组#3中没有因消耗导致的动物减少,它们在治疗期中的平均重量减轻明显低于组#2中卡培他滨治疗的小鼠的平均重量减轻(第12-14天;双尾t检验p=0.022)。如图15所示,所有set复方药物治疗的动物到第29天表现出重量增加(在初始重量水平之上);然而,到第26天时组#3动物的重量增加超过所有其他组并且到第29天时达到统计学上的显著性(双尾t检验,p=0.0006)。如在第一动物研究中,依米丁和茴香霉素似乎具有保护性作用并且诱导可逆的重量改变,其导致在治疗停止后一周之内动物重量的迅速增加。
当比较第一和第二动物研究中的平均%初始重量改变时(图12a和15),重量减轻和重量增加趋势是明显类似的。因此,在两个研究中观察到的可逆的重量改变可能是set复方药物与卡培他滨被一起递送时的普通响应。因为这种重量减轻是快速可逆的(并非由毒性副作用产生,因为动物重量在17天中回升38.2%),并且与肿瘤响应无关,它似乎是一个需要进行监测以防止重量改变成为关键的治疗问题的治疗特征。
图16示出了将set复方药物与低剂量的卡培他滨一起施用时,增加了动物存活。临床前体内存活是自发性动物死亡、动物消耗(总重量减轻>20%之后将动物处死)和允许的最大肿瘤负荷(肿瘤大小>2g之后将动物处死)的函数。该图示出了kaplan-meier图,其中将动物数量(%存活)相对于试验天数(时间)作图,并提供了每个治疗组的总存活函数的估计值。
载体(组#1,cremophorel)治疗未影响存活,并且由于肿瘤负荷,所有动物到第40天被处死(处死平均值为26天)。卡培他滨治疗的动物(组#2)的减少直到第43天才开始,之后由于肿瘤负荷,它们的减少是相当快的(到第47天减少5只动物,到第50天再减少两只,第54天失去最后一只动物)(死亡平均值为47天)。尽管大多数组#2动物在治疗期间重量减轻(图15),但是均未达到动物处死所需的>20%重量减轻阈值。相比之下,两个茴香霉素治疗组由于重量减轻而具有显著的动物减少。在非常高茴香霉素/卡培他滨/cremophorel组#5中,4只动物在第11天至第20天之间由于重量减轻而被处死,其余动物在第46天至57天之间因肿瘤负荷而被终止(处死平均值为47天)。因此,尽管茴香霉素对肿瘤大小有作用(如图14a和表11所示),相比卡培他滨单一疗法,0.00013mg/kg/天茴香霉素剂量结合低剂量卡培他滨并未提供任何统计学上显著的总体存活率益处。
相比之下,尽管因重量减轻而失去2只动物(第12-14天),组#4中的0.000054mg/kg/天茴香霉素剂量确实提供显著的总体存活益处(处死平均值为57天,与组2和5相比增加121%)。该组中的小鼠在第47至68天之间因肿瘤负荷而被处死,证明了0.000054mg/kg/天的治疗是茴香霉素与卡培他滨结合时优选的茴香霉素剂量(bed)。然而,在组#3中看到最大总体存活益处,其中低剂量卡培他滨与0.00013mg/kg/天依米丁和0.5mg/kg/天cremophorel结合(处死平均值为68天,与组2和5相比增加145%)。尽管在治疗期间组#3中有显著的重量减轻,但是动物均未达到>20%重量临界值(cutoff)(图15)。此外,该组的第一只动物在第57天因肿瘤负荷而被处死,在组#1、#2和#5的处死平均值之后并且等于组#4的处死平均值。如图16所示,组#3中的两只动物在研究期结束时仍然存活。这些临床前试验清楚地证明,用0.5mg/kg/天cremophorel和0.000054mg/kg/天茴香霉素或0.5mg/kg/天cremophorel和0.00013mg/kg/天依米丁治疗的动物表现出辅助药物响应,其提高了各种浓度下卡培他滨的治疗指数。
图17a-17j和表2示出了htrdm-fluc#32肿瘤的免疫染色研究,其检查了化学疗法治疗期间的肿瘤和免疫细胞响应。从因重量减轻而被处死的动物(组2动物#1,第24天和动物#7,第22天;组4动物#5,第18天;组5动物#2,第24天和动物#8,第22天)解剖来自第一动物研究的肿瘤(表7)。将肿瘤速冻、固定、切片,对于细胞和重组蛋白的多表位检测,使用荧光标记和未标记的抗体的混合物检测4种巨噬细胞标记物蛋白(生物素标记的抗小鼠mhcii类分子ia/ie、alexa-647标记的抗小鼠cd11b/mac-1、alexa-488标记的抗小鼠f4/80和alexa-647标记的抗小鼠cd68)和tr报告蛋白(抗萤火虫荧光素酶)。为了检测未标记的一级抗体,使用alexa-555标记的二级抗体或pe标记的链霉亲和素(streptavidin)。使用以dapi染料进行的核dna染色检测存活的肿瘤细胞。
150多年来,已知人实体瘤表现出不同步的非指数生长,这在很大程度上是由于包含外增殖/有丝分裂层、非有丝分裂细胞层和内坏死核的多层结构。增殖细胞层(厚度<10个细胞)直接与肿瘤微环境接触,从而将营养物、氧和生长刺激因子通过被动扩散注入细胞。在有丝分裂层内部是压缩的细胞层,其减少了血管形成/血流和对被动扩散固有抗性(即肿瘤组织间隙液压)。除了降低药物扩散和代谢活性,这种高细胞密度产生了“接触抑制或ci”表型,其在g1/s检查点抑制细胞并阻止细胞周期进程。因为这些非有丝分裂ci细胞不能开始进行dna复制,它们在本质上抵抗s期细胞毒性化学治疗剂的作用。然而,肿瘤再生长需要ci肿瘤细胞以重新进入细胞周期来替换由药物损伤杀死的有丝分裂细胞。这将在肿瘤细胞中产生意料不到的g2特异性set,其仅可使用tr表达系统检测到。此外,动物通过激活吞噬性免疫细胞(对于裸小鼠,这些免疫细胞仅由先天免疫系统产生)而响应于消退肿瘤中的凋亡细胞碎片。免疫染色将用于确定肿瘤相关巨噬细胞(tam)的亚型、它们的肿瘤分布以及与濒死肿瘤细胞的关联。
缩写:fluc:萤火虫荧光素酶;dapi:4',6-二脒基-2-苯基吲哚。
将图17a的核染色与图17b的g2特异性fluc表达相关联(将从组2动物#1分离出的肿瘤用卡培他滨处理16天,表7),证实了卡培他滨在一窄条的外周有丝分裂细胞中诱导g2/m检查点并激活set核糖体翻译(fluc表达)(白色箭头,图17b,层1)。通过对从肿瘤表面延伸出的连续细胞核数量进行计数,显示出层1的平均厚度为3.4个细胞(表12)。出乎意料的是,层1细胞表现出最少的染色巨噬细胞表位,但是其边缘的内细胞层(层2)包含高浓度的f4/80染色的巨噬细胞(厚度为6.4个细胞)。总的来说,该层的f4/80+巨噬细胞的其他免疫或fluc蛋白未被染色,并且所述巨噬细胞似乎被包含在有丝分裂细胞层(厚度为9.8个细胞)之中并且确定了与有丝分裂细胞层的边界。延伸到肿瘤中的是个体f4/80+细胞,其穿透肿瘤的平均深度为16.6个细胞(层3,从表面开始的总深度为26.4个细胞)。尽管层2/3的边界包含适度数量的fluc阳性细胞体,在层3和坏死核(细胞残余物具有最少的核dapi染色)之间观察到最少的染色。这些结果与卡培他滨的作用模式、预期的实体瘤的多层结构和濒死细胞对f4/80+先天免疫细胞的特定亚类的激活一致。在从组2动物#7(已被治疗14天)处理的第二肿瘤中观察到相同的肿瘤和免疫细胞响应。
图17c和图17d(从组4动物#5分离的肿瘤,所述动物用卡培他滨、低剂量茴香霉素和cremophorel治疗10天,表7)确定了set复方药物在从层3延伸到坏死核的肿瘤细胞中激活均一的、g2特异性fluc表达(白色箭头,图17d)。在图17c中,通过无fluc抗原染色的亮的小细胞核来证明层2巨噬细胞。不同于卡培他滨肿瘤,大多数层2免疫细胞表现出对cd68标记物蛋白(cd68+f4/80-)的选择性染色,以及一小部分共染色或轻度染色的f4/80巨噬细胞。此外,cd68+f4/80-免疫细胞穿透整个肿瘤,包括坏死核。因为组4的肿瘤未表现出显著的肿瘤响应或提高的动物存活,set激动剂cremophorel在整个肿瘤中刺激g2特异性set并激活独特的cd68+f4/80-巨噬细胞亚型。尽管由低剂量茴香霉素产生的任何肿瘤或动物作用(除了重量改变)仍然是不清楚的,本研究确实表明,set复方药物迫使定位(map)在层3到坏死核的ci细胞重新进入细胞周期并开始表达g2特异性fluc报告蛋白,这在组2卡培他滨单一治疗肿瘤中未观察到。
图17e-17f和表12(从组5动物#2分离的肿瘤,所述动物用卡培他滨、高剂量茴香霉素和cremophorel治疗16天)示出了肿瘤层结构的显著改变。图17f证实了层1中存在的fluc报告蛋白的g2特异性翻译(白色箭头);然而,与组2肿瘤相比,平均厚度增加至7.8个细胞(双尾t检验,p=0.008,表12)。此外,该层是高度混乱的(disorganized)并且包含定位至肿瘤边缘的小亚细胞fluc+胞体(body)。显著的是,不同于组4肿瘤,除了在坏死核中的细胞,内部肿瘤细胞未表现出显著的fluc染色。在层2(平均厚度为7.8个细胞)和层3(平均厚度为18.6个细胞)中也观察到类似的大小增加。不同于组2肿瘤的有丝分裂细胞层,该组5肿瘤表现出15.6个细胞的层1/2的结合大小(大小增加>50%)。如上文所述,在层2和3中观察到大量cd68+f4/80-巨噬细胞穿透至坏死核。这些结果与g2期肿瘤细胞数目的增加和濒死有丝分裂细胞层内出现小fluc+胞体(肿瘤消退33.9%)一致。这支持了set复方药物的以下能力:增强卡培他滨诱导的凋亡性细胞死亡,以及促使侵入式cd68+f4/80-巨噬细胞响应,同时还减少ci细胞层中g2特异性翻译。
图17g-17h(从组5动物#8分离的肿瘤,所述动物用卡培他滨、高剂量茴香霉素和cremophorel治疗14天)表明在ci和坏死核细胞中意料不到的高水平fluc表达和细胞死亡。图17g示出了从邻近的ci/坏死层(可检测的dapi染色的细胞核)跨越到坏死核(最少的dapi染色)中的肿瘤切片的dapi染色。图17h证明该组织切片包含高密度的fluc+胞体,其定位于包含不可检测的dapi染色的细胞(图17g和17h中的白色箭头)。出乎意料的是,该数据表明,set复方药物在推测死亡的细胞中激活了预料不到的高代谢活性。此外,set复方药物刺激细胞周期进展到g2期并在所治疗的肿瘤中心增强细胞死亡。考虑到该肿瘤已经历了59.8%的尺寸消退,这些结果支持以下观点:该药物杀死位于肿瘤表面的有丝分裂细胞和坏死核内部的非有丝分裂细胞。
图17i-17j(来自组5动物#8的肿瘤)示出了使用imagej软件,对肿瘤内部的荧光fluc+染色进行定量。通过在图17i上绘制15个框(boxes)(35x695像素,0.64um/px)并测量每个695像素的荧光密度而产生荧光密度图。将最暗的坏死细胞层像素调节到100%背景并将每个像素的总荧光与该值进行比较(图17j)。该密度图示出了,与邻近的dapi+细胞相比,在表现出最小dapi染色(坏死核)的细胞中fluc染色强度增加500%-600%。这一结果与以下事实一致:在被认为是非有丝分裂并且无代谢活性的细胞中fluc报告蛋白的set(和g2特异性凋亡性细胞死亡)的非常显著且选择性的增加。
具体实施方式
在本说明书中,使用了若干术语,其在以下段落中定义。
单数术语“一”、“一个”和“所述”不意欲进行限制,并且包括复数指代物,除非另有明确地说明或上下文另有清楚地表明。
本文使用的术语“包括”与“包含”同义,并且不排除额外的要素。
本文使用的术语“增生性疾病”指特征为不想要的细胞增殖的病理以及良性病症,包括癌症。
术语“癌症”在哺乳动物中指特征为存在具有癌细胞典型特征的细胞的生理病症,所述癌细胞典型特征例如为不受控的增殖、不死性、转移潜能、快速生长和增殖、不依赖锚定的生长和某些独特的形态特征。通常,癌细胞集合将被定位到“肿瘤”中,但是这样的癌细胞也可单独存在于动物中,或可作为独立细胞在血液中循环。
“转移癌症”是从身体中的一个位置或来源转移到另一个位点的癌症。通过转移细胞形成的肿瘤被称为“转移”肿瘤或“转移瘤(metastasis)”。癌细胞扩散到身体其他部位的过程被称为“转移”。
癌症的实例包括但不限于癌、淋巴瘤、芽基(blastema)、肉瘤和白血病。更具体地,所述癌症的实例包括结直肠癌、鳞状细胞癌、小细胞肺癌、非小细胞肺癌、胰腺癌、多形性成胶质细胞瘤、食管/口腔癌、宫颈癌、卵巢癌、子宫内膜癌、前列腺癌、膀胱癌、头颈癌、肝癌和乳腺癌。
术语“增生性疾病”也涵盖了非癌细胞的细胞分裂和异常或不想要增殖的疾病,并且这样的病症可通过给予本发明的组合物来治疗。这样的增生性疾病包括,例如ebv诱导的淋巴增生性疾病和淋巴瘤、新生内膜发育不全(例如在患有动脉粥样硬化和经历气囊血管成形术的患者中)、糖尿病继发的增殖性效应、银屑病、良性肿瘤(例如血管瘤、纤维瘤和肌瘤)和骨髓增生性疾病(例如真性红细胞增多症(polycytemiavera))。
术语“受试者”、“个体”和“患者”可互换使用,指人或任何其他哺乳动物,例如小鼠、大鼠、豚鼠、兔、狗、猫、绵羊、牛、马或非人灵长类动物。
术语“受试者”、“个体”和“患者”指患有肿瘤性疾病(例如癌症)或易患肿瘤性疾病(例如癌症)但是可能或可能尚未患有所述疾病或病症的个体。例如,术语“受试者”、“个体”和“患者”可以是表现出一种或多种指示肿瘤性疾病的症状、具有一种或多种风险因子或正在被筛选肿瘤性疾病的个体。所述术语也适用于之前接受过用于增生性疾病的治疗的个体。在一个优选的方面中,所述受试者是人。
本文使用的术语“治疗”、“方案”、“治疗方法”、“步骤(procedure)”、“疗法”或其等价物指方法、组合物或过程,其旨在:(1)延迟或预防医学病症、疾病或障碍的发生或复发;(2)延缓或终止病症的症状的进展、加剧或恶化;(3)缓解病症的症状;和/或(4)治愈病症。治疗癌症或增殖性细胞疾病不必意指所有的增殖性细胞都将会被清除、增殖性细胞的数目将会被减少或病症的症状将会被被缓解。通常要进行治疗,即使成功的几率低,然而提供了医疗史以及预估的患者的存活预期的治疗被认为是可能有利的。对于预防性活动而言,可在病症发作前给予治疗,对于治疗性作用而言,可在病症开始或发作之后给予治疗。
本文使用的术语“物质”指具有确定的化学组成的物质,并且在本文中可与术语“化合物”和“药物”互换使用。本文使用的术语“细胞毒性剂”“化学治疗剂”、“抗肿瘤药”、“治疗剂”、“细胞毒性肿瘤学药物”和“抗癌药物”可互换使用,以指为各种形式的增生性疾病、癌症和增殖性细胞疾病提供治疗的物质、分子、化合物、组合物、试剂、因子、方法或组合物。细胞毒性肿瘤学药物在常规上被划分为“细胞毒性抗肿瘤药”,例如核苷类似物、抗叶酸剂、其他抗代谢物、拓扑异构酶i抑制剂、蒽环类、鬼臼毒素、紫杉烷类、长春花生物碱类、烷化剂、铂化合物,以及杂多化合物(miscellaneouscompound)或“靶向抗肿瘤药”,例如单克隆抗体、酪氨酸激酶抑制剂、mtor抑制剂、类维生素a(retinoid)、免疫调节剂、组蛋白脱乙酰酶抑制剂和其他试剂。细胞毒性肿瘤学药物直接或间接抑制癌细胞生长或杀死癌细胞。
术语“护理标准”、“一线疗法”、“诱导疗法”、“主要疗法”和“主要治疗”在本文中用于定义临床医生应当遵循的用于某种类型的患者、疾病或临床状况的第一治疗选择。因为疾病治疗是复杂的,给定的一线疗法不必是仅有的护理选择标准。术语“辅助性药物”和“佐药”在本文中可互换使用,并且指被添加到主要疗法、治疗或步骤,增强主要疗法、治疗或步骤的功效、安全性或促进其表现的任何额外的物质、治疗或步骤。在功能上,辅助性药物在没有主要物质、治疗或步骤的情况下施用时可表现或不表现出治疗活性。
本文使用的术语“生物学有效剂量和/或量”、“治疗有效剂量/量”和“有效剂量/量”指在组织、器官系统或受试者中引起所需生物、医学或治疗响应的物质、组合物或治疗方法的任何数量。例如,所需响应可包括治疗范例的一种或多种优选的结果。
术语“泛耐药性”、“极端耐药性”和“交叉耐药性”在本文中可互换使用,以定义特征为针对肿瘤治疗药物和方法的广泛抗性的细胞表型。这种方法区别于多耐药性,后者用于描述药物转运系统的过表达。
本文使用的术语“共同给药”和“结合”指给予两种或更多种在受试者中表现出生物学有效或治疗活性的药物。共同给予的药物或复方药物可同时或依次递送。两种或更多种生物学有效或具有治疗活性的物质可作为单一或独立的组合物递送。
“药物组合物”在本文中被定义为包括一定量的药物和至少一种“生理上可接受的载体”或“赋形剂”。药物组合物可包括多种额外的成分以辅助或提高配方物活性,例如生物可利用率、药代动力学或药效学,以及一种或多种治疗剂。本文使用的术语“生理上可接受的载体”和“赋形剂”指不干扰任何活性药物成分的治疗功效或生物过程并且在给药浓度下对受试者没有过度毒性的试剂。术语赋形剂可通过但不限于以下试剂来示例:稀释剂、填充剂、抗氧化剂或其他稳定剂、分散剂、溶剂、分散介质、包衣、抗细菌剂、等渗剂、吸附延迟剂或吸附增强剂等。这些赋形剂用于配制药学活性物质的用途是本领域中公知的,参见例如"remington'spharmaceuticalsciences",e.w.martin,18thed.,1990,mackpublishingco.:easton,pa.,通过引用的方式将其全文纳入本文。
术语“cap依赖性核糖体”和“生长核糖体”指真核核糖体及相关的启动因子,其与mrna的5’端的选择性结构相互作用并且通过结合并扫描到正在生长和增殖的细胞中的优选翻译起始密码子来启动真核翻译(cap依赖性翻译)。术语“选择性翻译”(set)指不是由cap依赖性翻译过程产生的全部细胞翻译活性,或由于抑制cap依赖性翻译而导致的翻译。“set核糖体”是真核核糖体,以及产生不是由cap依赖性翻译过程产生的全部细胞翻译活性所需的,或由于抑制cap依赖性翻译而导致的翻译所需的任何相关蛋白或复合物。set核糖体在s晚期和g2细胞周期阶段指导蛋白的选择性合成(set)。在set过程中,set核糖体能够启动从内部mrna序列(被称为“内部核糖体进入序列”(ires;指导40s核糖体亚基与特定的mrna序列的结合))的翻译,并且能够使用mrna“再起始序列”(由tr表达盒中的调节序列来示例)来再起始翻译。翻译调节(tr)技术是基于tr表达盒(源自哺乳动物蛋白脂质蛋白质基因)内特定的rna序列和mrna二级结构,其结合至并定向40s核糖体亚基(不与5'mrnacap结构发生任何相互作用),从而将可操作连接的报告基因的翻译起始密码子定位在用于翻译起始的核糖体解码中心。
术语“set激动剂”指通过激活set核糖体来增加trmrna的set,产生set激动剂“响应”,并且诱导细胞周期进展到s/g2晚期,同时抑制cap依赖性翻译的试剂或治疗。set激动剂“响应”被定义为异常tr测定结果(通过任何tr测定形式检测,例如细胞计数15-试剂测定),其为所有累积的set响应的平均值以上的>2标准差。例如,用5种参考标准物(tpa、tax、cal、mg132和camp)处理hct116mtrdm-fluc细胞系确定tpa-tax是set激动剂,因为该tr测定平均值为每5种参考标准物响应的平均值以上的>3标准差。
术语“set核糖体拮抗剂”指当与set激动剂结合递送时,在ic100剂量(其为啮齿类动物ld50浓度的0.02%)下完全阻断set激动剂活性和set核糖体翻译的试剂(结合至或作用于set核糖体)。例如,通过tr测定(例如细胞计数剂量依赖性修饰剂测定)来检测ic100剂量或100%抑制剂浓度,所述tr测定检验使已知set激动剂(例如tpa)失活的特定的set拮抗剂剂量。
术语“基因”指包含产生多肽或前体或rna(例如,trna、sirna、rrna等)必需的编码序列的核酸(例如dna)序列。多肽可由全长编码序列或编码序列的任何部分编码,只要全长或片段的所需活性或功能特性(例如酶活性、配体结合、信号转导等)被保留。所述术语也涵盖了结构基因的编码区以及在位于编码区5’端和3’端附近的序列,从而所述基因对应于全长mrna的长度。位于编码区5’端并且存在于mrna上的序列被称为5’非翻译序列。位于编码区3’端或下游并且存在于mrna上的序列被称为3’非翻译序列。术语“基因”包括基因的cdna和基因组形式。基因的基因组形式或克隆包含编码区,其可被称为“内含子”或“插入区”或“插入序列”的非编码序列中断。内含子从细胞核或初级转录产物中被去掉或“剪接掉”,因此不存在于信使rna(mrna)转录产物中。mrna在翻译过程中发挥作用以指定产生的多肽中氨基酸的序列或次序。
术语“表达载体”指包含核酸表达盒的病毒载体和非病毒载体。
术语“表达盒”用于定义包含与编码序列可操作连接的调节元件的核苷酸序列,其导致细胞中编码序列的转录和翻译。
“哺乳动物启动子”指在哺乳动物细胞中发挥功能或来自哺乳动物细胞或同时二者的转录启动子。
“哺乳动物最小启动子”指通过rna聚合酶结合恰当地启动转录的所需的“核”dna序列,但是其在不存在任何可操作连接的转录效应物序列的情况下仅表现出象征性的(token)转录活性。
词语“开放阅读框”或“编码序列”指编码多肽或蛋白的核苷酸序列。编码区限于真核细胞中,其在5’端为编码起始子甲硫氨酸的核苷酸三联体“atg”,在3’端为指定终止密码子(即taa、tag和tga)的三联体之一。
“可操作地连接的”被定义为意指核酸与另一个核酸序列处于功能关系中。例如,如果启动子或增强子影响编码序列的转录,则启动子或增强子与该序列可操作地连接;或如果核糖体结合位点的位置有助于翻译,则核糖体结合位点与编码序列可操作地连接。通常,“可操作地连接的”意指被连接的dna序列是连续的。然而,增强子不必是连续的。通过在便利的限制性位点连接来实现连接。如果这样的位点不存在,则根据常规操作使用合成的寡核苷酸接头(adaptor或linker)。
“重组体”指方法、试剂和实验室操作的结果,其中对核酸或其他生物分子进行酶法的、化学的或生物学的裂解、合成、结合或其他离体操作以在细胞或其他生物体系中产生所需产物。术语“重组dna”指由通过分子生物学技术连接在一起的dna片段组成的dna分子。
“转染”是用于描述将外源物质(如外源dna)引入真核细胞的术语。该术语可与“转化”和“转导”互换使用,尽管后者在其狭义范围内指通过病毒(其作为载体起作用)将dna引入细胞的过程。因此,经过转染的细胞被称为“转染的”、“转化的”或“转导的”细胞。
本文使用的术语“质粒”指独立复制的dna片段。质粒通常是环状和双链的。
“报告基因”指可使用本领域技术人员已知的常规技术来检测或测量其表达的任何基因。
术语“调节元件”或“效应元件”指转录启动子、增强子、沉默子或终止子,以及调节核糖体活性或mrna成熟的任何转录调节元件、多聚腺苷酸化位点等。调节元件和效应物元件可被排列,从而允许、增强或辅助在它们调节之下的成熟编码序列的选择性产生。
术语“载体”指可插入外源dna片段的dna分子。通常,载体包含目的调节序列和编码序列。术语“载体”包括但不限于质粒、粘粒、噬菌粒、病毒载体和穿梭载体。
“穿梭”载体是能够进行原核复制但不包含真核复制序列的质粒载体。该复制缺陷的穿梭载体中包含的病毒dna序列指导真核宿主细胞内的重组以产生传染性的病毒粒子。
术语“应激”或“毒性”用于指细胞的天然生物化学和生物物理学内稳态的扰动。然而应激通常导致细胞稳态的恢复,毒性响应最终导致细胞死亡。
根据本发明的方面,用于治疗增生性疾病的方法包括给予哺乳动物选择性翻译(set)治疗剂,其包括细胞毒性药物和set复方药物。根据本发明的方面,用于治疗增生性疾病的方法包括给予人受试者set治疗剂,其包括细胞毒性药物和set复方药物。
根据本发明的方面的组合物包括细胞毒性试剂和set复方药物。
根据本发明的方面的组合物包括卡培他滨和set复方药物。
set复方药物包括set响应的激活剂和set核糖体活性的抑制剂。
根据本发明的方面,所包含的set响应的激活剂是蛋白激酶c激活剂,例如但不限于佛波酯。
根据本发明的方面,所包含的set核糖体拮抗剂是转录调节剂依米丁。
任选地,一种或多种额外的抗癌治疗(例如给予一种或多种额外的细胞毒性药物、放射疗法、光动力学疗法、手术或其他免疫疗法)可与set治疗剂结合以治疗患者的增生性疾病。
根据本发明的方面,表达盒包含调节基因表达的上游转录效应物序列。一方面,转录效应物序列是哺乳动物启动子。此外,转录效应物也可包括额外的启动子序列和/或转录调节因子,例如增强子或沉默子或其结合。这些转录效应物序列可包括已知结合至细胞组分的部分,所述细胞组分调节任何可操作地连接的编码序列的转录。例如,增强子或沉默子序列可包含结合已知细胞组分(例如转录调节蛋白)的序列。转录效应物序列可选自任何适合的核酸,例如基因组dna、质粒dna、病毒dna、mrna或cdna,或任何适合的生物体(例如病毒、细菌、酵母、真菌、植物、昆虫或哺乳动物)。本领域技术人员可根据所使用的转录和/或翻译系统来选择适合的转录效应物序列。在转录效应物元件内,任何单独的调节核酸序列可以以野生型排列方式(如以天然基因组次序存在)或人工排列方式进行排列。例如,经修饰的增强子或启动子序列可包含调节核酸序列的重复单位,从而通过这些改变来修饰来自载体的转录活性。
一方面,tr核酸表达盒或对照核酸表达盒中包含的启动子选自组成型、组织特异性和肿瘤特异性启动子。
tr核酸表达盒或对照核酸表达盒中包含的组成型启动子可选自例如rous肉瘤病毒(rsv)长末端重复(ltr)启动子、巨细胞病毒早期即刻基因(cmv)启动子、猿猴病毒40早期(sv40e)启动子、细胞质β-肌动蛋白启动子、腺病毒主要晚期启动子和磷酸甘油激酶(pgk)启动子。根据一方面,tr核酸表达盒或对照核酸表达盒中包含的组成型启动子是cmv启动子。根据一方面,tr核酸表达盒或对照核酸表达盒中包含的组成型启动子是sv40e启动子。
tr核酸表达盒或对照核酸表达盒中包含的组织特异性启动子可选自,例如转铁蛋白(tf)、酪氨酸酶(tyr)、白蛋白(alb)、肌肉肌酸激酶(ckm)、髓磷脂碱性蛋白(mbp)、神经胶质原纤维酸性蛋白(gfap)、神经元特异性烯醇酶(nse)和突触蛋白i(syn1)启动子。根据一方面,tr或对照表达盒中包含的组织特异性启动子是突触蛋白i(syn1)启动子。在另一个优选方面中,tr或对照表达盒中包含的组织特异性启动子是alb启动子。
tr核酸表达盒或对照核酸表达盒中包含的肿瘤特异性启动子可选自,例如血管内皮生长因子(vegf)、vegf受体(即kdr、e-选择素或内皮联蛋白(endoglin))、α-甲胎蛋白(afp)、癌胚抗原(cea)、erbb2(v-erb-b2成红细胞白血病病毒癌基因同系物2)、骨钙素(骨γ-羧基谷氨酸盐蛋白,bglap)、slp1(分泌白细胞蛋白酶(leukoproteinase)抑制剂或抗白细胞蛋白酶1)、低氧响应元件(hre)、l-网素(淋巴细胞溶质蛋白1)和己糖激酶ii(hk2)。在一个优选的方面中,tr核酸表达盒或对照核酸表达盒中包含的肿瘤特异性启动子是α-甲胎蛋白(afp)启动子。在另一个优选方面中,tr核酸表达盒或对照核酸表达盒中包含的肿瘤特异性启动子是slp1启动子。
根据本发明的方面,将特异性转录效应物元件分离,然后可操作地连接至tr核酸表达盒或对照核酸表达盒中的最小启动子,产生其转录活性依赖于单一或有限类型的细胞响应(例如热休克响应或金属调节的元件)的表达盒。
根据本发明的方面,tr核酸表达盒或对照核酸表达盒可包含物种特异性转录调节序列。这样的dna调节序列可根据表达盒所插入的细胞类型进行选择,并且可从原核或真核细胞(包括但不限于细菌、酵母、植物、昆虫、哺乳动物细胞)或病毒中分离。在这样的实例中,可选择哺乳动物启动子以在哺乳动物细胞中表达所选的核酸。
编码报告蛋白的开放阅读框核酸序列位于编码tr核酸表达盒中的tr元件的核酸的3’端,或位于对照核酸表达盒中的组成型启动子的3’端。编码报告蛋白的核酸序列可以是全基因组序列(例如,包含内含子)、合成核酸或编码报告蛋白的基因的cdna拷贝。在一个优选方面中,编码报告蛋白的cdna序列被包含在tr核酸表达盒或对照核酸表达盒中,这是由于通过去除mrna剪接位点降低了基因组复杂性。
将编码报告蛋白的核酸序列和编码tr元件的核酸序列插入到tr核酸表达盒中的技术是本领域已知的,并且包括直接或通过接头连接序列,从而使所述核酸序列处于表达盒中包含的调节元件的控制之下。可将一个或多个提供限制性内切核酸酶位点的接头添加到表达盒中包含的任何核酸序列,以促使正确插入序列。
如本文所述,报告基因编码报告蛋白,其赋予表达报告蛋白的细胞可检测的生物化学或视觉上可观察到的(例如荧光)表型。报告蛋白也可包括融合或杂合多肽,其中另一个多肽被融合在所述多肽或其片段的n端或c端。通过克隆在框内的编码一个多肽的核酸序列(或其部分)与编码另一个多肽的核酸序列(或其部分)来产生融合多肽。用于产生融合多肽的技术是本领域已知的,并且包括连接编码多肽的编码序列,从而使所述编码序列在框内并且融合多肽的翻译处于表达盒中包含的调节元件的控制之下。
本文所述的表达盒中编码的报告蛋白的非限制性实例包括抗原表位、生物发光蛋白、酶、荧光蛋白、受体和转运蛋白。
一类常用的报告基因编码酶或其他生物化学标记物,其在哺乳动物细胞中表达时导致细胞中或细胞环境中可见的改变。这样的改变可直接观察到,可包括添加适当的底物(其被转化为可检测的产物),或添加代谢示踪剂并与之结合。这些报告基因的实例为细菌lacz基因,其编码β-半乳糖苷酶(β-gal),氯霉素乙酰转移酶(cat),萤火虫荧光素酶(鞘翅目(coleoptera)甲虫),renilla荧光素酶(海肾),gaussia荧光素酶,单纯疱疹1胸苷激酶(hsv1-tk)和突变单纯疱疹1胸苷激酶(hsvl-sr39tk)基因。在β-gal的情况下,孵育表达细胞与卤素衍生的半乳糖导致有色或荧光产物,其可通过组织化学法或荧光计量法来检测和定量。在cat的情况下,将细胞裂解物与放射性标记的氯霉素或另一种乙酰基供体分子(例如乙酰coa)孵育,并通过色谱法来测定乙酰化的氯霉素产物。其他有用的报告基因编码天然发出荧光的蛋白,包括绿色荧光蛋白(gfp)、增强黄色荧光蛋白(eyfp)或单体红色荧光蛋白(mrfp1)。
由表达盒中的核酸编码的报告蛋白可选自荧光素酶、gfp、eyfp、mrfp1、β-gal和cat,但是也可使用本领域已知的任何其他报告基因。根据优选方面,由表达盒中的核酸编码的报告蛋白是萤火虫荧光素酶。在另一个优选方面中,由表达盒中的核酸编码的报告蛋白是renilla荧光素酶。在另一个优选方面中,由表达盒中的核酸编码的报告蛋白是gaussia荧光素酶。
本领域技术人员将容易地意识到,可将任何多聚腺苷酸化(polya)信号掺入到本文所述的tr核酸表达盒或对照核酸表达盒的3’非翻译(3'utr)元件中。适用于本发明的polya序列的实例包括sv40早期和晚期基因、hsv-tk和人生长激素(hgh)序列。根据一个优选方面,polya序列是sv40早期基因序列。
根据本发明的表达盒的方面,3'utr可包含一个或多个通过改变mrna稳定性来调节基因表达的元件。通常,通过失去mrnapolya尾、将去腺苷酸化rna募集(recruitment)到外来体和核糖核酸酶(rnase)降解来例证mrna衰变(decay)。在选择mrna中,这个过程是通过特定的rna不稳定性元件而加速,所述元件促使细胞降解系统对mrna的选择性识别。在本发明中,表达盒mrna可包含元件,例如3'utr富含au的元件(“are”)序列,其源自编码细胞响应/恢复基因的mrna种类。
根据本发明的方面,任选地包含在表达盒中的are序列的实例为来自c-fos、粒细胞巨噬细胞集落刺激因子(gm-csf)、c-jun、肿瘤坏死因子α(tnf-α)和il-8mrna的3'utr序列。根据优选方面,来自c-fos基因的are序列被包含在tr核酸表达盒或对照核酸表达盒中。
tr核酸表达盒或对照核酸表达盒也可包含5'非翻译区(5'utr),其位于启动子的3'端和编码tr核酸表达盒中的tr元件的序列的5'端。在表达盒的一些方面,这样的区域包含mrna转录起始位点。在表达盒的其他方面,5'非翻译区包含内含子序列,其指导mrna剪接并且是一些mrna种类的体内有效加工所必需的。真核细胞中mrna剪接的一般机制在sharp(science235:736-771,1987)中定义和总结。mrna剪接必需的4种核酸序列为:5'剪接供体、分支点、多聚嘧啶区(tract)和3'剪接受体。共有的5'和3'剪接点(mount,nucl.acids.res.10:459-472,1992)和分支位点序列(zhuangetal.,pnas86:2752-2756,1989)是本领域已知的。
tr核酸表达盒或对照核酸表达盒也可包含一个或多个5'utr序列,其包含一个或多个存在于天然基因序列中的天然内含子或人工内含子,例如存在于paav-mcs载体(stratagene)中的β-珠蛋白-免疫球蛋白序列。
tr核酸表达盒或对照核酸表达盒可包含一个或多个以下序列:位于启动子5'端的约15-50个核苷酸的序列,其包含一个或多个限制性位点,用来将表达盒插入到质粒、穿梭载体或病毒载体中;位于编码tr元件的序列或组成型启动子的3'端和报告序列的5'端的约15-50个核苷酸的序列,其包含一个或多个限制性位点,用于插入和可操作地连接编码tr元件的序列或组成型启动子和编码报告蛋白的序列;位于报告蛋白序列3'端和多聚腺苷酸化信号5'端的约15-50个核苷酸的序列,其包含一个或多个限制性位点,用于插入和可操作地连接orf序列和多聚腺苷酸化序列;以及位于多聚腺苷酸化序列3'端的约15-50个核苷酸的序列,其包含一个或多个限制性位点,用于将核酸表达盒插入到质粒、穿梭载体或病毒载体中。
根据用于复制表达盒的宿主细胞,可将本文所述的tr核酸表达盒或对照核酸表达盒插入到质粒或病毒(“穿梭”)载体中。通常,使用本领域已知技术,将tr核酸表达盒或对照核酸表达盒插入到载体中适当的限制性内切核酸酶位点中。适用于该目的的多种载体通常是已知的,例如记载于miller,humangenetherapy15-14,1990;friedman,science244:1275-1281,1989;eglitisandanderson,biotechniques6:608-614,1988;tolstoshevandanderson,currentopinioninbiotechnology1:55-61,1990;sharp,thelancet337:1277-1278,1991;cornettaetel.,nucleicacidresearchandmolecularbiology36:311-322,1987;anderson,science226:401-409,1984;moen,bloodcells17:407-416,1991;milleretal.,biotechniques7:980-990,1989;legallasalleetal.,science259:988-990,1993;和johnson,chest107:77s-83s,1995。
部分根据要用质粒转化的宿主细胞来选择质粒载体。例如,质粒中存在的细菌或哺乳动物选择性标记物的存在、复制起点、质粒拷贝数、指导与染色体dna的随机或位点特异性重组的能力等,能够影响适当的载体的选择。细菌质粒,例如pbluescriptii、pet14、puc19、pcmv-mcs和pcmvneo可用于在细菌细胞中增殖本发明的表达盒。在一个优选方面中,质粒是pcmvneo载体。在另一个优选方面中,质粒是pbluescriptii载体。
另一方面,将tr核酸表达盒或对照核酸表达盒插入到哺乳动物或病毒穿梭载体中。而哺乳动物穿梭载体包含哺乳动物选择性标记物并且提供对包含稳定基因组整合体的细胞的分离,病毒穿梭载体使用重组或遗传互补而提供病毒基因组的重构。在一些方面,哺乳动物穿梭载体选自pcmv、peyfp-n1、pegfp-n1或pegfp-c1质粒。在一个优选方面,哺乳动物穿梭载体为peyfp-n1。在一些方面,病毒穿梭载体选自paav-mcs(腺相关病毒血清型2或aav2基因组)或pbac-1、pbacpak8/9(苜蓿银纹夜蛾(autographacalifornica)杆状病毒基因组)质粒。在一个优选方面中,病毒穿梭载体是paav-mcs。在另一个优选方面中,病毒穿梭载体是pbac-1质粒。
为了确保将tr核酸表达盒或对照核酸表达盒有效递送到特定的细胞、组织或器官,可将它纳入有助于细胞靶向的非病毒递送系统。例如,可将包含本发明的tr核酸表达盒或对照核酸表达盒的哺乳动物穿梭质粒包封在脂质体中。脂质体包括乳剂、泡沫、微团、不溶性单层、液晶、磷脂分散液、片状层等。使用脂质体载体将dna序列递送到靶细胞,以及制备这些脂质体的方法是本领域公知的。
适用于实施本发明的病毒包括重组修饰的包膜或非包膜dna和rna病毒,优选地选自杆状病毒科(baculoviridiae)、细小病毒科(parvoviridiae)、微小核糖核酸病毒科(picornoviridiae)、疱疹病毒科(herpesviridiae)、痘病毒科(poxviridiae)和腺病毒科(adenoviridiae)病毒。根据方面,重组病毒是杆状病毒科病毒。在一个优选方面中,杆状病毒是苜蓿银纹夜蛾衍生病毒。在其他实施方案中,病毒是细小病毒科病毒。在一个优选方面中,腺相关病毒(“aav”)是aav血清型2。在另一个方面中,aav是aav血清型1。
病毒基因组优选地是通过重组dna技术进行修饰以包含本发明的tr核酸表达盒或对照核酸表达盒,并且可对病毒基因组进行改造,使其成为复制缺陷型的、条件复制型的或能够复制的。例如,以下情况被证明是有用的:使用条件复制型的病毒以限制病毒在特定的、受调节的细胞培养条件下复制。
本文包括嵌合病毒载体,其利用多于一个“亲代”病毒特性的有利元件。在本发明中也可产生和使用最小载体系统,其中病毒骨架仅包含包装病毒载体所需要的序列,并且任选地包含tr核酸表达盒或对照核酸表达盒。通常优选地使用来自待被治疗的物种的病毒,例如当用病毒转导人细胞或人细胞系时,优选使用人疱疹病毒。在一些情况下,可使用源自待被病毒转导的物种以外的物种的病毒。例如,来自非人来源的血清型的腺相关病毒(aav)适用于治疗人,因为非人血清型应当不会立即被天然或预存的人抗体识别。通过使对载体的免疫应答最小,避免了载体的快速全身性清除并增加了载体体内功效的持续时间。
上述任何哺乳动物穿梭载体中的tr核酸表达盒或对照核酸表达盒可被转化到哺乳动物细胞中。通过本领域技术人员可获得的任何技术,可将穿梭载体引入到宿主细胞中。这些技术包括但不限于化学转染(例如氯化钙法、磷酸钙法)、脂转染、电穿孔、细胞融合、显微注射和病毒感染(ridgway,a."mammalianexpressionvectors"ch.24,pg.470-472,rodriguezanddenhardt,eds.,butterworths,bostonma1988)。
根据本发明的方面,表达盒中包含的和/或被整合到稳定细胞系基因组中的dna序列编码的翻译调节或tr元件是内部核糖体进入位点(ires),其可通过以下特征与其他ires区分:(a)其核酸序列背景和(b)调节翻译的细胞活性(美国公开专利申请号2006/0173168,其以引用的形式纳入本文)。这两个特征的结合构成了在应激和/或濒死哺乳动物细胞中与该ires序列可操作地连接的下游编码序列的选择性翻译的基础。
在一些实施方案中,本发明的ires元件具有cap非依赖性翻译活性,其定位在哺乳动物蛋白脂质蛋白质(plp)基因或其dm20剪接变体的orf内。在其天然环境中,plpires活性存在于包含若干上游orf(“uorf”)的多顺反子rna中,其在正常细胞中有效阻断核糖体扫描到内部aug密码子。然而,细胞暴露于毒性剂导致核糖体结合和特定的内部rna序列的翻译,从而从plporf的3'端翻译内部氨基酸序列(例如pirp-m和pirp-l肽)。
根据本发明的方面,编码tr元件(其源自编码任何哺乳动物物种的蛋白脂质蛋白质(plp)或蛋白脂质蛋白质的dm20同种型的基因)的核酸序列被包含在tr表达盒中和/或被整合到稳定细胞系的基因组中。编码plp和dm20的核酸序列的特征在于,在哺乳动物物种之间的高度同一性。本文详细描述了编码tr元件的人和小鼠plp和dm20dna序列。
小鼠plp和人plpdna序列(分别为seqidno:6和8)是高度相关的并且特征为96.5%同一性。小鼠dm20和人dm20dna序列(分别为seqidno:5和7)是高度相关的并且特征为96%同一性。
plpdna序列与dm20dna序列高度相关,尽管与plpdna序列相比,dm20的特征在于104个核苷酸缺失(替代性的mrna剪接)。使用人plpdna序列(seqidno:8)作为参照,人dm20dna序列为87.5%同一的,小鼠dm20为84.3%同一的。tr元件编码序列seqidno:1与人plpdna序列(seqidno:8)具有83.1%同一性。因此,根据本发明的方面,当外显子3b存在时,表达盒中包含的tr元件编码序列的变体与seqidno:8具有83%同一性或更高同一性。
根据本发明的方面,将外显子5任选地从表达盒中编码tr元件的dna序列中排除,和/或整合到稳定细胞系的基因组中。使用人plpdna序列(seqidno:8)作为参照,排除外显子5的人dm20dna序列为78.7%同一的,排除外显子5的小鼠dm20为75.4%同一的。从tr元件编码序列seqidno:1中缺失外显子5之后产生的dna序列与人plpdnaseqidno:8具有74.2%同一性。因此,根据本发明的方面,当外显子3b和5缺失时,表达盒中包含的tr元件编码序列的变体与seqidno:8具有74.2%同一性或更高同一性。
根据本发明的方面,编码tr元件的包含于tr元件表达盒和/或被整合到稳定细胞系基因组中的dna序列不编码任何表达的蛋白或肽,使得在tr元件编码序列中保留一个或多个氨基酸密码子并不影响对编码tr元件的dna序列的分析。
seqidno:17是编码适用于根据本发明方面的组合物和方法的tr元件的蛋白脂质蛋白质突变体共有序列。seqidno:17的特征在于,在核苷酸722位为核苷酸t;在核苷酸772位为核苷酸a;在核苷酸503-526位编码第一18srrna结合位点;以及在核苷酸796-822位编码第二18srrna结合位点,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。seqidno:17的变体包括这些特征,并且其他特征为,与全长seqidno:17具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:18是编码适用于本发明的方面的组合物和方法的tr元件的dm20蛋白脂质蛋白质共有序列。seqidno:18的特征在于,在核苷酸617位为核苷酸t;在核苷酸667位为核苷酸a;并且其他特征为,在核苷酸398-422位编码第一18srrna结合位点;以及在核苷酸691-716位编码第二18srrna结合位点,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。seqidno:18的变体包括这些特征,并且其他特征为,与全长seqidno:18具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:19是编码适用于本发明的方面的组合物和方法的tr元件的蛋白脂质蛋白质共有序列。seqidno:19的特征在于,在核苷酸648位为核苷酸t;在核苷酸698位为核苷酸a;在核苷酸503-526位编码第一18srrna结合位点;以及在核苷酸722-748位编码第二18srrna结合位点,其中外显子5缺失,并且其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。seqidno:19的变体包括这些特征,并且其他特征为,与全长seqidno:19具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:20是编码适用于本发明的方面的组合物和方法的tr元件的dm20蛋白脂质蛋白质共有序列。seqidno:20的特征在于,在核苷酸543位为核苷酸t;在核苷酸593位为核苷酸a;并且其他特征为,在核苷酸398-422位编码第一18srrna结合位点;以及在核苷酸617-642位编码第二18srrna结合位点,其中外显子5缺失,并且其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。seqidno:20的变体包括这些特征,并且其他特征为,与全长seqidno:20具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:1编码tr元件(mtrdm),其源自编码蛋白脂质蛋白质的dm20同种型的小鼠基因。seqidno:1的特征在于,在核苷酸617位为核苷酸t;在核苷酸667位为核苷酸a;在核苷酸1位从a突变为t;在核苷酸4位从g突变为a;在核苷酸6位从c突变为t;在核苷酸7位从t突变为g;在核苷酸8位从t突变为a;在核苷酸17位从g突变为a;在核苷酸18位从t突变为g;在核苷酸21位从t突变为a;在核苷酸27位从a突变为t;在核苷酸511位从a突变为t;以及在核苷酸598位从a突变为t,所有突变都是相对于seqidno:5的野生型小鼠dm20(mdm)dna序列;另外的特征在于,在核苷酸398-422位编码第一18srrna结合位点;在核苷酸691-716位编码第二18srrna结合位点,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:1编码的tr元件的变体是由726个核苷酸的dna序列编码,其特征在于,在核苷酸617位为核苷酸t;在核苷酸667位为核苷酸a;其他特征在于,在核苷酸1、2和3位的任意或全部核苷酸发生突变,使得核苷酸1、2和3位不是atg;在核苷酸27、28和29位的任意或全部核苷酸发生突变,使得核苷酸27、28和29位不是atg;在核苷酸511、512和513位的任意或全部核苷酸发生突变,使得核苷酸511、512和513位不是atg;在核苷酸598、599和600位的任意或全部核苷酸发生突变,使得核苷酸598、599和600位不是atg;在核苷酸2、3和4位的任意或全部核苷酸发生突变,使得核苷酸2、3和4位是终止密码子;在核苷酸6、7和8位的任意或全部核苷酸发生突变,使得核苷酸6、7和8位是终止密码子;在核苷酸16、17和18位的任意或全部核苷酸发生突变,使得核苷酸16、17和18位是终止密码子;在核苷酸19、20和21位的任意或全部核苷酸发生突变,使得核苷酸19、20和21位是终止密码子;所有的突变都是相对于seqidno:5;在核苷酸398-422位编码第一18srrna结合位点;在核苷酸691-716位编码第二18srrna结合位点;其他特征在于,与seqidno:5具有至少83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性,或与seqidno:5具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:1编码的tr元件的变体是由726个核苷酸的dna序列编码,其特征在于,在核苷酸617位为核苷酸t;在核苷酸667位为核苷酸a;其他特征在于,核苷酸1位是t;核苷酸4位是a;核苷酸6位是t;核苷酸7位是g;核苷酸8位是a;核苷酸17位是a;核苷酸18位是g;核苷酸21位是a;核苷酸27位是t;核苷酸511位是t;核苷酸598位是t,所有的突变均是相对于seqidno:5;在核苷酸398-422位编码第一18srrna结合位点;在核苷酸691-716位编码第二18srrna结合位点;其他特征在于,与seqidno:5具有至少83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性,或与seqidno:5具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:1编码的tr元件的变体是由652个核苷酸的dna序列编码,其特征在于,在核苷酸543位为核苷酸t;在核苷酸593位为核苷酸a;其他特征在于,核苷酸1位是t;核苷酸4位是a;核苷酸6位是t;核苷酸7位是g;核苷酸8位是a;核苷酸17位是a;核苷酸18位是g;核苷酸21位是a;核苷酸27位是t;核苷酸511位是t;核苷酸524位是t,并且外显子5(518-591位核苷酸)缺失,所有突变均是相对于seqidno:5;在核苷酸398-422位编码第一18srrna结合位点;在核苷酸617-642位编码第二18srrna结合位点;其他特征在于,与seqidno:5具有至少83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性,或与seqidno:5具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:1编码的tr元件的变体是由652个核苷酸的dna序列编码,其特征在于,在核苷酸543位为核苷酸t;在核苷酸593位为核苷酸a;其他特征在于,在核苷酸1、2和3位的任意或全部核苷酸发生突变,使得核苷酸1、2和3位不是atg;在核苷酸27、28和29位的任意或全部核苷酸发生突变,使得核苷酸27、28和29位不是atg;在核苷酸511、512和513位的任意或全部核苷酸发生突变,使得核苷酸511、512和513位不是atg;在核苷酸524、525和526位的任意或全部核苷酸发生突变,使得核苷酸524、525和526位不是atg;在核苷酸2、3和4位的任意或全部核苷酸发生突变,使得核苷酸2、3和4位是终止密码子;在核苷酸6、7和8位的任意或全部核苷酸发生突变,使得核苷酸6、7和8位是终止密码子;在核苷酸16、17和18位的任意或全部核苷酸发生突变,使得核苷酸16、17和18位是终止密码子;在核苷酸19、20和21位的任意或全部核苷酸发生突变,使得核苷酸19、20和21位是终止密码子;外显子5(518-591位核苷酸)缺失,所有的突变均是相对于seqidno:5;在核苷酸398-422位编码第一18srrna结合位点;在核苷酸617-642位编码第二18srrna结合位点;其他特征在于,与seqidno:5具有至少83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性,或与seqidno:5具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:3编码tr元件(htrdm),其源自编码蛋白脂质蛋白质的dm20同种型的人基因。seqidno:3的特征在于,在核苷酸617位为核苷酸t;在核苷酸667位为核苷酸a;并且还包括:在核苷酸1位从a突变为t;在核苷酸4位从g突变为a;在核苷酸6位从c突变为t;在核苷酸7位从t突变为g;在核苷酸8位从t突变为a;在核苷酸17位从g突变为a;在核苷酸18位从t突变为g;在核苷酸21位从t突变为a;在核苷酸27位从a突变为t;在核苷酸511位从a突变为t;以及在核苷酸598位从a突变为t,所有突变都是相对于seqidno:7的野生型hdmdna序列;在核苷酸398-422位编码第一18srrna结合位点;在核苷酸691-716位编码第二18srrna结合位点,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:3编码的tr元件的变体是由726个核苷酸的dna序列编码,其特征在于,在核苷酸617位为核苷酸t;在核苷酸667位为核苷酸a;其他特征在于,核苷酸1位是t;核苷酸4位是a;核苷酸6位是t;核苷酸7位是g;核苷酸8位是a;核苷酸17位是a;核苷酸18位是g;核苷酸21位是a;核苷酸27位是t;核苷酸511位是t;核苷酸598位是t,所有的突变均是相对于seqidno:7;在核苷酸398-422位编码第一18srrna结合位点;在核苷酸691-716位编码第二18srrna结合位点;其他特征在于,与seqidno:7具有至少83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性,或与seqidno:7具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:3编码的tr元件的变体是由726个核苷酸的dna序列编码,其特征在于,在核苷酸617位为核苷酸t;在核苷酸667位为核苷酸a;其他特征在于,在核苷酸1、2和3位的任意或全部核苷酸发生突变,使得核苷酸1、2和3位不是atg;在核苷酸27、28和29位的任意或全部核苷酸发生突变,使得核苷酸27、28和29位不是atg;在核苷酸511、512和513位的任意或全部核苷酸发生突变,使得核苷酸511、512和513位不是atg;在核苷酸598、599和600位的任意或全部核苷酸发生突变,使得核苷酸598、599和600位不是atg;在核苷酸2、3和4位的任意或全部核苷酸发生突变,使得核苷酸2、3和4位是终止密码子;在核苷酸6、7和8位的任意或全部核苷酸发生突变,使得核苷酸6、7和8位是终止密码子;在核苷酸16、17和18位的任意或全部核苷酸发生突变,使得核苷酸16、17和18位是终止密码子;在核苷酸19、20和21位的任意或全部核苷酸发生突变,使得核苷酸19、20和21位是终止密码子;所有的突变均是相对于seqidno:7;在核苷酸398-422位编码第一18srrna结合位点;在核苷酸691-716位编码第二18srrna结合位点;其他特征在于,与seqidno:7具有至少83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性,或与seqidno:7具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:3编码的tr元件的变体是由652个核苷酸的dna序列编码,其特征在于,在核苷酸543位为核苷酸t;在核苷酸593位为核苷酸a;其他特征在于,核苷酸1位是t;核苷酸4位是a;核苷酸6位是t;核苷酸7位是g;核苷酸8位是a;核苷酸17位是a;核苷酸18位是g;核苷酸21位是a;核苷酸27位是t;核苷酸511位是t;核苷酸524位是t,外显子5(518-591位核苷酸)缺失,所有的突变均是相对于seqidno:7;在核苷酸398-422位编码第一18srrna结合位点;在核苷酸617-642位编码第二18srrna结合位点;其他特征在于,与seqidno:7具有至少83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性,或与seqidno:7具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:3编码的tr元件的变体是由652个核苷酸的dna序列编码,其特征在于,在核苷酸543位为核苷酸t;在核苷酸593位为核苷酸a;其他特征在于,在核苷酸1、2和3位的任意或全部核苷酸发生突变,使得核苷酸1、2和3位不是atg;在核苷酸27、28和29位的任意或全部核苷酸发生突变,使得核苷酸27、28和29位不是atg;在核苷酸511、512和513位的任意或全部核苷酸发生突变,使得核苷酸511、512和513位不是atg;在核苷酸524、525和526位的任意或全部核苷酸发生突变,使得核苷酸524、525和526位不是atg;在核苷酸2、3和4位的任意或全部核苷酸发生突变,使得核苷酸2、3和4位是终止密码子;在核苷酸6、7和8位的任意或全部核苷酸发生突变,使得核苷酸6、7和8位是终止密码子;在核苷酸16、17和18位的任意或全部核苷酸发生突变,使得核苷酸16、17和18位是终止密码子;在核苷酸19、20和21位的任意或全部核苷酸发生突变,使得核苷酸19、20和21位是终止密码子;外显子5(518-591位核苷酸)缺失,所有的突变均是相对于seqidno:7;在核苷酸398-422位编码第一18srrna结合位点;在核苷酸617-642位编码第二18srrna结合位点;其他特征在于,与seqidno:7具有至少83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性,或与seqidno:7具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:2编码tr元件(mtrp),其源自编码蛋白脂质蛋白质的小鼠基因。seqidno:2的特征在于,在核苷酸722位为核苷酸t;在核苷酸772位为核苷酸a;并且还包括:在核苷酸1位从a突变为t;在核苷酸4位从g突变为a;在核苷酸6位从c突变为t;在核苷酸7位从t突变为g;在核苷酸8位从t突变为a;在核苷酸17位从g突变为a;在核苷酸18位从t突变为g;在核苷酸21位从t突变为a;在核苷酸27位从a突变为t;所有突变都是相对于seqidno:6的野生型mplpdna序列;在核苷酸503-526位编码第一18srrna结合位点;在核苷酸796-822位编码第二18srrna结合位点,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:2编码的tr元件的变体是由831个核苷酸的dna序列编码,其特征在于,在核苷酸722位为核苷酸t;在核苷酸772位为核苷酸a;其他特征在于,核苷酸1位是t;核苷酸4位是a;核苷酸6位是t;核苷酸7位是g;核苷酸8位是a;核苷酸17位是a;核苷酸18位是g;核苷酸21位是a;核苷酸27位是t;核苷酸616位是t;核苷酸703位是t,所有的突变均是相对于seqidno:6;在核苷酸503-526位编码第一18srrna结合位点;在核苷酸796-822位编码第二18srrna结合位点;其他特征在于,与seqidno:6具有至少83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性,或与seqidno:6具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:2编码的tr元件的变体是由831个核苷酸的dna序列编码,其特征在于,在核苷酸722位为核苷酸t;在核苷酸772位为核苷酸a;其他特征在于,在核苷酸1、2和3位的任意或全部核苷酸发生突变,使得核苷酸1、2和3位不是atg;在核苷酸27、28和29位的任意或全部核苷酸发生突变,使得核苷酸27、28和29位不是atg;在核苷酸616、617和618位的任意或全部核苷酸发生突变,使得核苷酸616、617和618位不是atg;在核苷酸703、704和705位的任意或全部核苷酸发生突变,使得核苷酸703、704和705位不是atg;在核苷酸2、3和4位的任意或全部核苷酸发生突变,使得核苷酸2、3和4位是终止密码子;在核苷酸6、7和8位的任意或全部核苷酸发生突变,使得核苷酸6、7和8位是终止密码子;在核苷酸16、17和18位的任意或全部核苷酸发生突变,使得核苷酸16、17和18位是终止密码子;在核苷酸19、20和21位的任意或全部核苷酸发生突变,使得核苷酸19、20和21位是终止密码子;所有的突变均是相对于seqidno:6;在核苷酸503-526位编码第一18srrna结合位点;在核苷酸796-822位编码第二18srrna结合位点;其他特征在于,与seqidno:6具有至少83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性,或与seqidno:6具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:2编码的tr元件的变体是由757个核苷酸的dna序列编码,其特征在于,在核苷酸648位为核苷酸t;在核苷酸698位为核苷酸a;其他特征在于,核苷酸1位是t;核苷酸4位是a;核苷酸6位是t;核苷酸7位是g;核苷酸8位是a;核苷酸17位是a;核苷酸18位是g;核苷酸21位是a;核苷酸27位是t;核苷酸616位是t;核苷酸629位是t,外显子5(623-696位核苷酸)缺失,所有的突变均是相对于seqidno:6;在核苷酸503-526位编码第一18srrna结合位点;在核苷酸722-748位编码第二18srrna结合位点;其他特征在于,与seqidno:6具有至少83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性,或与seqidno:6具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:2编码的tr元件的变体是由757个核苷酸的dna序列编码,其特征在于,在核苷酸648位为核苷酸t;在核苷酸698位为核苷酸a;其他特征在于,在核苷酸1、2和3位的任意或全部核苷酸发生突变,使得核苷酸1、2和3位不是atg;在核苷酸27、28和29位的任意或全部核苷酸发生突变,使得核苷酸27、28和29位不是atg;在核苷酸616、617和618位的任意或全部核苷酸发生突变,使得核苷酸616、617和618位不是atg;在核苷酸629、630和631位的任意或全部核苷酸发生突变,使得核苷酸629、630和631位不是atg;在核苷酸2、3和4位的任意或全部核苷酸发生突变,使得核苷酸2、3和4位是终止密码子;在核苷酸6、7和8位的任意或全部核苷酸发生突变,使得核苷酸6、7和8位是终止密码子;在核苷酸16、17和18位的任意或全部核苷酸发生突变,使得核苷酸16、17和18位是终止密码子;在核苷酸19、20和21位的任意或全部核苷酸发生突变,使得核苷酸19、20和21位是终止密码子;外显子5(623-696位核苷酸)缺失,所有的突变均是相对于seqidno:6;在核苷酸503-526位编码第一18srrna结合位点;在核苷酸722-748位编码第二18srrna结合位点;其他特征在于,与seqidno:6具有至少83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性,或与seqidno:6具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:4编码tr元件(htrp),其源自编码蛋白脂质蛋白质的人基因。seqidno:4的特征在于,在核苷酸722位为核苷酸t;在核苷酸772位为核苷酸a;并且还包括:在核苷酸1位从a突变为t;在核苷酸4位从g突变为a;在核苷酸6位从c突变为t;在核苷酸7位从t突变为g;在核苷酸8位从t突变为a;在核苷酸17位从g突变为a;在核苷酸18位从t突变为g;在核苷酸21位从t突变为a;在核苷酸27位从a突变为t;在核苷酸616位从a突变为t;在核苷酸703位从a突变为t;所有突变都是相对于seqidno:8的野生型hplpdna序列;在核苷酸503-526位编码第一18srrna结合位点;在核苷酸796-822位编码第二18srrna结合位点,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:4编码的tr元件的变体是由831个核苷酸的dna序列编码,其特征在于,在核苷酸722位为核苷酸t;在核苷酸772位为核苷酸a;其他特征在于,核苷酸1位是t;核苷酸4位是a;核苷酸6位是t;核苷酸7位是g;核苷酸8位是a;核苷酸17位是a;核苷酸18位是g;核苷酸21位是a;核苷酸27位是t;核苷酸616位是t;核苷酸703位是t,所有的突变均是相对于seqidno:8;在核苷酸503-526位编码第一18srrna结合位点;在核苷酸796-822位编码第二18srrna结合位点;其他特征在于,与seqidno:8具有至少83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性,或与seqidno:8具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:4编码的tr元件的变体是由831个核苷酸的dna序列编码,其特征在于,在核苷酸722位为核苷酸t;在核苷酸772位为核苷酸a;其他特征在于,在核苷酸1、2和3位的任意或全部核苷酸发生突变,使得核苷酸1、2和3位不是atg;在核苷酸27、28和29位的任意或全部核苷酸发生突变,使得核苷酸27、28和29位不是atg;在核苷酸616、617和618位的任意或全部核苷酸发生突变,使得核苷酸616、617和618位不是atg;在核苷酸703、704和705位的任意或全部核苷酸发生突变,使得核苷酸703、704和705位不是atg;在核苷酸2、3和4位的任意或全部核苷酸发生突变,使得核苷酸2、3和4位是终止密码子;在核苷酸6、7和8位的任意或全部核苷酸发生突变,使得核苷酸6、7和8位是终止密码子;在核苷酸16、17和18位的任意或全部核苷酸发生突变,使得核苷酸16、17和18位是终止密码子;在核苷酸19、20和21位的任意或全部核苷酸发生突变,使得核苷酸19、20和21位是终止密码子;所有的突变均是相对于seqidno:8;在核苷酸503-526位编码第一18srrna结合位点;在核苷酸796-822位编码第二18srrna结合位点;其他特征在于,与seqidno:8具有至少83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性,或与seqidno:8具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:4编码的tr元件的变体是由757个核苷酸的dna序列编码,其特征在于,在核苷酸648位为核苷酸t;在核苷酸698位为核苷酸a;其他特征在于,核苷酸1位是t;核苷酸4位是a;核苷酸6位是t;核苷酸7位是g;核苷酸8位是a;核苷酸17位是a;核苷酸18位是g;核苷酸21位是a;核苷酸27位是t;核苷酸616位是t;核苷酸629位是t;外显子5(623-696位核苷酸)缺失,所有的突变均是相对于seqidno:8;在核苷酸503-526位编码第一18srrna结合位点;在核苷酸722-748位编码第二18srrna结合位点;其他特征在于,与seqidno:8具有至少83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性,或与seqidno:8具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
seqidno:4编码的tr元件的变体是由757个核苷酸的dna序列编码,其特征在于,在核苷酸648位为核苷酸t;在核苷酸698位为核苷酸a;其他特征在于,在核苷酸1、2和3位的任意或全部核苷酸发生突变,使得核苷酸1、2和3位不是atg;在核苷酸27、28和29位的任意或全部核苷酸发生突变,使得核苷酸27、28和29位不是atg;在核苷酸616、617和618位的任意或全部核苷酸发生突变,使得核苷酸616、617和618位不是atg;在核苷酸629、630和631位的任意或全部核苷酸发生突变,使得核苷酸629、630和631位不是atg;在核苷酸2、3和4位的任意或全部核苷酸发生突变,使得核苷酸2、3和4位是终止密码子;在核苷酸6、7和8位的任意或全部核苷酸发生突变,使得核苷酸6、7和8位是终止密码子;在核苷酸16、17和18位的任意或全部核苷酸发生突变,使得核苷酸16、17和18位是终止密码子;在核苷酸19、20和21位的任意或全部核苷酸发生突变,使得核苷酸19、20和21位是终止密码子;外显子5(623-696位核苷酸)缺失,所有的突变均是相对于seqidno:8;在核苷酸503-526位编码第一18srrna结合位点;在核苷酸722-748位编码第二18srrna结合位点;其他特征在于,与seqidno:8具有至少83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性,或与seqidno:8具有至少95%、96%、97%、98%、99%或更高同一性,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
根据本发明的方面,编码tr元件并且被包含在表达盒中的dna序列源自plp基因和/或dm20基因的外显子1-7。不局限于特定的理论,根据突变分析数据,认为外显子1至4足以编码功能性ires活性。此外,认为在应激/死亡特异性翻译中起作用的tr调节系统位于外显子6和/或7内。
在编码plp和dm20的野生型人和小鼠dna序列(在本文中表示为seqidno:5-8)中发生以下突变,产生突变序列:在指导全长plp和dm20合成的髓磷脂蛋白脂质蛋白质plp和dm20cdna中,核苷酸1从a突变为t以移除野生型aug起始密码子,从而避免这样的合成发生;在plp和dm20cdna的第二可能的阅读框中,核苷酸4从g突变为a以产生终止密码子,从而避免其全长合成;在plp和dm20cdna的第三可能的阅读框中,核苷酸6、7和8分别从c突变为t、t突变为g和t突变为a以产生终止密码子,从而阻止全长plp和dm20的合成;在plp和dm20cdna的主要(第一)开放阅读框中,核苷酸17和18分别从g突变为a,从t突变为g以产生第一终止密码子,从而阻止它们的全长合成;在plp和dm20cdna的主要(第一)开放阅读框中,核苷酸21从t突变为a以产生第二终止密码子,从而阻止其全长合成;核苷酸27从a突变为t以从plp和dm20cdna的第三可能的阅读框中移除aug密码子,从而阻止在野生型aug密码子不存在情况下的框外翻译起始;并且plp和dm20cdna中缺失终止密码子以降低下游开放阅读框翻译的干扰。
根据本发明的方面,源自plp或dm20的由被包含在表达盒中的dna序列编码的tr元件不指导pirp-m或pirp-l肽的翻译。除了上述改变,将以下突变引入到来自dm20cdna变体的编码tr元件的序列中:在指导pirp-m蛋白质合成的dm20变体中,核苷酸511从a突变为t以移除第一框内内部aug起始密码子,从而阻止这样的合成发生;在指导pirp-l蛋白质合成的dm20变体中,核苷酸598从a突变为t以移除第二框内内部aug起始密码子,从而阻止这样的合成发生。
类似地,将以下突变引入到来自小鼠plpcdna变体的tr元件中:在指导pirp-m蛋白质合成的plp变体中,核苷酸616从a突变为t以移除第一框内内部aug起始密码子,从而阻止这样的合成发生;在指导pirp-l蛋白质合成的plp变体中,核苷酸703从a突变为t以移除第二框内内部aug起始密码子,从而阻止这样的合成发生。
根据本发明的方面,tr元件选自人或小鼠tr元件。更优选地,tr元件选自由seqidno:1、seqidno:2、seqidno:3、seqidno:4、seqidno:17、seqidno:18、seqidno:19、seqidno:20或其任意变体编码的那些,其中所编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
根据本发明的方面,编码tr元件的dna序列包括:a)对应于参考序列seqidno:2或seqidno:4的至少核苷酸1-831并且与其具有至少62%序列同一性的plp核苷酸序列;或b)对应于参考序列seqidno:1或seqidno:3的至少核苷酸1-726并且与其具有至少62%序列同一性的dm20核苷酸序列;编码tr元件的dna序列在seqidno:2或seqidno:4plp核苷酸位置41-48、50-56、75-81、150-156、200-205、227-244、251-257、270-274、299-303、490-494、563-570、578-582、597-601、626-632、642-648、669-674、707-712、755-761、767-771和800-804中的一个或多个处,或在seqidno:1或seqidno:3中的其相应位置中的一个或多个处包含多聚嘧啶区。
在一个优选的实施方案中,(a)或(b)的序列同一性为至少或约70%,更优选至少或约80%。
根据本发明的方面,编码tr元件的dna序列在seqidno:2或seqidno:4plp核苷酸位置130-133、142-145、190-193、220-223、305-308、329-332、343-346、572-575、635-638、650-653和683-686中的一个或多个处,或在seqidno:1或seqidno:3中的其相应位置中的一个或多个处包含gnra序列。
在plp/dm20编码序列和由其编码或从其构建的tr元件中,可在一个或多个位置处发生突变而不对tr元件功能产生不利作用,所述一个或多个位置对应于以下seqidno:2和seqidno:4/seqidno:1和seqidno:3的plp/dm20核苷酸位置:1、2、3、4至21(包括该片段的全部或部分的缺失)、25、26、314、332、560/455、614/509、623/518至696/591(包括该片段的全部或部分的缺失,其移除外显子5)、616/511、703/598、806/701、811/706、817/712、818/713和827/722。在多个实施方案中,在plp/dm20编码序列中可保留除上述以外的其他核碱基。
在plp/dm20编码序列和由其编码或从其构建的tr元件中,可在一个或多个位置处发生突变而不对tr元件功能产生不利作用,所述一个或多个位置对应于以下seqidno:2和seqidno:4/seqidno:1和seqidno:3的plp/dm20核苷酸位置:1、4、6、7、8、17、18、21、25、26、27、314、332、560/455、616/511、703/598、806/701、811/706、817/712、818/713和827/722。在一些实施方案中,这些突变可以是1t、4a、6t、7g、8a、17a、18g、21a、25g、26c、27t、314g、332g、560/455c、616/511t、703/598t、806/701g、811/706t、817/712a、818/713a和827/722g中的一种或多种。
此外,插入(例如插入最多达或约5个核苷酸)可在plp位置614/509处进行,而不对ires功能产生不利作用。此外,与位置831/726的融合(例如与报告基因或其他靶基因编码序列的框内融合)未表现出对tr元件功能的任何不利作用。
在另一个实施方案中,本发明的tr元件源自人或小鼠以外的脊椎动物plp或dm20序列。在一些实施方案中,这可以是灵长类动物、马(rodequine)、牛、羊、猪、犬、猫、兔、有袋动物、鸟类、鱼类、两栖动物或爬行动物的序列。在多个实施方案中,脊椎动物序列可以是天然序列,其为野生型或变体;在一些实施方案中,脊椎动物序列可以是野生型序列。
对于本文中使用的plp/dm20序列,“哺乳动物共有序列”指dna序列seqidno:9。“哺乳动物共有序列”指以下物种的plp或dm20序列:人类(homosapiens)、猩猩(pongopygmaeus)(猩猩)、黑猩猩(pantroglodytes)(黑猩猩)、猕猴(macacamulatta)(猕猴)、食蟹猕猴(macacafascicularis)(食蟹猕猴)、野猪(susscrofa)(猪)、小家鼠(musmusculus)(小鼠)、褐家鼠(rattusnorvegicus)(大鼠)、短尾负鼠(monodelphisdomestica)(负鼠)、穴兔(oryctolaguscuniculus)(兔)、牛(bostaurus)(牛)和家犬(canisfamiliaris)(狗)。在共有序列中,将以下标准缩写用来表示核苷酸:m是a或c、r是a或g、w是a或t、s是c或g、y是c或t、k是g或t、v是a或c或g、h是a或c或t、d是a或g或t、b是c或g或t、x/n是a或c或g或t。
在一些实施方案中,可使用非哺乳动物的脊椎动物plp和/或dm20序列,例如在genbank中表示为caa43839(鸡)、p47790(斑胸草雀)、aaw79015(壁虎)、caa79582(青蛙)或baa84207(腔棘鱼)的那些。
本领域普通技术人员通过在万维网(http://ncbi.nlm.nih.gov/sites/entrez网站)上检索ncbigenbank的核苷酸菜单,可容易地获得编码这些的dna序列。例如,有用的dna序列包括以下genbank登录号列出的那些:aj006976(人)、cr860432(猩猩)、xm_001140782(黑猩猩)、xm_001088537(猕猴)、ab083324(食蟹猕猴)、nm_213974(猪)、nm_011123(小鼠)、nm_030990(大鼠)、xm_001374446(负鼠)、nm_001082328(兔)、aj009913(牛)、x55317(狗)、x61661(鸡)、nm_001076703(残基113-946、斑胸草雀)、ay880400(壁虎)、z19522(青蛙)和ab025938(腔棘鱼)。
在某些实例中,与所编码的tr元件可操作地连接的序列元件可破坏tr元件表现出的选择性翻译活性或表现出次佳的(sub-optimal)转录活性。为了减轻所连接的orf对tr活性的任何作用,本发明提供了利用所公开的核苷酸序列的替代密码子的密码子使用变体,所述替代密码子不改变所表达的多肽的多肽序列(从而不影响生物活性)。这些变体是基于遗传密码子的简并性,籍此若干氨基酸由多于一个密码子三联体编码。一个实例是密码子cgt、cgg、cgc和cga,其全部编码氨基酸精氨酸(r)。因此,蛋白可由变体核酸序列编码,所述核酸序列在精确序列上有差异,但是仍编码具有相同氨基酸序列的多肽。根据密码子利用/偏好,可选择密码子以优化orf的翻译效率,并且不影响tr表达盒的受调节的翻译。
定点诱变是一种通过在一个或多个需要的位置上改变核苷酸序列而产生序列变体的特别有用的方法。定点(或位点特异性)诱变使用包含具有所需突变的dna序列的寡核苷酸序列以及足够数量的相邻核苷酸,以提供具有充分大小和复杂性的序列,在预定突变的两侧形成稳定双链体。通常,优选长度约20至25个核苷酸的合成引物,在序列的预定突变的两侧的5至10个残基发生改变。适用于定点诱变的典型载体包括公开的载体,以及任何商业上或学术上可获得的质粒载体。通常,通过使适合的dna寡核苷酸序列与靶dna退火并通过本领域已知的pcr法来扩增靶序列,从而引入核苷酸置换。
本发明考虑到了在编码序列中使用每种可能的密码子,以产生用于本发明的所需的orf序列。
定向进化技术可用于制备具有提高的tr功能的序列变体。在定向进化技术中,从包含tr的多聚核苷酸开始,可进行至少一轮核酸突变或核酸剪接或同源重组。以定向或随机方式进行突变、剪接和同源重组。例如,可设计一种或多种寡核苷酸,用于上述tr元件的定点诱变,或可将一种或多种随机产生的寡核苷酸与初始的包含tr的多聚核苷酸模板接触。替代地或额外地,初始模板的pcr扩增可在允许错误的条件和/或易错聚合酶的条件下进行以允许引入突变,这种技术被称为“松散(sloppy)”pcr。
类似地,可以以定向或随机方式剪接或重组一组同源的、包含tr元件的多聚核苷酸。例如,一种或多种限制性核酸内切酶可用于以随机方式或以预定的方式消化同源多聚核苷酸模板,然后将所得片段连接在一起。替代地或额外地,可将包含tr元件的多聚核苷酸组混合,并在有利于它们之间的同源重组的条件下进行体外或细胞内处理。特别地,可将对于tr特异性翻译效率而言重要的调节序列结合或在数量上扩增,从而产生包含多拷贝的序列。对于这种尝试,可使用突变和剪接或重组技术的任何组合。可进行一轮或多于一轮的任意这些方式。
一轮或多于一轮的突变、剪接和/或重组之后,测试所得的多聚核苷酸以筛选tr活性。通常,这可通过将报告分子编码序列置于一种或多种已产生的tr变体的可操作调节之下来完成。然后,使所得构建体在被置于一定条件(例如应激条件)下的细胞中表达,在该条件下可发生tr翻译。所述测试可用于检测所需的tr元件功能的提高。例如,tr元件翻译针对应激条件的特异性、tr元件激活针对细胞应激响应的敏感性(例如细胞应激和/或死亡之前的生物化学改变)或tr元件激活之后翻译起始的效率(即量级(magnitude))中的任一种提高都是测定的关注点。
根据测定结果,可选择使用一种或多种提高的tr元件,或对其进行进一步开发;在一些实施方案中,可将所选的提高的tr元件核酸用作起始多聚核苷酸,或用作另一轮或多轮过程或定向进化的起始多聚核苷酸组。
定点诱变检查了set调节活性的外显子5-7序列。如所预期的,外显子5的缺失(也存在于小鼠jimpy突变中)破坏了与外显子5和6相关的所有orf(pirp-m/pirp-lorf和uorf7和8),但是未影响set调节。这表明来自全长tr表达盒的set需要顺式调节元件,该元件可能与不受外显子5缺失影响的单一uorf(uorf9,其定位在外显子7内)相关。意料不到的是,改变uorf9aug密码子(aug至uug)的单个碱基改变降低了生长的细胞中的set调节,并允许非应激细胞中的报告orf的翻译。为了进一步检查uorf9翻译对于报告蛋白orf的set而言是否是必需的,将突变引入到特定的氨基酸中(表现为单一或成对密码子改变),其改变了氨基酸序列,但是不将终止密码子引入到uorf9中。这些突变体确定,特定的核苷酸改变表现出对set的显性负调节。使用rna结构分析软件m-fold,检查每个uorf9突变导致的rna结构改变,发现每个显性负向突变改变了多个稳定的rna结构,包括完整的蛋白脂质mrna结构。这些研究提供了有力的证据,证明与uorf9相关的野生型rna结构对于有效的set调节而言是必需的。
uorf9的进一步比较序列分析鉴定了一个短rna片段,该片段与第二18srrna序列高度互补,但是与plpires18srrna序列具有最小同源性。尽管这两个序列可暂时性地与18srrna中相同暴露的螺旋的不同片段杂交,uorf918srrna序列更类似于保守的病毒序列(存在于许多哺乳动物病毒中),该序列指导感染的细胞中dorf的cap依赖性翻译再起始。对于ires18srrna序列,病毒翻译再起始需要mrna-18srrna相互作用,其控制40s亚基与mrna的相互作用。然而,不同于ires18srrna相互作用,翻译再起始也需要与eif3复合物相互作用的rna结构元件以使mrna排列在mrna出口通道中。这种mrna-18srrna-eif3复合物将40s亚基保持在mrna上,从而可结合新的三元复合物,还定位了用于翻译再起始的dorfaug密码子。
在一个优选方面中,trmrna使用两个独立的功能元件来指导应激细胞中报告蛋白的set。第一功能序列(被称为trires)是位于外显子4中的组成型ires元件,其在生长中和应激细胞中能够结合80s亚基。第二功能序列(被称为tr调节因子,位于外显子7中)控制非应激细胞中生长核糖体和p1pires之间的trmrna相互作用;然而,在用毒素处理的细胞中,tr调节因子控制trmrna、40s亚基和eif3复合物之间的相互作用以定位用于翻译再起始的报告dorf。下游tr调节因子控制上游组成型trires的能力尚未在任何其他ires元件中检测到或报道。这使得通过tr表达系统检测的set过程是独特的,并且表明在应激细胞中指导set的80s核糖体不同于在生长的细胞中产生cap依赖性翻译的80s核糖体。
在本发明的一方面中,set“参考标准”试剂或refstan是可使用标准化步骤进行并且在tr“参考”或“ref”细胞系中始终产生可预测的set响应的任何药物剂量方案、环境处理或细胞操作方法。在本发明的另一方面中,trref细胞系是稳定表达tr基因盒的任何细胞系,其已经过setrefstan的广泛筛选并且稳定产生可预测的set响应。在一个优选方面中,本发明记载了使用trref细胞系来表征过表达set信号途径的生物影响的方法。这些ref细胞系对于确定靶向主要set信号转导效应物(set核糖体)的药物的体外和体内功效而言是重要的。
在本发明的一些方面中,哺乳动物细胞可以是从动物(即原代细胞)分离的哺乳动物细胞或哺乳动物肿瘤细胞系。从动物分离细胞的方法是本领域公知的。在一些方面中,从小鼠分离原代细胞。在其他方面中,从人分离原代细胞。在另外的其他方面中,可使用哺乳动物肿瘤细胞系。示例性的细胞系包括hek293(人胚肾)、ht1080(人纤维肉瘤)、ntera2d(人胚性畸胎瘤)、hela(人宫颈腺癌)、caco2(人结肠腺癌)、hepg2(人肝脏肝细胞癌)、hct116(人结肠肿瘤)、mda231(人乳腺癌)、u2os(人骨骨肉瘤)、du145(人前列腺癌)、lncap(人前列腺腺癌)、lovo(人结肠癌)、miapaca2(人胰腺癌)、aspc1(人胰腺腺癌)、mcf-7(人乳腺癌)、pc3、capan-2(人胰腺腺癌)、colo201(人结肠癌)、colo205(人结肠肿瘤)、h4(人脑神经胶质瘤)、hutu80(人十二指肠腺癌)、ht1080(人结缔组织纤维肉瘤)和sk-n-mc(人脑神经上皮瘤)。哺乳动物肿瘤细胞系通常可获得自,例如美国组织培养保藏中心(atcc)或任何经批准的《布达佩斯条约》保藏点或其他生物保藏中心。
在本发明的一个方面中,出乎意料地发现,根据“set激活”依赖性蛋白翻译的水平,可将用tr表达盒稳定转化的哺乳动物细胞分成3个“tr类别”(参见下文)。稳定转化的细胞的整个群体——其中每个细胞包含至少一个赋予耐药性的转基因整合事件——被称为“细胞池”。随后从细胞池中分离出的单个细胞集落被称为“细胞系”。不同于第一种方法——其提供了具有多种set特异性表达水平的混合细胞群,第二种方法需要从几千个可能的细胞集落中选择、分离和表征不同的克隆,以纯化选择的表达独特的set依赖性蛋白表达水平的集落组(即trref细胞系)。
使用多种转染方案来产生细胞池,并将其铺板以回收全部耐药细胞。这些原代细胞池培养物(称为传代0培养物)包含所有可能的转染子的广泛随机组。然而,如本领域公知的,通常需要从细胞池亚克隆细胞以获得纯的细胞分离物。使用并非选择细胞类型特异性分离物的选择和纯化方法来回收细胞分离物(例如,更大的集落大小、增加的铺板率(platingefficiency)或更快的分离物生长率)。将集落从多个平板分离,没有任何大小偏好地收集,使用标准化方法进行增殖,并且在集落生长达到确定的大小和细胞数量时进行测定。使用set激动剂refstan,筛选在此方案中存活的每个克隆(即整个细胞系群体)的tr测定响应。
为了测量标准set响应,在处理的细胞中测定从tr表达盒翻译的报告蛋白的量,并且与未处理的细胞标准中表达的报告蛋白的水平进行比较。测试样品响应与对照表达水平的比率表示为未处理对照的百分数。在这些研究开始时,不存在已通过实验证明直接或间接调节set或set信号转导效应物(set核糖体)的refstan。因此,似乎符合逻辑的是,候选refstan试剂会包括可损伤和/或杀死细胞、选择性地改变细胞中已知代谢过程而不影响细胞存活力或产生中性的set响应的任何试剂。作为候选refstan的初始测试浓度,将已知绝对调节试剂特异性的靶酶或信号转导系统的浓度或处理用作优选的测试处理。本领域技术人员将知晓,如果候选的测试处理包括特定的药物剂量,则确定标准set响应需要使用剂量响应测定。在已确定标准refstan方案之后,将该方案用于所有随后的基于细胞的测定。
使用群体分析,将tr细胞系——特征在于它们的set激活潜能——分配到特定的类别。使用排序图为所有处理响应排序。趋势分析用于确定至少3种独立于肿瘤细胞类型的set激活趋势(所有转染的肿瘤细胞均包含相同的3种set激活响应并且可用于分离trref细胞系)。然而,如本领域技术人员了解的,最准确的tr类别分布需要检查统计学上显著的亚克隆数量以准确表示set激活响应的整个范围。优选地,从3种tr类别获得细胞系代表物需要分离至少约60个独立的亚克隆,更优选至少约100个独立的亚克隆,仍然更优选至少约250个独立的亚克隆。一旦鉴定细胞系,使其扩增并且保持在细胞培养物中或冷冻,用于贮存和未来使用。
将3种tr细胞系任意地命名为1类细胞、2类细胞和3类细胞,并按照如下进行分类。用“set激动剂”refstan处理之后,1类细胞的特征在于,报告蛋白的水平比未处理的细胞标准中报告蛋白的水平高100%至500%,其中未处理的细胞标准表示在用核酸表达盒稳定转化并且未用参考标准试剂处理的哺乳动物细胞中报告蛋白的水平。类似地,2类细胞的特征在于报告蛋白的水平比未处理的细胞标准中报告蛋白的水平高500%以上且不高于1400%,3类细胞的特征在于报告蛋白的水平比未处理的细胞标准中报告蛋白的水平高1400%以上。在一个优选方面中,3类细胞的特征在于,报告蛋白的水平比未处理的细胞标准中报告蛋白的水平高20,000%以上且不高于75,000%。根据推定类别的平均值与相邻类别组相差2个标准差,将类别命名指定给细胞系组。例如,在用set激动剂处理之后,所有1类细胞系中报告蛋白表达的平均值比所有回收的2类细胞系的平均值低2个标准差。
在一个优选方面中,在37℃和5%co2中用一种refstan处理细胞系,所述refstan以固定的剂量递送、持续固定的时间、以确定的体积、针对特定的细胞数量(所有水溶性refstan溶解于dmso并递送至细胞)。在其他方面中,用多种refstan处理细胞。例如但不限于,从以下试剂中开发setrefstan:camp、毒胡萝卜内酯(thapsigargin)、tpa、紫杉醇(taxol)、诺考达唑(nocodazole)、长春碱(vinblastine)、秋水仙碱(colchicine)、钙离子载体a23167、mg132、硼替佐米(bortezomib)(万珂(velcade))、和美新(hycamtin)(托泊替康)、4-氧代喹啉-3-羧酸衍生物抗生素、乙醇和甲醇。当使用至少两种refstan时,可使用refstan的任何组合。本领域技术人员可根据refstan的作用机制容易地确定哪种refstan的组合特别适用。两种refstan的示例性组合如下文详述。例如,两种refstan的组合包括但不限于:camp和tpa、camp和紫杉醇、camp和毒胡萝卜内酯、camp和诺考达唑、camp和长春碱、camp和秋水仙碱、camp和mg132、camp和硼替佐米(万珂)、camp和钙离子载体a23167、camp和4-氧代喹啉-3-羧酸衍生物抗生素、camp和和美新;tpa和紫杉醇、tpa和毒胡萝卜内酯、tpa和诺考达唑、tpa和长春碱;tpa和秋水仙碱、tpa和mg132、tpa和硼替佐米、tpa和钙离子载体a23167、tpa和4-氧代喹啉-3-羧酸衍生物抗生素、tpa和和美新;紫杉醇和毒胡萝卜内酯;紫杉醇和诺考达唑;紫杉醇和长春碱;紫杉醇和秋水仙碱、紫杉醇和mg132、紫杉醇和硼替佐米、紫杉醇和钙离子载体a23167、紫杉醇和4-氧代喹啉-3-羧酸衍生物抗生素、紫杉醇和和美新;mg132和毒胡萝卜内酯;mg132和诺考达唑;mg132和长春碱;mg132和秋水仙碱;mg132和硼替佐米;mg132和钙离子载体a23167、mg132和4-氧代喹啉-3-羧酸衍生物抗生素、mg132和和美新;毒胡萝卜内酯和诺考达唑、毒胡萝卜内酯和长春碱、毒胡萝卜内酯和秋水仙碱、毒胡萝卜内酯和硼替佐米、毒胡萝卜内酯和钙离子载体a23167、毒胡萝卜内酯和4-氧代喹啉-3-羧酸衍生物抗生素、毒胡萝卜内酯和和美新;诺考达唑和长春碱;诺考达唑和秋水仙碱、诺考达唑和钙离子载体a23167、诺考达唑和4-氧代喹啉-3-羧酸衍生物抗生素、诺考达唑和和美新;长春碱和秋水仙碱、长春碱和硼替佐米、长春碱和钙离子载体a23167、长春碱和4-氧代喹啉-3-羧酸衍生物抗生素、长春碱和和美新;秋水仙碱和硼替佐米、秋水仙碱和钙离子载体a23167;秋水仙碱和4-氧代喹啉-3-羧酸衍生物抗生素、秋水仙碱和和美新;硼替佐米和钙离子载体a23167、硼替佐米和4-氧代喹啉-3-羧酸衍生物抗生素;硼替佐米和和美新;钙离子载体a23167和4-氧代喹啉-3-羧酸衍生物抗生素;钙离子载体a23167和和美新;和4-氧代喹啉-3-羧酸衍生物抗生素和和美新。
在一个优选方面中,用set激活refstan筛选所有的tr细胞系以将每种分离物分配到tr类别中。另一方面中,set激活refstan上调蛋白激酶c途径。另一方面中,set激动剂refstan的具体实例包括聚氧乙烯氢化蓖麻油家族、佛波酯化合物家族和苔藓抑素类似物。在其他方面中,set激活refstan的具体实例包括cremophorel、tpa和苔藓抑素1。
原型pkc同工酶包含保守的cooh末端激酶序列和可变异的nh末端调节结构域,调节序列的差异基于差异化的激活模式,在功能上限定了3种酶类别。例如,常规的pkc[(cpkc)pkcα、pkcβi、pkcβii和pkcγ]被记载为脂质敏感性酶,其由磷脂酶c(plc)对膜结合的磷脂酰肌醇4,5-二磷酸酶(pip2)的水解与第二信使分子二酰甘油(dag)和肌醇三磷酸(ip3)的释放激活。由于ip3进入细胞质并刺激钙离子从er释放,疏水性的dag分子在细胞质膜表面结合于cpkc。因此,cpkc需要dag结合(或dag衍生物,例如佛波酯tpa)和钙离子来激活。相比之下,新的pkc[(npkc)pkcδ/θ和pkcε/η]缺少钙离子结合序列并且仅需要dag(或tpa)来激活。相比之下,非典型的pkc[(apkc)ρkcζ,pkci/λ]缺少钙离子结合序列,但是包含修饰的调节序列,使得apkc激活是通过磷酸肌醇-3,4,5-三磷酸(pip3)结合、各种激酶的磷酸化和自磷酸化来调节。apkc同种型也包含蛋白-蛋白接触位点,该位点将无活性和活性激酶指导到靠近靶底物的亚细胞位置以促使受体介导的信号转导和细胞骨架/微泡重组。
对于原型pkc同种型,第4组脂质激活的类pkc激酶(pkcμ/pkd1、pkcν/pkd2、pkd3)能够调节tpa依赖性set激活。这些酶包含与pkc调节结构域同源的序列,但是包含类似于钙调节蛋白依赖性激酶(细胞周期进程所需的酶活性)的激酶结构域。细胞刺激发生后,nh端类pkc调节结构域指导无活性的pkd蛋白到特定的亚细胞位置(例如质膜或er膜),此处无活性的激酶结合脂质(或tpa)并且被pkc依赖性(例如npkc酶活性)或不依赖pkc的激酶磷酸化。自磷酸化完成了pkd激酶的激活,这使得pkd激酶作为pkc激活的下游效应物发挥作用并且调节细胞损伤后的细胞恢复。
需要同工酶特异性的时空运动的复杂模式,以使pkc定位在它们的胞内底物附近。激活后,pkc同工酶通常从激活位点移运并定位于质膜、细胞核、er/高尔基体和/或线粒体。对于其他细胞激酶,激活状态的保持、蛋白更新和亚细胞定位由锚定被激活的激酶的支架蛋白调节。通过这种方式,支架蛋白整合不同的信号转导途径,并通过物理性地聚集信号转导分子来控制不同信号级联之间的交叉通讯。
本发明特别关注的是与激活的c激酶1(rack1)蛋白的受体相关的pkc活性,所述rack1蛋白是包含7个wd40(trp-asp40)重复的36kda胞质蛋白,其为pkc的选择性锚定蛋白(优选的伴侣为pkcβii、pkcε、pkcδ和ρkcμ同种型)。尽管rack1可存在于质膜和细胞核膜,本发明特别关注的是,rack1/蛋白激酶复合物结合于真核核糖体。在这个位置,rack1蛋白连接至40s头结构,接触18srrna(靠近mrna出口通道)和eif3复合物,以及大量信号转导蛋白,例如src激酶家族、整联蛋白β亚基(cd104)、pde4d5信号转导因子、转录激活因子1(stat1)、类胰岛素生长因子受体、e3泛素连接酶(vhl、延伸因子c等)和雄激素受体。通过锚定这些蛋白,rack1复合物控制细胞周期进程、抗凋亡/应激响应、改变的粘附性/移动性、蛋白更新、细胞分化、转录和翻译。可能的是,rack1蛋白复合物指导mrnaires上的set核糖体活性,并且促使特定mrna序列上功能核糖体的组装,这增加了翻译再起始的频率。
在本发明的一方面中,过表达set响应(即tr异常3类细胞,其显示出比所有3类细胞的平均值大3个标准差的set响应)的tr细胞系能够表现出与类干细胞、转移癌细胞相关的生长特征。为了保持与之前定义的tr类别名称一致,将表现出经验上确定的体外和体内生长特征的任何tr3类细胞系称为tr4类细胞。尽管癌细胞能够不受控地增殖并抵抗细胞死亡,但是很少有细胞能够在不存在生长支持性底物的情况下生长。在本发明的一方面中,tr4类细胞必须表现出3类异常set响应和在体外作为非粘附的3d结构在悬浮培养物中生长的能力。tr4类细胞系的成球(即肿瘤球)能力并不反映细胞聚集,而是代表从少量非粘附的细胞生长的能力。
在本发明的另一方面中,tr4类细胞系必须表现出3类异常set响应、在体外形成肿瘤球的能力、以及体内肿瘤启动和增殖活性。按照定义,被植入到裸小鼠中的少量tr4类细胞足以引发原代异基因肿瘤并使其生长,所述原代异基因肿瘤可被分割成亚碎片并作为继发肿瘤增殖。
在本发明的一方面中,表达tr表达载体的哺乳动物细胞可用于分离对set信号途径“成瘾(addicted)”的稳定细胞系。按照定义,如果癌基因信号途径对于启动和/或保持肿瘤发生生长是重要的,则肿瘤会对该癌基因信号途径成瘾。对于这些细胞,成瘾信号途径的破坏阻断了肿瘤增殖并降低存活力。例如,临床前研究表明,过表达c-myc的肿瘤(即5-15%的人乳腺癌表现出myc基因扩增)可通过靶向该途径而得到治疗,其可引起不依赖于其他遗传和表观遗传改变的肿瘤消退。然而,临床研究表明,转移乳腺癌不能通过任何现有的疗法来治疗。在大多数情况下,肿瘤再生长涉及肿瘤细胞在myc活性降低之后有效增殖的获得性能力(信号转导交叉通讯)。或者,肿瘤可对这样的信号转导途径成瘾,即对结构完整性重要的信号转导途径(例如vegfr序号转导)。肿瘤形成功能性血管系统的能力是在大于阻止营养物被动扩散到整个肿瘤中的大小的情况下进行肿瘤生长的关键步骤。按照定义,vegfr依赖性肿瘤内的细胞对vegf的大小依赖性存在成瘾。如之前所述,肿瘤通过经历转移扩散来适应异常血液和淋巴结构,这限制了细胞饥饿和坏死性死亡。
在本发明的一个优选方面中,tr4类细胞中的set响应的过表达等同于set信号转导成瘾,意味着该途径的治疗性干预能够调节药物功效。在tr4类细胞中靶向主要set效应物(set核糖体)的药物将阻断由mtorc2控制的细胞信号转导途径。因此,抑制从set核糖体的蛋白质合成的药物开发应当减少细胞恢复蛋白质的合成、改变mam核糖体/mtorc2/线粒体信号转导途径、促进增殖的细胞周期检查点控制、破坏细胞恢复,以及增加线粒体特异性凋亡性死亡。如实施例中所示,调节set核糖体的药物增加了细胞毒性药物的体内治疗指数。
通过评估在肿瘤微环境中细胞毒性药物和治疗剂的细胞、生物化学和分子靶标,以及通过利用破坏关键细胞信号转导系统(其与癌细胞对细胞毒性药物的抗性有关)的靶向治疗剂来实现本发明。本发明提供了增强细胞毒性药物或疗法的功效,同时增强细胞毒性治疗的安全性的方法和组合物。大多数细胞毒性药物在作为单一疗法给予时是有毒性的,但是在与其他试剂结合使用时它们的毒性可增强或降低。细胞毒性疗法,例如放射性疗法,以相同的方式损伤正常细胞和癌细胞。根据本发明的方面,治疗组合的毒性可高于或低于单独组分的毒性之和。本发明记载了高度意料不到的新结果,其表明当低(即亚毒性)剂量的靶向治疗剂与治疗剂量的细胞毒性剂一起被递送时,观察到最佳组合治疗效果。基于这些实施例,本发明记载了方法、体外和体内方案,以及基于稀释以实现最大治疗效果的组合物(即生物学有效剂量或bed)。
在任何癌症治疗方案中描述的细胞毒性或其他化学治疗剂的用途通常在癌症治疗领域被充分地表征,并且在本文中它们的用途与监测毒性、耐受性和功效,以及控制给药途径和剂量是同样考虑的(进行一些调整)。例如,递送至患者的细胞毒性剂的真实剂量取决于患者对化学治疗的耐受。本领域技术人员已知,多种离体测定的任一种可用于确定指示出器官损伤的不可接受的组织学或分子量度。对于表现出毒性的患者,与负面结果不存在的情况下使用的量相比,细胞毒性药物剂量必须降低。本发明预期了需要细胞毒性剂的患者依赖性剂量,并且定义了测定最佳剂量的方法和优选的药物组合物,所述组合物在细胞毒性药物必须以次佳的治疗浓度给予时最大程度地增强了细胞毒性药物的功效。
本发明提供了以下范例:(a)选择用于特定癌症的细胞毒性药物(例如许可的护理标准);(b)评估该试剂在肿瘤微环境中对体外和体内细胞、生物化学和分子响应的作用;(c)选择组合化学治疗,其阻断在肿瘤微环境中诱导的靶酶活性,从而该抑制阻断或预防了由靶标产生的耐药性;(d)使用体外和体内肿瘤模型,在临床前毒理学和功效研究中滴定细胞毒性药物和靶向化学治疗的多种组合以确定bed;以及(e)确定其人初始剂量。该开发新治疗方案的范例的目的在于使用两种或更多种药物的组合而实现的最佳响应,所述药物组合经选择被在与细胞毒性剂一起给予时实现靶向治疗剂的最大功效。
卡培他滨和5-氟尿嘧啶:根据本发明的方面,在受试者中治疗增生性疾病的药物组合物和治疗方法包括给予set复方药物以及卡培他滨([1-(3,4-二羟基-5-甲基四氢呋喃-2-基)-5-氟-2-氧代-1h-嘧啶-4-基]氨基甲酸戊酯)或5-氟尿嘧啶(5-fu)/甲酰四氢叶酸。
根据本发明的方面,提供了包括set复方药物以及卡培他滨或5-fu/甲酰四氢叶酸的组合物。
卡培他滨是氟尿嘧啶或5-fu的抗代谢物前药,其已被证明可有效治疗多种癌症类型(包括乳腺癌、食管癌、喉癌、胃肠癌和泌尿生殖道癌),但是也表现出严重毒性,例如中性粒细胞减少症、口腔炎和腹泻。卡培他滨被开发用于减少5-fu副作用,同时也增加肿瘤内药物浓度(需要肿瘤细胞酶以将肝代谢物转化为有活性的5-fu药物)。
给药后,口服卡培他滨易于被胃肠道吸收并转运至肝,以被羧酸酯酶加工成5'-脱氧-5-氟胞苷(5'dfcr)。肝脏胞苷脱氨酶将5'dfcr转化为5’-脱氧-氟尿苷(5'dfur),其被递送到血液循环系统。当5'dfur扩散到肿瘤细胞中时,过表达的胸苷磷酸化酶将5'dfur转化为5-氟尿嘧啶(5-fu)。这种肿瘤细胞特异性转化步骤提供了高浓度的5-fu,其不可逆地抑制胸苷酸合成酶(ts)并阻断脱氧尿苷单磷酸(dump)向脱氧胸苷单磷酸(tmp)的转化。通过拮抗ts,卡培他滨代谢物阻止了胸苷核苷酸合成,这使细胞生长、dna合成和复制停止。
卡培他滨目前被fda批准用于治疗转移结直肠癌和转移乳腺癌。在其他国家,它也被批准用于治疗早期(lowstage)结直肠癌。单一治疗的标准剂量为1250mg/m2,每天口服两次(bid)(早晚各一次),在3周周期中连续服用14天。
在本发明的一个优选方面中,用set复方药物和卡培他滨治疗肿瘤和/或肿瘤转移。在卡培他滨之前、与卡培他滨一起或在卡培他滨之后给予set复方药物以增强复制细胞的细胞死亡。另一方面中,在卡培他滨之前、与卡培他滨一起或在卡培他滨之后口服给予set复方药物以增强复制细胞的细胞死亡。
在本发明中,用set复方药物和5-fu来治疗肿瘤和/或肿瘤转移。在5-fu之前、与5-fu一起或在5-fu之后给予set复方药物以增强复制细胞的细胞死亡。另一方面,在静脉内5-fu之前、与5-fu一起或在5-fu之后口服给予set复方药物以增强复制细胞的细胞死亡。
环磷酰胺:根据本发明的方面,在受试者中治疗增生性疾病的方法包括给予set复方药物和环磷酰胺(rs-n,n-二(2-氯乙基)-1,3,2-氧氮磷杂环己烷-2-胺2-氧化物)。
根据本发明的方面,提供了包括set复方药物和环磷酰胺的组合物。
环磷酰胺是来自噁唑碱(oxazophorine)化学基团的氮芥烷化剂,其用于治疗多种癌症(例如乳腺癌、肺癌、前列腺癌、卵巢癌、淋巴瘤和多发性骨髓瘤)和一些自身免疫性疾病。作为前药,环磷酰胺在肝内通过细胞色素p450系统(即cyp3a5和cyp2b6氧化酶)被转化为活性代谢物(4-羟基环磷酰胺,其与醛磷酰胺发生互变异构)。在被递送到循环系统之后,醛磷酰胺可被转运到肿瘤细胞,此处醛磷酰胺通过胞内磷酸酶被去磷酸化为两种细胞毒性的活性代谢物——磷酰胺芥和丙烯醛(全身性毒素)。磷酰胺芥不可逆地使鸟嘌呤的7号氮烷基化,其通过形成链内和链间dna交联而干扰dna复制。然而,细胞dna的环磷酰胺修饰不依赖于有丝分裂期,并且在多个细胞周期检查点激活dna修复。
环磷酰胺可在口服(包衣片剂)和胃肠外制剂中获得。在儿科肿瘤学药物的开发过程中,开发了环磷酰胺的口服制剂,其在将粉末溶于水之后可通过口服服用。口服环磷酰胺可被快速吸收,生物可利用率>75%,清除半衰期为3-12小时。它主要作为代谢物被清除,但是5-25%的剂量作为未改变的药物被在尿中排泄。相比之下,静脉内卡培他滨在给药后2-3小时在血浆中产生最大代谢物浓度,尽管输注率的变化从30分钟至24小时以上。
在本发明的一个优选方面中,用set复方药物和环磷酰胺来治疗肿瘤和/或肿瘤转移。在环磷酰胺之前、与环磷酰胺一起或在环磷酰胺之后给予set复方药物以增强复制细胞的细胞死亡。另一方面,在口服环磷酰胺之前、与环磷酰胺一起或在环磷酰胺之后口服给予set复方药物以增强复制细胞的细胞死亡。可在环磷酰胺注射或输注之前、与环磷酰胺注射或输注一起或在环磷酰胺注射或输注之后口服给予set复方药物以增强复制细胞的细胞死亡。
托泊替康和伊立替康:根据本发明的方面,在受试者中治疗增生性疾病的方法包括给予set复方药物和托泊替康[(s)-10-[(二甲基氨基)甲基]-4-乙基-4,9-二羟基-1h-吡喃醇[3',4',6,7]吲嗪醇[1,2-b]喹啉-3,14(4h,12h)-二酮一氢氯化物]或伊立替康。最初从中国树喜树(camptothecaacuminata)的提取物分离的喜树碱(camptothecin)是拓扑异构酶i(dna合成所需的蛋白)的强效毒素。喜树碱药物类似物(喜树碱、伊立替康、卢比替康(rubitecan)和托泊替康;cpt、irt、rbt和tpt)表现出两种剂量依赖性作用模式。在低剂量下(约20nm),喜树碱及其衍生物引发应激响应,所述应激响应包括应激蛋白(例如pkcδ、atr激酶、cip2/kap1、p16ink4a、nek2、p21和cdc2酶)的激活和合成以及短暂的g2/m检查点。相比之下,高剂量(>1μm)导致不可逆的topoi-药物复合物、由于dna链断裂导致的永久性s期内阻滞、细胞衰老和增加的凋亡。
托泊替康是喜树碱的水溶性、半合成衍生物。作为拓扑异构酶i的选择性抑制剂,高剂量的托泊替康能够通过防止单链dna断裂的重新连接来消除dna超螺旋,但是对拓扑异构酶ii没有作用。托泊替康被开发作为喜树碱的替代物,喜树碱表现出不可接受的剂量限制毒性、较低的水溶性和不符合需要的保存期稳定性。口服托泊替康(胶囊)作为水溶性盐酸盐被递送,其余的赋形剂为明胶、单硬脂酸甘油酯、氢化植物油和二氧化钛(和红色氧化铁)。在癌症患者中,推荐的托泊替康剂量为每天给予1.2-3.1mg/m2,持续5天。托泊替康可被快速吸收,口服生物可利用率为约40%,并且最高血浆浓度发生在给药后1-2小时之间。
伊立替康是喜树碱的不溶于水的前药衍生物,其通过羧酸酯酶转化酶被转化为生物活性代谢物7-乙基-10-羟基-喜树碱(sn-38),后者的功效是伊立替康的1000倍。sn-38通过稳定拓扑异构酶i(topoi)和dna之间的可裂解复合物来抑制topoi活性,导致dna双链断裂,从而抑制dna复制、修复并引发s期的凋亡性细胞死亡。
在本发明的一个优选方面中,用set复方药物和托泊替康来治疗肿瘤和/或肿瘤转移。在托泊替康之前、与托泊替康一起或在托泊替康之后给予set复方药物以增强复制细胞的细胞死亡。另一方面,在托泊替康之前、与托泊替康一起或在托泊替康之后口服给予set复方药物以增强复制细胞的细胞死亡。
在本发明的一个优选方面中,用set复方药物和伊立替康来治疗肿瘤和/或肿瘤转移。在伊立替康之前、与伊立替康一起或在伊立替康之后给予set复方药物以增强复制细胞的细胞死亡。另一方面,在静脉内伊立替康之前、与伊立替康一起或在伊立替康之后口服给予set复方药物以增强复制细胞的细胞死亡。
紫杉醇和多西他赛:根据本发明的方面,在受试者中治疗增生性疾病的方法包括给予set复方药物以及紫杉醇(5β,20-环氧-1,2α,4,7β,10β,13α-六羟基紫杉-1-1-烯-9-14,10-二乙酸2-苯甲酸13-酯与(2r,3s)-n-苯甲酰基-3-苯基异丝氨酸)或多西他赛。紫杉醇是最初来自于太平洋紫杉树树皮的二萜抗癌化合物。树皮的粗提取物在作为国立癌症研究所的大规模筛选项目的一部分的临床前肿瘤测定中证明了抗肿瘤活性。紫杉醇是靶向微管蛋白功能的若干细胞骨架药物之一。不同于其他破坏微管组装的微管蛋白靶向药物(即秋水仙碱、长春新碱和长春碱),紫杉醇在有丝分裂中期阻止微管分解并破坏有丝分裂纺锤体组装、染色体分离和细胞分裂。由于延长的m期检查点的激活,细胞开始衰老并经历凋亡或回到g1期进行细胞分裂(即形成多核细胞)。
多西他赛是半合成的第二代紫杉烷,其来自在欧洲紫杉树欧州紫杉(taxusbaccata)中发现的化合物。同紫杉醇一样,多西他赛结合并稳定微管蛋白、抑制微管分解、在g2/m晚期阻滞细胞周期并促进细胞衰老和死亡。然而,当与紫杉醇进行比较时,多西他赛在靶细胞中表现出对微管蛋白结合位点更大的亲和性、独特的微管聚合模式、更长的细胞内保留和更高的细胞内溶度。这使得多西他赛成为强效的和广泛的抗癌药物,其也调节促血管生成因子的表达,通过控制炎症应答介导因子的表达而表现出免疫调节和促炎症特性。
紫杉醇在水和其他用于胃肠外药物给药的常见载体中的溶解性差(小于0.01mg/ml)。尽管有机溶剂可部分溶解紫杉醇,当将包含饱和溶解度下的紫杉醇的水混溶性有机溶剂稀释于水性输注液中时,药物将沉淀。使用表面活性剂的增溶作用允许存在可被稳定递送到患者的乳剂,因此通常使用50%的cremophor、50%无水乙醇(usp,美国药典)来配制紫杉醇,并将其于生理盐水或5%葡萄糖水溶液中稀释至最终浓度5%聚氧乙烯蓖麻油和5%无水乙醇或更低,用于对人进行静脉内给药。
在本发明的一个优选方面中,用set复方药物和紫杉醇来治疗肿瘤和/或肿瘤转移。在紫杉醇之前、与紫杉醇一起或在紫杉醇之后给予set复方药物以增强复制细胞的细胞死亡。在紫杉醇注射或输注之前、与紫杉醇注射或输注一起或在紫杉醇注射或输注之后口服给予set复方药物以增强复制细胞的细胞死亡。
在本发明的一个优选方面中,用set复方药物和多西他赛来治疗肿瘤和/或肿瘤转移。在多西他赛之前、与多西他赛一起或在多西他赛之后给予set复方药物以增强复制细胞的细胞死亡。在注射或注入多西他赛之前、与多西他赛一起或在多西他赛之后口服给予set复方药物以增强复制细胞的细胞死亡。
奥沙利铂:根据本发明的方面,在受试者中治疗增生性疾病的方法包括给予set复方药物和奥沙利铂[草酸合(反式-l-1,2-二氨基环己烷)铂]。作为新一代铂(ii)类似物,奥沙利铂与顺铂和卡铂的类似之处在于,它通过形成产生复制损伤并增强细胞死亡的pt-dna加合物而发挥功能。然而,奥沙利铂前药表现出不同的协同相互作用、独特的药效学、降低的毒性和激活的免疫响应,这将它与其他类似物相区分。奥沙利铂与草酸盐和1,2-二氨基环己烷载体配体的结构允许草酸盐基团的快速非酶学水解和置换以产生修饰蛋白、rna和dna的反应中间物。
在本发明的一个优选方面中,用set复方药物和奥沙利铂来治疗肿瘤和/或肿瘤转移。在奥沙利铂之前、与奥沙利铂一起或在奥沙利铂之后给予set复方药物以增强复制细胞的细胞死亡。在注射或注入奥沙利铂之前、与奥沙利铂一起或在奥沙利铂之后口服给予set复方药物以增强复制细胞的细胞死亡。
辅助治疗性治疗——放射疗法
放射疗法是用于控制不能切除的或不能实施手术的肿瘤和转移肿瘤的标准治疗。当放射疗法与化学疗法结合时可观察到改善的结果。放射疗法是基于以下原理:被递送到靶区域的高剂量辐射将导致复制细胞的死亡。辐射剂量方案通常根据辐射吸收剂量(gy)、时间和分级(fractionation)来确定。患者接受的辐射量取决于多种因素,但是两个最重要的因素是肿瘤相对于未受影响的关键结构或器官的位置,以及肿瘤转移的范围。用于接受放射疗法的患者的典型疗程为:持续1-6周的计划,总剂量为10-80gy,每天给予的单一部分为1.8-2.0gy,一周5天。
根据本发明的方面,用set复方药物和辐射来治疗肿瘤和/或肿瘤转移。在一个优选的方面中,在放射疗法之前、过程中或之后给予set复方药物以增强复制细胞的细胞死亡。另一方面,在放射疗法之前、过程中或之后给予set复方药物和细胞毒性剂以增强复制细胞的细胞死亡。
辐射源可在被治疗的患者的外部或内部。当辐射源在患者外部时,治疗被称为外照射放射疗法。当辐射源在患者内部时,治疗被称为近距离放射疗法。用于本发明的放射性原子可选自:包括但不限于镭、铯-137、铱-192、镅-241、金-198、钴-57、铜-67、锝-99、碘-123、碘-131和铟-111。
在本发明的一个方面中,可将set复方药物与治疗性抗体组分一起给予,从而将所述抗体用放射性同位素标记以增强肿瘤细胞的靶向死亡。在一个优选方面中,将set复方药物与细胞毒性剂和治疗性抗体组分一起给予,其中将所述抗体用放射性同位素标记以增强肿瘤细胞的靶向死亡。
辅助治疗剂——化学治疗药物
在某些方面中,将set复方药物和细胞毒性剂与一种或多种另外的化学治疗药物一起给予,所述化学治疗药物例如但不限于,拉帕替尼(lapatinib)、多西他赛和赫赛汀(herceptin)。拉帕替尼、多西他赛和赫赛汀的产生、配制和用途是公知的。
根据本发明的方面,任选地给予的另外的化学治疗药物的实例包括但不限于:别嘌呤醇(allopurinol)、六甲蜜胺(altretamine)、氨磷汀(amifostine)、阿那曲唑(nastrozole)、三氧化砷(arsenictrioxide)、贝沙罗汀(bexarotene)、博莱霉素(bleomycin)、白消安(busulfan)、卡铂、顺铂、顺铂-肾上腺素凝胶、塞来昔布(celecoxib)、苯丁酸氮芥(chlorabucil)、克拉屈滨(cladribine)、阿糖胞苷脂质体(cytarabineliposomal)、正定霉素脂质体(daunorubicinliposomal)、正定霉素(daunorubicin)、右丙亚胺(dexrazoxane)、多柔比星、苯丁酸氮芥(chlorambucil)、克拉屈滨(cladribine)、正定霉素(daunomycin)、右丙亚胺(dexrazorane)、表柔比星、雌莫司汀(estramustine)、依托泊苷磷酸盐(etoposidephosphate)、依托泊苷(etoposide)、依西美坦(exemestane)、戈舍瑞林乙酸盐(goserelinacetate)、羟基脲(hydroxyurea)、去甲氧基柔红霉素(idarubicin)、伊达比星(idamycin)、异环磷酰胺、甲磺酸伊马替尼(imatinibmesylate)、来曲唑(letrozole)、甲酰四氢叶酸、甲酰四氢叶酸左旋咪唑(leucovorinlevamisole)、美法仑(melphalan)、美司钠(mesna)、甲氨蝶呤、甲氧沙林(methoxsalen)、丝裂霉素c(mitomycinc)、米托蒽醌(mitoxantrone)、紫杉醇、培加酶(pedademase)、喷司他丁(pentostatin)、滑石(talc)、他莫昔芬(tamoxifen)、替莫唑胺(temozolomide)、替尼泊苷(teniposide)、托泊替康、维生素a酸(tretinoin)、戊柔比星(valrubicin)、长春瑞滨(vinorelbine)和唑来膦酸盐(zoledronate)。
根据本发明的方面,任选地与set治疗剂一起给予的化学治疗药物可选自小分子、肽、糖类、类固醇、抗体(包括其片段或变体)、融合蛋白、反义多核苷酸、核酶、小干扰rna、肽模拟物等。抗体的实例包括但不限于针对前列腺特异性膜抗原的抗体(例如mln-591、mln591rl和mln2704)、贝伐珠单抗(或其他抗vegf抗体)、阿伦株单抗(alemtuzmab)、mln576(xrl1576)、吉妥珠单抗-奥佐米星(gemtuzumab-ozogamicin)、利妥昔单抗(rituximab)和曲妥珠单抗。
set复方药物
雷帕霉素的机理靶标(即雷帕霉素的哺乳动物靶标)或mtor激酶是丝氨酸/苏氨酸激酶——磷脂酰肌醇3-激酶相关激酶家族的成员,其调节细胞生长、细胞增殖、细胞运动、细胞存活、蛋白质合成和转录激活。mtor蛋白是两个结构上不同的复合物(mtorc1和mtorc2)的催化亚基,其调节不同的信号转导过程。然而,信号转导过程由每种复合物交叉通讯控制,使得在生长细胞中mtorc1抑制mtorc2活性并且当细胞可以再开始生长时mtorc2激活mtorc1。
在本发明的一方面中,mtorc1激酶活性通过激活一系列5'帽识别蛋白来间接调节cap依赖性翻译,所述5'帽识别蛋白将40s核糖体亚基定位于与基因orf紧密相邻的位置。cap依赖性、雷帕霉素敏感性80s核糖体负责细胞周期进程所需的全部蛋白的合成。考虑到该翻译活性所调节的细胞功能,将该80s核糖体在本文中称为“生长核糖体”。
在本发明的一个方面中,mtorc2仅在mtorc1失活时被激活。在本发明的一个优选方面中,mtorc2通过与位于mam膜结构的80s核糖体直接键合而被激活。在该亚细胞位置,80s/mtorc2复合物指导损伤修复蛋白的合成,通过限制向衰老的进展而控制细胞的白细胞郁积,并且阻断细胞死亡过程。考虑到80s/mtorc2复合物优先使用序列特异性翻译机制(即ires翻译起始和dorf的翻译再起始),该机制仅对于mrna种类的亚组是可能的,将80s/mtorc2核糖体称为“选择性翻译”或set核糖体。
所包括的实施例提供了以下证据:雷帕霉素抗性80s/mtorc2复合物显示出独特的抗应激活性。例如,80s/mtorc2是耐热和耐冷的,而cap依赖性核糖体在这两种处理下快速失活。在一个优选方面中,80s/mtorc2在细胞周期检查点期间指导损伤细胞中的蛋白质合成,其增加了细胞存活力、促使损伤修复并促使增殖重新开始。
在本发明的一个优选方面中,被治疗的肿瘤由增殖性细胞和非增殖性细胞的混合物组成,增殖性细胞由mtorc1活性控制,非增殖细胞响应于mtorc2作用。选择性调节mtorc1或mtorc2的试剂无法阻止mtor催化亚基的信号转导交叉通讯。因此,在肿瘤中阻断mtor活性的本发明的治疗剂首先通过在增殖性细胞中经set激动剂诱导set活性而使mtorc1失活,产生细胞抑制检查点,并且第二试剂(set核糖体拮抗剂)阻断80s/mtorc2特异性翻译以阻止细胞恢复和细胞周期进程。这两种药物作用的结合将通过增强从细胞抑制状态到衰老状态的进展(其增强了细胞死亡)来增加dna损伤化学治疗药物的功效。
在一个优选方面中,能够调节肿瘤中mtor活性的药物结合物被称为“set复方药物”,并且由“set激动剂”和“set核糖体拮抗剂”组成。当set复方药物与细胞毒性化学治疗剂结合时,该疗法特别适用于治疗耐药性癌症、癌转移和/或复发的癌症。
一方面,所述三种组分是所述方案中单独的抗癌组分。在另一个实施方案中,所述方案还包括递送其他非抗肿瘤的活性成分。本文使用的set复方药物一方面指第一化合物或其衍生物或其可药用的盐,其激活细胞应激响应程序(例如选择性翻译过程);和第二化合物或其衍生物或其可药用的盐,其阻断来自选择性翻译核糖体的蛋白质合成。
在一个优选实施方案中,set激动剂是可用于激活蛋白激酶c功能或刺激细胞周期进展到g2(其在哺乳动物受试者中诱导选择性翻译)的本发明的化合物,其中将称为set激动剂的本发明化合物以足以增加选择性翻译的一种或多种组分(对于这些组分,set信号转导的调节响应于激活)的量给予受试者。在本发明的一个优选方面中,set复方药物的称为set激动剂的活性药物组分激活蛋白激酶c功能或刺激细胞周期进展到g2,其激活了癌症治疗中的set过程并与set核糖体拮抗剂发挥作用以提高细胞毒性治疗剂的功效。在本发明的另一方面中,set复方药物中称为set激动剂的活性药物组分激活蛋白激酶c功能或刺激细胞周期进展到g2,其在体内系统性地诱导set过程并提高损伤后的细胞恢复,这阻止了细胞死亡并增加细胞毒性治疗剂的安全性。
set激动剂——聚氧乙烯氢化蓖麻油
根据本发明的方面,聚氧乙烯氢化蓖麻油(phco,可接受的商用赋形剂)被包含在set复方药物制剂中并给予受试者。
如本文实施例所示,包含在set复方药物中的phco、聚氧乙烯35蓖麻油或cremophorel作为set激动剂(其促使细胞周期进展到g2),出乎意料地有效。
将set治疗剂的一种或多种组分任选地进行处理以增强物质溶解度,所述处理示例性地包括以下方法:共溶、乳化、微乳化、使用环糊精的药物络合、使用脂质体和纳米颗粒的载体介导、以及化学修饰,以获得水溶性衍生物或前药。
包含亲脂性药物的口服药物制剂可悬浮于可与水性介质混合的乳剂中。对于有效的口服递送,乳剂必须形成微滴,其由两种通过表面活性剂稳定的不混溶的液体组成。在到达肠腔后,这些微滴将分散成细小的微滴,其允许疏水药物保持在液体状态。因此,表面活性剂或乳化剂(可能与其他组分一起)稳定并溶解活性药物或药物试剂。用于制剂中的表面活性剂或乳化剂可以是单一产品,或两种或更多种产品的结合物。表面活性剂和乳化剂的实例包括但不限于:聚氧乙烯山梨聚糖脂肪酸酯、聚氧乙烯烷基醚、聚氧乙烯蓖麻油衍生物、聚氧乙烯硬脂酸酯及饱和的聚乙二醇甘油酯。这些可药用的表面活性剂是本领域公知的并且可从商业来源获得。
包含在组合物中并且根据本发明的方面给予的phco是非离子型表面活性剂,其通过将蓖麻油通过氢化转化为硬油并且用环氧乙烷浓缩硬油来制备。根据添加的环氧乙烷的平均摩尔数对phco进行分类,添加的环氧乙烷的平均摩尔数优选地为30、35、40、50和60。例如,如果每摩尔蓖麻油与平均35摩尔环氧乙烷发生反应,所得混合物被称为聚氧乙烯35蓖麻油(或cremophorel)。类似地,使用40摩尔环氧乙烷产生的产物称为聚氧乙烯40氢化蓖麻油(或cremophorrh)。在每种情况下,所得产物是聚乙二醇醚、蓖麻油酸的聚乙二醇酯、聚乙二醇和甘油的聚乙二醇醚的混合物。尽管色谱法用于减少phco中的水溶性离子、金属和氧化杂质(其催化药物试剂的分解),未分解的亲脂性混合物仍存在于商业产品中。
在本发明的一个方面中,phco作为set激动剂被包含于其中,其在癌症治疗中激活set过程并与set核糖体拮抗剂一起作用以提高细胞毒性治疗剂的功效。另外,phco作为类似洗涤剂的非离子型表面活性剂(其增加亲水性化合物的溶解度)和作为set激动剂(其与set核糖体拮抗剂一起发挥作用)起作用以提高细胞毒性治疗剂的功效。
在一个优选方面中,聚氧乙烯35蓖麻油(cremophorel)作为疏水药物的非离子型表面活性剂和作为set激动剂起作用。类似洗涤剂的聚氧乙烯35蓖麻油微粒(cmc为0.0095w/v%)通过增强细胞膜流动性发挥作用。除了激活set以外,聚氧乙烯35蓖麻油可抑制p-糖蛋白转运蛋白功能(阻断多药物抗性并增强某些疏水试剂的肠吸收)并破坏血液中的脂蛋白复合物(改变的hdl和ldl物理特征)。另一方面,聚氧乙烯40蓖麻油(cremophorrh)作为疏水性药物的非离子型表面活性剂和作为set激动剂起作用。
本发明的一个优选方面为,在set复方药物中包含phco以激活全身性体内set过程,其通过阻止细胞毒性死亡和增加细胞毒性治疗剂的安全性来提高损伤后的细胞恢复。根据本发明的一个方面,聚氧乙烯35蓖麻油作为set激动剂被包含在set复方药物中以激活set过程,其改善了体内细胞周期进程。根据本发明的一个方面,聚氧乙烯40蓖麻油作为set激动剂被包含在set复方药物中以激活set过程,其改善了体内细胞周期进程。
set激动剂——佛波酯
佛波醇是二萜的巴豆萜烷家族的天然植物来源的有机化合物,其作为二酰基甘油(dag)的分子模拟物发挥作用。对于dag,佛波酯通过直接激活丝氨酸/苏氨酸蛋白激酶家族(共同被称为蛋白激酶c(pkc)家族)来调节细胞信号转导途径。
如本发明的实施例所示,在小鼠异基因肿瘤模型中,set激活刺激由set核糖体控制的蛋白质合成,并激活先天免疫响应。与这些实施例一致的是,佛波酯tpa已被证明诱导表皮中的表型改变,这类似于在皮肤炎症应答中观察到的那些。在该体系中,tpa直接模拟皮肤对损伤的天然响应,包括诱导il-1α释放和全新的il-1基因表达(定位的炎症)。该体内响应与mam/线粒体/mavs复合物在与类nod受体家族包含pyrin结构域的蛋白(nlrp)(其被病原体或损伤信号结合激活)结合时所调节的细胞响应一致。复合体的形成导致对炎性体(inflammasome)的信号转导,产生对病原性信号的先天免疫炎症应答。
根据本发明的方面,set复方药物的set激动剂组分是佛波酯,其在癌症治疗中激活set并与set核糖体拮抗剂一起作用以提高细胞毒性治疗剂的功效。根据本发明的方面,优选的化合物佛波醇-12-十四酸酯-13-乙酸酯(pma或tpa)被包含在set复方药物中以在癌症治疗中激活set过程并与set核糖体拮抗剂一起作用以提高细胞毒性治疗剂的功效。
考虑到pkc激活能够阻断许多细胞毒性过程,本发明的一个优选方面是set复方药物中的佛波酯激活全身性的体内set过程的用途,所述set过程通过阻止细胞毒性死亡和增加细胞毒性治疗剂的安全性来提高损伤后的细胞恢复。本发明的一个方面是在set复方药物中包含佛波醇-12-十四酸酯-13-乙酸酯(pma或tpa),其作为set激动剂以激活提高体内细胞恢复响应的set过程。
set激动剂——苔藓抑素化合物
苔藓抑素是首先从苔藓虫物种苔藓虫(bululaneritina)的提取物中分离的一类大环内酯。苔藓抑素是蛋白激酶c(pkc)活性的强效调节剂。迄今为止,已鉴定至少20种不同的苔藓抑素类似物。同其他pkc激活剂一样,苔藓抑素1表现出广泛的条件性的体外和体内响应。苔藓抑素1在以短期暴露给予时是经典的新pkc的非典型激活剂;然而,延长暴露导致同种型特异性pkc失活,其抑制细胞生长(导致分化和/或凋亡性死亡)。尽管临床前动物研究表明苔藓抑素可治疗癌症,ii期人临床试验并未检测出苔藓抑素1作为单一疗法或与其他化学治疗剂结合时的任何治疗活性。这些结果支持了以下理论:set的苔藓抑素激活不足以阻断mtorc2激酶功能,该功能允许细胞毒性剂损伤后的肿瘤恢复。
作为set诱导在增加的细胞恢复中的作用的进一步支持,苔藓抑素1已被证明激活裂解淀粉样前体蛋白(app)的α-分泌酶,产生无毒性的蛋白片段。在此结果的基础上,测试苔藓抑素1预防与app加工相关的神经退化(即阿尔茨海默症或ad)的能力。在ad转基因动物(3种啮齿类动物系,其包含不同的导致人ad的突变)中的临床前测试表明,苔藓抑素1减少了淀粉样-β斑块和神经元纤维缠结,恢复了神经元突触,并且保护免受记忆丧失。在相关的临床前研究中,苔藓抑素1通过使之前被脑卒中、头部创伤或老化破坏的突触再生而增强和恢复记忆。这些活性支持了以下理论:pkc介导的set激活增强了损伤恢复过程,其通过限制细胞毒性而增加细胞存活力。
苔藓抑素2是结构不同的苔藓抑素类似物,其与pkc的佛波酯结合位点相关并且其酶结合常数是苔藓抑素1的10倍(反映出苔藓抑素2对pkc更大的亲和力)。临床前研究表明,苔藓抑素2抑制dna合成(和细胞生长)、诱导被处理的细胞释放花生四烯酸,并且与b细胞刺激因子-1协同作用以使初始的(naive)、休眠的淋巴结t细胞分化为细胞毒性t淋巴细胞。
在本发明的一个方面中,set复方药物中的set激动剂是苔藓抑素衍生物,其在癌症治疗中激活set并且与set核糖体拮抗剂一起作用以提高细胞毒性治疗剂的功效。在其他方面中,苔藓抑素1是用于set复方药物中的优选化合物,以在癌症治疗中激活set过程并且与set核糖体拮抗剂一起作用以提高细胞毒性治疗剂的功效。在其他方面中,苔藓抑素2是用于set复方药物中的化合物,以在癌症治疗中激活set过程并且与set核糖体拮抗剂一起作用以提高细胞毒性治疗剂的功效。
在本发明的一个方面中,set激动剂通过激活set过程而增加细胞恢复、减少副作用和提高药物安全性。考虑到pkc激活能够阻断许多细胞毒性响应,本发明的一个优选方面为set复方药物中的苔藓抑素激活全身性体内set过程的用途,所述set过程通过阻止细胞毒性死亡和增加细胞毒性治疗剂的安全性而提高损伤后的细胞恢复。本发明的一个方面是苔藓抑素1作为set复方药物中的set激动剂以激活set过程的用途,所述set过程提高体内细胞恢复响应。在本发明的另一个方面中,苔藓抑素2被用作set复方药物中的set激动剂以激活set过程,所述set过程提高体内细胞恢复响应。
set核糖体拮抗剂——茴香霉素
考虑到了用于抑制set核糖体蛋白质合成的候选分子可被重新设计、或可使用现有的核糖体抑制剂通过功能测定来鉴定。考虑到了适用于设计新分子的许多方法也适用于在已通过经验确定现有分子对set核糖体的功能活性之后修饰现有分子。多种试剂结合于80s核糖体并破坏蛋白质合成,包括例如但不限于:氯霉素(chloramphenicols)、大环内酯类(macrolides)、林可酰胺类(lincosamides)、链阳菌素(streptogramins)、异硫霉素(althiomycins)、噁唑烷酮(oxazolidinones)、核苷酸类似物(nucleotideanalogs)、硫链丝菌肽(thiostreptons)(例如微球菌素家族)、肽、戊二酰亚胺(glutarimides)、单端孢霉烯族毒素类(trichothecenes)、tan-1057、截短侧耳素(pleuromutilins)、潮霉素(hygromycins)、氨苄青霉素(betacins)、埃弗米诺米辛(eveminomicins)、boxazomycins和夫西地烷(fusidanes)。
茴香霉素或(2r,3s,4s)-4-羟基-2-(4-甲氧基苄基)-吡咯烷-3-基乙酸酯是浅灰链霉菌(streptomycesgriseolus)产生的抗生素,其抑制真核蛋白质合成。茴香霉素的吡咯烷环对于与60s核糖体亚基的相互作用是重要的,其结合在氨酰基(a位点)和肽基(p位点)的连接点。在该位点,茴香霉素阻断肽键形成并抑制肽基转移酶反应(阻止延长并破坏多核糖体稳定性)。
茴香霉素已广泛被用作神经调节剂,其调节记忆保留和恢复。除了它阻断翻译的能力,茴香霉素已被证明在不显著影响蛋白质合成的剂量下是有丝分裂原激活的蛋白激酶(mapk)信号转导系统——特别是应激激活的p38有丝分裂原激活的蛋白激酶(p38mapk)和c-junnh2末端激酶(jnk)的强效激活剂。
本发明记载了由set激动剂和set核糖体拮抗剂组成的set复方药物,其中set影响性药物的结合使mtor激酶活性失活并提高了细胞毒性治疗剂的功效。在本发明的一个方面中,set核糖体拮抗剂是核糖体活性的抑制剂,其“生物学有效剂量”(bed)产生100%set核糖体抑制但是远低于在动物中的致死浓度。
如实施例所示,茴香霉素选择性阻断来自激活的80s/mtorc2核糖体(set核糖体)的翻译,50%抑制浓度或ic50<50nm并且ic100(100%set核糖体抑制)为1μμ。在该实施例中,1μμ剂量下的set核糖体的绝对抑制远低于35μμ(肌肉内)和500μm(口服)的ld50(对于小鼠);远低于200μμ(肌肉内)和1mm(口服)的ld50(对于猴)。
在本发明的一个方面中,set核糖体拮抗剂是在哺乳动物受试者中可用于阻断set核糖体的蛋白质合成的本发明的化合物,其中将称为set核糖体拮抗剂的本发明的化合物以足以消除全部set的量给予受试者,之后set核糖体的激活产生恢复蛋白质合成。在一个优选方面中,茴香霉素作为set核糖体拮抗剂被包含在set复方药物中,其在癌症疗程中阻断来自set核糖体的蛋白质合成并与set激动剂一起作用以提高细胞毒性治疗剂的功效。
set核糖体拮抗剂——依米丁
依米丁或(2s,3r,11bs)-2-{{(lr)-6,7-二甲氧基-1,2,3,4-四氢异喹啉-1-基]甲基}-3-乙基-9,10-二甲氧基-2,3,4,6,7,11b-六氢-1h-吡啶并[2,1-a]异喹啉)是从吐根(cephaelisipecacuanha)的地根分离出的主要的吐根生物碱。依米丁的一些最早的用途是作为催吐药、祛痰药、抗寄生虫药和作为抗细菌/抗病毒剂。然而,在生理ph下,依米丁以浓度和时间依赖性方式,通过结合至40s亚基中的rps14蛋白,不可逆地抑制哺乳动物、酵母和植物的蛋白质合成。
rps14蛋白是重要的核糖体成熟因子,其参与20s前-rrna加工成18srrna和43s前核糖体成熟为40s。在80s核糖体中,rps14通过结合至18srrna中的保守螺旋结构和结合至mrna序列元件,促进40s亚基上的mrna组装。在40s平台结构上,接近mrna出口通道,rps14也控制40s亚基的构象改变,需要该构象改变以将各病毒iresrna元件排列在40s解码沟中。
在暴露于80s核糖体之后,依米丁结合于rps14暴露的碱性羧基端序列,这阻断了mrna40s亚基的结合。作为抗寄生虫药物,依米丁在亚细胞毒性浓度下阻断生长并诱导凋亡。作为抗病毒药物,依米丁阻断40s亚基上登革病毒(denguevirus)iresrna结构的组装,这阻止了cap非依赖性病毒蛋白质合成和复制。
本发明记载了由set激动剂和set核糖体拮抗剂组成的set复方药物,其中set影响性药物的结合使全部mtor激酶活性失活并提高了细胞毒性治疗剂的功效。在本发明的一个方面中,set核糖体拮抗剂是核糖体活性的抑制剂,其“生物学有效剂量”(bed)产生100%set核糖体抑制但是远低于在动物中的致死浓度。如实施例所示,依米丁选择性阻断来自激活的80s/mtorc2核糖体(set核糖体)的翻译,50%抑制浓度或ic50为175nm并且ic100(100%set核糖体抑制)为2.5μμ。在该实施例中,2.5μμ剂量下的set核糖体的绝对抑制远低于5μμ(静脉内)和35μm(口服)的ld50(对于兔);远低于216μμ(口服,120mg/kg)和174μm(皮下,95mg/kg)的ld50(对于大鼠)。
在本发明的一个方面中,set核糖体拮抗剂是在哺乳动物受试者中可用于阻断set核糖体的蛋白质合成的本发明的化合物,其中将称为set核糖体拮抗剂的本发明的化合物以足以消除全部set的量给予受试者,之后set核糖体的激活产生恢复蛋白质合成。在一个优选方面中,依米丁是set复方药物中的活性药物成分——其被称为set核糖体拮抗剂,其在癌症疗程中阻断来自set核糖体的蛋白质合成并与set激动剂一起作用以提高细胞毒性治疗剂的功效。
试剂给药
一方面,可包含有效量的本发明的一种或多种药物组合物,例如单一丸剂、胶囊、预测量的静脉内剂量或预填充的用于注射的注射器。或者,将组合物制备成单独剂量形式,其中一个单位(例如一个丸)将包含次佳的剂量,但是可指导患者每次治疗用两个或更多个单位剂量。也可制备用于终端使用者后期稀释的浓缩物,例如静脉内(iv)制剂和多剂量的注射制剂。
多种给药途径可用于治疗人或动物患者。所选择的特定方式将取决于所治疗的特定病症、治疗功效所需的剂量和组合制剂的组成。可使用任何医学上可接受的给药方式(即提供药物活性化合物的最佳治疗活性而不增强任何临床上不可接受的不利反应的方式)来实施本发明的方法。
优选的给药途径包括口服、胃肠外(例如皮下、注射、静脉内、肌肉内、胸骨内或输注)、通过吸入喷雾、局部地、通过粘膜吸附或通过直肠。更优选地,经口服给予本发明的化合物。另一方面,给药途径为胃肠外(即静脉内、腹膜内、输注或注射)。在本发明的一个方面中,通过肿瘤注射直接将化合物给予肿瘤。另一方面,经全身给予化合物。
对于作为悬浮剂或乳剂的口服给药,可根据药物制剂领域中公知的技术来制备组合物。组合物可包含微晶纤维素作为主体(bulk),海藻酸或海藻酸钠作为悬浮剂,甲基纤维素作为粘度增强剂、甜味剂或调味剂。作为立即释放的片剂,组合物可包含微晶纤维素、淀粉、硬脂酸镁、乳糖、或本领域已知的其他赋形剂、胶粘剂、填充剂、崩解剂、稀释剂和润滑剂。
对于作为注射溶液或悬浮剂的胃肠外给药,可使用适合的分散剂或润湿剂和悬浮剂,根据本领域公知的技术来配制组合物。将溶液或悬浮剂配制在水、等渗盐水(pbs)中,或与惰性表面活性剂(pcho)混合。分散液也可在甘油、液态聚乙烯、乙二醇、dna、植物油、三乙酸甘油酯及其混合物中制备。
在贮存和使用的常规条件下,可注射制剂包含惰性防腐剂以防止微生物生长。防腐剂可以是添加到或施用到药物组合物以防止被微生物生长或不想要的化学反应分解的物质或方法。通常,通过化学添加剂或物理加工来进行防腐治疗。在一个优选方面中,记载了用于鉴定惰性化学添加剂的方法和组合物,所述惰性化学添加剂可被用作不通过刺激或抑制mtor特异性翻译来调节set过程的防腐剂。
作为对治疗化学治疗后感染(由于免疫抑制)的预防,抗微生物治疗(即抗生素)将在化学治疗之后使用。类似地,靶向癌症相关的病毒和细菌能够预防引发胃癌、宫颈癌、造血癌、肝癌和脑癌。在本发明的一个优选方面中,给予抗微生物剂和抗病毒剂,以通过刺激或抑制mtor调节的翻译来控制受试者中的set过程。另一方面,记载了用于鉴定惰性抗生素的方法和组合物,所述惰性抗生素不通过刺激或抑制mtor调节的翻译来控制set过程,并且可被安全添加到本发明所述的药物制剂以预防微生物感染。
可使用多种药物形式。因此,如果使用固体载体,则所述制品可被制成片剂、放置在硬明胶胶囊中、粉末剂、粒剂形式、糖锭(troche)形式或锭剂(lozenge)。固体载体的量将广泛改变,但是优选地为糖浆、乳剂、软明胶胶囊、无菌注射溶液或安瓿瓶、小瓶中的悬浮剂,或非水性液态悬浮剂的形式。为了获得稳定的水溶性剂型,set复方药物和细胞毒性剂的可药用盐可溶解于有机或无机酸或碱的水溶液中。如果不可获得可溶性盐形式,set复方药物和细胞毒性剂可溶解在适合的共溶剂或其结合物中。这样的适合的共溶剂的实例包括但不限于醇、丙二醇、聚乙二醇300、聚山梨醇酯80、甘油等,其浓度范围为总体积的0-60%。
所想到的用于这些组合物的赋形剂、稀释剂或载体通常是药物制备领域已知的。对适用的材料的提及可见于公知汇编物,例如remington'spharmaceuticalsciences,mackpublishingco.,easton,pa。组合物和药物赋形剂、稀释剂或载体的性质将取决于计划的给药途径,例如通过静脉内和肌肉内注射、胃肠外、局部、口服或通过吸入。对于胃肠外给药,药物组合物为无菌注射液的形式,例如安瓿针剂(ampule)或水性或非水性液态悬浮剂。对于局部给药,组合物可以为膏剂、软膏、洗剂、糊剂、喷雾剂或滴剂的形式,其适用于给予皮肤、眼、耳、鼻或外生殖器。对于口服给药,药物组合物可以是片剂、胶囊、粉末剂、丸剂、糖锭、锭剂、糖浆、液体剂或乳剂的形式。
使用的药物赋形剂、稀释剂或载体可以是固体或液体。当使用溶液或悬浮液形式的药物组合物时,适合的载体或稀释剂的实例包括:对于水性系统,水;对于非水性系统,乙醇、甘油、丙二醇、橄榄油、玉米油、棉花籽油、花生油、芝麻油、液体石蜡,以及水的混合物;对于固体系统,乳糖、石膏粉、蔗糖、滑石、明胶、琼脂、果胶、阿拉伯胶、硬脂酸镁、硬脂酸、高岭土和甘露醇;对于气溶胶系统:二氯二氟甲烷、氯三氟乙烷和压缩的二氧化碳。此外,除了药物载体或稀释剂之外,本发明的组合物(instantcomposition)可包括其他成分,例如稳定剂、抗氧化剂、防腐剂、润滑剂、悬浮剂、粘度改良剂等,条件是其他成分对本发明的组合物的药效学、药代动力学或治疗作用没有有害作用。类似地,载体或稀释剂可包括本领域公知的延时材料,例如单独的单硬脂酸甘油酯或二硬脂酸甘油酯,或其与石蜡、乙基纤维素、羟丙基甲基纤维素、甲基丙烯酸甲酯等一起。
本发明的化合物能够形成可药用的酸加成物和/或碱盐。与金属或胺(例如碱金属和碱土金属或有机胺)形成碱盐。用作阳离子的金属的实例为钠、钾、镁、钙等。还包括重金属盐,例如银、锌、钴和铯。适合的胺的实例为ν,ν'-二苄基乙二胺、氯普鲁卡因、胆碱、二乙醇胺、乙二胺、n-甲基葡糖胺和普鲁卡因。与有机酸和无机酸形成可药用的酸加成盐。适合形成盐的酸的实例为盐酸、硫酸、磷酸、乙酸、柠檬酸、草酸、丙二酸、水杨酸、苹果酸、葡萄糖酸、延胡索酸、琥珀酸、抗坏血酸、马来酸、甲磺酸等。通过将游离碱形式与足量的所需酸接触以产生常规形式的单盐或二盐等,来制备酸性盐。按照需要,可通过用碱处理盐形式来再生游离碱形式。游离碱形式可在某些物理特性(例如在极性溶剂中的溶解度)方面不同于它们各自的盐形式,但是对于本发明的实施,药物盐形式应当在其他方面等同于各自的游离碱形式。
以治疗有效量给予药物活性化合物。治疗有效量意指获得所需的响应——例如延迟被治疗的增生性疾病的发生、抑制被治疗的增生性疾病的进展,或同时阻止被治疗的增生性疾病的发生或进展——所必需的量。这样的治疗给药,特别是对于细胞毒性剂,将取决于治疗的特定病症、病症的严重程度(例如肿瘤期)、单个患者参数如年龄、生理条件、身高、体重、同时存在的疾病状态和同时存在的治疗。这些因素是本领域公知的,并且仅通过常规临床评估即可解决。对于细胞毒性剂,优选使用最大耐受剂量,即根据合理的医学判断和经验性的人试验的最高安全剂量。本领域普通技术人员理解,针对技术、生理原因或针对实际上任何合理的医学原因,可给予更低剂量或可耐受剂量。
应理解,用于本发明的组合物和治疗方法的set复方药物和细胞毒性剂的真实优选剂量将根据使用的具体组分、配制的具体组合物、给药方式、具体位置、宿主和被治疗的增生性病症而改变。抗肿瘤领域的普通技术人员使用常规剂量确定测试,根据上述实验数据,可确定特定患者中的具体病理病症的最佳剂量。例如,通过胃肠外递送给予的剂量范围可为每日2–50mg/m2体表面积,持续1-5天,优选每3-4周重复,进行4个疗程。对于连续iv给药,剂量可以为约0.5mg/m2/天,持续5至21天。对于口服给药,剂量范围可以为20–150mg/m2体表面积,持续1至5天,在适当的间隔重复疗程。
本文使用的分子生物学技术、生物化学技术和微生物技术是本领域公知和通常使用的,并且记载于例如sambrookj.etal.(1989),molecularcloning:alaboratorymanual,coldspringharbor,第3版.(2001);ausubel,f.m.(1987),currentprotocolsinmolecularbiology,greenepub.associatesandwiley-interscience;ausubel,f.m.(1989),shortprotocolsinmolecularbiology:acompendiumofmethodsfromcurrentprotocolsinmolecularbiology,greenepub.associatesandwiley-interscience;innis,m.a.(1990),pcrprotocols:aguidetomethodsandapplications,academicpress;ausubel,f.m.(1992),shortprotocolsinmolecularbiology:acompendiumofmethodsfromcurrentprotocolsinmolecularbiology,greenepub.associates;ausubel,f.m.(1995),shortprotocolsinmolecularbiology:acompendiumofmethodsfromcurrentprotocolsinmolecularbiology,greenepub.associates;innis,m.a.etal.(1995),pcrstrategies,academicpress;ausubel,f.m.(1999),shortprotocolsinmolecularbiology:acompendiumofmethodsfromcurrentprotocolsinmolecularbiology,wiley,andannualupdates;sninsky,j.j.etal.(1999),pcrapplications:protocolsforfunctionalgenomics,academicpress;specialissue,jikkenigaku[experimentalmedicine]"idenshidonyu&hatsugenkaisekijikkenho[experimentalmethodforgeneintroduction&expressionanalysis]",yodo-sha,1997。将这些出版物每篇的相关部分(或可能全文)以引用的形式纳入本文。
本发明多肽的氨基酸或核苷酸缺失、置换或添加可通过作为公知技术的位点特异性诱变方法来进行。可根据以下文献中所述的方法进行一个或若干个氨基酸或核苷酸缺失、置换或添加:molecularcloning,alaboratorymanual,第二版,coldspringharborlaboratorypress(1989);currentprotocolsinmolecularbiology,supplement1to38,johnwiley&sons(1987-1997);nucleicacidsresearch,10,6487(1982);proc.natl.acad.sci.,usa,79,6409(1982);gene,34,315(1985);nucleicacidsresearch,13,4431(1985);proc.natl.acad.sci.usa,82,488(1985);proc.natl.acad.sci.,usa,81,5662(1984);science,224,1431(1984);pctwo85/00817(1985);nature,316,601(1985)等。
已详细描述了本发明,显而易见的是,可对本发明进行修改或变更,而不偏离所附权利要求中限定的本发明的范围。此外,应当理解,本公开内容中的所有实施例在说明本发明时是作为非限制性实施例提供的,因此不应当视为对所说明的本发明各方面的限制。
实施例
以下非限制性实施例证明对set核糖体的调节在肿瘤中产生慢性应激状态,其增强了一线肿瘤学药物的治疗活性,并且提供这些实施例以进一步举例说明本发明。
实施例1
1a.确定tr转移癌细胞模型的特征。晚期和侵入性肿瘤被认为包含表现出干细胞特征的独特的癌细胞群,所述特征例如自我更新的能力、进化并产生新的干细胞子代的能力、增强的对细胞损伤的抗性以及肿瘤启动能力。尽管癌干细胞(csc)占任何肿瘤的一小部分,它们组成了需要产生远距离、异源转移的群体。因为高tr类别编号(和升高的set核糖体活性)与增加的g2/m损伤修复潜能、提高的细胞存活力和耐药性有关;多种mtr和htr细胞系用于比较具有确定的体外和体内csc特性的set核糖体响应。例如,tr转移癌细胞模型将表现出一系列可测量的特性,包括:(1)它来自亲代tr细胞系的一小部分异常群体(排序前1-5%set诱导);(2)它证明了药物和应激抗性,其与基于细胞的tr测定中统计学上升高的set核糖体活性(称为4类响应)相关;(3)它表现出克隆进化,其由于低密度选择性生长(例如重复的单细胞集落形成及从少数细胞产生非粘附的肿瘤球)而导致set核糖体活性的高度显著改变(产生新的tr异常响应);(4)它在连续异种移植到裸小鼠之后表现出体内肿瘤启动活性;(5)它形成异基因肿瘤,其表现出对tr表达盒的set特异性翻译的体内调节;和(6)它形成具有升高的生长率和对细胞毒性药物处理的抗性的异基因肿瘤。例如,tr转移结直肠癌(crc)细胞模型克隆是从亲代crc细胞系(例如hct116)分离,并且表现出这些特性中的每一种。如随后部分所示,tr转移crc细胞模型的一个实例是htrdm-fluc#32。
1b.鉴定和分离源自小异常群体的tr细胞系
(a)细胞培养材料
将所有的哺乳动物细胞保持在37℃、5%co2、适合的完全生长培养基中(以下针对每种细胞系进行具体说明)。
dmem:1袋/ldmem粉末(invitrogenlifetechnologies);3.7g/l碳酸氢钠;30-50mg/l庆大霉素硫酸盐;10%胎牛血清(fbs)或dmem,高葡萄糖液体(thermofisherscientific);庆大霉素硫酸盐;10%fbs。
mem:1袋/lmem粉末以及earle's盐(invitrogenlifetechnologies);1.5g/l碳酸氢钠;10ml/l100mm丙酮酸钠溶液(invitrogenlifetechnologies);10ml/l10mmmem非必需氨基酸溶液(invitrogenlifetechnologies);30-50mg/l庆大霉素硫酸盐;10%fbs或mem液体(thermofisherscientific);庆大霉素硫酸盐;丙酮酸钠;mem非必需氨基酸;10%fbs。
rpmi:1袋/lrpmi1640粉末(invitrogenlifetechnologies);10ml/l100mm丙酮酸钠溶液(invitrogenlifetechnologies);30-50mg/l庆大霉素硫酸盐;10%fbs或rpmi液体(thermofisherscientific);丙酮酸钠;庆大霉素硫酸盐;10%fbs。
(b)哺乳动物细胞的转染
以下表达质粒用于转染哺乳动物细胞:pcmv-fluc、pmtrdm-fluc、phtrdm-fluc、pmtrdm-gluc和phtrdm-gluc。这些质粒包含tr表达盒(图1a),其使用罕见的翻译控制系统通过set核糖体来控制蛋白质合成。多核糖体特征分析证明,3%哺乳动物mrna(220-350种类)在cap依赖性翻译抑制之后被主动翻译。通常使用被cap依赖性和cap非依赖性过程共同翻译的转基因来检测这些转录产物的内部翻译起始。因为这些翻译活性定位至不同的细胞周期阶段,现有技术仅能够定性地测量翻译事件。tr表达序列包含大量上游开放阅读框(uorf)和翻译终止密码子,其阻止cap依赖性核糖体扫描到报告基因的下游orf。这需要tr翻译通过内部起始过程发生。
为了确定内部调节元件,缺失图谱鉴定了外显子4中的内部核糖体进入序列(trires),其控制g2/m期中来自亲代基因的两个内部orf(iorf)的翻译(定点诱变用于使tr序列中的这些orf失活)。该过程的特异性是通过以下事实来说明:外显子4ires两侧是可缺失而不影响set的非必需序列(外显子3b和5)。然而,缺失外显子5-7破坏set并且产生从外显子4的组成型翻译起始。随后的序列分析鉴定了外显子4中推定的trires元件,其与gtx基因中的ires元件具有序列同一性并且与ires功能所需的18srrna螺旋26序列具有序列同源性(表1)。因为外显子5-7在被克隆到哺乳动物表达载体中时未表现出转录或翻译活性,这表明外显子6-7必须包含外显子4trires的负调节因子。
外显子7的序列分析鉴定了与多个病毒基因组中存在的翻译“再起始”序列具有同一性的片段(tr调节因子,图1和表1)。在病毒中,该序列在g2/m期中发挥功能以指导从orf的翻译,该翻译在cap依赖性翻译中通常被阻断。此外,需要病毒rna(具有最小交叉物种结构同源性)中的mrna二级机构以将该序列和起始密码子定位在40s核糖体亚基上。为了检查tr外显子7序列的翻译调节,定点诱变用于在包含该再起始元件的rna结构中引入突变,并且任何影响天然外显子7rna结构的突变都使得无法调节trset(表2)。这证明了外显子4中的组成型trires被外显子7中的tr调节因子控制,以从tr表达盒产生g2特异性set和报告蛋白表达(fluc,gluc)。已知没有其他哺乳动物mrna包含该双功能调节系统。
按照供应商的指导,使用非脂质transfectol转染试剂(continentallabproducts)或fugene6基于脂质的转染试剂(rocheappliedscience)来进行哺乳动物转染。在transfectol转染之前,使哺乳动物细胞在100mm培养皿中生长至50%汇合,并且添加补充了2.5-5%fbs的适合的生长培养基,1-3小时之后添加dna/转染试剂混合物。通过首先结合1ml稀释剂和15μg质粒dna并进行涡旋,然后添加60μltransfectol并进行涡旋5秒,来制备所述混合物。在室温(rt)下将每种dna/转染试剂混合物孵育15分钟,然后将其逐滴加到细胞。在存在dna/transfectol混合物的情况下使细胞生长2-16小时。此时,用完全生长培养基、10%fbs替换培养基,并使细胞再生长24小时,然后添加g418选择性培养基。
在用fugene6转染之前,使哺乳动物细胞在t-25烧瓶中生长至50%汇合,并补充适合的完全生长培养基、10%fbs,1-3小时之后添加dna/转染试剂混合物。使用1:3、2:3和1:6dna:fugene6比例,为每种质粒dna制备三种dna/转染试剂混合物。为了准备dna/fugene6混合物,按照以下将fugene6稀释于适合的无血清生长培养基中:1:3比例混合物:242.5ulsfm+7.5μlfugene6,2:3比例混合物:242.5μlsfm+7.5μlfugene6,1:6比例混合物:235μlsfm+15μlfugene6。
将fugene6稀释物进行涡旋并在室温下孵育5分钟。然后如下添加质粒dna:1:3比例混合物:2.5μg,2:3比例混合物:5μg,1:6比例混合物:2.5μg。将dna/fugene6混合物进行涡旋并在室温下孵育15分钟,然后将该混合物添加至细胞。将细胞在存在dna/fugene6混合物的情况下生长过夜。此时,用完全生长培养基、10%fbs替换培养基,并使细胞再生长24小时,然后添加g418选择性培养基。
(c)稳定转化的细胞的选择
为了分离稳定亚克隆,以由表达质粒编码的g418抗性因子来选择转染子。转染后约48小时,施用g418选择性培养基(补充了500μg/mlg418的完全生长培养基)。每两天更换选择性培养基,持续2-3周,直到非抗性细胞脱附并且g418抗性“原代”克隆出现。根据克隆的数量和密度,将平板在无g418培养基中生长直到平板达到50-60%汇合。将选择平板上的全部“原代”克隆一起收集在一个样品中,转移至100mm培养皿,铺板后培养24小时,并生长直到约80%汇合。克隆的集合被称为细胞池或传代1(p1)池。
(d)测量稳定转化的哺乳动物细胞池中的set核糖体活性
使用一种或多种trset参考标准试剂(表3)来测试每个p1池的set核糖体活性,并使用两种测定方法中的一种(例如细胞计数或汇合测定)来测量。
使用细胞计数方案来进行全部定量trset测定。对于亚克隆分析,对来自p1池的细胞进行计数,并以25,000个细胞/孔(3个重复孔)的密度传代到白色透明底96孔微滴定盘。剩余的细胞放置在传代2(p2)培养皿中以保持原种培养。使微滴定板中的细胞生长18-40小时以达到约75%细胞汇合,然后在完全生长培养基中用参考标准试剂孵育细胞,并且测定fluc活性。相比之下,对所建立的细胞系的定量分析要求细胞必须在保证对数生长的培养条件(例如细胞数量、频繁的培养基更换)下生长(导致较高比例的细胞经历dna复制或s期细胞)。对这些培养物进行计数并如上述进行处理。该培养系统降低了g2特异性set核糖体背景并提高了未处理细胞与处理细胞的响应比例。
对于汇合测定,对汇合的p1培养物进行处理以传代,并且将固定体积的细胞悬浮液(约总数的1%或约60000个细胞/孔)传代到白色透明底96孔微滴定盘。使微滴定板中的细胞生长24-40小时直到所有样品孔达到汇合(即每平方厘米的最大细胞数),然后在完全生长培养基中用参考标准试剂孵育细胞,并且测定fluc活性。
孵育6小时之后,通过相差显微镜检查细胞的脱附迹象。如果约10%以上的细胞脱附,则在1200rpm下离心96孔板3分钟以沉淀脱附的细胞。除去培养基并用50μl细胞裂解缓冲液(25mmtris-磷酸盐(ph7.8)、10%甘油、1%tritonx-100、1mg/mlbsa、2mmegta和2mmdtt)替换。在室温下将细胞用细胞裂解缓冲液孵育10分钟,并且使用相差显微镜来验证细胞裂解。为了确保完全裂解,剧烈搅动每个样品孔。用注射器针头手动破坏气泡。为了发光,向孔中注射5μl溶解于反应缓冲液中的d-荧光素溶液(25mm双甘氨肽(ph7.8)、15mmmgso4、4mmedta、15mm磷酸钾、1mmdtt、1mm辅酶a、6.7mmatp和3.35mmd-荧光素)。振荡4秒之后,使用具有适合滤镜的fluostaroptima(bmglabtech)酶标仪测量发光值,增益为2500-4000。
使用处理细胞与未处理细胞产生的值的比率,将光值转化为倍数诱导(foldinduction)。最初,由任何给定的参考标准试剂产生的最大set值用于确定每种细胞型的最佳参考标准测定(即引发最高trset响应的参考标准的组成和剂量)(表3)。该测定随后用于筛选来自该池的亚克隆并指定类别命名。
(e)包含不同trset类别的克隆细胞系的分离和tr细胞组的构建
尽管依赖于细胞系池,但是如果在未用毒素处理的孔中增益为3500时总的相对光单位(rlu)不低于值50000并且处理细胞中的诱导为1.5至2.5倍,则判定组成型cmv-fluc载体转化的细胞是响应的。类似地,当在未用毒素处理和用毒素处理的孔中增益为3500时总rlu不低于值1000并且处理细胞中的诱导为3至1000倍,则判定包含trfluc表达载体的细胞是响应的。
为了从响应细胞池制备克隆分离物,收集来自p3-p4培养物的细胞、对其进行稀释、计数和再铺板。铺板密度为500至10,000个细胞/100mm培养皿,这取决于细胞类型。缓慢生长的、低密度敏感性细胞类型是以更高的细胞数量铺板,而快速生长的、密度不敏感的细胞类型是以更低的细胞数量铺板。集落形成需要1-4周,这取决于细胞类型。一旦可裸眼看见集落,则标记单独的集落以进行亚克隆。将经火焰灭菌的克隆环用一薄层高真空油脂处理,并将其粘附在围绕集落的平板上。将克隆环用1x胰蛋白酶-edta(invitrogen)填充并孵育以释放细胞,所述细胞作为p1集落被传代到24孔盘中。每个池处理足量的集落(150-400个独立的亚克隆)以回收全部翻译响应的分离物的>75%。随着每个亚克隆达到汇合,将每个分离物传代到t-25烧瓶(标记为p2),生长至汇合,并在汇合测定方案中使用细胞特异性最佳参考标准试剂测定进行分析。
根据发光读数,计算每个亚克隆的倍数诱导值。将这些值从最低值到最高值进行排序,并作为排序顺序相对于倍数诱导值的函数作图(即排序图)。为了分配tr类别名称,用统计分析将亚克隆分成亚组,所述亚组的区别在于与低类别响应组的平均值的至少2个标准差。基于最低的排序系列(最低翻译响应),细胞亚克隆被分成tr1类。使用类似的步骤,鉴定tr2和3类亚克隆。用全部类别响应的集合来确定1、2和3类的定义并使用细胞计数测定来鉴定亚克隆以进行详细分析。
定量细胞计数测定的结果用于鉴定足够的亚克隆以构建tr细胞组,其包含:第1类:不少于2至3个代表,加上全部边界克隆(作为第1和2类边界的类别命名);第2类:不少于3至4个代表,包括全部边界克隆;第3类:保留全部亚克隆。根据3类响应定义,“异常”为表现出在共同的第3类亚克隆的平均值之外的>3个标准差的trset响应的任何亚克隆。将每个tr细胞组亚克隆放置在低温贮存中。通常使用低传代亚克隆原种来制备冷藏保存的原种,所述低传代亚克隆原种已在100mm培养皿中生长至汇合,用1x胰蛋白酶-edta清洗至少2次(1分钟,室温),收集在2ml冷冻培养基(90%胎牛血清、10%dmso)/100mm培养皿中,并转移到冷冻小瓶(每小瓶1ml细胞;每小瓶1×107个细胞)。将冷冻小瓶放置在缓慢冷冻容器中的-70/-80℃冷冻室中16-24小时,然后转移到液氮中保存。
(f)表征和保持tr细胞组
为了确定每个tr细胞组成员的set表达方式,使用细胞计数测定以及参考标准试剂来检查组中的每个细胞,并对其进行时间过程(跨度不多于6小时)、剂量依赖(通过已知的生物化学或酶学特性确定的剂量)和多个剂量依赖的修饰剂测定(测试试验化合物或处理修饰参考标准响应的能力)。使用单一或结合处理(包含2种试验试剂/条件)来进行这些测定,并且根据测定中的试剂/条件的总数,将这些测定称为3、15或21试剂测定形式。
偶尔地,tr类别细胞系可由于不恰当的维持或较差的冷冻保存而受到损伤。为了恢复特定的分离物,需要对类别定义的亚克隆进行二级亚克隆和再纯化。为了纯化二级亚克隆,将细胞系进行连续稀释(铺板100-1000个活细胞/100mm培养皿)以恢复单独的克隆,使用所述的细胞计数测定对所述单独的克隆进行亚克隆、增殖和重新测定。对于tr2和3类细胞,该二级亚克隆步骤通常产生具有比亲代克隆更低和更高set值的亚克隆(例如图7a)。
1c.确定与独特的异常群相关的特定set核糖体响应
(a)测量set核糖体在s期中的暂时激活
用于tr测定的对数或指数细胞生长方案产生较高比例的s期细胞,最小部分的g1和g2期细胞,以及低set核糖体背景活性。通过多个set激动剂(表3)进行的翻译诱导被证明可在意料不到的快速时间过程中激活set核糖体。如图1b所示,测量set核糖体的暂时调节的非常好的系统包括trgluc表达载体(分泌的gluc蛋白)。在该研究中,tpa在处理的2小时之内诱导统计学上显著的set增加。因为s期细胞周期部分覆盖6-8小时,这些结果表明,set核糖体在s期后期细胞中变得具有活性并且其活性大小在细胞进入g2期时增加。这表明set核糖体激活与dna复制相关,并且能够诱导s期内部检查点的任何试剂均应当非选择性地产生对set核糖体翻译的立即阻断(非选择性的set拮抗剂)。相比之下,能够刺激dna复制和g2进程的化合物或处理将激活set核糖体并表现出set激动剂活性。
(b)检测和确定set核糖体的热调节
在dna复制期间受损的细胞能够激活s期内部检查点,诱导衰老并增加凋亡性细胞死亡。或者,抗性细胞能够通过激活g2/m细胞周期检查点而响应于细胞损伤,这提供了充足的时间以合成修复细胞损伤和诱导细胞周期进程所需的材料。热应激——被研究得最充分的细胞应激因子之一——显示出以下温度依赖性的能力:阻止dna合成、诱导dna链断裂、将mrna分离成应激颗粒和增加热休克蛋白的set,同时使cap依赖性核糖体失活。更早的研究表明,短期暴露(1-2小时)于低温(41℃)或中温(43℃)并未显著增加细胞死亡或s期内部检查点,但是确实使复制酶(例如拓扑异构酶)和cap依赖性翻译失活,同时在g2/m检查点终止有丝分裂。
如图2a和2b所示,对hek293tr细胞组进行连续热休克(42℃)并测定set核糖体响应。如细胞计数方案所述,将每组细胞系放置在一系列96孔微滴定板中,使用每孔25000细胞,并且使细胞生长约40小时。在42℃下加热每个微滴定板,每小时移出板,处理样品,并测定萤火虫荧光素酶活性,如所述的。每个时间点代表3个重复孔的平均值。如所预期的,cap依赖性翻译(例如cmv表达载体所例证的)在1小时之内显著降低,并且持续降低6小时。然而,在2小时开始(与set核糖体激活的更早的gluc暂时测定一致的时间)并持续整个处理过程,fluc报告蛋白的set线性增加。出乎意料地,在第6小时,每个tr细胞系中set核糖体响应的大小与之前指定的tr类别名称相关。这些结果表明,set核糖体在s期中的激活和set都是耐热的。
对于热休克,在环境温度下处理细胞(冷休克)导致冷休克蛋白的快速set和cap依赖性核糖体的失活。为了进一步检查set核糖体的热特性(图3a和3b),在42℃和23℃下,使用5个参考标准(表3),对来自hek293tr细胞组的代表性细胞系进行15-测定研究。将hek293细胞组细胞系放置在96孔微滴定板中并如细胞计数方案所述进行处理。用单一或成对结合的参考标准试剂(总结于表3中)处理细胞,并在环境温度(23℃)、生理温度(37℃)和高温(42℃)下孵育细胞6小时。如所述处理细胞并测定萤火虫荧光素酶活性。
如所预期的,cmv细胞系中cap依赖性翻译在任一温度下未表现出任何响应。相比之下,比较高温和低温结果发现,在一起施用优选的set激动剂(tpa)与热时,tr3类细胞表现出协同set激活。这种增强的set活性被已知终止早期dna合成的蛋白酶体抑制剂和拓扑异构酶i毒剂终止。相比之下,冷调节的set表现出不依赖于tr类别的响应,使得针对tpaset激动剂的全部set响应在6小时时相等。这些结果证明,热刺激s期进程和g2/m检查点的启动,而冷延缓了set核糖体激活和/或细胞向g2的进程。
(c)在用cap依赖性翻译抑制剂处理的细胞中检测和确定set核糖体响应
在分裂间期早期,雷帕霉素的哺乳动物靶标(mtor)激酶是多蛋白mtor复合物1的组分。在g0/g1cap依赖性翻译起始中,mtorc1从未直接结合核糖体,但是通过酶法激活调节蛋白,所述调节蛋白增强5'mrnacap结构上的40s亚基组装并诱导核糖体扫描相邻的orf。相比之下,在g2/m期间,形成mtor复合物2,其包含必须结合80s核糖体以激活mtor激酶的独特的辅助蛋白组。该独特的蛋白复合物改变80s核糖体功能,使得g2/m核糖体-mtorc2杂合体能够选择性地翻译trmrna(set核糖体)。
翻译调节途径可通过它们对mtor激酶抑制的敏感性进行区分。低剂量的雷帕霉素——一种大环内酯类抗生素——将结合mtorc1中的fkbp12蛋白,下调g1期cap依赖性核糖体活性,并诱导g1/s检查点。对于mtorc2,辅助蛋白的改变使mtor激酶对低剂量的雷帕霉素不敏感;然而,该过程对set核糖体的作用仍未确定。将mcf7tr细胞组的选择成员放置在96孔微孔板中并进行处理,如细胞计数剂量依赖性修饰剂方案所述。测试雷帕霉素浓度改变参考标准响应的能力,所述参考标准响应由100nμtpa/500nm紫杉醇结合物产生。以1nm至1μm浓度的剂量范围施用雷帕霉素。在完全生长培养基中制备全部稀释物。如所述将细胞孵育6小时,进行处理,并测定荧光素酶活性。
如图4所示,mcf7细胞通过激活set核糖体响应于低剂量的雷帕霉素(1nm-50nm)。在抑制mtorc2激酶的剂量下(>50nm),set的大小降低但是并未被消除。这些结果表明,set核糖体不是由标准g1翻译抑制剂调节。
(d)在用dna复制毒素处理的细胞中确定set核糖体响应
将mcf7和hek293tr细胞组的选择成员放置在96孔微滴定板中以对氯化钴和托泊替康进行细胞计数剂量依赖性和/或剂量依赖性修饰剂(测试改变由100nμtpa产生的set激动剂响应的能力)方案。氯化钴的剂量范围为2μm至2mm。托泊替康剂量范围为2nm至25μμ。将每个测试剂量(在完全生长培养基中制备)与合适的参考标准试剂混合并施用于细胞6小时,对样品进行处理,并且如所述测定荧光素酶活性。
在环境中普遍存在的金属在涉及采矿、工业、医学或农业过程中的长期职业性暴露的应用中被认为是危害人类健康。在哺乳动物中,金属如可溶性钴(ii)盐可导致剂量依赖性急性毒性、dna损伤、增加的突变频率和染色体畸变。在低至50μμ–100μμ的剂量下,培养的细胞可表现出s期缺陷,例如dna链断裂和解旋。如图5a和5b所示,将固定剂量的tr标准试剂(set激动剂和/或拮抗剂)与增加浓度的氯化钴(ii)混合以测试set的组合增加或降低。在低剂量(2μμ-50μμ)下,钴(ii)对set没有作用;然而,>50μμ的剂量能够抑制紫杉醇对set核糖体的激活(ic50为约200μμ)。相比之下,用tpa处理的细胞需要剂量>200μμ以抑制set活性(ic50为约1mm)。这些结果确定,由环境毒素产生的dna损伤能够抑制g2进程,并且set核糖体激活可表现出药物特异性调节。
真核dna拓扑异构酶i(topoi)是使在转录和复制过程中产生的dna超螺旋松弛的酶。topoi通过形成共价的酶-dna复合物来调节dna松弛,所述复合物刺激产生瞬间单链断裂,其可围绕完整的dna链旋转。在dna解旋之后,topoi-dna共价键倒转,游离的dna末端被重新连接。多种药物(例如喜树碱、托泊替康和伊立替康)已被证明会通过稳定酶-dna复合物和阻止dna连接来干扰此过程。在低剂量时,这些药物诱导单链断裂,其刺激细胞周期进程到g2/m检查点。相比之下,更高的浓度产生足量的受限的topoi-dna复合物,使得复制叉碰撞导致双链dna断裂、细胞衰老和死亡。如图6a所示,用托泊替康处理的mcf7tr细胞组的选择成员表现出剂量依赖性set激动剂活性(2-100nμ,10nm时产生最大set响应),在更高浓度下(100nμ-10μμ,ic100>5μμ)转变为set拮抗剂响应。类似地,图6b示出了用固定剂量的tpa和可变的托泊替康剂量处理hek2933类细胞系产生类似的双阶段set响应特征。在图6a-6b中,托泊替康对cmvcap依赖性核糖体没有可检测的作用。图6c将托泊替康特异性set响应与已知的细胞/动物响应和毒性相关联。特别重要的是,观察到从set激动剂活性转变到拮抗剂活性的剂量与人临床剂量和最大耐受剂量相关。set拮抗剂剂量诱导dna损伤、自发地杀死小鼠并终止细胞周期。这些结果表明,tr细胞系通过快速增加set核糖体活性而响应于中度dna损伤(例如单链断裂)和g2细胞周期进程。相比之下,能够导致严重dna损伤(双链断裂)的试剂促进s期早期检查点,其阻止了set核糖体激活。
(e)确定在tr3类异常细胞系中独特特性的体外生长测定
显然,set核糖体响应的大小与合成修复细胞损伤和细胞周期进程所需的s晚期和g2/m特异性蛋白的能力的增加有关。基于csc模型,这些特征通常与药物和应激抗性肿瘤细胞有关。如果tr3类异常细胞系是tr转移癌细胞模型的候选物,这些细胞必须表现出与转移潜能一致的生长特征。该实施例使用粘附生长和非粘附生长测定来检验增强的体外生长能力和进化并产生更多分化子代的能力。
第一个测定使用重复的集落形成方案以检验单细胞中增强的铺板率。在该测试中,在指数生长培养物中确认了来自mcf7、hek293和hct116tr细胞组的推定3类异常,并且将250-500个细胞铺板至两个100mm组织培养皿中(corning,细胞培养物处理的)。如之前所述,在g418选择性培养基中形成集落。将集落收集到单个池中,转移至单个t75烧瓶,用于原种保存,并重复进行亚克隆至少3个循环。基于倍数诱导,从最低至最高对细胞响应进行排序,并以排序相对于倍数诱导作图。
在第二个测试中,在指数生长培养物中确认了来自mcf7、hek293和hct116tr细胞组的推定3类异常,并且将10000个细胞转移至两个100mm组织培养皿中(fisherbrand聚苯乙烯有盖培养皿),所述培养皿未用细胞培养物处理。通过在完全培养基中传代1周,使细胞聚集并适应非粘附生长。手动破坏细胞聚集物,使其成为单细胞,并将其转移至新的有盖培养皿。对于早期培养物来说,在细胞聚集物中包含许多死细胞并非异常。因为这些细胞不会粘附于新鲜的细胞聚集物,通过使活细胞块沉淀(settle)并重复更换培养基将这些细胞除去。显微镜检查用于验证细胞存活力、生长率(细胞块大小),以及确定培养物是否包含小细胞球。在作为非粘附培养物2周之后,通过使用台盼蓝来测定活细胞数量并且将100-200个活细胞铺板在具有完全培养基的新的有盖培养皿中,来测量形成肿瘤球的能力。本质上,选择形成非粘附细胞集落的能力。将培养皿小心转移到孵育器中并生长>5天。显微镜检查用于鉴定包含小肿瘤球的培养物(图7b)。该研究确定了非粘附生长与肿瘤细胞类型而非tr类别响应相关。例如,hct116tr细胞组中的大多数分离物证明了非粘附生长的能力(表4)。将细胞池转移至标准组织培养皿并且适应非粘附生长至少2个传代,然后测量set响应。
如图7a所示,从进行集落形成方案的hek293tr3类异常细胞系分离的亚克隆表现出克隆进化(由单细胞克隆表现出的细胞生长的改变),这在本研究中通过与亲代tr细胞组克隆相比减少或增加的set响应来例证。特别地,集落形成能够选择新的异常亚克隆,其与其他亚克隆相比具有显著更高的tr测定响应。类似地,测试由hct116tr类别组(其包含许多tr3类异常克隆)产生的tr测定响应,在非粘附生长4周之后确定,仅有推定的tr转移癌细胞模型表现出set响应的显著增加(mtrdm-fluc#25、#28和#75,表4)。这些结果与tr3类异常细胞系通过改变其set大小而响应于应激生长条件的能力一致,其产生增强的抗性和存活力。这些特征与转移肿瘤细胞的预期响应一致,并支持以下概念:tr3类异常亚克隆能够适应生长应激并改变亲代set响应,从而产生具有升高的set活性的新的异常细胞。本发明人将这些候选细胞称为4类细胞,其仅需要特定的体内肿瘤特征以成为公认的tr转移癌细胞模型。
实施例2
2a.确定hct116tr转移癌细胞模型在裸小鼠的连续移植过程中表现出肿瘤启动活性
(a)植入来自tr转移肿瘤细胞模型和hct116亲代细胞的细胞和肿瘤碎片
在实验第1天,获自charlesriver实验室的雌性小鼠(crl:nu-foxn1nu)为7周龄。随意向小鼠喂食经辐射的啮齿类动物饮食5053(labdiet)和水。将小鼠圈养在生物泡洁净室内具有bed-o'cobs寝具(bedding)的固定的笼中,所述生物泡洁净室以100次完全换气/小时向泡环境中提供hepa过滤的空气。控制环境的温度范围在70°±2°f,湿度范围30-70%。
在37℃下,5%co2气氛中,使用rpmi1640培养基来扩增hct116亲代细胞和4类hct116htrdm-fluc#32细胞系,所述培养基用l-谷氨酰胺(cellgro)改良,补充10%胎牛血清、1%青霉素-链霉素-谷氨酰胺、1%丙酮酸钠和25mmhepes。植入之前,收集每种细胞类型,将其混合,并使用台盼蓝排除测定来测定活细胞数。在4℃、1500rpm(300xg)下离心细胞悬浮液5分钟。
制备hct116和hct116htrdm-fluc#32细胞的25×106个细胞/ml悬浮液(无血清rpmi),并且在第0天使用27-规格(gauge)针头将5×106个细胞/小鼠(0.2ml)经皮下植入到20只小鼠中(每个测试组10只动物)。将每个细胞悬浮液保持在潮湿的冰上以使细胞存活力的损失最小,并且频繁倒置以保持均一的细胞悬浮液。在植入后第21天(肿瘤平均大小750mg),对动物施行安乐死,收集肿瘤并切成30至60mg碎片(平均大小45mg)。使用12-规格套管针头,将来自hct116亲代和htrdm-fluc#32肿瘤的大块经皮下和双侧(第0天)植入到12只裸小鼠中(每个测试组6只动物)。在第22天,当每个组中的一个肿瘤长到>2g时,将动物处死。
至少每天一次地观察全部小鼠的临床征象。记录体重和肿瘤测量值,每周两次。使用长椭球体(假设均匀密度(unitdensity))的体积公式,从卡尺测量值来估算肿瘤负荷(mg):肿瘤负荷(mg)=(l×w2)/2,其中l和w是各个正交的肿瘤长度和宽度测量值(mm)。全部治疗、体重测定值和肿瘤测定值都在泡环境中进行。
(b)植入培养的细胞和肿瘤碎片的小鼠中的连续肿瘤生长
植入亲代hct116细胞系的10只测试动物中的9只产生肿瘤。肿瘤在17天中达到平均大小650mg(肿瘤体积加倍的时间为5.8天)。全部10只植入htrdm-fluc#32细胞的动物均产生肿瘤,其在17.4天中达到平均大小650mg(肿瘤体积加倍的时间为6.5天)。在两组中,小鼠表现出最小的重量减轻并且无自发性消退。如表5所示,肿瘤碎片生长是高度可变的。尽管每个肿瘤均在21天中表现出正的(positive)大小增加(与htrdm-fluc#32大小增加4x-30x相比,hct116大小增加3.2x-47.5x),但是肿瘤大小的分布不是随机的。在两组中,前4位肿瘤大小在统计学上大于其余的8个肿瘤;然而,大尺寸的排序分布倾向于htrdm-fluc#32肿瘤,12个该肿瘤中的6个超过600mg,相比之下,12个hct116亲代肿瘤中的4个超过600mg。这些结果表明,htrdm-fluc#32细胞系表现出连续的体内肿瘤启动活性,并且还支持增强的肿瘤生长率。
2b.推定的tr转移癌细胞肿瘤的非侵入式成像显示出tr表达盒的受调节的翻译
(a)从tr转移肿瘤细胞模型和hct116亲代细胞产生肿瘤
从charlesriver实验室(crl:nu-foxn1nu)或harlan实验室(hsd:无胸腺nude-fox1nu)获得雌性小鼠,其在研究第1天为6-7周龄。随意向小鼠喂食经辐射的啮齿类动物饮食5053(labdiet)和水,将小鼠圈养在生物泡洁净室内具有bed-o'cobs寝具(bedding)的固定的笼中,所述生物泡洁净室以100次完全换气/小时向泡环境中提供h.e.p.a过滤的空气。全部治疗、体重测定和肿瘤测量在泡环境下进行。控制环境的温度范围在70°±2°f,湿度范围30-70%。至少每天一次地观察全部小鼠的临床征象。对肿瘤超过2g、具有溃疡性肿瘤、处于明显痛苦或处于濒死状况的小鼠施行安乐死。
在37℃下,5%co2气氛中,将hct116亲代和hct116htrdm-fluc#32细胞在rpmi1640培养基中生长,所述培养基补充10%(热灭活的)胎牛血清、1%青霉素-链霉素-谷氨酰胺、25mmhepes和1%丙酮酸钠。在使用台盼蓝排除测定来测定细胞活力之后,收集并混合细胞以进行植入。离心细胞悬浮液,并在50%无血清rpmi和50%matrigel中制备50×106个细胞/ml悬浮液。给共计29只小鼠经皮下植入(第0天)5×106个细胞/小鼠hct116htrdm-fluc#32细胞(组1、2和3),并且给29只小鼠植入了hct116亲代细胞(组4、5和6)。在第8天,当所有组的平均估计肿瘤质量为125mg(组平均值的范围为119-129mg)时,开始治疗(将动物分成3组,每组6只动物)。治疗开始时所有小鼠的重量>19.2g。在第一次治疗时平均组体重是良好匹配的(组平均值范围22.4-23.5g)。根据治疗当天小鼠个体的体重,对所有小鼠进行给药(0.2ml/20g)。为了重复非侵入式成像研究,将其余hct116htrdm-fluc#32动物分成3组,每组包含3只动物(平均肿瘤重量约500mg)。
(b)包含tr转移肿瘤细胞模型的肿瘤的生物发光成像结果
如图8a-8d和表6所示,在治疗之前和治疗后6小时,获取hct116htrdm-fluc#32肿瘤表达的tr报告蛋白(fluc)活性的生物发光图像。组#1用cremophorel(0.5mg/kg/天)治疗。组#2用cremophorel(0.5mg/kg/天)、紫杉醇(20mg/kg/天)治疗。组#3用环磷酰胺(120mg/kg/天)治疗。使用获自molecularimagingproductscompany(mip)的d-荧光素粉来检测fluc酶。将盐水加到荧光素粉中以产生15mg/ml悬浮液。将所述悬浮液涡旋约1分钟以产生澄清的黄色溶液。在每次生物发光成像期间之前立即制备d-荧光素,并且在使用过程中将其贮存在湿冰上。使用ivis50光学成像系统(xenogen,alameda,ca)进行体内生物发光成像。在2%异氟醚气体麻醉下对动物进行成像(每次3只动物)。将每只小鼠经腹膜内(ip)注射150mg/kg荧光素,并在注射后10分钟进行成像(使肿瘤面对照相机)。使用ccd芯片的大的像素合并(binning)并且调节暴露时间(5秒至5分钟)以从肿瘤获得至少几百计数并且避免ccd芯片的饱和。使用livingimage(xenogen,alameda,ca)软件分析图像,并且手动圈出每个独特的信号并且通过组和小鼠编号标记。
图8a-8d和表6表明,由未治疗的hct116htrdm-fluc#32肿瘤表达的生物发光水平是高度可变的(范围为0.2×106至60×106光子/秒)。然而,肿瘤响应当分成两类,最低的预处理表达水平范围为0.2×106-1.2×106光子/秒,最高跨度为13.2×106-60.4×106光子/秒(最大的低的预处理响应的10倍以上)。尽管低的预处理肿瘤在治疗之后表现出高度显著的set增加(相对于未治疗的肿瘤,在治疗的肿瘤中增加10,540%-46,600%),表达更高水平的肿瘤不能够诱导显著的set活性(70.7%-381.8%)。为了排除这些响应是在预处理测量之后6小时时由残留的荧光素产生的可能性,在预处理之后24小时,对单独的一组负瘤动物进行成像(表6)。对于这些更大的肿瘤(平均肿瘤大小约500mg),组#2中仅1个肿瘤表现出低内源表达水平(0.5×106光子/秒),但是它产生预期的set增加(20,500%诱导)。这些结果表明,在hct116htrdm-fluc#32肿瘤中set可被紫杉醇/cremophorel激活,产生与体外tr3类异常活性一致的体内响应。第二,预处理set活性的存在表明,在有丝分裂细胞中小肿瘤形态产生意料不到的应激响应(之前未知的g2相关细胞周期检查点),其在肿瘤生长期间变得更为常见。此外,在每个治疗组中可诱导的肿瘤响应的存在表明,tr表达盒的set响应于每个药物/载体制剂中的一些化合物。特别值得注意的是,由cremophorel(通常用于将紫杉醇溶解于水溶液中的赋形剂)产生的大set诱导。
2c.在tr转移癌细胞模型肿瘤中意料不到的肿瘤依赖性和set依赖性耐药性
(a)药物制剂和动物治疗
测试组#1和#4是用载体对照(cremophorel0.5mg/kg/天;q2dx5)治疗,组#2和#5是用紫杉醇/cremophorel(分别为20mg/kg/天和0.5mg/kg/天;q2dx5)治疗,组#3和#6是用环磷酰胺(120mg/kg/天,q4dx3)治疗。每种药物(0.2ml/动物)均是经静脉内(iv)递送而递送。载体对照包含12.5%乙醇、12.5%cremophorel和75%盐水。从hauserpharmaceuticalservices获得干燥黄色粉末状的试剂级紫杉醇,在室温下避光保存。在治疗的每一天,将所述化合物溶解于无水乙醇(最终体积的12.5%)中,随后依次添加cremophorel(最终体积的12.5%)和盐水(最终体积的75%),在每次添加后充分混合。所得溶液是澄清和无色的。从mckessenspecialtyproducts获得白色粉末状的环磷酰胺,并在每次治疗前将其新鲜溶解于盐水中以产生澄清、无色溶液,ph为4.0。
至少每天一次地观察所有小鼠的临床征象。在治疗的每一天时及其后至少每周两次对小鼠进行称重。每周两次记录肿瘤测量值,持续63天。使用之前所述的公式,从卡尺测量值估算肿瘤负荷(mg)。对肿瘤负荷超过2g或具有溃疡性肿瘤的小鼠实施安乐死,同样对发现处于明显痛苦或处于濒死状况的小鼠实施安乐死。对于每个动物组,将单独的肿瘤重量相对于时间作图(图9a)。使用kaplan-meier图来评估动物存活,其中动物数量(%存活)相对于试验天数(时间)作图,并且提供了每个治疗组的存活函数(survialfunction)的估算值(图9b)。
(b)在tr转移肿瘤细胞模型肿瘤中意料不到的耐药活性
所有治疗在第8天,当平均肿瘤为125mg且平均动物重量为19.2g(范围22.4-23.5g)时开始。尽管在第8天载体组#1和#4中肿瘤大小没有差异,早在第11天就在htrdm-fluc#32动物中检测到统计学上显著的肿瘤增加(p=0.043),并且持续到第22天(p=0.0093)。在第25天的动物处死(组#1中,6只动物中的3只因肿瘤负荷而被处死,相比之下,组#4的6只动物中没有被处死)阻止了进一步的肿瘤比较。相比之下,组#2和#6中的肿瘤仅在第11天表现出显著的大小差异(p=0.023),这表明随后的环磷酰胺治疗在剩余的研究期间抑制了肿瘤生长。这些结果表明,htrdm-fluc#32肿瘤表现出增强的体内生长。
尽管组#2和#5确定了每个细胞系中紫杉醇/cremophorel功效,仍存在显著的个体肿瘤差异。作为一组,htrdm-fluc#32肿瘤(组#2)达到750mg的平均时间>63天(肿瘤生长延迟>48.7天),相比之下,hct116亲代肿瘤为50.4天(生长延迟为33.7天)。然而,如图9a所示,对紫杉醇/cremophorel敏感的3个肿瘤也表现出低的预处理set活性、显著的治疗后set诱导、最小的肿瘤消退和对化学疗法的高度抗性(导致在第29-36天之间的肿瘤再生长)。相比之下,高的预处理set肿瘤对紫杉醇/cremophorel特别敏感,并且表现出最小的再生长潜能。
图9b的存活图示出了对htrdm-fluc#32肿瘤的增强的生长率的其他支持。例如,在第29天最后一只组#1动物因肿瘤负荷而被处死(存活平均值为24天),相比之下,在第43天最后一只组#4动物因肿瘤负荷而被处死(存活平均值为29天)。尽管组#3和#6中的肿瘤大小和存活平均值没有显著改变,组#3中的最后一只动物在第39天因肿瘤负荷而被处死,相比于组#6的第43天。因为在组#2和#5中紫杉醇/cremophorel降低肿瘤再生长,因肿瘤负荷的动物处死减少;然而,两只htrdm-fluc#32动物被处死的时间显著早于hct116动物(第50和57天,相比于第57和62天)。这种细胞系依赖性的动物存活减少,以及增强的肿瘤生长率,证明htrdm-fluc#32肿瘤比hct116亲代细胞生长得更快。此外,6个htrdm-fluc#32肿瘤中的4个在紫杉醇/cremophorel治疗之后能够再生长,表明这些肿瘤表现出体内耐药性,其与在体外观察到的tr3类响应一致。因此,htrdm-fluc#32细胞系表现出每一种与trhct116csc相关的特性,因此代表了tr转移癌细胞模型的可行实例。迄今为止,15个候选3类异常细胞系已在6种表现出4类药物和应激抗性的癌细胞类型中被鉴定(hct116mtrdm-fluc#25、#28、#75和htrdm-fluc#32、#69、#122;mcf-7mtrplp-fluc#118和mtrdm-fluc#111、#217;hepg2htrdm-fluc#16;hek293htrdm-fluc#122和htrdm-gluc#79;du145htrdm-fluc#27和mtrdm-fluc#194;ht1080mtrdm-fluc#99、#122)。在该组中,hct116mtrdm-fluc#75和htrdm-fluc#32完成了全部体外研究,并且选择htrdm-fluc#32细胞系,用于本实施例中所述的体内肿瘤验证。
实施例3
3a.检查由set激动剂和拮抗剂产生的体外翻译活性
(a)由体内set激动剂产生的意料不到的基于细胞的set响应
如表6的组#1所示,在具有低set活性的预处理肿瘤中,cremophorel的静脉内递送(0.5mg/kg/天)产生显著的set激活。作为非离子型表面活性剂,cremophorel通常用于溶解疏水性药物,但是它也已被证明产生多种体内副作用。考虑到肿瘤set响应的激活模式和大小与基于细胞的set测定一致,将细胞计数剂量响应测定用于检查cremophorel诱导体外set的能力。如图10a所示,cremophorel(剂量范围2.5mg/ml至100mg/ml)降低了cmv细胞系中fluc表达,证明cremophorel抑制cap依赖性翻译。出乎意料的是,在任何剂量下hek293mtrdm-fluc#12(tr3类)和mtrdm-fluc#122(tr4类)的6小时处理均未产生显著的set增加。仅有孵育24小时的细胞在10mg/ml下表现出适度的160%set增加。这些结果表明,cremophorel产生细胞类型特异性有丝分裂作用。因为低剂量的cremophorel能够使细胞周期进程终止在s期,似乎cremophorel在培养的细胞中抑制g1cap依赖性翻译,但是没有诱导有丝分裂和set激活。相比之下,肿瘤通过进入g2并且激活set核糖体而响应于cremophorel,这表明细胞培养系统不能有效地模仿(model)体内肿瘤响应。
(b)检查通过核糖体结合翻译抑制剂产生的set拮抗剂活性
如表3所示,已鉴定许多set拮抗剂。然而,这些试剂中的大多数只是使细胞周期进程终止在s期,其阻止了g2set核糖体的激活。为了重复由药物敏感性肿瘤表达的预处理set,治疗剂必须激活g2进程,但是也阻断g2翻译以阻止负责细胞恢复的set超诱导。图10b示出了细胞计数剂量依赖性修饰剂测定结果,其检查了与一组直接结合于set核糖体的翻译抑制剂相关的set拮抗剂活性。为了测定ic100剂量(对set核糖体活性产生立即和完全抑制的药物的量),用100nμtpa(set激动剂)和不同浓度的翻译抑制剂茴香霉素、依米丁、放线菌酮和嘌呤霉素(剂量范围10nm至25μμ)的结合物来处理tr3类细胞he293htrdm-fluc#13和mtrdm-fluc#45。根据已报道的萤火虫荧光素酶的半衰期,ic100处理必须完全终止全部set(阻断set激动剂响应并使fluc活性显著降低至未处理的对照样品中活性的约85%)。因此,set阻断剂量终止set激动剂诱导,但是表现出残留的翻译活性(95-150%fluc活性),ic100浓度终止全部set活性,并且任何产生<85%活性的处理均可能影响蛋白质合成和降解。
如图10b所示,每种药物都能够阻断set激动剂活性;然而,set阻断和ic100剂量表现出药物特异性变化。例如,set激动剂诱导可被250nm-500nm茴香霉素、1μμ-2.5μμ依米丁、2.5μμ-5μμ放线菌酮和10μμ-25μμ嘌呤霉素终止。如所预期的,每种药物的ic100剂量增加到500nμ-1μμ(茴香霉素)、2.5-10μμ(依米丁)、>10μμ(放线菌酮)和>25μμ(嘌呤霉素)。因此,茴香霉素显示出最低的set阻断和ic100剂量,接着分别是依米丁、放线菌酮和嘌呤霉素。
b.测试口服set复方药物的安全性和功效(动物研究1)
(a)制备和在含有tr转移癌细胞模型肿瘤的裸小鼠中测试set复方药物制剂
给共计45只小鼠植入hct116mtrdm-fluc#32细胞并分成5组(每组8只动物)。所有的治疗在第7天开始,此时平均肿瘤重量为125mg(组平均值范围152-169mg)。在治疗开始时,全部小鼠重量平均值≥18.6g(组平均值范围20.5-22.4g)。全部小鼠经口服给药,每天施用治疗,持续18天。在治疗时和至少每周两次对小鼠进行称重,对于总体重降低到治疗第一天时其初始重量20%以下的小鼠实施安乐死。如之前所述估算肿瘤负荷(mg),将肿瘤超过2g的小鼠处死,切除肿瘤,快速冷冻于液氮中并贮存在-80℃,用于组织病理学和免疫染色分析。每周两次记录体重和肿瘤测量值,持续70天。
将每组中的组平均肿瘤重量以及个体肿瘤重量相对于时间作图,以确定治疗对肿瘤生长和消退的作用。在任意给定日测量的个体动物体重通过减去当天的肿瘤重量并转化为治疗第一天测量的初始体重的百分数而归一化。将归一化的重量相对于时间作图以评估治疗的作用。使用kaplan-meier图来评估动物存活,其中动物数量(%存活)相对于试验天数(时间)作图,并且提供了每个治疗组的存活函数的估算值。
(b)由set复方药物产生的高度显著的tr转移癌细胞模型肿瘤响应
如表7所示,将多种药物制剂给予共计40只小鼠(包含hct116mtrdm-fluc#32肿瘤),所述小鼠被分成5个测试组,每组8只动物。每种set复方药物均包含set激动剂、set拮抗剂和细胞毒性s期毒素。对于该研究(被称为第一异基因动物研究),细胞毒性s期毒素为卡培他滨(用于治疗转移性结肠癌的一线治疗剂)。尽管500mg/kg/天卡培他滨(治疗18天)等于标准人剂量的78%,该高剂量将产生小鼠毒性。本研究所选择的set激动剂是cremophorel(0.5mg/kg/天),该剂量之前被证明可激活体内set。考虑到在鱼和大鼠中cremophorel的ld50为450-6400mg/kg,测试剂量比毒性浓度低>900x。本研究所选择的set拮抗剂为茴香霉素,其表现出最低的set阻断和ic100剂量。如所述的,使用250nm-500nm茴香霉素(等价口服剂量为0.000027mg/kg/天),在基于细胞的测定中观察到set阻断活性,并且ic100为500nm-lμm(等价口服剂量为0.000054mg/kg/天)。考虑到茴香霉素的小鼠ld50为75-200mg/kg,ic100剂量比毒性浓度低>14,000x。组#1用10%乙醇、10%cremophorel(0.5mg/kg/天)和80%盐水的溶液治疗;组#2用500mg/kg/天卡培他滨治疗;组#3用0.5mg/kg/天cremophorel和0.000054mg/kg/天茴香霉素治疗;组#4(低剂量茴香霉素)用cremophorel、卡培他滨和0.000027mg/kg/天茴香霉素治疗;组#5(高剂量茴香霉素)用cremophorel、卡培他滨和0.000054mg/kg/天茴香霉素治疗。
如图11a和表8所示,与用卡培他滨(组#2;53.2%消退)或低剂量茴香霉素set复方药物(组#4;45.3%)治疗的动物相比,ic100或高剂量茴香霉素set复方药物产生高度显著的肿瘤消退(组#5;平均73.7%肿瘤大小消退)。如图11b所示,用卡培他滨或低剂量茴香霉素set复方药物治疗的动物立即抑制了肿瘤生长,但是在停止治疗的2周内,在所有肿瘤中再生长明显。相比之下,图11c示出了,在70天,高剂量茴香霉素set复方药物使6个肿瘤中的4个具有不显著的肿瘤再生长,并且6个肿瘤中的3个没有验尸肿瘤。
如图13中所详述的,只有在用高剂量茴香霉素set复方药物治疗的动物中显著的存活增加是明显的。组#1(28天)、组#2(24天)和组#3(28天)的存活平均值没有显著不同。相比之下,与组#5相比(>70天),组#4中因重量减轻而被处死的动物降低了存活平均值(15天)。这些结果共同表明,与高剂量茴香霉素set复方药物(其与高剂量卡培他滨结合时是非常有效的)相比,低剂量set复方药物未产生正的肿瘤或存活响应。
(c)由set复方药物产生的可逆的动物重量减轻
如图12a、12b和表9所示,set复方药物产生不同的动物重量减轻模式。出乎意料地,组#3中的set药物组分在早期药物治疗中(第10天)产生适度的重量增加,这在后期并不明显。如所预期的,组#2中的毒性卡培他滨治疗到第24天产生1例自发死亡和4例重量减轻处死(>20%重量减轻),但是存活的动物的重量在整个试验中没有显著增加或减少(图12b)。如图12a所示,用两种set复方药物治疗的动物分成2个动物组,一组显示出显著的重量减轻,第二组与对照动物没有显著差异。对于显著的重量减轻组中的许多动物而言,重量减轻超过20%并且动物被处死(表9;组#4,到第15天,8只动物中的5只;组#5,到第24天,8只动物中的2只)。相比之下,在治疗结束之前(第25天),存活的动物开始快速恢复损失的重量并且到第31至38天表现出统计学上显著的重量增加(表9)。尽管这种重量增加与最大肿瘤消退相关(图11c),与组#5相比,组#2和#4中在药物治疗结束之前的重量增加和重量依赖性动物处死的显著差异是出乎意料的。该结果表明,set药物组分提供了保护性作用,其减小了高剂量卡培他滨的毒性。
(d)set复方药物产生的意料不到的免疫响应
图17a-17j和表12示出了对用set复方药物治疗的htrdm-fluc#32肿瘤的免疫染色研究。从因重量减轻而被处死的动物(组#2,动物#1,第24天,以及动物#7,第22天;组#4,动物#5,第18天;组#5,动物#2,第24天,以及动物#8,第22天)切除肿瘤,快速冷冻,固定在pbs缓冲的4%多聚甲醛中,切成3μm冷冻切片,固定到载玻片上,并用荧光标记和未标记的抗体混合物染色以检测巨噬细胞标记物蛋白(生物素标记的抗小鼠mhc类别ii分子ia/ie、alexa-647标记的抗小鼠cd11b/mac-1、alexa-488标记的抗小鼠f4/80和alexa-647标记的抗小鼠cd68)和tr报告蛋白(抗萤火虫荧光素酶)。为了检测未标记的一级抗体,使用alexa-555标记的二级抗体或pe标记的链霉亲和素。使用dapi染料的核dna染色用于检测活的肿瘤细胞。为载玻片拍照(nikon90ieclipse)并使用niselements3.2或imagej软件来分析图像。
将图17a的核染色与图17b的g2特异性fluc表达相关联(组#2,动物#1肿瘤,其用卡培他滨治疗16小时),确认了卡培他滨在一窄条的外周有丝分裂细胞(图17b的白色箭头,被称为层1)中诱导g2/m检查点并激活set核糖体翻译(fluc表达)。通过对从肿瘤表面延伸出的连续细胞核数量进行计数,显示出层1的平均厚度为3.4个细胞(表12)。出乎意料的是,层1细胞表现出最少的巨噬细胞表位染色,但是其边缘的内细胞层(称为层2)包含高浓度的f4/80染色的巨噬细胞(厚度为6.4个细胞)。该层的f4/80+巨噬细胞的其他免疫或fluc蛋白未被染色,并且所述巨噬细胞似乎被包含在肿瘤有丝分裂细胞层(厚度为9.8个细胞)之中并且确定了与肿瘤有丝分裂细胞层的边界。个体f4/80+细胞穿透肿瘤的平均深度为16.6个细胞(称为层3)。免疫染色的细胞延伸到肿瘤中的总深度为26.4个细胞。尽管层2/3的边界包含适度数量的fluc阳性细胞体,在层3和坏死核(具有最少的核dapi染色的死细胞)之间观察到最少的染色。在从已被治疗14天的组2#动物#7处理的第二肿瘤中中观察到相同的肿瘤和免疫细胞响应。这些结果与卡培他滨的作用模式、预期的实体瘤的多层结构和濒死细胞对f4/80+先天免疫细胞的特定亚类的激活一致。
图17c和17d示出了用低剂量的茴香霉素set复方药物治疗10天的来自组#4动物#5的肿瘤。在该肿瘤中,set复方药物在从层3延伸到坏死核的肿瘤细胞中激活均一的、g2特异性fluc表达(白色箭头,图17d)。在图17c中,通过无fluc抗原染色的亮的小细胞核来证明层2巨噬细胞。不同于卡培他滨肿瘤,大多数层2免疫细胞表现出对cd68标记物蛋白(cd68+f4/80-)的选择性染色,以及一小部分f4/80被共染色或轻度染色的巨噬细胞(cd68+f4/80-)。此外,cd68+f4/80-免疫细胞穿透整个肿瘤,包括坏死核。因为组4的肿瘤未表现出显著的肿瘤响应或提高的动物存活,这些结果表明,set激动剂在整个肿瘤中刺激g2特异性set(迫使非有丝分裂细胞重新进入细胞周期)并激活独特的cd68+f4/80-巨噬细胞亚型。
图17e-17f和表12示出了从组#5动物#2分离的肿瘤,所述动物用高剂量茴香霉素set复方药物治疗16天。图17f证实了层1中存在的fluc报告蛋白的g2特异性翻译(白色箭头);然而,层1的平均厚度显著增加至7.8个细胞(层1厚度,p=0.008,表12)。此外,该层是高度混乱的并且包含定位至肿瘤边缘的小亚细胞fluc+胞体。显著的是,除了在坏死核中的细胞,内部肿瘤细胞未表现出显著的fluc染色。在层2(平均厚度为7.8个细胞)和层3(平均厚度为18.6个细胞)中也观察到类似的大小增加。组#5免疫反应性细胞层的总深度为15.6个细胞(大小增加>50%)。如在早期set药物肿瘤中,大多数巨噬细胞为cd68+f4/80-并且已穿透到坏死核。这些结果证实了高剂量茴香霉素set复方药物的以下能力:增强凋亡性细胞死亡(在濒死有丝分裂细胞附近出现小fluc+胞体),以及诱导侵入式cd68+f4/80-巨噬细胞响应,同时还减少非有丝分裂细胞中g2特异性翻译。
图17g和17h示出了从组#5动物#8分离的肿瘤,所述动物用高剂量茴香霉素set复方药物治疗14天。图17g示出了从邻近的坏死层(可检测的dapi染色的细胞核)跨越到坏死核(最少的dapi染色)中的肿瘤切片产生的dapi染色。图17h证明该切片包含高密度的fluc+胞体,其定位于包含不可检测的dapi染色的细胞(图17g和17h中的白色箭头)。出乎意料的是,该数据表明,高剂量茴香霉素set复方药物刺激细胞周期进程并在肿瘤中心增强细胞死亡(在推测死亡的细胞中意料不到的高代谢活性)。
图17i-17j表示来自组#5动物#8的肿瘤,以及使用imagej软件,对肿瘤内部的fluc+荧光进行定量。通过在图17i上绘制15个框(35×695像素,0.64um/px)并测量每个695像素的荧光密度而产生荧光密度图。将最暗的坏死细胞层像素调节到100%背景并将每个像素的总荧光与背景进行比较(图17j)。该密度图示出了,与邻近的dapi+细胞相比,在具有最小dapi染色的细胞中fluc染色强度增加约600%。这一结果与以下事实一致:在通常被认为是非有丝分裂并且无代谢活性的细胞中g2特异性凋亡性细胞死亡的非常显著且选择性的增加。
3b.测试口服set复方药物的安全性和功效(动物研究2)
(a)制备和在含有tr转移癌细胞模型肿瘤的裸小鼠中测试set复方药物制剂
给共计45只小鼠植入hct116mtrdm-fluc#32细胞并分成5组(每组8只动物)。对于该研究(称为第二异基因动物研究),卡培他滨的浓度降低至400mg/kg/天卡培他滨(治疗10天),其等于标准人剂量的35%。该低剂量治疗应当降低小鼠毒性。该研究中选择的set拮抗剂为茴香霉素和依米丁。如所述的,茴香霉素ic100剂量为500nμ-1μμ(等于0.000054mg/kg/天的口服剂量),依米丁ic100剂量为2.5-10μμ(等于0.00013mg/kg/天的口服剂量)。考虑到依米丁的大鼠ld50为68mg/kg,ic100剂量比最大测试剂量低>5,231x。如表10所示,组#1用载体治疗;组#2用400mg/kg/天卡培他滨治疗;组#3用cremophorel、卡培他滨和ic100浓度的依米丁(0.00013mg/kg/天)治疗;组#4用cremophorel、卡培他滨和0.000054mg/kg/天茴香霉素(高剂量)治疗;组#5用cremophorel、卡培他滨和0.00013mg/kg/天茴香霉素(非常高剂量)治疗。所有治均在第6天开始,此时实验中所有组的平均估计肿瘤质量为125mg(组平均值范围152-172mg)。在治疗开始时全部小鼠重量>16.9g(平均值范围19.9-21.2g)。根据治疗日的个体体重,全部小鼠经口服给药。每天施用治疗,持续10天,然后监测动物共72天。对所有小鼠称重并如上文所述记录肿瘤测量值。当肿瘤负荷>2g时,对小鼠施行安乐死,切除肿瘤,固定在pbs缓冲的4%多聚甲醛中并贮存在4℃。将组平均肿瘤重量以及每组内的个体肿瘤重量相对于时间作图,以确定治疗对肿瘤生长和消退的作用。在任意给定日测量的个体动物体重通过减去当天的肿瘤重量并转化为治疗第一天测量的初始体重的百分数而归一化。将归一化的重量相对于时间作图以评估治疗对总体动物健康的治疗作用。使用kaplan-meier图来评估动物存活,其中动物数量(%存活率)相对于试验天数(时间)作图,并且提供了每个治疗组的存活函数的估算值。
(b)由set复方药物产生的高度显著的tr转移癌细胞模型肿瘤响应
如图14a和表11所示,相对于用卡培他滨治疗的动物(组#2;35.2%肿瘤消退),ic100或高剂量依米丁(组#3;66.4%平均肿瘤消退)、ic100或高剂量茴香霉素(组#4;51.6%肿瘤消退)和非常高剂量的茴香霉素(组#5;46.2%肿瘤消退)set复方药物产生高度显著的肿瘤响应。如图14a所示,包含卡培他滨的药物立即抑制肿瘤生长,但是在停止治疗2周内,在所有组中再生长明显。对组#3中观察到的最大肿瘤消退的详细分析发现,在8只动物中的7只中,个体肿瘤表现出显著的肿瘤消退(图14b)。
如图16中所详述的,与组#1(26天)、组#2(47天)和组#5(21天)相比,在用高剂量依米丁(组#3,存活平均值62天)和茴香霉素set复方药物(组#5;存活平均值54天)治疗的动物中最高存活增加是明显的。这些结果共同表明,高剂量茴香霉素和高剂量依米丁set复方药物在与低剂量卡培他滨结合时是非常有效的。
(c)由set复方药物产生的可逆动物重量减轻
如图15所示,包含400mg/kg/天卡培他滨的药物产生了独特的双阶段重量改变模式。对于每种药物,动物重量在治疗期间降低(6-16天),但是停止治疗之后迅速恢复。对于茴香霉素set复方药物,重量减轻导致许多动物因重量减轻>20%而被处死,并且没有肿瘤再生长;组#4(到第14天,8只动物中的2只)和组#5(到第21天,8只动物中的4只)不同于组#2和组#3的无动物处死。尽管由高剂量依米丁set复方药物产生的平均重量改变在统计学上大于卡培他滨治疗的动物(第12-14天,p=0.02),动物重量迅速恢复并且到第29天表现出统计学上显著的重量增加(p=0.0006)。在动物研究1中,该重量增加与最大肿瘤消退相关(图14b)。这些结果表明,set复方药物制剂增强了卡培他滨诱导的动物重量减轻,并且对于减少因重量减轻>20%而导致的动物处死而言,包含茴香霉素的药物的的效果可能与包含依米丁的药物的效果不同。然而,在停止治疗10天内,每种set复方药物均使动物重量增加,并且在依米丁set复方药物中达到统计学上的显著性。
总之,实施例3证明了茴香霉素和依米丁set复方药物通过杀死肿瘤细胞表面的有丝分裂细胞和坏死核中的非有丝分裂细胞而提高卡培他滨药物作用(图17a-17j),产生广泛的肿瘤消退(表8和11),与高剂量和低剂量卡培他滨结合时显著提高肿瘤响应(图11a和14a),降低/逆转了动物重量改变(图12a和15),以及显著增加了动物存活(图13和16)。
项
项1.药物组合物,包括:set激动剂和set核糖体拮抗剂。
项2.项1的药物组合物,其中所述set激动剂是g2期进程的刺激剂。
项3.项1或2的药物组合物,其中所述set激动剂选自:聚氧乙烯氢化蓖麻油;佛波酯;苔藓抑素;其任一种的可药用的盐;以及其任意两种或更多种的结合物。
项4.项1-3中任一项的药物组合物,其中所述聚氧乙烯氢化蓖麻油选自聚氧乙烯30氢化蓖麻油、聚氧乙烯35氢化蓖麻油、聚氧乙烯40氢化蓖麻油、聚氧乙烯50氢化蓖麻油、聚氧乙烯60氢化蓖麻油,以及其任意两种或更多种的结合物。
项5.项1-4中任一项的药物组合物,其中所述聚氧乙烯氢化蓖麻油选自聚氧乙烯35氢化蓖麻油、聚氧乙烯40氢化蓖麻油及其结合物。
项6.项1-5中任一项的药物组合物,其中所述苔藓抑素选自苔藓抑素1、苔藓抑素2、其任一种的可药用的盐,以及其任意两种或更多种的结合物。
项7.项1-6中任一项的药物组合物,其中所述佛波酯选自12-o-十四烷酰佛波醇-13-乙酸酯或其可药用的盐。
项8.项1-7中任一项的药物组合物,其中所述set核糖体拮抗剂抑制set核糖体的蛋白质合成。
项9.项1-8中任一项的药物组合物,其中所述set核糖体拮抗剂选自茴香霉素、依米丁、放线菌酮、其任一种的可药用的盐,以及其任意两种或更多种的结合物。
项10.项1-9中任一项的药物组合物,其中所述set激动剂包括聚氧乙烯35氢化蓖麻油,并且所述set核糖体拮抗剂包括茴香霉素或其可药用的盐。
项11.项1-10中任一项的药物组合物,其中所述set激动剂包括聚氧乙烯35氢化蓖麻油,并且所述set核糖体拮抗剂包括依米丁或其可药用的盐。
项12.项1-11中任一项的药物组合物,其被配制用于对受试者的口服给药。
项13.根据本发明的方面提供鉴定有效促进或抑制体内g2进程的试剂的方法,所述方法包括提供tr4类细胞系的细胞,其特征在于tr3类异常set响应,其中所述细胞包含编码tr元件和报告蛋白的tr核酸表达盒;其中所述表达盒被稳定整合到所述细胞的基因组中;将所述细胞给予非人动物,在所述非人动物中产生异种移植肿瘤;将试验物质给予所述非人动物;以及测量试验物质对set响应的作用,其中set响应的增加将所述试剂鉴定为有效促进体内g2进程的set激动剂。
项14.项13的方法,还包括将set激动剂给予所述非人动物以促进体内g2进程,其中set响应的降低将所述试剂鉴定为有效抑制体内g2进程的set拮抗剂。
项15.项13或14的方法,还包括测量试验物质对异种移植肿瘤的作用。
项16.项13-15中任一项的方法,其中所述非人动物是大鼠或小鼠。
项17.鉴定有效作为治疗增生性疾病的set复方药物的组分的试剂的方法,包括:
提供细胞,其特征在于tr3类set响应或tr3类set异常响应,其中所述细胞包含被稳定整合到所述细胞的基因组中的编码tr元件和报告蛋白的表达构建体;
使所述细胞接触试验物质;和
测量与对照相比,所述试验物质对set核糖体的蛋白质合成的作用,其中试验物质对来自set核糖体的蛋白质合成的抑制将所述物质鉴定为有效作为治疗增生性疾病的set复方药物组分的试剂。
项18.项17的方法,其中所述细胞的特征还在于,在体外作为非粘附3d结构在悬浮培养物中生长的能力,和在体内启动并生长为原代异种移植肿瘤的能力,所述肿瘤可被切成亚碎片并作为继发肿瘤增殖。
项19.产生转移癌细胞系模型的方法,包括:
将编码tr元件和报告蛋白的表达盒引入到细胞中,产生其中所述表达盒被稳定整合到细胞的基因组中的亲代细胞群,;
分离亲代群的亚克隆;
将set激动剂给予每个亚克隆的细胞群以在每个亚克隆的细胞群中诱导settr响应;
通过检测报告蛋白的表达来测定每个亚克隆的细胞群中的trset响应;
对与每个其他亚克隆相比的每个亚克隆的trset进行排序,建立一系列特征为平均响应的trset响应;
选择特征为大于平均响应至少两个标准差的报告蛋白表达的可检测增加的亚克隆,从而确定所选择的亚克隆为tr3类trset响应亚克隆;
将set激动剂给予每个tr3类trset响应亚克隆的细胞群以在每个tr3类trset响应亚克隆的细胞群中诱导settr响应;
通过检测报告蛋白的表达来测定每个tr3类set响应亚克隆的细胞群中的trset响应;
对与每个其他tr3类set响应亚克隆相比的每个tr3类set响应亚克隆的trset响应进行排序,建立一系列特征为平均响应的trset响应;
选择特征为大于平均响应至少两个标准差的报告蛋白表达的可检测增加的tr3类set响应亚克隆,从而确定所选择的tr3类set响应亚克隆为tr3类set响应异常;
将一种或多种毒素给予一种或多种特征为tr3类set响应异常的亚克隆的细胞;以及
检测所述一种或多种特征为tr3类set响应异常的亚克隆的细胞的响应,所述响应指示出由于所述亚克隆细胞中升高的set核糖体活性而导致的药物和应激抗性,从而确定所述细胞为tr4类细胞,从而产生转移癌细胞系模型。
项20.项19的方法,还包括:
在低密度条件下培养tr4类细胞至少50个细胞周期,产生tr4类亚克隆并且能够形成低密度集落;
选择能够形成低密度集落的tr4类亚克隆;
将set激动剂给予能够形成低密度集落的每个tr4类亚克隆的细胞群以诱导trset响应;
通过检测报告蛋白的表达来测定能够形成低密度集落以诱导trset响应的每个tr4类亚克隆的细胞群中的set响应;
对与每个其他能够形成低密度集落的tr4类亚克隆相比的能够形成低密度集落的tr4类亚克隆的trset响应进行排序,建立一系列特征为平均响应的set响应;以及
选择特征为大于平均响应至少两个标准差的报告蛋白表达的可检测增加,能够形成低密度集落的tr4类亚克隆。
项21.项19或20的方法,还包括:
在非粘附的低密度培养条件下培养tr4类细胞;
选择作为悬浮聚集物生长的tr4类细胞的亚克隆,从而选择能够形成离体肿瘤球的tr4类细胞的亚克隆,所述肿瘤球由10个或更少细胞启动;
将一种或多种毒素给予能够形成离体肿瘤球的tr4类亚克隆的细胞,所述肿瘤球响应由10个或更少细胞启动;以及
检测能够用10个或更少细胞启动肿瘤球而形成离体肿瘤球的tr4类亚克隆的细胞的响应,所述响应指示出由于所述亚克隆细胞中升高的set核糖体活性而导致的药物和应激抗性,从而确定所述tr4类亚克隆的细胞能够用10个或更少细胞形成离体肿瘤球,其特征为tr4类set响应。
项22.分离的非天然存在的细胞,其特征在于3类异常set响应,其中所述细胞包含被稳定整合到细胞基因组中的编码表达tr元件和报告蛋白的表达盒。
项23.项22的细胞,其特征还在于,在体外作为非粘附3d结构在悬浮培养物中生长的能力,和在体内启动并生长为原代异基因肿瘤的能力,所述肿瘤可被切成亚碎片并作为继发肿瘤增殖。
项24.在哺乳动物受试者中治疗特征为异常细胞的增生性疾病的方法,所述方法包括:
给予药学有效量的细胞毒性剂、set激动剂和set核糖体拮抗剂的结合物。
项25.项24的方法,其中所述异常细胞包括有丝分裂异常细胞和非有丝分裂异常细胞,其中由于给予药学有效量的细胞毒性剂、set激动剂和set核糖体拮抗剂的结合物,异常细胞和非有丝分裂异常细胞均被诱导死亡。
项26.项24或25的方法,其中所述细胞毒性剂、set激动剂和set核糖体拮抗剂的结合物是有效的,从而使得与通过给予细胞毒性剂,而不给予set激动剂和set核糖体拮抗剂的治疗相比,需要更低剂量的细胞毒性剂来杀死异常细胞。
项27.项24-26中任一项的方法,其中所述细胞毒性剂选自5-氟尿嘧啶、甲酰四氢叶酸、卡培他滨、环磷酰胺、伊立替康、托泊替康、紫杉醇、多西他赛、奥沙利铂、其可药用的盐以及其任意两种或更多种的结合物。
项28.项24-27中任一项的方法,其中所述set激动剂是g2期进程的刺激剂。
项29.项24-28中任一项的方法,其中所述set激动剂选自聚氧乙烯氢化蓖麻油、佛波酯、苔藓抑素,其任一种的可药用的盐,以及其任意两种或更多种的结合物。
项30.项24-29中任一项的方法,其中聚氧乙烯氢化蓖麻油选自聚氧乙烯30氢化蓖麻油、聚氧乙烯35氢化蓖麻油、聚氧乙烯40氢化蓖麻油、聚氧乙烯50氢化蓖麻油、聚氧乙烯60氢化蓖麻油,以及其任意两种或更多种的结合物。
项31.项24-30中任一项的方法,其中所述聚氧乙烯氢化蓖麻油选自聚氧乙烯35氢化蓖麻油、聚氧乙烯40氢化蓖麻油及其结合物。
项32.项24-31中任一项的方法,其中所述苔藓抑素选自苔藓抑素1、苔藓抑素2,其任一种的可药用的盐,以及其任意两种或更多种的结合物。
项33.项24-32中任一项的方法,其中所述佛波酯为12-o-十四烷酰佛波醇-13-乙酸酯或其可药用的盐。
项34.项24-33中任一项的方法,其中所述set核糖体拮抗剂抑制set核糖体的蛋白质合成。
项35.项24-34中任一项的方法,其中所述set核糖体拮抗剂选自茴香霉素、放线菌酮、依米丁、其任一种的可药用的盐,以及其任意两种或更多种的结合物。
项36.项24-35中任一项的方法,其中所述细胞毒性剂包括卡培他滨或其可药用的盐,所述set激动剂包括聚氧乙烯35氢化蓖麻油,并且所述set核糖体拮抗剂包括茴香霉素或其可药用的盐。
项37.项24-36中任一项的方法,其中所述细胞毒性剂包括卡培他滨或其可药用的盐,所述set激动剂包括聚氧乙烯35氢化蓖麻油,并且所述set核糖体拮抗剂包括依米丁或其可药用的盐。
项38.项24-37中任一项的方法,其中所述受试者为人。
项39.项24-38中任一项的方法,其中所述增生性疾病为耐药性癌症和/或转移癌。
项40.项24-39中任一项的方法,其中所述细胞毒性剂、所述set激动剂和所述set核糖体拮抗剂是同时给予的。
项41.项24-40中任一项的方法,其中所述胞毒性剂、所述set激动剂和所述set核糖体拮抗剂是在不同的时间给予的。
项42.项24-41中任一项的方法,其中所述set激动剂和所述set核糖体拮抗剂是在药物制剂中一起给予的。
项43.项24-42中任一项的方法,其中所述set激动剂和所述set核糖体拮抗剂是在药物制剂中一起经口服给予的。
项44.项24-43中任一项的方法,还包括辅助的治疗性治疗。
项45.项24-44中任一项的方法,其中所述辅助的治疗性治疗包括对受试者的辐射治疗。
项46.项24-45中任一项的方法,其中所述辅助的治疗性治疗包括给予一种或多种额外的细胞毒性剂。
项47.项24-46中任一项的方法,其中所述细胞毒性剂是通过注射给予的。
项48.项24-47中任一项的方法,其中所述细胞毒性剂是经静脉内给予的。
项49.项24-48中任一项的方法,其中使患有特征为异常细胞的增生性疾病的受试者的异常细胞与所述细胞毒性剂接触,然后与所述set激动剂或所述set核糖体拮抗剂接触。
项50.项24-49中任一项的方法,其中所述异常细胞是癌细胞。
项51.项13-23中任一项的方法或细胞,其中表达盒编码tr元件,所述tr元件选自人和小鼠tr元件。
项52.项13-23中任一项的方法或细胞,其中表达盒编码tr元件,所述tr元件选自由seqidno:1、seqidno:2、seqidno:3、seqidno:4、seqidno:17、seqidno:18、seqidno:19、seqidno:20或其任一种的变体编码的那些,其中所述编码的tr元件赋予对mrna中可操作地连接的编码序列的选择性翻译。
项53.项13-23和52中任一项的方法和细胞,其中所述表达盒编码报告蛋白,所述报告蛋白选自抗原表位、生物发光蛋白、酶、荧光蛋白、受体和转运蛋白。
项54.项13-23和52-53中任一项的方法和细胞,其中所述表达盒编码报告蛋白,所述报告蛋白选自荧光素酶、gfp、eyfp、mrfp1、β-gal和cat。
项55.基本上如本文所述的治疗方法。
项56.基本上如本文所述的药物组合物。
项57.基本上如本文所述的鉴定有效作为治疗增生性疾病的set复方药物组分的试剂的方法。
项58.分离的非天然存在的细胞,其特征在于如本文所述的3类异常set响应。
项59.基本上如本文所述的产生转移癌细胞系模型的方法。
项60.基本上如本文所述的鉴定有效促进或抑制体内g2进程的试剂的方法。
序列
seqidno:1
鼠trdm
ttgagtgagttagagtagtgagctagttgtctggtaggggccccctttgcttccctggtggccactggattgtgtttctttggagtggcactgttctgtggatgtggacatgaagctctcactggtacagaaaagctaattgagacctatttctccaaaaactaccaggactatgagtatctcattaatgtgattcatgctttccagtatgtcatctatggaactgcctctttcttcttcctttatggggccctcctgctggctgagggcttctacaccaccggcgctgtcaggcagatctttggcgactacaagaccaccatctgcggcaagggcctgagcgcaacgtttgtgggcatcacctatgccctgactgttgtatggctcctggtgtttgcctgctcggctgtacctgtgtacatttacttcaatacctggaccacctgtcagtctattgccttccctagcaagacctctgccagtataggcagtctctgcgctgatgccagattgtatggtgttctcccatggaatgctttccctggcaaggtttgtggctccaaccttctgtccatctgcaaaacagctgagttccaattgaccttccacctgtttattgctgcgtttgtgggtgctgcggccacactagtttccctgctcaccttcatgattgctgccacttacaacttcgccgtccttaaactcatgggccgaggcaccaagttc
seqidno:2
鼠trplp
ttgagtgagttagagtagtgagctagttgtctggtaggggccccctttgcttccctggtggccactggattgtgtttctttggagtggcactgttctgtggatgtggacatgaagctctcactggtacagaaaagctaattgagacctatttctccaaaaactaccaggactatgagtatctcattaatgtgattcatgctttccagtatgtcatctatggaactgcctctttcttcttcctttatggggccctcctgctggctgagggcttctacaccaccggcgctgtcaggcagatctttggcgactacaagaccaccatctgcggcaagggcctgagcgcaacggtaacagggggccagaaggggaggggttccagaggccaacatcaagctcattctttggagcgggtgtgtcattgtttgggaaaatggctaggacatcccgacaagtttgtgggcatcacctatgccctgactgttgtatggctcctggtgtttgcctgctcggctgtacctgtgtacatttacttcaatacctggaccacctgtcagtctattgccttccctagcaagacctctgccagtataggcagtctctgcgctgatgccagattgtatggtgttctcccatggaatgctttccctggcaaggtttgtggctccaaccttctgtccatctgcaaaacagctgagttccaattgaccttccacctgtttattgctgcgtttgtgggtgctgcggccacactagtttccctgctcaccttcatgattgctgccacttacaacttcgccgtccttaaactcatgggccgaggcaccaagttc
seqidno:3
人trdm
ttgagtgagttagagtagtgagctagttgtctggtaggggccccctttgcttccctggtggccactggattgtgtttctttggggtggcactgttctgtggctgtggacatgaagccctcactggcacagaaaagctaattgagacctatttctccaaaaactaccaagactatgagtatctcatcaatgtgattcatgctttccagtatgtcatctatggaactgcctctttcttcttcctttatggggccctcctgctggctgagggcttctacaccaccggcgcagtcaggcagatctttggcgactacaagaccaccatctgcggcaagggcctgagcgcaacgtttgtgggcatcacctatgccctgaccgttgtgtggctcctggtgtttgcctgctctgctgtgcccgtgtacatttacttcaacacctggaccacctgcgactctattgccttccccagcaagacctctgccagtataggcagtctctgtgctgacgccagattgtatggtgttctcccatggaatgctttccctggcaaggtttgtggctccaaccttctgtccatctgcaaaacagctgagttccaattgaccttccacctgtttattgctgcatttgtgggggctgcagccacactggtttccctgctcaccttcatgattgctgccacttacaactttgccgtccttaaactcatgggccgaggcaccaagttc
seqidno:4
人trplp
ttgagtgagttagagtagtgagctagttgtctggtaggggccccctttgcttccctggtggccactggattgtgtttctttggggtggcactgttctgtggctgtggacatgaagccctcactggcacagaaaagctaattgagacctatttctccaaaaactaccaagactatgagtatctcatcaatgtgattcatgctttccagtatgtcatctatggaactgcctctttcttcttcctttatggggccctcctgctggctgagggcttctacaccaccggcgcagtcaggcagatctttggcgactacaagaccaccatctgcggcaagggcctgagcgcaacggtaacagggggccagaaggggaggggttccagaggccaacatcaagctcattctttggagcgggtgtgtcattgtttgggaaaatggctaggacatcccgacaagtttgtgggcatcacctatgccctgaccgttgtgtggctcctggtgtttgcctgctctgctgtgcccgtgtacatttacttcaacacctggaccacctgcgactctattgccttccccagcaagacctctgccagtataggcagtctctgtgctgacgccagattgtatggtgttctcccatggaatgctttccctggcaaggtttgtggctccaaccttctgtccatctgcaaaacagctgagttccaattgaccttccacctgtttattgctgcatttgtgggggctgcagccacactggtttccctgctcaccttcatgattgctgccacttacaactttgccgtccttaaactcatgggccgaggcaccaagttc
seqidno:5
小家鼠(musmusculus)
atgggcttgttagagtgttgtgctagatgtctggtaggggccccctttgcttccctggtggccactggattgtgtttctttggagtggcactgttctgtggatgtggacatgaagctctcactggtacagaaaagctaattgagacctatttctccaaaaactaccaggactatgagtatctcattaatgtgattcatgctttccagtatgtcatctatggaactgcctctttcttcttcctttatggggccctcctgctggctgagggcttctacaccaccggcgctgtcaggcagatctttggcgactacaagaccaccatctgcggcaagggcctgagcgcaacggtaacagggggccagaaggggaggggttccagaggccaacatcaagctcattctttggagcgggtgtgtcattgtttgggaaaatggctaggacatcccgacaagtttgtgggcatcacctatgccctgactgttgtatggctcctggtgtttgcctgctcggctgtacctgtgtacatttacttcaatacctggaccacctgtcagtctattgccttccctagcaagacctctgccagtataggcagtctctgcgctgatgccagaatgtatggtgttctcccatggaatgctttccctggcaaggtttgtggctccaaccttctgtccatctgcaaaacagctgagttccaaatgaccttccacctgtttattgctgcgtttgtgggtgctgcggccacactagtttccctgctcaccttcatgattgctgccacttacaacttcgccgtccttaaactcatgggccgaggcaccaagttctga
seqidno:6
小家鼠
atgggcttgttagagtgttgtgctagatgtctggtaggggccccctttgcttccctggtggccactggattgtgtttctttggagtggcactgttctgtggatgtggacatgaagctctcactggtacagaaaagctaattgagacctatttctccaaaaactaccaggactatgagtatctcattaatgtgattcatgctttccagtatgtcatctatggaactgcctctttcttcttcctttatggggccctcctgctggctgagggcttctacaccaccggcgctgtcaggcagatctttggcgactacaagaccaccatctgcggcaagggcctgagcgcaacgtttgtgggcatcacctatgccctgactgttgtatggctcctggtgtttgcctgctcggctgtacctgtgtacatttacttcaatacctggaccacctgtcagtctattgccttccctagcaagacctctgccagtataggcagtctctgcgctgatgccagaatgtatggtgttctcccatggaatgctttccctggcaaggtttgtggctccaaccttctgtccatctgcaaaacagctgagttccaaatgaccttccacctgtttattgctgcgtttgtgggtgctgcggccacactagtttccctgctcaccttcatgattgctgccacttacaacttcgccgtccttaaactcatgggccgaggcaccaagttctga
seqidno:7
人类(homosapiens)
atgggcttgttagagtgctgtgcaagatgtctggtaggggccccctttgcttccctggtggccactggattgtgtttctttggggtggcactgttctgtggctgtggacatgaagccctcactggcacagaaaagctaattgagacctatttctccaaaaactaccaagactatgagtatctcatcaatgtgatccatgccttccagtatgtcatctatggaactgcctctttcttcttcctttatggggccctcctgctggctgagggcttctacaccaccggcgcagtcaggcagatctttggcgactacaagaccaccatctgcggcaagggcctgagcgcaacgtttgtgggcatcacctatgccctgaccgttgtgtggctcctggtgtttgcctgctctgctgtgcccgtgtacatttacttcaacacctggaccacctgcgactctattgccttccccagcaagacctctgccagtataggcagtctctgtgctgacgccagaatgtatggtgttctcccatggaatgctttccctggcaaggtttgtggctccaaccttctgtccatctgcaaaacagctgagttccaaatgaccttccacctgtttattgctgcatttgtgggggctgcagctacactggtttccctgctcaccttcatgattgctgccacttacaactttgccgtccttaaactcatgggccgaggcaccaagttctga
seqidno:8
人类
atgggcttgttagagtgctgtgcaagatgtctggtaggggccccctttgcttccctggtggccactggattgtgtttctttggggtggcactgttctgtggctgtggacatgaagccctcactggcacagaaaagctaattgagacctatttctccaaaaactaccaagactatgagtatctcatcaatgtgatccatgccttccagtatgtcatctatggaactgcctctttcttcttcctttatggggccctcctgctggctgagggcttctacaccaccggcgcagtcaggcagatctttggcgactacaagaccaccatctgcggcaagggcctgagcgcaacggtaacagggggccagaaggggaggggttccagaggccaacatcaagctcattctttggagcgggtgtgtcattgtttgggaaaatggctaggacatcccgacaagtttgtgggcatcacctatgccctgaccgttgtgtggctcctggtgtttgcctgctctgctgtgcccgtgtacatttacttcaacacctggaccacctgcgactctattgccttccccagcaagacctctgccagtataggcagtctctgtgctgacgccagaatgtatggtgttctcccatggaatgctttccctggcaaggtttgtggctccaaccttctgtccatctgcaaaacagctgagttccaaatgaccttccacctgtttattgctgcatttgtgggggctgcagctacactggtttccctgctcaccttcatgattgctgccacttacaactttgccgtccttaaactcatgggccgaggcaccaagttctgatacactggtttccctg
seqidno:9
哺乳动物plp共有序列
atgggcytgttagagtgytgygcnagatgyctsgtaggggccccctttgcttccytggtggccactggattntgtttctttggngtggcactsttctgtggmtgtggacatgaagchytmactggyacagaaaagytaattgagacmtatttctccaaaaaytaccaagactaygagtatctcatyaatgtgatycatgcyttccagtatgtcatctatggaactgcctctttcttcttcctttatggggccctcctgctggcygagggcttctacaccaccggygcwgtcaggcagatctttggcgactacaagaccaccatctgcggsaagggcctgagygcaacggtaacagggggccagaaggggaggggttccagaggccaacatcaagctcattctttggagcgggtgtgtcattgtttgggaaaatggctaggacatcccgacaagtttgtgggcatcacctatgccytgacygttgtntggctcctngtgtttgcctgctckgctgtncctgtgtacatttayttcaayacctggaccacytgycagtctattgcckycccyagcaagacytctgccagyataggcastctctgygctgatgccagaatgtatggtgttctcccatggaatgctttyccwggcaangtktgtggctccaaccttctgtccatctgcaaaacagctgagttccaaatgacsttccayctgtttattgctgcvttygtgggkgctgcngcyacactngtktccctgctcaccttcatgattgctgccacttacaacttygccgtcctkaaactcatgggccgaggcaccaagttctga
包含外显子5的plp通用共有序列seoidno:17
btgagtgagttagagtagtgagcnagttgyctsgtaggggccccctttgcttccytggtggccactggattntgtttctttggngtggcactsttctgtggmtgtggacatgaagchytmactggyacagaaaagytaattgagacmtatttctccaaaaaytaccaagactaygagtatctcatyaatgtgatycatgcyttccagtatgtcatctatggaactgcctctttcttcttcctttatggggccctcctgctggcygagggcttctacaccaccggygcwgtcaggcagatctttggcgactacaagaccaccatctgcggsaagggcctgagygcaacggtaacagggggccagaaggggaggggttccagaggccaacatcaagctcattctttggagcgggtgtgtcattgtttgggaaaatggctaggacatcccgacaagtttgtgggcatcacctatgccytgacygttgtntggctcctngtgtttgcctgctckgctgtncctgtgtacatttayttcaayacctggaccacytgycagtctattgcckycccyagcaagacytctgccagyataggcastctctgygctgatgccagabtgtatggtgttctcccatggaatgctttyccwggcaangtktgtggctccaaccttctgtccatctgcaaaacagctgagttccaabtgacsttccayctgtttattgctgcvttygtgggkgctgcngcyacactngtktccctgctcaccttcatgattgctgccacttacaacttygccgtcctkaaactcatgggccgaggcaccaagttc
包含外显子5的dm20通用共有序列seqidno:18
btgagtgagttagagtagtgagcnagttgyctsgtaggggccccctttgcttccytggtggccactggattntgtttctttggngtggcactsttctgtggmtgtggacatgaagchytmactggyacagaaaagytaattgagacmtatttctccaaaaaytaccaagactaygagtatctcatyaatgtgatycatgcyttccagtatgtcatctatggaactgcctctttcttcttcctttatggggccctcctgctggcygagggcttctacaccaccggygcwgtcaggcagatctttggcgactacaagaccaccatctgcggsaagggcctgagygcaacgtttgtgggcatcacctatgccytgacygttgtntggctcctngtgtttgcctgctckgctgtncctgtgtacatttayttcaayacctggaccacytgycagtctattgcckycccyagcaagacytctgccagyataggcastctctgygctgatgccagabtgtatggtgttctcccatggaatgctttyccwggcaangtktgtggctccaaccttctgtccatctgcaaaacagctgagttccaabtgacsttccayctgtttattgctgcvttygtgggkgctgcngcyacactngtktccctgctcaccttcatgattgctgccacttacaacttygccgtcctkaaactcatgggccgaggcaccaagttc
外显子5缺失的plp通用共有序列seqidno:19
btgagtgagttagagtagtgagcnagttgyctsgtaggggccccctttgcttccytggtggccactggattntgtttctttggngtggcactsttctgtggmtgtggacatgaagchytmactggyacagaaaagytaattgagacmtatttctccaaaaaytaccaagactaygagtatctcatyaatgtgatycatgcyttccagtatgtcatctatggaactgcctctttcttcttcctttatggggccctcctgctggcygagggcttctacaccaccggygcwgtcaggcagatctttggcgactacaagaccaccatctgcggsaagggcctgagygcaacggtaacagggggccagaaggggaggggttccagaggccaacatcaagctcattctttggagcgggtgtgtcattgtttgggaaaatggctaggacatcccgacaagtttgtgggcatcacctatgccytgacygttgtntggctcctngtgtttgcctgctckgctgtncctgtgtacatttayttcaayacctggaccacytgycagtctattgcckycccyagcaagacytctgccagyataggcastctctgygctgatgccagabtgtatgttccaabtgacsttccayctgtttattgctgcvttygtgggkgctgcngcyacactngtktccctgctcaccttcatgattgctgccacttacaacttygccgtcctkaaactcatgggccgaggcaccaagttc
外显子5缺失的dm20通用共有序列seqidno:20
btgagtgagttagagtagtgagcnagttgyctsgtaggggccccctttgcttccytggtggccactggattntgtttctttggngtggcactsttctgtggmtgtggacatgaagchytmactggyacagaaaagytaattgagacmtatttctccaaaaaytaccaagactaygagtatctcatyaatgtgatycatgcyttccagtatgtcatctatggaactgcctctttcttcttcctttatggggccctcctgctggcygagggcttctacaccaccggygcwgtcaggcagatctttggcgactacaagaccaccatctgcggsaagggcctgagygcaacgtttgtgggcatcacctatgccytgacygttgtntggctcctngtgtttgcctgctckgctgtncctgtgtacatttayttcaayacctggaccacytgycagtctattgcckycccyagcaagacytctgccagyataggcastctctgygctgatgccagabtgtatgttccaabtgacsttccayctgtttattgctgcvttygtgggkgctgcngcyacactngtktccctgctcaccttcatgattgctgccacttacaacttygccgtcctkaaactcatgggccgaggcaccaagttc
本说明书中提及的任何专利或出版物均以引用的方式纳入本文,其程度如同意欲具体地且单独地以引用的方式纳入每篇单独的出版物一样。
本文所述的组合物和方法目前代表优选实施方案,为示例性的,并不意欲限制本发明的范围。本领域技术人员会想到其中的改变和其他用途。可实施这样的改变和其他用途,而不偏离权利要求中所述的本发明的范围。
序列表
<110>waynestateuniversity
<120>涉及增生性疾病的组合物和方法
<130>way-10552/47
<150>62/087,023
<151>2014-12-03
<160>20
<170>patentin版本3.5
<210>1
<211>726
<212>dna
<213>人工序列
<220>
<223>编码tr元件的鼠dm20基因的突变版本
<400>1
ttgagtgagttagagtagtgagctagttgtctggtaggggccccctttgcttccctggtg60
gccactggattgtgtttctttggagtggcactgttctgtggatgtggacatgaagctctc120
actggtacagaaaagctaattgagacctatttctccaaaaactaccaggactatgagtat180
ctcattaatgtgattcatgctttccagtatgtcatctatggaactgcctctttcttcttc240
ctttatggggccctcctgctggctgagggcttctacaccaccggcgctgtcaggcagatc300
tttggcgactacaagaccaccatctgcggcaagggcctgagcgcaacgtttgtgggcatc360
acctatgccctgactgttgtatggctcctggtgtttgcctgctcggctgtacctgtgtac420
atttacttcaatacctggaccacctgtcagtctattgccttccctagcaagacctctgcc480
agtataggcagtctctgcgctgatgccagattgtatggtgttctcccatggaatgctttc540
cctggcaaggtttgtggctccaaccttctgtccatctgcaaaacagctgagttccaattg600
accttccacctgtttattgctgcgtttgtgggtgctgcggccacactagtttccctgctc660
accttcatgattgctgccacttacaacttcgccgtccttaaactcatgggccgaggcacc720
aagttc726
<210>2
<211>831
<212>dna
<213>人工序列
<220>
<223>编码tr元件的鼠蛋白脂质蛋白基因的突变版本
<400>2
ttgagtgagttagagtagtgagctagttgtctggtaggggccccctttgcttccctggtg60
gccactggattgtgtttctttggagtggcactgttctgtggatgtggacatgaagctctc120
actggtacagaaaagctaattgagacctatttctccaaaaactaccaggactatgagtat180
ctcattaatgtgattcatgctttccagtatgtcatctatggaactgcctctttcttcttc240
ctttatggggccctcctgctggctgagggcttctacaccaccggcgctgtcaggcagatc300
tttggcgactacaagaccaccatctgcggcaagggcctgagcgcaacggtaacagggggc360
cagaaggggaggggttccagaggccaacatcaagctcattctttggagcgggtgtgtcat420
tgtttgggaaaatggctaggacatcccgacaagtttgtgggcatcacctatgccctgact480
gttgtatggctcctggtgtttgcctgctcggctgtacctgtgtacatttacttcaatacc540
tggaccacctgtcagtctattgccttccctagcaagacctctgccagtataggcagtctc600
tgcgctgatgccagattgtatggtgttctcccatggaatgctttccctggcaaggtttgt660
ggctccaaccttctgtccatctgcaaaacagctgagttccaattgaccttccacctgttt720
attgctgcgtttgtgggtgctgcggccacactagtttccctgctcaccttcatgattgct780
gccacttacaacttcgccgtccttaaactcatgggccgaggcaccaagttc831
<210>3
<211>726
<212>dna
<213>人工序列
<220>
<223>编码tr元件的人dm20基因的突变版本
<400>3
ttgagtgagttagagtagtgagctagttgtctggtaggggccccctttgcttccctggtg60
gccactggattgtgtttctttggggtggcactgttctgtggctgtggacatgaagccctc120
actggcacagaaaagctaattgagacctatttctccaaaaactaccaagactatgagtat180
ctcatcaatgtgattcatgctttccagtatgtcatctatggaactgcctctttcttcttc240
ctttatggggccctcctgctggctgagggcttctacaccaccggcgcagtcaggcagatc300
tttggcgactacaagaccaccatctgcggcaagggcctgagcgcaacgtttgtgggcatc360
acctatgccctgaccgttgtgtggctcctggtgtttgcctgctctgctgtgcccgtgtac420
atttacttcaacacctggaccacctgcgactctattgccttccccagcaagacctctgcc480
agtataggcagtctctgtgctgacgccagattgtatggtgttctcccatggaatgctttc540
cctggcaaggtttgtggctccaaccttctgtccatctgcaaaacagctgagttccaattg600
accttccacctgtttattgctgcatttgtgggggctgcagccacactggtttccctgctc660
accttcatgattgctgccacttacaactttgccgtccttaaactcatgggccgaggcacc720
aagttc726
<210>4
<211>831
<212>dna
<213>人工序列
<220>
<223>编码tr元件的人蛋白脂质蛋白基因的突变版本
<400>4
ttgagtgagttagagtagtgagctagttgtctggtaggggccccctttgcttccctggtg60
gccactggattgtgtttctttggggtggcactgttctgtggctgtggacatgaagccctc120
actggcacagaaaagctaattgagacctatttctccaaaaactaccaagactatgagtat180
ctcatcaatgtgattcatgctttccagtatgtcatctatggaactgcctctttcttcttc240
ctttatggggccctcctgctggctgagggcttctacaccaccggcgcagtcaggcagatc300
tttggcgactacaagaccaccatctgcggcaagggcctgagcgcaacggtaacagggggc360
cagaaggggaggggttccagaggccaacatcaagctcattctttggagcgggtgtgtcat420
tgtttgggaaaatggctaggacatcccgacaagtttgtgggcatcacctatgccctgacc480
gttgtgtggctcctggtgtttgcctgctctgctgtgcccgtgtacatttacttcaacacc540
tggaccacctgcgactctattgccttccccagcaagacctctgccagtataggcagtctc600
tgtgctgacgccagattgtatggtgttctcccatggaatgctttccctggcaaggtttgt660
ggctccaaccttctgtccatctgcaaaacagctgagttccaattgaccttccacctgttt720
attgctgcatttgtgggggctgcagccacactggtttccctgctcaccttcatgattgct780
gccacttacaactttgccgtccttaaactcatgggccgaggcaccaagttc831
<210>5
<211>729
<212>dna
<213>小家鼠(musmusculus)
<400>5
atgggcttgttagagtgttgtgctagatgtctggtaggggccccctttgcttccctggtg60
gccactggattgtgtttctttggagtggcactgttctgtggatgtggacatgaagctctc120
actggtacagaaaagctaattgagacctatttctccaaaaactaccaggactatgagtat180
ctcattaatgtgattcatgctttccagtatgtcatctatggaactgcctctttcttcttc240
ctttatggggccctcctgctggctgagggcttctacaccaccggcgctgtcaggcagatc300
tttggcgactacaagaccaccatctgcggcaagggcctgagcgcaacgtttgtgggcatc360
acctatgccctgactgttgtatggctcctggtgtttgcctgctcggctgtacctgtgtac420
atttacttcaatacctggaccacctgtcagtctattgccttccctagcaagacctctgcc480
agtataggcagtctctgcgctgatgccagaatgtatggtgttctcccatggaatgctttc540
cctggcaaggtttgtggctccaaccttctgtccatctgcaaaacagctgagttccaaatg600
accttccacctgtttattgctgcgtttgtgggtgctgcggccacactagtttccctgctc660
accttcatgattgctgccacttacaacttcgccgtccttaaactcatgggccgaggcacc720
aagttctga729
<210>6
<211>834
<212>dna
<213>小家鼠
<400>6
atgggcttgttagagtgttgtgctagatgtctggtaggggccccctttgcttccctggtg60
gccactggattgtgtttctttggagtggcactgttctgtggatgtggacatgaagctctc120
actggtacagaaaagctaattgagacctatttctccaaaaactaccaggactatgagtat180
ctcattaatgtgattcatgctttccagtatgtcatctatggaactgcctctttcttcttc240
ctttatggggccctcctgctggctgagggcttctacaccaccggcgctgtcaggcagatc300
tttggcgactacaagaccaccatctgcggcaagggcctgagcgcaacggtaacagggggc360
cagaaggggaggggttccagaggccaacatcaagctcattctttggagcgggtgtgtcat420
tgtttgggaaaatggctaggacatcccgacaagtttgtgggcatcacctatgccctgact480
gttgtatggctcctggtgtttgcctgctcggctgtacctgtgtacatttacttcaatacc540
tggaccacctgtcagtctattgccttccctagcaagacctctgccagtataggcagtctc600
tgcgctgatgccagaatgtatggtgttctcccatggaatgctttccctggcaaggtttgt660
ggctccaaccttctgtccatctgcaaaacagctgagttccaaatgaccttccacctgttt720
attgctgcgtttgtgggtgctgcggccacactagtttccctgctcaccttcatgattgct780
gccacttacaacttcgccgtccttaaactcatgggccgaggcaccaagttctga834
<210>7
<211>729
<212>dna
<213>人类(homosapiens)
<400>7
atgggcttgttagagtgctgtgcaagatgtctggtaggggccccctttgcttccctggtg60
gccactggattgtgtttctttggggtggcactgttctgtggctgtggacatgaagccctc120
actggcacagaaaagctaattgagacctatttctccaaaaactaccaagactatgagtat180
ctcatcaatgtgatccatgccttccagtatgtcatctatggaactgcctctttcttcttc240
ctttatggggccctcctgctggctgagggcttctacaccaccggcgcagtcaggcagatc300
tttggcgactacaagaccaccatctgcggcaagggcctgagcgcaacgtttgtgggcatc360
acctatgccctgaccgttgtgtggctcctggtgtttgcctgctctgctgtgcccgtgtac420
atttacttcaacacctggaccacctgcgactctattgccttccccagcaagacctctgcc480
agtataggcagtctctgtgctgacgccagaatgtatggtgttctcccatggaatgctttc540
cctggcaaggtttgtggctccaaccttctgtccatctgcaaaacagctgagttccaaatg600
accttccacctgtttattgctgcatttgtgggggctgcagctacactggtttccctgctc660
accttcatgattgctgccacttacaactttgccgtccttaaactcatgggccgaggcacc720
aagttctga729
<210>8
<211>850
<212>dna
<213>人类
<400>8
atgggcttgttagagtgctgtgcaagatgtctggtaggggccccctttgcttccctggtg60
gccactggattgtgtttctttggggtggcactgttctgtggctgtggacatgaagccctc120
actggcacagaaaagctaattgagacctatttctccaaaaactaccaagactatgagtat180
ctcatcaatgtgatccatgccttccagtatgtcatctatggaactgcctctttcttcttc240
ctttatggggccctcctgctggctgagggcttctacaccaccggcgcagtcaggcagatc300
tttggcgactacaagaccaccatctgcggcaagggcctgagcgcaacggtaacagggggc360
cagaaggggaggggttccagaggccaacatcaagctcattctttggagcgggtgtgtcat420
tgtttgggaaaatggctaggacatcccgacaagtttgtgggcatcacctatgccctgacc480
gttgtgtggctcctggtgtttgcctgctctgctgtgcccgtgtacatttacttcaacacc540
tggaccacctgcgactctattgccttccccagcaagacctctgccagtataggcagtctc600
tgtgctgacgccagaatgtatggtgttctcccatggaatgctttccctggcaaggtttgt660
ggctccaaccttctgtccatctgcaaaacagctgagttccaaatgaccttccacctgttt720
attgctgcatttgtgggggctgcagctacactggtttccctgctcaccttcatgattgct780
gccacttacaactttgccgtccttaaactcatgggccgaggcaccaagttctgatacact840
ggtttccctg850
<210>9
<211>834
<212>dna
<213>人工序列
<220>
<223>哺乳动物蛋白脂质蛋白基因共有序列
<220>
<221>misc_feature
<222>(24)..(24)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(72)..(72)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(84)..(84)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(486)..(486)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(495)..(495)
<223>nisa,c,g,ort
<220>
<221>misc_feature
<222>(516)..(516)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(654)..(654)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(744)..(744)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(753)..(753)
<223>n是a,c,g,或t
<400>9
atgggcytgttagagtgytgygcnagatgyctsgtaggggccccctttgcttccytggtg60
gccactggattntgtttctttggngtggcactsttctgtggmtgtggacatgaagchytm120
actggyacagaaaagytaattgagacmtatttctccaaaaaytaccaagactaygagtat180
ctcatyaatgtgatycatgcyttccagtatgtcatctatggaactgcctctttcttcttc240
ctttatggggccctcctgctggcygagggcttctacaccaccggygcwgtcaggcagatc300
tttggcgactacaagaccaccatctgcggsaagggcctgagygcaacggtaacagggggc360
cagaaggggaggggttccagaggccaacatcaagctcattctttggagcgggtgtgtcat420
tgtttgggaaaatggctaggacatcccgacaagtttgtgggcatcacctatgccytgacy480
gttgtntggctcctngtgtttgcctgctckgctgtncctgtgtacatttayttcaayacc540
tggaccacytgycagtctattgcckycccyagcaagacytctgccagyataggcastctc600
tgygctgatgccagaatgtatggtgttctcccatggaatgctttyccwggcaangtktgt660
ggctccaaccttctgtccatctgcaaaacagctgagttccaaatgacsttccayctgttt720
attgctgcvttygtgggkgctgcngcyacactngtktccctgctcaccttcatgattgct780
gccacttacaacttygccgtcctkaaactcatgggccgaggcaccaagttctga834
<210>10
<211>47
<212>rna
<213>人工序列
<220>
<223>螺旋2618srrna,部分
<400>10
gcgaugcggcggcguuauucccaugacccgccgggcagcuuccggga47
<210>11
<211>25
<212>rna
<213>人工序列
<220>
<223>b型流感病毒,部分
<400>11
cagagcucuaugggaaauucagcuc25
<210>12
<211>25
<212>rna
<213>人工序列
<220>
<223>猫杯状病毒,部分
<400>12
gccuccuacaugggaauacaauugg25
<210>13
<211>25
<212>rna
<213>人工序列
<220>
<223>兔出血性疾病病毒,部分
<400>13
cagagcucuaugggaaauucagcuc25
<210>14
<211>23
<212>rna
<213>人工序列
<220>
<223>gtxires
<400>14
cccgagccggcgggugcgggggc23
<210>15
<211>30
<212>rna
<213>人工序列
<220>
<223>鼠trires
<400>15
uguuugccugcucggcuguaccuguguaca30
<210>16
<211>42
<212>rna
<213>人工序列
<220>
<223>人tr调节基因
<400>16
aacuucgccguccuuaaacucaugggccgaggcaccaaguuc42
<210>17
<211>834
<212>dna
<213>人工序列
<220>
<223>包含外显子5的蛋白脂质蛋白质通用共有序列
<220>
<221>misc_feature
<222>(24)..(24)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(72)..(72)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(84)..(84)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(486)..(486)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(495)..(495)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(516)..(516)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(654)..(654)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(663)..(663)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(747)..(747)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(756)..(756)
<223>n是a,c,g,或t
<400>17
btgagtgagttagagtagtgagcnagttgyctsgtaggggccccctttgcttccytggtg60
gccactggattntgtttctttggngtggcactsttctgtggmtgtggacatgaagchytm120
actggyacagaaaagytaattgagacmtatttctccaaaaaytaccaagactaygagtat180
ctcatyaatgtgatycatgcyttccagtatgtcatctatggaactgcctctttcttcttc240
ctttatggggccctcctgctggcygagggcttctacaccaccggygcwgtcaggcagatc300
tttggcgactacaagaccaccatctgcggsaagggcctgagygcaacggtaacagggggc360
cagaaggggaggggttccagaggccaacatcaagctcattctttggagcgggtgtgtcat420
tgtttgggaaaatggctaggacatcccgacaagtttgtgggcatcacctatgccytgacy480
gttgtntggctcctngtgtttgcctgctckgctgtncctgtgtacatttayttcaayacc540
tggaccacytgycagtctattgcckycccyagcaagacytctgccagyataggcastctc600
tgygctgatgccagabtgtatggtgttctcccatggaatgctttyccwggcaangtktgt660
sdnggctccaaccttctgtccatctgcaaaacagctgagttccaabtgacsttccayctg720
tttattgctgcvttygtgggkgctgcngcyacactngtktccctgctcaccttcatgatt780
gctgccacttacaacttygccgtcctkaaactcatgggccgaggcaccaagttc834
<210>18
<211>726
<212>dna
<213>人工序列
<220>
<223>包含外显子5的dm20通用共有序列
<220>
<221>misc_feature
<222>(24)..(24)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(72)..(72)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(84)..(84)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(381)..(381)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(390)..(390)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(411)..(411)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(549)..(549)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(639)..(639)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(648)..(648)
<223>n是a,c,g,或t
<400>18
btgagtgagttagagtagtgagcnagttgyctsgtaggggccccctttgcttccytggtg60
gccactggattntgtttctttggngtggcactsttctgtggmtgtggacatgaagchytm120
actggyacagaaaagytaattgagacmtatttctccaaaaaytaccaagactaygagtat180
ctcatyaatgtgatycatgcyttccagtatgtcatctatggaactgcctctttcttcttc240
ctttatggggccctcctgctggcygagggcttctacaccaccggygcwgtcaggcagatc300
tttggcgactacaagaccaccatctgcggsaagggcctgagygcaacgtttgtgggcatc360
acctatgccytgacygttgtntggctcctngtgtttgcctgctckgctgtncctgtgtac420
atttayttcaayacctggaccacytgycagtctattgcckycccyagcaagacytctgcc480
agyataggcastctctgygctgatgccagabtgtatggtgttctcccatggaatgcttty540
ccwggcaangtktgtggctccaaccttctgtccatctgcaaaacagctgagttccaabtg600
acsttccayctgtttattgctgcvttygtgggkgctgcngcyacactngtktccctgctc660
accttcatgattgctgccacttacaacttygccgtcctkaaactcatgggccgaggcacc720
aagttc726
<210>19
<211>757
<212>dna
<213>人工序列
<220>
<223>外显子5缺失的蛋白脂质蛋白质通用共有序列
<220>
<221>misc_feature
<222>(24)..(24)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(72)..(72)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(84)..(84)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(486)..(486)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(495)..(495)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(516)..(516)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(670)..(670)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(679)..(679)
<223>n是a,c,g,或t
<400>19
btgagtgagttagagtagtgagcnagttgyctsgtaggggccccctttgcttccytggtg60
gccactggattntgtttctttggngtggcactsttctgtggmtgtggacatgaagchytm120
actggyacagaaaagytaattgagacmtatttctccaaaaaytaccaagactaygagtat180
ctcatyaatgtgatycatgcyttccagtatgtcatctatggaactgcctctttcttcttc240
ctttatggggccctcctgctggcygagggcttctacaccaccggygcwgtcaggcagatc300
tttggcgactacaagaccaccatctgcggsaagggcctgagygcaacggtaacagggggc360
cagaaggggaggggttccagaggccaacatcaagctcattctttggagcgggtgtgtcat420
tgtttgggaaaatggctaggacatcccgacaagtttgtgggcatcacctatgccytgacy480
gttgtntggctcctngtgtttgcctgctckgctgtncctgtgtacatttayttcaayacc540
tggaccacytgycagtctattgcckycccyagcaagacytctgccagyataggcastctc600
tgygctgatgccagabtgtatgttccaabtgacsttccayctgtttattgctgcvttygt660
gggkgctgcngcyacactngtktccctgctcaccttcatgattgctgccacttacaactt720
ygccgtcctkaaactcatgggccgaggcaccaagttc757
<210>20
<211>652
<212>dna
<213>人工序列
<220>
<223>外显子5缺失的dm20通用共有序列
<220>
<221>misc_feature
<222>(24)..(24)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(72)..(72)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(84)..(84)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(381)..(381)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(390)..(390)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(411)..(411)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(565)..(565)
<223>n是a,c,g,或t
<220>
<221>misc_feature
<222>(574)..(574)
<223>n是a,c,g,或t
<400>20
btgagtgagttagagtagtgagcnagttgyctsgtaggggccccctttgcttccytggtg60
gccactggattntgtttctttggngtggcactsttctgtggmtgtggacatgaagchytm120
actggyacagaaaagytaattgagacmtatttctccaaaaaytaccaagactaygagtat180
ctcatyaatgtgatycatgcyttccagtatgtcatctatggaactgcctctttcttcttc240
ctttatggggccctcctgctggcygagggcttctacaccaccggygcwgtcaggcagatc300
tttggcgactacaagaccaccatctgcggsaagggcctgagygcaacgtttgtgggcatc360
acctatgccytgacygttgtntggctcctngtgtttgcctgctckgctgtncctgtgtac420
atttayttcaayacctggaccacytgycagtctattgcckycccyagcaagacytctgcc480
agyataggcastctctgygctgatgccagabtgtatgttccaabtgacsttccayctgtt540
tattgctgcvttygtgggkgctgcngcyacactngtktccctgctcaccttcatgattgc600
tgccacttacaacttygccgtcctkaaactcatgggccgaggcaccaagttc652
- 还没有人留言评论。精彩留言会获得点赞!