使用固定于表面的多糖从血液中去除细胞因子的方法与流程
发明领域
本发明涉及从血液或血清(血液)中去除细胞因子和/或病原体的方法,所述方法通过使血液接触固体的、基本无微孔的基质,所述基质的表面已用多糖吸附剂,例如肝素、硫酸乙酰肝素和/或对待去除的细胞因子或病原体(吸附物)具有结合亲和力的其他分子或化学基团(吸附介质或介质)处理,其中用介质表面积的量和在介质上的结合位点的表面浓度平衡在所述介质内的间隙通道(interst itial channel)的大小,以提供足够的吸附能力,同时也允许血液通过吸附介质有相对高的流速。结果是,吸附质至介质上的结合位点的运输主要通过强制对流发生。(强制)对流的意思是,例如,通过泵产生的压力梯度,通过对有弹性的容器应用外部压力(或对刚性容器应用内部压力),通过重力高差(gravity head/elevation difference),或通过动脉压和静脉压的差异在待治疗患者中产生的流动。本发明提供了在一般在临床体外血液循环(extracorporeal blood circuit),例如透析、体外循环(cardiopulmonary bypass)和血液的体外膜氧合中使用的安全流速范围内的临床相关的吸附能力。所述方法与一般需要微孔吸附介质的慢得多的吸附质的扩散运输形成直接对比,吸附质的扩散运输需要吸附质在与介质上、介质后或介质内的吸附位点结合以前扩散通过微孔膜,和/或进入微孔中,因此其需要非常低的流速以在血液每次通过期间实现有效的分离。本发明也提供了通过从血液中去除细胞因子和/或病原体治疗疾病的方法和实施所述方法和治疗的设备,所述方法通过使血液接触基本无孔的基质,所述基质已用多糖吸附剂,例如肝素、硫酸乙酰肝素和/或其他吸附材料包被。
背景
很多疾病病症以在血流中存在升高浓度的细胞因子和/或病原体为表征。一些这样的病症通过旨在杀死病原体的疗法治疗,例如通过施用药物,例如抗感染药物。一些其他病症通过试图降低患者中的血源性(blood-borne)细胞因子或病原体的浓度的疗法治疗。其他疾病通过试图直接从患者血液中仅去除特定成分的疗法治疗。
例如,目前认为Guillian-Barre综合征是由病毒感染引起的刺激体内免疫系统过度产生抗体或可攻击患者神经系统的其他蛋白质的自身免疫疾病,其导致渐增水平的麻痹。大多数患者随时间而恢复,但是这些患者似乎在以后的病毒感染后容易复发病症。治疗Guillian-Barre综合征的一种方法包括“清洁”患者血液的血浆去除法(plasmapheresis),这是通过去除被视为攻击患者神经系统的抗体。
某些生物活性的碳水化合物和多糖可从血液和生物液(biological fluid)中去除有害物质。
肝素是可从哺乳动物组织中分离的多糖。其在哺乳动物组织中具有非常特定的分布;仅存在于肥大细胞的嗜碱性颗粒中。自从美国科学家McLean在1916年发现肝素以后,就已发现肝素能够避免血液凝结,和其在体内相对短的半衰期。通过注射游离型药物施用全身性肝素已在临床上使用了超过50年,作为安全和有效的血液抗凝剂和抗血栓剂。肝素对血液凝固/凝结的作用在停止施用后非常迅速的减少,使其在手术和其他程序期间的使用有效和安全。也就是说,肝素的抗凝和抗血栓形成的性能在许多医疗程序中有用,例如以最小化血液和体外循环的人造表面之间的不理想的相互作用。一旦程序结束,就可终止肝素的施用。由于其在体内的短半衰期,在患者血液中的肝素浓度在几小时内降低至安全水平。这在愈合取决于血液在手术位点凝结的能力以避免出血性并发症的手术后特别重要。除了其在治疗血栓栓塞(thromboembolic)疾病和预防表面诱发的血栓形成中的公认和持续的应用以外,最近发现肝素具有多种与其作为抗凝剂的功能明显无关的功能。例如,现在知道血液中的大量蛋白质以高亲和力结合肝素和/或密切相关的多糖——硫酸乙酰肝素,其也在动物组织中发现,包括健康血管接触血液的腔表面(在那里其可能有助于避免循环血液在与血管壁接触后凝结)。一些例子是抗凝血酶(AT)、纤连蛋白、玻连蛋白、生长因子(例如成纤维细胞生长因子、胰岛素样生长因子等)。人血清白蛋白(HSA)也结合肝素,但具有较低的亲和力,尽管其在血液中浓度高。
其他人已考虑过利用全身性游离肝素的选择性吸附性能阻碍感染,通过将肝素片段和/或所谓的含唾液酸片段直接引入血管系统。此疗法是基于以下假设,即这些片段将结合微生物上的凝集素并阻断它们,因此它们不能结合哺乳动物细胞表面上的受体。尽管许多科学家已经研究了此方法,迄今为止仅报导了少数成功。最常见的问题是与为了实现病原微生物的临床有效减少而引入(例如,通过注射)血流中的大量游离肝素相关的出血性并发症。本发明不需要使用任何游离的、全身性肝素以产生疗效,因此可消除出血性并发症。这是通过使肝素或硫酸乙酰肝素永久地结合具有高表面积的固体基质,并在包含此吸附介质的药筒(cartridge)或滤器内将所述基质暴露于血液。
以下参考涉及上面讨论的问题:
Weber等人(Weber V,Linsberger I,Ettenauer M,Loth F,等人Development of specific adsorbents for human tumor necros is factor-α:influence of antibody immobilization on performance and biocompatibility.Biomacromolecules 2005;6:1864-1870)报导了使用用单克隆抗TNF抗体包被的纤维素微颗粒的TNF的显著的体外结合,而Haase等人(Haase M,Bellomo R,Baldwin I,Haase-Fielitz A,等人The effect of three different miniaturized blood purificat ion devices on plasma cytokine concentration in an ex vivo model of endotoxinemia.Int J Artif Organs 2008;31:722-729)报导了IL-1ra,但不是IL-6的显著减少,使用和我们类似的离体方法,但使用多孔吸附设备。在体内,Mariano等人(Mariano F,Fonsato V,Lanfranco G,Pohlmeier R,等人Tailoring high-cut-off membranes and feasible application in sepsis-associated acute renal fai lure:in vitro studies.Nephrol Dial Transplant 2005;20:1116-1126)能够使用血液灌流和高截止聚砜(polysulphone)膜显著减少若干循环细胞因子,但也报导了血清白蛋白的减少。Schefold等人(Schefold JC,von Haehling S,Corsepius M,Pohle C,等人A novel selective extracorporeal intervention in sepsis:immunoadsorption of endotoxin,interleukin 6,and complement-activating product 5a.Shock 2007;28:418-425)显示了这些发现的假定的临床相关性,他们在患有感染性休克的33位患者的随机研究中能够通过选择性免疫吸附同时降低循环内毒素、IL-6和C5a水平,得到改善的器官功能。
发明概述
本发明的一个目的是提供从哺乳动物血液中去除细胞因子和/或病原体的方法,所述方法通过使血液接触用选择性吸附分子、生物分子或化学基团包被的固体的、基本无孔的基质。这样的选择性吸附分子可包括多糖,例如肝素、硫酸乙酰肝素、聚乙烯亚胺(PEI)、唾液酸、透明质酸和具有甘露糖序列的碳水化合物。当预防性使用时,例如在库存血的收集或输血期间,或在直接的患者至患者输血中,本发明的使用也可用于减少或消除疾病的传播。因此本发明也可用于预防疾病和在之前已感染的患者中帮助治愈疾病。
本发明的一个目的是提供通过从哺乳动物血液中去除细胞因子和/或病原体,用于治疗现有疾病的疗法,所述方法通过使哺乳动物血液接触用肝素和/或其他吸附分子包被的固体的、基本无孔的基质,并使血液返回患有疾病的患者。
上述目的不旨在以任何方式限制本发明的范围。
发明详述
1.从血液中去除细胞因子或病原体
本发明的第一个方面提供了从血液,例如哺乳动物血液中去除细胞因子和/或病原体的方法,所述方法通过使血液接触固体基质,例如用肝素和/或其他吸附性碳水化合物和/或多糖包被的固体基质。
在此方法的一个实施方案中,肝素被固定在基质表面上。发明人发现,与表面结合的固化肝素可有效用于从血液中去除大量细胞因子和病原体。然而,体外血液循环的一般流速要求将吸附“床”设计为允许相对高的流速以安全运行。这部分是由于缓慢移动或停滞的血液形成危险的血块的普遍倾向。在本发明中,将基质设计为具有足够大的间隙尺寸(interstitial dimension),以允许血液以高流速经过基质而没有大的压力下降。也就是说,当从哺乳动物患者中取出血液后,其以一定流速流经基质,其中主要通过强制对流完成吸附质至吸附床表面的递送。这与慢得多的分子扩散形成对比,分子扩散在使用高度多孔的吸附介质(例如多孔二氧化硅、葡聚糖凝胶、交联的聚苯乙烯和其他的大小排阻介质)和许多其他微孔介质中发生。当选择性渗透障碍膜和吸附介质一起使用时,例如在亲和疗法期间用于避免吸附介质接触血细胞和/或高分子量溶质时需要分子扩散。
在一般用于体外血液循环的(安全)运行的相对高的流速条件下,例如当用线性流速测量时≥8cm/min,优选地约≥24cm/min,和更优选地约24-329cm/分钟,或,当用流速测量时,约>50mL/分钟和优选地>150mL/分钟但低于约2000mL/分钟时,在对流运输中肝素和/或其他吸附分子结合细胞因子和病原体特别有效。相反地,在微孔介质的孔内吸附可能需要低得多的流速通过实际大小的吸附床以实现充分的分离或纯化,即<50mL/min到低至<1mL/min。
严格来说,普遍认为,当与通过强制对流将吸附质运送到(在基本无孔介质上的)结合位点所需的较短的停留时间相比,对需要吸附质扩散运输到介质内的吸附位点的介质来说,在吸附柱上需要长得多的“停留时间”(residence time)。然而,安全和有效的吸附药筒、柱、滤器等的尺寸有实际限制,特别是对于其可容纳的血液的最大滞留体积,和经过吸附介质的血液或血清的流速。为此,通过吸附设备的平均流速被认为是重要的设计变量。
在从流动的血液中去除细胞因子或病原体时可比较对流动力学和扩散动力学:依赖扩散运输的吸附介质一般使用因为存在微观孔而具有极高内表面积的非常多孔的材料。另一方面,适合对流运输的介质一般依赖宏观(macroscopic)“通道”或固体的、基本无孔的材料之间的可见间隙,例如颗粒、珠、纤维、网状泡沫体,或任选地螺旋缠绕的致密膜。
依赖强制对流运输的介质一般更适合高流速,而依赖慢得多的扩散运输的介质在需要高流速和较短的停留时间时效率低得多。为此,在体外血液净化设备中,更优选不需要吸附质缓慢扩散进吸附介质内的孔的吸附介质。当通过人造材料制造的循环泵送血液时,一般操作是应用相对高的血液流速以避免停滞和减少凝血的风险。另一方面,必须避免极高的流速,因为其可使血细胞暴露于可破坏或损伤血细胞的高剪切率和冲击损害。因此,本发明提供了用于从血液中去除细胞因子和/或病原体的方法和设备,使用对流运输的优选特征及其理想的、更快的动力学。这是通过使血液通过/流经基本无微孔的基质,所述基质的表面已用吸附分子,例如肝素处理,使其因此能够结合期望的细胞因子或病原体,从而将它们从血液中去除。如果表面处理有效地使基质无孔,在本发明中也可能使用微孔基质。这可有意或无意地(在制造介质时表面处理使孔堵塞)发生。这将微孔基质转化为不需要吸附质扩散进孔以结合介质的基质。
要求保护的方法旨在主要应用于体外疗法或程序,尽管也可用于可植入的设备。“体外疗法”的意思是在身体外面进行的程序,例如可在体液中加入期望的产物如氧气、抗凝血剂、麻醉剂等的疗法。相反地,使用特定类型的体外循环也可从体液中去除不理想的产物,如天然存在的毒素或毒物。实例是血液透析和血液过滤,它们代表了减少血液中的废产物的技术。在活性碳上的吸附已用于去除血源性毒物,等等。
在本发明中可使用来自哺乳动物全血和血清。没有旨在限制在要求保护的方法中可使用的血液或血清的量。其范围可从低于1mL至高于1L,直到包括患者的全部血容量(当应用返回患者的持续再循环时)。如果需要,可使用一次或多次“通过”吸附床。血液可为人或动物血液。
根据本发明优化从血液中去除细胞因子或病原体的吸附介质,用于流速>50mL/min,和优选地在约150-2000mL/min之间的传统体外血液循环。如果用线性流速测量,则≥8cm/min,优选地约≥24cm/min和更优选地约24-329cm/min。这样的高流速在吸附柱内产生短停留时间,且对流运输比Brownian扩散运输占优势。这对结合大分子量蛋白质或细胞因子,例如TNF-α和较大颗粒,例如病毒、细菌和寄生虫特别重要,因为它们扩散得非常非常慢。在本发明中,可用于去除细胞因子和病原体的主要吸附位点位于介质床间隙内的表面,血液流经或强制对流被递送通过介质床。为了处理血液,间隙通道需要足够大以允许红细胞的运输,红细胞的直径平均为6微米。为了允许在具有高血液流速的体外循环中放置填充的吸附药筒,间隙通道必须比红细胞的直径大若干倍。这可避免导致溶血的高剪切率,而同时最小化流经填充床或筒的血液中的压力降低。另外,介质优选为刚性的,以最小化由于压紧而可能堵塞过滤筒的形变。基于这些优先选择,优化的刚性介质平衡了间隙通道的大小和总表面积,例如用于在高流速体外血液循环中有效去除病原体和/或细胞因子。
2.在本发明中使用的基质。
多种形状和组成的材料可用作本发明中的基质。所有合适的基质提供较大的表面积,同时(主要)通过强制对流运输促进吸附质运输到结合其的吸附位点。一般提供填充在容器,例如柱中的介质,容器被设计为容纳介质,使其不被流动的血液带走(又称介质迁移)和允许血液流经基本所有的介质表面。制造吸附介质的有用的基质包括无孔刚性珠、颗粒或填充的网状泡沫体,刚性整体式床(monolithic bed)(例如通过烧结的珠或颗粒形成的),填充编织或非编织织物的柱,填充纱线或实心或空心致密(非微孔)单丝纤维的柱,由平面薄膜或致密膜形成的螺旋缠绕筒,或介质的组合,例如混合的珠/织物筒。用于本发明的一种合适基质是起初微孔性的但在(例如通过末端连接的肝素)产生吸附位点之前、之中或之后表面经处理后变得基本无孔的基质。
柱具有大孔结构,其对血液或血清呈现大表面积,同时避免大的压力降低和高剪切率。除了可能通过溶血损害血液以外,应当避免高的压力降低,因为其可关闭装备响应压力降低的自动关闭开关的体外循环。
基质也可采用致密膜,又称隔膜的形式。在此实施方案中,通过将肝素,硫酸乙酰肝素或另一种吸附性多糖和任选的不来源于肝素,硫酸乙酰肝素,或吸附性多糖的吸附组分一起结合至膜表面修饰无孔薄膜的表面。可选地,可通过用基本无孔的材料,例如聚合物在连接结合位点之前、之中或之后填充孔使微孔膜变得无孔或“致密”。薄片或(中空)纤维形式的膜可排列在外壳中以呈现用于在本发明的实践中适用的血液接触的大表面积。
2.1.珠作为基质
一种有用的基质是固体珠或颗粒的形式。“珠”可由足够刚性以在承受的流速下抵抗形变/压实的材料制造。抵抗形变是维持自由体积(freevolume)和随后的填充床“开关”的小幅压力降低所必需的。在基质块中基本缺乏可进入的孔,消除了吸附质在吸附前扩散进孔的需要。本发明的吸附位点主要在介质的表面上,如此放置使其对于主要通过对流运输递送到表面的血液中的吸附质易于接近。合适的基质在其表面上不需要完全的光滑,因为粗糙导致用于连接结合位点(例如通过肝素的共价或离子结合)的表面积的期望的增加。另一方面,很大程度上避免了具有分子尺寸的可进入的内部孔,以消除吸附质在与结合位点连接以前扩散进入孔中的需要。在本发明中可使用多种类型的珠。有用的珠应当具有足够的大小和刚性以避免在所述方法使用期间的形变/压实,并具有能够被肝素包被的足够的表面积,以用于所述方法。
足够的基质刚度的证据是在临床使用的一般速度下,在约一小时的水或盐水流期间穿过吸收床的压力降低没有显著增加:例如,当用类似流速的例如盐水测量时,相对初始压力降低(在流动的第一分钟内测量的)<10-50%的增加。
珠或其他高表面积基质可由若干不同的生物相容性材料,例如天然或合成的聚合物或基本不含可滤取杂质的非聚合材料,包括玻璃、陶瓷和金属制造。一些代表性聚合物包括聚氨酯,聚甲基丙烯酸甲酯,聚乙烯或乙烯和其他单体的共聚物,聚乙烯亚胺,聚丙烯和聚异丁烯。有用的基质实例包括无孔的超高分子量聚乙烯(Ultra High Molecular Weight PolyEthylene,UHMWPE)。其他合适的珠是聚苯乙烯,高密度和低密度聚乙烯,二氧化硅,聚氨酯和壳聚糖。
制造这些珠的方法是本领域已知的。聚乙烯珠和其他聚烯烃珠是在合成过程中直接产生的,通常无需进一步减少尺寸即可使用。其他聚合物可能需要研磨或喷雾干燥和分类,或经加工以产生期望的大小分布和性状的珠。
如上所述,为了用于本发明的方法,应当优化用于体外血液过滤的个体珠之间的通道或间隙空间的大小,以避免筒的入口和出口之间的大幅压力减少,允许血液细胞在高流速环境中的个体珠之间安全通过,和提供合适的间隙表面积用于使多糖吸附剂结合血液中的细胞因子或病原体。在用300微米、大致球形珠紧密填充的床中,合适的间隙孔径的直径是约68微米。有用的珠具有范围从约100至大于500微米直径的大小。珠的平均大小可从150-450微米。例如,来自Polymer Technology Group(Berkeley,USA)的具有0.3mm平均直径的聚乙烯珠是合适的。间隙孔是珠大小的函数。
为了使用,将合适的珠封装在容器,例如柱中。
下面描述基质的其他合适形式。
网状泡沫体具有开放的小室并可由例如聚氨酯和聚乙烯制造。可通过控制制造方法实现孔大小的控制。一般来说,网状泡沫体可为3-100孔/英寸并可展示≥66cm2/cm3的表面积。
可通过化学或物理方法将珠烧结为整体式多孔结构。可通过在筒中在其熔解温度以上加热珠并施加压力烧结聚乙烯珠。得到的间隙孔径比相同大小的非烧结珠的填充床的间隙孔径略有减少。可实验测定此减少并用于产生期望的最终间隙孔径。
柱或其他外壳形状可填充编织或非编织的肝素化织物,或在外壳已填满基质介质以后可连接肝素,硫酸乙酰肝素或任选的非肝素吸附位点,例如通过共价键、离子键或其他化学或物理键。通过在编织或针织期间或在制造非编织的网期间控制织物的纤维纤度(denier)和密度,可控制间隙孔径。有用的非编织织物可为毡合(fel ts)、熔喷或静电结成的网的形式,具有通过纤维的缠结和/或交叉纤维的粘附或凝聚维系在一起的随机取向。可用的编织织物具有更确定且非随机的结构。
柱可填充纤维或由纤维制造的纱线。聚乙烯和其他纤维可被拉成细的中空纤维或实心单丝纤维或复丝纱线,用把中空纤维膜安装在常规血液透析筒或血液氧合器中的相同方式可将其填充在筒中。在本发明中,在将肝素或其他吸附剂结合在外和/或内表面之前、之中或之后使原本多孔的中空纤维变得致密或无孔。来自Royal DSM的Dyneema 是由UHMWPE制造的高强度实心纤维。Dyneema可为肝素化的并填充在筒中以提供高表面积支持物,用于去除细胞因子和病原体。
螺旋缠绕筒包含与任选的间隔材料紧密缠绕在一起以避免相邻表面接触的薄膜或膜。膜可由聚合物例如聚氨酯,聚乙烯,聚丙烯,聚砜,聚碳酸酯,PET,PBT等制造。
2.2.吸附性多糖的连接
可通过多种方法,包括共价连接或离子连接将本发明的吸附性多糖结合到固体基质的表面。
本发明的吸附介质可包含与固体基质表面共价连接的肝素。可使用多种本来已知的方法将肝素连接至期望的基质,例如在Wendel和Ziemer的综述文章中描述的(H.P Wendel和G.Ziemer,European Journal of Cardio-thoracic Surgery 16(1999)342-350)。在一个实施方案中,肝素通过共价末端连接与固体基质连接。此方法通过减少或消除可能进入血流的肝素从基质表面的释放提高设备的安全性。要避免肝素被血液“滤出”和进入血液,因为这可增加出血和肝素引起的血小板减少的风险。
多糖,例如肝素与固体基质的共价连接相比非共价连接提供了对参数(如固定化分子的表面密度和方向)的更好的控制。发明人已证明这些参数对提供细胞因子或病原体与固化的碳水化合物分子的最佳结合是重要的。肝素在固体基质上的表面浓度可在1-10μg/cm2的范围中。共价末端连接的意思是,多糖,例如肝素通过肝素分子的末端残基与固体基质共价连接。也可在多个点上结合肝素。优选末端连接。
如果使用珠,在与多糖例如肝素,或其他化合物连接以前可对珠进行亲水化(hydrophilized)。制备珠的可能方法包括酸蚀、等离子体处理和暴露于强氧化剂例如高锰酸钾。
2.3.每克基质的多糖量
每克基质的多糖吸附剂的量可变化。在一个具体的实施方案中,如果使用珠,每克珠的多糖,例如肝素的量由使用的层数和珠的大小决定。珠越大,每克珠获得的多糖,例如肝素越少。优选的量是每次MBTH法2.0±0.5mg肝素/g珠。
在要求保护的方法中使用的多糖的分子量可变化。例如,天然肝素具有22kDa的平均分子量。硝酸分解的肝素具有8kDa的分子量。
3.具有不同表面功能的珠的混合物
肝素是可结合细胞因子,病原体和其他蛋白质的生物活性碳水化合物。但肝素最著名和最广泛的用途是作为避免血液凝结的抗凝剂。其作为可注射的、全身性抗凝剂已在临床上被安全使用了50年。另外,其作为医疗设备的涂料或表面处理已被制造商使用多年,用于改善医疗设备在血液接触应用中的安全性的唯一目的。在为了大量运输必须暴露大表面积于血液的设备中这特别重要。实例包括透析器和血液氧合器。在本发明中使用的吸附介质的表面为了2个目的包含肝素:1)肝素能够结合病原体,细胞因子和促成疾病的其他血源性物质,和2)肝素能够在接触外来的、例如人工制成的表面后避免血液凝固和相关反应。因此肝素是本发明的吸附介质的关键成分,因为其在从血液和其他生物液中去除有害物质的期间提供了有效性和安全性。
除了肝素和硫酸乙酰肝素以外,还有其他生物活性的化学部分(包括其他碳水化合物)可从血液和其他生物液中去除仅用固化的肝素不能有效去除的有害物质。例如,壳聚糖,一种高度阳离子型的正电荷碳水化合物会结合内毒素。其他正电荷分子,例如聚乙烯亚胺(PEI),也可结合内毒素。然而,阳离子型表面相比肝素化表面与血液较不相容,并可导致增加的促凝性,此为在血液接触设备中的一种危险情况。(见Sagnella S.,和Mai-Ngam K.2005,Colloids and Surfaces B:Biointerfaces,Vol.42,pp.147-155,Chitosan based surfactant polymers designed to improve blood compatibility on biomaterials和Keuren J.F.W.,Wielders S.J.H.,Willems G.M.,Morra M.,Cahalan L.,Cahalan P.,和Lindhout T.2003,Biomaterials,Vol.24,pp.1917-1924.Thrombogenecity of polysaccharide-coated surfaces)。尽管可以使用包含PEI,壳聚糖或其他固有形成血栓的(throbogenic)表面作为生物活性吸附剂的吸附药筒从血液中去除LPS或内毒素,由于严重的凝血风险,患者将需要高剂量的全身性抗凝剂。在全身性肝素的情况下,这可能导致出血风险和可能的血小板减少。
本发明的方法用肝素化介质和固有形成血栓的介质的混合物制备吸附床。通过用具有肝素化表面和,例如,阳离子型表面(或其他固有形成血栓的表面)组装的吸附药筒,细胞因子,病原体和内毒素均可从血液或生物液中安全地去除。
另一种有生物活性,但形成血栓的碳水化合物是唾液酸。已知唾液酸结合病毒凝集素,包括流感。(C,Mandal.1990,Experientia,Vol.46,pp.433-439,Sialic acid binding Lectins.)肝素化珠和唾液酸包被珠的混合筒可用于治疗患者,例如在流感流行期间。
腹部感染性休克通常由大肠杆菌(E.Coli)引起,这是一种革兰氏阴性菌。革兰氏阴性菌一般不结合肝素,因此使用除了细胞因子和/或内毒素以外还结合这些细菌的多功能吸附柱将是有用的。具有甘露糖序列的碳水化合物,例如已知甲基α-D--吡喃甘露糖苷结合大肠杆菌,肺炎克雷伯氏菌(K.Pneumonia),铜绿假单胞菌(P.Aeruginosa)和沙门氏菌(Salmonella)。(Ofek I.,和Beachey E.H.1,1978,Infection and Immunity,Vol.22,pp.247-254,Mannose Binding and Epithelial Cell Adherence of Escherichia coli和Sharon,N.2,1987,FEBS letters,Vol.217,pp.145-157Bacterial lectins,cell-cell recognition and infectious disease.)
此实施方案的使用是基于以下观念,即抗血栓形成表面和血栓形成表面的紧密接触或极为接近可避免临床上大量血栓的形成(如果单独使用固有形成血栓的表面则将发生)。在珠或颗粒形式的吸附介质的情况下,本发明的优选应用是在将其填充进筒或其他外壳以前,将不同的吸附介质混合在一起。这提供了相邻珠上的多种表面化学成分的紧密接触,同时允许有效制造吸附药筒或滤器。一种相关方法是把不同介质以“冻糕型(parfait-type)”排列分层堆积在外壳内,使得血液相继或以平行流接触不同介质。不同介质在筒内的一种排列是在筒的入口和/或出口处放置未混合的抗血栓形成介质,在入口和出口区之间插入包含更容易形成血栓的介质的任选混合的区域。在纤维形式的介质的情况下,可通过在纺织工业中熟知的从混合纤维形成织物的方法制备混合的编织、针织或非编织结构。可选地,可从较细的复丝纱线或由具有不同表面化学成分的2种或多种纤维制成的单丝制备纱线,只要一种纤维类型包含有效阻止在接触后血液凝结的表面。然后可使用混合纤维纱线制备用于血液接触的织物。可混合中空纤维或实心纤维吸附介质并用于制造类似中空纤维透析器或氧合器的筒。对用于螺旋缠绕吸附药筒类型的膜或薄膜型吸附介质,可使用彼此极为靠近的2种或多种表面化学成分,使血液必须(几乎)同时接触2种表面化学成分。这可通过在膜、薄膜表面层内的多种结合组分的有规律的或随机的阵列,或通过在2片间隔很近的薄、薄膜(其中之一是抗血栓形成的)之间形成血流通道实现。
4.用于本发明的方法的设备
本发明的另一个方面提供了包含吸附剂修饰的固体基质的设备用于从哺乳动物血液中体外去除细胞因子或病原体的用途,所述吸附剂对细胞因子或病原体具有结合亲和力。
在根据本发明的用途和方法中提及的设备可包含用于体外处理(例如患有肾衰竭的)患者的血液和血清的常规设备。
已知在用于体外循环的血液接触医疗设备中的局部血流模式通过剪切激活和在停滞区中的血小板聚集影响凝块形成。因此,在本发明的多个方面中使用的设备应被设计为不产生这些问题的形式。
在本发明的一些实施方案中使用的设备可例如具有以下性能:
在150-2000ml/min范围内的血流量,或如果用线性流速测量≥8cm/min。
低流阻。
具有固定在其上的碳水化合物的基质的大表面积,例如约0.1-1m2。
稳定的涂料(在与血液接触后没有临床上显著的碳水化合物泄漏到血液中)。
在设备中合适的血液动力学性能(无停滞区)。
最佳生物相容性。
可用于根据本发明的用途或方法的这样的设备的非限制性实例是儿科血流透析器,这是用于去除细胞因子分子的体外血液过滤设备,并且其兼容高流速。一种这样的设备可从Exthera Medical获得。也可使用其他型号或类型的用于体外处理血液或血清的设备,例如来自Gambro AB,Sweden的Prisma M10血液过滤器/透析器。
高流量条件可被定义为超过扩散限度的血流量。
5.细胞因子
如本文使用的,术语“细胞因子”的意思是例如与微生物感染或免疫有关而释放的蛋白质,其选自白介素,干扰素,趋化因子和肿瘤坏死因子。细胞因子的实例是血管细胞粘附分子(VCAM),抗凝血酶,激活调节的正常T细胞表达和分泌蛋白(RANTES),干扰素,肿瘤坏死因子α(TNF-α),肿瘤坏死因子β(TNF-β),白介素-1(IL-1),IL-8,GRO-α和白介素-6(IL-6)。
所述方法也提供了通过强吸附肝素结合分子,从血液中选择性去除细胞因子。一些分子相比其他分子对肝素具有更高的结合亲和力。例如,TNF-α对肝素具有高亲和力。
6.病原体
本发明的另一个方面提供了通过从哺乳动物血液中去除细胞因子和/或病原体治疗疾病的方法,所述方法通过使哺乳动物血液接触在上面的方法中公开的固体基质。可使用根据本发明的肝素化基质从血液中去除的病原体的实例包括:
病毒-腺病毒,冠状病毒,登革病毒,乙肝,丙肝,HIV,HPV巨细胞病毒,等等。
细菌-炭疽杆菌(Bacillus anthracis),肺炎衣原体(Chlamydia pneumoniaem),单核细胞增多性李斯特氏菌(Listeria monocytogenes),铜绿假单胞菌(Pseudomonas aeruginosa),金黄色葡萄球菌(Staphylococcus aureus),MRSA,化脓性链球菌(Streptococcus pyrogenes),小肠结肠炎耶尔森菌(Yersinia enterocolitica),等等。
寄生虫-Giardia lambitia,疟原虫属(plasmodium spp.)等等。
又见,Chen,Y.Gotte M.,Liu J.,和Park P.W.,Mol.Cells,26,415-426。
根据本发明可治疗的疾病的一个实例是脓毒症。脓毒症一般被视为对感染的全身性应答,其可导致器官衰竭并常导致死亡。此病症可由细菌、病毒、寄生虫或真菌感染引起。已知此病症在医院中特别危险,在医院中患者可能已经免疫受损。在脓毒症期间,患者经历所谓的细胞因子风暴(cytokine storm),且体内免疫系统攻击健康组织,导致在高度灌注的器官中的多器官衰竭。减少TNF-α和其他炎性分子将调节免疫应答并可作为器官保护策略。另外,在血液中的任意肝素结合病原体可被去除,这将帮助减少其进一步建群和可减少治疗感染所需的抗生素的量。通过降低与抗生素治疗相关的副作用风险,这可改善患者的安全。
本发明的方法可在其他常规治疗,例如施用抗生素以前或以后应用。
7.将本发明和其他过滤/分离步骤组合
在根据本发明的治疗方法的一个实施方案中,血液的取出和再引入可在连续的环路中进行,所述环路包含受试者血流的一部分。
在另一个方面,上述方法可与其他方法组合过滤或处理哺乳动物血液。例如,基于对流动力学的筒可与常规体外循环,例如CPB、血液透析和氧合串联使用。
8.实施例
在以下实施例中进一步描述本发明的多个方面。这些实施例不旨在限制。例如,在本实施例中使用肝素。然而,可单独使用其他碳水化合物和多糖吸附剂,或除了下面举例的肝素包被的基质以外还使用其他碳水化合物和多糖吸附剂。
8.1.实施例1
肝素柱的制备
具有0.3mm平均直径的聚乙烯(PE)珠(批号180153)由Polymer Technology Group(Berkeley,USA)提供,柱(Mobicol,1mL)从MoBiTec (Germany)获得。肝素和聚乙烯亚胺(PEI)分别购自Scient ific Protein Laboratories(Waunakee,Wisconsin,USA)和BASF(Ludwigshafen,Germany)。使用的所有化学品为分析级或更高。
如Larm等人(Larm O,Larsson R,Olsson P.A new non-thrombogenic surface prepared by select ive covalent binding of heparin via a modified reducing terminal residue.Biomater Med Devices Artif Organs 1983;11:161-173)描述的进行肝素在珠上的固定。
使用下述一般程序肝素化聚合物表面。
用氧化剂(高锰酸钾、过硫酸铵)蚀刻聚合物表面,以引入亲水特性和一些反应官能团(-SO3H,-OH,-C=O,-C=C-)。也可用等离子体或电晕蚀刻表面。例如,用氧化剂(在硫酸中的高锰酸钾)蚀刻PE-珠。这些亲水化珠特别包含OH-基和双键,在以后用作对照。
用聚胺,聚乙烯亚胺(PEI)或壳聚糖处理引入反应性氨基官能团。为了某些目的,可通过用双功能试剂,例如巴豆醛或戊二醛交联在表面上稳定聚胺。
通过用硫化多糖(硫酸葡聚糖或肝素)离子交联进一步稳定涂料。如果必要,重复这些步骤并建立夹心结构。在每一步之间应进行小心的漂洗(水,合适的缓冲液)。在最后加入PEI或壳聚糖之后,利用天然肝素还原性末端残基中的醛官能团,通过还原胺化进行与天然肝素胺化表面的末端连接(EPA)。
通过肝素的部分亚硝酸降解(nitrous degradation)可获得在还原性末端残基中的反应性更强的醛官能团。这会缩短反应时间,但固化的肝素将具有较低的分子量。连接通过还原胺化(氰基硼氢盐,CNBH3-)在水溶液中进行。
在此可选方法中,在醋酸缓冲液(800ml,0.1M,pH 4.0)中悬浮胺化介质并加入4.0g亚硝酸分解的肝素(来自Pharmacia,Sweden的肝素)。在摇晃0.5h后,加入NaBH3CN(0.4g)。摇晃反应混合物24h,然后如上处理,得到肝素化介质。
1-10μg/cm2肝素可连接至所有亲水表面,如玻璃,纤维素,几丁质等,和几乎所有疏水聚合物,如聚氯乙烯,聚乙烯,聚碳酸酯,聚苯乙烯,PTFE等。
得到的具有共价末端连接的肝素的PE-珠用氧化乙烯(ethylenoxide,ETO)灭菌并用0.9%氯化钠和超纯水漂洗。使用MBTH法测的肝素的量为2.0mg肝素/g珠。(Larm O,Larsson R,Olsson P.A new non-thrombogenic surface prepared by selective covalent binding of heparin via a modified reducing terminal residue.Biomater Med Devices Artif Organs 1983;11:161-173和Riesenfeld J,Roden L.Quantitative analysis of N-sulfated,N-acetylated,and unsubst ituted glucosamine amino groups in heparin and related polysaccharides.Anal Biochem 1990;188:383-389).
使用的聚乙烯珠具有0.3mm的平均直径,并使用保证肝素分子共价末端连接至表面的技术进行肝素化,因此使对肝素/硫酸乙酰肝素具有亲和力的蛋白质更易接近碳水化合物链。固化的肝素的平均分子量为约8kDa,且每克珠连接2mg(等于约360IU)。通过如预期地去除流经肝素化,而不是非肝素化珠的血液中75%的抗凝血酶(AT)浓度验证了此表面的完整性。
这些数据与Bindslev等人公开的在脓毒症患者中使用表面肝素化的氧合器的体外肺辅助的之前的观察结果良好吻合。(Bindslev L,Eklund J,Norlander O,Swedenborg J,等人Treatment of acute respiratory failure by extracorporeal carbon dioxide elimination performed with a surface heparinized artificial lung.Anesthesiology 1987;67:117-120.)
8.2.实施例2
患者
研究方案经卡罗林医学大学医院(Karolinska University Hospital)的当地伦理委员会批准,并从每位患者处得到签署的知情同意。从3位脓毒症(发热>38℃,发冷,白细胞>12x 109细胞/L)患者(2M/1F,年龄为43,56和68岁;表1)的血液透析器中抽取动脉血。
表1.献血患者的临床表征
以前对患者施用了广谱抗生素(头孢他啶或头孢呋辛,同时使用氨基糖苷类;每种1个剂量)和肝素(200IU/kg透析开始时的体重)。在EDTA真空管中收集血液并立即转移至相邻的房间中,对以前制备好的柱应用1mL血液并以1,5和10mL/min之一的流速通过柱,使用滚轮泵(roller pump)。在另一端立即收集通过柱的血液并冷冻离心(4500G)。随后收集上清并冷冻在-80℃用于以后的分析。
8.3.实施例3
细胞因子的定量分析
使用读板仪(Multiskan Ascent)用光致发光测量细胞因子的量。每个样品在3个孔中测量,使用几何平均数用于分析。所有试剂盒的测定内变异系数低于8%。我们使用了Coamatic抗凝血酶试剂盒(Haemochrom,货号8211991),Quantikine人IL-6(R&D Systems,货号D6050),Quantikine 人IL-10(R&D Systems,货号D1000B),蛋白质C抗原检测96(HL Scandinavia AB,产品号H5285),人CCL5/RANTES Quant ikine(R&D Systems,货号DRN00B),Quantikine人sVCAM-1(CD106)(R&D Systems,货号DVC00),Quantikine人IFN-γ(R&D Systems,货号DIF50),Quantikine HS TNF-α/TNFSF1A(R&D Systems,货号HSTA00D)和BD OptEIA人C5a ELISA试剂盒II(BD Biosciences,货号557965)。
统计学评估
使用成对Kruskal-Wallis检验比较每种细胞因子在过柱前和后的血液浓度,双侧p-值小于0.05指示显著。结果总结在表2中。
表2.在血液通过不同柱之前和之后测量的细胞因子浓度
细胞因子结合
分析的细胞因子在过柱前和后的浓度显示在表2和图1中。简单地说,相比非肝素化珠,通过肝素化珠导致血液VCAM和TNF的显著更大的减少。
珠体积的影响
使用1:1和1:10的血液:珠的体积得到的数据没有显著变化(表2)。
流速的影响
将血液流速从1变至最大10mL/min没有显著影响去除的各个细胞因子的量,表明观察到的与固化肝素分子的结合是非常快的事件,明显不依赖于扩散动力学。
8.4.实施例4
在此实施例中用临床尺寸的筒检测了5升加入重组TNF-α的血小板贫乏血浆。如在实施例1中描述的,用肝素化PE珠填充300ml筒。使用ETO灭菌,使用16小时周期和50度的温度灭菌设备。在研究开始前,允许设备“排气(gas out)”额外12个小时。
从Innovative Research处购买5.1L冷冻的、未过滤的猪肝素化血小板贫乏血浆,并贮存在-20度冰箱中直至使用日。从Invitrogen处获得粉末形式的1mg重组人肿瘤坏死因子-α。
进行程序当天上午从-20℃冰箱中取出血浆并置于温水浴中解冻。将1ml无菌水与1mg粉末状TNF-α混合以重构1mg/ml的浓度。
在Fresenius 2008K透析机上以封闭的系统设置安装“Combiset”血液透析管道(在Fresenius机器上使用的标准管道),用seraph滤血器代替Fresenius Kidney。将5L血浆转移进5L储存袋中,储存袋与动脉和静脉患者线连接。用盐水预处理透析机和管道以保证正常功能和没有空气通过封闭的循环。
将5L血浆袋置于周围包裹Bair Hugger保温毯的板式摇床(plate rocker)上,包裹保温毯以在程序进行期间维持温度。此时收集输注前(pre-infusion)的对照样品并置于液氮中速冻。然后将样本转移至样品储存盒并置于干冰上。在确认了所有连接后,将0.415ml TNF-α注入储存袋的端口。在收集输注后对照样品之前,允许具有TNF-α的血浆在摇床上混合10分钟。收集输注后样品,在液氮中速冻,然后移至干冰上的样品储存盒中。用盐水清洗透析系统,当血浆通过封闭系统时开启系统时钟。在5分钟时从滤器上游收集首个样品。
在试运行的第1个小时中,从滤血器的紧接上游和紧接下游的端口每隔5分钟收集样品。在液氮中速冻样品,并置于干冰上的样品储存盒中。
在试运行的第2和第3个小时中,从滤血器的紧接上游和紧接下游的端口每隔10分钟收集样品。在液氮中速冻样品,并置于干冰上的样品储存盒中。
在试运行的第4和第5个小时中,从上游和下游的端口每隔20分钟收集样品。也在液氮中速冻这些样品,并置于干冰上的样品储存盒中。
在每个时间点的上游和下游两处的每次样品收集时,使用新的针和新的注射器以避免残留的TNF-α。
进行ELISA监控血浆中的TNF-α的量。为了包被96孔板,在10μL包被缓冲液A中稀释10μL捕获抗体,每孔加入100μL。用封口膜覆盖板,4℃储存过夜或整个周末。从-80℃冰箱中取出样品,记录并解冻。从4℃冰箱中取出板,吸去孔中的液体,用400μL/孔测定缓冲液洗一遍,然后颠倒并在吸水纸巾上吸干。每孔加入300μL测定缓冲液,将板孵育60分钟。在这期间,通过在测定缓冲液中稀释,从CytoSet包含的TNF-α标准物制备标准物。在测定缓冲液中稀释解冻的样品。一旦样品被稀释,它们在冷藏盒中的合适位置中被替换并放回-80℃冰箱,如记录所指示。用400μL/孔测定缓冲液再次洗涤平板,颠倒和吸干。根据ELISA模板表将100μL置于孔中。一式两份测定样品和标准品,在每块板上包含标准曲线。在5.49mL测定缓冲液中稀释8.8μL检测抗体,在加完所有样品和标准品后对每孔加入50μL。在定轨振动器上在室温孵育板2小时。如上述洗涤和吸干板5次。在10mL测定缓冲液中稀释链霉抗生物素缀合物(16μL),每孔加入100mL。在定轨振动器上在室温孵育板30分钟,然后如上述用测定缓冲液洗5次。每孔加入100μLTMB溶液,在定轨振动器上再孵育板30分钟。每孔加入100μL终止溶液,在加入终止溶液后30分钟内在Vmax读板仪上在450nm处读板。
检测结果标绘在图1中。在富含TNF血清的40分钟的连续循环内,观察到80%的TNF减少,没有后续释放。在理想地混合后,血浆中的所有TNF将在33分钟内通过吸附柱。在此时期中捕获了大多数TNF证明了基于对流动力学通过吸附去除了TNF-α。
8.5.实施例5
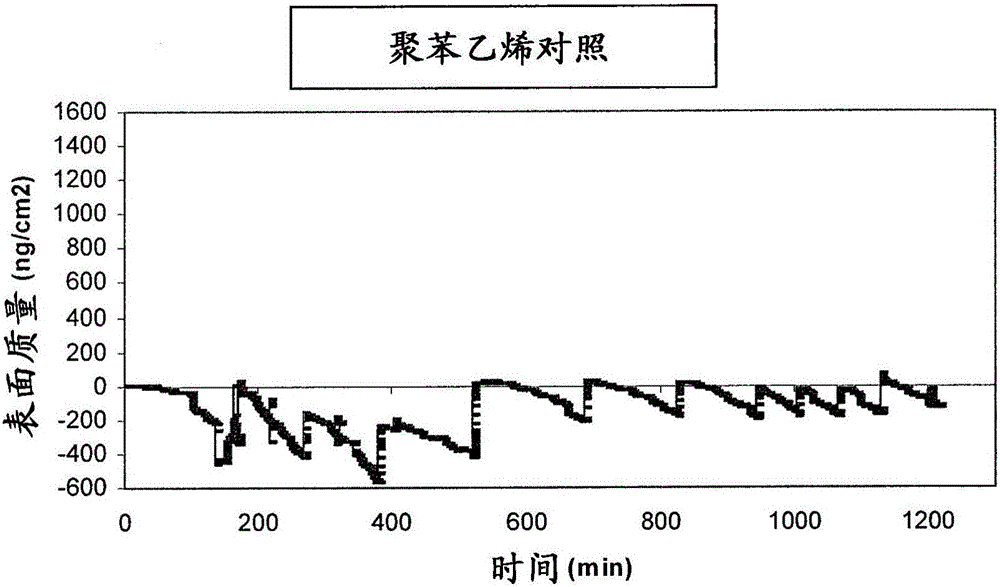
进行了石英晶体微天平(QCM)实验,以尝试标准化TNF-α与肝素化表面的非竞争性结合能力。QCM是一种可检测在特别制备的晶体上的吸附剂重量的技术。最小检测极限是0.5ng/cm2。QCM检测晶体的共振频率。因为晶体的质量随吸附而增加,共振频率的变化与质量的增加成比例。以下方程描述了质量变化(Δm)
n-泛音(overtone)
其中Δf是频率的变化。
根据实施例1中描述的方法肝素化聚苯乙烯包被的QCM晶体。制备了120ml溶液,其中将重组TNF-α加入PBS以得到83μg/L的终浓度。然后溶液以50μl/min的速度通过含有4个QCM晶体的小室。2个晶体是肝素化的,2个晶体是对照晶体(未处理的聚苯乙烯)。实验总时间是20小时。在肝素化晶体和对照晶体上吸附的TNF-α的量的结果显示在图2中。在肝素化晶体上最多吸附了1234ng/cm2的TNF-α,在对照表面上的吸附可以忽略不计。
8.6.实施例6
进行了下述研究,检测使用肝素化珠从采集自感染炭疽杆菌的猕猴的血浆中去除细胞因子。在若干动物死亡时收集血浆并合并。1ml过滤注射器填充0.5克根据实施例1中概述的程序肝素化的PE珠、或用作对照的未处理的PE珠。共使用3个样品注射器和3个对照注射器。在珠顶部放置顶部多孔板以避免在对过滤注射器加入盐水或血浆时使珠漂浮。使用2ml Tris缓冲的盐水(TBS)预处理过滤注射器。使用5ml注射器使2ml盐水通过滤器。然后缩回5ml注射器的活塞并填满4ml空气。然后使空气通过过滤注射器以将残留的盐水推出珠外。然后将0.5ml血浆吸入5ml注射器并随即推过过滤注射器。使另外4ml空气通过过滤注射器以去除任何残留血浆。在将血浆从注射器排空以后,取样等分试样并速冻,用于细胞因子浓度分析。使用Multiplex测定检测GRO-α,IL-8,MIP-1β,Rantes,和TNF-β。结果总结在表3中。
表3.
8.7.实施例7
使用分层组装的结合细胞因子和内毒素的药筒
使用2种不同的吸附介质制造药筒(cartridge)。使用肝素化珠捕获细胞因子和使用PEI珠捕获内毒素。通过控制肝素化珠与PEI珠的比例,可维持血液相容性。根据实施例1中的头2个步骤制造PEI珠。
在此实施例中,使用肝素化珠和聚乙烯亚胺(PEI)包被珠制造筒。在直立的支架(stand)上固定300ml吸附柱。然后加入50ml平均300微米的肝素化珠至筒中并允许其沉降。然后加入50:50的PEI珠和肝素化珠的混合物组成下一个200ml。然后用最后的50ml肝素化珠填充筒。然后密封筒,珠的紧密填充维持吸附介质的分层结构。在此筒中,2/3的珠是肝素化的,而1/3是胺化的,因此是固有形成血栓的。
8.8.实施例8
使用珠的一致混合物的结合细胞因子和内毒素的药筒
使用2种不同的吸附介质制造筒。使用肝素化珠捕获细胞因子,使用PEI珠捕获内毒素。通过控制肝素化珠与PEI珠的比例,可维持设备的总体血液相容性。
在此实施例中,使用肝素化珠和PEI包被珠制造筒。在直立的支架(stand)上固定300ml吸附柱。将100ml PEI包被珠加入200ml肝素化珠并充分混合。然后将300ml珠加至筒中并密封。珠的紧密填充维持珠的随机混合。在此筒中,2/3的珠是肝素化的,而1/3是胺化的。
8.9.实施例9
分层组装的结合细胞因子、革兰氏阴性菌和内毒素的药筒
使用3种不同的吸附介质制造筒。使用肝素化珠捕获细胞因子,使用甘露糖功能化珠捕获革兰氏阴性菌,使用PEI珠捕获内毒素。通过控制肝素化珠、甘露糖功能化珠与PEI包被珠的比例,可维持血液相容性。
在直立的支架(stand)上固定300ml吸附柱。然后加入50ml平均300微米的肝素化珠至筒中并允许其沉降。然后加入具有等量肝素化珠、PEI珠和甘露糖功能化珠的200ml珠至筒中。然后用最后的50ml肝素化珠将筒填满至顶部。然后密封筒,珠的紧密填充维持吸附介质的分层结构。在此筒中,55.6%的珠是肝素化的,22.2%是PEI珠,和22.2%是甘露糖功能化的。
在以下的权利要求书中进一步描述本发明的实施方案。
- 还没有人留言评论。精彩留言会获得点赞!