促神经修复管及其制备方法与流程
本发明涉及生物工程和生物医学领域,具体涉及促神经修复管及其制备方法。
背景技术:
目前各种外伤如压迫、牵伸、撕裂、切断等原因造成神经系统的部分或全部损伤,从而神经导致功能丧失和其他神经性疾病。对于出现损伤的神经,神经的神经元轴突在适当的情况下可以再生。借助神经外科特别是微神经外科的发展,神经损伤的修复和再生已成为可能。目前研究和临床上应用的神经修复技术主要有:直接缝合、神经移植(自体移植或异体移植)以及通过促神经修复管修复。直接吻合只限于较短的神经断伤(小于5mm),否则会存在吻合张力,不利于神经再生;神经移植和促神经修复管主要用于长截断的神经修复,但是神经移植由于受到供体的限制、免疫反应等,难以普遍使用;神经修复管能够提供一个良好的微环境促进周围神经的修复,在临床中已经得到了较大范围的应用。目前临床中使用最多的是一种硅胶管,能够引导神经束从神经缺损部位的近端向远端生长。但是临床结果显示,由于硅胶管是一种不能降解的材料需要二次手术取出,带来二次神经损伤;形状很难与病人的损伤部位完全匹配;并且生物活性较低;相比于神经移植病人不能得到很好的功能恢复。
技术实现要素:
为了解决本领域存在的上述问题,本发明提供了一种促神经修复管。
该促神经修复管是甲基丙烯化明胶的溶液形成凝胶制得的中空管。
其中,上述促神经修复管的管壁上附着有脂肪干细胞。所述管壁上附着有脂肪干细胞是指至少一侧管壁附着有脂肪干细胞。
进一步的,上述促神经修复管为将甲基丙烯化明胶的溶液注入促神经修复管模具中制得。
本发明同时还提供了制备促神经修复管的方法,其特征在于包括以下步骤:
a、分别准备甲基丙烯化明胶的溶液和促神经修复管模具;
b、将甲基丙烯化明胶的溶液注入模具中,待形成凝胶,取下模具,冻干得到促神经修复管;
c、将脂肪干细胞悬液滴加到步骤b制得的促神经修复管的壁上,在孵箱中孵育0.5h~1h,使细胞充分贴附在促神经修复管上,即得。
其中,上述的甲基丙烯化明胶溶液的浓度为5%~10%w/v。
进一步的,上述方法步骤b中,在甲基丙烯化明胶的溶液注入模具前,需加入过硫酸铵至含量为0.1%~0.5%w/v和四甲基乙二胺至含量为0.05%~0.2%w/v,充分混匀得到混合溶液。本中发明中的w/v为化学上常用的浓度计量单位,指的是每毫升加入的物质的质量,如0.5%是指1mL的溶液加5mg的量。
其中,上述方法步骤b中:将得到的混合溶液迅速注入已经放置于-20℃~0℃的模具中;充分反应形成凝胶后,在室温解冻,取下模具。
其中,上述方法步骤b取出模具后得到的促神经修复管需进行冻干处理。上述的冻干处理为处理至去除促神经修复管中的水分。
其中,上述方法步骤c在孵箱中孵育后,在神经管上加培养基后,再继续培养2~6小时得到促神经修复管。
其中,上述促神经修复管的模具为通过3D打印制得的个性化间接促神经修复管模具或金属间接促神经修复管模具。
其中,上述方法中所述的脂肪干细胞悬液的浓度为1×107~1×108个/mL。
了上述制备得到的促神经修复管。
本发明的有益效果在于:本发明通过间接3D技术,制备了一种可降解的明胶衍生物(GelMA)促神经修复管,并且可添加脂肪干细胞。实验表明,脂肪干细胞化的促神经修复管能够定向引导神经生长,减少疤痕组织和神经瘤的生长,提供一个神经生长良好的微环境。脂肪干细胞的存在能够释放促神经生长因子,加快周围神经的形貌和功能性恢复。本发明的GelMA促神经修复管具有良好的生物相容性和一定的机械强度,随着时间推移,促神经修复管会逐步分解,避免了神经管对神经的后继压迫和引发炎症,也避免二次手术,具有很好的临床应用前景。
附图说明:
图1、通过3维软件(soildwork)和3D打印机制备了促神经修复管模具。
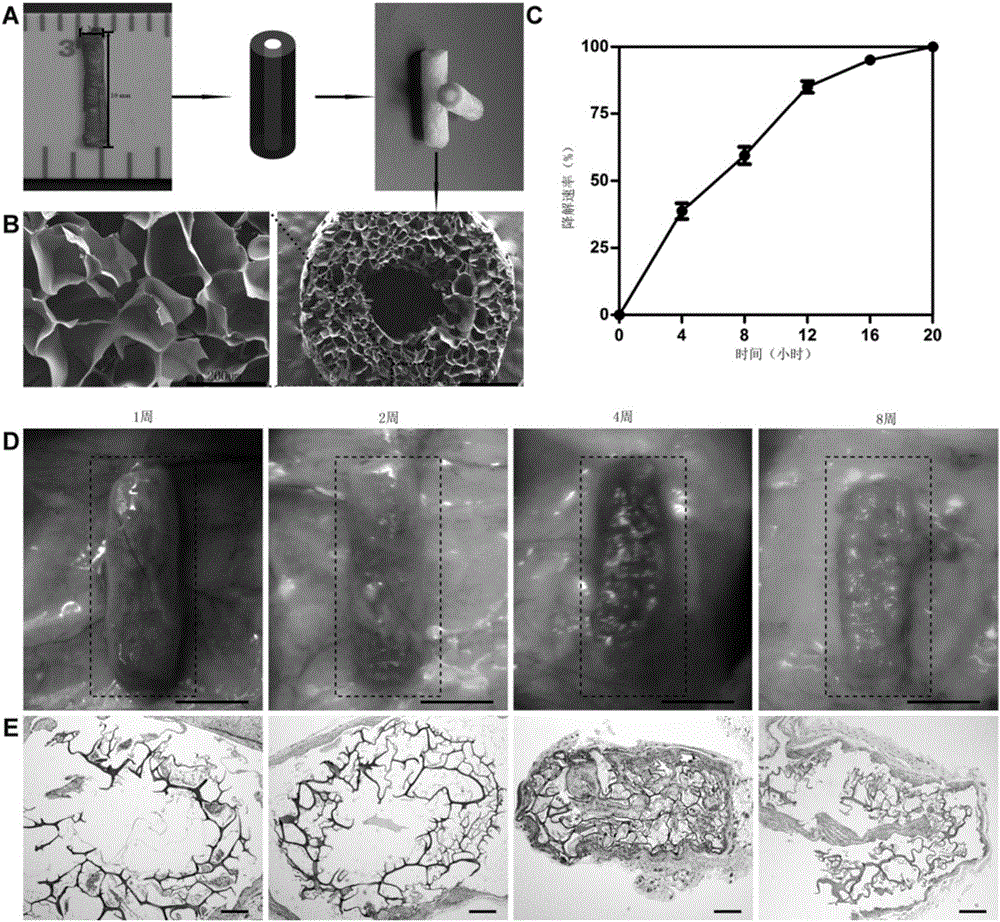
图2、制备的神经管的物理化学表征。A根据大鼠的坐骨神经制备了促坐骨神经修复管。B为扫描电镜图;C在胶原酶作用下的体外降解;D和E 1-8星期的皮下降解及H&E图。由图可知我们制备得到的促神经修复管是一种多孔状的可降解的生物材料,且有好的生物相容性。
图3、对在促神经修复管上培养了2天的脂肪干细胞做Live/dead的染色(A),罗丹明鬼笔环肽染色(B)。C图为脂肪干细胞在培养皿中培养2天后的SEM图,D图为脂肪干细胞在促神经修复管中培养2天后的SEM图,E图通过不同的时间点计算在培养皿和促神经修复管中细胞的增殖状态。F图中为脂肪干细胞在培养皿和促神经修复管中培养两天后神经营养因子的释放状态。从图中可以看出脂肪干细胞能够在GelMA促神经修复管中生长并且增殖。在促神经修复管能够促进脂肪干细胞分泌神经营养因子。
图4、不同手术组后在2,4,8,16周的坐骨神经指数。由图可见促神经修复管的加入有利于神经功能恢复,并且加上脂肪干细胞后能加速神经的功能性恢复。该图说明促神经修复管加上脂肪干细胞能够促进神经的功能性恢复。
图5、不同手术组后在4,8,16周的坐骨神经传导速率。由图可见促神经修复管的加入有利于神经功能恢复,并且加上脂肪干细胞后能加速神经的功能性恢复。
图6、A和B手术图,在坐骨神经上产生1cm的,再接上促神经修复管(或者促神经修复管+脂肪干细胞),C,D,E,F为在16周后,神经的恢复状态的直观图。(C假手术组,D为为自体神经移植,E为促神经修复管,F为促神经修复管+脂肪干细胞组)。
图7、A,B,C,D分别为假手术组、自体神经移植组、促神经修复管组、促神经修复管+脂肪干细胞组的腓肠肌的H&E图;E为不同组别的肌肉纤维的平均直径。F为实验手术组与假手术组的腓肠肌的湿重比。
具体实施方式:
本发明通过间接3D技术,制备了一种可降解的明胶衍生物(GelMA)促神经修复管,也可叫神经导管,并且可添加脂肪干细胞。
该神经修复管是甲基丙烯化明胶的溶液形成凝胶制得的中空管。上述促神经修复管为将甲基丙烯化明胶的溶液注入促神经修复管模具中制得。其中,该促神经修复管的至少一侧管壁附着有脂肪干细胞。
该制备促神经修复管具体可按以下方法制备:
a、分别准备甲基丙烯化明胶的溶液和促神经修复管模具;
b、将甲基丙烯化明胶的溶液注入模具中,待形成凝胶,取下模具,冻干得到促神经修复管;
c、将脂肪干细胞悬液滴加到步骤b制得的促神经修复管的壁上,在孵箱中孵育0.5h~1h,使细胞充分贴附在促神经修复管上,即得。
甲基丙烯化明胶溶液的浓度为使形成凝胶的强度合适并且能够在合适的时间降解即可。5%~10%w/v的浓度能够满足需要。
进一步的,上述方法步骤b中,在甲基丙烯化明胶的溶液注入模具前,需加入过硫酸铵和四甲基乙二胺,得到混合溶液,将得到的混合溶液迅速注入模具中,以反应形成凝胶。APS的作用是产生自由基,使GelMA中的碳碳双键反应。而TEMED起到促进APS产生自由基,加速反应的作用。模具一般放置-20℃~0℃环境下,待充分反应形成凝胶后,在室温解冻,取下模具。
取出模具后得到的促神经修复管最好进行冻干处理,尽量去除促神经修复管中的水分。
步骤c在孵箱中孵育后,还可以在促神经修复管上加培养基,再继续培养2~6小时得到得到细胞化的促神经修复管。这样细胞在管壁上附着得更好,活性会更强。
制备促神经修复管的模具可为本领域的各种常用模具。其中,为了与使用目标的神经形状更为匹配,模具可选用通过3D打印制得的个性化间接促神经修复管模具或金属间接促神经修复管模具。
制备时使用的脂肪干细胞悬液的浓度一般调整到1×107~1×108个/ml。
此外,本发明还提供了上述制备得到的促神经修复管。
以下通过具体实施方式对本发明进行更进一步的说明。
实施例一、构建促神经修复管模具
通过3D打印机设计和制备促神经修复管模具,进而可以制备得到促神经修复管。
在本次试验中先对大鼠坐骨神经直径进行测量,200~250g的大鼠坐骨神经直径约1.2~1.3mm,考虑到周围神经损伤后神经肿胀等因素,为大鼠坐骨神经损伤定制的促神经修复管约内径为1.5mm,导管外径为4mm(管壁厚度为1.25mm)。通过SolidWork软件设计出并采用桌式打印机(TD ARTIST)打印与促神经修复管匹配的模具,参见图1。
实施例二本发明促神经修复管的制备
1、准备甲基丙烯化的明胶(GelMA)
(1)、在60℃下,将A型明胶(购自Sigma公司,货号:G1890)以10%(W/V)的浓度完全溶于磷酸盐缓冲液中(PBS);
(2)、逐滴加入甲基丙烯酸酐,使其浓度为20%(v/v),在50℃下充分反应1小时;
(3)、用5倍体积的PBS(40℃)稀释以终止上述反应;
(4)、将反应产物在40℃下透析2周,然后在冻干机中冻干,在-20℃下保存。
2、制备个性化促神经修复管
(1)、在60℃,将GelMA完全溶于蒸馏水中,制成5%(w/v)的溶液,即每1mL的溶液溶解50mg GelMA;
(2)、将完全溶解的GelMA置于冰上5分钟,然后加入过硫酸铵(APS;购自Sigma公司)至0.5%(w/v)和四甲基乙二胺(TEMED;购自Sigma公司)至0.1%(w/v),充分混匀;
(3)、将上述混合物迅速注入已经放置于-20℃冰箱的模具中;
(4)、冻存24小时,充分解冻,取下模具后将促神经修复管用双蒸水充分洗净,然后冻干并在-20℃下保存备用。
3、促神经修复管的表征
用上述方法制备测定大鼠右侧坐骨神经并设计和制备了促神经修复管,然后对制备的促神经修复管进行表征(结果参见图3)。
结果表明
(1)、扫描电子显微镜示制备的促神经修复管有孔隙结构,孔的大小约167±13.5um,孔隙率89.3%±1.04%,溶胀率9.47±1.00;
(2)通过将促神经修复管放在1mg/mL的二型胶原酶中,通过在不同的时间点神经管的质量与原始神经管的质量做比较,发现促神经修复管在体外大约20小时完全降解。然后将促神经修复管埋植在大鼠背部皮下,在不同的时间点通过埋植部位的H&E图片和肉眼观察,发现促神经修复管在体内完全降解时间为2~4个月。
(3)、将没有添加脂肪干细胞的促神经修复管埋植到大鼠的背部皮下,在1、2、4、8周取下埋植的神经管做H&E染色,结果显示,促神经修复管的周围只具有少量的炎症细胞。说明该促神经修复管引起的炎症反应较小,具有良好的组织相容性。
4、制备细胞化的促神经修复管
在上述步骤3的基础上,本发明试图在促神经修复管上附着脂肪干细胞,附着方式采用新的方式,及滴加的方式制备细胞化的促神经修复管,结果参见图4。
具体步骤为:
(1)、从大鼠腹股沟脂肪组织中分离得到脂肪干细胞,在完全培养基(DMEM低糖+10%胎牛血清)中培养,使其体外充分扩增;
(2)、收获脂肪干细胞,取部分之前制备的促神经修复管,在每一根促神经修复管上滴加30μl总共含1×106脂肪干细胞的细胞悬液在孵箱中孵育1小时,使细胞充分贴附在促神经修复管上;
(3)、将含有脂肪干细胞的促神经修复管再继续完全培养3小时,使用移液器添加500uL的DMEM液体培养基(包含10%的胎牛血清,购买于Invitrogen公司),使脂肪干细胞充分贴附生长,得到细胞化的促神经修复管。
实施例三、本发明促神经修复管的体内效果试验
选取成年大鼠(体重200~250g)构建模型,来评估促神经修复管修复周围神经。
将大鼠分成4组接受功能评估,分别为假手术组、自体神经移植组、促神经修复管组、促神经修复管+脂肪干细胞组。
手术操作为对大鼠进行腹腔注射水合氯醛(0.5毫升/100克)进行麻醉。将大鼠后身毛去除,在坐骨神经处切开1毫米与股骨平行的伤口,将肱二头肌分开,露出坐骨神经,手术部位约在距离分叉神经5mm处。
假手术组不剪断神经;自体神经移植组为距离分叉神经5mm~15mm处分别剪断缝合;促神经修复管组为在距离分叉神经5mm~15mm处剪断1cm的神经,然后将无脂肪干细胞的促神经修复管缝合在两端;促神经修复管+脂肪干细胞组为在距离分叉神经5mm~15mm处剪断1cm的神经,然后将加了附着有脂肪干细胞的促神经修复管缝合在两端。
通过组织学,坐骨神经指数,电生理等方式检测各组指标,结果参见图4~图7以及附图说明。通过实验结果分析,随着时间的延长,使用脂肪干细胞+促神经修复管的大鼠在功能评估的坐骨神经指数和神经传导速率都越来越接近自体神经移植组,说明这种促神经修复管在动物实验中具有较好的结果,在临床上有很好的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!