一种大鼠劳损性膝骨关节炎模型建立的方法与流程
本发明属于医药生物技术领域,涉及运动医学、骨关节疾病与行为学功能学研究、组织工程和细胞治疗,特别涉及一种大鼠劳损性膝骨关节炎(knee osteoarthritis,KOA)模型的建立方法。
技术背景
KOA是一种在中老年群体中十分常见的,病因复杂,并以膝关节软骨劳损及退行性病变为主要特征的关节病,可以引起关节滑膜组织、软骨及软骨下骨结构破坏并产生一系列病理变化,给患者带来延绵不断的痛苦。其确切的发病机制至今尚未探究清楚,但研究发现其疾病相关的危险因素包括年龄、急性或慢性生物力学作用、关节软骨或骨肿瘤以及软骨微环境的代谢紊乱等。而关节的急性或慢性生物力学改变及周围韧带的稳定性变化可能是引起其关节软骨病理改变的首要因素。关节软骨组织的微环境调节主要靠软骨细胞外基质的分泌和排泄功能,其调节软骨组织损伤与修复的动态平衡一旦被打破,则会造成关节软骨的修复失衡,导致严重的病理改变,其修复的组织也为纤维增生组织,而不是正常的透明软骨组织。其损伤修复调节的主要因素包括细胞内分子作用(相关激酶级联作用、自我吞噬作用、转录因子、表观遗传学因素和miRNA相应的旁分泌作用等)和细胞外的刺激作用(细胞因子、激素、生物机械应力作用等)。这些调节因素的失衡或异常改变均会造成关节软骨骨性关节炎的发生,随着疾病的发展,疾病会从滑膜炎和软骨炎延绵至整个关节的严重炎症反应,导致软骨组织的大量破坏,纤维组织重度增生,新生血管和微环境代谢的紊乱,从而引起软骨组织的慢性自我纤维化修复,以及给患者带来连续剧烈的疼痛。
模拟KOA疾病的动物模型颇多,主要以鼠和兔为模型对象,大致可分为三大类,即:(1)自发型KOA动物模型,包括天然自发型和转基因动物模型等;(2)诱发型KOA动物模型,即实验动物在人为干预的因素下(如药物、冷刺激、生物力学等)诱导产生实验动物的KOA;(3)手术方法KOA动物模型,包括半月板摘除术、前后交叉韧带横断术及Hulth模型等。目前由于自发型KOA动物模型成本较高,且建模时间太长,所以大鼠的KOA实验造模多采用Hulth模型及其改良模型。虽然这些模型能造成相应的病理学改变,但与KOA发病原因、机理和临床上劳损性膝关节软骨损伤所致的骨性关节炎进展过程不尽相符,明显存在模型损伤程度控制困难等问题,并且修复治疗评价也受模型制备中多种组织不可逆性损伤因素影响极大。
技术实现要素:
为克服现有技术的不足,本发明所要解决的技术问题是提供一种高效的、能高度模拟临床KOA发病机制与过程的KOA动物模型建立的方法,为研究KOA的发病机制及治疗手段奠定基础。
一种大鼠劳损性KOA模型建立的方法,其具体步骤如下:
第一步:大鼠称重后,按0.5ml/100g剂量腹腔内注射7%水合氯醛麻醉,观察记录大鼠呼吸情况;选取右膝关节,备皮,络合碘消毒,酒精脱碘,用小尖刀沿髌韧带内侧缘切开皮肤,切口为2.0~3.0cm。再用眼科剪打开关节囊,钝性分开髁间窝处的脂肪垫组织以暴露髁间窝直致可以肉眼观察到内侧副韧带、前交叉韧带;术中少量出血,用无菌纱布按压止血,使手术视野更佳清晰,同时用生理盐水浸湿的纱布保持关节腔内湿润,将髌骨向外侧脱位,以扩大手术视野,尽量屈曲膝关节显露前交叉韧带,在直视下切断前交叉韧带,行抽屉试验确认前交叉韧带是否已完全切断;
第二步:手术创口使用无菌生理盐水冲洗干净后,用纱布处理手术部位,将外脱位的髌骨复位,行双层缝合,用4.0可吸收线独立缝合关节囊,以5.0丝线间断缝合伤口;术后一次性肌注青霉素1ml抗感染,4万U/ml,待SD大鼠清醒后按10mg/kg曲马多止痛,再将SD大鼠按编号分笼后,放回清洁动物室,让其自由活动及进食;
第三步:术后三天,大鼠疼痛缓解后,在实验动物跑台上适应性运动三天,跑步时使用自制束缚带交叉法束缚其胸部牵引使其直立于跑步机上,前肢支撑于横栏上,并在其前方放置食物和设置黑洞,利用其趋食和避光的习性自主向前运动,每只大鼠每天运动30min,速度为15~20m/min,即每天为450~600m;
第四步:适应性运动结束后,根据实验需求建立早期、中期和晚期骨性关节炎模型;即2周单次劳损运动方案为骨性关节炎早期模型、2周双次劳损运动方案为骨性关节炎中期模型、4周劳损运动方案为骨性关节炎晚期模型;2周单次劳损运动方案为大鼠每天下午5点运动一次,共运动2周;2周双次劳损和4周劳损运动方案为每天相同的两个时段,上午9点和下午5点各运动一次,40min/次,6天/周,分别运动2周和4周;动物跑台的上倾坡度为12度,速度为25~30m/min,每周分别运动距离为12000m~14400m。
所述实验动物跑台为普通可调速度和运动角度的滑带式跑台;所有大鼠均采取高处喂食喂水饲养,使SD大鼠处于长期直立进食状态,加重膝关节的重量负荷,促进模型制作进程,同时观察各组SD大鼠的变化并保留记录。
本发明在以往报道经典模型的基础上,结合关节急性或慢性生物力学作用这一首要危险因素,对临床劳损性KOA发病过程进行高效模拟,建立了一种和临床KOA发病比较相似的新型动物模型,即仅给予实验大鼠前交叉韧带横断术,而未切除大鼠半月板,高度维持了大鼠膝关节微环境的相对稳定性和代谢调节作用,在此基础上建立大鼠的膝关节不稳模型,同时使其处于强迫直立负重状态并给予一定强度的跑步运动负荷,结合上坡运动方式增加关节应力作用,来模拟临床膝关节软骨长期劳损的过程,建立膝骨关节炎新动物模型,并将这种新模型通过时间点与经典的Hulth法的早中晚期模型的进行对比,探索该方法的成模效率及不同时期KOA模型造模所需时间,有关行为学、病理组织学变化及膝关节损伤程度控制条件,为进一步研究该病的发病机制,研发新的治疗措施与产品奠定了的重要的动物模型评价基础。
附图说明
图1A为本发明SD大鼠直立运动状态膝关节受力示意图;
图1B为本发明SD大鼠自然四肢运动状态膝关节受力图;
图2A为本发明SD大鼠右膝关节前交叉韧带横断术;
图2B为本发明SD大鼠术后直立跑步运动模型;
图3中(1~7)为本发明SD大鼠各组右膝关节股骨侧负重区软骨表面大体标本观察图(1为空白组;2为Hulth4周组;3为Hulth6周组;4为手术组;5为2周单次劳损组;6为2周双次劳损组;7为4周劳损组。箭头所示为软骨缺损部位,圆圈所在范围为骨缺损或骨赘生长处);
图4为本发明SD大鼠各组右膝关节股骨侧负重区软骨表面大体评分的单因素方差分析结果图;
图5为本发明SD大鼠各组滑膜组织的Rydell-bal-azes大体评分的单因素方差分析结果图;
图6中(1~7)为本发明SD大鼠各组右膝关节股骨内侧髁负重区HE染色组织学观察图(1为空白组;2为Hulth4周组;3为Hulth6周组;4为手术组;5为2周单次劳损组;6为2周双次劳损组;7为4周劳损组;bar=100μm);
图7中(1~7)为本发明SD大鼠各组右膝关节股骨内侧髁负重区番红O软骨染色组织学观察图 (1为空白组;2为Hulth4周组;3为Hulth6周组;4为手术组;5为2周单次劳损组;6为2周双次劳损组;7为4周劳损组;bar=50μm);
图8中(1~7)为本发明SD大鼠各组右膝关节股骨内侧髁负重区甲苯胺蓝软骨染色组织学观察图 (1为空白组;2为Hulth4周组;3为Hulth6周组;4为手术组;5为2周单次劳损组;6为2周双次劳损组;7为4周劳损组;bar=50μm);
图9中(1~7)为本发明SD大鼠各组右膝关节股骨内侧髁负重区Ⅱ型胶原免疫组织化学染色观察图 (1为空白组;2为Hulth4周组;3为Hulth6周组;4为手术组;5为2周单次劳损组;6为2周双次劳损组;7为4周劳损组;bar=50μm);
图10为国际骨关节炎组织病理损伤分级评价标准的单因素方差分析结果图;
图11为国际骨关节炎组织病理损伤阶段评价标准的单因素方差分析结果图;
图12为国际骨关节炎研究协会(OARSI)的骨关节炎软骨病理评价系统评分的单因素方差分析结果图。
具体实施方式
下面结合附图对本发明做进一步详细描述。
一种大鼠劳损性膝骨关节炎模型建立的方法,为确保本发明方法的科学、合理,发明人进行了相应的实验研究和筛选,才得以确定本发明的技术方案。具体实验内容如下:
一.实验过程
1. 实验动物及分组
从中国第三军医大学医学实验动物中心分批购买8周龄的SD大鼠,空腹体重280~300g左右,雌雄各半,共42只,许可证号:SCXK(渝)2012-0005。为了减少生活环境的变化给大鼠带来影响,编号后,雌雄分开,按每笼4只,分笼饲养2周,使其达到10周龄,按编号抽签法随机分成7组,每组6只,即空白组(正常组,control)、手术组(operation)、Hulth4周组(Hulth 4w)、Hulth6周组(Hulth 6w)、2周单次劳损组(Single 2w)、2周双次劳损组(Double 2w)和4周劳损组(Runing 4w)。Hulth组分别根据经典Hulth法造模4周和6周,即手术切除SD大鼠右膝关节的前交叉韧带、内侧副韧带、内侧半月板;余下的4组只行右膝关节前交叉韧带横断术;手术组自由活动,不增加运动跑步;劳损组在手术基础上分别再给予术后2周单次、2周双次和4周的改良型动物跑台同等强度的直立跑步运动,模拟人类膝关节负重劳损的运动过程。
2. 手术及劳损方案
将需要手术造模的组别大鼠称重后,按0.5ml/100g的7%水合氯醛腹腔内注射麻醉,观察记录老鼠的呼吸情况。选取右膝关节,备皮,络合碘消毒,酒精脱碘,用小尖刀沿髌韧带内侧缘切开皮肤,切口大约2.0~3.0cm。再用眼科剪打开关节囊,并钝性分开髁间窝处的脂肪垫组织以暴露髁间窝直致可以肉眼观察到内侧副韧带、前交叉韧带(见图2A)。术中少量的出血用无菌纱布按压止血,使手术视野更佳清晰,同时用生理盐水浸湿的纱布保持关节腔内湿润,将髌骨向外侧脱位,以扩大手术视野,尽量屈曲膝关节显露前交叉韧带,在直视下切断前交叉韧带,行抽屉试验确认前交叉韧带是否已完全切断。Hulth组需要在直视下切断前交叉韧带和内侧副韧带,并切除内侧半月板,手术组和劳损组仅切断前交叉韧带。手术创口使用无菌生理盐水冲洗干净后,用纱布处理手术部位,将外脱位的髌骨复位,再行双层缝合,用4.0可吸收线独立缝合关节囊,以5.0丝线间断缝合伤口。术后肌注一次青霉素(4万u/m1)1ml抗感染,待SD大鼠清醒后曲马多(10mg/kg)止痛,再将SD大鼠按编号分笼后,放回SD大鼠房,正常组、Hulth4周组、Hulth6周组和手术组让其自由活动及进食。
术后让大鼠疼痛缓解两天后,2周单次劳损组、2周双次劳损组及4周劳损组的SD大鼠都适应性在实验动物跑台上运动3天,跑步时使用自制束缚带交叉法束缚其胸部牵引使其直立于跑步机上,前肢支撑于横栏上,并在其前方放置食物和设置黑洞,利用其趋食和避光的习性自主向前运动(见图2B),每只大鼠每天运动30min,速度为15~20m/min,每天大约运动450~600m。正式实验开始后,2周单次劳损组SD大鼠每天下午5点运动一次,2周双次劳损组和4周劳损组每天相同的两个时段,即上午9点和下午5点各运动一次,40min/次,6d/周,分别运动2周和4周,动物跑台的上倾坡度为12度,速度为25~30m/min,每周分别运动距离为12000m~14400m左右。
所有组均采取高处喂食饲养,使SD大鼠处于长期直立进食状态,加重膝关节重量负荷促进模型制作进程,同时观察各组SD大鼠一般情况的变化(如正常活动有无增减、活动时步态及休息时的体位有无变化、运动的灵活性有无变化、进食及体重状况有无变化等)并记录。
3. 大体标本观察
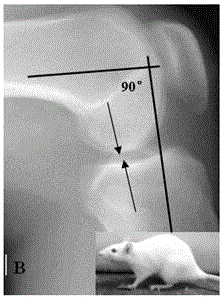
SD大鼠运动受力负重区的选择:分别观察大鼠正常四肢运动和直立运动时关节屈曲与运动受力角度,大鼠正常运动时膝关节屈曲角度约60°-120°(见图1B),自然直立时关节屈曲角度会超过120°,因此直立运动的负重区与正常四肢运动的负重区明显不同。通过对大鼠运动的观察,将其关节屈曲90°,在半月板后角前缘股骨与胫骨平台软骨接触点做一标记,认为其是自然四肢运动的负重区,再使大鼠处于直立状态,关节屈曲角度变为120°左右,可见股骨标记点移位超过半月板后角后缘,与后关节囊接触约0.5mm,胫骨平台标记点位于半月板后角中点附近约0.5mm,认为其是直立状态下的负重区(见图1A)。
分别在2周、4周和6周将各组大鼠麻醉后,以相同手术入路,取膝关节标本,观察并记录各组SD大鼠右侧膝关节的大体形态学改变,如膝关节积液情况、周围软组织及滑膜肿胀情况、软骨的形态改变和骨赘形成情况等。以关节软骨面的大体评分标准和滑膜组织(Rydell-bal-azes)的大体评分标准进行评分(见表1-2)。
4. HE染色、甲苯胺蓝软骨染色、番红O软骨染色
分别在2周、4周和6周将各组大鼠麻醉后,沿造模时的手术路径,行膝关节内侧切口,钝性分离关节周围的软组织和肌肉,在膝关节上、下方剪断股骨和胫骨,将一侧整个关节浸入中性甲醛溶液中固定24 h,10%EDTA溶液中脱钙6周,石蜡常规包埋,矢状位切片,放入二甲苯、逐级乙醇脱蜡至水,分别行HE、甲苯胺蓝软骨染色和番红O染色。在光学正置显微镜下(10×、20×和40×)下进行图像采集,根据其染色程度来评价其软骨组织中糖氨聚糖含量,并由两位独立观察者按以下所述OARSI法评分标准进行评分,取两者均值作为最终得分。
5. 免疫组织化学染色检查
将软骨标本切片脱蜡至水、抗原热修复、灭活内源性过氧化物酶等处理后,组织玻片分别滴加大鼠Ⅱ型胶原单克隆抗体(1∶200),4 ℃孵育过夜,PBS冲洗5min×3次;滴加辣根过氧化物酶标记的IgG,37 ℃孵育20 min,PBS冲洗5 min×3次。DAB显色,苏木精轻度复染,盐酸乙醇分化,水洗、梯度酒精脱水,二甲苯透明,封片,镜下观察并拍照。其中以PBS代替一抗做阴性对照。采用Image-Pro plus 6.0图像分析软件,测定单位面积软骨组织切片Ⅱ型胶原纤维免疫组化染色平均吸光度值和累积吸光度值。
6. OARSI软骨组织病理学评分
按照OARSI法对骨性关节炎组织病理学改变的评分依骨关节损伤分级(表3)、损伤阶段(表4)进行半定量综合评分(表5)。
KOA损伤分级为以下7 级(垂直范围):0 级,软骨表面平整,软骨形态完整;1 级,软骨表面完整,浅层纤维形成,且磨损不均匀;表面细胞团集,肥大生长;2 级,软骨表面不连续,伴有细胞增殖,在Ⅱ~Ⅲ层异染物质增加或减少,表面软骨细胞损耗1/3左右(番红O或甲苯胺蓝染色);3 级,软骨皲裂垂直扩散至Ⅲ层或出现侵蚀,表面软骨细胞损耗2/3左右(番红O或甲苯胺蓝染色);4 级,软骨糜烂,侵蚀加重,表层软骨和中层软骨出现分离现象;5 级,关节软骨剥脱,增生的成纤维组织侵蚀软骨损伤表面,填充皲裂;6 级,关节变形,骨赘形成。
KOA损伤阶段为以下四个阶段(水平范围):正常(S0);第一阶段(S1),软骨损伤范围小于10%;第二阶段(S2),损伤范围为10%-25%;第三阶段,软骨损伤范围为25%-50%;第四阶段,软骨损伤范围超过50%。
分级=深入软骨程度(垂直范围)
7. 主要观察指标
各组大鼠膝关节软骨的造模前后及不同时长运动负荷后的大体组织标本对比观察;软骨HE染色、甲苯胺蓝染色及番红O染色,Ⅱ型胶原蛋白等组织病理学变化。并进行关节软骨面的大体评分标准、滑膜组织(Rydell-bal-azes)的大体评分标准和OARSI标准进行评分,结果与经典的Hulth法骨性关节炎的模型进行对比。
8. 统计学分析
实验结果根据OARSI法病理评分标准采用盲法对标本进行组织学评分,所得评分结果由第一作者采用SPSS 17.0软件完成统计处理,多组间比较使用单因素方差分析,实验数据以x±s表示,定量资料全部进行正态性和方差齐性检验,P< 0.05为差异有显著性意义。
二. 实验结果
1.大鼠一般情况
大鼠均在术后1~2小时左右清醒,清醒后多数大鼠会减少使用右下肢,右下肢活动约在术后2~3天左右恢复,术后未见伤口感染、关节肿胀及步态不对称等异常情况。空白组和手术组动物在笼内自由行走活动,很少跑动。劳损组大鼠劳损运动后,活动明显减少,其余休息时间与空白组基本相当。劳损组在适应性运动期间,表现出明显的拒跑,约在正式跑步实验的第二天左右,能适应跑步强度,自主进行跑步运动。劳损组进食约为空白组和手术组的1~2倍。训练结束时,2周劳损组大鼠体重(339±8g)较2周的空白组(396±9g)轻(P< 0.05),4周劳损组大鼠体重(429±7g)较4周的空白组(475±9g)轻(P< 0.05)。
2.软骨大体标本观察
如图3所示,空白组(control):正常大鼠膝关节表面关节软骨色泽光亮,平滑,无明显软骨缺损和裂纹;
手术组(operation):膝关节表面关节软骨色泽灰暗,略显粗糙,无明显软骨缺损和裂纹;
Hulth4周组(Hulth 4w):可见软骨表面暗黄粗糙,磨损明显,内侧股骨髁表面可见软骨缺损,胫骨平台内侧软骨变淡黄,表面粗糙不平,部分大鼠关节可见少许骨赘形成(为KOA早中期表现);
Hulth6周组(Hulth 6w):关节软骨面色泽灰暗,磨损严重,部分脱落缺损,可见软骨下骨,内侧股骨髁软骨塌陷,胫骨平台色泽暗黄,表面凹凸不平,关节面显著变形,有明显骨赘形成(为KOA晚期表现);
2周单次劳损组(Single 2w):软骨表面略见粗糙,光泽变暗,未见明显骨赘形成(大致为KOA早期表现);
2周双次劳损组(Double 2w):与Hulth4周组大体表现相当;
4周劳损组(Runing 4w):与Hulth6周组大体表现相当。
将各组SD大鼠的右膝关节股骨侧负重区软骨表面进行观察并按关节软骨面的大体评分标准(表1)和滑膜组织的Rydell-bal-azes大体评分标准(表2)进行评分。可见Hulth组和跑步劳损各组关节软骨面评分和滑膜组织的Rydell-bal-azes大体评分均显著高于空白组和手术组(P < 0.001,见表6、表7和图4、图5);正常组和手术组相比无统计学差异;Hulth4周组与2周劳损组相比无统计学差异(大致为KOA早中期表现);Hulth6周组和4周劳损组相比无统计学差异(大致为KOA晚期表现)。
表6 关节软骨面大体评分单因素方差分析结果表(n=6,x±s)
与Control比较, aP <0.01; 与Operation 比较,bP <0.01; 与Hulth 4w 比较,c1P <0.05,c2 P <0.01; 与Hulth 6w比较,d P <0.01;与Double 2w比较, e1P <0.05,e2 P <0.01.
表7 滑膜组织的Rydell-bal-azes大体评分单因素方差分析结果表(n=6,x±s)
与Control比较, a1P <0.05, a2P <0.01; 与Operation 比较,b1P <0.05, b2P <0.01; 与Hulth 4w 比较,c1P <0.05,c2 P <0.01; 与Hulth 6w比较,d1 P <0.05, d2 P <0.01; 与Double 2w比较, e1P <0.05,e2 P <0.01.
3. 组织病理学观察
(1)HE染色检查结果
Control:关节软骨表面光滑完整,四层结构(软骨表层、中间层/移行层、辐射层、钙化层)清晰可辨,软骨细胞排列整齐呈柱状,潮线完整,细胞核清晰,深染均匀,少见纤维素表面增生;
Operation:与Control组差别不大,表面有轻微纤维增生,无裂缝形成,软骨下骨小梁变薄,细胞数目增多,软骨细胞簇集;
Hulth 4w:关节软骨表面粗糙不平,软骨层缺损,表面裂隙深达钙化层,细胞弥漫性增多,细胞簇集明显,出现明显的纤维化增生,潮线不完整(为KOA早中期表现);
Hulth 6w:关节面萎缩、塌陷,四层结构紊乱,软骨层基本消失,细胞数目明显减少,有显著的纤维化增生,出现多重潮线,软骨下骨暴露(为KOA晚期表现);
Single 2w:关节面略粗糙,软骨层紊乱,表面裂隙达辐射层,软骨细胞弥漫性增多,且排列紊乱、簇集,表面有纤维化增生,潮线不连续且下降明显(为KOA早期表现);
Doulble 2w:与Hulth 4w组的组织病理学表现相当;
Runing 4w:与Hulth 6w组的组织病理学表现相当(见图6)。
(2)番红O软骨染色检测结果(图7)
空白组可见软骨组织深染,色泽均一,软骨细胞分布层次分明;手术组与空白组比较,染色下降,着色尚均一,软骨组织各层次可见,软骨表面有少量纤维组织增生;跑步劳损各组和Hulth组关节软骨负重区均出现明显软骨表面不连续,纤维组织不同程度的增生,基质染色不均,染色明显下降,软骨细胞簇集,软骨层次紊乱等。Hulth4周组的损伤程度与2周双次劳损组的相当,符合早中期骨性关节炎的损伤标准;Hulth6周组与4周劳损组为重度损伤,损伤区域软骨结构完全消失,软骨下骨仅可见修复组织覆盖,修复组织番红O染色阴性,损伤处周围可见软骨细胞明显减少,可见粗大的骨小梁和空腔,符合晚期骨性关节炎的损伤标准(见图7)。
(3)甲苯胺蓝软骨染色检测结果
Control组可见软骨组织深染,色泽均一,软骨组织层次分明;手术组与空白组比较,软骨表面连续,稍显粗糙,软骨组织各层次可见,软骨层变薄,着色明显下降,染色尚均一;跑步劳损各组和Hulth组关节软骨负重区均出现软骨表面明显不连续,修复纤维组织不同程度的增生,着色明显下降,基质染色不均,软骨层次紊乱等。Hulth4周组的损伤程度与2周双次劳损组的相当,软骨组织各层次尚清晰,表面明显纤维组织增生,染色与正常组相比明显下降,符合早中期骨性关节炎的损伤标准;而Hulth6周组与4周劳损组为重度损伤,各层结构不可分辨,损伤区域软骨结构完全消失,损伤处周围可见软骨细胞明显减少,软骨下骨仅可见修复组织覆盖,符合晚期骨性关节炎的损伤标准(见图8)。
(4)Ⅱ型胶原免疫组织化学染色观察
与空白组相比,跑步劳损各组和Hulth各组的软骨组织与损伤修复的纤维组织间可见到明显的界限,损伤的软骨组织Ⅱ型胶原免疫组化含量明显减少,Hulth6周组与4周劳损组为重度损伤,其软骨组织Ⅱ型胶原免疫组化染色基本成阴性,提示软骨细胞损伤丢失过度且无法自身再生修复(见图9)。
4.OARSI评分
将各组SD大鼠的OARSI评分进行多组间单因素方差分析,结果显示,空白组和手术组损伤程度评分比较无统计学差异(P=0.67>0.05);Hulth4周组与2周单次劳损组和2周双次劳损组损伤程度评分比较均无统计学差异(P=0.424>0.05,P=0.067>0.05),但更接近于2周单次劳损组;而2周单次劳损组和2周双次劳损组损伤程度评分比较有统计学差异(P=0.011< 0.05);Hulth6周组与4周劳损组损伤程度评分比较也无统计学差异(P=0.593>0.05)。与空白组和手术组比较,Hulth4周组、Hulth6周组、2周单次劳损组、2周双次劳损组和4周劳损组的OARSI评分明显增高(P=0.0001<0.05)。表明经典的Hulth法和新型劳损性造模法均对KOA造模成功,且说明不同时间、不同劳损程度下各组软骨损伤程度也各异,即2周单次劳损组大致表现为KOA早期变化,2周双次劳损组大致表现为KOA中期变化,两者与Hulth法4周左右(KOA早中期变化)损伤程度相似;4周劳损组和Hulth法6周左右损伤程度相当,大致表现为KOA晚期变化(见表8-10,图10-12)。
表8 (深入软骨程度/垂直范围)评分(n=6,x±s)
与Control比较, aP <0.01; 与Operation 比较,bP <0.01; 与Hulth 4w 比较,c1P <0.05,c2 P <0.01; 与Hulth 6w比较,d P <0.01;与Double 2w比较, e P <0.01.
表9 骨关节炎组织病理损伤阶段(关节受累程度/水平范围)评分(n=6,x±s)
与Control比较, a1P <0.05, a2P <0.01; 与Operation 比较,bP <0.01; 与Hulth 4w 比较,c P <0.01; 与Hulth 6w比较,d P <0.01;与Double 2w比较, e P <0.01.
表10 SD大鼠右膝关节股骨内侧髁负重区软骨OARSI评分(n=6,x±s)
与Control比较, aP <0.01; 与Operation 比较,bP <0.01; 与Hulth 4w 比较,c P <0.01; 与Hulth 6w比较,d P <0.01;与Double 2w比较, e1 P <0.05, e2 P <0.01.
三、结论
本实验以大鼠为研究对象,采取了减少膝关节周围韧带不可逆性损伤,增加跑步运动劳损,建立KOA新模型制备的方法,从大鼠的运动功能、组织形态学的分期、分级,及膝关节软骨分泌活性物质改变的多个层面,阐释了KOA新模型的成功建立,并与经典Hulth模型进行了比较,发现了新模型的突出优点在于操作简单,创伤小,保持了更好的膝关节稳定性和关节腔内微环境,不仅高效的模拟了临床上的膝骨关节炎的劳损性诱发因素与疾病过程,而且缩短了建模时间,并可以根据造模时间、跑步运动量的控制来模拟不同时期的KOA模型,更好地模拟了绝大多数中老年人都要面对的劳损性膝骨关节炎的首要发病因素,也为KOA发病机制研究提供了更为可靠、可控的新模型,也将十分有利于评价膝骨关节炎治疗新措施的有效性和安全性,对于KOA治疗的新药、新产品和新技术开发与治疗作用机制的阐释,如干细胞制剂、中药、组织工程技术与产品等,具有极高的应用价值,这一劳损性KOA新模型也十分值得推广应用。
综上所述,与经典的Hulth法相比较,新型劳损性造模法能成功模拟KOA疾病模型,且更能说明在不同时间、不同劳损程度下各组软骨损伤程度也各异,即2周单次劳损组大致表现为KOA早期变化,2周双次劳损组大致表现为KOA中期变化,两者与Hulth法4周左右(KOA早中期变化)损伤程度相似;4周劳损组和Hulth法6周左右损伤程度相当,大致表现为KOA晚期变化。
实施例:
以下对本发明做进一步详细描述:
实例一:一种大鼠劳损性膝骨关节炎新模型的建立与应用,包括如下具体过程:
1. 大鼠称重后,按0.5ml/100g剂量腹腔内注射7%水合氯醛麻醉,观察记录大鼠呼吸情况;选取右膝关节,备皮,络合碘消毒,酒精脱碘,用小尖刀沿髌韧带内侧缘切开皮肤,切口为2.0~3.0cm。再用眼科剪打开关节囊,钝性分开髁间窝处的脂肪垫组织以暴露髁间窝直致可以肉眼观察到内侧副韧带、前交叉韧带;术中少量出血,用无菌纱布按压止血,使手术视野更佳清晰,同时用生理盐水浸湿的纱布保持关节腔内湿润,将髌骨向外侧脱位,以扩大手术视野,尽量屈曲膝关节显露前交叉韧带,在直视下切断前交叉韧带,行抽屉试验确认前交叉韧带是否已完全切断;
2. 手术创口使用无菌生理盐水冲洗干净,用纱布处理手术部位,将外脱位的髌骨复位,行双层缝合,用4.0可吸收线独立缝合关节囊,以5.0丝线间断缝合伤口;术后一次性肌注青霉素1ml抗感染,4万U/ml,待SD大鼠清醒后按10mg/kg曲马多止痛,再将SD大鼠按编号分笼后,放回清洁动物室,让其自由活动及进食;
3. 术后三天,大鼠疼痛缓解后,在实验动物跑台上适应性运动三天,跑步时使用自制束缚带交叉法束缚其胸部牵引使其直立于跑步机上,前肢支撑于横栏上,并在其前方放置食物和设置黑洞,利用其趋食和避光的习性自主向前运动,每只大鼠每天运动30min,速度为15~20m/min,即每天为450~600m;
4. 适应性运动结束后,根据实验需求建立早期、中期和晚期骨性关节炎模型;即2周单次劳损运动方案为骨性关节炎早期模型、2周双次劳损运动方案为骨性关节炎中期模型、4周劳损运动方案为骨性关节炎晚期模型;2周单次劳损运动方案为大鼠每天下午5点运动一次,共运动2周;2周双次劳损和4周劳损运动方案为每天相同的两个时段,上午9点和下午5点各运动一次,40min/次,6天/周,分别运动2周和4周;动物跑台的上倾坡度为12度,速度为25~30m/min,每周分别运动距离为12000m~14400m。
5. 所述实验动物跑台为普通可调速度和运动角度的滑带式跑台;所有大鼠均采取高处喂食喂水饲养,使SD大鼠处于长期直立进食状态,加重膝关节的重量负荷,促进模型制作进程,同时观察各组SD大鼠的变化并保留记录。
实施例二:实验动物跑台装置的构建,包括如下具体过程:
实验动物跑台主体为普通可调速度和运动角度的滑带式跑台,在其基础上改造特征有:
1. 增加自制软布束缚带,并采用交叉法束缚其胸部,两侧牵引使其能直立于跑步机上,且呼吸运动不受影响。
2. 增加横向支撑挡板,使直立大鼠前肢能支撑于横栏上,有支撑着力点。
3. 在大鼠正前方放置食物和设置黑洞,利用其趋食和避光的习性,使其能自主向前运动。
实施例三:对模型建立后的有效评价,包括如下具体过程:
1. 大体标本观察(负重区的选择):
分别观察大鼠正常四肢运动和直立运动时关节屈曲与运动受力角度,大鼠正常运动时膝关节屈曲角度约60°~120°,其自然直立时关节屈曲角度会超过120°,因此直立运动的负重区与正常四肢运动的负重区是不一样的。通过对大鼠运动的观察,将其关节屈曲90°,在半月板后角前缘股骨与胫骨平台软骨接触点做一标记,认为其是自然四肢运动的负重区,再使大鼠处于直立状态,关节屈曲角度变为120°左右,可见股骨标记点移位超过半月板后角后缘,与后关节囊接触约0.5mm,胫骨平台标记点位于半月板后角中点附近约0.5mm,认为其是直立状态下的负重区。
2. 大鼠大体标本评分:
按照应用需求分别在2周或4周将造模大鼠麻醉后,以相同手术入路,取膝关节标本,观察并记录大鼠右侧膝关节负重区的大体形态学改变,如膝关节积液情况、周围软组织及滑膜肿胀情况、软骨的形态改变和骨赘形成情况等。以关节软骨面的大体评分标准和滑膜组织(Rydell-bal-azes)的大体评分标准进行评分。
3. OARSI评分:
根据国际骨关节炎研究协会(OARSI)的“骨关节炎软骨病理评价系统”,对模型大鼠负重区软骨组织分别进行大体组织观察和组织病理学染色(包括HE染色、番红O软骨染色、甲苯胺蓝软骨染色和Ⅱ型胶原蛋白免疫组织化学染色等),根据结果进行OARSI标准半定量评分。
实施例四:通过对造模时间和运动强度的控制,来确定模型具体的疾病分期阶段,包括如下具体过程:
1. 实验动物及分组:
从中国第三军医大学医学实验动物中心分批购买8周龄的SD大鼠,空腹体重280-300g左右,雌雄各半,共42只,许可证号:SCXK(渝)2012-0005。为了减少生活环境的变化给大鼠带来影响,编号后,雌雄分开,按每笼4只,再分笼饲养2周,使其达到10周龄,按编号抽签法随机分组,分成7组,每组6只,即空白组、手术组、Hulth4周组、Hulth6周组、2周单次劳损组、2周双次劳损组和4周劳损组。空白组为正常鼠组;Hulth组分别根据经典Hulth法造模4周和6周,即手术切除SD大鼠右膝关节的前交叉韧带、内侧副韧带、内侧半月板;余下的4组均行右膝关节前交叉韧带横断术;劳损组分别再给予术后2周单次、2周双次和4周的改良型动物跑台同等强度的直立跑步运动,模拟人类膝关节负重劳损的运动过程。根据对经典Hulth法的分级分期评价,在相关定量评分上使与新方法对比,从而确定新方法的具体分级分期所需的造模时间。
2. 不同KOA时期的劳损方案:
术后让大鼠疼痛缓解两天后,2周单次劳损组、2周双次劳损组及4周劳损组的SD大鼠都适应性在实验动物跑台上运动3天,跑步时使用自制束缚带交叉法束缚其胸部牵引使其直立于跑步机上,前肢支撑于横栏上,并在其前方放置食物和设置黑洞,利用其趋食和避光的习性自主向前运动,每只大鼠每天运动30min,速度为15~20m/min(每天大约运动450~600m左右)。正式实验开始后,2周单次劳损组SD大鼠每天下午5点运动一次,2周双次劳损组和4周劳损组每天相同的两个时段(上午9点+下午5点)各运动一次,40min/次,6d/周,分别运动2周和4周,动物跑台的上倾坡度为12度,速度为25~30m/min,每周分别运动距离为12000m~14400m左右。所有组均采取高处喂食饲养,使SD大鼠处于长期直立进食状态,加重膝关节重量负荷促进模型制作进程,同时观察各组SD大鼠一般情况的变化(如正常活动有无增减、活动时步态及休息时的体位有无变化、运动的灵活性有无变化、进食及体重状况有无变化等)并记录。
将各组SD大鼠的OARSI评分进行多组间单因素方差分析,结果显示,空白组和手术组损伤程度评分比较无统计学差异(P=0.67>0.05);Hulth4周组与2周单次劳损组和2周双次劳损组损伤程度评分比较无统计学差异(P=0.424>0.05,P=0.067>0.05),但更接近于2周单次劳损组;而2周单次劳损组和2周双次劳损组损伤程度评分比较有统计学差异(P=0.011< 0.05);Hulth6周组与4周劳损组损伤程度评分比较也无统计学差异(P=0.593>0.05)。与空白组和手术组比较,Hulth4周组、Hulth6周组、2周单次劳损组、2周双次劳损组和4周劳损组的OARSI评分明显增高(P=0.0001<0.05)。表明经典的Hulth法和新型劳损性造模法均对KOA造模成功,且说明不同时间、不同劳损程度下各组软骨损伤程度也各异,即2周单次劳损组大致表现为KOA早期变化,2周双次劳损组大致表现为KOA中期变化,两者与Hulth法4周左右(KOA早中期变化)损伤程度相似;4周劳损组和Hulth法6周左右损伤程度相当,大致表现为KOA晚期变化。
实施例五:新模型的具体应用,包括如下具体过程:
本实验组采取了新模型的方法,应用于具体的实验研究当中,即对KOA具体治疗药物的研究,如透明质酸、干细胞制剂和中药等;更结合了组织工程技术,应用干细胞(如脂肪间充质干细胞、骨髓间充质干细胞、脐带间充质干细胞和羊膜间充质干细胞等)为种子细胞,结合相应生物支架,作用与新KOA模型当中,研究其具体治疗效果和作用机制。
- 还没有人留言评论。精彩留言会获得点赞!