一种光聚合水凝胶局部药物递送系统及制备方法和应用与流程
本发明涉及生物高分子材料以及纳米粒制剂技术领域,具体地说是一种光聚合水凝胶用于递送抗肿瘤纳米粒药物的局部水凝胶药物递送系统及制备方法和用途。
技术背景
随着经济社会的飞速发展,人们正在越来越重视自身的健康问题,整个社会也把人的身心健康水平提升到更高的水平。然而,即使在科学技术如此发达的今天,依然有很多困扰科学界和医学界的难题,癌症就是其中一种。据CA Cancer J Clin公布的最新数据估计,2015年中国的癌症总的发病病例数为429.16万,总死亡病例数为281.42万。由此可见,癌症依然是威胁人们身心健康的巨大杀手。当前,治疗癌症的手段分为:化疗、放疗、手术治疗。化疗作为治疗癌症的一种主要的手段,被广泛应用于临床的肿瘤治疗的过程中。诸多的化疗药物都是通过静脉注射的方式进入全身循环从而达到肿瘤部位进而杀灭肿瘤细胞的。然而,这种全身性的给药方式通常给患者带来巨大的全身性毒副作用。患者表现出的适应性不好,易造成患者白血球减少、血小板减少、贫血、恶心、呕吐等。而且严重的还会造成相关的并发症,如心肌病变、肺间质纤维化、周围神经病变、肾衰竭等。
为了减少化疗药物对于肿瘤患者的副作用,有越来越多的新剂型和载药系统被研究和探讨用于肿瘤患者化疗的可能性。如:新型的纳米粒制剂、脂质体制剂、新型的缓释制剂等。此外还包括新开发的一些用于局部递药的水凝胶药物递送系统,也可以降低其全身毒副作用。水凝胶作为一种新型的生物医用载体,在生物递药领域有着非常大的应用前景和巨大的潜力。它具备一些其他递药系统所不具备的性质,如:能够在水中吸水溶胀而又不在水中溶解,具有多孔特性,能够用于组织工程和生物降解等。当前,有越来越多的关于水凝胶作为药物递送系统的研究和报道,如:用Poly-(lactic-co-glycolic acid(PLGA)包裹的喜树碱和长春新碱的纳米颗粒被嵌入在光响应水凝胶内。并通过建立C6瘤肿瘤模型,观察老鼠的生存率来评估效果。在另一项研究中,用PLGA泡沫体载紫杉醇。通过建立皮下肿瘤模型和相关的体外释药曲线评估体内的抗肿瘤效果。还有可调节的三嵌段共聚水凝胶被用于局部递送三苯氧胺。缓慢释放的紫杉醇纳米粒不管是在体内还是在体外的实验中都显示了良好的抗肿瘤作用。但是大部分的水凝胶药物递送系统都存在一些问题,如:不易降解,成胶过程缓慢,生物相容性不好,载药量不高,释药比较快,可操作性不强等。
低分子量透明质酸是人体内一种固有的成份,是一种葡聚糖醛酸,没有种属特异性,它广泛存在于晶状体、关节软骨、皮肤真皮层等组织;在器官中分布在细胞质、细胞间质中,对其中所含的细胞和细胞器官本身起润滑与滋养作用,同时提供细胞代谢的微环境。低分子量透明质酸作为一种内源性的物质,在体内易被透明质酸酶降解,生物相容性很好。另外由于透明质酸分子中含有比较多的羟基,可以跟水凝胶主链中的氧原子形成氢键,将透明质酸和水凝胶主链连接在一起,因此有越来越多的学者选择透明质酸作为水凝胶材料。但是,大部分是以化学连接的形式。这样并不能够充分发挥透明质酸的优势,而且,这样的水凝胶降解速度比较缓慢,生物相容性的优势并不突出。而且,透明质酸是一种性能非常优良的保水剂,有相关学者研究表明,透明质酸作为细胞基质的组成部分,其与CD44受体的聚集密切相关,其相关性与透明质酸的分子量有关。高分子量的透明质酸能够促进CD44受体的聚集,而低分子量的透明质酸能够明显的抑制CD44受体的聚集。CD44受体在与肿瘤细胞的转移和生长密切先关中发挥关键作用,因此,可以预见,低分子量的透明质酸能够对于抑制肿瘤细胞的生长有一定的促进作用。现如今,有越来越多学者选择透明质酸作为水凝胶材料,由于透明质酸分子中含有比较多的羟基,可以跟水凝胶主链中的氧原子形成氢键,将透明质酸和水凝胶主链连接在一起。但是,大部分是以化学连接的形式,这样的水凝胶降解速度比较慢慢,生物相容性的优势并不突出。因此,可以在水凝胶的形成过程中加入低分子量透明质酸,构建一种含有低分子量透明质酸的水凝胶。
技术实现要素:
本发明的目的在于克服水凝胶药物递送系统在体内的生物相容性不太好、控制药物释放问题和传统DDS的毒副作用大的问题,提供一种光聚合水凝胶局部药物递送系统PEGDA-HA/PLGA-PTX,用于肿瘤的治疗。将该药物递送系统埋植在肿瘤部位后,将充分发挥局部药物递送系统的优势,伴随着PEGDA-HA水凝胶的降解,会在肿瘤部位持续释放足够量的PTX,以达到杀死肿瘤细胞的目的。该药物递送系统将为肿瘤的局部化疗提供一种可选方案。
实现本发明目的的具体方案是:
一种光聚合水凝胶局部药物递送系统,特点是该药物递送系统是通过将紫杉醇纳米粒溶于过膜的PBS溶液,加入聚乙二醇二丙烯酸酯和低分子量透明质酸、光引发剂Irgacure2959形成水凝胶溶液,将该水凝胶溶液置于紫外光下照射形成的载药水凝胶;其紫杉醇纳米粒为PLGA包裹PTX的纳米粒PLGA-PTX;在水凝胶溶液中,紫杉醇纳米粒浓度为1mg/mL,PTX在紫杉醇纳米粒PLGA-PTX中的含量为7-10%。
所述的低分子量透明质酸的分子量为776.64Da,聚乙二醇二丙烯酸酯的分子量为400Da;PLGA的分子量为38000-54000Da,lactide:glycolide=50:50。
一种上述药物递送系统的制备方法,该方法包括以下具体步骤:
步骤1:制备紫杉醇PLGA-PTX纳米粒
取PLGA和PTX粉末,质量比为10:1-15:1,溶于二氯甲烷作为有机相,浓度为10mg/mL-30mg/mL;再向有机相加入与二氯甲烷等量的质量比为1%的聚乙二醇水溶液作为水相,然后持续超声,形成均一初乳;初乳水化,有机相挥发后,将溶液过G50水凝胶柱,离心操作,洗涤,得PLGA-PTX纳米粒;
步骤2:制备光聚合水凝胶局部药物递送系统
取紫杉醇PLGA-PTX纳米粒,溶解于过膜的pH=7.0的PBS溶液中,得到纳米粒溶液,其PTX浓度为1mg/mL;加入0.1g/mL-0.2g/mL的聚乙二醇二丙烯酸酯水凝胶单体;再加入5mg/mL-6.5mg/mL的低分子量透明质酸,搅拌均匀后,避光条件下,加入光引发剂Irgacure2959,得到水凝胶溶液;将水凝胶溶液置于能量密度为100-200mW/cm2的波长为300-400nm的紫外灯下,光照2-5min,形成了白色固体的载药聚合水凝胶PEGDA-HA/PLGA-PTX即所述光聚合水凝胶局部药物递送系统;其中,所述光引发剂与聚乙二醇二丙烯酸酯的质量比为1:67-1:125。
所述的光聚合水凝胶局部药物递送系统在肿瘤的局部化疗中的应用。
对本发明所述药物递送系统作以下测定:
测定PLGA-PTX纳米粒的细胞毒性;
测定NCI-H460细胞对于PLGA-PTX纳米粒的摄取;
测定载药水凝胶PEGDA-HA/PLGA-PTX在体外的药物释放;
测定载药水凝胶PEGDA-HA/PLGA-PTX对肺癌生长的抑制作用;
测定载药水凝胶PEGDA-HA/PLGA-PTX作为局部水凝胶药物递送系统体内疗效的H&E染色效果;
经测定表明,本发明的药物递送系统中低分子量透明质酸通过氢键与主链的聚乙二醇二丙烯酸酯相连接形成PEGDA-HA,然后通过加入光引发剂,在比较短的时间内光引发聚合形成了PEGDA-HA水凝胶。光聚合仿生水凝胶PEGDA-HA用于递送PLGA-PTX纳米粒。水凝胶系统中含有的PLGA-PTX纳米粒一方面解决了PTX的水溶性问题,另一方面还能够达到缓释的效果。PEGDA-HA/PLGA-PTX药物递送系统能够在肿瘤部位持续扩散并释放,进而杀灭癌细胞。该系统由于加入了低分子量HA,因此有望提高溶胀率和载药量,改善其降解性能和生物相容性;另外由于采用光聚合合成方法,其成胶过程迅速,可操作性强,有望用于原位光聚合成胶。将该药物递送系统直接作用于肿瘤部位,抑制肿瘤效果明显,作用持久,可降解,生物相容性高。
本发明的药物递送系统,能够主动靶向作用于肿瘤部位,可降解,并持续释放药物作用于肿瘤细胞,是一种毒副作用小,抗肿瘤效果突出的生物仿生水凝胶药物递送系统。
附图说明
图1为不同引发剂含量的PEGDA水凝胶的扫描电镜图;
图2为不同引发剂含量的PEGDA水凝胶的化学降解图;
图3为不同低分子量透明质酸含量的PEGDA-HA水凝胶的溶胀曲线图;
图4为不同透明质酸含量的PEGDA-HA水凝胶的化学降解和酶降解曲线图;
图5为水凝胶过程图;
图6为水凝胶形态图和SEM图;
图7为水凝胶过程1H-HMR图;
图8为水凝胶的红外谱图;
图9为PLGA-PTX纳米粒的透射电镜图和粒径分布、电位图;
图10为药物递送系统PEGDA-HA/PLGA-PTX的体外释放曲线图;
图11为PLGA-PTX和游离PTX的CCK8曲线图;
图12为PLGA-PTX-DIO/PLGA-DIO纳米粒的细胞摄取图;
图13为药物递送系统的抗肿瘤疗效图;
图14为药物递送系统体内疗效的H&E染色实验图。
具体实施方式
本发明药物递送系统由一种基于低分子量透明质酸的光聚合水凝胶PEGDA-HA载高分子药物纳米粒PLGA-PTX而构成,其制备过程如下:
步骤1:制备PLGA-PTX纳米粒
取一定量的PLGA和PTX粉末溶于1mL二氯甲烷作为有机相,再向有机相加入等量的1%的聚乙二醇水溶液作为水相,然后持续超声,形成均一初乳。初乳水化,有机相挥发。纳米粒溶液过G50水凝胶柱,离心操作,洗涤。得纳米粒;
步骤2:制备基于低分子量透明质酸的聚乙二醇二丙烯酸酯的光聚合水凝胶(PEGDA-HA)
包括引发剂2-羟基-4′-(2-羟乙氧基)-2-甲基苯丙酮与聚乙二醇二丙烯酸酯单体不同比例水凝胶的水凝胶时间及降解速率以及低分子量透明质酸与聚乙二醇二丙烯酸酯单体不同比例的溶胀率与分别在化学条件和生理条件的降解速率的关系。通过实验确定了引发剂2-羟基-4-(2-羟乙氧基)-2-甲基苯丙酮与聚乙二醇二丙烯酸酯单体的比例关系以及低分子量透明质酸同聚乙二醇二丙烯酸酯单体的比例关系并制备了可降解的聚合物水凝胶;
步骤3:对应的紫杉醇浓度和聚乙二醇二丙烯酸酯单体的比例为1mg/g。所有的聚合物纳米粒溶解在水凝胶溶液前均经过了G50的葡聚糖水凝胶柱的纯化;
步骤4:引发剂2-羟基-4′-(2-羟乙氧基)-2-甲基苯丙酮与聚乙二醇二丙烯酸酯单体不同比例的水凝胶的扫描电镜图片(SEM);
步骤5:引发剂2-羟基-4′-(2-羟乙氧基)-2-甲基苯丙酮与聚乙二醇二丙烯酸酯单体不同比例的水凝胶的溶胀率和水凝胶时间;
步骤6:低分子量透明质酸(HA)与聚乙二醇二丙烯酸酯(PEGDA)不同比例的水凝胶的溶胀率和降解速率;
步骤7:该水凝胶载药系统所载的PLGA-PTX纳米粒的透射电镜形态以及DLS粒径,zeta电位;
本发明的PLGA-PTX纳米粒粒径为170nm左右,zeta电位为-4.64mV,呈实心的球体。NCI-H460细胞对该纳米粒有比较高的摄取率。
实施例1
(1)PLGA-PTX纳米粒的制备
分析天平称取10mg分子量为38000Da~54000Da的PLGA固体和1mgPTX固体于EP管中,向EP管中加入l mL二氯甲烷(AR),待完全溶解,作为有机相。向有机相内加入等量的1mL 1%聚乙二醇水溶液(Mw=2000Da),持续超声5min,得到均一的初乳。向初乳加入9mL的Mill-Q水,然后加入11mL的1%的聚乙二醇水溶液。室温搅拌几个小时,有机溶剂完全挥发。将纳米粒溶液通过G50葡聚糖水凝胶柱纯化。再将纯化过后的PLGA-PTX纳米粒于15000g离心,洗涤三次,除去过量的PVA溶液,收集离心管下层的纳米粒,冻干。取一定量冻干得到的PLGA-PTX纳米粒于5mL MeOH(HPLC级)中,室温条件,59Hz超声48h,离心,取上清液,通过HPLC测定紫杉醇含量,并根据所用紫杉醇测得的标准曲线,算出该纳米粒载药量为7.4%。色谱条件为:C18柱,柱温40℃,流动相为水︰乙腈:甲醇=41︰36︰23,紫外灯波长为227nm。
(2)PEGDA-HA水凝胶的制备
1)光引发剂与聚乙二醇二丙烯酸酯单体不同比例制备水凝胶的水凝胶时间、溶胀率和降解速率与引发剂含量的关系
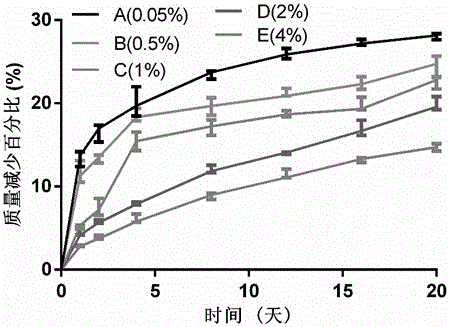
分别称取1g的PEGDA(Mw=400),加入五个不同的5mL的圆底烧瓶中,然后分别向烧瓶内加入5mL过膜的PBS溶液,机械搅拌,待溶液均匀后,避光条件分别加入0.05%w/w、0.5%w/w、1%w/w、2%w/w、4%w/w的2-羟基-4′-(2-羟乙氧基)-2-甲基苯丙酮光引发剂,避光环境,室温条件搅拌2h。然后取出均匀的水凝胶液置于能量密度为166mW/cm2的波长为365nm的紫外灯下,观察到水凝胶形成,精确记录该过程的持续时间。每一组重复三次。由表1可见,随着引发剂含量的增加,水凝胶时间逐渐缩短,后逐渐趋于平缓。将得到的不同引发剂含量的水凝胶冻干,得干水凝胶,称重,记为初始值m0,然后将干水凝胶分别浸泡于10mL pH=7.0过膜的PBS溶液中,浸泡24h,取出水凝胶,用吸水纸将水凝胶表面的水擦干,称重,记为m1。每组重复测量三次。溶胀率=(m1-m0)/m0×100%。由此得到不同引发剂单体比形成的水凝胶的溶胀率。由表1可见,水凝胶的溶胀率随着引发剂含量的增加先增大后减小。通过图1可见,随着引发剂含量的增加,形成的水凝胶的孔径逐渐缩小,其锁水能力也在减小,溶胀率也会减小,特别是图1的E图,由于交联密度过大,已经在扫描电镜下观察不到网孔的存在。将各个时间点的数据收集整理即得到了不同引发剂单体比的水凝胶的降解速率曲线。由图2可见,A、B、C、D、E曲线显示,随着引发剂含量的增加,水凝胶的化学降解速率逐渐减慢,生物相容性依次递减。
2)低分子量透明质酸同聚乙二醇二丙烯酸酯不同比例的水凝胶的溶胀率和降解速率同低分子量透明质酸含量的关系
分别称取1g的PEGDA(Mw=400),加入五个不同的5mL的圆底烧瓶中,然后分别向烧瓶内加入5mL过膜的PBS溶液,机械搅拌,待溶液均匀后,避光条件分别加入1%w/w的2-羟基-4′-(2-羟乙氧基)-2-甲基苯丙酮光引发剂,然后分别加入低分子量透明质酸(Mw=776.64)的量为5mg、10mg、25mg、50mg、100mg对应的浓度分别为1mg/mL、2mg/mL、5mg/mL、10mg/mL、20mg/mL,分别记为A,B,C,D,E。避光条件搅拌2h,得到均一的水凝胶溶液。然后将水凝胶溶液分别置于能量密度为166mW/cm2的波长为365nm的紫外灯下,光照2.5min,形成了白色的聚合水凝胶。分别将得到的不同引发剂单体比的水凝胶于37℃,50mL过膜的pH=7.0的PBS溶液中,100r.min-1孵育,并于不同的时间点取出水凝胶,用吸水纸擦干水凝胶表面的水,称重,记为m1,初始值为m0,降解率=(m0-m1)/m0*100%。将各个时间点的降解率收集整理得到了不同低分子量透明质酸含量的水凝胶的化学降解速率曲线。见图4(左),结果显示,随着透明质酸含量的增加,水凝胶的化学降解速度逐渐增加,但是,200h后降解速度减慢。
分别将得到的不同引发剂单体比的干水凝胶于37℃,50mL过膜的pH=7.0的PBS(含有10IU/mL的透明质酸酶)溶液中,100r.min-1孵育,并于不同的时间点取出水凝胶,用吸水纸擦干水凝胶表面的水,称重,与初始值比较计算降解率。将各个时间点的数据收集整理即得到了不同低分子量透明质酸单体比的水凝胶的酶降解速率曲线。见图4(右),结果显示透明质酸含量越高,水凝胶的酶降解速度越快。原因在于透明质酸酶的存在可以加速含有低分子量透明质酸水凝胶的降解。酶降解速度明显快于化学降解速度,为化学降解速度的两倍。
将得到的不同低分子量透明质酸含量的水凝胶冻干,得干水凝胶,称重,极为初始值m0,然后将干水凝胶分别浸泡于50mL过膜的pH=7.0的PBS溶液中,浸泡24h,取出水凝胶,用吸水纸将水凝胶表面的水擦干,称重,记为m1。每组重复测量三次。溶胀率=(m1-m0)/m0×100%。得到不同低分子量透明质酸单体比的水凝胶的肿胀率曲线。见图3,各组水凝胶溶胀率显示,随着低分子量透明质酸含量的增加,水凝胶的溶胀率逐渐增加,从最初的SR=4增加到SR=12,溶胀率变化很明显。
(3)制备PEGDA-HA/PLGA-PTX水凝胶药物递送系统
分析天平称取一定量的PLGA-PTX冻干纳米粒,溶解于过膜的pH=7.0的PBS溶液中,得到纳米粒溶液,其对应的PTX浓度为1mg/mL。加入PEGDA,对应浓度为0.2g/mL。然后加入低分子量透明质酸(HA,Mw=776.64),透明质酸对应浓度为5mg/mL。搅拌均匀后,避光条件下,加入引发剂2-羟基-4′-(2-羟乙氧基)-2-甲基苯丙酮,对应浓度为1%w/w(引发剂/PEGDA单体)。将水凝胶溶液置于能量密度为166mW/cm2的波长为365nm的紫外灯下,光照2.5min,形成了白色的载药聚合水凝胶PEGDA-HA/PLGA-PTX。由图5可见,水凝胶形成过程非常迅速,在2.5min内由液态水凝胶液变成白色的固态水凝胶。形成的凝胶片如图6(A)所示,图6(B)为该凝胶片的冻干后的形态。图6(C)和(D)是该凝胶的扫描电镜图,从中可以清楚地看到凝胶过程形成的凝胶网络。
实施例2
称取1g的PEGDA于5mL的烧瓶内,向其中加入5mL的D2O,搅拌均匀,然后加入25mg低分子量透明质酸HA,搅拌均匀。避光条件下,加入10mg的光引发剂Irgacure 2959,搅拌均匀。取50微升初始的水凝胶溶液于核磁管中,测试此时的1H-NMR图。然后将装有水凝胶溶液的核磁管置于能量密度为166mW/cm2的波长为365nm的紫外灯下照射50s后观察到,水凝胶开始以极快的速度形成,测试此时的1H-NMR图。然后继续在紫外灯下照射100s,观察到水凝胶完全形成,测试此时的1H-NMR图。由图7可知,a1、b1、c1为t=0的1H-NMR图,a2、b2、c2为t=50s的1H-NMR图,a3、b3、c3为t=150s的1H-NMR图,通过对比水凝胶过程不同时间点的水凝胶核磁氢谱,发现随着水凝胶过程的进行,水凝胶的特征峰δ=6.0~6.48有逐渐减弱的趋势。其中δ=6.0~6.48对应于PEGDA中的CH2=CH-,进一步分析可知,随着聚合反应的进行,体系中CH2=CH-的比例逐渐减少。可从a1-a2-a3,b1-b2-b3,c1-c2-c3吸收峰的变化趋势看出。
实施例3
取一定量的干水凝胶于石英研钵,取适量的KBr,研磨,压片。于傅立叶红外光谱仪中测得PEGDA-HA水凝胶的红外光谱图。由图8分析可见,2900cm-1归属于PEGDA中-CH2-CH2-链节的C-H伸缩振动吸收峰。1720cm-1归属于PEGDA中酯键的C=O伸缩振动吸收峰,1080cm-1为聚合物分子链的C-O伸缩振动的吸收峰,3409cm-1为水凝胶过程中未被取代的羟基的伸缩振动吸收峰。
实施例4
用Mill-Q水配置PLGA-PTX溶液,纳米粒浓度为1mg/mL,超声3min,静置2min,用马尔文激光粒度仪测定其粒径大小、分布和纳米粒表面的电性。测试结果显示,纳米粒粒径为170nm左右,粒径分布比较均一。zeta电位为-4.64mV。
实施例5
PLGA-PTX的形态通过透射电子显微镜(TEM)来观察,需用1%的磷钨酸负染制备样品,具体如下:(1)滴一滴样品溶液于铜网上,(2)空气中干燥约10分钟,用滤纸吸去多余的液体,(3)再滴一滴1%的磷钨酸于铜网上,室温干燥5分钟后用滤纸吸去多余的染液,(4)待样品干燥后置于透射电镜下观察。观察到该PLGA-PTX纳米粒呈现明显的的核壳结构,呈球形。见图9透射电镜图。
实施例6
PEGDA-HA/PLGA-PTX水凝胶药物递送系统体外释药特性:将实施例1中制备好的PEGDA-HA/PLGA-PTX水凝胶液和PEGDA-HA水凝胶液分别加入到黑色的96孔板中,每个孔加入200μL,其中PEGDA-HA水凝胶液作为空白对照。将装有两组水凝胶液的黑色96孔板置于能量密度为166mW/cm2的波长为365nm的紫外灯下,光照2.5min,形成了白色的载药聚合水凝胶PEGDA-HA/PLGA-PTX和PEGDA-HA水凝胶。向每个有水凝胶的孔加入200μL的pH=5.3的柠檬酸盐缓冲液(包含10mg/mL的BSA),然后将96孔板置于37℃,100r.min-1孵育。在每个特定的时间点t=0,6h,24h,48h,72h,120h,168h,240h,312h取出100μL的缓释样品,然后加入100μL的甲醇,用于沉淀BSA。将处理后的样品分别在15000g离心15min,收集上清液,通过HPLC测定PTX含量。色谱条件为:C18柱,柱温40℃,流动相为水:乙腈:甲醇=41:36:23,紫外灯波长为227nm。将测得的PEGDA-HA/PLGA-PTX组的PTX的量减去对照组的数据,再根据PTX溶解在甲醇中的标准曲线算出释放的PTX的量。对比水凝胶载药系统初始的PTX浓度,算出来分别在各个时间点PTX的释放量。通过释放曲线图10可以看出,该水凝胶载药系统在初始的24h内释放量比较快有30%左右,而后释放速度逐渐降低。直到释放到第13天时,释放了将近80%的药量。可以预计,该水凝胶药物递送系统基本可以维持20天左右的药物释放。
实施例7
体外细胞摄取:以NCI-H460细胞为模型,将细胞以3×105cells/ml的密度种于24孔板中培养24小时,然后用载有荧光染料PLGA-DIO和PLGA-PTX-DIO药物时设置对照组。加药处理后用PBS洗涤三次,分别用激光共聚焦定性和流式细胞仪定量评价细胞摄取情况。用激光共聚焦定性分析,细胞核用Hochest染成蓝色。流式细胞仪分析的细胞先用PBS洗涤三次,用用PBS洗涤,消化、离心,将沉淀重悬,流式细胞仪检测。如图12所示,激光共聚焦结果定性观察显示,相比PLGA-DIO纳米粒和PLGA-PTX-DIO纳米粒细胞摄取差异不大而且摄取比例都相对较高。细胞仪定量考察也结果显示,NCI-H460细胞对PLGA-DIO和PLGA-PTX-DIO纳米粒子的摄取比例相对较高而且差异不大(P<0.05),分别为96.51%和96.24%。
实施例8
PLGA-PTX的细胞毒性评价:体外细胞毒性实验以NCI-H460细胞为模型,采用CCK-8试剂盒分析IC50值来考察PLGA-PTX和游离的PTX对细胞的抑制率,具体方法:将密度为3*105cells/mL的非小细胞肺癌细胞NCI-H460悬液种于96孔板中,放置在5%CO2条件下的37℃培养箱,培养24小时;向96孔板中加入不同浓度的PTX、PLGA-PTX两种药物溶液,并设置空白对照,和阴性对照(不加药),每组设三个复孔;加药后将96孔板放置在5%CO2条件下的37℃培养箱中继续孵育48小时;移去孔中的液体,每孔再次加入100μl新鲜培养基和10μl CCK-8试剂;将96孔板放在37℃恒温震荡箱中轻微震荡培养4小时;用酶标仪测定在450nm处的OD值。
细胞活性计算公式
细胞活性(%)=[A(加药)OD-A(空白)OD]/[A(不加药)OD-A(空白)OD]×100%。
A(空白):具有培养基和CCK-8溶液而没有非小细胞肺癌细胞NCI-H460的孔的OD值;
A(加药):具有非小细胞肺癌细胞NCI-H460、CCK-8溶液和药物溶液的孔的OD值;
A(不加药):具有非小细胞肺癌细胞NCI-H460、CCK-8溶液而没有药物溶液的孔的OD值。如图所11示,PTX,PLGA-PTX处理NCI-H460细胞48h后,IC50值分别为10-5.678mg/mL,10-5.527mg/L。PLGA包裹的PTX纳米粒IC50值与游离的PTX的IC50值比较接近,说明PLGA-PTX纳米粒细胞毒性相近,而且间接反映出PLGA-PTX纳米粒在48h内释放的比较多。
实施例9
将NCI-H460细胞按常规条件(37℃,5%CO2)培养,待细胞融合度达到80-90%时,用含EDTA的0.25%胰酶消化细胞并离心收集,用pH=7.4PBS洗涤细胞两次计数,制备成终浓度为5×106个/mL的单细胞悬液,用1mL注射器将细胞接种到裸鼠的右肩皮下,每只裸鼠接种0.1mL,当肿瘤长至400-500mm3时备用。当肿瘤长至400-500mm3时(记作0天),将荷瘤小鼠随机分成4组,分别设为PBS对照组(尾静脉注射100μL)(n=6),PEGDA-HA组(植入肿瘤部位100μL)(n=6),PEGDA-HA/PLGA-PTX(5mg/kg)(植入肿瘤部位100μL)(n=7),PLGA-PTX组(尾静脉注射PLGA-PTX纳米粒100μL)(5mg/kg)(n=6),考察如下指标:
肿瘤生长曲线:每两天用游标卡尺测量肿瘤的长径和短径,根据公式V=1/2(长径*短径2),算肿瘤的体积,绘制肿瘤体积随时间变化的生长曲线。
体重变化曲线:每两天称量模型鼠的体重,绘制其体重随时间的变化曲线,如果模型鼠体重降低不超过15%,可认为该载药系统的毒性较小。
疗效实验结果如图13所示,与PLGA-PTX(5mg/kg)组和PEGDA-HA/PLGA-PTX(5mg/kg)组相比,PEGDA-HA/PLGA-PTX(5mg/kg)表现出明显的抑制肿瘤生长的效果。而且同对照组PBS组相比,PEGDA-HA组也有一定的效果。总体看来PEGDA-HA/PLGA-PTX自给药开始20天内抑制肿瘤生长效果非常明显。
实施例10
水凝胶载药系统的作用于体内疗效的H&E染色实验:等到给药到第20天左右的时间,处死组别分别为PBS组和PEGDA-HA/PLGA-PTX组各一只老鼠,分别取出老鼠的各个脏器和肿瘤组织,将脏器浸泡于福尔马林溶液中,备用。制作各个脏器和肿瘤组织的石蜡切片。首先将石蜡切片梯度脱水,分别于二甲苯、二甲苯,100%乙醇,95%乙醇,80%乙醇,75%乙醇,水,梯度由高到低分别脱水10min,10min,5min,3min,3min;再从低浓度到高浓度脱一次,脱水完毕。脱水后首先用苏木素染色15min,再用水洗3~4次,用1%的HCl乙醇溶液分化1~2s,然后用水洗3次。返蓝3~4min,在水里摇一摇。伊红染色1~3min,用梯度酒精迅速依次脱水2min(从高到低)。二甲苯透明5min x 2,最后用中性树脂封片,封片过程中注意除去气泡。运用荧光显微镜对H&E染色后的切片进行观察,如图14所示,其中A1、B1、C1、D1、E1、F1为PBS对照组,A2、B2、C2、D2、E2、F2为PEGDA-HA/PLGA-PTX实验组。通过观察发现,与PBS对照组相比,实验组PEGDA-HA/PLGA-PTX组的肿瘤,在两组肿瘤切片图的相同位置观察到,实验组肿瘤细胞组织有明显的坏死现象,而PBS对照组则没有观察到组织的坏死。对比其他脏器的切片图,均没有观察到有组织坏死现象,说明该PEGDA-HA/PLGA-PTX水凝胶局部递药系统不会造成机体其他组织的坏死,符合课题设计预期。
表1.不同引发剂含量的PEGDA水凝胶的水凝胶时间和溶胀率(每个样品均重复测量三次取平均值)
a:Irgacure2959
b:PEGDA。
- 还没有人留言评论。精彩留言会获得点赞!