香菇多糖在制备抑制胰岛β细胞受损的药物中的用途的制作方法
本发明属于医药领域,涉及香菇多糖的用途,具体涉及香菇多糖在制备抑制胰岛β细胞受损的药物中的用途。
背景技术:
糖尿病(Diabetes mellitus,DM)是以慢性血糖升高为主要特征的代谢性疾病。随着社会经济发展和医疗水平的提高,糖尿病发病率日趋增高,其发病率和死亡率已位于非传染疾病的第3位,且发展中国家尤为明显。从第十二届中华医学会糖尿病分会上获悉,中国大、中城市和乡镇20岁以上的人群糖尿病患病率已超过10%,且糖尿病前期高达15%。尽管1型糖尿病患者只占糖尿病患者总数的5%-10%,但1型糖尿病多在儿童或青少年时期发病,并易诱发糖尿病酮症酸中毒、糖尿病性高渗状态急性并发症,及全身各系统血管、神经等慢性并发症,最后多以肾衰竭导致死亡,给家庭、社会、国家带来沉重负担和压力。
1型糖尿病(Type 1Diabetes mellitus,T1DM)是一种慢性、多因素自身免疫性疾病,在发病过程中,胰岛β细胞会不断遭到破坏,最终导致胰岛素分泌不足,表现为高血糖症。遗传、环境和自身免疫等因素都易导致T1DM的发生。其中,环境因素可能是主要的T1D致病因素,但其相关机制至今尚未明确。制造理想的模拟人类T1DM发病过程和代谢特征的模型,对糖尿病的机制研究及糖代谢相关研究具有十分重要的意义。链脲佐菌素(Streptozotocin,STZ)是一种经典的制造大鼠和小鼠糖尿病模型的药物,其可破坏胰岛β细胞,使胰岛素分泌不足。目前应用十分广泛。
至今,T1D的标准治疗方案是外源注射胰岛素,控制血糖水平。尽管该治疗方式能有效改善糖代谢,提高患者生存质量,但经常会诱发低血糖症及各种复杂的并发症,如大血管斑块、视网膜病变和肾脏损害等。所以,长期外源注射胰岛素,并不能得到良好的干预及治疗效果。因此,寻找一种有效抑制胰岛β细胞受损,达到治疗T1D的新方法至关重要。
香菇多糖(Lentinan,LNT)是从香菇子实体中提取的一类大分子多糖聚合物。研究表明,香菇多糖具有调节免疫功能、抗血小板凝集、抗肿瘤、护肝、抗病毒和刺激干扰素形成等功能,已成为研究的热点。但目前对于香菇多糖的研究仍主要集中在抗肿瘤和提高机体免疫等方面,对香菇多糖抗氧化有效抑制胰岛β细胞受损的研究鲜见报道。
技术实现要素:
因此,本发明的目的之一在于提供香菇多糖的一种新用途,具体来说是所述香菇多糖作为抑制胰岛β细胞受损的药物中的用途。
本发明的另一个目的是探讨环境因素导致T1DM发生的可能分子机制,提供一种通过抗氧化保护胰岛β细胞免受损伤的新药物。
本发明的目的可通过如下技术方案实现:
香菇多糖在制备抑制胰岛β细胞受损的药物中的用途。
香菇多糖在制备通过抗氧化保护胰岛β细胞免受损伤的药物中的用途。
一种抑制胰岛β细胞受损的药物组合物,含有香菇多糖作为有效成分,还含有药学上允许的辅料。
一种通过抗氧化保护胰岛β细胞免受损伤的药物或保健品,含有香菇多糖。
本发明的有益效果在于:本发明提供了一种香菇多糖在抑制胰岛β细胞受损的药物中的用途。本发明通过运用STZ诱导大鼠胰岛素瘤细胞INS-1受损的模型,观察香菇多糖通过抗氧化减轻STZ诱导的胰岛β细胞INS-1损伤的作用及可能的分子机制。结果显示,对于STZ诱导的INS-1细胞损伤,香菇多糖可改善INS-1细胞的凋亡和胞内活性氧(reactive oxygen species,ROS)堆积,降低iNOS(诱导型一氧化氮合酶)的表达和一氧化氮(NO)释放,剂量依赖性减轻STZ引起的JNK(c-Jun氨基末端激酶)和p38MAPK(促分裂素原活化蛋白激酶,mitogen-activatedproteinkinases)信号通路的激活。另外,香菇多糖还能通过阻断NF-κB通路并增强Pdx-1(胰十二指肠同源框因子-1)表达改善STZ诱导的胰岛素分泌障碍。
关于本发明的优点与精神可以藉由以下的发明详述及所附图式得到进一步的了解。
附图说明
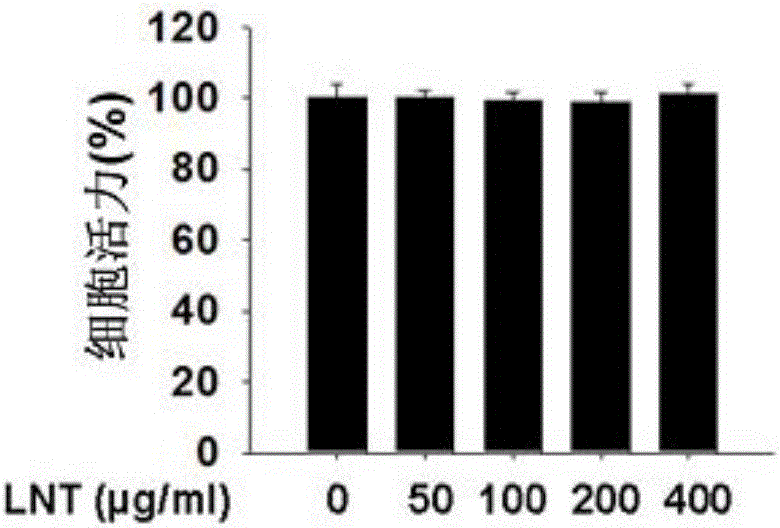
图1A与图1B所示分别为STZ和LNT对INS-1细胞活力的影响的示意图。
图2A和图2B所示为LNT对STZ诱导的INS-1细胞凋亡的影响的示意图。
图3A和图3B所示为LNT对STZ诱导的INS-1细胞凋亡的影响的示意图。
图4A和图4B所示为LNT对STZ诱导的INS-1胞内ROS堆积和NO合成增加的影响的示意图。
图5A和图5B所示为LNT对STZ诱导INS-1细胞iNOS表达上升的影响的示意图。
图6A-图6D所示为LNT对STZ诱导INS-1细胞JNK和p38MAPK信号通路活化的影响的示意图。
图7A-图7C所示为LNT对STZ引起的INS-1胰岛素合成障碍的影响的示意图。
图8A-图8D所示为LNT对STZ处理的INS-1细胞中NF-κB和Pdx-1蛋白表达的影响的示意图。
具体实施方式
本发明提供一种香菇多糖在制备抑制胰岛β细胞受损的药物中的用途。
其中,本发明采用的香菇多糖,纯度达98%,可以在市场上购得,也可以自制,优选地,所述香菇多糖是在江苏永健医药科技有限公司购买得到。香菇多糖的分子式为(C42H70O35)n,分子量1152.999,结构式为:
为更好的说明本发明的目的、技术方案和优点,以下通过实施例对本发明作进一步的阐述。
实施例1香菇多糖对STZ诱导的INS-1细胞凋亡的影响
实验细胞:大鼠胰岛素瘤细胞INS-1培养于含10%胎牛血清(fetal calf serum,简称FBS)、11.1mM葡萄糖、50μMβ-巯基乙醇、100U/ml青霉素、100μg/ml链霉素、10mM HEPES(4-羟乙基哌嗪乙磺酸)、1mM丙酮酸钠的RPMI-1640培养液内。细胞采用不同规格的培养皿或培养板培养于5%CO2,37℃的恒湿培养箱中。
实验药品:香菇多糖购自江苏永健医药科技有限公司。
实验步骤:
1)配置STZ和LNT溶液。STZ溶解于柠檬酸缓冲液中。柠檬酸缓冲液的配制:柠檬酸(分子量(FW):210.14)2.1g加入双蒸水100mL中配成A液;柠檬酸钠(FW:294.10)2.94g加入双蒸水100mL中配成B液。用时将A、B液按一定比例混合(1:1.32),PH计测定PH值,调节PH 4.2-4.5,即是STZ的柠檬酸缓冲液。LNT溶于无菌PBS中。STZ和LNT的药物溶液均现用现配,避光操作。
2)处理INS-1细胞。INS-1细胞铺板后待其贴壁生长密度为70%左右时,撤血清,用含0.1%BSA(牛血清白蛋白)、11.1mM葡萄糖、50μMβ-巯基乙醇、100U/ml青霉素、100μg/ml链霉素、10mM HEPES、1mM丙酮酸钠的RPMI-1640培养液和不同浓度的STZ或/和LNT处理细胞,24h后进行相关检测。经STZ和LNT共同处理的实验组预先用含对应处理浓度LNT的培养液孵育30min,然后再加药刺激24h。所有进行加药处理的细胞实验均设置溶剂对照组,以排除溶剂自身对于细胞状态和实验结果的可能影响,并保证溶剂的最终浓度不大于0.1%。
3)MTT检测细胞活力。具体操作步骤如下:细胞接种于96孔板中,经药物处理完成后,每孔加入MTT 10μl(MTT溶解于无菌PBS(磷酸缓冲盐溶液,phosphate buffer saline)中,浓度为0.5%(m/v);将96孔板置于37℃培养箱中反应4h;反应完成后用注射器吸尽培养液,每孔加入DMSO(二甲基亚砜)100μl溶解紫色结晶甲瓒。37℃培养箱中反应10min;用酶标仪在570nm波长处读取吸光度值,细胞经药物处理后的活力与该吸光度值成正比关系。
4)Annexin V-PI双染法检测细胞凋亡。约2×105个/ml的细胞接种于60mm的培养皿中,37℃培养过夜以使其贴壁,用药物(STZ或/和LNT)处理细胞24h,PBS洗细胞2次,1000g(重力加速度)离心5min,弃上清,加入400μl的Annexin V-FITC结合液重悬细胞,加入5μl的Annexin V-FITC,轻轻混匀,4-8℃避光孵育15min后,加入10μl的PI(碘化丙啶)避光孵育5min,1h内用流式细胞仪检测细胞凋亡率。
5)TUNEL荧光检测细胞凋亡。弃旧培养液,PBS洗涤细胞1-2遍。用4%的多聚甲醛固定细胞,在4℃条件下固定25min;PBS洗细胞2-3遍,用PBS按1:100的比例稀释蛋白酶K,100μl/孔,室温孵育5min后用PBS洗1-3遍;标记:用去离子水按1:5的比例稀释5×Equilibration Buffer,100μl/孔,室温孵育10-30min;在标记孵育的同时冰上解冻BrightGreen Labeling Mix,配制TdT(末端转移酶,terminal deoxynucleotidyl transferase)孵育缓冲液;加入TdT孵育缓冲液孵育细胞,50-100μl/孔,湿盒中37℃避光孵育60min;弃去多余液体,PBS洗1-3遍;用Hochest对细胞染色5min,PBS洗涤1-3遍;将盖玻片置于载玻片上,用Zeiss正置荧光显微镜观察拍照。
统计学分析:本实验所有数据均采用均值±标准差(±s)表示,组间差异性分析采用t检验,以P<0.05作为统计学差异参考标准。
实验结果:
1)如图1A所示,图1A显示的为:不同浓度的STZ处理INS-1细胞24h后进行MTT实验,检测的细胞活力;可以看出,当STZ工作浓度为0.5mM时,INS-1细胞出现活力下降,即0.5mM的STZ能引起适度的INS-1细胞损伤,因此我们将采用0.5mM的STZ进行后续实验。再参见图1B,图1B显示的为:不同浓度的LNT处理INS-1细胞24h后进行MTT实验,检测的细胞活力;可以看出,仅用LNT处理INS-1细胞并不能影响细胞活力,这提示LNT对INS-1没有明显的细胞毒性。(*P<0.05,**P<0.01,***P<0.001)
2)重要的是,如图2A-图3B,当LNT浓度达到200μg/ml和400μg/ml时,能明显减轻0.5mM的STZ诱导的INS-1细胞凋亡。其中图2A表示的是:LNT预处理INS-1细胞30min,再用0.5mM的STZ和不同浓度的LNT共同处理细胞24h,空白对照组LNT和STZ均不加,Annexin V-PI双染后流式检测各组细胞凋亡情况;图2B则是对图2A中细胞凋亡率的统计情况。图3A表示的是:INS-1细胞处理方法同图2A所述,TUNEL染色法检测细胞凋亡情况,采用激光共聚焦显微镜观察细胞(400×),其中蓝色荧光为Hoechst,绿色荧光为TUNEL阳性;图3B则是对图3A中TUNEL阳性细胞百分比的统计。
从以上实验结果可以看出,本发明所述香菇多糖对于STZ诱导的INS-1细胞凋亡起到一定的保护作用。(**P<0.01,#P<0.05)
实施例2香菇多糖对STZ诱导的INS-1胞内ROS堆积、NO合成增加和iNOS(诱导型一氧化氮合酶)表达上升的影响
为了探索LNT的可能作用,我们研究了在STZ诱导INS-1细胞损伤进程中LNT对氧化应激信号通路相关分子的影响。
1)胞内活性氧检测
细胞按1-2×104个/孔接种于白底黑壁的96孔板中,培养至生长稳定后,用药物处理24h后,操作步骤如下:弃去培养上清,用PBS清洗细胞两次,操作需轻柔;每孔加入100μl工作液,于培养箱中孵育1-2h;弃去反应工作液,再次PBS清洗细胞,荧光酶标仪在波长Ex/Em=520/605nm处读数。结果见图4A-图4B,图4A表示的是:LNT预处理INS-1细胞30min,再用0.5mM的STZ和不同浓度的LNT共同处理细胞24h,空白对照组LNT和STZ均不加,胞内活性氧检测试剂盒(红色荧光)检测INS-1胞内ROS水平,用荧光酶标仪在波长Ex/Em=520/605读数,采取底部读数模式;图4B表示的是:INS-1细胞处理方法同图4A,Griess法检测NO水平。由图可知,与对照组相比,STZ的处理增加了INS-1胞内ROS水平。同时,LNT能剂量依赖性的缓解STZ引起的ROS增加(图4A)。(*P<0.05,#P<0.05)
2)NO水平检测
INS-1细胞2×104个/孔接种于48孔板,经加药处理24h后,操作步骤如下:收集培养液,1500g(重力加速度)离心除去细胞碎片后取上清;用Griess法操作各样品并制作标准曲线;酶标仪在波长540nm处读数;根据标准曲线计算各处理组培养上清中的NO含量。结果见图4B,STZ诱导的NO水平上调也可被LNT抑制。
3)Western blot检测iNOS的表达
用提取总蛋白的试剂盒提取药物处理24小时后的INS-1细胞总蛋白,运用Western免疫印迹方法,检测iNOS蛋白的表达。用GAPDH(甘油醛-3-磷酸脱氢酶,glyceraldehyde-3-phosphate dehydrogenase)的表达水平以确保相同上样量的蛋白质。结果见图5A和图5B,图5A表示的是:INS-1细胞处理方法同图4A所述,Western Blot检测各处理组INS-1细胞iNOS蛋白表达情况;图5B表示的是:以STZ单独处理组为基准分析其它组iNOS蛋白表达的变化倍数。与空白对照组相比,0.5mM的STZ明显增强了INS-1细胞iNOS蛋白的表达,200μg/ml和400μg/ml的LNT能有效抑制STZ引起的iNOS表达增加。(*P<0.05,#P<0.05)
这部分实验结果说明,本发明所述香菇多糖能通过减少ROS堆积、NO释放和iNOS表达改善STZ引起的INS-1细胞氧化应激。
实施例3香菇多糖对STZ诱导INS-1细胞JNK和p38MAPK信号通路活化的影响
根据实施例2中STZ、LNT对INS-1细胞氧化应激相关分子影响的结果,我们接下来检测了各处理组JNK、p38MAPK信号通路的活化情况。
免疫印迹法检测JNK和p38MAPK的磷酸化,具体步骤见实施例2所述的Western blot方法。结果见图6A-6D,图6A表示的是:LNT预处理INS-1细胞30min,再用0.5mM的STZ和不同浓度的LNT共同处理细胞24h,空白对照组LNT和STZ均不加,Western Blot检测磷酸化JNK蛋白表达情况;图6B则是STZ单独处理组为基准统计分析其它组磷酸化JNK蛋白的水平;图6C表示的是:LNT预处理INS-1细胞30min,再用0.5mM的STZ和不同浓度的LNT共同处理细胞24h,空白对照组LNT和STZ均不加,磷酸化p38蛋白表达情况;图6D则是STZ单独处理组为基准统计分析其它组磷酸化p38蛋白的水平。在INS-1细胞中,STZ的处理导致JNK和p38MAPK的磷酸化水平增加,而LNT的处理能剂量依赖性的降低STZ诱导的JNK(图6A和6B)和p38MAPK(图6C和6D)的磷酸化。(**P<0.01,#P<0.05,##P<0.01)
这部分结果说明,本发明所述香菇多糖通过抑制JNK和p38MAPK信号通路的活化,改善STZ诱导的INS-1细胞凋亡和氧化应激状态。
实施例4香菇多糖对STZ引起的INS-1胰岛素合成障碍的影响
为了进一步研究LNT对STZ处理的INS-1胰岛素合成功能影响,我们采用RT-PCR(实时荧光定量,Real-time PCR)方法检测Insulin 1和Insulin 2的mRNA(信使核糖核酸)水平,并测定了各组细胞胰岛素合成情况。
1)实时荧光定量RT-PCR
INS-1细胞的GAPDH,insulin 1和insulin 2的mRNA水平用SYBR GREEN染料法,Roche Light 480Ⅱ型实时定量PCR仪进行相对定量检测,数据用2-ΔΔCt法分析。结果如图7A-图7C所示,图7A表示的是:LNT预处理INS-1细胞30min,再用0.5mM的STZ和不同浓度的LNT共同处理细胞24h,空白对照组LNT和STZ均不加,Real-time PCR检测Insulin 1的mRNA;图7B表示的是:LNT预处理INS-1细胞30min,再用0.5mM的STZ和不同浓度的LNT共同处理细胞24h,空白对照组LNT和STZ均不加,Real-time PCR检测Insulin 2的mRNA。图7C表示的是:INS-1细胞处理方法同图7A所述,酸乙醇过夜抽提INS-1胞内胰岛素,用放射免疫法测定各实验组胞内胰岛素含量,并用蛋白校正。STZ能抑制INS-1细胞Insulin 1和Insulin 2的转录水平。与STZ单独处理组相比,当LNT浓度达到200μg/ml时,Insulin 1(图7A)和Insulin 2(图7B)的mRNA水平有了显著提高。(*P<0.05,#P<0.05)
2)细胞内胰岛素抽提实验
INS-1细胞接种于48孔板,经加药处理24h后,操作步骤如下:细胞弃培养上清,PBS漂洗一次,加入200μl无糖并含有各处理组对应浓度药物(STZ和LNT)的KRB缓冲液(Krebs-Ringer bicarbonate HEPES buffer,含10mmol/l HEPES,0.5mmol/l NaH2PO4,3.6mmol/l KCl,135mmol/l NaCl,2mmol/l NaHCO3,1.5mmol/l CaCl2,0.5mmol/l MgSO4,0.1%BSA。pH=7.4),培养1h;细胞每孔加200μl酸乙醇抽提液(acid-ethanol solution:74%ethanol,1.4%HCl),4℃条件下孵育12h左右后,取上清于2ml EP管中。样品可冻存于-80℃超低温冰箱中待测;用胰岛素放免检测试剂盒,放免法(radio immuno assay,RIA)检测胰岛素水平。结果如图7C所示,LNT可改善STZ引起的INS-1细胞胰岛素合成量下降。(***P<0.001,#P<0.05)
以上结果表明,本发明所述香菇多糖能改善STZ引起的INS-1细胞胰岛素合成障碍。
实施例5香菇多糖对STZ引起的NF-κB和Pdx-1表达的影响
为了进一步探索LNT改善STZ诱导INS-1细胞功能损伤的可能机制,我们用免疫印迹法(Western Blot)检测了核NF-κB和胞内Pdx-1蛋白的表达情况。
免疫印迹法检测核NF-κB和胞内Pdx-1蛋白的表达,具体步骤见实施例2所述的Western blot方法。结果见图8A-图8D,图8A表示的是:LNT预处理INS-1细胞30min,再用0.5mM的STZ和不同浓度的LNT共同处理细胞24h,空白对照组LNT和STZ均不加,Western Blot检测NF-κB p65的入核量;图8B则是以Histone为内参对图8A进行统计分析的情况。图8C表示的是:INS-1细胞处理方法同图8A,提取总蛋白进行Western Blot实验,检测PDX-1的表达;图8D则是以GAPDH为内参对图8C进行统计分析情况。
STZ单独处理增强了INS-1细胞核NF-κB的表达。与STZ单独处理组相比,LNT的共同处理可降低核NF-κB蛋白的表达(图8A和8B);并且,与对照组相比,STZ能下调Pdx-1的蛋白水平,LNT的处理可逆转STZ引起的Pdx-1的蛋白水平下降(图8C和8D)。(***P<0.01,#P<0.05)
这部分结果说明,LNT能通过抑制核NF-κB活化,增强Pdx-1蛋白表达,改善STZ引起的β细胞功能障碍。
综上,本发明通过运用STZ诱导大鼠胰岛素瘤细胞INS-1受损的模型,观察香菇多糖通过抗氧化减轻STZ诱导的胰岛β细胞INS-1损伤的作用及可能的分子机制。结果显示,对于STZ诱导的INS-1细胞损伤,香菇多糖可改善INS-1细胞的凋亡和胞内活性氧堆积,降低iNOS的表达和一氧化氮(NO)释放,剂量依赖性减轻STZ引起的JNK和p38MAPK号通路的激活。另外,香菇多糖还能通过阻断NF-κB通路并增强Pdx-1(胰十二指肠同源框因子-1)表达改善STZ诱导的胰岛素分泌障碍。
藉由以上较佳具体实施例的详述,是希望能更加清楚描述本发明的特征与精神,而并非以上述所揭露的较佳具体实施例来对本发明的保护范围加以限制。相反地,其目的是希望能涵盖各种改变及具相等性的安排于本发明所欲申请的权利要求的保护范围内。因此,本发明所申请的权利要求的保护范围应该根据上述的说明作最宽广的解释,以致使其涵盖所有可能的改变以及具相等性的安排。
- 还没有人留言评论。精彩留言会获得点赞!