组织映射和可视化系统的制作方法
相关申请的交叉引用
本申请要求于2015年6月26日提交的美国临时申请no.62/185,356的优先权,其公开内容通过引用结合于此。
本申请还是于2014年4月8日提交的未决美国申请的no.14/248,288的继续部分,本申请要求以下十四个美国临时申请的优先权,其公开内容通过引用结合于此:2013年4月8日提交的申请no.61/809,629;2013年4月8日提交的申请no.61/809,646;2013年10月25日提交的申请61/895,880;2013年4月8日提交的申请no.61/809,636;2013年8月9日提交的申请no.61/864,335;2013年5月31日提交的申请no.61/829,985;2013年5月8日提交的申请no.61/820,992;2013年5月8日提交的申请no.61/821,001;2013年5月8日提交的申请no.61/821,014;2014年1月31日提交的申请no.61/934,640;2014年2月12日提交的申请no.61/939,185;2014年1月31日提交的申请no.61/934,647;2014年2月26日提交的申请no.61/945,005以及2014年3月4日提交的申请no.61/947,950,所有上述公开内容通过引用结合于此。
通过引用结合
在本说明书中提及的所有公布和专利申请通过引用结合于此,其程度如同每个单独的公布或专利申请被具体地和单独地指示为通过引用结合。
背景技术:
一些先前的组织映射系统获取要映射(map)的组织表面上的多个点的位置,并且通过内插各个点之间的表面来使用各个点位置来生成目标组织表面的图像。为了获取每个点的位置,用户将探针放置在表面上的点处,并记录该点的位置。用户将探针移动到表面上的多个点,并为每个点记录位置。为了使用这种方法和类似的方法创建表面的三维模型,必须将映射探针移动到要映射的表面上的相对大量的点,这增加了处理时间。另外,使用这些技术创建的模型包括仅针对在映射过程期间探针实际触摸的点的测量的位置信息;其余的表面点被内插,并因此容易出错。
能够映射组织而不必使用需要逐点位置感测的方法来创建目标组织的模型将是有益的。
技术实现要素:
本公开一般涉及适于创建患者映射的设备和系统及其方法。
本公开的一个方面是一种使用心脏可视化导管来创建患者映射的方法,包括:将消融导管定位在要映射的患者相邻组织内,消融导管包括可扩张构件,该可扩张构件包括可扩张膜,设置在可扩张膜内的至少一个相机,相机具有视场,相机定向为使得当所述可扩张膜扩张时所述相机视场包括所述可扩张膜的一部分,以及具有相对于相机的固定位置和定向的定位元件,其中定位元件的位置和定向被定义在全局参照系中并且可由定位元件检测器检测;将流体递送到可扩张膜中以至少部分地使可扩张膜膨胀;使患者与可扩张膜的至少一部分接触;利用相机捕获与可扩张构件相邻的患者解剖结构(anatomy)的多个不同的2d图像,每个2d图像使与可扩张膜接触的患者的至少一部分可视化;当多个不同的2d图像中的每一个被捕获时,利用指示定位元件的位置和定向的信息来标记多个不同的2d图像中的每一个;创建患者映射,其中创建患者映射包括将多个不同的2d图像中的每一个在对应的标记位置和定向处放置到3维空间,并且显示患者映射。
在一些实施例中,消融导管包括设置在可扩张膜内的多个相机,所述多个相机中的每一个具有不同的视场,所述定位元件相对于每个相机具有固定位置和定向并且其中,利用相机捕获多个不同的2d图像包括利用多个相机捕获多个不同的2d图像,所述不同的2d图像中的每一个包括多个相机的视场,并且其中标记步骤包括当所述多个2d图像中的每一个被捕获时,利用指示定位元件的位置和定向的信息来标记多个不同的2d图像中的每一个。
在一些实施例中,创建患者映射包括将多个不同的2d图像投影到2d平面上,并且其中显示患者映射包括显示2d平面。
在一些实施例中,创建患者映射包括投影在表面是非平面的3d体积中限定的表面上的2d患者映射。
在一些实施例中,该方法还包括将至少一个自然标志(landmark)映射到患者映射中。将至少一个自然标志映射到患者映射中可以包括将至少一个肺静脉口映射到患者映射中。
在一些实施例中,该方法还包括将至少一个电标志映射到患者映射中。将至少一个电标志映射到患者映射中可以包括映射从由以下组成的群组中选择的至少一个电标志:电生理标志、转子、神经细胞簇、设置在心脏的内壁上的神经、以及在所述心脏附近延伸的神经。在一些实施例中,电标志是神经,所述方法还包括将能量递送到组织中并且监测指示将能量递送到神经中的组织调节活动的响应。在一些实施例中,电标志是传导束,所述方法还包括将能量递送到组织中并且监测指示将能量递送到传导束中的组织调节活动的响应。在一些实施例中,将至少一个电标志映射到患者映射中包括感测心脏中的组织的电活动,并映射异常电活动的定位。
在一些实施例中,该方法还包括将至少一个创建的标志映射到患者映射中。将至少一个创建的标志映射到患者映射中可以包括映射指示可扩张膜已经与组织接触或者没有与组织接触的区域。该方法可以还对指示已经与组织接触的多个图像中的颜色以及指示没有与组织接触的多个图像中的颜色进行区分。将至少一个创建的标志映射到组织映射中可以包括将消融能量已经递送到的组织区映射到患者映射中。该方法可以还包括将染料注射到组织中,并将染料的定位映射到患者映射中。
在一些实施例中,相机具有参照系,所述相机参照系相对于定位元件处于固定位置和定向,并且其中当多个图像中的每一个被捕获时利用指示定位元件的位置和定向的信息来标记多个不同图像中的每一个包括确定全局参照系中的相机视场中的位置矢量。确定位置矢量可以包括使用相机和由可扩张膜承载的第一缩放元件之间的已知距离。第一距离元件可以是在设备的远侧区域处的轮毂(hub),轮毂直接或间接地固定到可扩张膜。在一些实施例中,确定位置矢量包括通过计算相机与组织上的点之间的距离来进行估计。通过计算相机与组织上的点之间的距离来进行估计可以使用图像内的可扩张构件所承载的标记的已知图像尺寸的变化。
在一些实施例中,方法还包括将流体递送到可扩张膜中并在膜内创建大于阈值的流体压力,当可扩张构件压靠心房组织时所创建的流体压力在相机和可扩张构件之间创建基本恒定的距离。由于所创建的流体压力,可扩张构件压靠心房组织导致心房组织围绕可扩张构件变形。
本公开的一个方面是一种消融导管,其包括:可扩张膜,设置在可扩张膜内的至少一个相机,相机具有视场,相机定向为使得当可扩张膜扩张时相机视场包括可扩张膜,以及具有相对于相机的固定位置和定向的定位元件,其中定位元件适于使得定位元件的位置和定向可以定义在全局参照系中并且可由定位元件检测器检测。
本公开的一个方面是一种组合来自心脏消融可视化系统的图像的方法,包括:提供利用设置在可扩张构件内的可视化元件捕获的多个图像,使用多个捕获的图像之间的至少一个共同标志来组合多个捕获的图像,其中至少一个共同标志是从由解剖标志、电生理标志和创建的标志组成的群组中选择的。
本公开的一个方面包括使用一个或多个标志将多个图像拼接在一起的方法,所述一个或多个标志可以是在此描述的任何类型的标志。将图像拼接在一起可以在使用或不使用定位元件的情况下完成。
附图说明
图1a-图1c示出了处于扩张构造的示例性消融设备。
图1d示出处于收缩构造的示例性消融设备。
图2a是消融导管的示例性远端的侧视图。
图2b是来自图2a的导管内侧的特写侧视图。
图3是显示可扩张膜内部的透视图。
图4示出了相机组件。
图5是消融导管的远端的透视图,其具有可扩张构件的剖面。
图6是led柔性电路的示例性平面图。
图7示出了结合了包括护套管的可滑动护套工具的设备的远端。
图8是显示了固定到膜的外部和电极的三个单独的柔性电路的平面图。
图9a示出了图8中柔性电路和电极中的一个的一部分。
图9b示出了来自图9a的截面s-s的柔性电路的示例性不同层。
图10示出了三个柔性电路尾部中的每一个,其终止于从球囊的远端向近侧延伸并且在外轴内向近侧延伸并固定到球囊和冲洗轴的近端的外表面的终端。
图11a-图11b、图12a-图12b、图13、图14a-图14b、图15和图16示出了适于映射结构或适于与映射结构一起使用的示例性消融导管。
图17是示例性可视化导管的远侧部分的侧视图。
图18a、图18b、图18c和图18d显示了四个相机的轴线相对于导管轴的纵向轴线的定向。
图19显示了四个相机中的一个的几何形状,并且全部四个具有相同的几何形状。
图20显示了由代表性相机拍摄的规则网格图案目标的图片。
图21a、图21b和图21c显示了可用于将椭圆球囊的3d表面打开到2d平面中的参数化。
图22显示了使用已知图案模拟的一组四个相机图像,在这种情况下,消融电极印刷在膜上。
图23显示了通过使用上述方法将来自图22的图像投影回未打开的球囊表面而生成的全景图像。
在图24中,通过将分量图像投影回到未打开的球囊表面上来生成全景图像。
图25显示了使用在此描述的方法由四个相机获取的组织图像。
图26仅示出了相机组件中的四个相机中的一个相机的四个视场中的一个视场。
图27示出了来自四个相机的四个视场,每个相机覆盖了至少一个其它视场,以向医生提供360度视场。
图28a、图28b和图28c示出了消融心脏组织的示例性方法。
图29a、图29b和图29c示出了消融心脏组织的示例性方法。
图30是示例性实施例的电气方面的示例性示意图。
图31示出了来自多个信道的映射信号。
图32和图33示出了外部控制台的方面。
图34示出了心脏消融系统的示例性框图。
图35示出了可以叠加在来自相机的图像上的示例性信息和指示符。
图36表示用于应用于球囊的外表面的示例性柔性电路。
图37显示了固定到球囊的组装的柔性电路。
图38a和图38b示出了在显示器上呈现给用户的如在此所述的来自四个相机阵列的合成视图。
图39和图40示出了消融导管的示例性实施例,其中球囊被配置用于接触(物理)测量。
图41示出了示例性消融和可视化导管的一部分,其包括定位元件。
图42表示左心房内和全局参照系内的心脏消融导管。
图43示出了与心房组织接触的示例性消融和可视化导管。
图44a、图44b、图44c、图44d和图44e示出了系统可用于创建患者映射的过程中的示例性步骤,并且在该实施例中,患者映射包括左心房的表面。
图45示出了来自示例性可视化和消融导管的可扩张膜内部的相机的示例性视图。
图46a、图46b、图46c和图46d示出了3维空间中的示例性患者映射。
图47a示出了可以映射到患者映射中的示例性标志。
图47b表示来自多个相机相对于左心房的视场以及一些示例性标志。
图47c示出了包括多个捕获和标记的图像的示例性患者映射,并且包括示例性标志。
图47d示出了包括多个捕获和标记的图像的示例性患者映射,并且包括示例性标志,同时不包括来自视场的一些可扩张构件部件。
图48a示出了可视化系统图像,其具有用于区分血液的存在和与可扩张构件相邻的血液的缺乏的指示符。
图48b示出了消融手术之后的来自图48a的视图,其具有组织的烧伤区域的附加指示符。
图49a、图49b和图49c示出了使用示例性标记来估计cs的示例性过程。
具体实施方式
图1a-图1c示出了示例性心脏消融导管的远侧部分。图1a-图1c显示了处于扩张构造的可扩张构件10。图1a是远端视图,图1b是透视图,并且图1c是侧视图。
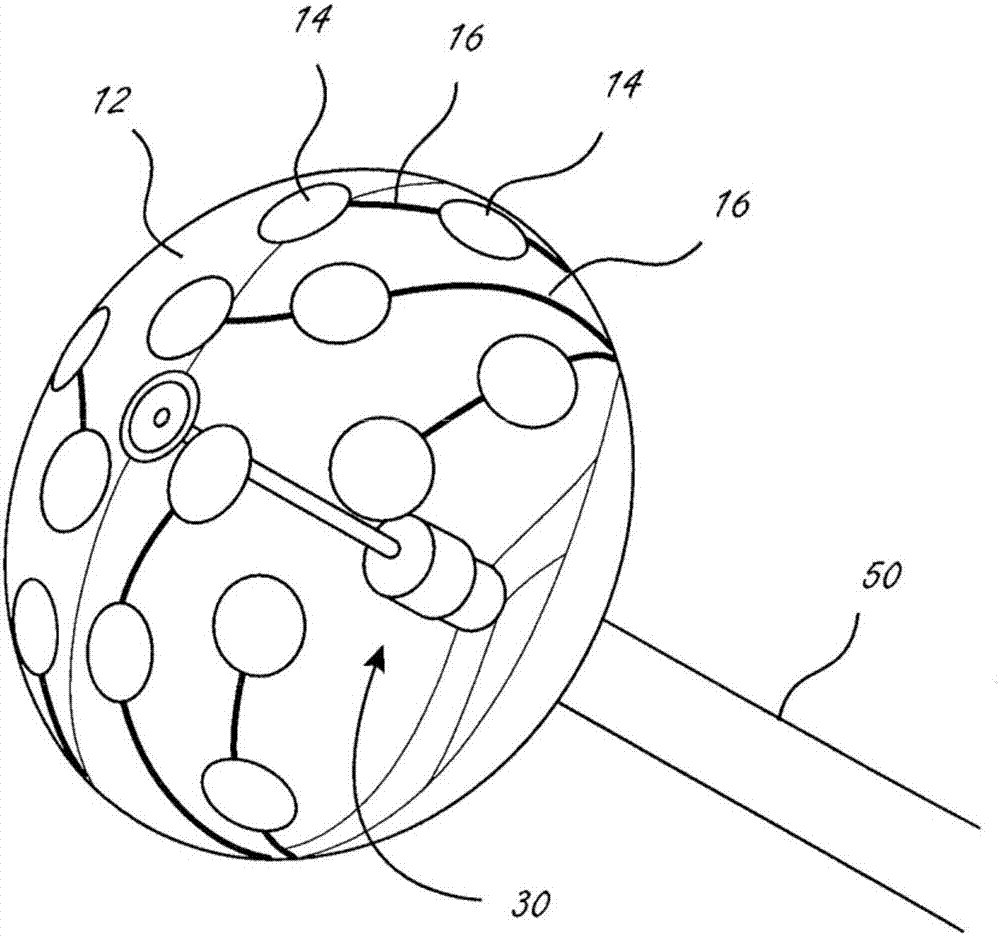
心脏消融导管被配置成将消融能量递送到诸如心脏组织的组织并且消融组织。可扩张构件10包括膜或球囊12以及固定到膜12的外部的多个能量递送元件14。在该实施例中,能量递送元件14是被配置和定位成当可扩张构件10膨胀和消融组织时将消融rf能量递送到组织,并且与被配置为生成rf能量的rf发生器(未示出)电通信。
图1d示出了在完全膨胀之前处于倒塌或收缩构造的可扩张构件10。
图2a是图1a-图1c中所示的消融导管的远侧部分的侧视截面图。图2b是外轴51内的部件的突出的侧面截面图。图2a显示了在外腔50远端处扩张的膜12,其是外轴51和冲洗轴55之间的环形空间。在所示的组件20的内部构件和外部构件之间,膜12的远端例如通过压配合和/或粘合剂固定到远侧轮毂组件20。膜12的近端被固定到冲洗轴55的外表面。轮毂20被固定到导丝轴54,导丝轴54在该实施例中限定导丝腔53,使得消融导管可以在导丝(未示出)上前进。导丝轴54和冲洗轴55适于相对于彼此可轴向移动,这允许膜12的远端相对于膜12的近端移动。两个部件之间的相对移动可以允许球囊的形状被改变。如图1d所示,该移动还有助于将可扩张构件10转变成倒塌构造。
可视化系统30包括设置在导丝轴54上的相机组件32和照明源35。相机被配置为使得能够从可扩张构件10内对过程进行实时成像以可视化膜和电极、膜/电极和心脏组织界面时的心脏组织,以及消融手术期间的损伤形成,如下面更详细描述的。
图2b显示了径向外轴51、限定冲洗腔52的冲洗轴55以及限定了导丝腔53的导丝轴54。
在此所述的膜12的材料可以变化。通常,膜材料很薄,容易折叠成低轮廓,并在扩张后可再折叠。材料可以是弹性的、无弹性的、有弹性的、无弹性的、顺应性的、半顺应性的或无顺应性的。在实施例中,膜12具有可扩张结构并且可以由诸如用于构造本领域已知的球囊导管的那些材料的材料构成,但不限于聚氯乙烯(pvc)、聚乙烯(pe)、十字聚烯烃、聚烯烃共聚物(poc)、聚对苯二甲酸乙二醇酯(pet)、尼龙、聚合物共混物、聚酯、聚酰亚胺、聚酰胺、聚氨酯、有机硅、聚二甲基硅氧烷(pdms)等。膜12可以由诸如pe、poc、pet、聚酰亚胺或尼龙材料的相对无弹性的聚合物构成。膜12可以由相对顺应性的弹性体材料构成,包括但不限于硅酮、胶乳、聚氨酯或聚酯膜弹性体。膜12可以嵌入其他材料,例如金属、凯夫拉(kevlar)或尼龙纤维。膜12可以由薄的不可扩张的聚合物膜构成,诸如聚酯或其他柔性热塑性或热固性聚合物膜。在一个实施例中,柔性膜12的厚度可以为约0.001”至约0.002”,以提供足够的爆裂强度并且允许折叠。在一些实施例中,优选使电极机械性能尽可能接近膜机械性能。提供其的一种方法是使用无弹性的膜,当它扩张时不会伸展。这有助于将分支固定到膜。膜12具有大致平坦的前侧或远侧面,但也可以具有其他形状。
可扩张元件10包括通常在2012年10月23日授权的美国专利no.8,295,902、在2012年3月22日公布的美国专利no.2012/0071870中作为柔性电路提到的。在此使用的柔性电路通常是指导电层、绝缘层和可选的衬底层。柔性电路与至少一个电极电连通。
图8是显示固定到膜12的外部的三个单独的柔性电路的平面图。三个柔性电路中的每一个包括六个能量递送元件14以及终止于用于六个电极中的每一个的六个导电迹线的终端41的尾部。终端可以是连接器或焊盘或其他这种合适的接口的形式。终端41从可扩张构件上的能量递送元件向近侧延伸,其中的一个可以在图1d中看到。每个尾部分叉成三个分支16,其中的每一个分支包括两个能量递送元件。两个侧分支16中的每一个以基本上相同的角度远离连接器的纵向轴线延伸,并且侧分支上的两个电极中的每一个被设置在其他侧分支上的另一对应电极相同的轴向位置(在远侧/近侧方向上)。然而,中央分支最初沿着与尾部的纵向轴线相同的大体方向延伸,并且中央分支上的第一电极轴向设置在与右侧和左侧分支上的第二电极相同的大体定位处。中央分支然后远离尾部的纵向轴线延伸,并且中央分支上的第二(远侧)电极比柔性电路上的其他五个电极更远设置,并且径向设置(相对于尾部的纵向轴线)在与其他侧分支之一上的第一(近侧)电极相同的大体位置处。在图8中,柔性电路之一上的六个电极被标记为a-f。柔性电路的两个侧分支分别包括电极a-b和e-f。中央分支包括电极c和d。在平面图中,电极c(中央分支的远侧电极)轴向设置在与电极b和f相同的大体位置处。电极d比其他五个电极更远设置并径向地定位在与电极a相同的大体位置处。电极a和e设置在与电极b、c和f相同的大体轴向位置。三个柔性电路中的每一个都位于可扩张构件上,并且电极的布置和尺寸提供了固定到可扩张构件的十八个电极。如在图1a和图1b中可以看到的,有三个电极紧密围绕轮毂20。
图9a示出了包括六个能量递送元件14的图8中柔性电路之一(柔性电路,其中终端41处于“6点钟”位置)的一部分。图9a显示了替代实施例,其中中央分支16上的远侧电极在页面上而不是在左侧向右延伸,如图8所示。这种布置提供了球囊上的十八个电极的相同的大体布置。在图1a-图1c的实施例中,存在设置在膜12上的来自图9a的三个柔性电路,以及因此固定到膜12的十八个能量递送元件。图9b示出了来自图9a的分段ss的柔性电路的示例性不同层。不导电的衬底层13沉积在膜12上,在膜12上沉积导电层或迹线15。除了电极14所在的位置之外,绝缘层17沉积在导电层15的顶部。例如,在图9b的左侧,电极14设置在导电元件15上,由此将电极14与导电层15电耦合,该导电层15电耦合到rf发生器。在图9b的右侧,绝缘层17防止右侧的导体15电耦合到电极14。相反,右侧的导体15将电耦合到该分支上的远侧电极。因此,每个单独的导体15仅电耦合到一个电极14。在9a所示的图中,存在六个单独的导电迹线15,其中的每一个独立地耦合到一个电极。正如在2012年10月23日授权的美国专利no.8,295,902、在2012年3月22日公布的美国专利no.2012/0071870中详细所述,电极被设计尺寸和配置为在柔性电路的一部分和未被柔性电路覆盖的膜的一部分上延伸。以这种方式,可以将大表面积电极沉积并固定到膜上。如在此描述的,显示每个电极在其中间具有冲洗孔,用于冲洗与电极相邻的组织,并且防止膜内的冲洗流体变得太热并且干扰组织消融。
导体或导电层15可以是材料,诸如但不限于铜、金、银、锡、镍、钢、铜镍(铜镍合金)、kovar(镍-钴铁合金)或其他材料。在实施例中,可以在导电层15中使用多于一种导电材料。在实施例中,铜的导电层15可以在电极14下方的导电焊盘处镀有附加导电材料的薄层。在实施例中,附加导电材料的薄层可以是金。柔性电路及其部件可以使用本领域已知的技术来制造。
用于形成电极14的材料可以改变。电极14可以是导电或光学墨水的薄膜。墨水可以是基于聚合物的,用于更好地粘合到膜。电极材料可以是生物兼容的低电阻金属,诸如另外不透射线的银、银片、金和铂。墨水另外可以包括诸如碳和/或石墨的材料以及已经描述的更多的导电材料。碳和/或石墨的添加可以增加聚合物基体的导电性。当作为纤维包含时,碳和/或石墨为墨水电极增加了另外的结构完整性。其他纤维材料可以被取代以达到相同的目的。当电极材料不是特别不透射线时,可以将诸如钽和钨的添加剂与电极材料混合以增强不透射线性。工程导电材料llc(ecm)提供导电墨水的示例,其是基于聚氨酯的银负载墨水。另一个示例是创意材料公司,它制造导电墨水、薄膜以及不透射线墨水。如上所述,可以使用粘合剂将电极14应用到膜12和柔性电路。或者,电极材料可以具有粘合特性,或者可以是载有导电颗粒(例如银薄片)的粘合剂,使得电极14可以将柔性电路的部件粘合到膜12。如果使用另外的粘合剂层来将电极14粘合到膜12和柔性电路,则粘合剂层可以包括导电或非导电材料。用导电或光学墨水或薄金属膜形成的电极可以在荧光透视下可视化,以提供膜的形状和电极的定位的大体感测。为了在荧光透视下增强可视化,不透射线的添加剂可以被包括在电极材料或靠近电极的顶部或下方放置的不透射线的标记物中,如将在下面更详细讨论的。另外,粘合层或衬底将最佳地由最小反射材料构成。
每个电极可单独寻址,或可以与任何其他电极一起使用。如图34所示的示例性示意图所示,电极可以以单极模式或双极模式操作。可以选择电极组,使得损伤例如但不限于线性、斑点或空心圆。
图3示出了膜12的远端和轮毂20的耦合,其可以是压配合、粘合耦合或两者的组合。
为了防止或减少与能量递送元件接触的组织炭化和与电极相邻的血液凝结的可能性,在电极位置处的每个柔性电路包括穿过其中的冲洗孔,并且被显示在电极的中心。冲洗孔还防止膜内的膨胀/冲洗流体变得过热,这会干扰消融。也是使膜12膨胀以使其朝向其扩张构造重新构造的流体的冲洗流体从流体源通过冲洗腔52泵送到膜12中,通过冲洗孔(未标出)并且朝向与电极接触的组织以冷却目标组织。心脏消融的先前尝试的缺点之一是由于缺乏冷却功能,消融手术导致血液凝结或组织焦化。此外,由于每个电极是可单独寻址的,并且可视化系统允许操作者识别单个电极是否与组织接触,所以只有与组织接触的电极可以被打开。因此,能量更有效地耦合到需要消融的部位,并且几乎没有能量消散到血液中。
在此消融导管的显著优点之一在于,当使用时,消融手术可以利用具有来自可扩张膜内的透视的成像或可视化构件来可视化。在图1a-图1d的实施例中,成像构件30包括相机组件32,相机组件32包括多个相机33和多个照明或光源35(例如,led)。可扩张构件10还包括固定到膜12的外表面的漫反射器22。反射器22是适于创建从照明源入射到其上的光的漫反射的漫反射器。与镜面反射相反,反射器22适于以漫反射的方式反射光,以更好地照射尽可能多的相机视场。如果反射器适于镜面反射而不是漫反射,则从反射器反射的来自照明源的光将在相机的视场中出现为局部斑点,并且不会照射尽可能多的视场。
照明源35被配置和定位为朝向反射器22大体径向向外提供照明。漫反射器22因此朝向相机的视场来向前漫反射光。照明源因此为相机提供照明以使包括组织和损伤形成的手术可视化。
在一些实施例中,漫反射器被印刷在球囊的外部上。漫反射器可以由填充有非导电白色颜料(例如tio、bao、baso4、苯乙烯或其他聚合物珠)或金属颗粒的硅树脂或聚氨酯树脂构成。最佳的材料将是最小反射的,例如黑色粘合剂。
在该实施例中,漫反射器被固定到膜,使得它不完全叠加任何电极,并且被定位成使得照明源当被激活时朝向反射器发射光。在这个实施例中,漫反射器或反射器在不完全延伸到膜的远端的定位处固定到膜。在该实施例中,反射器固定到膜,使得反射器不比最近侧的电极向更远延伸。然而,在替代实施例中,反射器可以在膜周围的一些位置中向远侧延伸到最近侧电极。例如,反射器的远侧边缘可以是弯曲的而不是直的,并且取决于膜上的电极布局,反射器的一些部分可以相对于最近侧电极向远侧延伸。如果处于其扩张构造的膜可以在限定远侧部分和近侧部分的最远侧定位和最近侧定位之间分成两半,则反射器至少设置在近侧部分上。在图1a-图1c所示的实施例中,反射器仅设置在近侧部分上。
本公开的一个方面是包括漫反射器但不包括任何消融元件的可扩张构件。例如,包括可扩张构件和至少一个相机以及其中的至少一个光源的医疗设备即使不用于消融手术,也可以受益于漫反射器。
虽然在此反射器被描述为漫反射器,但是可以存在一些用途,在该用途中以镜面方式反射光的反射器可以是有益的。可选地,反射器可以具有以漫反射方式反射光的部分和以镜面方式反射光的部分。
图4显示了包括四个相机33的示例性相机组件32,相机33相对于导管的纵向轴线以一定角度设置在相机轮毂37内。相机轮毂37被固定到导丝轴54,并且包括腔39,腔39被配置成在其中接收导丝轴54。
图5是具有膜的剖面的可扩张构件10的另一透视图。图6是包括led的led柔性电路的示例性平面图,所述led柔性电路缠绕在靠近相机的照明轮毂周围。
如上所述,光从漫反射器反射,以在至少一个相机的视场中提供照明。相机的视场可以包括固定到膜的电极的视图。如在此所述,电极可以是高度反射的,例如如果它们由银组成。反射电极使得入射到电极上的光反射到相机的视场中,这可能导致电极在显示器上出现为亮斑点,可能干扰观看手术。因此可以有利的是,在导管中包括反射调节器,该反射调节器适于减少来自多个消融电极中的至少一个的光的镜面反射进入成像构件的视场。
在一些实施例中,反射调节器是光吸收剂。光吸收剂可以定位在电极的底部和膜之间。在一些实施例中,光吸收剂是黑色粘合剂,其将电极的部分粘合到膜,并且用作光吸收剂。
在一些实施例中,反射调节器是抗反射涂层。示例性抗反射涂层包括,例如但不限于,沉积的tio2、mgf2薄层和“蛾眼”结构,其由直径大约200nm间隔300nm范围的纳米颗粒组成,随机微结构固定到或形成在膜的内表面,其适合于减少反射。抗反射涂层可以仅粘合到膜的一部分,例如电极布置在的部分。例如,抗反射涂层可以仅应用于内膜的远端部分。
反射调节器将减少来自电极底部的反射量,在膜内创建膜和电极的更清晰的图像。
当在显示器上显示由至少相机提供的图像或视频时,对于能够在视觉上识别显示器上的电极是有帮助的。例如,可以使用用户界面来控制任何电极的递送参数,并且使医生能够容易地确定并确认视频上的给定电极是用户界面上的特定电极,从而简化了手术并且确保正确的电极正在被激活和如预期使用。
在一些实施例中,导管包括与多个电极中的至少一个相关联的电极标识符,并且在一些实施例中,导管包括多个电极中的每一个的电极标识符。电极标识符不需要对于每个电极都是唯一的,但是在一些实施例中,对于每个电极是唯一的。电极标识符在视觉上是可识别的并且允许个体在视觉上将标识符与电极相关联。
在一些实施例中,电极标识符是设置在每个电极上或附近的字母数字字符。下面描述并显示了这种类型的标识符的示例。例如,字母数字字符可以被印刷在电极的背面,或者柔性电路的与电极相关联的一部分的背面。字母数字字符也可以被印刷在电极附近的膜上,使得标识符可以容易地与特定的电极相关联。
在一些实施例中,电极标识符是与一个或多个电极相关联的颜色。例如,可以对电极进行颜色编码,使得用户可以在视觉上识别每个电极。在一些实施例中,一组电极可以具有特定颜色,诸如连接到相同柔性电路的所有电极都是一种颜色。电极标识符的附加示例是电极的形状,使得电极或电极组可以基于其形状在视觉上被识别。例如,电极组可以是圆形、椭圆形、六边形、矩形、正方形等。每个电极也可以具有唯一的形状。
以下在来自多个相机的叠加视场图像的上下文中描述电极标识符的示例。
图10示出了三个柔性电路尾部中的每一个,其终止于从球囊的远端向近侧延伸并且在外轴51内向近侧延伸并固定到球囊和冲洗轴55的近端的外表面的端部41(每个柔性电路的一个)。在图2b中也可以看到该构造的近侧方面。在图10中,可以看到六个导电线18从端部41中的一个向近侧延伸,其中每一个都与那个特定柔性电路中的六个电极中的一个电连通。六个导线18延伸导管的长度并与rf发生器连通。在未示出的替代实施例中,六个导电迹线15延伸导管的长度并且与rf发生器连通。图10中还示出了用于可视化系统的相机柔性电路43,其在导管中从可视系统向近侧延伸。
用于膜和柔性电路材料的示例性材料可以在于2012年10月23日授权的美国专利no.8,295,902;于2012年3月22日公布的美国专利no.2012/0071870中找到。膜材料的另外的示例包括pet、聚氨酯等。用于反射器的示例性材料包括填充有非导电白色颜料(例如tio或bao或baso4(优选不导电))的金属化涂料、硅树脂或聚氨酯树脂。用于电极的示例性材料包括银填充的硅树脂或聚氨酯。用于导电迹线的示例性材料是导电金属,包括铜或其他这样的导电材料。绝缘层可以是已知的介电材料。用于衬底的示例性材料包括kapton。
如在此所述,消融导管可以包括固定到膜外部的消融和映射电极。在这样的实施例中,映射的组织区域限于由可扩张结构限定的接触区域。然而,被映射的转子可能大于可扩张结构的接触区域,使得为转子准确映射心房室更加困难和耗时。在一些实施例中,消融导管包括可扩张膜,并且还适于增加可以映射到大于由可扩张膜接触表面限定的区域的区域。
在这些实施例中的一些中,当适当刚硬时映射臂可以提供限制消融元件意外进入肺动脉的方式,由此使动脉壁的意外消融和随后的狭窄风险最小化。
在一些实施例中,在其上设置有至少一个映射电极的映射结构被承载在球囊的外部并且折叠在递送导管的壁与消融导管的外部之间。映射结构可以固定到消融导管的外部。在一些实施例中,一个或多个映射结构可以是可变形的脊柱,已经在心脏消融空间中描述了它的使用。例如,映射结构可以由镍钛诺制成并且适于变形。当递送导管相对于消融导管向远侧推进时,映射结构因此可以在从递送导管释放时扩张并且可以折叠成折叠的递送构造。
在其它实施例中,映射电极结构适于通过在此的消融导管的导丝腔递送。
图11a和图11b描绘了示例性消融导管300,其包括承载在多个可重构的映射臂308的表面上的映射电极302(为了清楚起见,仅标注一个)的阵列。图11a是侧视图,并且图11b是远视图。臂308一起具有“篮”构造并且设置在扩张膜306的外部。在图11a和图11b中,臂308在从递送导管内释放之后处于其扩张构造。臂308在递送和缩回期间折叠到递送导管和消融导管300之间的空间中,并适于在通过递送导管缩回或递送经过递送导管的远端释放时自行扩张。示出了六个臂408,每个臂具有多个电极302,但是可以包括更多或更少的篮的臂。臂可以全部固定到相同的映射篮毂(或由单件材料制成)上,或者可以独立地固定到消融导管。图11a和图11b示出了臂308处于缩回位置的导管300,其中臂308的近端缩回并定位在递送导管和消融导管之间。臂308比在图11a和图11b中所示的扩张构造更靠近扩张膜306的表面。
图13是示例性消融导管320的远端的远端视图。在该实施例中,消融导管包括承载多个映射电极322(仅标记了三个)的可选螺旋结构328。类似于图11a和图11b中的实施例,螺旋映射结构可以适于通过导丝腔323递送,或其可适于从递送导管和消融导管轴之间扩张。在图13中的实施例中,其中螺旋结构适于经由导线腔递送,螺旋在侧视图中可以在单个平面中,或者当螺旋向远侧推进与组织接触时螺旋可以具有适于变形成单个平面的圆锥构造。在图13-图17上为了清楚起见,在消融球囊上没有标记消融电极。
图14a是示出具有在其上具有多个映射电极342(仅两个被标记)的专用映射结构348的可选消融导管340的简化侧视图。在该实施例中,两个映射臂348具有如所示的扩张的环形构造,并且适于如图所示通过导丝腔347递送。可能存在多于或少于两个臂。图14b是替代实施例的远视图,其中映射结构350在其扩张构造中包括多个环。在该实施例中,至少一个环352具有比第二环354的高度大的扩张的“高度”(从导管的纵向轴线沿垂直于轴线的线测量的距离)。特别地,存在四个臂,其中第一高度大于四个其它臂354的高度。可以有任何数量的高度尺寸不同的环。
图15示出了导丝腔360内的折叠构造中的映射臂和电极362的示例性构造,并且仅仅是说明性的以示出多个臂如何可以设置在导丝腔内。可以在其中设置更多或更少的臂。
图16示出了示例性消融导管370的简化侧视图,其中映射臂378终止于其各自的远端379。也就是说,每个臂具有自由端。类似于在此的其他实施例,导管370包括球囊376、导丝腔377、臂378上的映射电极372。所描述的映射臂中的任何一个可以包括诸如niti线的加强构件,使得在释放时映射构件呈现预定的形状。
通过导丝腔递送的任何映射臂可以可选地被配置为在消融导管和递送导管之间的空间中递送,反之亦然。
在又一些实施例中,映射臂可以编织成随着其向远侧延伸而直径增加的圆锥编织物或编织物结构。
在使用时,可视化系统允许通过设置在球囊内的一个或多个相机的视图来进行过程的实时可视化。可视化允许整个手术可视化,允许医生评估组织接触的程度,并在发生电极、组织和损伤形成时观察。为了清楚起见,图29仅示出相机组件中的四个相机中的一个的四个视场中的一个。图30示出了来自四个相机的四个视场,每个相机均覆盖有至少一个其他视场,以向医生提供治疗区域的360度视图(以导管的纵向轴线作为参照)。尽管在四个图像的中心显示出盲点,但是与当前实施例中使用的不同的透镜系统可以允许消除该点。由于在整个导管周围设置有电极,所以360度视图允许医生可视化利用设置在导管周围的电极的整个损伤。包括任何电极位置的损伤形成的整个过程的可视化对医生都是非常有帮助的。
覆盖相机视场的在此描述涉及美国专利no.2012/0071870的公开,特别是图38h-38r及其文字描述。本公开的一个方面是使用来自附接到内窥镜导管的多个相机的图像来生成全景图像显示的示例性方法。在一些实施例中,从多个相机捕获的多个图像与至少一个其他图像叠加,以围绕消融导管的纵向轴线创建全景图像。两个或更多个相机可以对可扩张构件的各个部分(从可扩张构件内)和解剖结构进行成像,并且相机之间的几何关系或者是已知的(通过设计或者测量),或者可以使用球囊的常见解剖特征作为标志根据图像本身进行估计。
一般而言,对于每个相机,将像素映射到虚拟打开的显示屏幕(例如,围绕相机的圆顶形屏幕)的映射函数被计算。然后使用反投影(即使用相机作为投影仪)将图像投影回该虚拟显示屏幕。叠加区域中的数据使用合成(包括混合或其他手段)进行组合。
图17是示例性可视化导管的远侧部分的侧视图。图17示出了远侧部分的几何形状,其包括由充满盐水的膜围绕的附接到导管的中心轴的远端的四个相机。每个摄像头都在膜内对封闭膜的一部分进行成像。图17中所示的圆锥形状表示多个相机中的一个的视场。在该实施例中,尽管图17中未示出,但是多个射频电极被固定到膜的外部。当远端部分定位在诸如左心房的心腔内部时,相机能够可视化球囊外部的血液或组织以及球囊的内表面。这提供了在开始消融之前验证电极与组织接触的方式,并且相对于诸如肺静脉的解剖标志,球囊被适当定位。
图18a-图18d示出了四个相机的轴线相对于导管轴的纵向轴线的定向。图18c中所示的箭头ap、bq、cr和ds表示各个相机的轴。om是导管轴的纵向轴线。参数“c”是导管轴om的轴线和相机的轴线之间的最短距离(见图18a)。相机轴线也相对于导管轴om的轴线成角度φ(见图18b)。如图18d的侧面几何视图所示,膜的远侧表面可以被建模为旋转的椭圆形实线。参数a和b定义了椭球体。如图18d所标示的椭圆的赤道与图18d所示的点“o”相距距离“d”。如图18d所示,具有轴线cr的相机的成像平面与c的距离为e。
图19示出了四个相机视场中的一个的几何形状,并且全部四个具有相同的几何形状。通过等式(1)和(2),成像平面中的像素p(u,v)与空间中的点q(x,y,z)相关,其中f是相机的焦距。
和
此外,由相机捕获的图像可能具有镜筒像差。图20显示了由代表性相机拍摄的规则网格图案目标的图片。可以看出,镜筒像差使距离中心390较远的网格点看起来较小并彼此压缩。
通过使用网格目标可以确定将原始像素坐标p(u,v)映射到由于镜筒像差
使用图21a-图21c中所示的参数化,可以将椭圆球囊的3d表面打开到2d平面中。在图21a中,a和b的参数将球囊描述为椭圆形的回转体。参数m对应于从天顶开始沿着球囊表面的弧长。在图21b中,旋转角γ描述回转体的方位角。在图21c中,打开的球囊表面由极坐标中的参数(m,y)或直线坐标中的
球囊表面上的点可以是:(x,y,z)。通过打开球囊表面,可以从椭圆球囊几何形状构造平面打开的图像,如下所示:
其中:θ=g(m)...(5)
并且g(m)是众所周知的“第二类完全椭圆积分”。打开的2d表面由极坐标(m,γ)或直线坐标
总之,表1(下面)中的参数描述了这个多相机系统的相机几何形状。
表格1
使用表1的参数,可以计算与由给定相机创建的图像中的每个像素相对应的打开的球囊上的点的
图22示出了使用已知图案模拟的一组四个相机图像,在这种情况下,消融电极601印刷在膜上。电极601可以是图1a-1d中所示的十八个电极的图案。电极601也具有与它们相关联的标识符,在这种情况下是唯一的字母数字字符。
图23示出了通过使用上述方法将来自图22的图像投影回打开的球囊表面上而生成的全景图像。图25还示出了印刷在每个电极上的数字形式的示例性电极标识符,以启用每个电极的可视识别。图25还示出了所收集的图像如何包括与它们相邻定位的图像的公共区域,并且公共区域被叠加以创建全景图像。
在图24中,通过将分量图像投影回到打开的球囊表面上来生成全景图像,但是电极370不具有与它们相关联的电极标识符。图25示出了使用上述方法由四个相机获取的组织图像。图25示出了通过使用本发明将这些图像投影回到打开的球囊上而生成的全景图像。
上面的示例性方法从多个相机中的每一个获取图像,并且组合这些图像以创建全景图像。如上所述,来自每个相机的图像可以使用几何变换来变形。变形可以包括与相机之间的已知几何关系相关联的信息。变形过程可以包括使用合成在图像的叠加区域中生成的几何变换。该过程可以包括使用加权平均。该手术包括阿尔法混合。变形过程可以包括使用图像的叠加区域中的特征追踪创建的几何变换。相机之间的几何关系的表征可以包括使用实验确定的光学目标。几何关系可以通过对相机、包含相机和球囊的固定件进行几何建模来分析确定。几何变换可以包括将球囊映射到平面表面上,同时保持3d表面上任何任意一组点之间的距离的几何变换。
在示例性的使用方法中,使用导管消融心脏组织以治疗心律失常。使用包括导丝和引导导管技术的已知进入手术将导管推进到左心房中。然后将膨胀/冲洗流体从流体源向膨胀/冲洗腔52向下泵送,以使球囊膨胀至左心房内图1a-图1c所示的构造。手术过程中随时可以激活相机,但通常在膨胀之前,医生可以查看膨胀是否有问题。此时可以看到球囊被血液包围。导管朝向心房壁向远侧推进,并且当球囊接触组织时,血液将被移位,提供组织的清晰视图。然后医生可以根据所需的治疗组织或期望映射的区域来确定球囊是否需要移动。这里的设备中的可视化系统的优点在于,只要简单通过观察显示相机视场的显示,医生就可以容易地看到球囊何时正确定位。这也简化了系统,因为不需要执行反射能量的分析,如在心脏消融的一些先前的尝试中那样。
一旦根据诸如在肺静脉周围的适当放置的可视化信息或映射电信息确定球囊已经被适当地定位在治疗部位,一般如图32和33所示的外部控制台用于激活某些电极并控制手术的能量递送参数。射频发生器创建射频能量并将其传送到电极。图33中示出了在此所示实施例的电学方面的示例性示意图。可以理解,包括十八个通道,而仅示出了三个通道。未示出的替代实施例可以包括更多或更少的通道。如图33所示,系统的映射能力显示在电极的右侧。每个电极可以以单极或双极模式使用,并且使用每个电极可以测量阻抗和电压。
发生器被配置为使得电极可以根据需要用于映射组织、消融组织和刺激组织。消融心脏组织以治疗异常信号通常在此被描述并且是已知的。然而,发生器也被配置为创建电组织刺激信号并将电组织刺激信号递送给电极,使得电极刺激心脏组织。图30中的示意图示出了可以选择每个电极用于消融或刺激,同时来自每个电极的映射连续发生。映射部分包括被配置为过滤掉消融带宽的滤波器,以及可以被递送或以其他方式呈现的其他非必要带宽,使得映射可以连续发生。因此,在此的公开内容包括发生器,所述发生器被配置使得每个电极可以被用于同时映射和消融组织,或者同时刺激和消融组织。该系统还被配置使得消融、刺激和映射都可以同时发生,尽管刺激和消融不会在任何给定的时间从相同电极发生。此外,这些处理可以顺序执行。
心脏组织的刺激可以针对许多原因完成。在示例性实施例中,可以在诊断手术期间执行组织的刺激以确保电极正在工作。例如,rf能量可以被递送到第一电极并且被另一个电极感测,从而在多对电极之间递送能量以确保该对电极正在工作。在该示例性使用中,刺激能量可以在球囊与组织接触之前或在其与组织接触之后递送,因为血液通常具有足够低的阻抗,从而不妨碍诊断测试。在替代实施例中,可以在组织正被其他电极消融的同时刺激心脏组织。例如但不限于,可以使用三个电极来递送消融能量以在三个电极之间创建损伤(例如,线性消融),而损伤的一侧上的电极可以用于将刺激能量递送到损伤的另一侧上的电极上的电极以确定组织是否被有效消融。示例性的组织刺激递送信号能力包括0至20ma的电流、0至100ms的脉冲宽度、高达300bpm的重复速率。更优选为0到10ma、0到10ms和高达180bpm。以这些方式刺激心脏组织不同于映射测量阻抗中的映射,同时刺激递送配置为刺激心脏组织的能量。因此,在此的公开内容包括在消融手术期间(包括在实际消融之前,消融时或在消融已经发生之后)刺激心脏组织的方法。
图28a-图28c示出了消融肺静脉口周围的心房组织以隔离肺静脉的示例性方法,并且从由来自相机的四个视场所创建的视图来显示。图28a-图28c是指医生在使用该系统时将会看到的视图。再次,取决于相机组件和相机的设置,中间的盲点可以被移除。在图28a中,球囊已经被推进到与肺静脉腔1502的口1501周围的口组织接触。在图28a中,没有电极已经被激活,虽然在该阶段也可以进行映射手术以评估心脏组织的传导。图28b示出了某些电极“a”被激活并且在电极接触和应用电源之后,损伤区域1503开始在组织中形成。在这个示例中,标记为“b”的电极没有被激活。图28c示出了继续消融组织和通常围绕肺静脉口延伸的损伤区域1504的形成。
图29a-图29c示出了使用在此的系统创建用于治疗转子的损伤的示例性方法。图29a示出了抵抗除了口区域之外的心脏组织而推进的球囊,其中没有电极已被激活。图29b仅示出了被激活的电极“a”,并且消融损伤1601开始形成电极与组织接触并被激活的位置。在该实施例中,电极a是来自三个柔性电路中的每一个的最远端的电极。图29c示出了连续的消融以及靶向转子的损伤区域1604的形成。中间的盲点隐藏了损伤延伸到无法看到的组织上。在使用的替代实施例中,可以使用多于三个的电极(例如,四个电极)来执行转子消融。
本公开的一个方面是一种将由相机提供的一个或多个图像与作为心脏组织的特征和消融导管的特征中的至少一个的指示的信息或图像叠加的方法。叠加的图像(或叠加的信息和图像)在可视显示器(例如,监视器)中呈现给医生,并且可以是远程用户界面的一部分。该方面包括适于叠加图像的方法和系统。在此的方法和设备也适用于获得信息并叠加图像。
正被叠加的信息可以是心脏组织的特征或消融导管的特征的任何合适的可视指示符。
在一些实施例中,叠加在来自相机的图像上的信息是接触可扩张构件的心脏组织上的电活动。
在一些实施例中,叠加在来自相机的图像上的信息是消融电路的局部阻抗。
在一些实施例中,叠加在来自相机的图像上的信息是与球囊相对的心脏组织的温度。
在一些实施例中,包括cmos相机的相机适于响应于红外范围内的光。可以使用该响应来估计消融之前、期间和之后的组织的温度。响应可以由算法解释并叠加显示到来自相机的可见光图像。
在一些实施例中,加速度计被放置在消融球囊中、消融球囊上或消融球囊附近的定位处。加速度计可以用于检测球囊相对于重力的方向。加速度计可以创建用于确定加速度计位置相对于初始位置的加速度数据。该位置可以用于构建由球囊访问的位置的数据库和/或由球囊上的电极收集的信息和/或应用于球囊电极的rf功率。信息收集可以用于重建模型,以向医生提供与被治疗的地点和需要治疗的地点相关的指导。
图35示出了可以叠加在来自相机的图像上的示例性信息和指示符。指示符402和404是传送与电极相邻的组织的温度的方式的示例。例如,指示符402是定性指示温度的一系列线,诸如“中”。指示符404是一系列相交线,并且可以指示“高”温度。因此可以使用任何类型的视觉指示符来指示与任何电极相邻的一个或多个组织区域的定性温度。
叠加信息406提供组织温度的定性指示,在该示例中为99度。信息406紧挨着电极的图像,而信息408是在电极图像上的信息。指示符410是叠加在电极顶部的红色,提供“热”的定性指示。信息414和416被叠加以指示相应电极“接通”和“断开”。
在一些实施例中,叠加信息是全部相同类型的信息。例如,每个电极可以同时与指示组织温度的信息叠加。在其他实施例中,对于任何电极,叠加信息的类型可以不同。
可以叠加的信息类型的附加示例包括电阻抗,其可以使用在此的任何指示符(例如,颜色、数字)来定量或定性地可视化。另外,映射信号也可以叠加在相机图像上。
图36表示用于应用于球囊的外表面的示例性柔性电路,其中薄聚酰亚胺衬底101厚度大约0.002-0.003”并且总结构厚度在0.004-0.006”之间。
轮廓是最终消融垫102的轮廓(仅大的正方形和三角形)。孔103用于盐水流动。电路迹线104终止于消融垫上的暴露区域。导电银漆用于创建消融垫的几何形状,并且暴露的痕迹提供导电性。
或者,如在此所述的,可使用黑色粘合剂来使银印刷的消融垫102下方的区域变暗以防止球囊内的反射。使用聚酰亚胺衬底101的一种方法可以消除黑色粘合剂,从而提供更薄且更柔顺的安装表面。在一些实施例中,存在设置在相机和电极之间的光吸收层和材料,以减少视场中的光的反射。光吸收剂可以具有与电极相同的基础材料,但是没有或者具有很小的导电性能。在这些实施例中,电极的至少一部分因此不与可扩张构件直接接触,而光吸收剂可以与可扩张构件直接接触。或者,光吸收部分可以包括诸如碳纳米管的导电材料,其将提供光吸收质量和导电质量。
提供介电区域105以防止串扰和导电至血液或其他介质。柔性电路的近侧具有电线附接到的两个小焊盘106。
如图3所示的组装的柔性电路可以如图40所示固定到球囊201,这样的球囊位于中心杆202周围,并且这种杆具有捕获球囊(未示出)内表面的图像的系统并且将这样的图像发送到患者体外的显示器。在三角形垫的远端的可选的长突起203围绕球囊的前部缠绕以形成电路的物理锚。
另外,加速度计204被放置在消融球囊中、消融球囊上或消融球囊附近的定位处,这样的加速度计可以用于检测球囊相对于重力的定向并且构建如在此所述的治疗相关数据集。
当医生移动如在此所述的导管时,更具体地,当医生围绕导管的纵向轴线旋转系统时,图像显示器将显示固定的球囊的内表面和球囊外的一切(例如,心脏组织)移动。这是由于在此的实施例中相机相对于导管和球囊系统固定的事实。
图38a和图38b示出了如在此所描述的来自在显示器上呈现给用户的四个相机阵列的合成视图。这些图像被映射到合成图像,该合成图像表示球囊承载的相机在球囊内的轴上的排列和定向。映射配准依赖于在两个或更多个图像内存在共同特征的情况下在相互之上的每个相机视场内的映射公共特征。如图所示,一个电极(定向配准电极)可以通过星号(如图所示)形状的标记来识别,其在电极之前已经印刷在球囊上并且对于相机可见。在其他实施例中,每个电极可以用其自己的唯一标识符标记,或者一些或全部电极可以具有帮助识别它们的不同形状。公共的固定特征(相对于相机)包括迹线、电极和其他固定的标记。图38a示出分别在由电极514和510创建的烧伤502和504之后拍摄的初始图像。球囊以肺静脉506为中心。图38b示出球囊旋转后由相机阵列捕获的第二图像。每个合成图像已经被处理,使得固定特征(相对于相机)被映射到用户显示器,使得配准标记(以及因此整个图像)被旋转针对围绕合成图像(例如烧伤502或504)中心的一个或多个解剖特征的质心的测量的旋转相等且相反的量。通过这样做,固定特征的图像将旋转,同时固定特征后面的图像的部分在球囊被操纵时将保持固定。
因此,在此公开了一种系统,通过图像处理,示出球囊的内表面旋转,同时保持球囊(例如组织)外的所有东西的图像仍然静止或固定。以这种方式,不是导管一部分的所有东西的图像将保持固定,并且是导管一部分的所有东西都将在视频中显示为旋转。在这个替代实施例中,用户观看的图像示出固定特征(例如,电极)被旋转,同时解剖特征保持静止。解剖特征是组织中的非固定特征或非球囊相关特征,例如在该视图中表示的肺静脉和由消融创建的烧伤图像。即使固定特征随着相机移动而移动,也可以实现这一点。保持所述组织针对用户固定并使设备部件移动允许医生更好地控制设备相对于组织的运动。为了促进该手术,相对于固定特征的定位计算一个或多个关键解剖特征的质心的平均旋转。然后使用旋转的平均或其他合适的表示来旋转如在用户显示器上呈现的合成图像。
图34示出了心脏消融系统的示例性框图,在此描述了其细节。图38中的任何系统组件可以包含在此所述的任何单独组件中并与其一起使用。
设置在可扩张构件上的电极的数量和设置(其中每一个可单独寻址并且可用于以单极或双极模式递送能量)提供了多种损伤形成,而不必移除和插入单独的rf导管。图31和图32中所示的示例性方法仅仅是示例性的。线性损伤和弧形损伤是可以根据期望的消融手术创建的损伤形状的另外的示例。在此提供的具体示例中,在可扩张构件10的基本上远端部分上设置有十八个独立可寻址电极。它们中的任何一个都可以被激励而其他的不可以,允许在心脏或其他组织中制造许多不同的损伤形成以用于治疗心律失常。任何电极都可以在双极模式下与任何其他电极一起使用。损伤的深度和宽度可以通过选择和/或改变在双极和单极构造中正在使用什么电极组合来控制。单极构造创建更深、更窄的损伤,并且双极构造创建更浅、更宽的损伤。
在此的设备的优点之一是电极的数量和设置允许多种损伤形成,而不需要移除和插入新的导管。可视化系统允许整个手术可视化。
图7示出了结合有包括护套管102的可滑动护套工具100的设备的远端。在使用时,如前所述,使球囊12折叠如先前所述的,然后使护套工具在折叠的球囊上滑动。然后护套管102装配到递送导管(未示出)中。然后移除护套固定件,使递送导管内的折叠的球囊准备好前进到递送部位。
本公开的一个方面是一种递送导管,该递送导管包括作为转向机构的同心鞘,其中映射系统被构建到远侧末端中,其中映射篮在递送期间驻留在两个同心轴之间的空间中并且在递送时被推进进入心脏腔室。上面描述了可部署的映射篮的示例。然后消融导管可以通过递送导管与定位篮一起递送。然后可以使用映射篮上的电极来识别用于消融的目标位置,然后使用消融导管消融目标位置。消融导管的定位可以另外通过映射篮来识别和验证。
本公开的一个方面是一种消融导管,其包括直径大约1cm至大约5cm并且位于可膨胀或可扩张结构的端部上的电极结构,并且可以包括以下中的任一个:具有承载多个电极的球囊的消融导管。在一些实施例中,多个电极被替代地用作单个消融电极,然后被用作能够监测电极间阻抗的一组单独的阻抗感测电极。这样的测量可用于表征在烧伤之前或烧伤之后由消融和/或映射消融区域所导致的烧伤的功效。在一些实施例中,接触压敏电极可以被包含作为验证电极与心脏组织的适当接触的手段。在许多实施例中,如在此其他地方所述提供冲洗,其中冲洗系统包含压力传感器。在这样的实施例中,接触压力可以从与增加在冲洗流出端口抵靠组织按压处的流出阻力相关联的冲洗系统内的压力变化中推断。在其他实施例中,使用球囊构造内的球囊,使得冲洗压力可以与膨胀压力隔离。然后膨胀系统内的压力变化与接触压力直接相关。在另一个替代中,冷却可以通过球囊内的再循环(而不是冲洗)来提供。
在一些实施例中,通过阻抗匹配来测量电极的接触压力。表征损伤质量的替代手段是测量超声通带中声阻抗的变化。声阻抗将根据温度和变性而从正常组织的声阻抗改变。在这样的实施例中,前视的us转发器可以包含在球囊中或球囊的表面上。这样的传感器可以被实施为一个或多个转发器的阵列、一个或多个发射器的阵列以及一个或多个接收器的阵列或单个转发器。
在替代实施例中,可以通过微波辐射测量来监测损伤的温度。
图39和图40示出了消融导管的示例性实施例,其中球囊被配置用于接触(物理)测量。球囊的接触压力和因此电极的特征在于,当电极被按压抵靠组织时,通过电极的球囊中的冲洗孔所引起的内部球囊压力的变化被堵塞。当球囊被按压抵靠组织时,压力将暂时增加,然后达到与冲洗端口的堵塞或部分堵塞相关联的流出阻力的任何减小相关联的新平衡。该接触压力可以通过之前的实验映射到电极接触表面区域。由可扩张结构内的相机组成的视觉接触监视器监视接触作为球囊中透明部分的视觉外观的变化。视觉外观的变化是由于与可扩张构件接触的血液和组织的外观不同造成的。
接触监测可以用来控制功率递送。通过在此所述的任何手段获得的电极接触的测量可以用于介导递送到电极的功率的量。一种控制算法限制了电极的功率,使得接触表面的每个区域的功率保持在恒定水平。
图39示出了配置用于接触测量的原型球囊。球囊714固定到轴711的端部。应变仪713固定到轴711以及引线712,该引线712与未示出的应变仪放大器对接。存在两个另外的应变仪,其以正负120度固定到轴。图40是类似设备的图示,其中全部三个应变仪被配置在轴751上的应变仪组件755中,轴751包括到应变仪组件的引线。球囊754包括电极756。在替代实施例中,可以经由一个或多个压力传感器监测被设置在球囊的近端附件附近的细胞中的封闭体积的流体或凝胶的压力。在其他实施例中,应变仪可以用位移传感器代替。如上所述,来自这种感测系统的测量可以被映射到电极接触表面的估计。图39的球囊的直径为2厘米,并且图40的球囊的直径为1至3厘米。图40的设备上的电极的构造包括八个电极。这样小的轮廓允许小递送大小和精确机动性。这样的系统与单个rf发生器兼容并且可以包括冲洗系统(未示出),以使不希望的伤害最小化。
患者映射
本公开还包括适于创建患者映射(例如,但不限于左心房的至少一部分的患者映射)的设备和系统以及创建患者映射的方法。患者映射创建组合相邻可扩张构件的解剖结构的多个不同的捕获的2d图像、可视化当图像被捕获时与可扩张构件接触的患者(例如,组织)的至少一部分的多个捕获的2d图像中的每一个。方法和系统依赖于相机与可扩张构件上的定位之间的已知或可确定的距离,以及与可视化系统具有固定关系的定位元件,使得方法可以使用全局参照系中的2d图像的位置和定向(在此一起称为“定位”)标记多个捕获的2d图像中的每一个。然后可以将多个2d图像在其标记的位置处放置在3维空间(由3个坐标-x,y,z定义的空间)中,以创建患者映射,然后可以在监视器或屏幕上显示患者映射。在此使用的患者映射可以表示为屏幕上的2d或3d的投影。例如,患者映射的3d视图可以被显示,或者患者映射的2d表示可以被显示在屏幕上。
在此的映射包括组合由可视化系统捕获的不同图像,其中在可视化系统在患者的组织内移动并与患者的组织接触时捕获图像(例如,通过移动导管或相机的视场)。在可视化相对于患者移动时,多个不同的2d图像被捕获并用于在此创建映射。
在此创建的患者映射与体积患者映射不同,其可以使用例如超声系统、ct系统和mri系统来生成。通常通过使用成像系统获得患者的2d切片来创建体积图,然后将该切片组合成患者的至少一部分的体积。系统可以允许用户扫描2d切片或3d合成物以可视化体积的不同部分。使用这些系统创建的体积与在此描述的患者映射不同。
如上所述,一些先前的组织位置映射系统(诸如可以映射左心房的那些)使用逐点映射系统,并且使用相对大量的单个点来创建3d患者映射。在此的系统可以在3维空间中创建组织映射,而不必依赖于这种类型的逐点过程。
在一些实施例中,医疗设备(例如,心脏消融导管、心脏可视化和映射导管)包括可视化系统,诸如在此的任何系统,其包括一个或多个相机,以及相对于可视化系统的一个或多个组件处于固定位置的定位元件。定位元件在这里通常被称为一个或多个组件,其位置和/或定向可以相对于全局参照系被检测到。例如但不限于,由ndimedical(位于加拿大安大略省的滑铁卢市n2v1c5)出售的aurora电磁跟踪系统利用发射低强度变化的电磁场的场发生器,在其内患者被放置以跟踪可以是多个正交线圈的传感器的位置。电磁跟踪系统和软件在全局参照系内确定传感器的位置和定向。
在一些示例性实施例中,具有一个或多个可视化元件(例如,相机)的消融导管(例如在此的任何导管)还可以包括以三个正交传感器线圈形式的定位元件,其位置和定向可以通过跟踪系统来感测,诸如由ndi、cartotm或ensitetmnavxtm系统销售的诸如aurora系统的电磁跟踪系统。在一些实施例中,诸如磁限制性(magnetorestrictive)传感器的其它磁场或rf场检测器可以替代线圈。
当定位元件相对于可视化系统具有固定的或至少已知的位置和定向时,可视化系统获得的信息可以与跟踪系统的全局参照系相关联。例如,在一些实施例中,在此的方法确定目标表面的子表面或部分的定位和定向,然后将子表面组合成目标表面的表示或患者映射。
一些方法还适于对由映射系统可视化的表面结构特征(解剖学的或创建的)成像,并将这些特征映射到目标表面的患者映射上。在此的一些方法也适于表征目标组织中的一个或多个解剖结构和患者映射中的定位。示例性的解剖结构包括心脏的腔室的内表面,例如左心房,并且示例性的结构包括小梁、肺静脉、corina、心内膜后面的血管、隔膜或经由相机可感测的光可见的其他自然特征。在此的一些方法还适于表征在模型化组织的表面内或表面上发生的生理过程。示例性的生理过程包括电信号,例如穿过心肌的转子或心电信号,并在下面更详细地描述。在此的一些方法还适于表征在模型化组织表面内或附近发生的可刺激生理结构。示例性的可刺激生理结构包括自主神经节、巴合曼束、膈神经。在此的一些方法还适于表征由医疗设备在组织上和/或组织中创建的损伤标记,例如,烧伤、染色标记或其他损伤。
图41示出适用于创建患者映射的示例性医疗设备。图41示出了消融导管420的远侧部分,其中消融导管420与上面的一些导管类似。导管420包括具有冲洗孔的可扩张膜422,其固定到细长主体424的远侧区域。在可扩张膜422内是定位元件426和可视化系统428。可视化系统428包括一个或多个相机430和光源432。导管420还包括漫反射器434。定位元件426固定到内轴436,内轴436可以包括其中的导丝腔。定位元件426具有相对于一个或多个相机430(包括相机视场(其中之一被示为“fov”))固定的位置和定向。定位元件426可以包括线圈,其在3维空间(x,y,z)和定向中的位置可以被跟踪系统检测到。导管420还包括由可扩张膜承载的一个或多个标记。如在上下文中所使用的“承载”可以是可扩张膜的外表面(直接或间接地固定到其上)之外的一个或多个元件、与膜集成的某物、或膜的内表面之内的某物。外部标记的示例包括相对于可扩张膜的外表面固定的rf电极(消融和/或感测)或柔性电路的一个或多个组件。标记的其他示例可以是视觉标记,例如具有已知尺寸和它们之间的距离的视觉标记(例如,具有已知尺寸和它们之间的已知距离的线或其他形状)。在一些实施例中,导管还包括一个或多个电极(消融和/或感测)以及由可扩张膜承载的一个或多个柔性电路,上面描述了其示例。导管420可以以上述任何方式用于递送、膨胀、消融和感测。
在此所述的方法和系统的示例性使用是创建心脏的腔室的至少一部分(诸如,左心房的表面)的患者映射,并且其是结构和电特征,诸如肺静脉、小梁、隔膜、通过包括转子的肌肉传播的电信号和穿过心脏区域或心脏区域附近的其他异常信号、神经、神经束以及任何其他传导特征。这样的示例性系统可以用于治疗心房纤颤和其他类似的疾病。
图42示出了患者映射(在此也可以称为表面映射)和可视化消融系统的实施例的远端。如图所示,固定到细长轴或导管1110并由细长轴或导管1110递送的消融导管1100的远端接触患者胸部1200内的左心房后表面1210。肺静脉口1211中的一个标记在图表面上。左心房及其后表面处于3d可映射体积1190中。
图43示出了接触左心房1210的后表面的表面映射和可视化消融系统(其可以与图41中的消融导管420相同或相似)的远侧区域的侧面截面图。如所示,示出了可扩张膜或球囊1120接触肺静脉口1211周围的心房壁组织1210。在球囊内可以看到两个相机1130和相关联的视场1113(虚线)。相机由导丝腔穿过的管状轴和在管状轴上承载。所示的横截面示出了四个电极1150,其中两个电极与心房组织接触,两个电极不与心房组织接触。定位元件1170设置在设置有导丝腔的细长构件的外表面上并由其承载。电极和/或支持电路(例如,柔性电路)可以用作标记(在此也被称为“可视化元件”),其在下文中更详细地描述。示出了参照系1180(x,y,z轴)叠加在相机1130中的一个上。
图44a-图44e示出了系统可用于创建患者映射的过程中的示例性步骤,并且在该实施例中,患者映射包括左心房的表面。该示例性过程可以用于提供用于治疗心房纤颤的消融治疗。该过程的部分在全局参照系内确定或表征在组织上的一个或多个感兴趣区域或点的位置。全局参照系由跟踪系统来定义,该跟踪系统可以感测定位元件的位置和定向。与系统组件(例如,相机)相关联的位置矢量的定位和定向以及组织中或组织上的特征可以相加以表征全局参照系内感兴趣的点或区域的位置。这可以包括将本地参照系中定义的位置向量映射到全局系内定义的位置。这可以包括将与可扩张膜接触的特征、特征或组织(或患者的任何其他部分)的位置映射到全局系中。
将使用以下约定来描述在此的参照系、位置向量和变换。参照系将以大写字母开头,后跟“f”。在此描述的示例性参照系是全局系(“gf”)、定位元件系(“lf”)和相机的参照系(“cp”)。位置矢量在此将由大写字母对(表示起点的第一个字母以及表示位置矢量的终点的第二个字母)指定。“gl”是示例性位置矢量,描述从全局系“gf”中的原点开始并在定位元件处结束的位置矢量。gl通常由定位跟踪系统来测量,其的一个示例是aurora系统。矢量“lc”描述从定位元件到相机测量的位置矢量。lc通常通过导管的设计来固定。“cs”是从相机上的点到可视化表面上的点测量的位置矢量。cs通常如下所述进行计算。“gs”是从gf的起点到点测量的表面上的点“p”的位置。当使用下标列出位置向量时,下标表示其表征的系。以全局系表征的元件可以使用或不使用系指示。
图44a-图44e概念性地示出了在表征心房壁上的点p的过程中使用的位置矢量和相对参照系,该点由位置矢量gs描述。图44a-图44e示出了具有轴x,y,z的全局参照系“gf”,其提供用于定位元件的位置和定向的参照系。图44a示出了并且图44b更详细地示出了示例性导管450的远侧区域,其中可扩张构件与肺静脉460的一个的开口周围的心房壁456的表面接触。导管450可以在创建心房壁表面的患者映射的过程中使用,无论是2d还是3d映射。图44a和图44b示出了定位元件457的位置矢量“gl”以及其在全局参照系内的位置是期望的心房壁表面上的点的位置矢量“gs”。这些点中的三个点可以用于表征表面以映射到全局参照系中。
图44c示出了图44b的视图,但是为了清楚起见已经移除了可扩张构件。可以在导管远端附近看到定位元件457,定位元件457的位置和定向可以由定义全局系gf的全局映射系统来表征。该可视化系统包括三个相机(可以使用更多或更少的相机;在此或已知的任何组件都可以使用),其相对于定位元件的位置和定向被固定。可视化系统还包括一个或多个光源(例如,在此或已知的任何照明组件),其也可以被看到固定到导管。还示出了第一相机的参照系“cf”,以及从相机到心房壁表面上的感兴趣点的位置矢量“cs”。每个相机具有与其视场相关联的参照系cf并且被对齐使得参照系cf的一个轴线与相机的光轴线共线。图44d仅示出了参照系和位置矢量。图44e示出了定位元件的位置矢量gl、定位元件参照系“lf”、从定位元件到相机的位置矢量“lc”、从相机到心房壁上的感兴趣点的相机参照系“cf”位置矢量、定位元件的位置矢量gl以及墙上的感兴趣点的位置矢量sp的特写视图。
在此描述的位置矢量的一帧到另一帧的坐标的变换在此为tsfef中(v),其描述了在位置矢量“v”上从“sf,起始帧”到“ef,结束帧”的变换。当使用如上所述的系统时,表面上的点gs(p)的位置可以通过将向量和gs(将被确定的)=gl+lc+cs相加来表征。给定所描述的系统,这个矢量和将被描述为gs=gl+lcgf+csgf,给定系统中包括的测量系统。通过适当的变换,该等式可被写为:gs=gl+lcgf+csgf,它可以变为gl+tlfgf(lc)+tcfgf(cs)),其可以变为gl+tlfgf(lc)+tlfgf(tcflf(cs))。这种转换在已知文献中有更详细的描述。因此可以使用最终等式来确定位置矢量gs,其是全局参照系中的点的表征。
图45示出了来自示例性可视化和消融导管的可扩张膜内部的相机的示例性视图。该视图包括可扩张膜470、内部消融电极472和外部电极474的一部分,其与沿着衬底延伸的各个导电迹线电连通,在此描述了其示例。cs示出了从相机到感兴趣点的位置矢量的终点。
迄今为止,这些方法利用可扩张构件的一部分与患者的至少一部分(例如,心房壁)之间的接触。当可扩张构件与患者接触时,估计相机与患者的接触部分之间的距离与相机与接触患者的特定部分的可扩张构件之间的距离相同。这是因为可扩张构件与患者的特定部位直接相邻并接触。
相机和可扩张构件之间的距离可以是已知的,或者可以被估计。在一些方法中,可扩张构件充有膨胀流体(其也可以是流过可扩张构件中的冲洗孔的冲洗流体),并且可扩张构件的形状在使用时保持大致相同。当可以估计形状以保持大致相同时,假定存在可扩张构件的已知扩张状态或构造,可以确定相机与可扩张构件上的每个定位之间的距离。在一些情况下,可扩张构件的远端的位置可相对于可扩张构件的近端调整。在这些实施例中,可以基于球囊的远端和近端之间的特定相对位置来确定相机和可扩张构件之间的距离。因此,当在使用时并且移动成与组织接触时,相机和接触的组织之间的距离总是可以基于相机和可扩张构件之间的已知距离来估计。然而,由于构造的非常微小的变化,距离可能略有变化。
当在使用时(例如,当向上挤压抵靠心房壁组织时)保持可扩张构件的构造的一种方式是将可扩张膜膨胀至或高于阈值内部流体压力,以确保可扩张构件不会有意义地变形以防止使用已知的距离。例如但不限于,在一些实施例中,如果内部流体压力是至少约0.8psi(例如,至少约1.0psi),则即使当被推靠在组织上时,可扩张构件的构造也可以保持相同。
在此的一些实施例中,可扩张膜的远端被固定到细长设备的远端,所述细长设备可以包括其中的导丝腔。在一些实施例中,轮毂设置在细长设备的远端处。细长设备可以相对于一般导管轴的远端轴向移动,这可改变可扩张构件的形状。该系统可以配置成使得细长设备中的一定量的行程(通常由于外部手柄上的致动器)可以与可扩张构件中的形状变化相关。或者,该系统可以被适配成使得手柄上的外部致动器的位置可以指示可扩张构件的构造或形状。因此,细长设备的相对轴向位置可以与可扩张构件的特定构造相关。因此可以使用细长设备或控制它的手柄组件的相对轴向位置来确定相机与可扩张构件上的定位之间的距离。
图46a-图46d示出了根据在此的方法创建的3维空间中的示例性患者映射600,包括组合由相机捕获以及使用指示定位元件的定位和定向的信息标记的多个2d图像601和602(其中的每一个包括来自3个不同相机的3个图像)。用于在3维空间中创建患者映射的方法可以利用距相机的已知/估计或计算的距离。例如,可以使用图44a-图44e中的方法和参照系之间的变换来创建图46a-图46d中所示的3d模型600。图46a和图46b示出了两组相机图像601和602,每组相机图像601和602包括来自三个不同相机的三个叠加图像,其当图像被捕获时相对于左心房中的解剖标志组合并示出。所示三角形表示相机图像中的叠加,其中每个相机视场中的单个电极叠加。所捕获的和组合的图像示出了电极603(为了清楚起见仅标注了一个)、烧伤的组织区域604以及来自相机的视场。相对于包括肺静脉口605的解剖标志示出了图像系,并且组织606的表面也可以大体上看到。图46a和图46b示出了相对于解剖标志在3维空间中的组合图像。图46c和图46d示出组合成3维空间的图像,其中解剖参照(在该实施例中为肺静脉)可以被可视化为图像的切口。例如,可以在图46d中看到三个肺静脉605的定位,其中一个肺静脉位于三个图像的交叉处,而其中两个肺静脉的部分可以在两个视场中被可视化为切口。
图46b和图46d示出了在3维空间中创建的患者映射的2d投影。2d表示可以显示在显示器或监视器上,并被认为类似于下面的图47d。
可以使用相同的手术来创建左心房的大部分表面的患者映射。
图46a-d中所示的患者映射也可以被映射到从其他成像系统(例如mri或ct系统)获得的表面获得的图像上。例如,可以使用mri系统来创建患者的左心房的3d表面,并且然后可以将在此的患者映射映射到mri3d表面上。
图47a示出左心房的示例性部分,其识别解剖标志(不是所有实际上都能够在左心房内看见)的相对位置,诸如膈神经610、巴合曼束611、4个肺静脉612、心房附件613和二尖瓣614。图45a还示出了可以可选地映射到在此任何模型的示例性“创建的”标志,例如示出组织已被消融或以其他方式被任何适当消融导管修改的烧伤标志615。例如,一旦根据任何消融过程已经消融了组织,就可以将消融的组织的定位映射到患者映射,从而在视觉上呈现给医生。因此,在此的软件可以为医生识别什么组织已被消融,从而识别什么组织没有被消融。医生然后可能想要返回并消融任何未消融的组织。图47a还示出了以染料形式注入到心脏组织中或应用到组织表面的创建的标志616。以这种方式,组织区域内的特定定位可以被标记,其因此可以用作建模过程中的附加标志。标志甚至可以是手术过程中创建的伤害,例如导丝或其他工具的伤害。标志可以是在组织上或对组织刻意制作的标记,但其不会伤害患者。然后可以将附加的标志映射到模型中,就如它是任何其他类型的标志一样。在一些实施例中,可扩张构件的轮毂包括适于将染料递送到组织中的元件,例如与染料储存器流体连通的可致动针头或用于无针头注射的端口。当该设备抵靠组织放置时,针头可以被推进到组织中,并且染料可以通过针头注射到组织中,从而创建标志。图47a中还识别了其他解剖特征(例如,上下腔静脉、冠状窦和自主神经节)。
图47b示出了使用具有三个相机的设备获得的两组图像(620'-620”'和621'-621”'),其中当设备与组织接触时获得该组图像。这两组图像使用在此的方法组合。图47c示出了组合的两组捕获的图像,并且包括视场内的标志。图47c是投影在2d平面上并显示的患者映射的示例。图47c还示出了映射到患者映射上的电生理学标志,包括转子表示622和异常电活动623的指示符,其可以使用任何映射电极624(为了清楚起见仅标记1)来感测。也可以看到口的部分。
图47d示出了可以呈现给用户的示例性显示的患者映射,其中多个标志(以及不同类型的标志)被映射到患者映射。三个口625的部分在视场中。烧伤标志626已被添加到患者映射,其指示组织被消融的位置。还包括解剖标志627(显示为“b”图标),其指示巴合曼束的定位以及指示膈神经的定位的标志628(显示为“p”图标)。
创建患者映射需要标记至少两个图像以包含在映射中。将被标记的图像可以被自动标记,或者可以基于用户输入来标记。例如,系统可以自动标记已经建立联系的所有图像,并使用这些这些图像中的任何一个(或全部)来创建映射。系统可以定期或不定期自动捕获图像。或者,该系统可以适于接收用户输入(例如,按下按钮)以使图像的标记被用于创建患者映射。可以使用任意数量的自动或非自动方式来指示应在映射创建中使用什么图像。
在此创建的映射可以被实时显示,或者映射可以被存储用于以后的可视化和分析。
在一些实施例中,该方法包括使用可扩张膜上的一个或多个电极激发特定定位处的组织,然后监测响应,并且基于该响应,该方法然后可以映射该位置。作为示例,该设备可以抵靠组织定位,以便试图激发巴合曼束611(见图47a)。当检测到心室收缩时,巴合曼束的位置可以映射到模型。或者,激发可以试图过度激发巴合曼束来抑制或干扰收缩。当检测到收缩已被抑制或干扰时,可以将该位置映射到模型。或者,该设备可以用于激发膈神经,然后该方法包括监测膈膜收缩。如果膈膜收缩,则膈神经的定位可以映射到模型。
图48a和图48b示出了可以映射到在此的任何患者映射的另外的示例性创建的标志。在该示例中,计算机实现的方法(例如,算法)检测并指示在可扩张构件和组织之间已经接触了哪里。然后可以将任何类型的指示符映射到映射上,以视觉地指示已经接触了哪里。该方法可以适用于检测非电极和非柔性电路区域中的视场中的图像颜色。白色区域指示缺少血流,因此指示正在抵靠组织进行接触。红色指示血流,因此表示设备和组织之间缺少接触。在任何特定的电极周围可以存在红色和白色的程度,这可能指示设备和组织之间的部分接触。该方法然后将接触区域(或非接触区域)映射到患者映射,其提供映射在患者映射上的视觉指示符,以供医生理解设备和组织之间已经接触了哪里,以及在设备和组织之间哪里没有接触。
图48a示出了在组织消融之前的图像,并且图48b示出了在消融之后的所捕获的图像。在该实施例中,该设备包括四个相机,其中已经组合了来自这些相机的图像。虚线区域指示在可扩张构件附近哪里存在血液(由于球囊与组织之间缺少足够的接触,因此血液存在于球囊与组织之间)。白色区域631指示在哪里球囊接触组织,从视场中除去血液,并且在图像中显示白色(或至少不同于指示血液的红色)。图48b中的区域632(显示为内衬)指示在哪里使用与组织接触的电极(如由缺少血液指示所指示的)组织已经被烧伤或消融。然后可以将区域632的定位映射到患者映射上,并且被显示为医生可以理解该组织已经被烧伤。图48a还示出了另一个解剖标志633,其如所示的是血液的细流(被看作图像中红色和白色之间的对比)。该血液的细流是从设备附近的肺静脉流出(进入左心房)的血液。口的定位一般示出在634处。即使无法看见口,血液的细流的出现也可用作口的定位的指示。因此特定的血流可以提供不同解剖标志位于哪里的指示。因此,血流633的存在和定向可以用作将口映射到在此的任何患者映射上的方式,或者简单地作为医生定位口的有用指示符。图48a还指示叠加区域635,其中来自两个不同相机的图像被叠加以呈现较大的组合图像。
在利用定位元件的一些实施例中,相机和可扩张构件之间的距离可以是未知的,并且可以需要被计算或估计。例如,如果可扩张构件不保持基本恒定的形状(例如,流体压力不在阈值以上),则距离可以改变,并且估计距离的方式可以提高创建的患者映射的准确性。一个概念利用标记的已知尺寸和可视化系统的能力捕获标记的图像以确定相机和感兴趣的组织区域之间的距离。当可扩张膜和相关标记被放置与组织接触时,接触的组织和相机之间的距离与标记和相机之间的距离几乎相同。因此,确定相机和标记之间的距离提供了相机和接触的组织之间的期望的距离。相机和标记之间的距离(例如,由球囊承载的电极、柔性电路组件等)可以通过在接触组织之后,量化可视化尺寸并将其与相对于该视场的已知标记尺寸进行比较来确定。如果在所捕获的视场中标记的相对尺寸保持不变,则标记将处于离相机已知的距离处,并且因此组织区域将处于离相机的已知距离处。例如,如果捕获的图像中的以像素为单位的标记的特定尺寸大于其以像素为单位的预期尺寸,则标记(和组织)或其一部分将比球囊处于预定膨胀状态时更接近相机,这可能是由于通过使球囊抵靠组织折叠而使球囊向内变形。捕获图像中的标记的尺寸也可以例如指示标记是否由于与不与图像平面共面的组织表面接合而歪斜。这可以是组织表面曲率的指示符。捕获图像中的标记尺寸因此可以帮助确定标记与相机之间的距离以及相机与组织区域之间的距离。
并且一旦确定了相机和接触的组织之间的距离,就可以使用相机视场与(从相机相对于定位元件的固定位置和定向表征的)全局参照系之间的已知关系来将组织区域放置在全局参照系中。可以针对多个组织区域重复该过程,然后可以通过使用例如在软件中实现的已知数学关系将多个成像的组织区域组合到全局参照系中来创建患者映射。
在距离是未知的并且正被估计的实施例中,cs是等式右侧上的未知位置矢量。gl可以通过跟踪系统感测,并且lc通过导管的设计被固定。可以使用标记的已知尺寸来估计cs(经由计算)。图49a-图49c示出了使用示例性标记来估计cs的示例性过程。当与组织表面接触的球囊表面相对平坦且接近平行于可视化系统的图像平面时,如果标记的尺寸和可视化系统的视场是已知的,则可视化系统的图像平面与视场内的标记之间的距离可以被确定。在在此描述的实施例中,标记可以是以下中的任何一个或多个;消融元件(例如,电极)或消融元件或其支撑柔性电路的特征、导丝轴的一部分、印刷或结合到球囊的表面或导丝杆轴的外表面上的特征、由导丝轴承载的元件,以及由相机外壳承载的元件。
对于如上所述的情况,到球囊表面上的缩放元件的距离“d”将近似于以下关系:
其中xm是可视化元件的已知尺寸,pixtot是与相机的图像平面上的已知长度特征平行的相机的图像平面上的像素的总数,pixref是跨越相机的图像平面上的已知长度特征的相机的图像平面中的像素的数量,并且α是包括在视场中的角度。这适用于像素均匀间隔且水平和垂直像素数相等的情况。
球囊与感兴趣的点相接触,并且因此计算的相机和标记之间的距离可以被用作相机与该点之间的距离或cs的估计。然后可以使用cs在全局参照系中表征该点的位置矢量gs。该过程可以根据需要重复多个点或表面区域来创建患者映射。
当组合图像帧以创建患者映射时,由于例如当捕获特定图像时相机和参照特征之间的距离差异,可能不会精确地缩放一些参照特征(例如,设备上的标记或解剖参照(例如,肺静脉口))。例如,相机和特征之间的距离可以取决于可扩张膜和组织之间的接触程度。在一些实施例中,患者映射因此可以包括自动缩放图像中的一个或多个参照特征以创建其中参照特征要缩放或尽可能接近缩放的患者映射。
这里的系统可以适应于多种可视化模式。例如,该系统可以适应于在2d平面和3维空间中的一个或两个中生成的映射。用户界面可以允许用户(例如,医生)在这些模式之间进行选择。或者,用户界面可以适用于同时显示2d和3d模型。
本公开内容还包括将图像组合(也可以被称为拼接)在一起以创建合成图像的方法。在一些实施例中,当可视化系统在患者内部和相对于患者移动时,可以捕获图像。通过利用图像中的共同特征可以将图像拼接在一起。在此的任何标志都可以用作将图像组合在一起的共同特征。例如,可以使用以多个图像显示的自然标志(例如,口)来将多个图像拼接在一起,从而可视化口。诸如创建的标志的其他标志可以用作多个图像来组合图像的共同特征。电生理学标志可以类似地用作组合图像的共同特征。例如,该方法可以使用监视信号的定时关系来帮助将图像拼接在一起。例如,参照图31,信号之间的相位可以用来帮助将图像拼接在一起。
当将图像组合或拼接在一起时,方法可以与上面设置的定位元件和全局参照系一起使用,但是方法不需要包括使用定位元件。定位元件的使用可以使得通过在全局参照系中具有已知的感测位置和定向来创建患者映射变得更容易,但是如果标志可以用于有效地创建可用映射,则可以不是绝对必要的。因此,本公开还包括在不使用定位元件的情况下创建利用任何类型的标志的组合图像的映射的方法和系统。
在许多情况下,在映射过程期间要映射的表面将会运动。例如,当映射左心房表面和心脏跳动时就是这种情况。在这种情况下,捕获与运动相关的信号(诸如在这种情况下为ecg)并且在时间上将ecg与在映射过程期间捕获的数据与获取其的时间相关联是有用的。完成这种关联的一种方法是使用时间戳标记两组数据,并使用时间戳来完成关联。
- 还没有人留言评论。精彩留言会获得点赞!