一种用于使药物活性成分微粒化和/或靶向滑膜组织的方法与流程
本发明涉及一种方法,其通过施用包含三嵌段共聚物和二嵌段共聚物的可生物降解药物递送组合物来将至少一种药物活性成分微粒化和/或靶向滑膜组织和/或其他关节组织(如关节软骨、韧带、肌腱、半月板等),其中所述三嵌段共聚物含有聚酯和聚乙二醇,所述二嵌段共聚物含有聚酯和一个封端的聚乙二醇。
背景技术:
关节炎是影响关节和周围组织的情形的总称。关节是身体中骨骼聚集的地方,例如膝盖、手腕、手指、脚趾和臀部。两种最常见的关节炎类型是骨关节炎和类风湿性关节炎。骨关节炎是最常见类型的关节疾病,仅在美国就影响了超过2000万人。它是70多岁以上人慢性残疾的主要原因,每年花费美国超过1,850亿美元。这是一种痛苦的退行性关节疾病,常常涉及臀部、膝盖、颈部、腰背部或手部小关节。骨关节炎通常发生于因进行特定的作业或玩喜爱的运动或体重过重而反复过度使用导致受伤的关节中。骨关节炎可以被认为是由滑膜关节中关节(透明)软骨的生物化学分解引起的退行性疾病。然而,目前的观点认为,骨关节炎不仅涉及关节软骨,还涉及整个关节器官,包括软骨下骨和滑膜。类风湿性关节炎是一种自身免疫性炎症性疾病,通常涉及手指、拇指、手腕、肘,肩、膝、脚和踝关节中的各种关节。自身免疫性疾病是身体释放攻击自身健康组织的抗体和酶的一种疾病。在类风湿性关节炎中,这些酶会破坏关节的内层。这会导致疼痛、肿胀、僵硬、畸形,以及活动和功能减少。例如,在类风湿性关节炎中,骨关节中未调节的趋化因子积聚吸引并激活浸润的巨噬细胞和t细胞。这些细胞的活化诱导滑膜细胞增殖,这至少部分地导致炎症和最终的骨和软骨损失(参见devries,m.e.等,seminimmunol11(2):95-104(1999))。痛风是由滑膜液和其他组织中沉积的单钠尿酸盐晶体或肾脏中形成的尿酸结石所导致的一种疾病。痛风通常发生在中年,在30岁以前不常见。女性绝经前很少有痛风性关节炎发作。此外,有超过100种疾病可归类为风湿性疾病,例如强直性脊柱炎、纤维肌痛、感染性关节炎、幼年特发性关节炎、红斑狼疮、风湿性多肌痛、银屑病关节炎、反应性关节炎和硬皮病。这些风湿性疾病通过引发磨损和撕裂关节炎、感染自身免疫性疾病或晶体性疾病如痛风而牵连关节。一般而言,用非甾体类抗炎药(nsaid)治疗以慢性肌肉骨骼疼痛和各种形式的急性疼痛为特征的关节炎和其他风湿性疾病。nsaid通过抑制酶pgg/h合酶(也称为环氧酶(cox))的活性来阻断前列腺素的产生。cox有两种异构体;即调节和组织分布不同的cox-1和cox-2。cox-1在基础条件下表达并且参与起稳态作用的pg的生物合成。cox-2的表达在一些病态状况和炎症期间增加(crofford等,arthritisrheum(2000),43:4-13)。美国专利8,557,865b2公开了用戊脉安、地尔硫卓、硝苯地平,普鲁卡因胺、河豚毒素及它们的混合物的离子通道调节剂来治疗骨关节炎的方法。该方法包括将这些离子通道调节剂注入患者关节的关节内空间中。thakkar等,drugsrd(2007):8(5)275-285公开了关节内给药后增加了物质负载(issues-loaded)的固体纳米颗粒的保留。发现该保留在注射后4小时为10.13%,这比溶液中的塞来昔布高出近16倍。morgen等人,pharmres(2013)30:257-268也使用纳米颗粒用于关节内注射到膝关节后来改善局部保留。这些纳米颗粒是阳离子的,并且已经证明从这些纳米颗粒每周释放约20%的结合肽。然而,本领域中仍然有需求将药物活性成分递送到哺乳动物的关节中,其中关节在滑膜区域中保留药物活性成分从而使药物在更长的时间内递送。本领域中还需要提供一种制剂,该制剂中至少一种药物活性成分的释放速率可以通过制剂的微粒化来调节,该制剂是可生物降解的药物递送组合物。本领域还需要将药物活性成分直接靶向滑膜组织和/或其他关节组织,包括滑膜和滑液,并且药物活性成分保留在滑膜组织中。在将至少一种活性成分靶向滑膜组织和/或其他关节组织并微粒化时,药物随时间的释放速率可随时间调节。通过本发明的技术实现要素:、优选实施例和权利要求中的描述,本发明实现了上述以及其他目标。
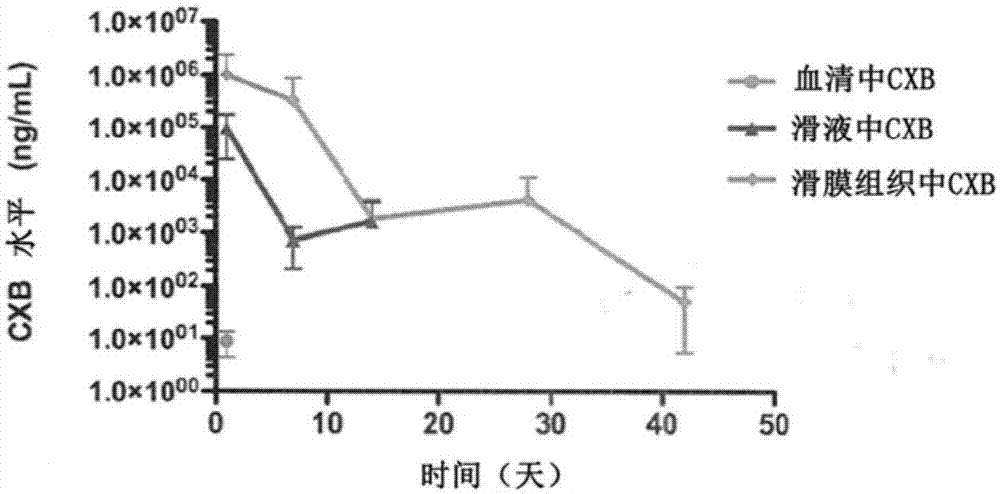
发明内容本发明提供了一种方法,用于使包含至少一种药物活性成分的可生物降解的药物递送组合物微粒化,所述方法包含:(1)配制可生物降解的药物组合物,其包含(a)下式的可生物降解的三嵌段共聚物:plav-pegw-plax其中v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,并且v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:mpegy-plaz其中y和z是重复单元的数目,y在3到45范围内且z在7到327范围内,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的二嵌段共聚物的比率为3:2~1:19;和(c)至少一种药物活性成分;(2)在患者的至少一个关节中施用所述配制的可生物降解的药物递送组合物,使得其被包含在铰接关节囊(thearticulatingjointcapsule)内。在用于使可生物降解的药物递送制剂微粒化的方法中,通过注射器吸取用于施用的制剂并注射到所述至少一个关节中,或通过将制剂暴露于水溶液并手动放置到关节内而人工地形成固体填塞物。这种用于微粒化的方法导致可生物降解的药物递送制剂受到机械性挑战,例如由关节的内部结构、关节连接、负重和/或滑液压力导致的那些挑战。在这种微粒化方法中,可生物降解的药物递送制剂破裂成碎片。在该微粒化方法中,至少一种药物活性成分以1%至85%(w%/w%)的量存在于所述可生物降解的药物递送制剂中,并且三嵌段和二嵌段中的聚乙二醇链的范围为300da至12kda。另一方面,三嵌段和二嵌段中的聚乙二醇链为2kda。在一个实施方式中,聚乳酸重复单元与环氧乙烷的摩尔比在三嵌段中为1.6至7.2,在二嵌段中为1.9至4.8,并且三嵌段中的聚合度为72至324,二嵌段中的聚合度为85.5至216。一方面,三嵌段的含量为6%至24%(wt%/wt%),二嵌段的含量为12%至40%(wt%/wt%)。在另一个实施方式中,可生物降解的药物递送组合物包括在生物相容性有机溶剂中混合三嵌段共聚物与二嵌段共聚物,以形成三嵌段共聚物和二嵌段共聚物的混合物,并向所述三嵌段共聚物和二嵌段共聚物的混合物中添加至少一种药物活性成分。在该方法的另一方面,溶剂可以被蒸发掉。在另一方面,三嵌段共聚物和二嵌段共聚物混合物以及至少一种药物活性成分进一步暴露于水溶液以形成固体填塞物。如本文所述,在这种用于微粒化的方法中,可生物降解的药物组合物的碎片破裂成更小的碎片。这些碎片可为约1厘米到1微米之间。在另一个实施方式中,在微粒化的方法中,以膝关节0.1~6ml、髋关节0.1~6ml、踝关节0.1~4ml、肩关节0.1~6ml、肘关节0.1~2ml的量向患者施用。另一方面,所述至少一种药物活性成分可以应用于手术后的应用,所述术后应用可以是例如全部或部分膝关节替换、全部或部分髋关节替换、全部或部分踝关节替换、关节镜或开放性关节手术、微骨裂、自体软骨细胞移植、镶嵌式成形术、清创和灌洗、韧带修复、肌腱修复、旋转套修复、半月板手术、滑膜切除术或通过关节内注射用于炎性疾病或关节疼痛的非手术应用。在另一方面,本发明提供了一种包含至少一种药物活性成分的可生物降解的药物递送组合物,包含:(1)配制可生物降解的药物组合物,其包含(a)下式的可生物降解的三嵌段共聚物:plav-pegw-plax其中v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,并且v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:mpegy-plaz其中y和z是重复单元的数目,y在3到45范围内且z在7到327范围内,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的二嵌段共聚物的比率为3:2~1:19;和(c)至少一种用于使所述可生物降解的药物递送组合物微粒化的药物活性成分;其中所述配制的可生物降解的药物递送组合物被包含在铰接关节囊内来微粒化。本发明还提供了一种用于使至少一种药物活性成分靶向滑膜组织的方法,所述方法包括向需要这种治疗的哺乳动物或动物施用可生物降解的药物递送组合物,所述可生物降解的药物递送组合物包含:(a)下式的可生物降解的三嵌段共聚物:av-bw-ax其中a是聚酯,b是聚乙二醇,v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,并且v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:cy-az其中a是聚酯,c是封端的聚乙二醇,其中y和z是重复单元的数目,y在3到45范围内且z在7到327范围内,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的ca二嵌段共聚物的比率为3:2~1:19;和(c)至少一种药物活性成分。另一方面,本发明提供了一种用于使至少一种药物活性成分靶向滑膜组织的方法,所述方法包括向需要这种治疗的哺乳动物或动物施用可生物降解的药物递送组合物,所述可生物降解的药物递送组合物包含:(a)下式的可生物降解的三嵌段共聚物:av-bw-ax其中a是聚酯,b是聚乙二醇,v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,并且v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:cy-az其中a是聚酯,c是封端的聚乙二醇,其中y和z是重复单元的数目,y在3到45范围内且z在7到327范围内,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的ca二嵌段共聚物的比率为1:3~1:9;和(c)至少一种药物活性成分。在另一方面,本发明提供了一种用于使至少一种药物活性成分靶向滑膜组织的方法,所述方法包括向需要这种治疗的哺乳动物或动物施用可生物降解的药物递送组合物,所述可生物降解的药物递送组合物包含:(a)下式的可生物降解的三嵌段共聚物:av-bw-ax其中a是聚酯,b是聚乙二醇,v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,v和x是酯重复单元,w是环氧乙烷重复单元,v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:cy-az其中a是聚酯,c是封端的聚乙二醇,其中y和z是重复单元的数目,y在3到45范围内且z在7到327范围内,y是环氧乙烷重复单元的数目,z是酯重复单元的数目,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的ca二嵌段共聚物的比率为3:2~1:19;和(c)至少一种药物活性成分。另一方面,本发明提供了一种用于使至少一种药物活性成分靶向滑膜组织的方法,所述方法包括向需要这种治疗的哺乳动物或动物施用可生物降解的药物递送组合物,所述可生物降解的药物递送组合物包含:(a)下式的可生物降解的三嵌段共聚物:av-bw-ax其中a是聚酯,b是聚乙二醇,v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,v和x是酯重复单元,w是环氧乙烷重复单元,v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:cy-az其中a是聚酯,c是封端的聚乙二醇,其中y和z是重复单元的数目,y在3到45范围内且z在7到327范围内,y是环氧乙烷重复单元的数目,z是乳酰基或乳酰基重复单元的数目,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的ca二嵌段共聚物的比率为1:3~1:9;和(c)至少一种药物活性成分。在另一个实施方式中,一种用于使至少一种药物活性成分靶向滑膜组织的方法,所述方法包括向需要这种治疗的哺乳动物或动物施用可生物降解的药物递送组合物,所述可生物降解的药物递送组合物包含:(a)下式的可生物降解的三嵌段共聚物:plav-pegw-plax其中v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:pegy-plaz其中y和z为3到237或3到371的重复单元的数目,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的二嵌段共聚物的比率为3:2~1:19;并且其中二嵌段共聚物中的peg是封端的;和(c)至少一种药物活性成分。本发明的另一方面,涉及一种用于使至少一种药物活性成分靶向滑膜组织的方法,所述方法包括向需要这种治疗的哺乳动物或动物施用可生物降解的药物递送组合物,所述可生物降解的药物递送组合物包含:(a)下式的可生物降解的三嵌段共聚物:plav-pegw-plax其中v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:pegy-plaz其中y和z是重复单元的数目,y在3到45范围内且z在7到327范围内,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的二嵌段共聚物的比率为1:3~1:9;并且其中二嵌段共聚物的peg是封端的;和(c)至少一种药物活性成分。另一方面提供了一种用于使至少一种药物活性成分靶向滑膜组织的方法,所述方法包括向需要这种治疗的哺乳动物或动物施用可生物降解的药物递送组合物,所述可生物降解的药物递送组合物包含:(a)下式的可生物降解的三嵌段共聚物,其含量为总组合物的2.0%至45%(w%/w%):plav-pegw-plax其中v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物,其含量为总组合物的8.0%至50%(w%/w%):pegy-plaz其中y和z是重复单元的数目,y在3到45范围内且z在7到327范围内,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的二嵌段共聚物的比率为3:2~1:19;并且其中二嵌段共聚物的peg是封端的;和(c)至少一种药物活性成分,其含量为总组合物的1%至20%(w%/w%)。另一方面提供了一种用于使药物活性成分靶向滑膜组织的方法,所述方法包括向需要这种治疗的哺乳动物或动物施用可生物降解的药物递送组合物,所述可生物降解的药物递送组合物包含:(a)下式的可生物降解的三嵌段共聚物:plav-pegw-plax其中v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:pegy-plaz其中y和z为7至371的重复单元的数目,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的二嵌段共聚物的比率为1:3~1:9,并且其中二嵌段共聚物的peg是封端的,其中聚合物总含量为总组合物的20%至50%(w%/w%);和(c)至少一种药物活性成分,其含量为总组合物的10%至20%(w%/w%)。在用于使至少一种药物活性成分靶向滑膜组织的方法中,本发明的可生物降解的药物递送组合物在组合物中的乳酸与环氧乙烷的摩尔比对于三嵌段共聚物可以为0.5至3.5或0.5至22.3,以及对于二嵌段共聚物可以为2至6或0.8至13。另一方面,在用于使药物活性成分靶向滑膜组织的方法中,本发明的可生物降解的药物递送组合物在组合物中的乳酸与环氧乙烷的摩尔比对于三嵌段共聚物可以为0.5至2.5以及对于二嵌段共聚物可以为3至5。在一个方面,可生物降解的药物递送组合物是可注射液体,当其被注入关节内空间时成为硬化植入物并在长持续时间内释放至少一种药物活性成分。在另一方面,可生物降解的药物递送组合物可以用作空间制剂(spatialformulation),使得其可以施用到哺乳动物的关节内空间上或内部。例如,它可以在手术过程中分散到关节内空间来治疗滑膜组织。另一方面,该靶向方法中的至少一种药物活性成分可以应用于手术后的应用,所述术后应用可以是例如全部或部分膝关节替换、全部或部分髋关节替换、全部或部分踝关节替换、关节镜或开放性关节手术、微骨裂、自体软骨细胞移植、镶嵌式成形术、清创和灌洗、韧带修复、肌腱修复、肩袖(rotatorcuff)修复、半月板手术、滑膜切除术或通过关节内注射用于炎性疾病或关节疼痛的非手术应用。另一方面,可生物降解的药物组合物呈可插入关节中的固体棒状植入物的形式。除了固体棒之外,还可以根据它们的医疗应用制成其他形状并插入体内。本发明的另一方面是如本文所述的可生物降解的药物组合物在将至少一种药物活性成分靶向哺乳动物或动物的滑膜组织中的应用。其他方面和实施方式如下所述或容易地从下面对优选实施方式的描述中产生。附图说明图1.体内定量递送至滑液、滑膜组织和血清的塞来昔布随时间(天)的药代动力学曲线图。图2.代表羊膝盖中f14分布的羊中f14的宏观照片。图3.羊血浆、滑液和滑液组织中的塞来昔布随时间的药代动力学图。在14天的研究期间,滑液组织维持了极高水平的塞来昔布。图4.单个羊滑膜组织中的乳酸的定量图。具体实施方式如本文所用,术语“可生物降解”是指三嵌段共聚物和二嵌段共聚物在一段时间后会在体内流失(erode)、降解或粒化而形成更小的无毒组分。术语“动物”包括动物界的所有成员。如本文所用,哺乳动物包括雌性具有乳汁分泌腺的任意组脊椎动物,包括人类。哺乳动物的例子包括但不限于猫、狗、人、猪、马、牛、猿、黑猩猩等。“活性成分”是指用于治疗关节各种疾病的药品或药物。因此,活性成分、药品和药物可以互换使用。本文所用的术语药品或活性成分包括但不限于在动物体内局部或全身作用的生理学或药理学活性物质。在本发明的方法中使用的本发明的可生物降解的药物组合物中存在至少一种活性成分。在本发明的方法中可以使用超过一种的活性成分,例如非甾体类抗炎药和局部麻醉剂。如本文所用,“疾病”是指由感染、饮食或由机体的错误运转而引起的哺乳动物(例如人或动物)的任何失调。术语“植入物”是指药物递送组合物是可注射的,是原位形成并且可生物降解的,并且当注射到关节内空间时变成固体植入物。因此,所合成的制剂是液体,使得它们可以容易地通过注射器进行注射而无需过度用力。术语“空间制剂”包括可以施用于哺乳动物或动物体上或体内的任何制剂,并且不是必须通过注射器施用。如本文所用,“重复单元”是聚合物的基本重复单元。“封端的聚乙二醇”(cpeg)是指其中一个末端羟基发生反应的peg,包括烷氧基封端的peg、尿烷封端的peg、酯封端的peg及类似化合物。封端基团是不含易与如丙交酯、乙交酯、己内酯等环状酯或其他酯和其混合物反应的化学官能团的化学基团。封端的peg聚合物与丙交酯的反应生成二嵌段cpeg-pla共聚物。如本文所用,聚乙二醇(在本申请中缩写为peg)有时被称为聚(环氧乙烷)或聚(氧乙烯),这些术语在本发明中可互换使用。缩写“pla”是指聚(乳酸)。缩写“plga”是指聚(乳酸-共-乙醇酸)。缩写“t”或“tb”是指三嵌段共聚物,而缩写“d”或“db”是指二嵌段共聚物。本文所用的术语“二嵌段”是指例如封端的peg-聚酯共聚物。“mpeg”是指甲氧基聚乙二醇。术语“三嵌段”是指例如聚酯-peg-聚酯共聚物。如本文所使用的,术语“滑膜组织”是指薄的、疏松的血管结缔组织,其构成、更具体而言连接例如在手和脚中的所有关节的内部和肌腱周围的鞘。滑膜组织含有滑膜细胞,其分泌称为滑液的粘液;这种液体含有蛋白质和透明质酸,并作为关节软骨表面的润滑剂和营养剂。“滑膜组织病况”是指影响滑膜组织或滑液的任何疾病,并且可以包括任何类型的关节炎,包括骨关节炎、类风湿性关节炎、痛风,和风湿性疾病,包括强直性脊柱炎、纤维肌痛、感染性关节炎、幼年特发性关节炎、红斑狼疮、风湿性多肌痛、银屑病性关节炎、反应性关节炎和硬皮病。如本文所用,“滑膜”是围绕关节的膜,也称为滑膜组织,其分泌润滑组织并为组织提供营养的流体。如本文所用,“其他关节组织”包括但不限于关节软骨、韧带、半月板、肌腱、旋转套等。如本文所用的,“关节内”是指两个骨头之间的关节内部的空间,特别指关节囊所容纳的关节部分。意思是“关节的内部”,关节内可以指空间本身,或者对于身体的可移动关节来说,指滑膜(关节囊内衬)内部的任何组织或流体。滑膜内有滑液(关节的润滑液)以及关节软骨(在邻接的骨表面之间提供了近乎无摩擦的滑动表面或缓冲垫)。其他关节类型可能在关节内空间作为将两个骨骼保持在一起的韧带。在滑膜或可活动关节中,这些组织是关节外的,或关节囊外的。如本文所用,“靶向”是指将至少一种药物活性成分递送至哺乳动物或动物的方法,从而增加滑膜组织中的药物相对于身体其它部分的浓度。所述靶向使药物活性成分定位滑膜组织并延长作用。“微粒化”是指分解成碎片或颗粒的行为、细分、分散。这与粉碎相同。微粒化可用于靶向关节、软骨、韧带、肌腱、滑液、旋转套、半月板、滑膜切除术或用于炎性疾病或关节疼痛等的通过关节内注射的非手术应用因此,在一个方面,本发明涉及一种用于使包含至少一种药物活性成分的可生物降解的药物递送组合物微粒化的方法,该方法包括:(1)配制可生物降解的药物组合物,其包含:(a)下式的可生物降解的三嵌段共聚物:plav-pegw-plax其中v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,并且v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:mpegy-plaz其中y和z是重复单元的数目,y在3到45范围内且z在7到327范围内,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的二嵌段共聚物的比率为3:2~1:19;和(c)至少一种药物活性成分;(2)在患者的至少一个关节中施用所述配制的可生物降解的药物递送组合物,使得其被包含在铰接关节囊内。在所述用于使配制的可生物降解的药物递送组合物微粒化的方法中,该配制的可生物降解的药物递送组合物可通过注射器吸取而施用并注射到所述关节中,或通过将配制的可生物降解的药物递送组合物暴露于水溶液并手动放置到关节内而人工地形成固体填塞物。在后一种递送体系中,可生物降解的药物递送组合物可以根据所放置的关节的面积来成形。因此,尺寸和形状可能会根据关节的种类而有所不同。当施用于关节时,可生物降解的药物组合物可受到由关节的内部结构、关节连接、负重和/或滑液压力导致的机械性挑战。这种机械性挑战被认为有助于可生物降解的药物组合物的微粒化。在这种微粒化方法中,可生物降解的药物递送组合物破裂成碎片。随着时间的推移,这些碎片可能会进一步降解,并可能分解成更小的碎片。这些小片可以为1厘米到1毫米,进一步降到1微米。碎片可以随着时间的推移被分解。所述至少一种药物活性成分(api)可以以1%至85%w%/w%的量存在于可生物降解的药物递送组合物中。另一方面,所述至少一种api可以以1%至40%w%/w%的量存在于可生物降解的药物组合物中。另一方面,所述至少一种api可以以5%至40%w%/w%的量存在于可生物降解的药物组合物中。另一方面,所述至少一种api可以以5%至15%w%/w%的量存在于可生物降解的药物组合物中。另一方面,所述至少一种api可以以5%至30%w%/w%的量存在于可生物降解的药物组合物中。可用于本发明的可生物降解的药物递送组合物中的至少一种药物活性成分包括抗氧化剂,例如没食子酸烷基酯、丁基羟基茴香醚(bha)、丁羟甲苯(bht)、α-生育酚、抗坏血酸、多酚类,黄酮类,β-胡萝卜素,维生素a,维生素c,维生素e,硫辛酸,二硫代乙硫酮(dithiolethione)、卵磷脂(ovothiol)、谷胱甘肽、硒、槲皮黄酮、褪黑激素、亚硫酸钠、亚硫酸氢钠、焦亚硫酸钠、巯基乙酸、硫代甘油、l-半胱氨酸或它们的组合。抗感染剂是抑制感染的药剂,包括抗病毒剂、抗真菌剂和抗生素。抗病毒剂是抑制病毒的药剂,包括阿糖腺苷、阿昔洛韦和三氟胸苷。抗真菌剂是抑制真菌生长的药剂。抗真菌剂包括两性霉素b、霉康唑、特康唑、益康唑、异康唑、硫康唑、联苯苄唑(biphonazole)、克霉唑、酮康唑、布他康唑、伊曲康唑、奥昔康唑、苯唑康唑(phenticonazole)、制霉菌素、萘普芬(naphthyphene)、齐诺康唑、环吡唑胺(cyclopyroxolamine)和氟康唑。主要类别的抗生素有:(1)β-内酰胺类,包括青霉素类、头孢菌素类和单环β-内酰胺类;(2)氨基糖甙类,例如庆大霉素、妥布霉素、奈替米星和阿米卡星;(3)四环素类;(4)磺胺类和甲氧苄氨嘧啶;(5)氟喹诺酮类,例如环丙沙星、诺氟沙星和氧氟沙星;(6)万古霉素;(7)大环内酯类,包括例如红霉素、阿奇霉素和克拉霉素;和(8)其他抗生素,例如多粘菌素、氯霉素和林可酰胺类抗生素。许多药物属于可用于治疗肿瘤疾病的化疗药。这些药物可以包括抗代谢物,例如甲氨蝶呤(叶酸衍生物)、氟尿嘧啶、阿糖胞苷、巯嘌呤、硫鸟嘌呤、胃酶抑素(嘧啶和嘌呤类似物或抑制剂)、各种天然产物如长春新碱和长春花碱(长春花生物碱)、依托泊苷和替尼泊苷、各种抗生素如美托霉素(miotomycin)、普卡霉素、博来霉素、阿霉素、道诺霉素,更生霉素;多种生物反应调节剂,包括干扰素-α;各种各样的其他试剂和荷尔蒙调节剂,包括顺铂、羟基脲、米托蒽醌、丙卡巴肼、氨鲁米特、泼尼松、孕激素、雌激素、抗雌激素如他莫西芬、雄激素类固醇、抗雄激素药如氟他胺、促性腺激素释放激素类似物如亮丙瑞林、基质金属蛋白酶抑制剂(mmpi)以及抗癌剂,包括紫杉酚(紫杉醇)和相关分子,统称为紫杉烷类、紫杉碱或紫杉烷。抗疼痛剂如抗-ngf、自毒素抑制剂/lpa受体拮抗剂、trpv1拮抗剂,nav1.7拮抗剂和消退素。nsaid、非cox-2特异性或cox-2特异性,如cox-2抑制剂、mpegs-1抑制剂、ep4-受体拮抗剂、依托芬那酯、塞来昔布、阿利考昔、罗非考昔、萘丁美酮、贝诺酯、依托考昔、安吡昔康、氨丙洛芬(aminophemazone)、伐地考昔、对乙酰氨基酚、丁苯羟酸、尼美舒利、帕瑞考昔、甲灭酸、右布洛芬、布洛芬、氟比洛芬、阿司匹林、右酮洛芬、双氯芬酸、二氟尼柳、依托度酸、非诺洛芬、氟洛克、氟比洛芬、吲哚美辛、酮洛芬、酮咯酸、氯诺昔康、洛索洛芬、洛索马克、罗美昔布、甲氯芬那酸、美洛昔康、萘普生、甲氧基甲基萘乙酸、尼莫洛(nimalox)、奥沙普秦、吡罗昔康、水杨酰水杨酸、舒林酸,替诺昔康,托芬那酸及它们的混合物。dmoad例如hif2α抑制剂、补体级联调节剂、tgfβ信号调节剂、锌转运蛋白、聚蛋白多糖酶抑制剂和ep4-受体拮抗剂。合成代谢剂如fgf-18和op-1。抗分解代谢剂,例如人润滑素、timp-3、op-1、mmp-13抑制剂、组织蛋白酶k、抗细胞因子剂(例如抗il-1β和tnfα阻断剂)。自噬调节剂,如mtor抑制剂和青藤碱。抗破骨细胞介导的骨质疏松剂,例如雌激素、选择性雌激素受体调节剂(serm),二磷酸盐(例如唑来膦酸盐)、雷尼酸锶,降血钙素和甲状旁腺激素。营养剂如氨基葡萄糖和硫酸软骨素。局部麻醉剂如布比卡因,卡波卡因,阿替卡因,罗哌卡因,二丁卡因,依替卡因,丁卡因,利多卡因,赛罗卡因等,包括它们的混合物和/或其盐和/或其衍生物。生物制剂如抗ngf(tanezumab)和fgf18(sprifermin)。可以施用如本文所述的至少一种api的混合物。这种混合物取决于必须治疗至少一个关节的患者的症状。在如本文所述的用于微粒化的方法中,三嵌段和二嵌段中的聚乙二醇链可以在300da至12kda的范围内。另一方面,三嵌段和二嵌段中的聚乙二醇链可以在5kda至8kda的范围内。另一方面,三嵌段和二嵌段中的聚乙二醇链可以在1kda至5kda的范围内。另一方面,三嵌段和二嵌段中的聚乙二醇链可以在1kda至2kda的范围内。在又一方面,三嵌段中的聚乙二醇链为2kda且二嵌段中的聚乙二醇链为1kda。在又一方面,三嵌段中的聚乙二醇链为1kda且二嵌段中的聚乙二醇链为2kda。在又一方面,三嵌段中的聚乙二醇链为2kda且二嵌段中的聚乙二醇链为2kda。在如本文所述的用于颗粒化的方法中,三嵌段中聚乳酸重复单元与环氧乙烷的摩尔比可以在1.6至7.2的范围内,且二嵌段中的在1.9至4.8的范围内。另一方面,三嵌段中聚乳酸重复单元与环氧乙烷的摩尔比可以在2.0至6.0的范围内,且二嵌段中的在2.0至3.0的范围内。另一方面,三嵌段中聚乳酸重复单元与环氧乙烷的摩尔比可以在3.0至6.5的范围内,且二嵌段中的在2.5至4.5的范围内。本文所述的微粒化方法中,三嵌段中的聚合度可以在72至324的范围内,且二嵌段中的聚合度可以在85.5至216的范围内。另一方面,本文所述的微粒化方法中,三嵌段中的聚合度可以在92至135的范围内,且二嵌段中的聚合度可以在91至180的范围内。另一方面,本文所述的微粒化方法中,三嵌段中的聚合度可以在95至130的范围内,且二嵌段中的聚合度可以在95至175的范围内。另一方面,本文所述的微粒化方法中,三嵌段中的聚合度可以在98至132的范围内,且二嵌段中的聚合度可以在95至175的范围内。在如本文所述的用于微粒化的方法中,可生物降解的药物组合物中的三嵌段含量可以为6%至24%(wt%/wt%),且二嵌段含量可以为12%至40%(wt%/wt%)。在如本文所述的用于微粒化的方法中,可生物降解的药物组合物中的三嵌段含量可以为5%至30%(wt%/wt%),且二嵌段含量可以为15%至25%(wt%/wt%)。在如本文所述的用于微粒化的方法中,可生物降解的药物组合物中的三嵌段含量可以为10%至40%(wt%/wt%),且二嵌段含量可以为10%至20%(wt%/wt%)。在如本文所述的用于微粒化的方法中,可生物降解的药物组合物中的三嵌段含量可以为15%至50%(wt%/wt%),且二嵌段含量可以为5%至35%(wt%/wt%)。在如本文所述的用于微粒化的方法中,所述可生物降解的药物组合物的配制包括将三嵌段共聚物与二嵌段共聚物在生物相容性有机溶剂中混合以形成三嵌段共聚物和二嵌段共聚物混合物。然后将至少一种药物活性成分加入到所述三嵌段共聚物和二嵌段共聚物混合物中。可以将溶剂蒸发掉。在对患者施用时,所使用的量可以是膝部约0.1至6ml,臀部约0.1至6ml,脚踝约0.1至4ml,肩部约0.1至6ml和肘部约0.1至2ml。另一方面,所述至少一种药物活性成分可以应用于手术后的应用,所述术后应用可以是例如全部或部分膝关节替换、全部或部分髋关节替换、全部或部分踝关节替换、关节镜或开放性关节手术、微骨裂、自体软骨细胞移植、镶嵌式成形术、清创和灌洗、韧带修复、肌腱修复、旋转套修复、半月板手术、滑膜切除术或通过关节内注射用于炎性疾病或关节疼痛的非手术应用。在另一个实施方式中,描述了一种包含至少一种药物活性成分的可生物降解的药物递送组合物,包含:(1)配制可生物降解的药物组合物,其包含:(a)下式的可生物降解的三嵌段共聚物:plav-pegw-plax其中v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,并且v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:mpegy-plaz其中y和z是重复单元的数目,y在3到45范围内且z在7到327范围内,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的二嵌段共聚物的比率为3:2~1:19;和(c)至少一种用于使所述可生物降解的药物递送组合物微粒化的药物活性成分;其中所述配制的可生物降解的药物递送组合物被包含在铰接关节囊内来微粒化。本发明还涉及一种用于使至少一种药物活性成分靶向滑膜组织的方法,所述方法包括向需要这种治疗的哺乳动物或动物施用可生物降解的药物递送组合物,所述可生物降解的药物递送组合物包含:(a)下式的可生物降解的三嵌段共聚物:av-bw-ax其中a是聚酯,b是聚乙二醇,v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,并且v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:cy-az其中a是聚酯,c是封端的聚乙二醇,其中y和z是重复单元的数目,y在3到45范围内且z在7到327范围内,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的二嵌段共聚物的比率为3:2~1:19;和(c)至少一种药物活性成分。三嵌段组合物中重复单元的数目v、w和x可根据活性成分释放的靶向时间和活性成分本身的种类而变化。因此,三嵌段中的重复单元的数目v、w和x可以在8至1090、10至850、20至700、30至650的范围内,且v=x或v≠x。例如,w可以是273、x+y可以是682且v=x或v≠x,或者w可以是136、x+y可以是273且v=x或v≠x,或者w可以是45.5、x+y可以是546,或者w可以是273、x+y可以是136。三嵌段中peg的大小可以在194da至12,000da的范围内。三嵌段和二嵌段中peg的大小也可以在164da至12kda的范围内。三嵌段中的聚酯可以是聚乳酸(pla)、聚已酸内酯(pcl)、聚乙醇酸(pga)或聚羟基链烷酸酯(pha)。在一个实施方式中,使用的聚酯是聚乳酸。通过用peg分子量除以eo单元分子量(44da)来计算dp-peg的聚合度。v+x等于pla的聚合度(重复单元数目)。通过用dp-peg乘以la/eo比率来计算dp-pla。然后将三嵌段共聚物与下式的可生物降解的二嵌段共聚物组合:cy-az,其中a是聚酯,c是封端的聚乙二醇,y和z是7至371或3至327的重复单元数目。上述组合物中的三嵌段共聚物与二嵌段共聚物的比率为3:2~1:19或1:3至1:9。封端的聚乙二醇的例子包括烷氧基封端的peg,例如甲氧基peg或乙氧基peg,尿烷封端的peg,酯封端的peg,胺封端的peg和酰胺封端的peg。该封端peg的列表并不是穷尽的,并且本领域技术人员可以知晓其他未列出的封端peg。然而,二嵌段组合物中y和z的重复单元数目(聚合度(dp))也可以变化。因此,y可以例如在7至43或3至45的范围内,z可以在32至123或7至327的范围内。例如,y可以是25,z可以是123,y可以是34.5,z可以是123,或y可以是45,z可以是32。通过将封端peg的peg分子量除以eo单元分子量(44da)来计算dp-peg的聚合度。通过用dp-peg乘以la/eo比率来计算dp-pla。二嵌段中的聚酯可以是聚乳酸(pla)、聚已酸内酯(pcl)、聚乙醇酸(pga)、聚(乳酸-共-乙醇酸)(plga)或聚羟基链烷酸酯(pha)。在一个实施方式中,使用的聚酯是聚乳酸。在另一个实施方式中,聚酯是聚(乳酸-共-乙醇酸)。la/eo比率是指可生物降解的药物递送组合物中的乳酸单元与环氧乙烷单元的摩尔比。它是通过nmr实验测定的。结合的三嵌段共聚物的la/eo摩尔比可在0.5至3.5的范围内。另一方面,本文所述的可生物降解的药物递送组合物中三嵌段的la/eo摩尔比可以在0.5至2.5的范围内。在另一方面,三嵌段的la/eo摩尔比可以在0.5至22.3的范围内。二嵌段的la/eo比率可以在2至6的范围内。另一方面,可生物降解的药物递送组合物中二嵌段的la/eo比率可以在3至5的范围内。另一方面,二嵌段的la/eo比率可以在0.8至13的范围内。聚合度或dp是时间t时聚合反应中平均聚合物链中重复单元的数量。例如,peg的聚合度约为45至170,或者可以是4至273或3至45,而pla的聚合度可以在约84至327的范围内,或者可以是24至682或7至327。另一方面,本发明提供了一种用于使至少一种药物活性成分靶向滑膜组织的方法,所述方法包括向需要这种治疗的哺乳动物或动物施用可生物降解的药物递送组合物,所述可生物降解的药物递送组合物包含:(a)下式的可生物降解的三嵌段共聚物:av-bw-ax其中a是聚酯,b是聚乙二醇,v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,并且v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:cy-az其中a是聚酯,c是封端的聚乙二醇,其中y和z是重复单元的数目,y为3到45且z为7到327,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的二嵌段共聚物的比率为1:3~1:9;和(c)至少一种药物活性成分。另一方面,本发明提供了一种用于使至少一种药物活性成分靶向滑膜组织的方法,所述方法包括向需要这种治疗的哺乳动物或动物施用可生物降解的药物递送组合物,所述可生物降解的药物递送组合物包含:(a)下式的可生物降解的三嵌段共聚物:av-bw-ax其中a是聚酯,b是聚乙二醇,v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,v和x是酯重复单元,w是环氧乙烷重复单元,并且v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:cy-az其中a是聚酯,c是封端的聚乙二醇,其中y和z是重复单元的数目,y为3到45且z为7到327,y是环氧乙烷重复单元的数目,z是酯重复单元的数目,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的ca二嵌段共聚物的比率为3:2~1:19;和(c)至少一种药物活性成分。另一方面,本发明提供了一种用于使至少一种药物活性成分靶向滑膜组织的方法,所述方法包括向需要这种治疗的哺乳动物或动物施用可生物降解的药物递送组合物,所述可生物降解的药物递送组合物包含:(a)下式的可生物降解的三嵌段共聚物:av-bw-ax其中a是聚酯,b是聚乙二醇,v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,v和x是酯重复单元,w是环氧乙烷重复单元,并且v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:cy-az其中a是聚酯,c是封端的聚乙二醇,其中y和z是重复单元的数目,y为3到45且z为7到327,y是环氧乙烷重复单元的数目,z是酯重复单元的数目,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的ca二嵌段共聚物的比率为1:3~1:9;和(c)至少一种药物活性成分。另一个实施方式中,本发明提供了一种用于使至少一种药物活性成分靶向滑膜组织的方法,所述方法包括向需要这种治疗的哺乳动物或动物施用可生物降解的药物递送组合物,所述可生物降解的药物递送组合物包含:(a)下式的可生物降解的三嵌段共聚物:plav-pegw-plax其中v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,并且v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:pegy-plaz其中y和z为3到237或3到371的重复单元的数目,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的二嵌段共聚物的比率为3:2~1:19;并且其中二嵌段共聚物的peg是封端的;和(c)至少一种药物活性成分。本发明的另一方面提供一种用于使至少一种药物活性成分靶向滑膜组织的方法,所述方法包括向需要这种治疗的哺乳动物或动物施用可生物降解的药物递送组合物,所述可生物降解的药物递送组合物包含:(a)下式的可生物降解的三嵌段共聚物:plav-pegw-plax其中v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,并且v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:pegy-plaz其中y和z是重复单元的数目,y为3到45且z为7到327,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的二嵌段共聚物的比率为1:3~1:9;并且其中二嵌段共聚物的peg是封端的;和(c)至少一种药物活性成分。另一方面,提供了一种用于使至少一种药物活性成分靶向滑膜组织的方法,所述方法包括向需要这种治疗的哺乳动物或动物施用可生物降解的药物递送组合物,所述可生物降解的药物递送组合物包含:(a)下式的可生物降解的三嵌段共聚物,其含量为总组合物的2.0%至45%(w%/w%):plav-pegw-plax其中v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物,其含量为总组合物的8.0%至50%(w%/w%):pegy-plaz其中y和z是重复单元的数目,y在3到45范围内且z在7到327范围内,其中在所述可生物降解的药物组合物中,(a)的可生物降解三嵌段共聚物与(b)的可生物降解的二嵌段共聚物的比率为3:2~1:19;并且其中二嵌段共聚物的peg是封端的;和(c)至少一种药物活性成分,其含量为总组合物的1%至20%(w%/w%)。另一方面提供了一种用于使至少一种药物活性成分靶向滑膜组织的方法,所述方法包括向需要这种治疗的哺乳动物或动物施用可生物降解的药物递送组合物,所述可生物降解的药物递送组合物包含:(a)下式的可生物降解的三嵌段共聚物:plav-pegw-plax其中v和x为24到682的重复单元的数目,w为4到273的重复单元的数目,v=x或v≠x;(b)下式的可生物降解的二嵌段共聚物:pegy-plaz其中y和z为7至371的重复单元的数目,其中在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物与(b)的可生物降解的二嵌段共聚物的比率为1:3~1:9,并且其中二嵌段共聚物的peg是封端的,其中聚合物总含量为总组合物的20%至50%(w%/w%)或30%至50%(w%/w%);和(c)至少一种药物活性成分,其含量为总组合物的10%至20%(w%/w%)。在用于使至少一种药物活性成分靶向滑膜组织的方法中,本发明的可生物降解的药物递送组合物在组合物中的乳酸与环氧乙烷的摩尔比对于三嵌段共聚物可以为0.5至3.5或0.5至22.3,以及对于二嵌段共聚物为2至6或0.8至13。另一方面,在用于使药物活性成分靶向滑膜组织的方法中,本发明的可生物降解的药物递送组合物在组合物中的乳酸与环氧乙烷的摩尔比可以为0.5至2.5(对于三嵌段共聚物)以及为3至5(对于二嵌段共聚物)。一方面,该用于靶向的方法中,可生物降解的药物递送组合物是可注射液体,当其被注入关节内空间时,其成为硬化植入物在另一方面,可生物降解的药物递送组合物可以在该用于靶向的方法中用作空间制剂,使得其可以施用到哺乳动物或动物的关节内空间上或内部。例如,它可以在手术过程中分散到关节内空间来治疗滑膜组织。在另一方面,该用于靶向的方法中,可生物降解的药物组合物呈棒状植入物形式或呈可插入体内的任何形状的固体植入物形式。在所述用于靶向的可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物和(b)的可生物降解的ca二嵌段共聚物的比率为3:2~1:19。在一个实施方式中,可生物降解的三嵌段共聚物与可生物降解的二嵌段共聚物的比率选自1:3~1:9的组。该用于靶向的方法中,聚酯链的长度由聚酯与环氧乙烷的摩尔比确定,三嵌段共聚物中的摩尔比为0.5至3.5或0.5至2.5或0.5至22.3,二嵌段共聚物中的摩尔比为3至5或2至6或0.8至13。因此,例如,如果使用聚乳酸,则链长由乳酸/环氧乙烷的摩尔比限定。类似地,如果使用聚乙醇酸,则链长由聚乙醇酸/环氧乙烷的摩尔比限定,或者聚已酸内酯/环氧乙烷的摩尔比或聚羟基链烷酸酯/环氧乙烷的摩尔比限定。如果使用聚(乳酸-共-乙醇)酸,则链长由(la+g)/eo的比率限定。该用于靶向的方法中,封端的聚乙二醇的质量可以为164da至2kda或100da至2kda。它可以在较低的100到300da的范围内或在1kda到2kda的范围内。该用于靶向的方法中,可生物降解的药物递送组合物中的聚乙二醇链的大小为200da至12kda,或者可以为200da至12kda或194da至12kda。该用于靶向的方法中的聚合物的含量为组合物总重量的20%至50%(w%/w%)。另一方面,在可生物降解的药物组合物中,聚合物总重量为组合物总重量的30%至50%(w%/w%)。在另一方面,可生物降解的药物组合物中聚合物的含量为组合物总重量的40%至50%(w%/w%)。因此,该用于靶向的方法中,三嵌段共聚物的含量为组合物总重量的3.0%至45%(w%/w%)。在另一方面,三嵌段共聚物的含量为组合物总重量的6%至10%(w%/w%)。在另一方面,三嵌段共聚物的含量为组合物总重量的20%至40%(w%/w%)。同样地,该用于靶向的方法中,可生物降解的药物组合物中二嵌段共聚物的含量为组合物总重量的8%至50%(w%/w%)。另一方面,二嵌段共聚物的含量为组合物总重量的10%至20%(w%/w%)。在另一方面,二嵌段共聚物的含量为组合物总重量的20%至40%(w%/w%)。该用于靶向的方法中至少一种药物活性成分被包裹在三嵌段:二嵌段可生物降解的药物递送组合物中。用于本发明的代表性药物和生物活性剂包括但不限于可用于治疗滑膜组织的任何医学病况的任何药物活性成分,包括肽药物、蛋白质药物、脱敏剂、抗原、非甾体类抗炎剂、抗炎药、麻醉剂、皮质类固醇、止痛剂等。非甾体类抗炎剂的例子包括依托芬那酯、塞来昔布、阿利考昔、罗非考昔、萘丁美酮、贝诺酯、依托考昔、安吡昔康、氨丙洛芬(aminophemazone)、伐地考昔、对乙酰氨基酚、丁苯羟酸、尼美舒利、帕瑞考昔、甲灭酸、右布洛芬、布洛芬、氟比洛芬、阿司匹林、右酮洛芬、双氯芬酸、二氟尼柳、依托度酸、非诺洛芬、氟洛克、氟比洛芬、吲哚美辛、酮洛芬、酮咯酸、氯诺昔康、洛索洛芬、洛索马克、罗美昔布、甲氯芬那酸、美洛昔康、萘普生、甲氧基甲基萘乙酸、尼莫洛(nimalox)、奥沙普秦、吡罗昔康、水杨酰水杨酸、舒林酸,替诺昔康,托芬那酸及它们的混合物。上述药物的组合也可用在本发明的用于靶向滑膜组织的可生物降解的药物递送组合物中。例如,在本发明中,如果需要治疗骨关节炎,非甾体类抗炎剂和皮质类固醇可以一起施用。例如靶向动物滑膜组织的药物等兽医学类药物也构成本发明的一部分。对于本领域技术人员来说,在所述递送系统中可以使用能在溶液环境中释放的其他药物或生物活性剂。而且,可以使用各种形式的药物或生物活性剂。这些包括但不限于例如不带电的分子、分子复合物、盐、醚、酯、酰胺等形式,它们当注射到动物体内时被生物活化或被用作空间制剂,因此可以施用在动物身体上或体内或作为棒状植入物。活性成分的药学有效量可根据活性成分、动物的医学病况的程度以及递送活性成分所需的时间而变化。除了考虑通过注射器针头注射的可接受溶液或分散物粘度并且可有效地治疗疾病而不会使动物或植物服用过量之外,加入聚合物溶液中的活性成分的量没有临界上限。加入递送系统的活性成分的下限仅取决于活性成分的活性和治疗所需的时间长度。例如,一些活性成分在可生物降解的药物递送组合物中的量可为10~200mg/g。另一方面,药物的含量应为10~40μg/g。例如,对于小分子,活性成分可以高达每克100至200毫克。通常,该用于靶向的方法中,药物活性成分的含量为组合物总重量的1%至20%(w%/w%)。另一方面,活性成分的含量为组合物总重量的1%至4%(w%/w%)。另一方面,活性成分的含量为组合物总重量的2%至4%(w%/w%)。在另一方面,小分子的活性成分的含量为组合物总重量的10%至20%(w%/w%)或21%至50%(w%/w%)。在本发明的可生物降解的药物递送组合物中,在该用于靶向的方法中,药学有效量可以在长时间内逐渐释放。这种缓慢释放可以是连续的或不连续的,线性的或非线性的,并且可以根据三嵌段共聚物和二嵌段共聚物的成分而变化。因此,与聚乙二醇含量相比,三嵌段和二嵌段共聚物中的乳酸含量越高,以及可生物降解的药物组合物中的三嵌段和二嵌段共聚物的含量越高,则活性成分或药物的释放期越长。换言之,la/eo摩尔比越高,三嵌段共聚物和二嵌段共聚物的重量百分比越高,活性成分从药物组合物中释放的时间越长。取决于所需的治疗类型和所使用的可生物降解的药物递送组合物,活性成分可以释放24小时至1年或7天至1年或更长的时间。在一个方面,可生物降解的药物递送组合物可以递送活性成分至少7天。另一方面,可生物降解的药物递送组合物可以递送活性成分至少30天。另一方面,可生物降解的药物递送组合物可以递送活性成分至少90天。另一方面,可生物降解的药物递送组合物可以递送活性成分至少1年以上。该用于靶向的方法中,可生物降解的药物递送组合物可以是室温下的可注射液体并且可以通过注射器注射而无需过度用力。但是这些可生物降解的药物递送组合物也是原位形成并可生物降解的,并且当注射到动物或植物中时变成固体植入物或贮库(depot)。或者,可生物降解的药物组合物以固体形式制出,制备成小颗粒并用作喷洒在受伤部位的粉末。另一方面,药物递送组合物是棒状植入物,其可植入皮肤下或体内的其他区间内。在另一方面,药物递送组合物可以以膜状制备和应用。在又一方面,可生物降解的药物递送组合物可以用作空间制剂,以使其可以施用到动物身体上或体内。可生物降解的药物递送组合物可以进一步包含药学上可接受的载体、佐剂或赋形剂。可接受的载体可以是盐水、缓冲盐水等。可将它们与药物和二嵌段共聚物以及三嵌段共聚物形成制剂后,加入到可生物降解的药物递送组合物。可以在混合药物的同时配制佐剂。在这方面,可以使用的佐剂有明矾、磷酸铝、磷酸钙、mpltm、cpg基序、修饰的毒素、皂苷、内源性刺激佐剂例如细胞因子、弗氏完全和不完全佐剂,iscom型佐剂,胞壁肽等。赋形剂可以是任何稀释剂、附加溶剂、填充剂或粘合剂,其可以在需要时改变可生物降解的药物递送组合物中活性成分的递送方式。例子包括少量的甘油三酯如三乙酸甘油酯或三丙酸甘油酯。可用于本发明方法中的可生物降解的药物递送组合物中的量可以在12%至20%(w%/w%)的范围变化。在一个方面,制剂中三乙酸甘油酯的量可以为17.0%(w%/w%)。另一方面,可以以16%(w%/w%)的量添加三丙酸甘油酯(本文缩写为tripro)。该方法中,可用于溶解三嵌段共聚物或二嵌段共聚物的有机溶剂选自:苄醇、苯甲酸苄酯、二甲基异山梨醇(dmi)、二甲基亚砜(dmso)、乙酸乙酯、苯甲酸乙酯、乳酸乙酯、甘油缩甲醛、甲基乙基酮、甲基异丁基酮、n-乙基-2-吡咯烷酮、n-甲基-2-吡咯烷酮(nmp)、吡咯烷酮-2、四甘醇、三乙酸甘油酯,三丁酸甘油酯,三丙酸甘油酯(tripro)及它们的混合物。在一个实施方式中,溶剂是dmso、tripo、nmp及其混合物。这些溶剂可作为制剂的一部分而保留在可生物降解的药物递送组合物中或可在制备后蒸发掉。该用于靶向的方法中的有机溶剂的量可以为总组合物的40%至74%(w%/w%)。在另一方面,用于制备可生物降解的药物递送组合物的有机溶剂的量为总组合物的50%至60%(w%/w%)。在又一方面,用于制备可生物降解的药物递送组合物的溶剂的量为总组合物的60%至70%(w%/w%)或26%至90%(w%/w%)或40%至79%(w%/w%)。一些mpeg-oh被少量oh-peg-oh污染。依照本发明的方法并使用污染的mpeg-oh,本发明包含的最终产物会是被少量pla-peg-pla污染的mpeg-pla。提供一种治疗滑膜组织病况的方法,所述方法包括向需要这种治疗的哺乳动物或动物施用至少一种如本文所述的可生物降解的药物递送组合物。滑膜组织病况可以包括任何类型的关节炎,包括骨关节炎、类风湿性关节炎、痛风,和风湿性疾病,包括强直性脊柱炎、纤维肌痛、感染性关节炎、幼年特发性关节炎、红斑狼疮、风湿性多肌痛、银屑病性关节炎、反应性关节炎和硬皮病。这种治疗方法适用于所有滑膜关节,如膝盖、脚踝、肘、肱部、尺骨、枢轴关节、球窝关节、铰链关节、肩、肩胛、腿关节、腓骨、鞍状关节、腕关节、手指关节和胫骨。如本文所述的方法可以应用于手术后的应用如全膝关节置换术(tkr)或全髋关节置换术(thr),或非手术应用,例如用于炎性疾病的关节内注射和用抗生素治疗感染。另一方面,至少一种药物活性成分可以应用于术后应用,可以是例如全部或部分膝关节替换、全部或部分髋关节替换、全部或部分踝关节替换、关节镜或开放性关节手术、微骨裂、自体软骨细胞移植、镶嵌式成形术、清创和灌洗、韧带修复、肌腱修复、旋转套修复、半月板手术、滑膜切除术或通过关节内注射用于炎性疾病或关节疼痛的非手术应用。本发明的另一方面是如本文所述的可生物降解的药物组合物的应用,用于使至少一种药物活性成分靶向哺乳动物或动物中的滑膜组织。在上述应用或治疗方法中,聚酯可以是聚乳酸(pla)、聚已酸内酯(pcl)、聚乙醇酸(pga)、聚(乳酸-共-乙醇酸)(plga)或聚羟基链烷酸酯(pha)。在一个实施方式中,使用的聚酯是聚乳酸。在所述可生物降解的药物组合物中,(a)的可生物降解的三嵌段共聚物和(b)的可生物降解的ca二嵌段共聚物的比率为1:3至1:9。在一个实施方案中,在上述应用或方法中,可生物降解的三嵌段共聚物与可生物降解的ca二嵌段共聚物的比率选自3:2至1:19的组。在上述应用或方法中,聚酯链的长度由聚酯与环氧乙烷的摩尔比限定,三嵌段中为0.5至3.5或0.5至2.5或0.5至22.3,以及二嵌段中为3至5或2至6或0.8至13。封端的聚乙二醇的质量可以在100da至2kda或164da至2kda的范围内。在上述应用或方法中,可以在100至300da范围内或在1kda至2kda范围内。在上述应用或方法中,可生物降解的药物递送组合物中聚乙二醇链的大小为200da至12kda,或者可以为400da至12kda或194da至12kda。尽管已经描述了本发明的多个实施方式和/或方面,应理解在不脱离本发明的精神和范围的情况下可以做出各种修改。实施例实施例1-聚合物的合成根据美国专利第6,350,812号中所述的方法合成共聚物,并通过引用并入本文,但稍作修改。典型地,在80℃加热必要量的peg(三嵌段共聚物中)或甲氧基-peg(二嵌段共聚物中),并在反应器中真空干燥30分钟。加入dl-丙交酯(与目标la/eo摩尔比对应)和乳酸锌(丙交酯量的1/1000)。首先通过两个短的真空/n2循环使反应混合物脱水。在恒定的氮气流量(0.2巴)下将反应物在140℃加热。反应停止后,将共聚物从容器中排出并在室温下静置直到凝固。通过1hnmr表征所得产物的乳酸盐含量。将本文描述的三嵌段聚合物标记为pxry,其中x表示peg链的大小,以kda计,并且y是la/eo摩尔比。将本文描述的二嵌段mpeg-pla聚合物标记为dpxry,其中x表示peg链的大小,以kda计,并且y是la/eo摩尔比。实施例2-塞来昔布制剂的制备本文所述的制剂基于含有塞来昔布作为药物的聚合物有机溶液。典型地,在恒定的磁力搅拌下,在室温下将0.4g聚合物(对应于限定质量比的二嵌段共聚物和三嵌段共聚物的混合物)溶解于0.57g的生物相容性溶剂中并过夜。溶剂是单一溶剂或溶剂的组合。次日,将20mg塞来昔布加入到聚合物溶液中并搅拌至完全溶解。当药物不溶于溶剂时,得到药物在聚合物溶液中的悬浮液。或者,将药物溶解或悬浮在生物相容性溶剂中,然后加入聚合物。使用前将制剂装入注射器中。实施例3-其他非甾体类抗炎药(nsaid)制剂的制备依照实施例1和2,制备以下药物活性成分的各种制剂:依托芬那酯、塞来昔布、阿利考昔、罗非考昔、萘丁美酮、贝诺酯,依托考昔、安吡昔康、氨丙洛芬(aminophemazone)、伐地考昔、对乙酰氨基酚、丁苯羟酸、尼美舒利、帕瑞考昔、甲灭酸、右布洛芬、布洛芬、氟比洛芬和罗哌卡因。实施例4-用于注射的制剂的制备依照实施例1和2制备了各种制剂,列于下表1中:表1实施例5-羊的膝关节的关节内空间注射每个时间点在三只羊的关节内空间注射f14的制剂。在第0、1、7、14、28和42天采集每只羊的血浆、滑液和滑膜组织样品。通过lc-ms测定每个目标位置的塞来昔布(cxb)的量。结果显示在下表中。表2、3和4显示了第一次研究中血浆、滑液和滑膜组织中所测定的cxb浓度。仅在该研究的第1天可在血浆中检测到cxb。检测到所有动物在第1天和第7天的cxb在滑液中的水平更高,但是这个水平是短暂的并且在14天内下降直至第28天检测不到。在开始的7天内,滑膜组织的cxb水平极高,此后42天内cxb的组织水平缓慢减少,但是仍然保持了90天。血浆中塞来昔布的浓度表2:血浆中cxb的浓度(ng/ml)天数羊1羊2羊30bqlbqlbql13.94a12.59.797bqlbqlbql14bqlbqlbql28bqlbqlbql42bqlbqlbqlbql-低于检测限<5.00ng/mla-低于检测限,仅作为估计值滑液中塞来昔布的浓度表3:滑液中cxb的浓度(ng/ml)天数羊1羊2羊30bqlbqlbql119,400112,000169,00079831381,10014bql8374,08028bqlbqlbql42bqlbqlbqlbql-低于检测限<10.00ng/ml滑膜组织中塞来昔布的浓度表4:滑膜组织中cxb的浓度(ng/ml)bql-低于检测限<10.00ng/ml在第二次pk研究中使用3只羊,时间点如下表所列。表4、5和6分别显示了在血浆、滑液和滑膜组织中测得的cxb浓度。仅在研究的第1天可在血浆中明确检测到cxb。在第1天在滑液中检测到更高水平的cxb,但是该水平在14天内显著下降。在研究的整个14天内,滑膜组织的cxb水平非常高。在对侧对照组膝关节滑膜组织中检测到cxb。原始数据请参考14.2.7.5节。血浆中塞来昔布的浓度表5:血浆中cxb的浓度(ng/ml)天数羊1羊2羊30bqlbqlbql128.221.515.271.76a1.38a2.50a141.14a1.27a0.566abql-低于检测限<5.00ng/mla-低于检测限,浓度仅作为估计值报告滑液中塞来昔布的浓度表6:滑液中cxb的浓度(ng/ml)天数肢体羊1羊2羊30bqlbqlbql1f14191,000145,000220,000对照组23.0-47.17f142,2506,87084,700对照组bqlbqlbql14f14132907589对照组bqlbqlbqlbql-低于检测限<10.00ng/ml滑膜组织中塞来昔布的浓度表7:滑膜组织中cxb的浓度(ng/ml)图1和3显示了f14制剂的结果,展示了定量的药代动力学分布。将制剂f14与f15和f16比较,结果表明f14对滑膜组织和滑液具有优越的靶向作用,而f15和f16不具有这种靶向。在第1天至第40天观察羊的宏观分布。塞来昔布的分布清楚地如图2所示。f14的3个月制剂在整个时间段内递送塞来昔布制剂。实施例6-患者的膝关节的关节内空间注射对患者x的膝关节进行平片检查,以研究滑膜腔的最小阻塞和最大通入路径。这种通入可以是上外侧、上内测或前内侧/前外侧。基于患者x的膝关节骨骼解剖学来选择膝部注射部位。对患者x来说,选择上外侧膝关节注射部位。患者x仰卧,膝盖完全伸展,并有一个薄垫支撑以方便放松。注射部位用笔标记以在皮肤上留下印记,并用酒精棉签清洁皮肤。临床医生拇指轻轻稳定膝盖骨,同时将含有可降解的药物递送组合物与塞来昔布的25g1.5”针插入到膝盖骨的上外侧表面下面,朝向膝盖骨的中心,然后稍微向后和向内侧推进到膝关节。然后注射针的内容物并将针从膝盖中抽出。实施例7-滑膜组织中乳酸的定量背景进行这项研究以定量滑膜组织中的乳酸水平。材料使用来自五只羊的膝关节的滑膜组织。左膝关节未处理,右膝关节注射0.6ml的f14制剂。该制剂包含15%的塞来昔布作为api,8%的p2r2.2作为三嵌段,32%的dp2r2.4作为二嵌段和45%的dmso。体内经过7天后,从羊中取出组织并将其储存在-80℃冰箱的冷冻管中等待进一步分析。首先称量滑膜组织样品并将组织转移到50ml的falcon管中。加入2ml的5mnaoh并将falcon管放置过夜用于40℃消化。然后用刮刀手动压碎样品并加入2ml的5nhcl,涡旋样品以均化溶液。将falcon管以4,000rpm离心10分钟以获得用于测定的澄清上清液。关于乳酸定量,使用购自megazymetm的l-和d-乳酸酶促试剂盒,并依照该试剂盒的说明书。简言之,在96孔板中加入20至100μl的上清液、50μl的缓冲液、10μl的nad+(烟酰胺腺嘌呤二核苷酸)和2μl的gpt酶(谷氨酸-丙酮酸转氨酶)。然后混合孔板并放置3分钟,然后加入2μl的l-或d-ldh酶(乳酸脱氢酶)。然后将孔板再次混合,并在酶标仪上读取340nm处的吸光度。使用statistica软件(v10,statsoft)进行统计分析。结果将每个稀释液的乳酸浓度与其他稀释液进行比较以确定数据的可混合性。所有稀释因子(所有p值>0.7)均未发现统计学显著性,这支持了所有的各个动物乳酸值的汇集。与用盐水处理的膝盖相比,f14处理的膝盖的平均乳酸浓度具有高度统计学显著性(p=0.015)(表7)。表8.处理7天后羊*的滑膜组织中测定的乳酸*corg研究#7300+数据表示平均值±sd,n=4^使用学生的t检验进行比较为了说明滑膜组织中乳酸的水平,在扣除了盐水处理的对照组中测定的乳酸后,图1仅显示了每只羊的外源乳酸。结论利用上述酶促法在滑膜组织中测量到的统计学显著的外源乳酸有力地表明:注射到羊膝盖中的聚合物制剂被微粒化并靶向滑膜组织,并在注射后7天继续存在。实施例8-不同组合物的制剂然后,如下表9所示配制不同的组合物:实施例9-用不同的可生物降解的药物递送组合物确定微粒化为了确认不同的组合物被微粒化并靶向滑膜组织,与上述实施例1和2类似地制备8种具有不同特性和api的不同制剂。制剂中使用的组成、三嵌段和二嵌段的细节如上表9和下表10和11所列。三嵌段聚乙二醇和二嵌段封端的聚乙二醇的质量范围为1至2kda。三嵌段聚合物中乳酸与环氧乙烷的摩尔比为2至6,二嵌段聚合物中乳酸与环氧乙烷的摩尔比为2.4至4。对于三嵌段和二嵌段,该比率范围都表示聚酯的链长度根据聚合度计为90至182,或根据摩尔质量计为6545g/mol至13091g/mol。制备后,将制剂过滤灭菌。然后,将每种制剂关节内注射到成年羊的膝盖中,其中每只羊接受一种制剂双侧注射。表10-三嵌段制剂的说明表11-二嵌段制剂的说明为了确认其他制剂的微粒化和滑膜组织靶向,用表9中列出的配方依照实施例1和2制备制剂。制备后,制剂全部过滤灭菌。共使用6只羊,并在12只膝盖中进行双侧注射。羊处理组如下表12所列:在第7天处死后,手术打开膝盖并宏观观察,通过定性检查颗粒大小和分布来判断每种制剂的微粒化表现。照片记录微粒化和缺失,由制剂内的d&c绿色#6染料辅助颗粒可视地变蓝。结果总结在下面的表13中:表13结论当三嵌段(f392)或二嵌段(f396)由2kda的peg组成时,,观察到微粒化。无关其pla链长度(f390,f14),在三嵌段和二嵌段中均有2kda的peg的配方使得贮库处表现出微粒化。结果显示不同的api(例如塞来昔布、双氯芬酸或布比卡因)导致了相似的整个关节中的微粒化和分布。基于双氯芬酸和布比卡因的制剂比基于塞来昔布的制剂更快微粒化和分布,这可能是由于这些api的制剂粘度较低。实施例10-塞来昔布制剂的制备本文所述的制剂基于含有塞来昔布作为药物的聚合物有机溶液。典型地,在恒定的磁力搅拌下,在室温下将0.4g聚合物(对应于限定质量比的二嵌段共聚物和三嵌段共聚物的混合物)溶解于0.4g的生物相容性溶剂(例如dmso)中并过夜。溶剂是单一溶剂或溶剂的组合。次日,将0.02g塞来昔布加入到聚合物溶液中并搅拌至完全溶解。当药物不溶于溶剂时,得到药物在聚合物溶液中的悬浮液。或者,将药物溶解或悬浮在生物相容性溶剂中,然后加入聚合物。使用前将制剂装入注射器中。虽然已经根据各种优选实施方式描述了本发明,但是本领域技术人员将认识到,可以在不脱离本发明的范围的情况下进行各种修改、替换、省略和改变。因此,本发明的范围旨在由权利要求的范围限定,包括它的等同。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1