P糖蛋白在影响INS-1832/13细胞胰岛素分泌应用的制作方法
本发明涉及一种生物工程领域,具体涉及一种能够影响ins-1832/13细胞胰岛素分泌的p糖蛋白。
背景技术
糖尿病(diabetesmellitus,dm)是一类因胰岛素抵抗和(或)胰岛素分泌不足所引起的以慢性高血糖为特征的代谢紊乱性疾病,严重危害人类生命和生活质量。其病理生理学极其复杂,在全球范围内广为流行,且其发病率还会继续增加。2014年,全球18岁以上的t2dm的发病率大约为9%。在美国,排除意外事故的影响,糖尿病是女性死亡的第五大原因,是男性死亡的第四大原因。而中国糖尿病的发病率为9.7%(9.24亿成年人),且前驱糖尿病的发病率为15.5%(14亿成年人)。糖尿病发病率的增加与经济快速发展,平均寿命延长以及生活方式改变有关。血糖控制不佳会增加糖尿病相关的微血管和大血管并发症风险。糖尿病及并发症使患者生活质量降低,寿限缩短,病死率增高,应及早防治。糖尿病治疗在于改善血糖控制,以降低并发症的发生。
很多研究表明糖尿病可以改变许多药物在体内的药代动力学作用,并且这种变化通常与外排转运体的改变密切相关。有研究发现外排转运体家族主要成员之一的atp结合盒(atp-bindingcassette)超家族蛋白与糖、脂肪、胆固醇的平衡密切相关。atp结合盒超家族(atp-bindingcassettesuperfamily,abc),在人类主要包括49个家庭成员,这些家庭成员依据序列的同源性主要分成了7个亚族abca,abcb,abcc,abcd,abce,abcf及abcg。磺脲类受体(sulfonyurealreceptor,sur)是abcc亚族的重要成员,主要包括sur1(abcc8)及sur2(abcc9)。sur1通过对胰岛细胞上重要的离子通道-atp敏感性钾离子通道(katp)的调控在胰岛素分泌中发挥着重要的作用。abc另一个重要成员,abca1,与糖脂代谢的相关报道近年来逐渐增多。有报道表明gsis过程中的第一相分泌的失调控与脂质毒性相关,而后者与abca1有着非常紧密的关系。另有报道证明在abca1敲除小鼠的实验中abca1通过调控体内胆固醇的平衡而改善胰岛β细胞功能,维持良好的胰岛素分泌及糖耐。abcg1与abca1相似,通过调控胆固醇而对胰岛素分泌产生调节作用。
p-糖蛋白(abcb1b)作为abc转运蛋白超家族中的一员,是一个分子量约为170kda的大分子跨膜蛋白,在人类由abcb1b单基因调控,在啮齿类动物中由abcb1a和abcb1b双基因调控,代谢产物分别为mdr1和mdr3。p-糖蛋白高表达于恶性肿瘤组织中,并且与化疗药物耐药密切相关,因此得名为多药耐药(mdr)蛋白。它具有广泛结构类型的底物,作为药物的外排泵,通过水解atp酶产生的能量,外排大量疏水性药物,如抗癌药物,环孢素a、钙通道阻滞剂,黄连素等。p-糖蛋白不仅存在于肿瘤细胞中,也广泛分布于正常组织中,如脑、肠、肺、肝、肾、皮肤等,尤其是具有有排泄和分泌作用的内皮细胞表面,表明该蛋白与细胞分泌激素类物质及防止毒素入侵有关。
一直以来,肿瘤细胞耐药性是临床有待解决的重要难题之一,而p-糖蛋白又是调控耐药的主要分子靶点之一,因此长期以来研究热点一直集中在p-糖蛋白介导的药物外排泵功能方面。近几年国内外对于p-糖蛋白与血糖稳态相关性的报道逐渐增多。有研究报道,糖尿病造成的高血糖状态对于血脑屏障、肠道等中的p糖蛋白表达均有影响,而来自中国的研究报道阐明了糖尿病大鼠大脑皮质、肠粘膜、海马、肾脏、肝脏等组织中p糖蛋白的表达量均出现了变化。虽然近几年国内外关于p糖蛋白与血糖稳态相关性的研究越来越多,但其对胰岛素分泌的影响尚未明确。
技术实现要素:
发明目的:为解决这一问题,本发明初步探讨了一种p-糖蛋白对ins-1832/13细胞胰岛素分泌的影响及其潜在机制,为糖尿病的预防以及治疗提供一种新的思路。
技术方案
具体来说,本发明通过体外培养的大鼠胰岛素瘤细胞ins-1832/13细胞(简称832/13细胞);用含有不同浓度(5.0×106,1.0×107,5.0×107,1.0×108pfu/ml)的过表达p-糖蛋白的腺病毒(ad-abcb1b)在无血清条件下感染细胞4小时;然后换成正常培养基再孵育20h;采用3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-h-tetrazoliμmbromide(mtt)法检测细胞活性;随后提取细胞总rna,应用实时定量pcr检测细胞abcb1bmrna表达量的变化;萃取832/13细胞膜蛋白,应用westernblot技术检测p-糖蛋白(p-gp),胰岛素分泌相关蛋白包括小窝蛋白1(caveolin-1,cav-1)、l型钙离子通道蛋白1.2(l-typecalciumchannelprotein,cav1.2)、钾离子通道蛋白6.2(kir6.2)、氯离子通道蛋白3(clcn-3)、腺苷酸环化酶(adenylatecyclase,ac),凋亡相关蛋白(bcl-2和caspase-3)以及磷酸化pka及creb表达量的变化;用罗丹明123荧光实验测定p-gp的功能变化;利用elisa方法测定细胞内camp含量;最后用上述腺病毒感染24小时后的细胞进行高糖刺激胰岛素分泌试验(glucosestimulatedinsulinsecretion,gsis),应用放免法测定胰岛素细胞内含量和细胞外分泌量;利用免疫共沉淀法检测p-gp、caveolin-1、kir6.2、clcn-3、cav1.2、ac蛋白之间的相互作用。随后再利用激光共聚焦技术测定细胞内钙信号
有益效果
本发明说明了p糖蛋白可通过激活camp-pka-creb-ca2+信号转导通路,增加pka、creb活性,增加细胞内camp含量,使胰岛素分泌相关蛋白包括小窝蛋白(caveolin1)、l型钙离子通道蛋白1.2(cav1.2)、钾离子通道蛋白(kir6.2)、腺苷酸环化酶(ac)的表达量增加,然后通过蛋白之间的相互作影响胰岛素的分泌。本发明为研究胰岛保护因子,提高胰岛移植临床转归提供理论基础。
附图说明:
图1荧光显微镜鉴定的不同方式腺病毒感染细胞后的荧光效果图。图1-1示从左到右依次为分别用含有不同浓度的(5×106,10×106,50×106,100×106pfu/ml)ad-abcb1b的腺病毒感染ins-1832/13细胞4h后,换成正常培养基再孵育20h后观察到的感染效果。图1-2示腺病毒浓度为50×106pfu/ml条件下,从左到右依次为非荧光下的细胞生长状态,然后感染不同的时间(12h,24h,48h)后显微镜下观察到的感染效果。
图2是mtt鉴定的p-糖蛋白过表达后细胞活性的柱状图。对照组为不含有ad-abcb1b的腺病毒(浓度100×106pfu/ml),实验组用含有不同浓度(5×106,10×106,50×106,100×106pfu/ml)ad-abcb1b的腺病毒感染832/13细胞4h,然后换成正常培养基再孵育20h。实验结果表明所选浓度的p糖蛋白对ins-1832/13细胞并没有明显的细胞毒性作用。
图3是westernblot技术鉴定的不同方法腺病毒感染细胞后,细胞中p糖蛋白表达量变化的免疫印迹图,real-timepcr技术鉴定p糖蛋白基因水平的变化量柱状图。3-1示不同浓度的腺病毒感染832/13细胞24h后p糖蛋白表达情况,阴性对照组为不含有ad-abcb1b的腺病毒(浓度为100×106pfu/ml),实验组为含有不同浓度ad-abcb1b腺病毒感染832/13细胞4h后换成正常培养基再孵育20h。图3-2示腺病毒感染细胞不同时间后p糖蛋白表达情况,阴性对照组和实验组腺病毒浓度均为50×106pfu/ml。图3-3示腺病毒浓度为50×106pfu/ml,感染时间为24h时p-gp的表达情况,结果发现不仅在细胞上p-gp基因和蛋白水平的表达均增加,且胰岛中p-gp基因和蛋白水平的表达均增加(图3-4)。图3-5示腺病毒浓度为50×106pfu/ml,感染时间为24h时细胞质和细胞膜上p-gp表达量的变化,与对照组相比,过表达组p-gp在细胞膜上的表达明显增加。
图4是westernblot技术鉴定凋亡相关蛋白caspase3和bcl2的表达量变化。westernblot结果所示,与阴性对照组细胞比较,p糖蛋白过表达后的细胞凋亡相关蛋白caspase3和bcl2的表达,并没有明显变化
图5是罗丹明123荧光实验鉴定p-gp外排功能变化的免疫荧光图。腺病毒感染细胞后,通过罗丹明123(rh-123)积累实验检测p-gp外排功能有无变化。p-gp过表达后可明显降低ins-1832/13细胞内罗丹明123的蓄积,表明p-gp的外排泵功能显著增强。
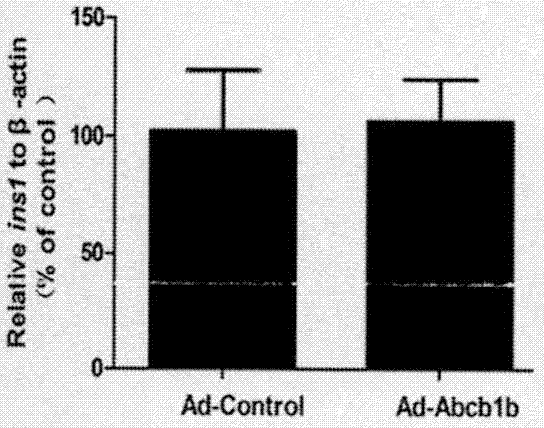
图6是qpcr技术鉴定的p糖蛋白过表达后胰岛素合成表达量ins1、ins2和pdx1表达变化柱状图。图6-1示与对照组相比,过表达组ins1基因表达量没有明显变化;图6-2示与对照组相比,过表达组ins2基因表达量没有明显变化;图6-3示与对照组相比,过表达组pdx1基因表达量没有发生显著改变。
图7是elisa方法鉴定腺病毒感染24小时后行低糖和高糖刺激胰岛素分泌试验细胞内胰岛素含量和细胞外胰岛素分泌量。图7-1示在低糖孵育时,实验组与对照组相比,基础胰岛素分泌没有明显变化;图7-2示校正蛋白后,对照组和实验组细胞内胰岛素的含量并没有差别。图7-3示高糖刺激后细胞胰岛素增加的倍数,结果显示与阴性对照组相比,实验组增加的倍数明显较高,说明胰岛素分泌量明显增加。
图8是westernblot技术鉴定p-gp,cav-1,cav1.2,kir6.2,clcn-3,ac,bcl-2和caspase-3,pka及creb表达量变化的免疫印迹图。如图8-1所示,与对照组相比,p糖蛋白过表达组的cav1.2和cav-1表达量均显著增加,结果显示cav1.2和cav-1蛋白表达变化与p糖蛋白变化一致。图8-2显示,与阴性对照组相比,p糖蛋白过表达后,细胞内camp含量明显增加,ac蛋白表达增加,且pka和creb活性增加,kir6.2蛋白表达没有变化(图8-3)。此外通过elisa试剂盒检测发现,。
图9是免疫共沉淀法鉴定的p-gp、caveolin-1、kir6.2、clcn-3、cav1.2、ac蛋白间相互作用的柱状图。结果显示,p-gp与cav-1,cav-1和kir6.2,cav-1和ac之间具有相互作用关系(图9-1,图9-2),但p-gp与cav1.2、kir6.2、ac之间以及cav-1与cav1.2之间暂时没有发现具有相互作用关系(数据未显示)。
图10是激光共聚焦技术测定上述细胞内钙信号图。结果发现,与阴性对照组相比,低糖孵育时,p糖蛋白过表达组细胞内钙信号没有变化,高糖刺激后,p糖蛋白过表达组细胞内钙信号增加。
具体实施方式
实施例1:p糖蛋白过表达胰岛素瘤细胞ins-1832/13细胞的构建。
准备好细胞全培养基及细胞培养常用器材置于细胞房无菌环境中。移除细胞培养基,无菌pbs轻洗细胞2次。加入5ml细胞培养基,用3ml吸管吹打细胞,直至瓶壁透亮即瓶底细胞已经吹下。悬浮液移至离心管中,加入适量培养基,用电动枪轻轻吹打混匀悬浮液。将细胞悬液移至离心管中,加入适量培养基,再用10ml移液枪吹打10min后混匀,然后将悬浮液平铺到6孔板,生长12-24h后,待细胞置于对数生长期时,换成无血清培养基,再用不同浓度的(5×106,10×106,50×106,100×106pfu/ml)过表达p-糖蛋白的腺病毒感染细胞4小时后,换成正常培养基,再孵育20h后,分别用westernblot法和real-timepcr法检测p糖蛋白的蛋白和基因水平的变化。再用腺病毒浓度均为50×106pfu/ml,然后感染不同的时间(12h,24h,48h)后检测p糖蛋白的蛋白和基因水平的变化。
实施例2:mtt法检测细胞活性以确定适量的腺病毒浓度和腺病毒最佳的感染时间。
细胞成细胞悬浮液,96孔板的每个孔里加入100μl的细胞悬液,调整细胞密度到5×103/孔,每加3-5列后,“8”字法混匀细胞悬液,同时要设置相应的对照孔,即分别只含有细胞培养液、mtt、dmso组,96孔板的边缘孔用无菌pbs填充以排除边缘效应的影响。待24h后加入不同浓度的腺病毒,设5个梯度6个复孔。腺病毒感染结束后,显微镜下观察细胞状态。每孔加入10μl0.5%的mtt溶液(即5mg/ml),避光条件下继续孵育4h后终止mtt孵育,并每孔加入150μldmso,避光条件下放在摇床低速振荡10min,用酶标仪检测490nm处各孔的吸光度值。根据细胞活力=实验组a值/对照组a值进行统计学处理。结果表明所选浓度的p糖蛋白对ins-1832/13细胞并没有明显的细胞毒性作用。然后再根据mtt的结果,确定合适的给药剂量,在给药后12h,24h,48h收集细胞,提取细胞总蛋白,westernblot检测p-gp的表达量,最后应用灰度分析解析条带
实施例3p-gp过表达后,p-gp的外排泵功能显著增强
十二孔板培养细胞24小时后,分别用50×106pfu/ml浓度的ad-control和ad-abcb1b腺病毒孵育细胞,感染结束后,用预热的无血清1640培养液洗涤细胞2遍。每孔加入含有1μl罗丹明母液(1μg/μl)的无血清1640培养液1ml,培养箱避光3h。孵育结束后,用无血清1640洗涤细胞2遍,提取细胞蛋白。每孔加220μl强ripa裂解液进行裂解30min,12000r/min离心10min后取清液加入到白色避光的荧光强度专用的96孔板中,每孔加入100μl上清液;然后加入罗丹明配制的标准品,在λex=485nm,λem=535nm条件下,通过victoriiimultiplatereader仪器测荧光强度值。p-gp过表达后可明显降低ins-1832/13细胞内罗丹明123的蓄积,表明p-gp的外排泵功能显著增强。
实施例3:p糖蛋白过表达后,提取细胞rna,采用qpcr方法检测abcb1b等相关基因表达水平的变化。
1)引物
2)标记相应ep管,然后依次加入以下组分(总体积20μl):
实施例4:p糖蛋白过表达细胞及胰岛细胞后高糖刺激下胰岛素分泌明显增加。
取12孔板进行铺板,待细胞密度至70%-80%时,换成无血清培养基,分别用不含有abcb1b的阴性对照病毒和含有abcb1b的腺病毒(浓度5.0×107pfu/ml)感染细胞4小时后,换成正常培养基,孵育20h后在低糖(2.5mm)孵育和高糖(16.7mm)刺激后分别收取上清液,用酸乙醇法提取细胞蛋白,然后检测蛋白含量,用mercodiaratinsulinelisa试剂盒检测样品胰岛素含量,并用对应的蛋白浓度校正。大鼠胰岛细胞转染时,先挑选形态一致、大小相近、圆形的新鲜胰岛,50个分为一组,置于6孔板培养24h。第二天,将胰岛移至96孔板,换成无血清培养基,转染方法及gsis实验方法同上述细胞。
实施例5:abcb1b增加p-gp、cav-1、ac、cav1.2蛋白的表达量,增加creb活性。
p糖蛋白过表达后,提取细胞膜蛋白或核蛋白,应用westernblot技术检测p糖蛋白、cav-1、cav1.2、kir6.2、ac、bcl-2和caspase-3以及磷酸化pka及creb表达量的变化。
实施例6:abcb1b过表达后细胞内p-gp与cav-1,cav-1与kir6.2,cav-1与ac具有相互作用关系
采用免疫共沉淀检测p-gp过表达后,cav-1,cav-1与kir6.2,cav-1与ac相互作用关系,用p-gp沉淀cav-1,细胞裂解方法同蛋白提取方法,取100μg的细胞裂解上清液,与蛋白g琼脂糖磁珠进行预孵育2h后取上清,然后分别再用5μg的c219抗体或igg抗体与蛋白g琼脂糖磁珠孵育2h。最后将细胞上清液与含有抗体的免疫磁珠孵育过夜,然后通过westernblot法用cav-1抗体作为一抗即可。
实施例7:abcb1b增加细胞内钙浓度增加
采用共聚焦实验检测的细胞内钙信号的变化。感染细胞结束后,低糖溶液清洗细胞2-3次,然后把2.5mmol低糖配制的浓度为2μm的fura-2荧光探针加入到培养板内,检测以340nm与380nm激发的510nm的荧光强度及二强度比值。200s时弃去低糖溶液,以低糖溶液清洗残液2-3次,在300s左右时加入高糖(16.7mmol)配制的探针溶液,然后检测以340nm与380nm激发的510nm的荧光强度及二强度比值。图10示低糖和加入高糖后细胞内钙信号变化,图10示400s时(钙信号变化最大处)细胞内钙信号变化。
- 还没有人留言评论。精彩留言会获得点赞!