一种集超声/荧光双模态成像及光热/光动力治疗于一体的多功能微泡的制作方法
本发明属于生物医用材料领域,具体涉及一类集超声/荧光双模态成像及光热/光动力治疗于一体的多功能超声微泡,以及其在肿瘤诊疗方面的用途。
背景技术:
荧光成像是分子生物学和医学研究极为重要的手段。其中近红外区域(波长600~900nm)生物分子的光吸收最低,而自发荧光最弱,大量的红外光可以穿过组织和皮肤而被检测到。因此,其波长范围被认为是光学成像的“诊断窗”。其独特优势为:①敏感性高;②可通过不同荧光探针的设计实现各种肿瘤的靶向性成像;③可提供实时动态的肿瘤活体成像。但是近红外染料受限于成像深度(不超过1cm),从而影响了在显示深部肿瘤中的应用。
无创性超声成像因其具有便捷、低价和实时成像等无可比拟的优点己被广泛应用于癌症的早期诊断中。超声微泡造影剂是通过引入与组织不同声学特性的材料如气体来改善成像效果的,其既能高质量显示肿瘤形态学信息也能有效反映其生物学特性,显著提高了诊断的准确率。超声成像接收声信号,相比光学成像,大大增加了成像深度。近红外荧光/超声双模态显像,可以取长补短,提供了一种深浅兼顾的诊断肿瘤的新方法。
肿瘤的光治疗(phototherapy)因其治疗成本低、组织创伤小、副作用小及高效性逐渐成为继手术、放疗、化疗后肿瘤治疗的又一有效手段。光治疗主要包括光热治疗(photothermaltherapy,ptt)和光动力治疗(photodynamictherapy,pdt)。ptt主要是通过使用在近红外区有强吸收的光热治疗剂,通过特定波长的光照射富集于肿瘤部位中的光热剂使其局部温度升高来杀伤肿瘤细胞。pdt是指将光敏剂药物输送到肿瘤细胞,通过光照使其产生“高活性”的单线态氧和自由基(ros),从而诱导癌细胞发生凋亡。
虽然单纯的ptt和pdt用于肿瘤的治疗已取得了显著的进步,但是能够同时结合ptt和pdt两种治疗方式的纳米材料仍比较少见。如能通过微纳米技术实现ptt和pdt的结合,将有望进一步提高治疗的效果。因此,需要开发新型材料联合光动力和光热疗法来实现协同抗癌作用。另外,理想的光治疗应在杀伤肿瘤组织的同时尽可能不损伤周围的正常组织,以保证治疗的有效性和安全性。对于光治疗而言,光敏剂/光热治疗试剂是光治疗的核心要素,只有在光敏剂/光热治疗试剂存在的部位才能产生光治疗效应而对细胞产生损伤;由于治疗时所用激光能量一般较低,在缺乏光敏剂的情况下单纯的激光辐照对细胞并无杀伤效果。因此光治疗的肿瘤靶向性依赖于光敏剂在靶区域的良好聚集。如何实现光敏剂/光热治疗试剂在肿瘤部位的精准聚集是光治疗中面临的一大难题。
随着超声微泡制备技术的迅速发展,超声微泡造影剂除可作为优良的超声成像对比増强剂,在肿瘤诊断方面发挥重要作用外,其在肿瘤的治疗方面也具有巨大的应用潜能。在治疗领域,超声微泡可用作药物、基因和纳米材料等其它治疗物质的控制释放载体,达到靶向输送的目的。但是作为药物载体,首先需要克服超声微泡载药量低的问题。
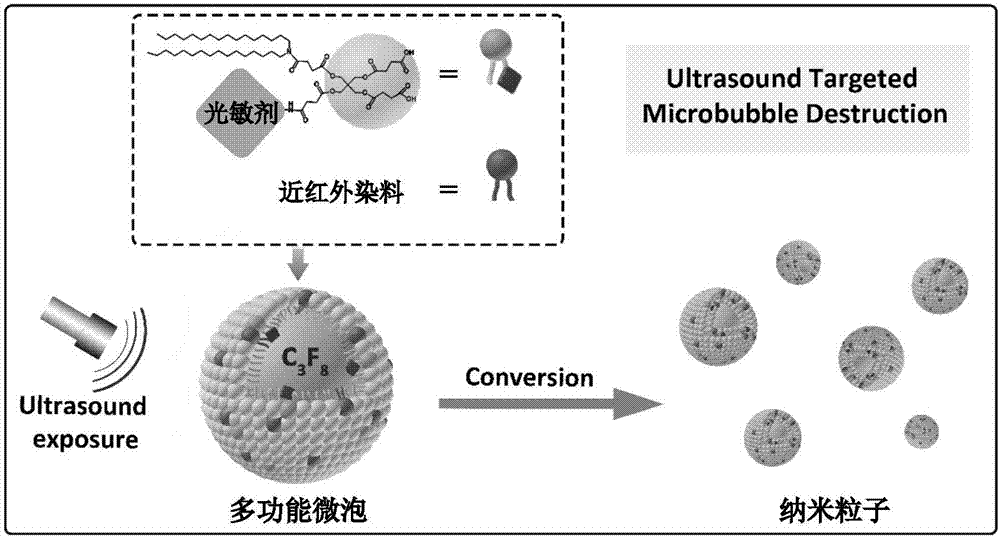
基于以上考虑,我们开发出了一类集超声/荧光双模态成像及光热/光动力治疗于一体的多功能超声微泡,其特点是将用于光热治疗的近红外染料和用于光动力治疗的具有光敏剂功能基团的脂质组装到超声造影剂的膜成分中,在超声引导下可在肿瘤部位定点击破微泡,使其转变为纳米粒子,在超声空化作用下,纳米粒子更多的被肿瘤细胞摄取。随后在荧光成像引导下,在肿瘤部位实施光热和光动力联合治疗。
技术实现要素:
本发明的目的是提供一类集超声/荧光双模态成像及光热/光动力治疗于一体的多功能超声微泡造影剂以及该类微泡的制备方法。
本发明的另一目的是提供上述集超声/荧光双模态成像及光热/光动力治疗于一体的多功能超声微泡造影剂在肿瘤诊疗中的应用。
本发明所述的集超声/荧光双模态成像及光热/光动力治疗于一体的多功能超声微泡造影剂的结构如附图1所示。
本发明中多功能微泡造影剂其特征在于该微泡的壳层是由脂质单分子层构成,其组成同时包括:用于光热治疗的近红外染料、用于光动力治疗的含有光敏功能基团的脂质及各类常规磷脂,微泡内包载惰性气体或液体,近红外染料和含有光敏剂功能基团的脂质可以和常规磷脂在水溶液中共同自组装形成微泡。
其中所述近红外染料首选生物相容性好、光热转换效率高的具有疏水长链或者双亲性的染料,一般其结构如下:
所述的含有光敏剂功能基团的脂质一般指光敏功能基团共价连接到脂质上,其结构一般如下:
其中r1=h或c6~18烷基,r2=c6~18烷基;a,b=2或3;x=n或o,即光敏剂和脂质的连接方式是酯键或酰胺键;所述的含光敏功能基团的脂质经溶胶凝胶过程后在水溶液中能自组装形成脂质体。光敏功能基团包括血卟啉、原卟啉、四苯基卟啉、焦脱镁叶绿酸(pyropheophorbide)、细菌叶绿素、叶绿素a、苯并卟啉衍生物、四氢苯基二氢卟吩、苯并二氢卟吩、萘并二氢卟吩、酞菁或萘酞菁等。
本发明所述的一种集超声/荧光双模态成像及光热/光动力治疗于一体的多功能微泡的制备方法,包括以下步骤:
1)将一定比例的磷脂、含有光敏剂功能基团的脂质及近红外染料于乙醇中溶解混合均匀(含有光敏剂功能基团的脂质比例0~20%,近红外染料比例0~20%)。
2)采用乙醇注入法,将混匀的上述体系滴加到生理盐水中,40-60℃水浴超声15-30分钟。
3)使用8000~14000kd的透析袋将得到的体系2)在生理盐水中室温下透析2~4h。
4)将上述所得体系转移至西林瓶中,然后加入丙二醇、甘油作为稳定剂,混匀。
5)往西林瓶中填充惰性内包物质,封口后,使用银汞调和器剧烈震荡45s,分离提纯后得到集超声/荧光双模态成像及光热/光动力治疗于一体的多功能微泡。
在步骤l)中,所述的磷脂包含12~24个碳的碳链长度以及包括磷脂酰胆碱、磷脂酰基乙醇胺、磷脂酸和磷脂酰基甘油,例如1,2-二硬脂酰基-sn-甘油基-3-磷酸胆碱(dspc)、1,2-二棕榈酰基-sn-甘油基-3-磷脂酰胆碱(dppc)、1,2-二棕榈酰基-sn-甘油基-3-磷脂酸(dppa)、二硬脂酰磷脂酰乙醇胺-聚乙二醇2000(dspe-peg2000)、二硬脂酰磷脂酰乙醇胺-聚乙二醇2000(dspe-peg5000)等。
步骤5)中所述的惰性内包物质包含空气、氮气、二氧化碳、氟碳烃气体,液体选自c5-c12氟碳烃。
本发明中超声/荧光双模态成像及光热/光动力治疗于一体的多功能微泡,其光热治疗试剂/具有光敏剂功能基团的脂质和磷脂共成膜,光热和光敏药物的比例各根据需要进行调控,载药量大大提高;同时,其能够综合荧光和超声两种成像模式,精准定位肿瘤位置;并且在超声作用下实现微泡靶向爆破,增加了光热治疗试剂/光敏剂在肿瘤部位的富集;光热和光动力联合治疗肿瘤,优于单独的光热治疗或者光动力治疗效果,有效改善了疗效。
附图说明
图1是本发明所描述的多功能微泡造影剂的结构图;图2是具体实施例1制备得到的多功能微泡的粒径分布图;图3是具体实施例4中不同浓度下的多功能微泡造影剂在近红外光照射下的升温曲线;图4是具体实施例5中多功能微泡造影剂体外在激光照射下产生单线态氧能力的测定;图5是具体实施例6中微泡造影剂的体外超声造影图像;图6是具体实施例7中微泡造影剂在动物肿瘤组织处的超声造影图像;图7是具体实施例8中微泡造影剂在动物肿瘤组织处被超声击破后的荧光成像的图像;图8是具体实施例9中微泡造影剂在动物肿瘤组织处被超声击破后,经激光照射后肿瘤组织的热成像图;图9是具体实施例10中微泡造影剂用于光热和光动力联合治疗下的动物肿瘤生长曲线。
具体实施方式
通过以下具体实施方式将有助于理解本发明,但并不限制本发明的内容。
实施例1
将二硬脂酰基磷脂酰胆碱(dspc)、胆固醇(cholesterol)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg2000)、卟啉脂质(pgl)和近红外染料dir按照一定摩尔比混合(55%:15%:10%:10%:10%),然后采用乙醇注入法,在50℃水浴超声条件下,将上述混合物注入到0.8ml水中;将上述所得到的溶液置于截留分子量8000-14000da的透析袋中,透析2~4h,取出后分别加入甘油和丙二醇各100μl混合均匀。将混合液装入3.5ml西林瓶中,充入足量的全氟丙烷(c3f8)气体,振荡器震荡45s,分离提纯后得到集超声/荧光双模态成像及光热/光动力治疗于一体的多功能微泡(pgl-dirmbs)。微泡粒径分布如附图2所示。
实施例2
将二硬脂酰基磷脂酰胆碱(dspc)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg2000)、卟啉脂质(pgl)和近红外染料dir按照一定摩尔比混合(70%:10%:10%:10%),然后采用乙醇注入法,在50℃水浴超声条件下,将上述混合物注入到0.8ml水中;将上述所得到的溶液置于截留分子量8000-14000da的透析袋中,透析2~4h,取出后分别加入甘油和丙二醇各100μl混合均匀。将混合液装入3.5ml西林瓶中,充入足量的全氟丁烷气体,振荡器震荡45s,分离提纯后得到集超声/荧光双模态成像及光热/光动力治疗于一体的多功能微泡(pgl-dirmbs)。
实施例3
将二硬脂酰基磷脂酰胆碱(dspc)、1,2-二棕榈酰基-sn-甘油基-3-磷脂酸(dppa)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg2000)、卟啉脂质(pgl)和近红外染料dir按照一定摩尔比混合(55%:15%:10%:10%:10%),然后采用乙醇注入法,在50℃水浴超声条件下,将上述混合物注入到0.8ml水中;将上述所得到的溶液置于截留分子量8000-14000da的透析袋中,透析2~4h,取出后分别加入甘油和丙二醇各100μl混合均匀。将混合液装入3.5ml西林瓶中,加入足量的全氟溴辛烷,振荡器震荡45s,分离提纯后得到集超声/荧光双模态成像及光热/光动力治疗于一体的多功能微泡(pgl-dirmbs)。
实施例4
为了评价实施例1-3中获得的多功能微泡的光热转化能力,将不同浓度的微泡经过760nm激光辐照(1w/cm2,5min)后,记录其温度随时间的变化情况。附图3显示pbs经过激光照射5min后温度基本没有明显的升高,10μmol和30μmol的微泡(dir当量)经过激光辐照5min后温度可以分别升高9.7℃和19.5℃,说明dir有很高的光热转换效率。
实施例5
为了评价实施例1-3中获得的多功能微泡产生单线态氧的能力,将不同浓度的微泡经过超声辐照后转变为纳米粒子,用760nm激光辐照(1w/cm2,10min),然后使用650nm激光(200mw/cm2,15min)辐照,同时使用单线态氧探针sosg检测此过程中单线态氧的产生量。此过程的对照组包含超纯水、卟啉脂质体、未经760nm辐照降解dir的微泡。结果见附图4,经过760nm激光辐照降解dir后的微泡产生单线态氧的能力和卟啉脂质相比没有明显的差异。
实施例6
将实施例1-3中获得的集超声/荧光双模态成像及光热/光动力治疗于一体的多功能微泡与生理盐水按体积比1:3配置后注入乳胶管中,在水槽中放入500ml超声脱气水,将上述乳胶管置于液体中部,使用超声诊断仪contrast模式,mi:0.04(机械指数),探头频率:3-12mhz,观察微泡体外超声造影效果。体外超声造影图像见附图5所示,由于硅胶管壁本身较高的密度,导致其在超声场里呈现较高的回声效果,而硅胶管内腔在没有造影剂pgl-dirmbs存在的时候,呈现无回声状态。当注射pgl-dirmbs之后,在硅胶管的内腔中观察到显著的回声信号增强,从而证实了pgl-dirmbs具有很好的体外超声显影增强的能力。
实施例7
为了评估实施例1-3中获得的多功能微泡体内超声显影增强性能,对接种了皮下4t1肿瘤的小白鼠进行肿瘤超声成像。微泡的浓度为108/ml,按照1ml/kg的浓度尾静脉注射到小白鼠体内,紧接着注射100μl生理盐水。使用超声诊断仪contrast模式,mi:0.04(机械指数),探头频率:3-12mhz。微泡注射后38s时,瞬间调大超声能量(机械指数为0.5左右)维持2s,击破肿瘤处的微泡,观察肿瘤组织微泡再灌注的情况。体内超声造影图像见附图6所示,注射后20s时,超声信号接近饱和,38s时,实验小白鼠肿瘤部位超声造影信号消失,说明pgl-dirmbs在高能超声作用下发生了破裂,随后几秒又可见微泡重新灌注到肿瘤血管,增强超声造影信号逐渐增强,然后在大概注射3min后,超声增强信号逐渐衰减至未注射微泡前水平。
实施例8
为了评估实施例1-3中获得的多功能微泡在体内对肿瘤进行荧光成像的能力,对接种了皮下4t1肿瘤的小白鼠进行荧光成像。微泡的浓度为108/ml,按照1ml/kg的浓度尾静脉注射到小白鼠体内,紧接着注射100μl生理盐水。在超声成像引导下进行高能量超声辐照肿瘤部位击碎微泡(1.03mhz,50%duty,1w/cm2,3min),然后0.5h、3h、12h、24h分别对小鼠进行近红外荧光成像。体内活体荧光成像图像如附图7示,肿瘤部位超声击破微泡后,3小时后即可见肿瘤部位的荧光强度远远强于其他组织或器官。
实施例9
体内治疗实验中进一步考察了实施例1-3中获得的多功能微泡是否能对癌细胞进行有效的光热消融。接种了皮下4t1肿瘤的小白鼠尾静脉注射微泡200ul,然后超声成像引导下进行高能量超声辐照肿瘤部位击碎微泡(1.03mhz,50%duty,1w/cm2,3min),4h后760nm激光(1w/cm2,10min)照射肿瘤部位,利用红外照相机对其肿瘤部位的温度进行监测(对照组:pbs)。肿瘤部位温度变化情况见附图8,激光照射10min后,肿瘤组织的温度高达57.0℃,可有效杀伤肿瘤细胞。
实施例10
体内光热和光动力联合治疗实验考察了实施例1-3中获得的多功能微泡是否能对肿瘤生长进行有效抑制。将携带4t1皮下肿瘤的裸鼠随机分为7组,分别用pbs+us+laser760+laser650,dirnps+us+laser760+laser650,pglnps+us+laser760+laser650,pgl-dirnps+us+laser760+laser650,pgl-dirmbs+us,pgl-dirmbs+laser760+laser650orpgl-dirmbs+us+laser760+laser650处理,其中给药方式均为尾静脉注射200ul。每组小鼠治疗后,每天记录其肿瘤体积及体重变化(肿瘤体积=长*宽^2/2)。光热和光动力联合治疗组(纳米粒子或着微泡)的肿瘤体积增长速率远小于单纯光热或单纯光动力组的肿瘤体积增长速率,即联合治疗的效果要比单纯光热或光动力治疗效果要好;微泡联合超声组在治疗后完全抑制了肿瘤的增长,而纳米粒子组肿瘤在前四天被抑制,增长缓慢,但是随后便出现了快速增长的现象,说明粒子组仅在治疗过程中杀死了大部分的肿瘤细胞,仍然有极少量的肿瘤细胞存活,后期又开始快速分裂生长,由此可见,微泡联合超声肿瘤部位靶向击破技术可以使得更多的治疗试剂被肿瘤细胞摄取,发挥更有效的治疗作用。结果如附图9所示。
- 还没有人留言评论。精彩留言会获得点赞!