Nano-MitoPBN脂质体纳米颗粒靶向肝脏清除活性氧改变肝脏代谢的应用的制作方法
本发明设计生物技术和医学领域,更具体的本发明涉及脂质体包裹的线粒体靶向自由基清除剂mitopbn纳米颗粒可以靶向肝脏线粒体,改变肝脏氧化还原微环境和代谢状态。
背景技术
脂质体(liposomes)是由脂质双分子层所形成的一种超微球形载体制剂,是纳米载药系统的典型代表。当两性分子如磷脂分散于水相时,分子的疏水尾部聚集在一起,亲水头部暴露在水相,形成具有双分子层结构的封闭囊泡(vesicles)。在囊泡内水相和双分子膜内可以包裹多种不同极性的药物。经脂质体处理的药物与未经脂质体处理的药物相比具有副作用低、在体内作用时间长、机体摄入量多的特点。另外,脂质体具有良好的生物相容性,可以被正常代谢,因此,脂质体作为药物载体,具有很大的开发潜力。1965年,英国bangham等提出了脂质体的概念,他们发现,当磷脂分散在水中时,可形成多层类似洋葱结构的封闭囊泡1988年,载益康唑的脂质体凝胶(pevaryllipogel)由瑞士cilag制药公司注册,在瑞士、意大利、比利时等国上市销售。1990年,注射型两性霉素b脂质体在欧洲上市;随后,阿霉素脂质体也作为第1个抗癌药脂质体产品上市。目前,已有多个脂质体制剂上市并在临床中得到广泛使用。
脂质体图
pbn(n-tert-butyl-α-phenylnitrone)是一种自旋捕捉剂,能够有效捕获碳、氧中心的自由基,生成相对稳定的自旋加合物,降低自由基的活性,起到抗氧化的作用。线粒体作为体内活性氧的主要产生场所,我们利用线粒体呼吸链复合体在进行电子传递过程中会使线粒体膜内外两侧形成电势差,其中线粒体膜内具有相对较低的电势,而膜外的电势相对较高这一特征,我们自主合成了一种选择性自由基捕获探针mitopbn(专利号201610112127.1)。mitopbn是pbn与亲脂性三苯基磷阳离子结合形成,三苯基磷基团自身带有正电荷,因此可以顺着线粒体膜内外的电势差进入线粒体基质当中,使药物在线粒体中发生累积。
mitopbn图
近年来一些研究显示由于肝脏血流量较低,肝脏的kupffer细胞比脾的巨噬细胞会摄取更多的纳米颗粒,所以认为大部分纳米颗粒会被肝脏所捕获。基于这样的理论和研究基础,我们利用脂质体包裹mitopbn后形成粒径为100nm左右的nano-mitopbn,使mitopbn靶向肝脏线粒体(专利号:2016109980790)。肝脏作为生物体内代谢中心,能够同时调控合成代谢途径和分解代谢途径,将其线粒体作为一个治疗靶点,对于由活性氧所导致的代谢失调性疾病(如糖尿病,肿瘤等)有重要的治疗意义。
技术实现要素:
1.脂质体包裹的线粒体靶向自由基清除剂mitopbn纳米颗粒(nano-mitopbn)其主要用途在于:
1)可以靶向进入肝脏组织
2)可以靶向肝脏后进入肝脏线粒体内
3)靶向肝脏线粒体后,可以清除线粒体内ros
4)靶向肝脏线粒体后,可以改变肝脏代谢状况
5)改善糖尿病鼠体内肝脏代谢水平,降低血糖,改善糖尿病
2.如权利要求书1所述的用途,其特征在于,nano-mitopbn进入细胞内的效率比mitopbn高;nano-mitopbn进入细胞线粒体的效率比mitopbn和pbn都要更高。
3.如权利要求书1和2所述的用途,其特征在于,比较nano-mitopbn和mitopbn在组织内的分布,结果显示nano-mitopbn进入肝脏的量比进入其他组织都要更高,且其在肝脏内的高峰时间在15min-1h,随后即被代谢。
4.如权利要求书1所述的用途,其特征在于,nano-mitopbn会进入肝脏实质细胞。
5.如权利要求书3所述的用途,其特征在于,nano-mitopbn可以清除线粒体内羟自由基,超氧阴离子,过氧化氢,并且改善氧化应激疾病中的总抗氧化能力,脂质过氧化程度和蛋白羰基化水平。
6.如权利要求书4所述,其特征在于,nano-mitopbn可以改变肝脏代谢状况,减少糖异生水平和磷酸戊糖途径。
7.如权利要求书5所述,其特征在于,nano-mitopbn可以改善糖尿病鼠体内肝脏代谢水平,线粒体功能并且降低血糖。
1.脂质体包裹的线粒体靶向自由基清除剂mitopbn纳米颗粒(nano-mitopbn)其主要用途在于:
1)可以靶向进入肝脏组织
2)可以靶向肝脏后进入肝脏线粒体内
3)靶向肝脏线粒体后,可以清除线粒体内ros
4)靶向肝脏线粒体后,可以改变肝脏代谢状况
5)改善糖尿病鼠体内肝脏代谢水平,降低血糖,改善糖尿病
2.如权利要求书1所述的用途,其特征在于,nano-mitopbn进入细胞内的效率比mitopbn高;nano-mitopbn进入细胞线粒体的效率比mitopbn和pbn都要更高。
3.如权利要求书1和2所述的用途,其特征在于,比较nano-mitopbn和mitopbn在组织内的分布,结果显示nano-mitopbn进入肝脏的量比进入其他组织都要更高,且其在肝脏内的高峰时间在15min-1h,随后即被代谢。
4.如权利要求书1所述的用途,其特征在于,nano-mitopbn会进入肝脏实质细胞。
5.如权利要求书3所述的用途,其特征在于,nano-mitopbn可以清除线粒体内羟自由基,超氧阴离子,过氧化氢,并且改善氧化应激疾病中的总抗氧化能力,脂质过氧化程度和蛋白羰基化水平。
6.如权利要求书4所述,其特征在于,nano-mitopbn可以改变肝脏代谢状况,减少糖异生水平和磷酸戊糖途径。
7.如权利要求书5所述,其特征在于,nano-mitopbn可以改善糖尿病鼠体内肝脏代谢水平,线粒体功能并且降低血糖。
具体实施方式:
实施例1.细胞摄取实验比较nano-mitopbn与mitopbn被肝细胞l02摄取的情况。
如图1所示:
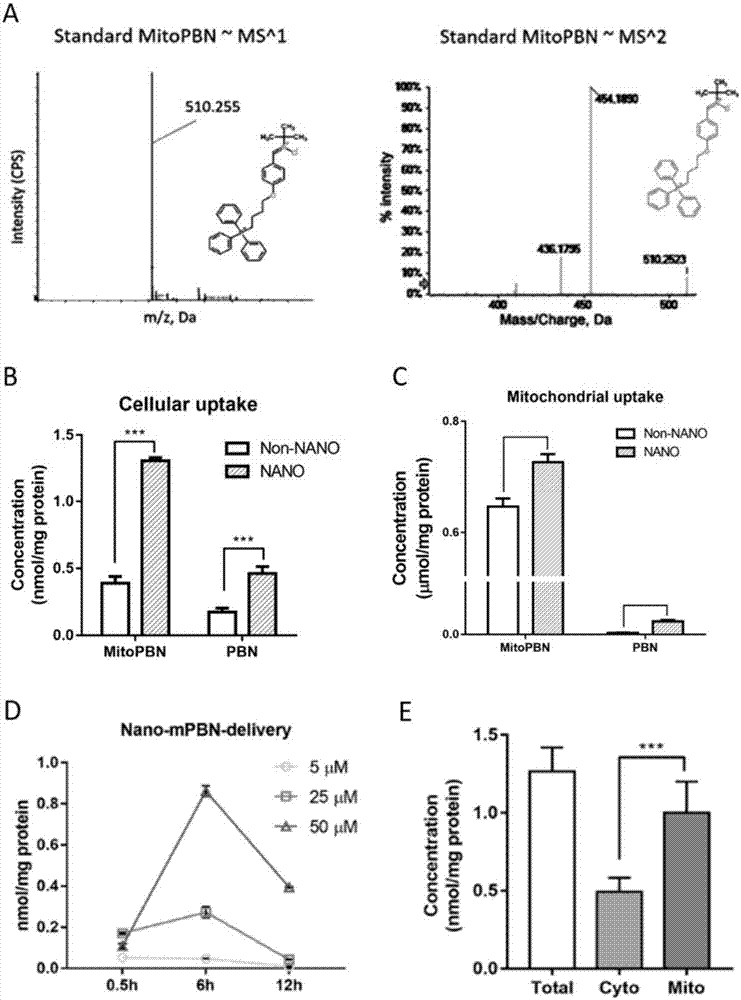
1)将nano-mitopbn/mitopbn和nano-pbn/pbn加入培养细胞l02(106个细胞)的培养基中,3h后吸弃培养液,收集细胞,利用100μl冰甲醇沉淀细胞蛋白并反复重悬后离心13,000rpm,30min收集上清液利用lc-ms检测其细胞内mitopbn和pbn的含量。同时抽提细胞内线粒体,利用并甲醇沉淀蛋白收集上清,检测线粒体内mitopbn的浓度。图1a显示mitopbn的质谱一级(510.225da)和二级信号谱图(454.189da)。图1b显示20μmnano-mitopbn/mitopbn和nano-pbn/pbn在3h内进入细胞的含量,结果显示脂质体包裹的mitopbn进入细胞的含量比未包裹的更高,同时脂质体包裹的pbn进入细胞的含量比未包裹的也更高,mitopbn比pbn进入细胞的含量更高。图1c显示20μmnano-mitopbn/mitopbn和nano-pbn/pbn在3h内进入细胞线粒体的含量。结果显示,脂质体包裹的nano-mitopbn进入线粒体的含量显然大于脂质体包裹的nano-pbn。同时脂质体包裹的nano-mitopbn进入线粒体的含量大于未包裹的mitopbn.
2)分别将5,25,50μm的nano-mitopbn加入培养细胞l02(106个细胞)的培养基中,分别在0.5h,6h,12h后吸弃培养液,收集细胞,利用100μl冰甲醇沉淀细胞蛋白并反复重悬后离心13,000rpm,30min收集上清液利用lc-ms检测其细胞内摄入的mitopbn的含量。图1d显示不同浓度的nano-mitopbn进入细胞的过程。结果显示nano-mitopbn在6h在胞内浓度最高,6h后逐渐降低,且nano-mitopbn被细胞吸收的效率呈浓度依赖型。图1e显示6h内线粒体在全细胞裂解液,胞质和线粒体中的分布。结果显示nano-mitopbn在6h时主要存在于细胞线粒体内。(*p<0.05,**p<0.01,***p<0.001)
实施例2.比较nano-mitopbn和mitopbn在小鼠体内分布
如图2所示,将同样浓度(2.5mg/kg)的nano-mitopbn和mitopbn腹腔注射入小鼠体内,分别在15min,30min,1h,2h和3h处死小鼠,取其心脏,胰岛,肝脏,肾脏和脾脏,比较其在组织内的分布。图2a显示nano-mitopbn在不同时间内的组织分布。图2b显示mitopbn在不同时间内的组织分布。图2c显示注射nano-mitopbn后不同时间内,其在肝脏和肝脏线粒体内的浓度变化(黑色表示其在肝脏内浓度,灰色表示其在线粒体内浓度)。图2d显示nano-mitopbn和nano-pbn在不同时间内在肝脏浓度区别。结果显示nano-mitopbn进入肝脏的量比进入其他组织都要更高,且其在肝脏内的高峰时间在15min~1h,随后进入线粒体;未包裹脂质体的mitopbn在其他组织的分布与包裹脂质体的nano-mitopbn含量相差不大,但是肝脏内明显偏小;与nano-pbn相比较,其进入肝脏的浓度更高。
实施例3.测定nano-mitopbn在肝脏实质细胞中的分布
如图3所示,将2.5mg/kgnano-mitopbn腹腔注射入小鼠腹腔内1h后,利用灌流法除去肝脏中血液,分离小鼠原代肝脏实质细胞,利用lc-ms标准曲线计算得出肝脏实质细胞内mitopbn浓度。图3a为mitopbn标准曲线。图3b为实质细胞中mitopbn的浓度。结果显示大部分mitopbn进入肝脏实质细胞。
实施例4.nano-mitopbn改善细胞氧化应激及保护线粒体功能的作用
如图4a所示,在培养细胞l02(106个细胞)中使用10mmstz对其进行氧化应激干预24h,并且加入nano-mitopbn(13μmol/l)干预24h。24h干预时间后,将培养液吸弃,使用pbs(ph=7.0)洗细胞一次,分别使用dcf(用于检测过氧化氢),hpf(用于检测羟自由基)和mitosox(用于检测超氧阴离子)荧光探针孵育干预后的细胞,使用流式细胞仪检测荧光强度。结果显示nano-mitopbn可以清除线粒体内羟自由基,超氧阴离子,过氧化氢。(下方的柱状图为荧光强度的定量分析。c:正常组s:stz干预组s+m:stz+nano-mitopbn干预组,*p<0.05,**p<0.01,***p<0.001)
在seahorse专用培养板中培养细胞l02(104个细胞),使用10mmstz对其进行氧化应激干预24h,并且加入nano-mitopbn(13μmol/l)干预24h。利用seahorse分析仪检测细胞的有氧氧化能力,分别在仪器程序中加入oligomycin,fccp和antimycina,检测细胞在三种药物作用下的耗氧能力变化,反应细胞的有氧氧化能力(ocr);利用seahorse分析仪检测细胞的酵解能力,分别在仪器程序中加入glucose,oligomycin和2-dg,检测细胞在三种药物作用下细胞酸化率的变化,反应细胞的酵解能力(ecar)。结果如图4b所示,nano-mitopbn改善氧化应激下l02细胞线粒体功能(ecar和ocr)。
实施例5.nano-mitopbn改善糖尿病小鼠体内氧化应激及改善线粒体功能的作用
如图5所示,分别将糖尿病和缺氧小鼠作为氧化应激动物模型,分别注射三周nano-mitopbn(2.5mg/kg),三周之后处死小鼠并且收集动物血浆和各脏器。利用血浆检测小鼠血浆总抗氧化能力(taoc),脂质过氧化(mda)和蛋白羰基化水平(图5a),小鼠处死前麻醉后取尚有活性的肝脏组织,利用蔗糖梯度离心法分离尚有活性的线粒体组织,使用clark氧电极方法检测线粒体在加入succinicacid和adp底物之后的耗氧能力变化,反映线粒体的功能(图5b)。
实施例6.nano-mitopbn改善缺氧小鼠体内氧化应激及改善线粒体功能的作用
如图6所示,图6a为nano-mitopbn改善缺氧小鼠总抗氧化能力(taoc),脂质过氧化(mda)。图6b为nano-mitopbn改善缺氧小鼠线粒体呼吸能力(rcr)。(c:正常组s:stz干预组s+m:stz+mitopbn干预组,d:糖尿病组,d+v:糖尿病+空载体,d+m:糖尿病+mitopbn,*p<0.05,**p<0.01,***p<0.001)
实施例7.nano-mitopbn改善糖尿病小鼠肝脏代谢
如图7所示,在糖尿病小鼠中注射3周nano-mitopbn(2.5mg/kg),三周之后处死小鼠并且收集动物肝脏并匀浆制备成westernblot样品。利用特异性抗体检测动物肝脏组织中糖酵解和糖异生关键酶(pepck1,gk,pfkm,p-pfk2/pfk,pdha)的蛋白表达水平。图7a为糖异生关键酶pepck1的蛋白表达。图7b为磷酸戊糖途径中g6pd的活性。图7c为糖酵解关键酶gk,pfkm,p-pfk2/pfk,pdha的蛋白表达水平。检测其肝脏内氨基酸代谢和脂肪酸代谢(图7d)。结果显示mitopbn的干预导致了肝脏内氨基酸代谢和脂肪酸代谢的一些变化,同时mitopbn降低了糖尿病鼠异生和磷酸戊糖途径的异常上调,并上调了糖酵解途径。(western图右边的柱状图为对应条带的灰度分析。(c:正常组,d:糖尿病组,d+v:糖尿病+空载体,d+m:糖尿病+mitopbn,*p<0.05,**p<0.01,***p<0.001)
实施例8nano-mitopbn改善糖尿病小鼠血糖水平
如图8所示,在糖尿病小鼠中注射3周nano-mitopbn(2.5mg/kg),三周之后处死小鼠并且收集动物血浆检测其餐后血糖(图8a)和葡萄糖耐量(ipgtt,图8b)。同时利用透射电镜观察nano-mitopbn干预后糖尿病小鼠肝脏,心肌组织内的线粒体形态变化(图8c)。结果显示mitopbn缓解了糖尿病小鼠的血糖上升以及肝脏和心肌细胞的线粒体形态变化。(c:正常组d:糖尿病组,d+v:糖尿病+空载体,d+m:糖尿病+mitopbn,*p<0.05,**p<0.01,***p<0.001)
附图说明
图1是nano-mitopbn在l02细胞内的摄取图
图2是nano-mitopbn在动物各组织内的摄取图
图3是nano-mitopbn进入肝实质细胞的质谱图
图4是nano-mitopbn改善细胞氧化应激及保护线粒体功能图
图5是nano-mitopbn在改善糖尿病小鼠内氧化应激和线粒体功能图
图6是nano-mitopbn在改善缺氧小鼠内氧化应激和线粒体功能图
图7是nano-mitopbn在改善缺氧小鼠肝脏内葡萄糖代谢图
图8是nano-mitopbn在改善糖尿病小鼠血糖和肝脏形态和功能图。
- 还没有人留言评论。精彩留言会获得点赞!