包括强子治疗装置、MRI和强子射线照相系统的医疗设备的制作方法
发明领域
根据第一方面,本发明涉及一种包括带电强子治疗装置、磁共振成像装置和强子射线照相系统的医疗设备。根据第二方面,本发明涉及用于建立和/或检查治疗计划的方法。
现有技术的说明
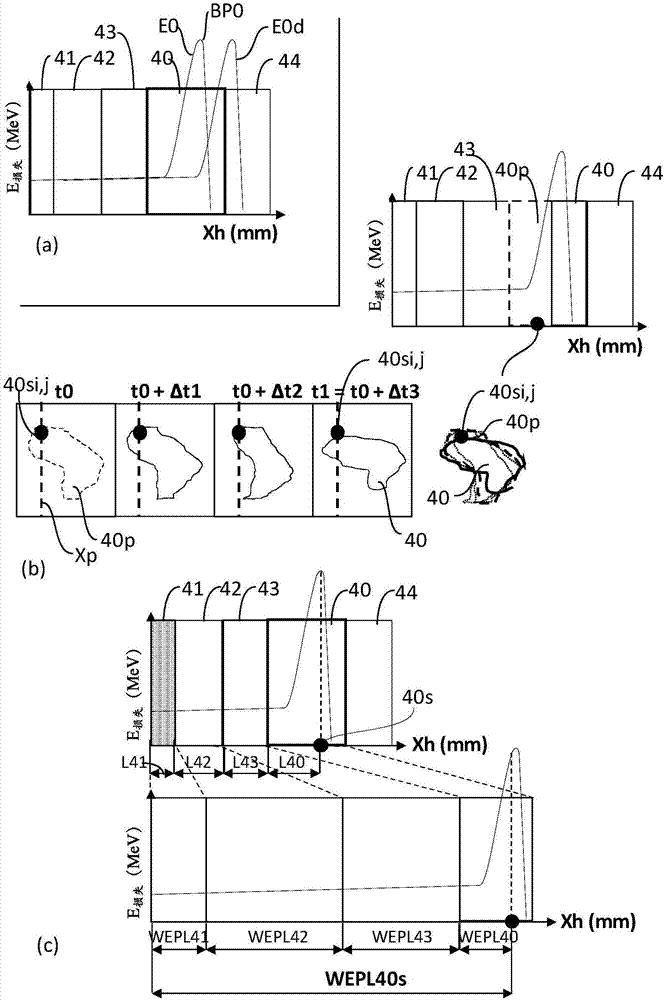
用于治疗患者的强子治疗(例如,质子治疗)已经知道了几十年,具有优于常规放射治疗的若干优点。这些优点是由于强子的物理性质产生的。常规放射治疗中的光子束根据由光子束横穿的组织的距离的递减指数曲线释放其能量。相比之下,并且如图2所示,强子射束首先在其穿透组织41-43时释放其能量的一小部分,形成平台,然后随着强子路径延长,整个能量在陡峭增大到峰值和射束的范围结束时降落之后在局部释放。所述峰值被称为布拉格峰值,并且对应于图2(c)中所展示的布拉格曲线的最大值。因此,强子射束可以在目标组织40内的精确位置递送高剂量的强子,从而保护了周围的健康组织41-44。如图2(a)所示,强子治疗的允许在精确位置递送高剂量强子的优点也是其弱点之一,因为如果强子射束的布拉格峰值的位置bp0相对于目标组织40偏移,则高剂量的强子可能被递送到相邻的健康组织43、44(比较图2(a)中能量损失e损失相对于强子射束在组织内行进并沿射束路径xp测量到的距离xh的曲线的实线e0和虚线e0d)。出于此原因,布拉格峰值相对于目标组织的位置的相对位置的确定对于对患者适当地实施强子治疗是至关重要的。
在实践中,强子治疗通常需要在任何治疗可以开始之前建立治疗计划。在该治疗计划中,通常进行患者和目标组织的计算机断层扫描(ct扫描)。针对患者的治疗,ct扫描仪用于表征待由治疗强子射束1h横穿的目标组织40和周围组织41-43。所述表征产生包括目标组织的体积的3d表示,并且治疗计划系统基于强子射束横穿的组织41-43的性质来确定所计算出的范围剂量。
该表征允许计算水等效路径长度(wepl),所述水等效路径长度用于确定将规定剂量的强子递送到目标点40s所需的治疗强子射束的初始能量ek,其中k=0或1,这取决于所述初始能量被确定时的阶段。图2(c)展示了通过横穿不同组织的强子射束行进的物理距离转换成到对应的wepl。通过给定组织行进给定距离的强子射束的wepl是强子射束将在水中行进的等效距离。如图2(c)所示,如果不同性质和厚度的健康组织41-43将目标组织与患者皮肤的外表面分开(通常情况就是如此),则将依次考虑到每个组织的水对应路径长度直到达到目标点来计算目标点的wepl。利用在水中行进的强子射束的等效路径长度的值,将布拉格峰值定位在目标点的wepl处所需的初始能量ek可以容易地计算出、并且对应于将布拉格峰值定位在目标组织内的目标点处所需的初始能量ek。
然后可以在包括一个或多个治疗会话的治疗阶段期间执行治疗计划,在所述一个或多个治疗会话期间将多个剂量的强子沉积到目标组织上。然而,强子射束相的布拉格峰值对于目标组织的目标点的位置具有许多不确定性,包括:
·一方面在强子治疗会话期间并且另一方面在建立治疗计划与强子治疗会话之间患者位置的变化;
·目标组织(参见图2(b))和/或相对于强子射束位于目标组织上游的健康组织41-43的大小和/或位置的变化。
·ct扫描仪的范围计算受限于ct图像的质量。另一限制与以下事实有关,即:ct扫描仪使用必须在强子衰减中转换的x射线的衰减,所述强子衰减是不明显的并且取决于所横穿组织的化学成分。
出于明显的原因,患者的位置、特别是目标组织的位置的不确定性至关重要。即使通过ct扫描仪进行精确表征,在治疗会话期间目标组织的实际位置仍然难以确定,原因如下:
(a)首先,在照射会话期间,目标组织的位置可能由于解剖过程如患者的呼吸、消化或心跳而改变。解剖过程还可能导致从强子射束的射束路径xp出现或消失气体或液体。
(b)其次,治疗计划通常在强制治疗会话开始之前数天或数周确定,并且患者的治疗可能需要分配到几个治疗会话的数周的时间。在此期间,患者可能会失去或增加体重,因此有时会明显改变组织(如脂肪和肌肉)的体积。
因此,目标组织的大小可能改变(例如,肿瘤可能已经生长、退化或改变位置或几何形状)。图2(b)示出了目标组织40在建立治疗计划的时刻t0与治疗会话的时刻t0+δt1、t0+δt2、t1=t0+δt3之间的大小和位置的演变的示例。治疗计划和最后治疗会话可能会隔开数天或数周。因此,在时刻t0建立的治疗计划可能包括在所述时刻t0属于目标组织40p的目标点40si,j(图2(b)中的黑点))的照射。由于目标组织40p在周期δt3期间可能已经移动或改变形状,所以目标点40si,j在治疗会话的时刻t0+δt3可能不再属于目标组织40并且反而位于健康的组织。因此,照射所述目标点将击中并可能伤害健康组织43而不是目标组织40。
在本领域中已经提出使用耦合到强子治疗装置的磁共振成像装置(mri)来标识目标组织的大小和/或位置的任何变化。例如,美国专利8427148描述了一种包括耦合到mri的强子治疗装置的系统。所述系统可以在强子治疗会话期间采集患者的图像,并且可以将这些图像与治疗计划的ct扫描仪图像进行比较。现在图1展示了使用耦合到mri的强子治疗装置的强子治疗会话的已知流程图的示例。建立了包括目标组织40s和周围组织41-43的表征的治疗计划。传统上,该步骤通过ct扫描仪分析来执行,并且允许确定目标组织的位置p0和形态、用于目标组织的强子治疗的强子射束的最佳轨迹或射束路径xp、以及遵循所述射束路径xp的强子射束所横穿的组织的大小和性质的特征,以确定所述目标组织的目标点的wepl40s。因此可以计算出将强子射束的布拉格峰值的相应位置bp0与目标组织的位置p0匹配所需的强子射束的初始能量ek。这完成了治疗计划的建立。
强子治疗会话在建立治疗计划之后。通过耦合到强子治疗装置的mri,可以捕获包括待由强子射束横穿的目标组织和周围组织的体积vp的磁共振(mr)图像。然后可以将mr图像与ct扫描仪图像进行比较,以评估在执行ct扫描仪的时刻(图2(b)中=t0)与强子治疗会话的时刻(图2(b)中t1=t0+δt3)之间所成像组织中是否可以检测到任何形态差异δ。如果可以检测到影响治疗会话的形态差异不大,则强子治疗会话按治疗计划中所计划的进行。另一方面,如果检测到可能影响目标组织相对于所计划强子射束及其相应布拉格峰值的相对位置的一些差异,则强子治疗会话被中断,并且必须建立新的治疗计划。本领域中提出的这种技术是非常有利的,因为它可以防止基于已经过时的治疗计划执行强子治疗会话,从而防止健康组织而不是目标组织被照射。
磁共振(mr)图像提供了由强子射束横穿的软组织的高对比度,但是迄今为止,还不适合使强子射束本身、更不用说布拉格峰值的位置可视化,因为:
·mri测量组织中氢原子的密度,但到目前为止,并没有产生关于强子停止功率比的任何可标识信息。从氢原子密度到强子停止功率比的转换受到与ct扫描仪中的x射线转换相似但尚不甚了解的不确定性。
·由于ct扫描仪和mri中使用的技术不同,来自ct扫描仪的图像与来自mri的图像之间的比较并不明显并且可能存在不确定性。
总之,虽然在强子治疗中,准确地确定布拉格峰值相对于目标组织的部分的位置是至关重要的,因为该位置的错误可能导致照射健康组织的不是照射目标组织,但是到目前为止,仍没有确定布拉格峰值和目标组织的相对位置的令人满意的解决方案。本领域中提出的结合有强子治疗装置和mri的设备允许在治疗会话期间在体采集图像,从而给出了与目标组织的实际位置相关的信息。然而,所述图像不足以确保强子射束的布拉格峰值的位置及其相对于目标组织所处在的位置的确切确定。因此,仍然需要与mri组合的强子治疗装置,以允许更好地相对于目标组织的位置确定布拉格峰值的位置。
技术实现要素:
所附的独立权利要求中限定了本发明。从属权利要求中限定了优选实施例。
根据第一方面,本发明涉及一种医疗设备,所述医疗设备包括:
(a)强子治疗装置,所述强子治疗装置包括强子源,所述强子源被适配用于沿着射束路径引导具有初始成像射束能量e0p的成像强子射束,所述射束路径穿过并且超过:
·感兴趣对象,包括多个组织m并且在上游边界与下游边界之间被所述射束路径穿过,以及
·目标点,所述目标点在所述上游边界与所述下游边界之间被定位在所述感兴趣对象的目标组织内;
(b)磁共振成像装置(mri),用于在成像体积vp内采集磁共振(mr)数据,所述成像体积包括所述感兴趣对象的包含所述目标点的一部分以及至少所述射束路径的包括在所述上游边界和所述目标点之间的部分;
(c)强子射线照相系统(hrs),被适配用于采集由所述成像强子射束生成的信号;以及
(d)控制器,被配置用于确定在所述上游边界和所述下游边界之间所述射束路径的水等效路径长度wepl,hrs,所述确定至少基于利用所述hrs采集的所述信号。
所述控制器可以被进一步配置用于计算由包括在所述上游边界与所述下游边界之间的所述射束路径所穿过的具有厚度lm的所述多个组织m的所述水等效路径长度weplm,所述计算基于所述mr数据和所述wepl,hrs。
优选地,所述控制器被配置用于在治疗会话期间的时刻t1执行对包括在所述上游边界和所述目标点(40s)之间的射束路径的水等效路径长度wepl40s,0的计划值的验证,其中所述wepl40s,0的所述计划值先前已经在治疗会话期间在时刻t0被确定。所述验证可以包括:
·包括在所述上游边界和所述目标点之间的射束路径的水等效路径长度wepl40s,1的实际值的计算,所述计算基于定位在所述目标组织上游并包含所述目标组织的所述多个组织的所述weplm;
·将所述wepl40s,1的实际值与所述wepl40s,0的计划值进行比较;
·如果wepl40s,0-δ≤wepl40s,1≤wepl40s,0+δ,其中δ=10mm,优选δ=5mm,更优选δ=3mm,则应用所述治疗计划;
·如果wepl40s,1≥wepl40s,0+δ或wepl40s,1≤wepl40s,0-δ,其中δ=10mm,优选δ=5mm,更优选δ=3mm,则采取另外的动作。
优选地,所述另外的动作包括将:
·先前在治疗计划期间并且基于所述wepl40s,0的所述计划值计算出的治疗强子射束的计划初始能量e0,所述计划初始能量e0在与由所述治疗计划限定的所述目标点的位置相对应的计划位置bp0处产生布拉格峰值;校正至
·在所述验证期间并且基于所述wepl40s,1的所述实际值计算出的治疗强子射束的经校正的初始能量e1,所述经校正的初始能量e1在与所述目标点的实际位置相对应的治疗位置bp1处产生所述布拉格峰值。
所述控制器还可以被配置用于通过以下方式建立治疗计划:
·计算所述目标点的wepl40s,0的初步值,所述计算基于所述weplm;以及
·计算治疗强子射束的计划初始能量e0,所述计算基于所述wepl40s,0的值,并且在所述治疗计划的建立期间在与由所述目标点的位置相对应的计划位置bp0处产生所述布拉格峰值。
根据本发明的医疗设备的强子射线照相系统可以包括以下检测器中的一者或多者:测程望远镜;热量计;或光谱仪。
在优选的实施例中,根据本发明的医疗设备进一步包括瞬发伽马检测器和pet扫描仪中的至少一者。
在优选的实施例中,根据本发明的医疗设备进一步包括用于支撑处于非仰卧姿势的患者的支撑件。
根据第二方面,本发明涉及一种用于对治疗强子射束的计划初始能量e0进行验证的方法,所述计划初始能量在治疗计划期间计算出以便照射感兴趣对象内的目标点,所述感兴趣对象包括多个组织m。该方法包括以下步骤:
(a)对包括所述目标点的成像体积vp执行磁共振(mr)成像,并且采集mr数据;
(b)沿射束路径发射具有初始成像射束能量e0p的成像强子射束,所述射束路径穿过并且超过:
·沿着所述射束路径在上游边界与下游边界之间延伸的所述感兴趣对象,以及
·所述目标点;
(c)用强子射线照相系统(hrs)检测由所述成像强子射束生成的信号;
(d)根据所述信号确定在上游边界与下游边界之间所述射束路径的水等效路径长度wepl,hrs;
(e)计算由包括在所述上游边界与所述下游边界之间的所述射束路径穿过的具有厚度lm的组织m的weplm,所述计算基于所述mr数据和所述wepl,hrs;
(f)计算包括在所述上游边界和所述目标点之间的所述射束路径的所述wepl40s,1的实际值的值,所述计算基于定位在所述目标点上游并包含所述目标点的所述组织的所述weplm;
(g)将所述wepl40s,1的实际值与在所述治疗计划的建立期间所确定的wepl40s,0的初步值进行比较;
(h)如果wepl40s,0-tol≤wepl40s,1≤wepl40s,0+tol,其中tol=10mm,优选tol=5mm,更优选tol=3mm,则对所述计划初始能量e0进行验证;
(i)如果wepl40s,1≥wepl40s,0+tol或wepl40s,1≤wepl40s,0-tol,其中tol=10mm,优选tol=5mm,更优选tol=3mm,则采取另外的动作。
优选地,所述另外的动作包括将所述计划初始能量e0的值修改至在所述验证期间并且基于所述wepl40s,1计算出的治疗强子射束的经校正的初始能量e1,所述经校正的初始能量e1在与所述目标点的实际位置相对应的治疗位置bp1处产生所述布拉格峰值。
所述治疗计划的所述验证可以在时刻t0+δti进行、并且在其之前可以是在时刻t0建立所述治疗计划。所述治疗计划的建立包括以下步骤:
(a)运行ct扫描仪和/或磁共振成像以产生所述感兴趣对象的包含包括在上游边界与目标点之间的预测射束路径的部分内的所述组织的初步表征、以及包括在所述上游边界与所述目标点之间的所述射束路径的初步wepl40s,0的标识;以及
(b)计算相对于所述初步表征所优化的剂量递送方案,包括计算治疗强子射束的计划初始能量e0的,所述计算基于所述wepl40s,0的值,并且在所述治疗计划的建立期间在与由所述目标点的位置相对应的计划位置bp0处产生所述布拉格峰值。
优选地,所述建立用于照射感兴趣对象内的目标点的治疗强子射束的治疗计划的方法包括以下步骤:
(a)对包括目标点的成像体积vp执行磁共振(mr)成像,以便采集mr数据;
(b)沿射束路径发射具有初始成像射束能量e0p的成像强子射束,所述射束路径穿过并且超过:
·沿着所述射束路径在上游边界与下游边界之间延伸的所述感兴趣对象,以及
·所述目标点;
(c)用强子射线照相系统(hrs)检测由所述成像强子射束生成的信号;
(d)根据所述信号确定在上游边界与下游边界之间所述射束路径的水等效路径长度wepl,hrs;
(e)计算由包括在所述上游边界与所述下游边界之间的所述射束路径穿过的具有厚度lm的组织m的weplm,所述计算基于所述mr数据和所述wepl,hrs;
(f)计算包括在所述上游边界和所述目标点之间的所述射束路径的所述wepl40s,0的值,所述计算基于定位在所述目标点上游并包含所述目标点的所述组织的weplm;
(g)计算剂量递送方案,包括计算治疗强子射束的计划初始能量e0,所述计算基于所述wepl40s,0的值,并且在所述治疗计划的建立期间在与由所述目标点的位置相对应的计划位置bp0处产生所述布拉格峰值。
优选地,所述建立治疗计划的方法进一步包括所述感兴趣对象的包含包括在上游边界与下游边界之间的所述射束路径的部分内由所述射束路径穿过的所述组织的初步表征。所述表征可以至少基于所述mr数据。
优选地,所述治疗计划的所述验证根据本发明的方法在时刻t1进行、并且在其之前是根据本发明的方法在时刻t0建立所述治疗计划。
优选地,在同一室内进行执行磁共振(mr)成像和发射成像强子射束的步骤。
优选地,根据本发明的方法进一步包括提供根据本发明的医疗设备的步骤。
附图简要说明
将通过示例并参照附图更详细地解释本发明的这些和另外的方面,在附图中:
图1示出了使用耦合到mri的强子治疗装置的现有技术的强子治疗方法的流程图;
图2示意性地示出了(a)横穿组织的强子射束的布拉格峰值的位置,(b)目标组织的形态和位置随时间的变化可以在治疗计划和实际需要的治疗之间产生差异,和(c)实际路径长度和水等效路径长度之间的关系。
图3示意性地示出了包括耦合到mri的强子治疗装置的医疗设备的两个实施例;
图4示意性地展示了目标组织的强子笔形射束治疗;
图5示意性地示出了mri中的成像层面vpi的选择以及相位梯度和频率梯度的创建;
图6示出了根据本发明的设备的两个示例,示出了强子射束对目标组织的访问;
图7示出了根据本发明的医疗设备的示例,所述医疗设备包括强子治疗装置、mri装置、以及强子射线照相系统。
图8示意性地展示了用于强子射线照相系统的检测器的示例;
图9示意性地展示了根据本发明的强子射束的能量的计算;
图10和图11示出了根据本发明的使用医疗设备的强子治疗方法的流程图;
图12示出了根据本发明的医疗设备的实施例,并且所述医疗设备包括强子治疗装置、mri装置、强子射线照相系统、以及瞬发伽马检测器或pet扫描仪。
图13示出了根据本发明的医疗设备的实施例,并且所述医疗设备包括强子治疗装置、mri装置、强子射线照相系统、以及用于支撑处于非仰卧姿势的患者的支撑件。
这些附图未按比例绘制。总体上,相同的部件在附图中用相同的附图标记表示。
优选实施方式的详细说明
强子治疗是使用能量强子的射束1h的外部射束放射治疗的一种形式。图3、图4和图6示出了针对感兴趣对象的目标组织40中的目标点40s的强子射束1h。感兴趣对象的目标组织40通常包括形成肿瘤的癌细胞。在强子治疗会话中,具有初始能量ek(k=0或1)的强子射束照射目标组织(如肿瘤)内的一个或多个目标点,并且破坏被照射的目标点中包含的癌细胞,从而通过被照射组织的坏死减小所治疗肿瘤的尺寸。
感兴趣对象可以包括多种材料,包括有机材料。优选地,感兴趣对象包括多个组织m,如图2所示,m=40-44,所述组织可以是例如:皮肤、脂肪、肌肉、骨骼、空气、水(血液)、器官和肿瘤。目标组织40优选为肿瘤。
如现有技术文献中所述,沿着射束路径xp横穿有机体的强子射束1h沿着射束路径xp在特定穿透距离处损失其大部分能量。如图2和图4所示,当绘制作为沿着射束路径xp测量到的距离xh的函数的强子射束的每单位距离[mevg-1cm-2]的能量损失e损失时,所述特定穿透距离对应于所谓的布拉格峰值的位置。与其他形式的放射治疗不同,强子射束可以因此在目标组织内与布拉格峰值的位置相对应的非常特定的位置处递送高剂量的能量。布拉格峰值的位置主要取决于强子射束的初始能量ek(即,在横穿任何组织之前)以及所横穿的组织的性质和厚度。递送到目标点的强子剂量取决于强子射束的强度和暴露时间。强子剂量以戈瑞(gy)为单位进行测量,并且在治疗会话期间递送的剂量通常约为一至几个戈瑞(gy)。
强子是由强核力保持在一起的夸克组成的复合粒子。强子的典型示例包括质子、中子、离子和重离子,如碳离子。在强子治疗中,一般使用带电强子。优选地,强子是质子,并且相应的强子治疗被称为质子治疗。在下文中,除非另有说明,否则对质子束或质子治疗的任何引用总体上适用于强子射束或强子治疗。
强子治疗装置1总体上包括强子源10、射束传输线11、以及射束递送系统12。带电强子可以从注射系统10i中产生,并且可以在粒子加速器10a中加速来积聚能量。合适的加速器包括例如回旋加速器、同步回旋加速器、同步加速器、或激光加速器。例如,(同步)回旋加速器可以使带电强子粒子沿着向外的螺旋路径从(同步)回旋加速器的中心区域加速,直到它们达到期望的输出能量ec,它们由此处从(同步)回旋加速器提取出。当从(同步)回旋加速器提取出时,由强子射束达到的所述输出能量ec典型地包括在60至400mev之间,优选在210至250mev之间。输出能量ec不一定是在治疗会话期间所使用的强子射束的初始能量ek;ek等于或低于ec,ek≤ec。合适的强子治疗装置的示例包括但不限于在美国专利申请号4870287中描述的装置,所述申请的全部公开内容通过引用并入本文作为本发明中所使用的强子射束治疗装置的代表。
从(同步)回旋加速器提取的强子射束的能量可以通过沿着沿着射流径向xp定位在(同步)回旋加速器下游的能量选择装置10e(如降能器)来减小,所述能量选择装置可以将输出能量ec降低到任何ek值,包括下降到接近0mev。如上所述,沿着横穿特定组织的强子射束路径xp,布拉格峰值的位置取决于强子射束的初始能量ek。通过选择与位于目标组织内的目标点40s相交的强子射束的初始能量ek,可以控制布拉格峰值的位置以对应于目标点的位置。
强子射束还可以用于表征组织的特性。例如,可以用强子射线照相系统(hrs,特别是质子射线照相系统prs)获得图像。然而,用于表征目的递送到目标点的强子的剂量可能比在强子治疗会话期间递送的剂量(如上文所讨论的,其约为1至10gy)低得多。用于表征目的hrs的所递送强子的剂量典型地在10-3至10-1gy的数量级(比通常针对治疗性治疗递送的剂量低1至4个数量级)。这些剂量对目标点没有显著的治疗性效果。可替代地,递送到目标组织中的一小组目标点的治疗强子射束可以用于表征目的。用于表征目的所递送的总剂量不足以治疗目标组织。
如图3所示,在强子源的下游,具有初始能量ek的强子射束通过射束传输线11被引导到射束递送系统12。射束传输线可以包括一个或多个真空管道11v、用于控制强子射束方向和/或用于聚焦强子射束的多个磁体。射束传输线还可以被适配用于将强子射束从单个强子源10分配和/或选择性地引导到用于并行治疗若干患者的多个射束递送系统。
射束递送系统12包括用于沿着射束路径xp对强子射束1h进行定向的喷嘴12n。喷嘴可以是固定的或移动的。移动喷嘴一般被安装在台架12g上,如图4和图6示意性展示的。台架用于围绕以等中心为中心并垂直于一般为水平的轴线z的圆改变强子出口的方向。在仰卧式强子治疗装置中,水平轴线z可以选择成平行于躺在沙发上的患者(即,患者的头部和脚部沿着水平轴线z对齐)。喷嘴12n和等中心限定了路径轴线xn,角度取向取决于台架中喷嘴的角位置。通过邻近喷嘴定位的磁体,在以路径轴线为中心并且以喷嘴作为顶点的锥体内,强子射束1h的射束路径xp可以相对于路径轴线xn偏离(参见图4(a))。这是有利的,因为以等中心为中心的目标组织的体积可以由强子射束来处理,而无需改变台架内喷嘴的位置。同样适用于固定喷嘴,不同之处在于路径轴线的角位置是固定的。
在提供有台架的装置中待由强子射束治疗的目标组织必须被定位在等中心附近。为此目的,可以移动用于患者的沙发或任何其他支撑件;所述沙发或任何其他支撑件典型地可以在水平平面(x,z)上平移(其中x是垂直于水平轴线z的水平轴线),并且在垂直于x和z的竖直轴线y上平移,并且还可以绕任何的这些x、y、z旋转,使得目标组织的中央区域可以被定位在等中心处。
为了根据先前建立的治疗方案帮助患者相对于喷嘴12n的正确定位,射束递送系统可以包括成像装置。例如,可以使用常规x射线射线照相系统来对包括目标组织40的成像体积vp进行成像。如此获得的图像可以与在建立治疗计划期间先前收集到的对应图像进行比较。
取决于预先建立的治疗计划,强子治疗可以包括以各种形式将强子射束递送到目标组织,包括本领域公知的以下技术:笔形射束、单散射、双重散射、以及均匀散射。本发明可以应用于所有强子治疗技术。然而,强子治疗优选地通过笔形射束技术来应用。图4示意性地展示了这种递送技术。在预先建立的递送时间内,具有初始能量ek,1的强子射束被引导到第一目标点40s1,1。然后,在预先建立的递送时间内,强子射束被移动到第二个目标点40s1,2。对一系列目标点40s1,j重复所述过程,以按照预先建立的扫描路径扫描第一等能量治疗体积vt1。用具有初始能量ek,2的强子射束按照相似的扫描路径逐点扫描第二等能量治疗体积vt2。因此,因此按照类似扫描路径照射处理给定目标组织40所必需的许多等能量治疗体积vti。扫描路径可以包括通过同一扫描点40si,j的若干个通道。等能量治疗量vti是可用具有初始能量ek,i的强子射束治疗的目标组织的体积。等能量治疗体积vti是层面形状的,其厚度近似对应于相应强子射束的初始能量ek,i的值处的布拉格峰值的幅度,并且仅受限于以路径轴线xn为中心的锥体的开口角的主区域表面包围可在台架中的喷嘴或固定喷嘴装置的给定位置可用的射束路径xp。在均质目标组织的情况下,主表面基本上是平面的,如图4(b)所示。然而,实际上,由于目标组织40和上游组织41-43在性质和厚度上都不是均质的,所以等能量体积vti的主表面是崎岖不平的。图4(b)中的蛋形体积示意性地展示了通过将一个目标点40si,j暴露于具有初始能量ek,i的射束而接收某一治疗性剂量的强子的目标组织的体积。
图4(c)中展示了递送到目标组织40的剂量d。如上所述,在治疗会话期间递送的剂量通常约为一至几个戈瑞(gy)。这取决于递送到每个等能量治疗体积vti的每个目标点40si,j的剂量。递送到每个目标点40si,j的剂量取决于强子射束的强度i和所述目标点上的照射时间tij。因此,递送到目标点40si,j的剂量dij是在照射时间tij上的积分dij=∫idt。递送到目标点40si,j的典型剂量dij约为0.1-20cgy。递送到等能量治疗体积vti的剂量di是针对所述等量能量治疗体积中扫描的n个目标点的递送到每个目标点的剂量dij的总和,di=∑dij,j=1至n。因此,递送到目标组织40的总剂量d是针对p个被照射等能量治疗体积vti递送到每个能量治疗体积的剂量di的总和,d=∑di,i=1至p。因此,可以通过控制强子射束的强度i、每个目标点40si,j的总照射时间tij、被照射目标点40si,j的数量中的一者或多者来在宽泛的值范围内控制递送到目标组织的强子剂量d。一旦患者被定位成使得待治疗的目标组织40位于等中心的近似位置,则强子治疗会话的持续时间主要取决于以下各项的值:
·每个目标点40si,j的照射时间tij,
·扫描时间δti,用于将强子射束从目标点40si,j引导到相同等能量治疗体积vti的相邻目标点40si(j+1),
·在每个等能量治疗体积vti中扫描的目标点40si,j的数量n,
·将从等能量治疗体积vti中扫描到的最后目标点40si,n传递到下一个等能量治疗体积vt(i+1)的第一目标点40s(i+1),1所需的时间δtvi,以及
·其中包围了目标组织40的等能量治疗量vti的数量。
目标点40si,j的照射时间tij约为1-20ms。在同一等能量治疗体积中的相继目标点之间的扫描时间δti一般非常短,约为1ms。从一个等能量治疗体积vti传递到后续的等能量治疗体积vt(i+1)所需的时间δtvi稍长,因为这需要改变强子射束的初始能量ek并且约为1-2s。
如图2(a)和(b)所示,强子射束的初始能量ek的精确确定明显是关键的,因为如果由此确定的布拉格峰值的位置不对应于目标组织40的实际位置,则大剂量的强子可能被递送到健康的、有时是重要的器官,并且可能危及患者的健康。布拉格峰值的位置主要取决于强子射束的初始能量ek以及所横穿的组织的性质和厚度。因此,除了确定目标组织在患者体内的确切位置之外,产生与目标组织的精确位置相对应的布拉格峰值的位置的强子射束的初始能量ek的计算还需要所横穿的组织的初步表征,直到到达目标组织40。这种表征是在实际强子治疗之前(一般几天前)建立的治疗计划期间执行的。实际强子治疗可以划分为分布在若干个星期的若干个会话。典型的治疗计划可以通过用用ct扫描仪采集数据开始,所述数据一般呈感兴趣对象的图像的形式。可以通过执行以下步骤中的一个或多个来表征由ct扫描仪所采集的图像:
·基于每个组织的灰色阴影与已知灰度等级的比较,标识在图像上表示的作为组织的x射线吸收能力的函数的组织的性质;例如,组织可以是脂肪、骨骼、肌肉、水、空气之一;
·从皮肤到目标组织沿着一个或多个强子射束路径xp测量每个组织的位置和厚度;
·根据组织各自的性质,把相应的强子停止功率比(hspr)赋予每个所标识组织;
·基于组织各自的hspr和厚度,计算目标组织上游的且包括目标组织的每个组织m的组织水等效路径长度weplm,其中m=40至44;
·将由此确定的所有组织m的weplm相加以产生位于目标组织40中的目标点40s的wepl40s,所述wepl40s对应于强子射束从皮肤行进到目标点40s的距离;
·根据wepl40s,计算将布拉格峰值定位在目标点40s处所需的强子射束的初始能量ek。
可以针对限定所述目标组织的若干个目标点重复所述过程步骤。
磁共振成像装置
磁共振成像装置2(mri)基于存在于感兴趣对象的有机组织中的可激发原子与电磁场的相互作用来实现医学成像技术。当被放置在强的主磁场b0中时,所述可激发原子的核的围绕与主磁场b0对齐的轴线的自旋导致平行于主磁场b0的静态净极化。在所述主磁场b0中在可激发原子的共振频率fl(称为拉莫尔频率(larmorfrequency))下射频(rf)激发磁场b1的脉冲的应用通过使净极化向量侧向倾斜(例如,所谓的90°脉冲,b1-90)或倾斜到大于90°的角度并且甚至使所述净极化向量以180°反转(即所谓的180°脉冲,b1-180)来激发所述原子。当rf电磁脉冲关闭时,可激发原子的核的自旋逐渐返回到平衡状态,产生静态净极化。在松弛期间,自旋的横向向量分量产生诱导信号的振荡磁场,所述信号可以被紧邻在检查中的解剖结构定位的天线2a收集。
如图5和图6所示,mri2通常包括用于产生均匀主磁场b0的主磁体单元2m;用于产生rf-激发磁场b1的射频(rf)激发线圈2e;用于分别沿着第一、第二和第三方向x1、x2和x3产生磁梯度的x1-、x2-、和x3-梯度线圈2s、2p、2f;以及用于当所激发原子从其激发状态松弛回到其静止状态时接收由所激发原子发射的rf信号的天线2a。主磁体产生主磁场b0,并且可以是永磁体或电磁体(超导磁体或非超导磁体)。合适的mri的示例包括但不限于在欧洲专利号0186238中描述的装置,所述申请的全部公开内容通过引用并入本文。
如图5所示,可以通过沿着第一方向x1产生磁场梯度来选择与第一方向x1垂直的厚度为δxi的成像层面或层vpi。在图5中,第一方向x1平行于由患者的躺卧姿势限定的轴线z,产生与所述轴线z垂直的层面。实际上,这不一定是这种情况,并且第一方向x1可以是任何方向,例如横向于轴线z,使层面以相对于患者的某一角度延伸。如图5(a)所示,由于可激发原子的拉莫尔频率fl取决于其所暴露于的磁场的幅值,在频率范围[fl]i内发送rf激发磁场b1的脉冲仅激发暴露于磁场范围[b0]i的可激发原子,所述可激发原子被定位在厚度为δxi的层面或层vpi中。通过改变rf激发磁场b1的脉冲的频率带宽[fl]i,可以控制成像层vpi的宽度、δxi、以及位置。通过在连续成像层vpi上重复该操作,可以对成像体积vp进行表征和成像。
为了将由天线所接收的信号的空间原点定位在与第一方向x1垂直的平面上,通过激活x2-和x3-梯度线圈2p、2f,沿着第二方向x2和第三方向x3连续产生磁梯度,其中x1⊥x2⊥x3,如图5(b)所示。所述梯度在所激发核的自旋中在其松弛时引起相位梯度
主磁场b0一般包括在0.2t和7t之间,优选地在1t和4t之间。射频(rf)激发线圈2e产生在围绕包括在厚度为δxi的层面内并暴露于主磁场范围[b0i]的原子的拉莫尔频率fl的频率范围[fl]i内的磁场。对于氢原子,每磁场强度单位的拉莫尔频率fl/b=42.6mhzt-1。例如,对于暴露于主磁场b0=2t的氢原子,拉莫尔频率fl=85.2mhz。
mri可以是闭孔、开孔或宽孔mri中的任何一种。典型的闭孔mri具有1.0t至3.0t的磁场强度,其直径约为60cm。如图6所示,开孔mri典型地具有两个主磁极2m,所述两个主磁极由它们之间的间隙分开以便容纳处于躺卧姿势、坐姿或适于对成像体积vp进行成像的任何其他姿势的患者。开孔mri的磁场通常包括在0.2t和1.0t之间。宽孔mri是一种具有较大直径的闭孔mri。
强子治疗装置+mri
如参考图2(b)的引言所讨论的,目标组织40的位置和形态可以在建立治疗计划的时刻t0与治疗会话的时刻t1=t0+δt3之间演化,所述治疗会话可以分隔几天或几周。在治疗计划中标识为属于目标组织40p的目标点40si,j可能在治疗会话时刻间t0+δt3不再属于目标组织40。照射所述目标点可能伤害健康组织43而不是目标组织40。
为了避免这种事件,现有技术提出了将强子治疗装置(pt)1耦合到诸如磁共振成像装置(mri)2的成像装置。这种耦合可能不是微不足道的,需要克服许多挑战,但是pt-mri设备已被描述在最近的技术中、并且是本领域普通技术人员所公知的。例如,诸如在mri的强磁场b0内校正强子射束路径xp的问题的解决方案是可用的。
pt-mri设备允许在治疗会话的日期t0+δt3将目标组织和周围组织的形态和位置可视化,以便与在时刻t0治疗计划建立期间采集的相应形态和位置进行比较。如图1的流程图所示,在时刻t0建立治疗计划与在时刻t0+δt3治疗会话之间的组织形态和位置的差异被观察到的情况下,治疗会话将被中断并且新的治疗计划可能被建立,其中新目标点的定义对应于待由具有经校正的能量和方向的强子射束照射的实际目标组织40(参见图1,菱形框“
本发明旨在于在检测到目标组织的形态或位置变化的情况下通过提供在体校正初始能量ek和射束路径xp、强子射束的方向所需的信息来进一步提高pt-mri设备的功效。不管在目标组织40中检测到任何变化,这都将允许治疗会话进行。
所使用的mri可以是上述闭孔、开孔或宽孔mri中的任何一种。开放式mri在分离两个主磁极2m的间隙中提供了大量的开放空间,以便在几乎任何方向上定向强子射束。可替代地,如图6(a)所示,可以在主磁体单元上提供对强子透明的开口或窗口2w。这种配置具有强子射束可以平行于b0的特殊性。在另一实施例中,强子射束可以被定向穿过由闭孔mri形成的隧道的空腔,或者对强子透明的环形窗可以在所述隧道的壁上与基本上垂直于轴线z的台架平行地延伸,使得强子射束可以以不同的角度达到目标组织。在使用固定喷嘴的情况下,可以相应地减小这种开口或窗口的尺寸。
强子射线照相系统
图7展示了医疗设备的示例,所述医疗设备包括强子治疗装置1、磁共振成像装置(mri)2、强子射线照相系统(hrs)3、以及控制器5。
hrs包括检测器3d,所述检测器被配置用于检测由成像强子射束1hp生成的信号。所述成像强子射束具有通常高于治疗目标组织40的治疗强子射束所使用的能量的初始成像射束能量e0p。初始成像射束能量e0p必须足够高以穿过并超过感受兴趣对象。例如,初始成像射束能量e0p可以高于每个核100mev,优选高于每个核120mev,更优选高于每个核150mev。所述成像强子射束的强度低于治疗强子射束的强度。可以朝向位于目标组织40内的一个或多个目标点40si,j引导所述成像强子射束。成像强子射束传递到(多个)目标点的总剂量可以低于10-3至10-1gy,优选地,总剂量低于10-2gy。成像强子射束1hp遵循来自射束递送系统的喷嘴12n的射束路径。所述成像强子射束的射束路径至少穿过:
(a)感兴趣对象的上游边界41u,例如患者的皮肤;
(b)感兴趣对象内部的目标组织40内的目标点40s;以及
(c)感兴趣对象的下游边界41d,例如患者的皮肤。
术语“上游”和“下游”是相对于强子射束的方向定义的。
穿过物质的强子射束沿其射束路径损失其能量的一部分。所述损失是由于强子与所横穿的组织m的电子的相互作用(库仑相互作用)以及与所横穿的组织的原子核的相互作用(库仑相互作用或弹性碰撞),其中m=41-43。所述损失与所横穿的组织m的厚度lm成比例,并且取决于组织m的性质。特别地,所述损失取决于强子射束所横穿的组织m的密度。在强子治疗中,强子射束横穿的组织是例如皮肤、脂肪,肌肉、骨骼、空气、水(血液)、器官、以及肿瘤。(成像)强子射束的总衰减等于每个组织中的衰减的总和。在上游边界之前和下游边界之后的空气中的衰减通常可忽略不计。
hrs的检测器3d测量剩余能量,或者等效地测量成像强子射束的剩余射程。剩余能量是穿过感兴趣对象之后的强子射束的剩余能量。剩余射程是强子射束在布拉格峰值之前可以穿过的水中距离。
知道初始射束能量e0p和检测器中的剩余能量,控制器5可以计算在感兴趣对象的包括在上游边界与下游边界之间的部分内强子射束所损失的能量。根据所损失的能量,所述控制器可以计算布拉格曲线,如图2(c)所示。能量损失对应于感兴趣对象是包括在上游边界与下游边界之间的一部分的水等效路径长度wepl,hrs。
hrs的检测器3d可以是以下检测器之一:测程望远镜3t;热量计3c或光谱仪3s。检测器被定位成相对于等中心与喷嘴相对,并且被成像强子射束的射束路径穿过。检测器可以被定位在mri的内部或外部。检测器可以安装在强子递送系统的台架上,或安装在专用台架上。可替代地,检测器的位置可以是固定的。
测程望远镜是允许测量遵循限定轨迹的粒子的射程的检测器。测程望远镜设计包括闪烁器堆叠和多层电离室。图8(a)展示了包括多层电离室32t的测程望远镜。强子射束1h通过孔口31t进入检测器,成像强子射束的能量然后在每个电离室中进行测量,从而给出测量点33t。这些测量点用于计算作为检测器中的距离(其可以是水等效距离或不是水等效距离)的函数的能量损失的曲线34t。
热量计是通过使粒子在装置内完全释放其能量并测量该能量的量来测量粒子的能量的检测器。图8(b)示出了热量计3c的示例,所述热量计包括吸收成像强子射束的剩余能量的吸收材料31c和可测量由吸收材料吸收的能量(例如通过测量吸收材料的温度上升)的测量装置32c。检测器可以是分段的,以获得关于取向的信息。
光谱仪是测量成像强子的能量分布的检测器。检测器测量每个能量范围内的粒子数。图8(c)展示了光谱仪3s的示例。光谱仪必须包括色散元件。例如,光学光谱仪的色散元件可以是棱镜。带电强子光谱仪的分散元件可以是mri的主磁场b0。在带电强子射束与b0垂直(或至少不平行)的情况下,根据洛伦兹定律,所述带电强子射束偏离。偏离与强子射束的速度(或相当于能量)成比例。例如,对于较低的能量,偏离较大。成像强子射束在其穿过感兴趣对象内的组织时损失能量,从而导致较大的偏离。通过测量从参考点(例如,路径轴线xn与光谱仪的检测板31s的交点)到检测板31s与成像强子射束相交的点的距离xs,控制器可以计算成像强子射束的(剩余)能量。距离xs取决于强子射束的(剩余)能量,并且允许计算强子射束所横穿的组织的wepl。实际上,在迭代过程之后计算剩余能量。水等效路径长度wepl,hrs是根据mr数据估计出的,并且强子射束的偏离被模拟。然后,将光谱仪的检测器上的所模拟强子射束的位置与所测量的实际位置进行比较。然后校正wepl,hrs,并且再次模拟所述强子射束,直到所模拟位置等于所测量位置从而产生正确的wepl,hrs为止。
根据本发明的医疗设备包括:
(a)强子治疗装置,所述强子治疗装置包括强子源10,所述强子源被适配用于沿着射束路径引导具有初始成像射束能量e0p的成像强子射束1hp,所述射束路径穿过并且超过:
·感兴趣对象,所述感兴趣对象在上游边界与下游边界之间被所述射束路径穿过,以及
·目标点40s,所述目标点在所述上游边界与所述下游边界之间被定位在所述感兴趣对象的目标组织内;
(b)mri,用于在成像体积vp内采集磁共振(mr)数据,所述成像体积包括所述感兴趣对象的包含所述目标点的一部分以及至少所述射束路径的包括在所述上游边界和所述目标点之间的部分;
(c)hrs,被适配用于采集由所述成像强子射束生成的信号;以及
(d)控制器5,所述控制器被配置用于确定在上游边界与下游边界之间所述射束路径的水等效路径长度wepl,hrs,所述确定至少基于利用所述hrs采集的所述信号。
目标组织40的位置和形态可以在建立治疗计划的时刻t0与治疗会话的时刻t0+δt3之间演化。pt-mri设备允许在治疗会话的日期t0+δt3将目标组织和周围组织的形态和位置可视化,以便与在时刻t0治疗计划建立期间采集的相应形态和位置进行比较。来自mri的图像不允许准确地确定wepl和/或hspr,并且因此,在治疗会话期间无法适配所述治疗计划。hrs允许测量成像强子射束的wepl,并且根据所述wepl在治疗会话期间校正和适配治疗计划。因此,根据本发明的强子治疗装置允许在治疗会话期间检测到目标组织的形态或位置的变化的情况下校正强子射束的能量和方向。所述强子治疗装置因此降低了导致新癌症形成的照射健康组织或未击中目标组织的风险。所述强子治疗装置还在允许适配目标点处递送的剂量方面提高了治疗效率。
优选地,由mri提供的mr数据和由hrs提供的强子射束生成的信号是同时或以短的延迟采集的。这两个测量结果因此不是组织的相同配置。
有利的是,mr图像的计划包括(成像)强子射束的射束路径。mr图像可以用于(帮助)确定由强子射束横穿的组织m的性质,并且确定由强子射束横穿的组织m的厚度lm,其中m=40至44。因此,对成像强子射束通过的计划进行成像是有用的。
控制器5可以被配置用于计算由射束路径穿过的并且包括在所述上游边界与所述下游边界之间的具有厚度lm的组织m的所述水等效路径长度weplm,其中m=40至44。如图9所示,mr数据由mri采集。所述mr数据对应于所成像的组织内的氢原子的密度。可以在mr数据上选择由成像强子射束横穿的组织。控制器可以确定或估计:
·由成像强子射束横穿的组织m的性质;
·每个组织m的hspr、m;
·组织m的厚度lm。
通过将厚度lm、hspr,m以及用hrs测量出的wepl,hrs用等式列出,控制器可以计算每个组织m的水等效路径长度weplm。该计算可以是例如导致lm和hspr,m的值相对于所测量的wepl,hrs优化的迭代过程。
控制器然后可以计算包括在所述上游边界和所述目标点之间的射束路径的水等效路径长度wepl40s,k的值,其中k=0或1,所述计算基于定位在所述目标组织40上游并包含所述目标组织的所述组织m的weplm。wepl40s,k用于计算治疗强子射束的初始能量ek,使得沿着射束路径测量到的治疗强子射束的布拉格峰值的位置对应于目标点40s的位置pk。
图10和图11展示了使用根据本发明的设备的强子治疗的工作流程的示例。首先,可以如上所述地用ct扫描仪(图10)经典地建立或用根据本发明的医疗设备(图11)建立治疗计划。第二,在治疗会话期间,可以用根据本发明的设备执行治疗计划验证,并且第三,可以应用所述治疗。通常递送若干个治疗会话。
治疗计划基于包括在上游边界和目标点40s之间的射束路径的水等效路径长度的wepl40s,0的计算来提供治疗强子射束的计划初始能量e0。基于与属于目标组织40的若干个目标点40si,j相对应的水等效路径长度wepl40si,j,0的计算,所述治疗计划可以包括若干个计划初始能量e0i,j的计算。治疗计划通常在治疗会话之前几天或几周的时刻t0进行。
如图11所示,可以用根据本发明的医疗设备的控制器5来计算wepl40s,0。控制器5采集mr图像和wepl,hrs。mr图像用于估计成像强子射束所横穿的组织的性质(包括密度)、厚度lm以及hspr,m。这些数据与用hrs测量出的wepl,hrs列出等式以计算组织m的水等效路径长度weplm,然后使用所述水等效路径长度来计算wepl40s,0。wepl40s,0的值允许控制器计算治疗强子射束的计划初始能量e0。在建立所述治疗计划期间,所述计算在与目标点的位置p0相对应的计划位置bp0处产生布拉格峰值。可替代地,如图10所示,可以根据ct扫描图像计算出wepl40s,0。
例如,控制器可以求解以下等式:
优选地,对于若干个目标点40si,j测量若干个wepl,hrs。
所述治疗计划的验证可以由控制器5在治疗会话期间执行。所述控制器验证包括在上游边界和目标点40s之间的射束路径的并在建立所述治疗计划期间确定的水等效路径长度wepl40s,0等于还是不等于在治疗会话期间确定的wepl40s,1的实际值。
如果wepl40s,0-δ≤wepl40s,1≤wepl40s,0+δ,其中δ=10mm,优选δ=5mm,更优选δ=3mm,则应用所述治疗计划。
如果wepl40s,1≥wepl40s,0+δ或wepl40s,1≤wepl40s,0-δ,其中δ=10mm,优选δ=5mm,更优选δ=3mm,则所述控制器可以采取另外的动作。例如,所述控制器可以中断治疗会话,并且可以建立新的治疗计划。可替代地,所述控制器可以将计划初始能量e0修改至经校正的初始能量e1,所述经校正的初始能量与在治疗会话期间目标点40s的实际位置p1相对应的治疗位置bp1处产生布拉格峰值。然后可以递送经校正的治疗计划。
图12展示了根据本发明的强子治疗装置的示例,所述强子治疗装置进一步包括瞬发伽马检测器或pet扫描仪。瞬发伽马探测器是用于在感兴趣对象中使沿着强子射束路径发射的瞬发伽马成像的装置。强子射束的强子可以与所横穿的组织的原子核碰撞(非弹性)地进入。碰撞可能导致核反应,所述核反应通过去激发导致伽马射线的发射。这些伽马射线在强子通过之后非常快速地(接近立即)发射。可以用包括例如闪烁器6s、光电倍增器6p和光子检测器6d的检测器来检测伽马射线。
可替代地,可以使用正电子发射断层摄影(pet)扫描仪。pet扫描仪是用于使感兴趣对象中沿着强子射束路径定位的β+(正电子)发射体的浓度在3d中成像的装置。强子射束的强子的一小部分通过与所横穿的组织的原子核的相互作用而产生正电子发射同位素(例如,11c、13n、15o)。这些放射性活性同位素随着正电子的发射而衰减,正电子将与电子一起湮灭,导致巧合发射的两个伽马光子的发射。所述pet检测器检测这两个γ光子的发射源,并且因此测量β+发射体的浓度。β+发射体的浓度与强子射束的射束路径有关。
瞬发伽马检测器和pet扫描仪是可以补充hrs的附加检测器。它们都依赖于治疗强子射束。伽马光子的发射与强子射束和射束路径相关联。从感兴趣对象的上游边界到布拉格峰值稍微上游的位置,发生所述发射。这些附加检测器提供关于布拉格峰值的位置的附加信息,并且因此允许改进强子射束的射程确定。
图13展示了根据本发明的强子治疗装置的示例,所述强子治疗装置进一步包括用于支撑处于非仰卧姿势的患者的支撑件。目标组织40s的位置的低不确定性可以许可建立治疗计划与治疗会话之间的大的形态差异。在这种情况下,治疗处于非仰卧姿势的患者可能是有利的,因为不需要台架。射束喷嘴因此是固定的,并且所述设备的成本大大降低。根据图13的实施例的设备还可以包括瞬发伽马检测器和/或pet扫描仪。
根据第二方面,本发明涉及用于建立和验证治疗计划的方法。
如上所述,可以按“经典”的方式通过使用ct扫描仪例如遵循以下步骤来建立治疗计划:
(a)运行ct扫描仪和/或mri;
(b)根据ct/mr图像,执行所述感兴趣对象的包含包括在上游边界与目标点之间的预测射束路径的部分内的所述组织的初步表征、所述表征包括组织m的性质及其厚度lm的标识;
(c)包括在上游边界41u和目标点40s之间的射束路径的初步wepl40s,0的标识;以及
(d)计算相对于所述初步表征所优化的剂量递送方案,包括计算治疗强子射束的计划初始能量e0,所述计算基于所述wepl40s,0的值,并且在所述治疗计划的建立期间在与由所述目标点的位置相对应的计算出的计划位置bp0处产生所述布拉格峰值。
可替代地,可以在执行mri以获得包括目标点40s的成像体积vp的mr数据时中建立治疗计划。具有初始成像射束能量e0p的成像强子射束可以沿着射束路径发射,所述射束路径穿过并且超过:
·沿着所述射束路径在上游边界与下游边界之间延伸的所述感兴趣对象,以及
·所述目标点。
mr数据可以用于表征强子射束所横穿的组织m。所述表征包括组织m的性质的确定、组织m的厚度lm的测量、以及组织m的hsprm的估计。
用强子射线照相系统(hrs)测量剩余能量或等效的成像强子射束的剩余射程。初始能量e0p与剩余能量之间的差异给出了与上游边界与下游边界之间的所述射束路径的水等效路径长度wepl,hrs相对应的所吸收能量。
根据wepl,hrs并且根据组织m的表征,可以计算出组织m的水等效路径长度weplm。最终,使用定位在所述目标点上游并包含所述目标点的所述组织的weplm来计算包括在所述上游边界和所述目标点之间的所述射束路径的所述wepl40s,0的值。然后计算出计划初始能量e0,使得在治疗计划建立期间治疗强子射束的布拉格峰值的位置bp0对应于目标点40s的位置p0。优选针对若干个目标点40si,j进行所述计算。
在治疗之前执行所述治疗计划的建立。所述计划治疗可以包括多个连续的治疗会话。通常,在第一治疗会话之前几天到几周内执行所述治疗的建立。
治疗会话可以包括在治疗患者之前对计划能量e0进行验证的步骤。所述验证类似于所述治疗计划的建立:执行mri,并且发射成像强子射束。mr数据用于表征成像强子射束所横穿的组织,并且使用由成像强子射束生成的信号来计算wepl,hrs。由此,计算出组织m的weplm。基于所述治疗会话的日期的实际测量结果来计算出包括在上游边界和目标点之间的射束路径的水等效路径长度wepl40s,1。
将所述wepl40s,1的实际值与在所述治疗计划的建立期间所确定的wepl40s,0的初步值进行比较。如果wepl40s,0-δ≤wepl40s,1≤wepl40s,0+δ,其中δ=10mm,优选δ=5mm,更优选δ=3mm,则计划初始能量e0通过验证。如果wepl40s,1≥wepl40s,0+δ或wepl40s,1≤wepl40s,0-δ,其中δ=10mm,优选δ=5mm,更优选δ=3mm,则可以停止治疗会话。
对于中断所述治疗会话而言,可替代地,并且优选地,可以将所述计划初始能量e0的值修改至在所述验证期间并且基于所述wepl40s,1计算出的治疗强子射束的经校正的初始能量e1,所述最终能量e1在与所述目标点的实际位置相对应的治疗位置bp1处产生所述布拉格峰值。
优选地,所述方法是用根据本发明的医疗设备来执行的。优选地,射束递送系统、mri和hrs被定位在同一室中。
本发明允许在治疗会话期间降低强子射束的射程不确定性。目标组织40的位置和形态可以在建立治疗计划的时刻t0与治疗会话的时刻t0+δt3之间演化,不够(部分地)测量此演化对于执行良好的治疗是至关重要的。结合hrs的pt-mri可以有助于使目标组织和周围组织的形态和位置的变化可视化,并且在体验证在治疗计划期间计算出的初始能量。根据本发明的设备可以允许校正初始能量以使目标组织的位置与强子射束的布拉格峰值的位置相匹配。因此,所述设备降低了导致新癌症形成的照射健康组织或未击中目标组织的风险,并且在允许适配目标点处递送的剂量方面提高了治疗效率。
- 还没有人留言评论。精彩留言会获得点赞!