葫芦巴萃取物及其制备方法、包含葫芦巴萃取物的医药组合物与用途与流程
本发明涉及一种葫芦巴萃取物的制备方法,特别是指以水萃取的葫芦巴萃取物的制备方法。本发明另涉及一种用于预防或治疗非酒精性脂肪肝的组合物,特别是指前述葫芦巴萃取物与红曲萃取物。本发明另涉及一种医药组合物,特别是指前述葫芦巴萃取物、红曲萃取物、米糠、朝鲜蓟、人参或其组合。本发明另涉及一种医药组合物的用途,特别是指前述的医药组合物用于预防或治疗非酒精性脂肪肝的用途。
背景技术
脂肪肝(fattyliver)由肝脏细胞积聚脂肪而成。当饮食摄取的脂肪多过人体所能应付时,肝脏便会渐渐积聚脂肪组织。如果脂肪占肝脏5%以上,这情况便为脂肪肝。肝脏一旦积聚脂肪便很容易继续受损,导致肝脏发炎和结疤。非酒精性脂肪肝病(non-alcoholicfattyliverdisease,nafld)是一种渐进性的复合肝脏疾病,它始于肝脏内脂肪的积聚,而这种脂肪积聚并非过量酒精导致。非酒精性脂肪肝炎(non-alcoholicsteatohepatitis,nash)是非酒精性脂肪肝病(nafld)中较为严重的、晚期的一种。脂肪肝炎是指有炎症的,即损害持续进行的脂肪肝病,与酒精性肝病类似,但发生在不喝酒或只喝少量酒的人身上。非酒精性脂肪肝炎与单纯的肝脏脂肪积聚不同,如果是后者身体状况仍然可以很好。患有非酒精性脂肪肝炎的成人中,其中20%会形成肝硬化,其中11%会因肝病致命,也有很多出现慢性肝脏衰竭而需要肝脏移植。
葫芦巴,学名(trigonellafoenum-graecum),为一年生豆科蝶形花亚科葫芦巴属的一种植物,其种子可作为调味料和中药。中医认为葫芦巴种子性味苦温,入肾肝经。用来治疗肾虚、阳痿、脱发,胃寒痛等疾病。也可作为松弛剂、肠道润滑剂和降低发烧的温度,有助于降低胆固醇和血糖的含量,藉由减少黏液来帮助气喘及鼻窦炎。现有技术多以有机溶剂如甲醇、乙醇(酒精)、丙酮、乙酸乙酯等进行萃取。然而,随着现代人对饮食安全的重视,由于有机溶剂容易残留于萃取物中不易分离,因此有待进一步改进萃取方法。
有鉴于此,如何发展出安全的萃取方式以萃取葫芦巴,现有技术实有待改善的必要。
技术实现要素:
为了克服现有技术的缺点,本发明的目的在于提供一种葫芦巴萃取物的制备方法,制备而得的葫芦巴萃取物能达成预防或治疗非酒精性脂肪肝的效果。
为达到上述的发明目的,本发明提供一种葫芦巴萃取物的制备方法,其包含以下步骤:(1)齐备葫芦巴植物组织,并浸泡于水溶剂且于25℃至100℃、0.5小时至5小时进行萃取;以及,(2)将经萃取的葫芦巴植物组织进行过滤,获得葫芦巴萃取物。
较佳的,所述步骤(1)中,葫芦巴植物组织为葫芦巴种子或葫芦巴根茎叶。
较佳的,所述步骤(1)中,水溶剂使用的重量比为葫芦巴植物组织的1倍至20倍。
较佳的,所述步骤(1)中,萃取温度与时间为50℃至95℃、0.5小时至3小时。
本发明另提供一种预防或治疗非酒精性脂肪肝的组合物,其包含如前述的葫芦巴萃取物。
较佳的,所述组合物还包含红曲萃取物、米糠萃取物、朝鲜蓟萃取物、牛磺酸、人参萃取物或其组合。
更佳的,所述葫芦巴萃取物为12重量份至16重量份,红曲萃取物为3重量份至14重量份,米糠萃取物为0.5重量份至5重量份,朝鲜蓟萃取物为0.5重量份至3重量份,牛磺酸为0.8重量份至25重量份,人参萃取物为0.1重量份至10重量份。
本发明另提供一种预防或治疗非酒精性脂肪肝的医药组合物,其包括如前述的组合物以及其药学上可接受的载剂。
本发明另提供一种组合物用于制备预防或治疗非酒精性脂肪肝的医药组合物的用途,其是将医药组合物以有效剂量施予受体,以使受体达到预防或治疗非酒精性脂肪肝的效果。
本发明的医药组合物可利用所属领域的技术人员所详知的技术,将上述的组合物与药学上可接受的载剂制备成适用本发明组合物的剂型。所述的医药组合物可用现有技术水准中已习知的方法,利用已知的赋形剂包含,但不限于增塑剂、填料、润滑剂、稀释剂、黏合剂、崩解剂、溶剂、表面活性剂、防腐剂、甜味剂、抗氧化剂及黏度剂;较佳的,所述增塑剂包括,但不限于玉米粉;较佳的,所述润滑剂包括,但不限于二氧化硅(sio2)、硬脂酸镁(magnesiumstearate,mag);较佳的,所述稀释剂包括,但不限于麦芽糊精
本发明所述的医药组合物可以多种形式存在,这些形式包括,但不限于固体药剂形式,其中固体药剂包括,但不限于胶囊、锭剂、丸剂、粉剂、脂质体及栓剂。较佳的形式取决于预期的投药模式及治疗应用;较佳的,本发明所述的医药组合物的剂型是口服。
依据本发明,“有效剂量”是指在剂量上及对于所需要的时间而言对达成所要预防或治疗非酒精性脂肪肝有效的量;其如本发明所例示的,有效预防非酒精性脂肪肝剂量可通过油滴生成试验、组织切片染色、血液分析总胆固醇、血清谷氨酸草酰乙酸转氨酶(serumglutamicoxaloacetictransaminase,sgot)与血清丙氨酸转氨酶(serumglutamic-pyruvictransaminase,sgpt)等试验而得知。
较佳的,所述的组合物包含葫芦巴萃取物、红曲萃取物、米糠萃取物、朝鲜蓟萃取物、牛磺酸及人参萃取物,该组合物施予方式是口服施予,且施予受体的有效剂量介于受体每日每公斤0.0004克(g/kg/day)至0.81g/kg/day。以上剂量是根据2005年美国食品药物管理局所公告的实验初期估算方法(estimatingthemaximumsafestartingdoseininitialclinicaltrialsfortherapeuticsinadulthealthyvolunteers)计算而得。
本发明的优点在于本发明以水萃取制备方法萃取而得的葫芦巴萃取物,其预防或治疗非酒精性脂肪肝的效果相较于以有机溶剂萃取的葫芦巴萃取物而言更佳,且在相同的剂量下以水萃取的葫芦巴萃取物相较于以有机溶剂萃取的葫芦巴萃取物抑制脂肪肝的效果更好;此外,前述葫芦巴萃取物与红曲萃取物、米糠萃取物、朝鲜蓟萃取物、牛磺酸、人参萃取物一并使用时,其预防或治疗非酒精性脂肪肝的效果又比单独使用葫芦巴萃取物更佳。
附图说明
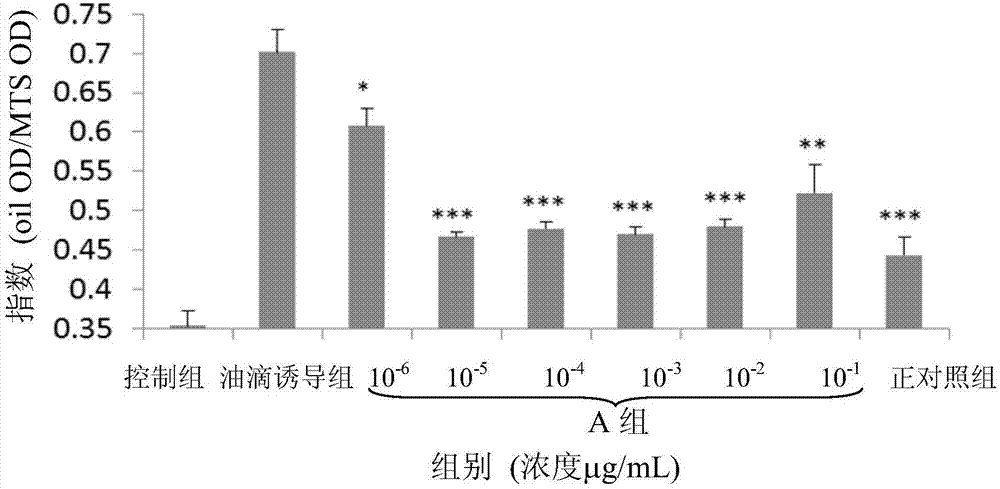
图1为本发明的a组(经水萃取方法所萃取的葫芦巴萃取物)的油滴生成的指数柱状图;各组为二重复,平均值(mean)±标准差(standarddeviation,sd);以学生t检验(student’sttest),*代表p<0.05、**代表p<0.01、***代表p<0.001;mts作为细胞存活的分析方法。
图2为本发明的b组(经酒精萃取方法2萃取的葫芦巴酒精萃取物)的油滴生成的指数柱状图;各组为二重复,mean±sd;student’sttest,*代表p<0.05、**代表p<0.01、***代表p<0.001。
图3为本发明的c组(经水萃取方法所萃取的葫芦巴萃取物)的油滴生成的指数柱状图;各组为二重复,mean±sd;student’sttest,*代表p<0.05、**代表p<0.01、***代表p<0.001。
图4为本发明的d组(经酒精萃取方法2萃取的葫芦巴酒精萃取物)的油滴生成的指数柱状图;各组为二重复,mean±sd;student’sttest,*代表p<0.05、***代表p<0.001。
图5为本发明的控制组(control)、高脂组与ye2组(经水萃取方法所萃取的葫芦巴萃取物)的动物肝脏组织切片染色图。
图6为本发明的控制组、高脂组与ye2组的动物肝脏组织切片的大囊泡性脂肪变性分数的柱状图;mean±sd;单因子变异数分析(one-wayanova),*代表相较于控制组p<0.05;
图7为本发明的控制组、高脂组与ye2组的动物肝脏组织切片的小囊泡性脂肪变性分数的柱状图;mean±sd;one-wayanova,*代表相较于控制组p<0.05;
图8为本发明的控制组、高脂组与ye2组的动物肝脏组织切片的细胞气球化分数的柱状图;mean±sd;one-wayanova,*代表相较于控制组p<0.05;
图9为本发明的控制组、高脂组与ye2组的动物血液的总胆固醇的柱状图;mean±sd;one-wayanova,*代表相较于控制组p<0.05;
图10为本发明的控制组、高脂组与ye2组的动物血液的sgot的柱状图;mean±sd;one-wayanova,*代表相较于控制组p<0.05;
图11为本发明的控制组、高脂组与ye2组的动物血液的sgpt的柱状图;mean±sd;one-wayanova,*代表相较于控制组p<0.05;
图12为本发明的葫芦巴萃取物复方的油滴生成的指数柱状图;各组为四重复,mean±sd;student’sttest,***代表p<0.001。
图13为本发明的葫芦巴萃取物复方的细胞存活光密度(obliviondust,od)值的柱状图;各组为四重复,mean±sd;student’sttest,***代表p<0.001。
图14为本发明的葫芦巴萃取物复方于不同剂量的血清中三酸甘油脂的柱状图;各组为十重复,mean±sd;one-wayanova与邓肯氏多变域测验(duncan’smultiplerangetest),当两字母分别为a与b时,代表p<0.05。
图15为本发明的葫芦巴萃取物复方于不同剂量的血清中胆固醇的柱状图;各组为十重复,mean±sd;one-wayanova与duncan’smultiplerangetest,当其中两组的字母分别为不同的两字母时,代表p<0.05。
图16为本发明的葫芦巴萃取物复方于不同剂量的血清中游离脂肪酸的柱状图;各组为十重复,mean±sd;one-wayanova与duncan’smultiplerangetest,当其中两组的字母分别为不同的两字母时,代表p<0.05。
图17为本发明的葫芦巴萃取物复方于不同剂量的血清中alt的柱状图;各组为十重复,mean±sd;one-wayanova与duncan’smultiplerangetest,当其中两组的字母分别为不同的两字母时,代表p<0.05。
图18为本发明的葫芦巴萃取物复方于不同剂量的血清中ast的柱状图;各组为十重复,mean±sd;one-wayanova与duncan’smultiplerangetest,当其中两组的字母分别为不同的两字母时,代表p<0.05。
图19为本发明的葫芦巴萃取物复方于不同剂量的动物肝脏组织切片染色图。
图20为本发明的葫芦巴萃取物复方于不同剂量的总肝中胆固醇的柱状图;各组为十重复,mean±sd;one-wayanova与duncan’smultiplerangetest,当其中两组的字母分别为不同的两字母时,代表p<0.05。
图21为本发明的葫芦巴萃取物复方于不同剂量的总肝中三酸甘油脂的柱状图;各组为十重复,mean±sd;one-wayanova与duncan’smultiplerangetest,当其中两组的字母分别为不同的两字母时,代表p<0.05。
图22为本发明的葫芦巴萃取物复方于不同剂量的总肝中游离脂肪酸的柱状图;各组为十重复,mean±sd;one-wayanova与duncan’smultiplerangetest,当其中两组的字母分别为不同的两字母时,代表p<0.05。
图23为本发明的葫芦巴萃取物以高效液相层析(highperformanceliquidchromatography,hplc)侦测总皂苷于波长203nm分析的高效液相层析图。
图24为本发明的葫芦巴根茎叶萃取物以hplc侦测总皂苷于波长203nm分析的高效液相层析图。
具体实施方式
以下配合附图及本发明的较佳实施例,进一步阐述本发明为达成目的所采取的技术手段。
制备例1葫芦巴的水萃方法
取新鲜或干燥的葫芦巴种子以水溶剂萃取,其中水溶剂所使用的重量比为葫芦巴种子的1倍至20倍,较佳为5倍至10倍。将浸泡于水溶剂的葫芦巴种子置于25℃至100℃、0.5小时至5小时,较佳为50℃至95℃、0.5小时至3小时,并经过过滤(以已知的物理过滤方法进行固-液分离,例如孔洞、重量或密度)后,获得葫芦巴萃取物(简称ye2)。该葫芦巴萃取物可以已知食品加工方法进行浓缩或干燥。
制备例2葫芦巴的有机溶剂萃取方法
取新鲜或干燥的葫芦巴种子以50%酒精溶剂萃取,其中酒精溶剂所使用的重量比为葫芦巴种子的1倍至20倍,较佳为5倍至10倍。将浸泡于酒精溶剂的葫芦巴种子置于25℃至100℃、0.5小时至5小时,较佳为50℃至95℃、0.5小时至3小时,并经过过滤(以已知的物理过滤方法进行固-液分离,例如孔洞、重量或密度)后,获得葫芦巴酒精萃取物(简称ye3)。该葫芦巴萃取物可以已知食品加工方法进行浓缩或干燥。
实施例1细胞实验-同时加药与刺激,模拟预防机转
(1)取肝癌细胞(liverhepatocellularcarcinoma,hepg2)种植于每孔2.5×104个细胞,培养24小时。
(2)此处分为以下多组:
控制组:添加与油滴诱导剂等体积的细胞培养液及1%二甲基亚砜(dimethylsulfoxide,dmso)于肝癌细胞中6小时。
油滴诱导组:添加1%dmso与500毫摩尔浓度(mm)的油滴诱导剂[单元脂肪酸油酸(oleicacid,oa,c18:1)与饱和脂肪酸棕榈酸(paltimicacid,pa,c16:0),以体积比2:1(v/v)比例溶于细胞培养液中]于肝癌细胞中6小时进行刺激。
正对照组:添加磷脂酰胆碱(phosphoatidylcholine)每毫升0.01微克(μg/ml)以及500毫摩尔浓度(mm)的油滴诱导剂于肝癌细胞中6小时进行刺激。
a组:取制备例1经水萃取方法萃取的干燥的葫芦巴萃取物溶于1%dmso溶剂中,使浓度最终成为每毫升10-6微克(μg/ml)、10-5μg/ml、10-4μg/ml、10-3μg/ml、10-2μg/ml及10-1μg/ml后,同时与500mm的油滴诱导剂分别添加于肝癌细胞中6小时。
b组:取制备例2经酒精萃取方法所萃取的干燥的葫芦巴酒精萃取物溶于1%dmso溶剂中,使浓度最终成为10-6μg/ml、10-5μg/ml、10-4μg/ml、10-3μg/ml、10-2μg/ml及10-1μg/ml后,同时与500mm的油滴诱导剂分别添加于肝癌细胞中6小时。
(3)以上各组最后以细胞存活率试验(mtsassay)及油红组织染色(oilred-ostain)进行检测,并以oilredod值/mtsod值做为油滴生成的指数(index)依据。
请参阅图1至图2所示,用水萃或酒精进行萃取时,发现当浓度越高,抑制油滴生成于肝癌细胞的效果越好。a组的半致死剂量(halfmaximalinhibitoryconcentration,ic50)为0.1ng/ml,b组的ic50为0.3ng/ml。其中a组可发现经水萃取方法所剂萃取的葫芦巴萃取物在浓度为10-5μg/ml时即有非常好的抑制效果。
实施例2细胞实验-先加药后刺激,模拟预防机转
(1)取肝癌细胞(hepg2)种植于每孔2.5×104个细胞,培养24小时。
(2)此处分为以下多组:
控制组:添加与c组等体积的1%dmso于肝癌细胞中并静置16小时,再添加与油滴诱导剂等体积的细胞培养液16小时。
油滴诱导组:添加1%dmso于肝癌细胞中并静置16小时,再添加500mm的油滴诱导剂(同实施例1)16小时进行刺激。
正对照组:添加磷脂酰胆碱0.01μg/ml于肝癌细胞中并静置16小时,再添加500mm的油滴诱导剂16小时进行刺激。
c组:取制备例1经水萃取方法所萃取的干燥的葫芦巴萃取物溶于1%dmso溶剂中,使浓度最终成为10-6μg/ml、10-5μg/ml、10-4μg/ml、10-3μg/ml、10-2μg/ml及10-1μg/ml后,分别添加于肝癌细胞中并静置16小时,再添加500mm的油滴诱导剂16小时做为刺激。
d组:取制备例2经酒精萃取方法所萃取的干燥的葫芦巴酒精萃取物溶于1%dmso溶剂中,使最终浓度成为10-6μg/ml、10-5μg/ml、10-4μg/ml、10-3μg/ml、10-2μg/ml及10-1μg/ml后,分别添加于肝癌细胞中并静置16小时,再添加500mm的油滴诱导剂16小时做为刺激。
(3)以上各组最后以mtsassay及oilred-ostain进行检测,并以oilredod值/mtsod值做为油滴生成的指数依据。
请参阅图3至图4所示,c组ic50为0.3ng/ml,d组的ic50为0.9ng/ml。其中以水萃取方法所萃取的c组剂量为10-3μg/ml时指数为0.3839±0.0203具有最佳抑制油滴生成的效果,而以酒精萃取的d组当剂量为10-3μg/ml时指数为0.4471±0.0086,甚至不如c组剂量为10-3μg/ml时所能抑制油滴生成的效果。
实施例3动物实验
(1)取7周龄雄性c57bl/6j小鼠进行实验。
(2)实验分成以下几组:
控制组:给予小鼠控制饮食(chowdiet,cd),包括4.8%千卡(%kcal)脂肪与0%千卡胆固醇,并持续12周,共6只。
高脂组:给予小鼠高脂饮食(highfatdiet,hfd),包括42%千卡脂肪与0.2%千卡胆固醇,并持续12周,共6只。
ye2组:给予小鼠高脂饮食,同时给予制备例1经水萃取方法所萃取的干燥的葫芦巴萃取物以0.108g/kg/day混合于高脂饮食中,并持续12周,共6只。
(3)动物牺牲后,将肝脏组织切片以苏木精-伊红染色(hematoxylinandeosinstain,h&e)染色,根据2005年kleiner等人所建立的评分标准,针对大囊泡性脂肪变性(macrovesicularsteatosis):分数0为<5%(大囊泡占组织中的百分比),分数1为5%至33%,分数2为>33%至66%,分数3为>66%;针对小囊泡性脂肪变性(microvesicularsteatosis):分数0为未产生,分数1为有产生;针对肝细胞气球化(ballooning):分数0为未产生,分数1为少量细胞气球化,分数2为多数细胞气球化。此外,同时抽取动物血液,针对总胆固醇、sgot与sgpt进行分析。
请参阅图5所示,从组织切片染色图可看出高脂组的肝脏细胞充满脂肪,呈现如空包状且组织疏松,而ye2组则与控制组较为相同;请参阅图6所示,ye2组相较于高脂组,大囊泡性脂肪变性显著降低;请参阅图7所示,ye2组小囊泡性脂肪变性呈度与高脂组相当;请参阅图8所示,ye2组相较于高脂组,肝细胞气球化程度显著降低;请参阅图9所示,ye2组的总胆固醇含量与高脂组相当;请参阅图10所示,ye2组相较于高脂组,sgot含量显著降低;请参阅图11所示,ye2组相较高脂组与控制组,sgpt含量皆显著降低。
实施例4细胞实验-葫芦巴萃取物复方
(1)取肝癌细胞(hepg2)种植于每孔2.5×104个细胞,培养24小时。
(2)此处分为以下多组:
控制组:添加与实验组别的萃取物等体积的1%dmso于肝癌细胞中并静置16小时,再添加与油滴诱导剂等体积的细胞培养液16小时。
油滴诱导组:添加与实验组别的萃取物等体积的1%dmso于肝癌细胞中并静置16小时,再添加500mm的油滴诱导剂(同实施例2)16小时进行刺激。
实验组别:取制备例1经水萃取方法萃取的干燥的葫芦巴萃取物、红曲萃取物、米糠萃取物、朝鲜蓟萃取物、牛磺酸与人参萃取物共6种原料,其中后5种原料皆为市售可取得的原料,以不同重量份混成8组分别为实验组别1至实验组别8,如下表1所示。此外,在一较佳的实施例中可依需求额外添加vite、sio2、mag及
表1、各组别之原料含量(重量份)
注:「-」表示未添加。
(3)以上各组最后以mtsassay及oilred-ostain进行检测,并以oilredod值/mtsod值做为油滴生成的指数依据。
请参阅图12所示,以油滴诱导组油滴生成百分率为100%,其中,实验组别1油滴生成百分率约97%、实验组别2油滴生成百分率约38.6%,实验组别3油滴生成百分率约57%、实验组别4油滴生成百分率约58.4%、实验组别5油滴生成百分率约79.3%、实验组别6油滴生成百分率约78.1%、实验组别7油滴生成百分率约72.4%、实验组别8油滴生成百分率约60.1%。因此,以上实验组别2至7皆能显著降低油滴的生成,其中实验组别2中6种原料都有的复方,其油滴生成百分率最低。
请参阅图13所示,无论是控制组、油滴诱导组或是实验组别1至8的细胞存活od值都无显著改变,因此,施予实验组别2至8都能维持相同的细胞存活率。
实施例5动物实验-葫芦巴萃取物复方
(1)取8周龄雄性c57bl/6j小鼠进行实验。
(2)实验分成以下几组:
控制组:每日口服施予小鼠0.2ml二次水,第二周开始之后给予控制饮食,喂食一般饲料与管喂二次水(ddh2o),并持续至第18周,共10只。
高脂组:每日口服施予小鼠0.2ml二次水,第二周开始之后给予小鼠高脂饮食,喂食60%高脂饲料诱发肝损伤与管喂二次水,并持续至第18周,共10只。其中,60%高脂饲料为20%千卡蛋白质、20%千卡碳水化合物及60%千卡脂肪,该配方由e.a.ulman,ph.d.,所调配于researchdiets,inc.,8/26/98与3/11/99,产品编号d12492。
低剂量组:每日口服施予小鼠0.2ml1倍(0.005~1g/kg/day)的葫芦巴萃取物复方(同实施例4实验组2中,葫芦巴萃取物、红曲萃取物、米糠萃取物、朝鲜蓟萃取物、牛磺酸与人参萃取物的比例),第二周开始之后给予小鼠高脂饮食,并持续至第18周,共10只。
中剂量组:每日口服施予小鼠0.2ml5倍(0.025~5g/kg/day)的葫芦巴萃取物复方(同实施例4实验组2中,葫芦巴萃取物、红曲萃取物、米糠萃取物、朝鲜蓟萃取物、牛磺酸与人参萃取物的比例;中剂量组为5倍低剂量组的剂量),第二周开始之后给予小鼠高脂饮食,并持续至第18周,共10只。
高剂量组:每日口服施予小鼠0.2ml10倍(0.05~10g/kg/day)的葫芦巴萃取物复方(同实施例4实验组2中,葫芦巴萃取物、红曲萃取物、米糠萃取物、朝鲜蓟萃取物、牛磺酸与人参萃取物的比例;高剂量组为10倍低剂量组的剂量),第二周开始之后给予小鼠高脂饮食,并持续至第18周,共10只。
(3)于第18周抽取动物血液,针对血清中三酸甘油脂、血清中胆固醇、血清中游离脂肪酸、血清中alt、血清中ast、与sgpt进行分析。此外,于第18周动物牺牲后,将肝脏组织切片以h&e染色,并针对肝脏组织进行总肝中胆固醇、总肝中三酸甘油脂以及总肝中游离脂肪酸的分析。
请参阅图14所示,无论是低剂量组、中剂量组或高剂量组相较于高脂组,血清中三酸甘油脂皆显著降低。请参阅图15所示,低剂量组、中剂量组或高剂量随着剂量的增加,相较于高脂组,中剂量组或与高剂量血清中胆固醇也显著减少。请参阅图16所示,无论是低剂量组、中剂量组或高剂量组相较于高脂组,血清中游离脂肪酸皆显著降低。请参阅图17所示,相较于高脂组,低剂量组及中剂量组血清中游离脂肪酸皆显著降低。请参阅图18所示,相较于高脂组,低剂量组及高剂量血清中ast皆显著降低。
请参阅图19所示,从组织切片染色图可看出高脂组的肝脏细胞充满脂肪,呈现如空包状且组织疏松,而随着低剂量组、中剂量组或高剂量组其剂量的增加,肝脏细胞越为紧密,其中高剂量组与控制组较为相同;请参阅图20所示,相较于高脂组,中剂量组及高剂量组的总肝中胆固醇含量显著降低;请参阅图21所示,无论是低剂量组、中剂量组或高剂量组相较于高脂组,总肝中三酸甘油脂皆显著降低;请参阅图22所示,相较于高脂组,中剂量组及高剂量组的总肝中游离脂肪酸含量显著降低。
实施例6葫芦巴植物组织的成分分析
取制备例1葫芦巴种子以水萃取而得的葫芦巴萃取物,以及取新鲜或干燥的葫芦巴根茎叶(约一个月大的植株)以同制备例1的制备方法获得一葫芦巴根茎叶萃取物,分别进行hplc。hplc的分析条件为管柱:c18[(5微米(μm),x250毫米(mm)];流动相-甲醇:水=90:10;侦测波长:203纳米(nm);注入体积为20微升(μl);流洗时间为30分钟;流速为1ml/分钟(min)。
请参阅图23与图24所示,结果显示葫芦巴萃取物(图23)和葫芦巴根茎叶萃取物(图24)中总皂苷(saponins)轮廓(profile)的相似度高,因此无论是葫芦巴种子或是葫芦巴根茎叶以水进行萃取的萃取物,应具有相似的功效。
根据本发明可作的不同修正及变化对于本领域技术人员而言均显然不会偏离本发明的范围与精神。虽然本发明已叙述特定的较佳具体事实,必须了解的是本发明不应被不当地限制于这些特定具体事实上。事实上,在实施本发明的已述模式方面,对于本领域技术人员而言显而易知的不同修正亦被涵盖于请求保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!