培化西海马肽的药物组合物及其制备方法与流程
本发明涉及多肽类药物制剂领域。具体而言,本发明涉及包含培化西海马肽的药物制剂及其制备方法。
背景技术:
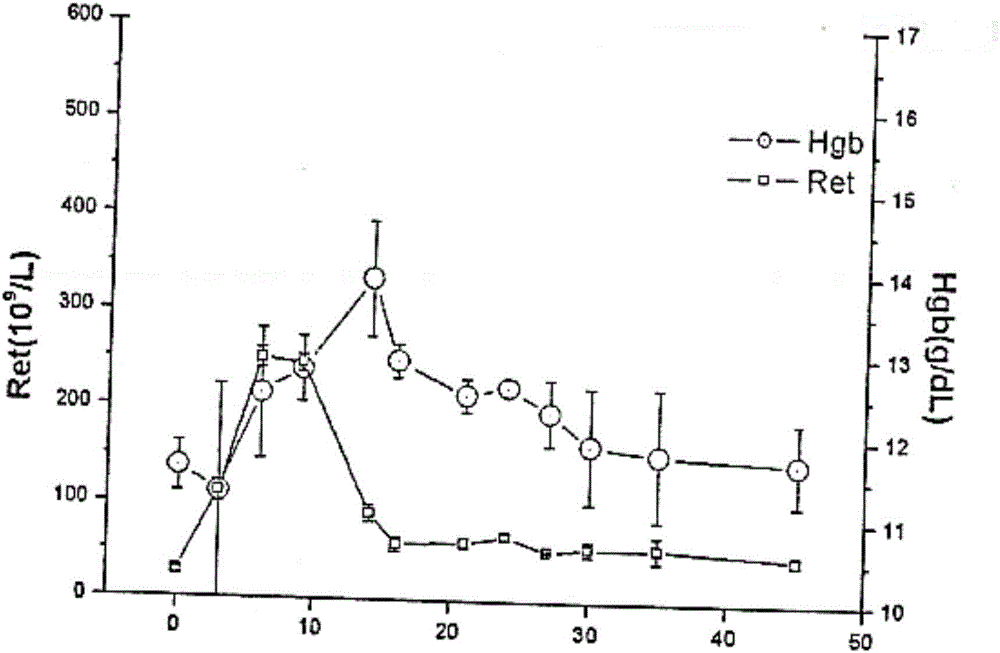
:培化西海马肽是聚乙二醇修饰的促红细胞生成素模拟肽衍生物,其中epo作用于骨髓造血细胞,刺激有丝分裂和红细胞前体细胞的分化,促进红细胞系干细胞增生、分化,最终成熟为内分泌激素。由于epo在血红细胞形成过程中是必需的,它能促使红细胞增生,提高机体的血红蛋白(hb)总量,改善机体携氧能力,所以该激素在诊断和治疗红细胞生成不足或红细胞产生缺陷的血液疾病中有着广泛的应用。此外,也可用于外科手术前的自体输血及手术后贫血的恢复、骨髓异常增生综合征贫血、血红蛋白病的镰状红细胞贫血及β-地中海贫血、早产儿贫血、慢性炎症或感染引起的贫血、脊髓损伤、肾性贫血、再生障碍性贫血等等。培化西海马肽是epo模拟肽经聚乙二醇化修饰后的产物,属于化学合成的多肽类药物,临床上拟用于治疗肾衰竭引起的贫血。培化西海马肽的水溶性良好,热稳定性较差,且极易在胃肠道被酶解。因此在临床上,培化西海马肽的给药剂型采用注射液或冻干粉针,优选注射液。技术实现要素:本发明的目的在于提供一种稳定的培化西海马肽药物组合物,能够显著地控制聚合物杂质。具体而言,本发明主要通过以下方案实施:培化西海马肽药物组合物包括活性成分培化西海马肽、缓冲液和等渗调节剂,培化西海马肽的结构为:优选地,所述培化西海马肽的浓度选自0.1mg/ml~100mg/ml,优选0.1mg/ml~20mg/ml。优选地,所述培化西海马肽组合物为培化西海马肽注射液,其包含0.05%~5.0%(w/v)的培化西海马肽,0.1%~5.0%(w/v)的缓冲盐,0.05%~5.0%(w/v)的等渗调节剂。其中w/v的单位为g/ml。优选地,所述培化西海马肽注射液包含0.1%~2%(w/v)的培化西海马肽,0.3%~3.0%(w/v)的缓冲盐,0.1%~2.0%(w/v)的等渗调节剂。优选地,所述培化西海马肽注射液包含0.1%~1.0%(w/v)的培化西海马肽,0.5%~1.5%(w/v)的缓冲盐,0.1%~1.0%(w/v)的等渗调节剂。优选地,所述缓冲液选自磷酸盐缓冲液、醋酸盐缓冲液、枸橼酸盐缓冲液、碳酸盐缓冲液、酒石酸盐缓冲液、tris缓冲液、组氨酸盐,优选醋酸盐缓冲液或磷酸盐缓冲液。其中磷酸盐缓冲液包括磷酸二氢盐和磷酸氢二盐。优选地,所述等渗调节剂选自氯化钠、甘露醇、山梨醇、甘油、葡萄糖、木糖醇的一种或多种,优选甘露醇或氯化钠。优选地,所述培化西海马肽注射液包含0.1%~2%(w/v)的培化西海马肽,0.1%~2.0%(w/v)的磷酸二氢盐,0.1%~2.0%(w/v)的磷酸氢二盐,0.1%~2.0%(w/v)的氯化钠;优选的,所述培化西海马肽注射液包含0.1%~1%(w/v)的培化西海马肽,0.2%~1%(w/v)的磷酸二氢盐,0.1%~0.6%(w/v)的磷酸氢二盐,0.1%~1.0%(w/v)的氯化钠,其中w/v的单位为g/ml。优选地,所述培化西海马肽与缓冲盐的重量比为1:1~10,优选1:2~4。优选地,所述缓冲盐中其碱和酸的重量比为1:1~10,优选1:1~5。进一步优选地,所述缓冲盐选自磷酸二氢钠和磷酸氢二钠,重量比为1~10:1,优选1~3:1,更优选1.2~2:1。优选地,所述培化西海马肽与等渗调节剂的重量比为1:0.5~10,优选1:1~2。优选地,所述药物组合物的ph范围为4.0至7.0,优选5.0至6.0。本发明的又一目的在于提供制备所述药物组合物的方法,将缓冲盐和等渗调节剂溶于注射用水,加入活性炭,过滤脱炭得中间体药液;将培化西海马肽溶解至上述药液,搅拌溶解,过滤、分装。优选地,所述低温条件为在2℃~25℃之间。优选地,制备药物组合物经无菌过滤、分装、充氮气封装。优选地,中间体药液配制采用充氮气保护。优选地,中间体药液采用氮气压滤。优选地,灌装过程在氮气保护下完成。优选地,所述的药物组合物,采用西林瓶进行分装。优选地,所述的药物组合物,采用卡式瓶进行分装。优选地,所述的药物组合物,采用预灌封注射器进行分装。聚合物杂质是培化西海马肽的多聚体,该杂质的存在使产品降解,降低产品的含量。本发明通过处方中组分的筛选,通过对各组分比例的控制,无需添加其他辅料,即可得到稳定性好的培化西海马肽药物组合物,能够有效地控制培化西海马肽的聚合物杂质。附图说明1、图1为猕猴皮下注射100μg.kg-1剂量,血红蛋白(hgb)和网织红细胞(ret)时间变化2.图2为猕猴皮下注射500μg.kg-1剂量,血红蛋白(hgb)和网织红细胞(ret)时间变化3.图3为猕猴皮下注射1500μg.kg-1剂量,血红蛋白(hgb)和网织红细胞(ret)时间变化4.图4为猕猴静脉注射100μg.kg-1剂量,血红蛋白(hgb)和网织红细胞(ret)时间变化具体实施方式本发明进一步通过如下实施例进行说明,所述实施例不理解为进一步的限定。本领域技术人员易于理解所述的特定方法和结果仅仅是说明性的。实施例1称取处方量的磷酸二氢钠6.0g和磷酸氢二钠4.5g溶于800ml注射用水中,加入氯化钠4.0g,搅拌溶解;然后加入0.1%的活性炭至上述溶液并置60℃水浴中保温15min并趁热过滤脱炭,取续滤液冷却至20℃;称取处方量的培化西海马肽4.0g,缓慢搅拌使之溶解,并用磷酸二氢钠或氢氧化钠分别调节药液ph至3.0、4.0、5.0、6.0、7.0;采用注射用水将上述药液分别定容至1000ml,最后将药液用0.22μm的微孔滤膜过滤,分装至西林瓶中,充氮气后压塞,轧盖。将样品分别置25℃和40℃条件下考察其稳定性,考察指标为外观、浊度、有关物质和含量,结果见表1。表1实施例2称取处方量的磷酸二氢钠6.0g和磷酸氢二钠4.5g溶于800ml注射用水中,加入氯化钠,搅拌溶解;然后加入0.1%的活性炭至上述溶液并置60℃水浴中保温15min并趁热过滤脱炭,待空白辅料冷却后测ph(5.0~6.0),若不在范围内加入适量盐酸或氢氧化钠溶液调节药液的ph至5.0~6.0,取续滤液冷却至20℃;称取处方量的培化西海马肽4.0g,缓慢搅拌使之溶解,采用注射用水将上述药液分别定容至1000ml,最后将药液用0.22μm的微孔滤膜过滤,分装至预灌封注射器中,充氮气后压塞。将样品分别置25℃和40℃条件下考察其稳定性,考察指标为外观、浊度、有关物质和含量,结果见表3。表2实施例3称取处方量的磷酸二氢钠和磷酸氢二钠溶于800ml注射用水中,加入氯化钠4.0g,搅拌溶解;然后加入0.1%的活性炭至上述溶液并置60℃水浴中保温15min并趁热过滤脱炭,取续滤液冷却至20℃;待空白辅料冷却后测ph(5.0~6.0),若不在范围内加入适量盐酸或氢氧化钠溶液调节药液的ph至5.0~6.0,称取处方量的培化西海马肽适量,缓慢搅拌使之溶解,采用注射用水将上述药液分别定容至1000ml,最后将药液用0.22μm的微孔滤膜过滤,分装至预灌封注射器中,充氮气后压塞。将样品分别置25℃和40℃条件下考察其稳定性,考察指标为外观、浊度、有关物质和含量,结果见表3。表3时间(月)温度(℃)性状聚合物杂(%)总杂(%)含量(%)025无色澄明液体0.241.0299.6%325无色澄明液体0.241.0399.6%625无色澄明液体0.251.0899.5%340无色澄明液体0.231.0799.5%640无色澄明液体0.281.1399.5%实施例4称取处方量的磷酸二氢钠和磷酸氢二钠溶于800ml注射用水中,加入氯化钠4.0g,搅拌溶解;然后加入0.1%的活性炭至上述溶液并置60℃水浴中保温15min并趁热过滤脱炭,取续滤液冷却至20℃;待空白辅料冷却后测ph(5.0~6.0),若不在范围内加入适量盐酸或氢氧化钠溶液调节药液的ph至5.0~6.0,称取处方量的培化西海马肽适量,缓慢搅拌使之溶解,采用注射用水将上述药液分别定容至1000ml,最后将药液用0.22μm的微孔滤膜过滤,分装至预灌封注射器中,充氮气后压塞。将样品分别置25℃和40℃条件下考察其稳定性,考察指标为外观、浊度、有关物质和含量,结果见表4。表4时间(月)温度(℃)性状聚合物杂(%)总杂(%)含量(%)025无色澄明液体0.221.0399.5%325无色澄明液体0.231.0599.5%625无色澄明液体0.231.0999.4%340无色澄明液体0.241.1199.4%640无色澄明液体0.261.1499.4%试验例一溶血试验1、受试物:1.1供试品:实施例2和3制备的培化西海马肽注射液;1.2溶媒:氯化钠注射液。2、实验方法:2.1血球浮液的配制:取犬血5ml,用玻璃棒搅动血液,除去纤维蛋白原,使之成为脱纤血液。加入0.9%氯化钠溶液约10倍量,摇匀,1500转/分钟离心15分钟,除去上清液,沉淀的红细胞再用0.9%氯化钠溶液按上述方法洗涤3次,至上清液不显红色为止。量取血球1.0ml,加生理盐水稀释至50ml,配成2%的混悬液供试验用。2.2药液配制:将实施例3和实施例4注射液用生理盐水稀释至1.00mg/ml,混匀备用。2.3加样试验一和试验二分别取试管8支,按下列顺序加入各种溶液第1到第5管为受试物管,第6管为阴性对照管,第7管为阳性对照管,第8管为溶媒对照管。将各管溶液轻轻摇匀,置37℃水浴箱中,观察并记录15min、30min、45min、1h、2h、3h的结果。每观察时间点拍照。如溶液变清并染红色,即表示溶血。必要时可用显微镜观察红细胞是否破裂。表5.培化西海马肽注射液溶血实验观察表(试验一)表6培化西海马肽注射液溶血实验观察表(试验二)培化西海马肽注射液进行溶血试验,除阳性对照管外所有受试管均未发生显著溶血和凝血现象,表明培化西海马肽注射液未引起溶血和凝血现象。试验例二、一般药理、局部刺激性研究表7实施例3制备的培化西海马肽注射液药理研究总结试验二表明本发明制备的培化西海马肽注射液安全性,未对神经、心血管、呼吸系统和皮下组织产生过敏反应。试验例三、猕猴单次皮下或静脉注射培化西海马肽后的药代及药效动力学研究猕猴单次皮下注射实施例3制备的培化西海马肽(100,500和1500皮g.kg-1,低、中、高剂量),各剂量组之间,末端相半衰期t1/2随剂量增加而延长,全身清除率cl随剂量增加而逐渐减慢,提示在100~1500减g.kg-1范围内,药物在猕猴体内呈非线性药代动力学特征。猕猴静脉注射100脉g.kg-1实施例3制备的培化西海马肽后2分钟血清抗原浓度达到最高10081.5±999.5ng.ml-1,随后逐渐消除,给药后72小时,血清抗原浓度降至本底水平。auc(0-t)为19835±758.6(ng·h)ml-1,(p<0.001vssc100μg.kg-1),auc(0-∞)为207020±758.6(ng·h)ml-1(p<0.001vssc100μg.kg-1),与等剂量sc组相比有显著性统计学意义差别。末端相半衰期t1/2β为17.4±0.6h,与sc100μg.kg-1给药相比均有统计学意义差别(p<0.01),全身清除率cl为5.0±0.2ml.h-1.kg-1。表7猕猴皮下和静脉单次给药药代动力学数据药效动力学研究表明,培化西海马肽剂量依赖性地增加猕猴血红蛋白水平,皮下注射100和500赖g.kg-1剂量组在第14天的血红蛋白增长值分别为1.9和2.3g/dl,1500μg.kg-1组血红蛋白的最大值出现在第24天,增长幅度为3.4g/dl,至45天时还未降至给药前水平,呈现明显的长效效应;静脉注射100未g.kg-1剂量组在第14天的血红蛋白(hgb)增长值为3.2g/dl。与给药前相比,培化西海马肽剂量依赖性地刺激网织红细胞(ret)的合成,皮下注射100和500g.kg-1剂量组在第6天的网织红细胞较给药前增加分别为527%和796%,1500μg.kg-1组网织红细胞最大值出现在第9天,较给药前增加1240%,3个剂量组至45天时均未降至给药前水平,呈现明显的长效效应;静脉注射100μg.kg-1剂量组在第6天的网织红细胞较给药前增加716%,见附图1~4。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1