使用禁食模仿饮食来增强抗雌激素在癌症治疗中的疗效的制作方法
本发明涉及制药工业的技术领域。
特别地,本发明涉及具有抗雌激素活性的化合物,包括选择性雌激素受体调节剂(serms)、选择性雌激素受体下调剂(serds)和芳香酶抑制剂(ais),用在与限定的饮食方案相结合的乳腺癌(bc)和其他雌激素敏感的癌症的治疗中。
背景技术
在美国,每年有超过200000名女性罹患乳腺癌[1]。所有乳腺癌中约70%表达雌激素受体(er)。治疗这些癌症的常用疗法要么直接通过serms(例如,他莫昔芬)和serds(氟维司琼)靶向作用于er,要么通过卵巢切除或通过ais来降低内源性雌激素水平。然而,激素疗法耐受性的出现仍然是一个主要问题,因为尽管具有最初的疗效,但患有转移性、er阳性的女性中的40%发生进一步进展[2]、[3]。内分泌抗性与多种机制有关,包括er信号通路的组分的失调、细胞周期和促存活信号分子的改变以及生长促进信号级联反应的激活(例如磷脂酰肌醇3-激酶(pi3k)/akt/哺乳动物雷帕霉素靶点(mtor))[2]、[4]。
一些策略已经实现了改善激素疗法在bc中的效果和/或一旦出现抗性就恢复这些激素药物的活性。
已经显示mtor的抑制在实验和临床上均显示出对激素疗法的敏感性的恢复,并且甾体ai依西美坦(exemestane)与依维莫司(everolimus)(一种mtor抑制剂)的组合现已获得fda批准用于在用来曲唑(letrozole)或阿纳托唑(anastrozole)治疗之后具有转移性的er阳性bc复发或发展的患者(nccn指南版本3.2015)[5]。最近,在一线疗法中,将cdk4/6抑制剂帕博西尼(palbociclib)添加到ai来曲唑中也已证明是成功的,导致药物获批[6]。然而,尽管取得了这一进展,但是仍然迫切需要确定安全且成本有效的方法,以提高激素疗法在er阳性的bc中的有效性,避免或至少延迟耐受性的发生。
最近的研究表明,使用短期禁食或禁食模拟饮食会使癌细胞对以下抗肿瘤治疗敏感化:化疗药物,酪氨酸激酶抑制剂和放疗[7]、[8]、[9]、[10]。已经在体外和体内记录了这种敏化效应。在后一种情况下,该效应是通过饥饿(仅水)或借助于特别设计的低热量饮食(禁食模拟饮食)获得的。
这种禁食或禁食模式饮食增强抗肿瘤药物活性的能力本质上反映了恶性细胞不能适应营养素缺乏,主要由于生长促进信号级联反应的异常激活(反过来由癌基因突变引起,例如ras、her2、egfr和akt,或肿瘤抑制因子的突变引起,例如pten),以及由于响应癌细胞饥饿而增加的p53激活(通过减轻p53本身的rev1的抑制作用)[11]。
反之亦然,未转变的组织保持不受影响,或者甚至可能通过恢复到自我保护模式而从禁食或禁食模拟饮食中获益,该自我保护模式的特征在于细胞生长减少、去乙酰化酶(sirtuin)活性提高和自噬激活,从而变得更耐受基因毒性压力并能够耐受剂量的化疗药物,否则会对非饥饿细胞而言是致死的[12]、[13]、[14]、[15]。值得注意的是,禁食或禁食模拟饮食对提高常用的酪氨酸激酶抑制剂的活性也是有效的,这提示更加现代的、分子靶向的治疗可以通过与周期性的禁食或禁食模拟饮食的方案共同给药而受益[10]。
禁食或禁食模仿饮食提高在癌症细胞中化疗的疗效,同时保护健康细胞免受其毒性影响,这一发现最近引起了医生[16]和患者的强烈关注,目前一些先导试验正在探索在人类中将禁食或禁食模拟饮食与化疗相结合(包括在南加州大学诺里斯综合癌症中心、莱顿大学、热那亚大学和柏林夏洛特大学进行的研究(nct01304251,nct01175837,nct00936364,nct01175837,nct01802346,nct02126449)。这些研究一致证实了safdie等的研究结果[17],表明化疗期间的饥饿耐受良好并且几乎没有副作用。此外,禁食或禁食模拟饮食的循环已被证明可以保护骨髓细胞免受化疗毒性的影响,同时也可以促进由环磷酰胺治疗杀死的祖细胞和免疫细胞基于干细胞的再生[18]。
然而,对于禁食(或减少的热量饮食)可能对基于具有抗雌激素活性的化合物的抗癌疗法的功效所产生的影响并没有可靠的预测。表述“具有抗雌激素活性的化合物”是指以下化合物:serms、serds和ais。
由于这些原因,申请人进行的研究集中在研究饥饿或减少的热量饮食与基于具有抗雌激素活性的化合物的抗癌疗法之间可能的相互作用。
技术实现要素:
在一个方面,本发明涉及一种具有抗雌激素活性的化合物,其用在治疗人类患者的bc或其他雌激素反应性肿瘤和癌症的方法中,其中,该方法包括使所述患者在用具有抗雌激素活性的化合进行治疗,同时使所述患者在24-190小时的时间段内接受减少的热量摄入。
上述具有抗雌激素活性的化合物优选地选自由serms、serds和ai组成的组。
通过减少的热量摄入,其意味着相对于常规热量摄入,每日热量摄入减少10-100%,优选减少50-100%,更优选减少75-100%,包括完全饥饿。
受试者的常规热量摄入量是指受试者为了维持他/她的体重而消耗的千卡数。受试者的正常热量摄入可以通过采访受试者或通过考虑受试者的体重来估计。作为一个粗略的指导,男性受试者的正常热量摄入量平均为2600kcal/天,女性为1850kcal/天。
优选地,当每日热量摄入减少10-85%时,给患者食用具有高含量的单不饱和脂肪和多不饱和脂肪以及减少含量的蛋白质和糖的食物(≥40%的热量来自脂肪)。这是因为基于这些食物的饮食具有类似于饥饿的有益效果[13]。
优选地,所述减少的热量摄入的时间段为48至150小时,最优选为约120小时。
在可以在本发明使用的serms中,以下药物被提及:他莫昔芬(tamoxifen)、雷洛昔芬(raloxifene)、托瑞米芬(toremifene)、拉索昔芬(lasofoxifene)、奥培米芬(ospemifene)、阿佐昔芬(arzoxifene)、巴西多昔芬(bazedoxifene)。
在可以用于本发明的serds中,以下药物被提及:氟维司琼(fulvestrant)、ru58668、gw7604、gdc-0810、azd9496、pipendoxifene、阿考比芬(acolbifene),op-1074((2s)-3-(4-羟基苯基)-4-甲基-2-(4-{2-[(3r)-3-甲基吡咯烷-1-基]乙氧基}苯基)-2h-色烯-7-醇)。
在可以用于本发明的ai中,以下药物被提及:阿纳托唑(anastrozole)、依西美坦(exemestane)、来曲唑(letrozole)、伏氯唑(vorozole)、福美司坦(formestane)、法倔唑(fadrozole)。
如本文所用,“癌症”是指以不受控制的细胞分裂并且这些细胞通过侵入直接生长到邻近组织中或通过转移植入远端部位而扩散的能力为特征的疾病或障碍。本发明聚焦于bc的治疗,特别是er阳性的bc,但其适用于所有雌激素反应性的肿瘤和癌症。
上述同时给予患者具有抗雌激素活性的化合物的减少的热量摄入的时间段可以在5-60天的相应时间段后重复一次或多次,在5-60天的相应时间段期间,患者遵循常规热量摄入的饮食的同时被给予抗雌激素化合物。
上述减少的热量摄入方案优选相当于低于800kcal/天,更优选低于400kcal/天。
这种减少的热量摄入可以通过具有减少的热量、糖和蛋白质含量而不含有相对高水平的不饱和“有益脂肪”和所有必需的微量营养素的饮食事物而获得,以防止营养不良。
在另一个方面,本发明涉及一种如上定义的具有抗雌激素活性的化合物,用在人类患者bc治疗中,其中,人类患者在使用具有抗雌激素的活性的化合物进行治疗的同时还附加地使用化学治疗剂进行治疗,该化学治疗剂优选地选自紫杉烷类(taxanes),优选多西他赛(docetaxel)和紫杉醇(paclitaxel)、环磷酰胺(cyclophosphamide)、甲氨蝶呤(methotrexate)、5-氟尿嘧啶(5-fluorouracil)、吉西他滨(gemcitabine)、长春瑞滨(vinorelbine)、卡铂(carboplatin)、顺铂(cisplatin)、表柔比星(epirubicin)和多柔比星(doxorubicin)。
另一方面,本发明涉及一种药物组合物,包括如上定义的具有抗雌激素活性的化合物和药学上可接受的载体,用在如上定义的患者的bc治疗和其它雌激素依赖性肿瘤和癌症治疗的方法中。
根据本发明的药物组合物可以进一步包含化学治疗剂,其优选地选自紫杉烷类,优选多西他赛和紫杉醇、环磷酰胺、甲氨蝶呤、5-氟尿嘧啶、吉西他滨、长春瑞滨、卡铂、顺铂、表柔比星和多柔比星。
另一方面,本发明还涉及一种使用具有抗雌激素活性的化合物治疗对雌激素有反应的bc细胞或肿瘤细胞的方法,包括:
在减小的血清或葡萄糖浓度的培养基中培养对雌激素有反应的bc细胞或肿瘤细胞;以及
用具有抗雌激素活性的化合物治疗癌细胞。
培养基中的血清浓度优选降低10-90%,并且培养基中的葡萄糖浓度优选降低20-90%。
从以下各章节报告的实验结果可清楚看出的是,出乎意料地发现,饥饿、特别是sts以及经过24-72小时时间段的减少的热量摄入,对同时采用具有抗雌激素活性的化合物进行抗癌治疗的抗癌效果有积极的影响。
当上述减少的热量摄入的时间段被常规热量摄入的相应的时间段取代时,也可获得对采用具有抗雌激素活性的化合物的同时抗癌治疗效果的积极影响,在此期间,患者仅食用上述提到的具有高含量的单不饱和脂肪和多不饱和脂肪以及减少含量的蛋白质和糖(≥40%的热量来自脂肪)的食物,因为基于此类食物的饮食具有与饥饿相似的有益效果[10]。
在其一个方面,本发明因此还涉及一种具有抗雌激素活性的化合物,用在治疗人类患者的癌症的方法中,其中,该方法包括让所述患者食用仅使用具有高含量的单不饱和脂肪和多不饱和脂肪以及减少含量的蛋白质和碳水化合物(≥40%的热量来自脂肪)的食物持续24-190小时,所述食物的量能够确保常规的每日热量射入,同时用所述具有抗雌激素活性的化合物对所述患者进行治疗。
与先前已知的将sts与化疗或放疗相关联、通常需要给予皮质类固醇以对抗化疗和放疗引起的副作用(即恶心)和过敏反应的治疗所发生的情况不同,根据本发明的方法本发明不需要给予皮质类固醇,因为具有抗雌激素活性的化合物不显示化疗或放疗的严重副作用。
与上述已知的治疗方法相比,这是一个非常显著的优势,因为对肿瘤细胞的反应有益的对饥饿的代谢适应(例如低血糖,低igf-1和胰岛素血浆水平)不会由伴随的皮质类固醇激素的给予而被阻止或阻碍。
此外,关于上述策略,一旦通过给予mtor抑制剂(例如依托莫司)或cdk4/6抑制剂(例如帕博西尼)而出现抗性,该策略就改善在bc中激素治疗的效果和/或恢复这些激素药物的活性,本发明提出的治疗实现了相同的效果,同时耐受良好并且没有严重的副作用。由此提出的治疗甚至能够潜在地降低激素疗法本身的副作用并能够促进再生作用,而依维莫司和帕博西尼均可引起显著的副作用,例如在依维莫司的情况下会引起口腔炎、贫血和高血糖[5],在帕博西尼的情况下会引用中性粒细胞减少和肺血栓栓塞[6]。
根据本发明的化合物和组合物可以采用任何可用且有效的递送系统进行给药,包括但不限于以含有常规的、药学上可接受的和无毒的载体、佐剂和赋形剂的剂量单位制剂的口服、口腔、肠胃外、吸入途径、局部施用、通过注射、通过透皮或直肠途径(例如,通过栓剂)。通过肠胃外途径给药包括皮下、静脉内、肌内、胸骨内注射或输液技术。
用于通过口服途径给药的固体剂型包括例如胶囊、片剂、粉剂、颗粒剂和凝胶剂。在这种固体剂型中,活性化合物可以与至少一种惰性稀释剂混合,例如蔗糖、乳糖或淀粉。这些剂型通常还包含不同于惰性稀释剂的附加物质,例如润滑剂如硬脂酸镁。
可注射的制剂,例如水性或油性无菌可注射溶液或悬浮液,可以根据已知的技术和通过任选地使用适当的分散剂、湿润和/或助悬剂进行配制。
根据本发明的药物制剂可以通过使用常规的制药技术来制备,如本领域的各种药典或手册中所述,例如“remington′spharmaceuticalscienceshandbook”,mackpublishing,newyork,18thed.,1990。
根据本发明的化合物的平均日剂量取决于许多因素,例如疾病的严重性和患者的状况(年龄、体重、性别):剂量通常可以从每天1mg至1500mg的根据本发明的化合物,任选地分成更多次给药。
将参考附图和某些实施例进一步描述本发明,这些实施例在下文中通过说明而非限制的方式提供。
附图说明
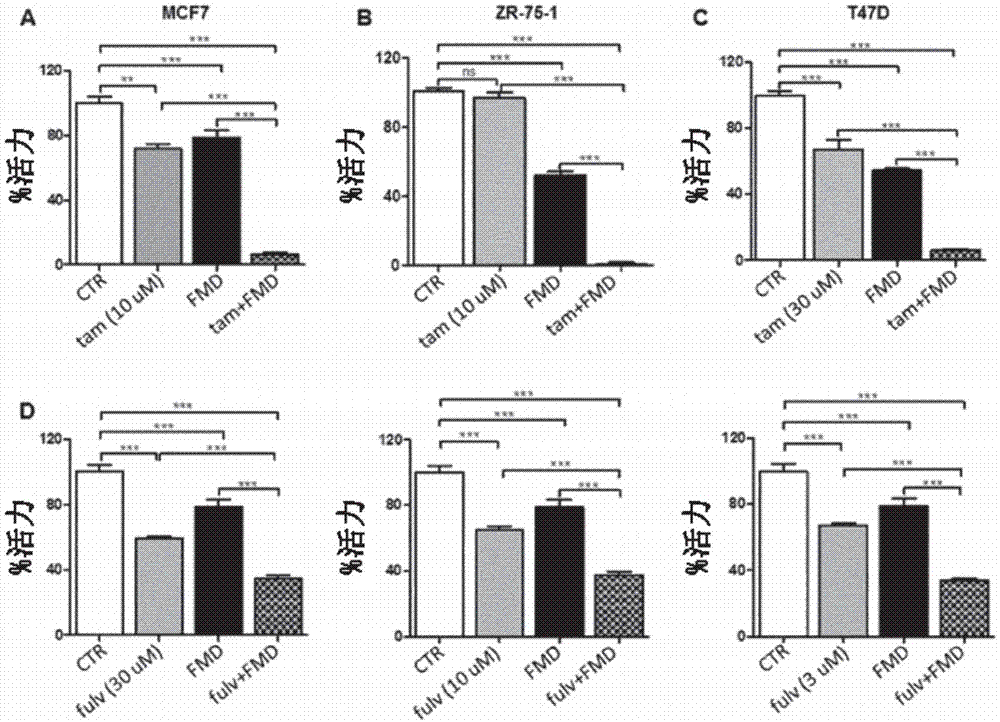
图1a为示出了禁食模拟条件(重建血液中禁食的代谢结果的条件)或禁食模拟饮食(1%胎牛血清和50mg/dl葡萄糖-fmd)、他莫昔芬以及fmd+他莫昔芬对er阳性bc细胞mcf7的活力的各自影响的直方图。
图1b为示出了禁食模拟条件或禁食模拟饮食(1%胎牛血清和50mg/dl葡萄糖-fmd)、他莫昔芬和fmd+他莫昔芬对er-阳性bc细胞zr-75-1的活力的各自影响的直方图。
图1c为示出了禁食模拟条件或禁食模拟饮食(1%胎牛血清和50mg/dl葡萄糖-fmd)、他莫昔芬和fmd+他莫昔芬对er阳性bc细胞t47d的活力的各自影响的直方图。
图1d包括显示了在三种不同浓度的氟维司琼下禁食模拟条件或禁食模拟饮食(1%胎牛血清和50mg/dl葡萄糖-fmd)、氟维司琼和fmd+氟维司琼分别对er阳性bc细胞mcf7的活力的影响的三个直方图。
图2a是显示禁食模拟条件或禁食模拟饮食(1%胎牛血清和50mg/dl葡萄糖-fmd)、他莫昔芬和fmd+他莫昔芬对mcf7细胞中的g1细胞周期阻滞的诱导的各自影响的直方图。
图2b是显示禁食模拟条件或禁食模拟饮食(1%胎牛血清和50mg/dl葡萄糖-fmd)、他莫昔芬和fmd+他莫昔芬对zr-75-1细胞中的细胞g1循环阻滞的诱导的各自影响的直方图。
图2c是显示禁食模拟条件或禁食模拟饮食(1%胎牛血清和50mg/dl葡萄糖-fmd)、他莫昔芬和fmd+他莫昔芬t47d细胞中的g1细胞周期循环阻滞的各自影响的直方图。
图2d包括三个显示禁食模拟条件或禁食模拟饮食(1%胎牛血清和50mg/dl葡萄糖-fmd)、他莫昔芬和fmd+他莫昔芬对mcf7,zr-75-1和t47d细胞中的e2f1、e2f2、ccne1基因表达的各自影响的直方图。
图3是显示了来自分别接受禁食模拟条件或禁食模拟饮食(1%胎牛血清和50毫克/分升葡萄糖-fmd)、采用他莫昔芬治疗、以及fmd+他莫昔芬治疗的mcf7、zr-75-1和t47d细胞的细胞裂解物中总的和磷酸化的p70s6k(thr389,总的和磷酸化的4e-bp1、磷酸化的elf4e(ser209))和β-肌动蛋白的水平的免疫印迹。
图4a是显示来自分别接受禁食模拟条件或禁食模拟饮食(1%胎牛血清和50mg/dl葡萄糖-fmd)、他莫昔芬(5μm)治疗以及fmd+他莫昔芬(5μm)治疗的mcf7、zr-75-1和t47d细胞的细胞裂解物中的erα和β-肌动蛋白水平的免疫印迹。
图4b包括显示通过qpcr测定的禁食模拟条件或禁食模拟饮食(1%胎牛血清和50mg/dl葡萄糖-fmd)、他莫昔芬和fmd+他莫昔芬对mcf7,zr-75-1和t47d细胞中的ttf1基因表达的各自影响的直方图。
图5是报告基于禁食模拟条件或禁食模拟饮食(1%胎牛血清和50mg/dl葡萄糖-fmd)之间的差异表达基因(deg)与mcf7细胞中的载体的途径分析的表格。
图6a包括显示通过qpcr测定的禁食模拟条件或禁食模拟饮食(1%胎牛血清和50mg/dl葡萄糖-fmd)、他莫昔芬和fmd+他莫昔芬对mcf7、zr-75-1和t47d细胞中的rad51基因表达的各自影响的三个直方图。
图6b是显示来自分别接受禁食模拟条件或禁食模拟饮食(1%胎牛血清和50mg/dl的葡萄糖-fmd)、他莫昔芬(5μm)治疗,以及fmd+他莫昔芬(5μm)治疗的mcf7、zr-75-1和t47d细胞的细胞裂解物中rad51和β-肌动蛋白水平的免疫印迹。
图7包括两个直方图,示出了:
1)禁食模拟条件或禁食模拟饮食(1%胎牛血清和50mg/dl葡萄糖-fmd)、他莫昔芬(5μm)、fmd+他莫昔芬(5μm)、他莫昔芬5um+多柔比星100nm、fmd+多柔比星100nm以及fmd+他莫昔芬5μm+多柔比星100nm对er阳性bc细胞mcf7的活力的各自影响;
2)禁食模拟条件或禁食模拟饮食(1%胎牛血清和50mg/dl葡萄糖-fmd)、他莫昔芬(5μm)、fmd+他莫昔芬(5μm)、他莫昔芬5μm+泰索帝100nm、fmd+泰索帝100nm、fmd+他莫昔芬5μm+泰索帝100nm对er阳性bc细胞mcf7的活力的各自影响。
图8a为显示在皮下放置雌二醇颗粒和注射mcf7细胞后在balb/c无胸腺小鼠(nu+,nu+)中发展的肿瘤体积的示意图,其中小鼠经受禁食、他莫昔芬治疗和他莫昔芬+禁食治疗。
图8b是显示在皮下放置雌二醇颗粒和注射mcf7细胞后在balb/c无胸腺小鼠(nu+,nu+)中发展的肿瘤体积的示意图,其中小鼠接受禁食、氟维司琼治疗和氟维司琼+禁食治疗。
图8c示出了来自图8a实验的小鼠体重。
图8d示出了来自图8b实验的小鼠体重。
具体实施方式
申请人实施了几个实验,以评估禁食模拟条件或禁食模拟饮食(1%胎牛血清和50mg/dl葡萄糖-fmd)是否使细胞bc对他莫昔芬以及对氟维司琼敏感。实际上,在所有测试的er阳性bc的细胞模型(mcf7、zr-75-1、t47d)中检测到fmd条件下他莫昔芬活性强烈增强(图1a-c)。类似地,可以明显地看出氟维司琼的抗增殖作用在mcf7细胞中显著增加(图1d)。
特别地,在图1a-d的实验中,将3×103mcf7(a,d)、zr-75-1(b)或t47d(c)细胞接种在含有10%fbs的常规dmem培养基的96孔板中。24小时后,除去细胞培养基,将细胞在相同培养基(ctr)或含有1%fbs(fmd)的低葡萄糖(0.5g/l)dmem培养基中培养24小时。24小时后,将指定浓度的他莫昔芬(tam)或氟维司琼(fulv)加到培养基中。
随后的实验旨在确定由禁食模拟条件或禁食模拟饮食(fmd)引起的在bc细胞系中他莫昔芬活性和氟维司琼活性增强的内在机制。这些实验表明,fmd条件本质上提高了他莫昔芬和氟维司琼诱导g1细胞周期阻滞的能力(图2a-c)。
有趣的是,这与rb磷酸化(ser780,未示出)和细胞周期促进基因(e2f1、e2f2和ccne1)下调的减少相关,其对禁食模拟条件或禁食模拟饮食(fmd)结合他莫昔芬的反应比单一治疗的反应(在所有细胞系中观察到的效果)更加明显(图2d)。
特别地,在图2a-d的实验中,将5×105mcf7、zr-75-1或t47d细胞接种在含有10%fbs的常规dmem培养基中的6孔板中。24小时后,除去细胞培养基,将细胞在相同培养基(ctr)或者在禁食模拟条件下或禁食模拟饮食(fmd)中培养24小时。24小时后,将10μm他莫昔芬(tam)加入到所述的培养基中。24小时后,将细胞用于细胞周期分析或用于mrna提取并且随后通过qpcr测定e2f1、e2f4和ccne1表达。
在t47d细胞中,细胞周期阻滞和e2f1、e2f2和ccne1下调仅发生在针对禁食模拟条件或禁食模拟饮食加上他莫昔芬的联合治疗的反应中。因此,这些结果清楚地表明,禁食或禁食模拟饮食具有提高激素疗法阻断er阳性细胞系中增殖能力的潜力。
申请人随后研究了他莫昔芬、禁食模拟条件或禁食模拟饮食及它们的组合对细胞信号传导的影响,考虑到在bc中对激素疗法具有抗性,特别关注了pi3k-mtor途径[2],[5]。
在此,有趣的是,观察到他莫昔芬与禁食模拟条件或禁食模拟饮食(fmd)的组合导致mtor活性的显著抑制,正如通过mcf7、zr-75-1和t47d中磷酸化的p70s6k和eif4e降低的水平所检测到的(图3)。
在图3的实验中,如图2的实验中那样处理mcf7、zr-75-1和t47d细胞。在他莫昔芬(5μm)添加后24小时,细胞用于蛋白质裂解物生成通过免疫印迹检测总的和磷酸化的p70s6k(thr389)、总的和磷酸化的4e-bp1、磷酸化的eif4e(ser209),her2和β-肌动蛋白。
在4e-bp1(mrna翻译的阻遏物通常由mtor磷酸化,随后4e-bp1从eif4e解离并激活帽依赖性的mrna翻译)的情况下,检测到响应于在所有er阳性细胞系中他莫昔芬和禁食模拟条件或禁食模拟饮食(fmd)的组合的未磷酸化形式的显著积累,这再次与受损的mtor信号传导一致。
总体而言,这些发现表明蛋白质翻译中的阻断可能有助于联合的他莫昔芬和禁食模拟条件或禁食模拟饮食(fmd)的强抗癌活性。
在随后的实验中,还评估了在他莫昔芬中加入禁食模拟条件或禁食模拟饮食(fmd)是否影响her2的表达,其上调暗示对bc中的激素疗法的抵抗机制[2]。
值得注意的是,在三种bc细胞系的两种(zr-75-1和t47d)中,禁食模拟条件或禁食模拟饮食(fmd)当与他莫昔芬联合应用时导致her2表达显著降低(图3)。由于her2信号传导有助于er阳性的bc细胞抵抗激素疗法,因此禁食模拟条件或禁食模拟饮食(fmd)的这种效应可能有助于增强bc细胞对激素疗法本身的敏感性[2]。
对erα表达和era介导的转录(ttf1表达的qpcr检测)的研究表明,禁食模拟条件或禁食模拟饮食(fmd)可降低erα水平,并一致地提高他莫昔芬降低ttf1表达的能力(图4)。
在图4的实验中,如图2的实验中那样处理mcf7、zr-75-1或t47d细胞。在加入他莫昔芬(5μm)后24小时,将细胞用于蛋白质裂解物生成或用于mrna提取,通过免疫印迹检测er和β-肌动蛋白。通过qpcr测定ttf1表达。
为了获得通过禁食模拟条件或禁食模拟饮食(fmd)来增强他莫昔芬活性的内在机制的进一步的见解,他莫昔芬、禁食模拟条件或禁食模拟饮食(fmd)以及它们的组合在整体基因表达上对mcf7细胞的影响,如通过标准基因表达微阵列检测到的,进行比较(数据由4个独立的生物学重复/条件而外推)。根据差异表达基因的基因本体论(go)分析,似乎禁食模拟条件或禁食模拟饮食(fmd)及其与他莫昔芬的组合而诱导的基因表达变化相似,包括对细胞周期、dna复制、dna解旋、有丝分裂g1-g1/s期途径的类似影响。然而,引人注目的是,禁食模拟条件或禁食模拟饮食(fmd)加到他莫昔芬中导致与dna修复相关的途径发生显著变化,这些变化在仅暴露于禁食模拟条件或禁食模仿饮食(fmd)或显露于单独的他莫昔芬的细胞中不存在(图5)。
rad51(log2倍数变化:-1.864),pcna(log2倍数变化:-1.658),tipin(log2倍数变化:-1.604),exo1(log2倍数变化:-1.583)和brca1(log2倍数变化:-1.372)这些基因来自这些途径,它们被发现在用他莫昔芬和禁食模拟条件或禁食模拟饮食(fmd)治疗的mcf7中被最高程度地下调。作为对这些数据的验证,在mrna和蛋白质水平上,响应于他莫昔芬加上mcf7、zr-75-1和t47d细胞中的禁食模拟条件或禁食模拟饮食(fmd)的强烈rad51下调都很容易得到验证(图6a,b)。
在图6的实验中,如图2的实验中那样处理mcf7、zr-75-1或t47d细胞。在加入他莫昔芬(5μm)后的24小时,将细胞用于rna提取或用于蛋白质裂解物的生成。在图6a中,通过qpcr检测rad51表达。在图6b中,通过免疫印迹检测rad51和β-肌动蛋白。
在采用结合氟维司琼和禁食条件模拟或禁食模拟饮食(fmd)治疗的mcf7细胞中观察到类似的rad51下调(未示出数据)。有趣的是,ingenuitypathwayanalysis(ipa)显示,作为一种极有可能介导在以结合他莫昔芬和禁食模拟条件或禁食模拟饮食(fmd)治疗的bc细胞基因表达谱中的这些变化的转录因子(受到这些结合另一种刺激物的抑制),foxm1,参与细胞周期进程、染色体分离和基因组稳定性的原癌基因[19]。
基于来自基因表达微阵列的数据,表明采用他莫昔芬加上禁食模拟条件或禁食模拟饮食(fmd)治疗的bc的dna修复能力受损,研究了在这些条件下mcf7细胞是否对化疗药物变得更加敏感。具体地,测试了两种常用于治疗bc的药物:泰索帝(多西他赛)和多柔比星。事实上,正如在短期活力测定(72h)中检测到的那样,三联治疗(他莫昔芬加多柔比星,或泰索帝加禁食模拟条件或禁食模拟饮食(fmd))是实现最明显的细胞活力降低的一种方法(图7)。
在图7的实验中,将5×103mcf7细胞/孔接种到含有10%fbs的常规dmem培养基中的96孔板中。24小时后,除去细胞培养基,将细胞在相同培养基中或在含有1%fbs的低葡萄糖(0.5g/l)dmem培养基(禁食模拟条件)中培养24小时。24小时后,将10μm他莫昔芬(tam)加入到所示的培养基中。24小时后,用指定浓度的多柔比星或泰索帝刺激细胞。72小时后在磺酰罗丹明b测定中测定活力。
基于这些数据,在mcf7异种移植物中进行初始概念验证(poc)实验以确定短期禁食(48小时,仅水,每周一次)本身是否具有抗癌活性,最重要的是,它们是否会增强他莫昔芬和体内氟维司琼的活性。
与体外数据一致,他莫昔芬和禁食周期都减少了mcf7异种移植物的生长(图8a,b)。然而,当组合在一起时,这两种治疗比单独的任一种治疗明显更有效。
在图8a-d的实验中,皮下放置雌二醇颗粒24小时后,六到八周龄的balb/c无胸腺小鼠(nu+/nu+)皮下注射5×106个mcf7细胞。当肿瘤变得可触知时,将小鼠随机分配到六个组中的一个(每个治疗组六只小鼠):对照(正常饮食);他莫昔芬(正常饮食结合他莫昔芬,30mg/kg/餐;口服管饲法);氟维司琼(正常饮食结合氟维司琼,30mg/kg的每周一次;皮下注射);禁食(仅水,48小时);禁食+他莫昔芬;禁食+氟维司琼。每天监测肿瘤大小(a,b)和小鼠体重(c,d)。*:p<0.05。
所有治疗均耐受良好,尽管禁食确实导致小鼠显著的体重减轻(图8c,d),但是动物在一个治疗周期和下一个治疗周期之间完全恢复了其体重,并且他莫昔芬加到禁食中未能使体重减轻加重。
总体而言,上述实验结果清楚地证明了禁食或禁食模拟饮食提高通常使用的bc激素疗法的活性、下调bc细胞中的erα并抵抗几种已知的激素疗法抗性机制的能力。此外,它们清楚地证明了如何将激素疗法与禁食或禁食模拟饮食引起的代谢条件相结合导致癌细胞dna修复器官的严重损害,使其对化疗药物敏感化。
因此,通过禁食或通过禁食模拟饮食的减少的热量摄入代表了一种新的方法,该方法可增加激素疗法的活性、避免(或至少显著延迟)对这些药物的耐受性并且在采用或不采用化学治疗的情况下同时应用激素疗法时可能用于预防肿瘤再生长或完全根除肿瘤细胞。
参考文献:
[1]desantisce,fedewasa,godingsauera,kramerjl,smithra,jemala.breastcancerstatistics,2015:convergenceofincidenceratesbetweenblackandwhitewomen.ca:acancerjournalforclinicians,20l6;66:31-42.
[2]osborneck,schiffr.mechanismsofendocrineresistanceinbreastcancer.annualreviewofmedicine,2011;62:233-47.
[3]rahap,thomass,thurnkt,parkj,munsterpn.combinedhistonedeacetylaseinhibitionandtamoxifeninducesapoptosisintamoxifen-resistantbreastcancermodels,byreversingbcl-2overexpression.breastcancerresearch:bcr,2015;17:26.
[4]creightoncj,fux,hennessybt,casaaj,zhangy,gonzalez-anguloam,llucha,grayjw,brownph,hilsenbecksg,osborneck,millsgb,leeav,schiffr.proteomicandtranscriptomicprofilingrevealsalinkbetweenthepi3kpathwayandlowerestrogen-receptor(er)levelsandactivityiner+breastcancer.breastcancerresearch:bcr,2010;12:r40.
[5]baselgaj,camponem,piccartm,burrisha,3rd,rugohs,sahmoudt,noguchis,gnantm,pritchardki,lebrunf,beckjt,itoy,yardleyd,deleui,pereza,bachelott,vittoril,xuz,mukhopadhyayp,lebwohld,hortobagyign.everolimusinpostmenopausalhormone-receptor-positiveadvancedbreastcancer.thenewenglandjournalofmedicine,2012;366:520-9.
[6]finnrs,crownjp,langi,boerk,bondarenkoim,kulykso,ettlj,patelr,pintert,schmidtm,shparyky,thummalaar,voytkonl,fowstc,huangx,kimst,randolphs,slamondj.thecyclin-dependentkinase4/6inhibitorpalbociclibincombinationwithletrozoleversusletrozolealoneasfirst-linetreatmentofocstrogenreceptor-positive,her2-negative,advancedbreastcancer(paloma-1/trio-18):arandomisedphase2study.thelancet.oncology,2015;16:25-35.
[7]leec,raffaghellol,brandhorsts,safdiefm,bianchig,martin-montalvoa,pistoiav,weim,hwangs,merlinoa,emionitel,decabor,longovd.fastingcyclesretardgrowthoftumorsandsensitizearangeofcancercelltypestochemotherapy.sciencetranslationalmedicine,2012;4:124ra27.
[8]safdief,brandhorsts,weim,wangw,leec,hwangs,contips,chentc,longovd.fastingenhancestheresponseofgliomatochemo-andradiotherapy.plosone,2012;7:e44603.
[9]shiy,felley-boscoe,martitm,orlowskik,pruschym,stahelra.starvation-inducedactivationofatm/chk2/p53signalingsensitizescancercellstocisplatin.bmccancer,2012;12:571.
[10]caffai,d′agostinov,damontep,soncinid,ceam,monacellif,odettip,ballestreroa,provenzania,longovd,nencionia.fastingpotentiatestheanticanceractivityoftyrosinekinaseinhibitorsbystrengtheningmapksignalinginhibition.oncotarget,2015;6:11820-32.
[11]shimhs,weim,brandhorsts,longovd.starvationpromotesrev1sumoylationandp53-dependentsensitizationofmelanomaandbreastcancercells.cancerresearch,2015;75:1056-67.
[12]raffaghellol,leec,safdiefm,weim,madiaf,bianchig,longovd.starvation-dependentdifferentialstressresistanceprotectsnormalbutnotcancercellsagainsthigh-dosechemotherapy.proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica,2008;105:8215-20.
[13]brandhorsts,weim,hwangs,morgante,longovd.short-termcalorieandproteinrestrictionprovidepartialprotectionfromchemotoxicitybutdonotdelaygliomaprogression.experimentalgerontology,2013;48:1120-8.
[14]yangh,yangt,baurja,pereze,matsuit,carmonajj,lammingdw,souza-pintonc,bohrva,rosenzweiga,decabor,sauveaa,sinclairda.nutrient-sensitivemitochondrialnad+levelsdictatecellsurvival.cell,2007;130:1095-107.
[15]leec,safdiefm,raffaghellol,weim,madiaf,parrellae,hwangd,cohenp,bianchig,longovd.reducedlevelsofigf-imediatedifferentialprotectionofnormalandcancercellsinresponsetofastingandimprovechcmotherapeuticindex.cancerreseareh,2010;70:1564-72.
[16]lavianoa,rossifanellif.toxicityinchcmothcrapy-whenlessismore.thenewenglandjournalofmedicine,2012;366:2319-20.
[17]safdiefm,dorfft,quinnd,fontanal,weim,leec,cohenp,longovd.fastingandcancertreatmentinhumans:acaseseriesreport.aging,2009;1:988-1007.
[18]chengcw,adamsgb,perinl,weim,zhoux,lambs,dasaccos,mirisolam,quinndi,dorfftb,kopchickjj,longovd.prolongedfastingreducesigf-1/pkatopromotehematopoietic-stem-cell-basedregenerationandreverseimmunosuppression.cellstemcell,2014;14:810-23.
[19]zonas,bellal,burtonmj,nestaldemoraesg,lamew.foxm1:anemergingmasterregulatorofdnadamageresponseandgenotoxicagentresistance.biochimicaetbiophysicaacta,2014;1839:1316-22.
- 还没有人留言评论。精彩留言会获得点赞!