治疗或预防肝病的方法与流程
本申请要求2016年4月21日提交的题为“治疗或预防肝病的方法”的澳大利亚专利申请号2016901494的优先权以及2016年4月21日提交的题为“治疗或预防肝病的方法”的澳大利亚专利申请号2016901483的优先权。其全部内容通过引用并入本文。
序列表
本申请与电子格式的序列表一同提交。该序列表的全部内容通过引用纳入本文。
本申请涉及治疗或预防肝病的方法。
介绍
以肝脏脂肪堆积为特征的疾病在工业化国家的成人和儿童中正变得越来越普遍,这绝大部分归因于不健康的饮食习惯和肥胖症。由长期过量饮酒所导致的酒精性脂肪肝病(afld)基本上遵循涉及如下的病理过程:脂肪变性、脂肪性肝炎(ash)、炎症、肝硬化,以及在某些情况下,肝细胞癌。非酒精性脂肪肝病(nafld)被认为是最常见的肝脏疾病,该术语包括一系列与afld相似的肝脏病变,这些病变按照严重程度依次为肝脂肪变性(脂肪在肝脏堆积)、非酒精性脂肪性肝炎(nash)、肝硬化直至肝细胞癌。
据估计,约30%的美国人口受到nafld影响。该患病率在肥胖对象和罹患2型糖尿病的对象中提高至超过60%。nafld可以从肝脏脂肪变性逐渐恶化到nash,而nash的特征是以肝细胞损伤、炎性细胞浸润和/或纤维化为表现的肝损伤的发展。随后,nash可以发展成与肝细胞被瘢痕组织替代有关的肝硬化,并且在更晚期阶段发展成肝细胞癌。nafld被认为是引起肝硬化和肝衰竭的重要和常见原因。nafld还与心血管疾病风险提高有关。nafld被认为是代谢综合症的一部分。与代谢综合征中所见类似,患有nafld的个体中>80%超重,且其中约30%肥胖。此外,患有nafld的个体还常患有并发的高脂血症、2型糖尿病(t2dm),并有高血压。
目前尚无针对nafld的有效治疗方法,大多数治疗依赖于对相关疾病(如肥胖、糖尿病和高脂血症)的管理。nafld的其他疗法主要针对生活方式习惯,例如锻炼和饮食。旨在针对减轻体重和胰岛素抵抗的药理学干预效果有限。例如,对于二甲双胍和他汀类药物的研究表明这些药物在改善nafld或nash患者的肝脏组织学方面缺乏效果。
技术实现要素:
在本发明的形成中,发明人在被认可的nafld和nash模型中研究了抑制vegd-b的效果。发明人在高脂饮食或无胆碱高脂饮食喂养敲除小鼠中研究了抑制vegf-b表达的效果,由此证明了抑制该蛋白质的预防效果。发明人还将拮抗性抗体给予高脂饮食或无胆碱高脂饮食喂养小鼠以研究抑制该蛋白质的治疗效果。在所有情况下,vegf-b抑制均降低或防止肝脏中的脂质堆积,所有情况下均将脂质水平降低到或维持与对照相似的水平。因此,抑制vegf-b将脂质堆积降低到了正常或健康水平,而不是可能有害的低水平。抑制vegf-b还降低或防止肝脏炎症和nash的若干特征,包括肝细胞膨胀(nash的主要病理表现之一)、mallory-denk体(mdb)形成、炎症灶和卫星现象(satellitosis)。因此,发明人证明了他们能够预防或治疗nafld,并预防nash发展。很明显,这些方法还在预防肝硬化、肝纤维化和/或肝细胞癌中具有其他益处。
发明人的发现为通过抑制vegf-b信号转导来治疗或预防对象中的nafld或其并发症的方法提供了依据。例如,本公开提供一种治疗或预防对象中的nafld或其并发症的方法,所述方法包括给予该对象抑制vegf-b信号转导的化合物。
在一个实例中,nafld是肝脂肪变性,例如孤立性肝脂肪变性。
在一个实例中,nafld是nash。
在一个实例中,nafld是肝硬化。
在一个实例中,nafld是nash来源的肝硬化。
在一个实例中,nafld是nash相关的肝硬化。
在一个实例中,nafld是nash相关的肝纤维化。
在一个实例中,本公开提供一种预防或延迟患有nafld的对象中肝硬化发作的方法,所述方法包括给予该对象抑制vegf-b信号转导的化合物。
例如,该对象患有nash,且该方法预防或延迟肝硬化的发作。
在一个实例中,本公开提供一种延缓患有nafld的对象中肝硬化发展的方法,所述方法包括给予该对象抑制vegf-b信号转导的化合物。
在一个实例中,本公开提供一种延缓患有nafld的对象中的nafld发展为肝硬化的方法,所述方法包括给予该对象抑制vegf-b信号转导的化合物。
在一个实例中,nafld的并发症是肝细胞癌。
在一个实例中,肝细胞癌是nash来源的肝细胞癌。
在一个实例中,肝细胞癌是nash相关的肝细胞癌。
在一个实例中,本公开提供一种预防或延迟患有nafld的对象中肝细胞癌发作的方法,所述方法包括给予该对象抑制vegf-b信号转导的化合物。
例如,该对象患有nash,且该方法预防或延迟肝细胞癌的发作。
在一个实例中,本公开提供一种延缓患有nafld的对象中肝细胞癌发展的方法,所述方法包括给予该对象抑制vegf-b信号转导的化合物。
在一个实例中,本公开提供一种延缓患有nafld的对象中的nafld发展为肝细胞癌的方法,所述方法包括给予该对象抑制vegf-b信号转导的化合物。
在一个实例中,该对象患有nafld,且该方法治疗所述疾病。例如,该对象患有肝脂肪变性。例如,该对象患有nash。
在一个实例中,患有nafld的对象还超重或肥胖和/或患有糖尿病(例如2型糖尿病)和/或患有代谢综合症。
在一个实例中,本公开提供一种治疗或预防超重或肥胖对象中nafld或其并发症的方法,所述方法包括给予该对象抑制vegf-b信号转导的化合物。
在一个实例中,与给予化合物前该对象的体重相比,给予该化合物并未实质性或显著降低该对象的重量。
在一个实例中,该对象患有nafld(例如,如前所述),且该方法预防或延缓该疾病的发展。例如,该对象患有脂肪变性,且该方法延缓或防止nash发展。在另一实例中,该对象患有nash,且该方法延缓或防止肝硬化发展。
在一个实例中,该对象患有nafld(例如,如前所述),且该方法防止或降低发生nafld并发症的风险。例如,该对象患有nafld,且该方法防止肝细胞癌的发展或降低其风险。
在一个实例中,对象患nafld的诊断是基于一种或多种肝酶(例如丙氨酸氨基转移酶(alat)或天冬氨酸氨基转移酶(asat))血清水平的提高、肝脏超声检查或肝脏活检。
在一个实例中,该对象具有发展为nafld的风险,例如患有nafld的合并症。例如,该对象肥胖和/或患有糖尿病(例如2型糖尿病)和/或患有代谢综合症。
在一个实例中,化合物以有效地具有以下一种或多种效果的量给予:
·减少或防止脂质(例如中性脂质)在对象肝脏中堆积,例如据肝脏活检样品评估;
·减少或防止对象肝脏中的炎症,例如通过降低对象肝脏中免疫细胞的数量;
·减少或防止对象肝脏中nafld的病理变化(如mallory-denk体或肝细胞膨胀或炎性病灶或卫星现象)的发展;
·减少或防止肝纤维化和/或肝硬化的发展;
·减少或防止肝细胞癌的发展。
在一个实例中,本公开提供一种降低患有nafld(例如患有nash)的对象肝脏中的脂质(例如中性脂质)水平的方法,所述方法包括给予该对象抑制vegf-b信号转导的化合物。在一个实例中,与给予对象该化合物之前的脂质水平相比或与在患有nafld的对象群体中观察到的脂质水平相比,脂质水平降低。在另一实例中,脂质水平降低到与未患有nafld的对象或与未患有nafld的对象群体中相似(例如相差10%)或相同的水平。
在一个实例中,本公开提供一种降低患有nafld的对象中炎症水平的方法,所述方法包括给予该对象抑制vegf-b信号转导的化合物。
在一个实例中,抑制vegf-b信号转导的化合物特异性抑制vegf-b信号转导。这并不意味这本公开的方法不包括抑制多种vegf蛋白的信号转导,只是抑制vegf-b信号转导的该化合物(或其部分)特异于vegf-b,例如不是vegf蛋白的通用抑制剂。该术语也并未排除例如包含其结合域的双特异性抗体或蛋白,其能通过一个(或多个)结合域特异性抑制vegf-b信号转导,且能通过另一结合域特异性抑制另一蛋白质的信号转导。
在一个实例中,抑制vegf-b信号转导的化合物结合vegf-b。
例如,化合物是包含与vegf-b结合或特异性结合并中和vegf-b信号转导的抗体可变区的蛋白质。
在一个实例中,化合物是抗体模拟物。例如,该化合物是包含免疫球蛋白的抗原结合结构域的蛋白质,例如ignar、骆驼抗体或t细胞受体。
在一个实例中,化合物是结构域抗体(例如,仅包含与vegf-b结合的重链可变区或仅包含与vegf-b结合的轻链可变区)或仅重链抗体(例如,骆驼抗体或ignar)或其可变区。
在一个实例中,化合物是包含fv的蛋白质。例如,蛋白质选自下组:
(i)单链fv片段(scfv);
(ii)二聚体scfv(di-scfv);或
(iv)双抗体;
(v)三抗体;
(vi)四抗体;
(vii)fab;
(viii)f(ab’)2;
(ix)fv;或
(x)与抗体的恒定区、fc或重链恒定结构域(ch)2和/或ch3相连的(i)-(ix)之一。
在另一实例中,化合物是抗体。示例性抗体是全长和/或裸抗体。
在一个实例中,化合物是重组、嵌合、cdr移植、人源化、同人源化(synhumanized)、灵长类化、去免疫化或人蛋白质。
在一个实例中,化合物是包含竞争性抑制抗体2h10与vegf-b结合的抗体可变区的蛋白质。在一个实例中,蛋白质包括包含seqidno:3所示序列的重链可变区(vh)和包含seqidno:4所示序列的轻链可变区(vl)。
在一个实例中,化合物是包含人源化的抗体2h10可变区的蛋白质。例如,蛋白质包含可变区,该可变区其包含抗体2h10的vh和/或vl的互补决定区(cdr)。例如,该蛋白质包含:
(i)含以下所述的vh:
(a)cdr1,其包含seqidno:3的氨基酸25-34所示的序列;
(b)cdr2,其包含seqidno:3的氨基酸49-65所示的序列;和
(c)cdr3,其包含seqidno:3的氨基酸98-108所示的序列;和/或
(ii)含以下所述的vl:
(a)cdr1,其包含seqidno:4的氨基酸23-33所示的序列;
(b)cdr2,其包含seqidno:4的氨基酸49-55所示的序列;和
(c)cdr3,其包含seqidno:4的氨基酸88-96所示的序列。
在一个实例中,化合物是包含vh和vl的蛋白质,所述vh和vl是人源化的抗体2h10可变区。例如,该蛋白质包含:
(i)含以下所述的vh:
(a)cdr1,其包含seqidno:3的氨基酸25-34所示的序列;
(b)cdr2,其包含seqidno:3的氨基酸49-65所示的序列;和
(c)cdr3,其包含seqidno:3的氨基酸98-108所示的序列;和
(ii)含以下所述的vl:
(a)cdr1,其包含seqidno:4的氨基酸23-33所示的序列;
(b)cdr2,其包含seqidno:4的氨基酸49-55所示的序列;和
(c)cdr3,其包含seqidno:4的氨基酸88-96所示的序列。
在一个实例中,任一前述段落中的可变区或vh包含seqidno:5所示的序列。
在一个实例中,任一前述段落中的可变区或vl包含seqidno:6所示的序列。
在一个实例中,化合物是抗体。
在一个实例中,化合物是抗体,所述抗体包含:含seqidno:5所示序列的vh和含seqidno:6所示序列的vl。
在一个实例中,蛋白质或抗体是编码任何前述蛋白质或抗体的核酸编码的任何形式的蛋白质或抗体。
在一个实例中,蛋白质或抗体包含:
(i)含以下所述的vh:
(a)cdr1,其包含由包含seqidno:11的核酸所编码的序列,或包含seqidno:17的氨基酸序列;
(b)cdr2,其包含由包含seqidno:12的核酸所编码的序列,或包含seqidno:18的氨基酸序列;和
(c)cdr3,其包含由包含seqidno:13的核酸所编码的序列,或包含seqidno:19的氨基酸序列;和/或
(ii)含以下所述的vl:
(a)cdr1,其包含由包含seqidno:14的核酸所编码的序列,或包含seqidno:20的氨基酸序列;
(b)cdr2,其包含由包含seqidno:15的核酸所编码的序列,或包含seqidno:21的氨基酸序列;和
(c)cdr3,其包含由包含seqidno:16的核酸所编码的序列,或包含seqidno:22的氨基酸序列。
在一个实例中,蛋白质或抗体包含:
(i)含以下所述的vh:
(a)cdr1,其包含由包含seqidno:23的核酸所编码的序列,或包含seqidno:29的氨基酸序列;
(b)cdr2,其包含由包含seqidno:24的核酸所编码的序列,或包含seqidno:30的氨基酸序列;和
(c)cdr3,其包含由包含seqidno:25的核酸所编码的序列,或包含seqidno:31的氨基酸序列;和/或
(ii)含以下所述的vl:
(a)cdr1,其包含由包含seqidno:26的核酸所编码的序列,或包含seqidno:32的氨基酸序列;
(b)cdr2,其包含由包含seqidno:27的核酸所编码的序列,或包含seqidno:33的氨基酸序列;和
(c)cdr3,其包含由包含seqidno:28的核酸所编码的序列,或包含seqidno:34的氨基酸序列。
在一个实例中,蛋白质或抗体包含:
(i)含以下所述的vh:
(a)cdr1,其包含由包含seqidno:35的核酸所编码的序列,或包含seqidno:41的氨基酸序列;
(b)cdr2,其包含由包含seqidno:36的核酸所编码的序列,或包含seqidno:42的氨基酸序列;和
(c)cdr3,其包含由包含seqidno:37的核酸所编码的序列,或包含seqidno:43的氨基酸序列;和/或
(ii)含以下所述的vl:
(a)cdr1,其包含由包含seqidno:38的核酸所编码的序列,或包含seqidno:44的氨基酸序列;
(b)cdr2,其包含由包含seqidno:39的核酸所编码的序列,或包含seqidno:45的氨基酸序列;和
(c)cdr3,其包含由包含seqidno:40的核酸所编码的序列,或包含seqidno:46的氨基酸序列。
在一个实例中,化合物在组合物内。例如,组合物包含如本文所述的包含抗体可变区或vh或vl或抗体的蛋白质。在一个实例中,组合物另外包含蛋白质或抗体的一种或多种变体。例如,其包含缺失编码的c-末端赖氨酸残基的变体、脱酰胺化变体和/或糖基化变体和/或包含焦谷氨酸的变体(例如在蛋白质的n末端)和/或缺失n-末端残基(例如抗体或v区中的n-末端谷氨酰胺)的变体和/或包含全部或部分分泌信号的变体。编码的天冬酰胺残基的脱酰胺变体可产生异天冬氨酸和产生天冬氨酸异构体,或甚至产生涉及相邻氨基酸残基的琥珀酰胺。编码的谷氨酰胺残基的脱酰胺变体可产生谷氨酸。当提及特定的氨基酸序列时,包括包含这种序列和变体的非均相混合物的组合物。
在一个实例中,抑制vegf-b信号转导的化合物抑制或阻止vegf-b表达。例如,该化合物选自反义、sirna、rnai、核酶和dna酶。
在一个实例中,vegf-b是哺乳动物vegf-b,例如人vegf-b。
在一个实例中,对象是哺乳动物,例如灵长类动物,如人。
本文所述的治疗方法可另外包括给予其他化合物以治疗或预防nafld。
本文所述的治疗方法可另外包括给予其他化合物以治疗或预防肥胖(或延迟其发展)。本文描述了示例性化合物。
本公开还提供了抑制vegf-b信号转导的化合物,其用于治疗或预防nafld或其并发症。
本公开还提供了抑制vegf-b信号转导的化合物在制备用于治疗或预防nafld或其他并发症的药物中的用途。
本公开还提供了包含抑制vegf-b信号转导化合物的试剂盒,该试剂盒中包装有指导用于治疗或预防nafld或其并发症的使用说明书。
本文描述了示例性nafld及其并发症和化合物,适用于前述三段所述实例,或需必要的调整。
附图说明
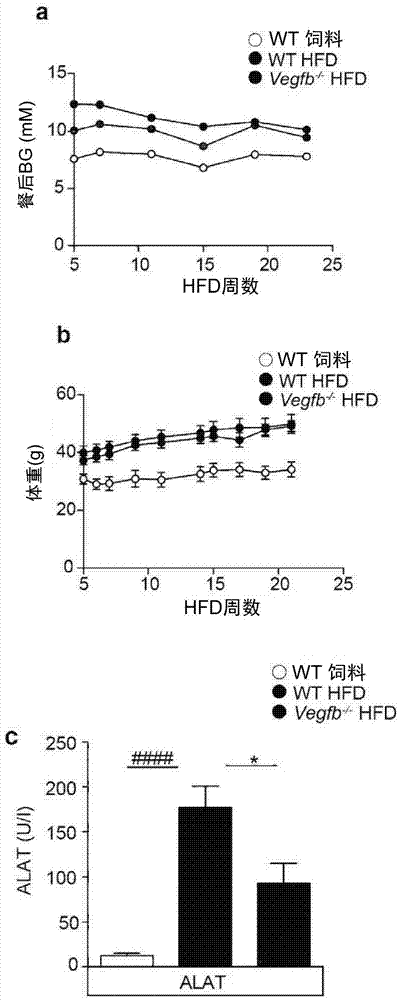
图1显示饲料饲喂野生型(chow-fedwt)、hfd饲喂野生型和hfd饲喂vegfb-/-小鼠中的a.血糖水平、b.体重和c.血清丙氨酸氨基转移酶水平。数值为平均值±s.e.m。####表示与饲料饲喂野生型相比,p<0.0001。*表示与hfd饲喂野生型小鼠相比,p<0.05。n=3-8只/组(a),n=3-8只/组(b),n=6-10只/组(c)。
图2显示饲料饲喂野生型、hfd饲喂野生型和hfd饲喂vegfb-/-小鼠中如下定量的图表:a.肝切片的油红o染色;以及b.脂肪酸合成酶肝mrna(fasn)的相对表达。数值为平均值±s.e.m。###代表与饲料饲喂野生型相比p<0.001。*表示与hfd饲喂野生型小鼠相比,p<0.05。n=6-11只/组(a),n=3-6只/组(b)。
图3显示饲料饲喂野生型、hfd饲喂野生型和hfd饲喂vegfb-/-小鼠中如下定量的图表:a.亲脂素、b.肝脏切片中甘露糖-6-磷酸受体结合蛋白1(tip47)以及c.亲脂素的肝mrna(plin2a)相对表达。数值为平均值±s.e.m。####表示与饲料饲喂野生型相比,p<0.0001。****表示与hfd饲喂野生型小鼠相比,p<0.0001。n=4-11只/组(a),n=5-8只/组(b),n=3-6只/组(c)。
图4显示饲料饲喂野生型、hfd饲喂野生型和hfd饲喂vegfb-/-小鼠肝脏切片中如下物质的定量:a.蛋白酪氨酸磷酸酶c型受体(cd45)、b.包含egf样模块的粘蛋白样激素受体样1(f4/80)以及c.单核细胞化学诱导蛋白-1的肝mrna(mcp1)相对表达。数值为平均值±s.e.m。##表示p<0.01,###表示p<0.001,均与饲料饲喂野生型相比。*表示p<0.05,**表示p<0.01,****表示p<0.0001,均与hfd饲喂野生型小鼠相比。n=4-6只/组(a),n=4-8只/组(b),n=4-5只/组(c)。
图5显示饲料饲喂野生型、hfd饲喂野生型和hfd饲喂vegfb-/-小鼠肝切片中所有被识别的膨胀肝细胞、mallory-denk体、炎症灶以及卫星现象的总数定量。数值为平均值±s.e.m。####表示与饲料饲喂野生型相比,p<0.0001,以及****表示与hfd饲喂野生型小鼠相比,p<0.0001。n=5-9只/组。
图6显示用抗vegf抗体(2h10)或对照抗体处理的饲料饲喂野生型和hfd饲喂小鼠中的a.血糖水平;b.体重;c.肝重;d.肝重与体重比以及e.血清丙氨酸氨基转移酶水平。数值为平均值±s.e.m。####表示与饲料饲喂野生型相比p<0.0001。n=6-10只/组。
图7显示用抗vegf抗体(2h10)或对照抗体处理的饲料饲喂野生型和hfd饲喂小鼠中的如下定量:a.肝切片的油红o染色以及b.脂肪酸合成酶肝mrna(fasn)的相对表达。数值为平均值±s.e.m。####表示与饲料饲喂野生型相比p<0.001。**表示与对照处理的hfd饲喂小鼠相比p<0.01。n=6-11只(a),n=3-6只(b)。
图8显示用抗vegf抗体(2h10)或对照抗体处理的饲料饲喂野生型和hfd饲喂小鼠中的如下定量:a.亲脂素、b.肝脏切片中甘露糖-6-磷酸受体结合蛋白1(tip47)以及c.亲脂素肝mrna(plin2a)的相对表达。数值为平均值±s.e.m。####表示与饲料饲喂野生型相比p<0.0001。**表示p<0.01,****表示p<0.0001,均与对照处理的hfd饲喂小鼠相比。n=5-11只/组(a),n=6-8只/组(b),n=3-5只/组(c)。
图9显示用抗vegf抗体(2h10)或对照抗体处理的饲料饲喂野生型和hfd饲喂小鼠中的如下定量:a.蛋白酪氨酸磷酸酶c型受体(cd45)、b.肝脏切片中包含egf样模块的粘蛋白样激素受体样1(f4/80)以及c.单核细胞化学诱导蛋白-1的肝mrna(mcp1)相对表达。数值为平均值±s.e.m。与饲料饲喂野生型相比,##p<0.01,###p<0.001。**表示p<0.01,****表示p<0.0001,均与对照处理的hfd饲喂小鼠相比。n=4-7只/组(a),n=4-8只/组(b),n=4-7只/组(c)。
图10显示用抗vegf抗体(2h10)或对照抗体处理的饲料饲喂野生型和hfd饲喂小鼠肝切片中所有被识别的膨胀肝细胞、mallory-denk体、炎症灶以及卫星现象的总数定量。数值为平均值±s.e.m。####表示与饲料饲喂野生型相比,p<0.0001,以及****表示与对照处理hfd饲喂野生型小鼠相比,p<0.0001。n=5-9只/组。
图11显示经短期cd饮食(cd饮食5个月;cd5)的野生型、vegfb+/-和vegfb-/-小鼠中以下指标的结果:a.体重和血糖水平;b.腹膜内葡萄糖以及c.腹膜内胰岛素耐受试验(ipgtt和ipitt),以auc分析表示定量。数值为平均值±s.e.m。*表示与cd饮食的野生型相比,p<0.05。n=4-13只/组。
图12显示cd5饮食的野生型、vegfb+/-和vegfb-/-小鼠中以下指标的结果:a.肝重和肝重体重比;b.血清丙氨酸氨基转移酶(alat)水平。数值为平均值±s.e.m。*表示p<0.05,***表示p<0.001,均与cd饮食的野生型小鼠相比。n=4-13只/组。
图13显示cd5饮食的野生型、vegfb+/-和vegfb-/-小鼠中以下所述的结果:a.肝切片的油红o(oro)染色定量;b.甘油三酯(tg)、酮类(kb)和非酯化脂肪酸(nefa)的血浆水平定量。数值为平均值±s.e.m。*表示p<0.05,**表示p<0.01,***表示p<0.001,均与cd饮食的野生型小鼠相比。n=4-13只/组。
图14显示cd5饮食的野生型、vegfb+/-和vegfb-/-小鼠肝切片中如下物质的免疫标记定量:a.蛋白酪氨酸磷酸酶c型受体(cd45);以及b.包含egf样模块的粘蛋白样激素受体样1(f4/80)。数值为平均值±s.e.m。*表示p<0.05,**表示p<0.01,***表示p<0.001,均与cd饮食的野生型相比。n=4-13只/组。
图15显示用抗vegf抗体(2h10)或对照抗体处理的cd5饮食的野生型小鼠和饲料饲喂野生型小鼠以下指标的结果:a.体重和血糖水平;b.腹膜内葡萄糖耐受试验(ipgtt);以及c.腹膜内胰岛素耐受试验(ipitt),其定量以曲线下面积分析表示。数值为平均值±s.e.m。#表示与饲料饲喂野生型相比,p<0.05。n=8-10只/组。
图16显示用抗vegf抗体(2h10)或对照抗体处理的cd5饮食的野生型小鼠和饲料饲喂的野生型小鼠中以下指标的结果:a.肝重和肝重体重比;b.血清丙氨酸氨基转移酶(alat)水平。数值为平均值±s.e.m。##表示p<0.01,###表示p<0.001,均与饲料饲喂野生型小鼠相比。**表示与用对照处理的cd饮食c57bl/6小鼠相比,p<0.01。n=8-10只/组。
图17显示用抗vegf抗体(2h10)或对照抗体处理的cd5饮食的野生型小鼠和饲料饲喂的野生型小鼠中以下所述的结果:a.oro染色定量;b.甘油三酯(tg)、酮类(kb)和非酯化脂肪酸(nefa)血浆水平定量。数值为平均值±s.e.m。#表示p<0.05,##表示p<0.01,###表示p<0.001,均与饲料饲喂野生型小鼠相比。*表示p<0.05,****表示p<0.0001,均与用对照处理的cd饮食小鼠相比。n=8-10只/组。
图18显示用抗vegf抗体(2h10)或对照抗体处理的cd5饮食的野生型小鼠和饲料饲喂的野生型小鼠肝切片中a.亲脂素表达定量。数值为平均值±s.e.m。####表示与饲料饲喂野生型动物相比p<0.0001。****表示与用对照处理的cd饮食小鼠相比p<0.0001。n=8-10只/组。
图19显示用抗vegf抗体(2h10)或对照抗体处理的cd5饮食的野生型小鼠和饲料饲喂的野生型小鼠肝切片中如下物质的免疫标记定量:a.蛋白酪氨酸磷酸酶c型受体(cd45);以及b.包含egf样模块的粘蛋白样激素受体样1(f4/80)。数值为平均值±s.e.m。##表示p<0.01,###表示p<0.001,均与饲料饲喂野生型小鼠相比。**表示p<0.01,***表示p<0.001,均与用对照处理的cd饮食小鼠相比。n=8-10只/组。
图20显示用抗vegf抗体(2h10)或对照抗体处理的cd5饮食的野生型小鼠和饲料饲喂的野生型小鼠的肝切片马森三色染色(massontrichrome)肝纤维化定量。数值为平均值±s.e.m。####表示与饲料饲喂野生型小鼠相比,p<0.001。****表示与用对照处理的cd饮食小鼠相比p<0.0001。n=8-10只/组。
图21显示用抗vegf抗体(2h10)或对照抗体处理的cd5饮食的野生型小鼠和饲料饲喂的野生型小鼠h&e染色肝切片中nash的肝总评分。数值为平均值±s.e.m。####表示与饲料饲喂动物相比,p<0.0001。***表示与用对照处理野生型小鼠的cd饮食的c57bl/6小鼠相比,p<0.001。n=5-10只/组。
图22显示用抗vegf抗体(2h10)或对照抗体处理的长期cd饮食(cd饮食12个月)的野生型小鼠和饲料饲喂的野生型小鼠以下指标的结果:a.体重和血糖水平;b.腹膜内葡萄糖及c.腹膜内胰岛素耐受试验(ipgtt和ipitt),定量以auc分析表示。数值为平均值±s.e.m。##表示p<0.01,###表示p<0.001,均与饲料饲喂野生型小鼠相比。n=8只/组。
图23用抗vegf抗体或对照抗体处理的cd12饮食的野生型小鼠和饲料饲喂野生型小鼠的一系列图表,显示了:a.肝重和肝重体重比;b.血清丙氨酸氨基转移酶(alat)水平定量;c.钆强化mri扫描的代表性图像。肿瘤负荷以箭头指示;d.用2h10或对照抗体处理的无肿瘤和有肿瘤长期cd饮食小鼠的概述图。符号代表小鼠个体;e.肝脏肉眼观察的代表性图像;f.用对照抗体处理的cd12饮食小鼠的肝肿瘤部位。数值为平均值±s.e.m。##表示p<0.01,###表示p<0.001,均与饲料饲喂野生型小鼠相比。*表示p<0.05,**表示p<0.01,均与用对照处理的cd饮食c57bl/6小鼠相比。n=8只/组(a-e);n=4只(f)。
图24显示用抗vegf抗体或对照抗体处理的有肿瘤或无肿瘤、cd12饮食的野生型小鼠和饲料饲喂野生型小鼠的肝脏oro染色定量。数值为平均值±s.e.m。#表示p<0.01,##表示p<0.01,###表示p<0.001,均与饲料饲喂野生型小鼠相比。****表示与用对照处理的cd饮食无肿瘤小鼠相比p<0.0001。n=4-8只/组。
图25显示用抗vegf抗体(2h10)或对照抗体处理的有肿瘤或无肿瘤、cd12饮食的野生型小鼠和饲料饲喂野生型小鼠肝切片中如下物质的免疫标记定量:a.蛋白酪氨酸磷酸酶c型受体(cd45);以及b.包含egf样模块的粘蛋白样激素受体样1(f4/80)。数值为平均值±s.e.m。#表示p<0.01,###表示p<0.001,均与饲料饲喂野生型小鼠相比。*表示与用对照处理的cd饮食无肿瘤小鼠相比p<0.01。^^^表示与用对照处理的cd饮食有肿瘤小鼠相比p<0.001。n=4-8只/组。
序列表要点
seqidno:1是含有21氨基酸n-末端信号序列的人vegf-b186同种型的氨基酸序列。
seqidno:2是含有21氨基酸n-末端信号序列的人vegf-b167同种型的氨基酸序列。
seqidno:3是源自抗体2h10的vh的氨基酸序列。
seqidno:4是源自抗体2h10的vl的氨基酸序列。
seqidno:5是源自抗体2h10的人源化形式的vh的氨基酸序列。
seqidno:6是抗体2h10的人源化形式的vl的氨基酸序列。
seqidno:7是源自抗体4e12的vh的氨基酸序列。
seqidno:8是抗体4e12的vl的氨基酸序列。
seqidno:9是源自抗体2f5的vh的氨基酸序列。
seqidno:10是抗体2f5的vl的氨基酸序列。
seqidno:11是源自抗体2h10的vlcdr1的核苷酸序列。
seqidno:12是源自抗体2h10的vlcdr2的核苷酸序列。
seqidno:13是源自抗体2h10的vlcdr3的核苷酸序列。
seqidno:14是源自抗体2h10的vhcdr1的核苷酸序列。
seqidno:15是源自抗体2h10的vhcdr2的核苷酸序列。
seqidno:16是源自抗体2h10的vhcdr3的核苷酸序列。
seqidno:17是源自抗体2h10的vlcdr1的氨基酸序列。
seqidno:18是源自抗体2h10的vlcdr2的氨基酸序列。
seqidno:19是源自抗体2h10的vlcdr3的氨基酸序列。
seqidno:20是源自抗体2h10的vhcdr1的氨基酸序列。
seqidno:21是源自抗体2h10的vhcdr2的氨基酸序列。
seqidno:22是源自抗体2h10的vhcdr3的氨基酸序列。
seqidno:23是源自抗体2f5的vlcdr1的核苷酸序列。
seqidno:24是源自抗体2f5的vlcdr2的核苷酸序列。
seqidno:25是源自抗体2f5的vlcdr3的核苷酸序列。
seqidno:26是源自抗体2f5的vhcdr1的核苷酸序列。
seqidno:27是源自抗体2f5的vhcdr2的核苷酸序列。
seqidno:28是源自抗体2f5的vhcdr3的核苷酸序列。
seqidno:29是源自抗体2f5的vlcdr1的氨基酸序列。
seqidno:30是源自抗体2f5的vlcdr2的氨基酸序列。
seqidno:31是源自抗体2f5的vlcdr3的氨基酸序列。
seqidno:32是源自抗体2f5的vhcdr1的氨基酸序列。
seqidno:33是源自抗体2f5的vhcdr2的氨基酸序列。
seqidno:34是源自抗体2f5的vhcdr3的氨基酸序列。
seqidno:35是源自抗体4e12的vlcdr1的核苷酸序列。
seqidno:36是源自抗体4e12的vlcdr2的核苷酸序列
seqidno:37是源自抗体4e12的vlcdr3的核苷酸序列。
seqidno:38是源自抗体4e12的vhcdr1的核苷酸序列。
seqidno:39是源自抗体4e12的vhcdr2的核苷酸序列。
seqidno:40是源自抗体4e12的vhcdr3的核苷酸序列。
seqidno:41是源自抗体4e12的vlcdr1的氨基酸序列。
seqidno:42是源自抗体4e12的vlcdr2的氨基酸序列。
seqidno:43是源自抗体4e12的vlcdr3的氨基酸序列。
seqidno:44是源自抗体4e12的vhcdr1的氨基酸序列。
seqidno:45是源自抗体4e12的vhcdr2的氨基酸序列。
seqidno:46是源自抗体4e12的vhcdr3的氨基酸序列。
具体实施方式
概述
通篇中,除非另有说明或上下文另有要求,应认为单个步骤、组合物、步骤的组或组合物的组包括一个和多个(即一个或多个)这些步骤、组合物、步骤组或组合物组。
本领域技术人员应理解,本发明易于进行除说明书中所述的那些以外的变化和修改。应理解本发明包含所有这些变化和修改。本发明还包括说明书中单独或共同提到或指出的所有步骤、特征、组合物和化合物,以及所述步骤或特征中任意两种或更多种或任意和全部组合。
本发明的范围不限于本文所述的具体实施例,实施例仅用于示例目的。功能上等同的产品、组合物和方法清楚地包含于本发明的范围内。
本发明的任何实施例都将经必要的修改以适用于本发明的任何其他实施例,除非另有明确说明。
应理解,本公开中与nafld治疗或预防相关的任何实例可在细节上视必要进行修改以应用于在患有nafld的对象中抑制或防止先天免疫应答(例如消化系统中的先天免疫应答和/或全身性先天免疫应答)。
除非另有明确定义,本文使用的所有技术和科学术语都具有与本领域普通技术人员的常规理解相同的含义(例如在细胞培养、分子遗传学、免疫学、免疫组化、蛋白质化学和生物化学领域)。
除非另有说明,本发明中使用的重组蛋白、细胞培养和免疫技术是标准方法,其是本领域技术人员熟知的。这类技术描述并解释于文献中,例如j.perbal,apracticalguidetomolecularcloning(《分子克隆实践指南》),约翰韦利森出版社(johnwileyandsons)(1984),j.sambrook等,molecularcloning:alaboratorymanual(《分子克隆:实验室指南》),冷泉港实验室出版社(coldspringharbourlaboratorypress)(1989),t.a.brown(编),essentialmolecularbiology:apracticalapproach(《精编分子生物学:实践指南》),卷1和2,irl出版社(1991),d.m.glover和b.d.hames(编),dnacloning:apracticalapproach(《dna克隆:实践指南》),卷1-4,irl出版社(1995和1996),以及f.m.ausubel等(编),currentprotocolsinmolecularbiology(《新编分子生物学实验指南》),格林出版联合公司和韦利科学公司(greenepub.associatesandwiley-interscience)(1988,包括直至今日的所有更新),edharlow和davidlane(编),antibodies:alaboratorymanual(《抗体:实验室手册》),冷泉港实验室出版社(1988),以及j.e.coligan等(编),currentprotocolsinimmunology(《新编免疫学实验指南》),约翰韦利森出版社(包括直至今日的所有更新)。
本文中可变区及其部分、免疫球蛋白、抗体及其片段的描述和定义由以下文献中的讨论进一步阐明:kabatsequencesofproteinsofimmunologicalinterest(感兴趣的免疫蛋白序列),马里兰州贝塞斯达,1987和1991,bork等,jmol.biol.242,309-320,1994,chothia和leskj.molbiol.196:901-917,1987,chothia等,nature342,877-883,1989和/或al-lazikani等,jmolbiol273,927-948,1997。
本文中对蛋白质或抗体的任何讨论将被理解为包括在制造和/或储存期间产生的蛋白质或抗体的任何变体。例如,在制造或储存过程中,抗体可能脱酰胺化(例如在天冬酰胺或谷氨酰胺残基)和/或发生糖基化改变和/或谷氨酰胺残基转化成焦谷氨酰胺和/或n-末端或c-末端残基被去除或“剪切”和/或信号序列部分或全部经不完全加工的而保留在抗体的末端。应当理解,包含特定氨基酸序列的组合物可以是所述或被编码序列和/或所述或被编码序列的变体的不均匀混合物。
术语“和/或”(例如“x和/或y”)应理解为表示“x和y”或“x或y”且应被认为提供了对这两种含义或各含义的明确支持。
整篇说明书中,词语“包括”或其变化形式,如“包含”或“含有”应理解为意味着包括所指的元素、整数或步骤,或成组的元素、整数或步骤,但不排除任何其它元素、整数或步骤,或成组的元素、整数或步骤。
本文所用术语“来源于”或“源自”表示特定整体可获自特定来源,但并不一定直接来自该来源。
选择的定义
vegf-b已知存在两种主要同种型,称为vegf-b186和vegf-b167。仅为了命名的目的而不是为了限制,人vegf-b186的示例性序列示于ncbi参考序列:np_003368.1,ncbi蛋白质登录号np_003368,p49765和aal79001以及seqidno:1。在本公开的上下文中,vegf-b186的序列可缺少21个氨基酸的n-末端信号序列(例如,如seqidno:1的氨基酸1至21所示)。仅为了命名的目的而非限制,人vegf-b167的示例性序列示于ncbi参考序列:np_001230662.1,ncbi蛋白质登录号aal79000和aab06274以及seqidno:2。在本公开的上下文中,vegf-b167的序列可缺少21个氨基酸的n-末端信号序列(例如,如seqidno:2的氨基酸1至21所示)。可以使用本文提供的序列和/或在公共数据库中的和/或使用标准技术确定vegf-b的其他序列(例如,如ausubel等,(编辑),《新编分子生物学实验指南》),格林出版联合公司和韦利科学公司(currentprotocolsinmolecularbiology,greenepub.associatesandwiley-interscience)(1988,包括直到现在的所有更新)或sambrook等,分子克隆:实验室手册》,冷泉港实验室出版社(molecularcloning:alaboratorymanual,coldspringharborlaboratorypress)(1989))。人vegf-b可以缩写为hvegf-b。在一个实例中,本文提及的vegf-b是vegf-b167同种型。
vegf-b还包括wo2006/012688中所述的vegf-b10-108肽。
如本文所用,“非酒精性脂肪肝病”或“nafld”是指脂肪在肝脏堆积(肝脂肪变性)、有或无炎症和纤维化(即肝纤维化)、但并未过量使用酒精的病症。该术语包括脂肪变性、nash和肝硬化。
如本文所用,“患有nafld的对象”是指已被诊断为患有nafld的对象。在一些实例中,在常规检查、代谢综合症和肥胖监测或药物(例如降胆固醇药或类固醇)可能的副作用的监测过程中怀疑患有nafld。在一些实例中,肝酶(如asat和alat)高。在一些实例中,对象在腹部或胸部成像、肝超声或核磁共振成像后被确诊。在一些实例中,在nafld诊断之前,已排除其他情况,如过量酒精摄入、丙肝和威尔逊病。在一些实例中,对象已通过肝活检确诊。
如本文所用,“脂肪变性”和“非酒精性脂肪变性”可互换使用,且包括轻度、中度和重度脂肪变性,无炎症或纤维化,没有过量使用酒精。
本文所用术语“肝”和“肝脏”可以互换使用。
如本文所用,“患有脂肪变性的对象”和“患有非酒精性脂肪变性的对象”可互换使用,是指已被确诊为脂肪变性的对象。在一些实例中,脂肪变性通过本文就nafld的通述中所述的方法来诊断。
如本文所用,“非酒精性脂肪性肝炎”或“nash”是指肝脏具有炎症和/或纤维化(即肝纤维化)的nafld。确定nash分期的示例性方法描述于,例如kleiner等,2005,hepatology,41(6):1313-1321以及brunt等,2007,modernpathol,20:s40-s48。
如本文所用,“患有nash的对象”是指已被诊断为患有nash的对象。在一些实例中,nash通过上文nafld通述中所述的方法诊断。在一些实例中,在nafld患者中例如根据gambinor等,annalsofmedicine2011;43(8):617-49诊断出晚期纤维化。
如本文所用,术语“nash来源的肝硬化”或“患有nash来源的肝硬化的对象”是指患有由nash导致的肝硬化(即nash已发展为肝硬化)的对象。
如本文所用,术语“nash相关的肝硬化”或“nash关联的肝硬化”或“患有nash相关的肝硬化的对象”是指被确诊为肝硬化和nash,但该肝硬化并不一定由nash所致的对象。
如本文所用,术语“nash相关的肝纤维化”或“nash关联的肝纤维化”或“患有nash相关的肝纤维化的对象”是指被确诊为肝纤维化和nash,但该肝纤维化并不一定由nash所致的对象。
如本文所用,术语“nash来源的肝细胞癌”或“患有nash来源的肝细胞癌的对象”是指患有由nash导致的肝细胞癌(即nash已发展为肝细胞癌)的对象。
如本文所用,术语“nash相关的肝细胞癌”或“nash关联的肝细胞癌”或“患有nash相关的肝细胞癌的对象”是指被确诊为肝细胞癌和nash,但该肝细胞癌并不一定由nash所致的对象。
如本文所用,对象“超重”是指该对象的bmi为25~<30。
如本文所用,对象“肥胖”是指该对象的bmi为30或以上。
如本文所用,“具有发生nafld风险的对象”是指具有一种或多种nafld并发症,如肥胖、异常肥胖、代谢综合症、心血管疾病和糖尿病的对象
如本文所用,“具有发生脂肪变性风险的对象”是指未被诊断为患有脂肪变性但具有一种或多种nafld并发症,如肥胖、异常肥胖、代谢综合症、心血管疾病和糖尿病的对象。
如本文所用,“具有发生nash风险的对象”是指具有脂肪变性且还具有一种或多种nafld并发症,如肥胖、异常肥胖、代谢综合症、心血管疾病和糖尿病的对象。
术语“重组”应理解为指人工遗传重组的产物。因此,对于包含抗体可变区的重组蛋白,该术语不包括在对象体内天然产生的抗体,所述抗体为b细胞成熟期间发生的天然重组的产物。然而,如果这类抗体被分离,其应被认为是包含抗体可变区的分离的蛋白质。类似地,如果编码该蛋白质的核酸被分离并使用重组方式表达,则所得蛋白质是包含抗体可变区的重组蛋白。重组蛋白还包括当其处于细胞、组织或对象(例如蛋白质在其中表达的细胞、组织或对象)内时通过人工重组方式表达的蛋白质。
术语“蛋白质”应理解为包括单条多肽链(即通过肽键连接的一系列相邻氨基酸)或彼此共价或非共价连接的一系列多肽链(即多肽复合物)。例如,可使用合适的化学键或二硫键共价连接该一系列多肽链。非共价键的示例包括氢键、离子键、范德华力和疏水相互作用。
术语“多肽”或“多肽链”应据以上段落理解为表示通过肽键连接的一系列相邻氨基酸。
本领域技术人员将意识到,“抗体”通常被认为是包含由多个多肽链组成的可变区的蛋白质,例如包含轻链可变区(vl)的多肽和包含重链可变区(vh)的多肽。抗体还通常包含恒定结构域,其中一些可以排列成恒定区,对重链而言包括恒定片段或可结晶片段(fc)。vh和vl相互作用形成包含能够特异性结合一个或几个密切相关抗原的抗原结合区的fv。通常,源自哺乳动物的轻链为κ轻链或λ轻链,而源自哺乳动物的重链为α、δ、ε、γ或μ。抗体可以是任何类型(如igg、ige、igm、igd、iga和igy)、类(如igg1、igg2、igg3、igg4、iga1和iga2)或亚类。术语“抗体”还包括人源化抗体、灵长类化抗体、人抗体、合成人源化抗体和嵌合抗体。
术语“全长抗体”、“完整的抗体”或“全抗体”可互换使用以指与抗体的抗原结合片段相对而言基本完整形式的抗体。具体而言,全抗体包含具有重链和轻链(包含fc区)的那些抗体。恒定结构域可以是野生型序列恒定结构域(如人野生型序列恒定结构域)或其氨基酸序列变体。
如本文所用,“可变区”指本文所定义抗体的轻链和/或重链的部分,其能够特异性结合抗原并包含互补决定区(cdr)(即cdr1、cdr2和cdr3)和框架区(fr)的氨基酸序列。示例性可变区包含三个或四个fr(如fr1、fr2、fr3和任选的fr4)以及三个cdr。在源自ignar的蛋白质的情况下,蛋白质可能缺少cdr2。vh指重链的可变区。vl指轻链的可变区。
本文所用术语“互补决定区”(同义词cdr;即cdr1、cdr2和cdr3)指抗体可变结构域中抗原结合所必需的氨基酸残基。每个可变结构域通常具有被鉴定为cdr1、cdr2和cdr3的三个cdr区。分配给cdr和fr的氨基酸位置可以根据kabat系统(《感兴趣的免疫蛋白序列》国家卫生院,马里兰州,贝塞达斯(sequencesofproteinsofimmunologicalinterest,nationalinstitutesofhealth,bethesda,md.,)1987和1991)或本领域其他编号系统来确定,例如chothia和leskj.molbiol.196:901-917,1987;chothia等.nature342,877-883,1989;和/或al-lazikani等,jmolbiol273:927-948,1997的规范编号系统;lefranc等devel.andcompar.immunol.,27:55-77,2003的imgt编号系统;或honnegher和plükthunj.mol.biol.,309:657-670,2001的aho编号系统。
“框架区”(fr)是除了cdr残基以外的其他可变结构域残基。
本文所用术语“fv”应理解为指任何如下所述蛋白质,无论其由多个多肽或单个多肽组成:其中vl和vh相联并形成具有抗原结合位点的复合物(即能够特异性结合抗原)。形成抗原结合位点的vh和vl可以在单条多肽链中或不同多肽链中。此外,本公开的fv(以及本公开的任何蛋白质)可具有多个抗原结合位点,可结合或可不结合相同的抗原。该术语应理解为包括直接来源于抗体的片段以及采用重组方式生产的对应于这类片段的蛋白质。在一些实例中,vh不与重链恒定结构域(ch)1相连和/或vl不与轻链恒定结构域(cl)相连。示例性的含fv多肽或蛋白质包括fab片段、fab’片段、f(ab’)片段、scfv、双抗体、三抗体、四抗体或更高级的复合物,或者与恒定区或其结构域(如ch2或ch3结构域)相连的任意前述物质,如微小抗体。“fab片段”由抗体的单价抗原结合片段组成,且可通过使用木瓜蛋白酶消化全抗体以生成由完整轻链和一部分重链组成的片段来生产或者可使用重组方法来生产。通过使用胃蛋白酶处理全抗体随后还原以生成由完整轻链和一部分重链(包含vh和单个恒定结构域)组成的分子,由此可获得抗体的“fab'片段”。通过该方式处理,每个抗体可获得两个fab'片段。还可通过重组方式生产fab'片段。抗体的“f(ab')2片段”由通过两个二硫键联合在一起的两个fab'片段的二聚体组成,并可通过使用胃蛋白酶处理全抗体分子而不进行后续还原来获得。“fab2”片段是包含两个fab片段的重组片段,这两个fab片段采用例如亮氨酸拉链或ch3结构域连接。“单链fv”或“scfv”是含有抗体的可变区片段(fv)的重组分子,其中轻链的可变区和重链的可变区通过合适的柔性多肽接头共价连接。
对于蛋白质或其抗原结合位点与抗原的相互作用,本文所用术语“结合”指该相互作用取决于抗原上所存在的特定结构(如抗原决定簇或表位)。例如,抗体识别并结合特定蛋白质结构而非广泛结合蛋白质。如果抗体结合表位“a”,则在含有标记的“a”和该蛋白质的反应中存在含有表位“a”(或游离、未结合的“a”)的分子会降低与该抗体结合的标记的“a”的量。
本文所用术语“特异性结合”或“特异地结合”应理解为表示:与同其他抗原或细胞的反应或连接相比,本公开的蛋白质更频繁、更快速、更持久和/或亲和力更高地与特定抗原或表达该特定抗原的细胞反应或联合。例如,与同其它生长因子(例如vegf-a)或同由多反应性天然抗体(即已知结合人类天然存在的多种抗原的天然存在的抗体)普遍识别的抗原的结合相比,该蛋白质以实质上更高的亲和力(例如,20倍或40倍或60倍或80倍至100倍或150倍或200倍)与vegf-b结合。通常,但非一定,提及结合时指特异性结合,且各术语应理解为对其他术语提供明确支持。
本文所用术语“中和”应理解为指蛋白质能够通过vegf-r1阻断、降低或阻止细胞中的vegf-b-信号转导。确定中和作用的方法是本领域已知的和/或描述于本文中。
如本文所用,术语“特异性抑制vegf-b信号转导”应理解为是指化合物抑制vegf-b信号转导,且并不显著或可测程度地抑制通过一种或多种其他vegf蛋白(例如vegf-a、vegf-b、vegf-c、vegf-d和/或pigf)的信号转导。
如本文所用,术语“不显著抑制”应理解为是指在本文所述化合物的存在下,对通过非vegf-b的其他vegf蛋白的信号转导(例如通过vegf-a、vegf-b、vegf-c、vegf-d和/或pigf的信号转导)的抑制水平并未统计学显著地低于本文所述化合物不存在情况下(即可在同种型对照抗体存在下进行的对照测试中)的水平。
如本文所用,术语“并不可测程度地抑制”应理解为是指本文所述化合物对非vegf-b的其他vegf蛋白的信号转导(例如通过vegf-a、vegf-b、vegf-c、vegf-d和/或pigf的信号转导)的抑制不超过不存在本文所述化合物时检测到的信号转导水平(即可在同种型对照抗体存在下进行的对照测试中)的10%或8%或6%或5%或4%或3%或2%或1%。
本文所用术语“阻止”、“防止”或“避免”包括给予本公开的化合物从而停止或阻碍至少一种病症症状的发展。
本文所用术语“治疗”或“处理”包括给予本文所述的蛋白质从而降低或消除特定疾病或病症的至少一种症状或减缓该疾病或病症的进展。
本文所用术语“对象”应理解为指包括人的任何动物,例如哺乳动物。示例性对象包括但不限于人和非人灵长类动物。例如,该对象是人。
nafld的治疗
本公开提供了治疗或预防对象中nafld的方法,所述方法包括给予该对象vegf-b信号转导抑制剂。
在一些实例中,该方法包括确定对象是否患有nafld,并选择确定患有nafld的对象,然后如本文所述给予抑制vegf-b的化合物。确定对象是否患有nafld可包括回顾其病史,或者指令进行或进行确诊所需的测试。患有nafld的大部分个体并无症状;该病症通常因肝功能异常测试或肝肿大而被偶然性地发现,即通过不相关的病症被注意到。在50%患有单纯性脂肪变性的患者中发现肝生化指标的提高(参见例如sleisenger,sleisenger和fordtran的《胃肠道和肝脏疾病》(gastrointestinalandliverdisease,费城:w.b.桑德斯公司(philadelphia:w.b.saunderscompany(2006))。通常,诊断从常规血液检验包中的肝测试中存在指标升高开始,如丙氨酸氨基转移酶(alat)或天冬氨酸氨基转移酶(asat)的升高。更轻缓的是(evenmodest),肝脂肪堆积的亚临床增加已被发现是代谢综合症进行性发病机理的早期因素(参见例如almeda-valdés等,ann.hepatol.8增刊1:518-24(2009);polyzos等,currmolmed.9(3):299-314(2009);byrne等,clin.sci.(lond).116(7):539-64(2009))。
在评估过程中常可进行成像研究。超声波检查发现回声反射性增加的“亮”肝。因此,医学成像可有助于nafld的诊断;在算机断层扫描术(ct)中,脂肪肝具有比脾脏更低的密度,而在t1加权的磁共振成像(mri)中,脂肪显得明亮。
与单纯性脂肪肝不同,采用肝脏活检来鉴别诊断非酒精性脂肪性肝炎(nash)。对于肝脏活检,将针穿过皮肤插入以取出小片肝。当用显微镜检查该组织时显示脂肪与炎症并存且肝细胞损伤,则诊断为nash。若该组织显示有脂肪但无炎症和损伤,则诊断为单纯性nafld。因此,当指示评估严重程度时,会用到通过肝脏活检进行的组织学诊断。
在一个实例中,该对象患有脂肪变性。
在一个实例中,该对象患有nash。
在一个实例中,该对象患有肝硬化。在一个实例中,nafld是nash来源的肝硬化。在另一个实例中,肝硬化是nash相关的肝硬化。
在一个实例中,本公开的方法预防或减缓nafld的发展,例如从脂肪变性到nash或从nash到肝硬化的发展。
在一个实例中,该对象肥胖。例如,该对象的bmi为30或以上。因此,本公开提供了在肥胖对象中治疗nafld的方法,所述方法包括给予该对象抑制vegf-b的化合物。
在一个实例中,该对象患有代谢综合症。例如,该对象患有糖尿病、葡萄糖耐受性不良、空腹血糖不良或胰岛素抵抗,以及以下所述中的两项:
·血压≥140/90mmhg;
·血脂异常:甘油三酯(tg):≥1.695mmol/l以及高密度脂蛋白胆固醇(hdl-c)≤0.9mmol/l(男性),≤1.0mmol/l(女性);
·向心性肥胖:腰:臀比>0.90(男性);>0.85(女性)或体重指数>30kg/m2;
·微量白蛋白尿:尿白蛋白排泄率≥20μg/min或白蛋白:肌酐比≥30mg/g。
在一个实例中,所述对象患有糖尿病。例如,患有糖尿病的对象具有临床认可的糖尿病标志,例如:
·空腹血浆葡萄糖大于或等于7mmol/l或126mg/dl;
·随机血浆葡萄糖(一天中的任何时间获取)大于或等于11.1mmol/l或200mg/dl,伴有糖尿病症状。
·口服葡萄糖耐受性检测(ogtt)值大于或等于11.1mmol/l或200mg/dl,以两小时的间隔测量。进行ogtt的时间跨度是两或三个小时。
在一个实例中,所述对象患有2型糖尿病。
vegf-b信号转导抑制剂
包含抗体可变区的蛋白质
示例性vegf-b信号转导抑制剂包含抗体可变区,例如,结合vegf-b并中和vegf-b信号转导的抗体或抗体片段。
在一个实例中,抗体可变区特异性结合vegf-b。
合适的抗体和包含其可变区的蛋白质是本领域已知的。
例如,wo2006/012688中描述了抗vegf-b抗体及其片段。
在一个实例中,抗vegf-b抗体或其片段是竞争性抑制2h10与vegf-b结合的抗体或其抗原结合片段。在一个实例中,抗vegf-b抗体或其片段是抗体2h10或其嵌合、cdr移植或人源化形式或其抗原结合片段。就此而言,抗体2h10包含:含seqidno:3所示序列的vh,以及含seqidno:4所示序列的vl。在wo2006/012688中描述了该抗体的示例性嵌合和人源化形式。
在一个实例中,抗vegf-b抗体或其片段包含:含seqidno:5所示序列的vh,以及含seqidno:6所示序列的vl。
在一个实例中,抗vegf-b抗体或其片段是竞争性抑制4e12与vegf-b结合的抗体或其抗原结合片段。在一个实例中,抗vegf-b抗体或其片段是抗体4e12或其嵌合、cdr移植或人源化形式或其抗原结合片段。就此而言,抗体4e12包含:含seqidno:7所示序列的vh以及含seqidno:8所示序列的vl。
在一个实例中,化合物是包含人源化的抗体4e12可变区的蛋白质。例如,该蛋白质所含可变区包含抗体4e12的vh和/或vl的互补决定区(cdr)。例如,该蛋白质包含:
(i)含以下所述的vh:
(a)cdr1,其包含seqidno:7的氨基酸25-34所示序列;
(b)cdr2,其包含seqidno:7的氨基酸49-65所示序列;和
(c)cdr3,其包含seqidno:7的氨基酸98-105所示序列;和/或
(ii)含以下所述的vl:
(a)cdr1,其包含seqidno:8的氨基酸24-34所示序列;
(b)cdr2,其包含seqidno:8的氨基酸50-56所示序列;和
(c)cdr3,其包含seqidno:8的氨基酸89-97所示序列。
在一个实例中,抗vegf-b抗体或其片段是竞争性抑制2f5与vegf-b结合的抗体或其抗原结合片段。在一个实例中,抗vegf-b抗体或其片段是抗体2f5或其嵌合、cdr移植或人源化形式或其抗原结合片段。就此而言,抗体2e5包含:含seqidno:9所示序列的vh以及含seqidno:10所示序列的vl。
在一个实例中,化合物是包含人源化的抗体2f5可变区的蛋白质。例如,该蛋白质所含可变区包含抗体2f5的vh和/或vl的互补决定区(cdr)。例如,该蛋白质包含:
(i)含以下所述的vh:
(a)cdr1,其包含seqidno:9的氨基酸25-34所示序列;
(b)cdr2,其包含seqidno:9的氨基酸49-65所示序列;和
(c)cdr3,其包含seqidno:9的氨基酸98-107所示序列;和/或
(ii)含以下所述的vl:
(a)cdr1,其包含seqidno:10的氨基酸24-34所示序列;
(b)cdr2,其包含seqidno:10的氨基酸50-56所示序列;和
(c)cdr3,其包含seqidno:10的氨基酸89-96所示序列。
在另一个实例中,使用例如本领域已知或本文简要描述的标准方法制备抗体或包含其可变区的蛋白质。
基于免疫的方法
为了产生抗体,任选地用任何合适的或期望的佐剂和/或药学上可接受的运载体配制的vegf-b或其携带表位的片段或部分或其修饰形式或其编码核酸(“免疫原”)以可注射组合物形式给予对象(例如,非人类动物对象,如小鼠、大鼠、鸡等)。示例性的非人类动物是哺乳动物,如鼠类动物(例如大鼠或小鼠)。注射可以是鼻内、肌肉内、皮下、静脉内、皮内、腹膜内或其他已知途径。可任选地,免疫原被给予多次。用于制备和表征抗体的方法是本领域已知的(参见例如《抗体:实验室手册》,冷泉港实验室(antibodies:alaboratorymanual,coldspringharborlaboratory)1988)。在wo2006/012688中描述了在小鼠中产生抗vegf-b抗体的方法。
可通过在免疫后不同时间点对被免疫动物的血液进行取样来监测多克隆抗体的产生。如果需要,可以给予第二次加强注射以获得所需的抗体滴度。重复加强和滴度测定的过程直至达到合适的滴度。在获得所需免疫原性水平时,对被免疫的动物取血并分离和储存血清,和/或将该动物用于生成单克隆抗体(mab)。
单克隆抗体是本公开所涵盖的示例性抗体。通常,单克隆抗体的产生涉及在足以激发产生抗体的细胞的条件下用免疫原免疫对象(例如,啮齿类动物,例如小鼠或大鼠)。在一些实例中,免疫经遗传工程改造以表达人抗体并且不表达鼠抗体蛋白的小鼠以产生抗体(例如,如pct/us2007/008231和/或lonberg等,nature368(1994):856-859中所述)。免疫后,将产生抗体的体细胞(例如b淋巴细胞)与永生细胞例如永生化骨髓瘤细胞融合。用于产生这种融合细胞(杂交瘤)的各种方法在本领域是已知的,并且描述于例如kohler和milstein,nature256,495-497,1975。然后,可以在足以产生抗体的条件下培养杂交瘤细胞。
本公开包括用于产生抗体的其它方法,例如abl-myc技术(例如在largaespada等,curr.top.microbiol.immunol,166,91-96.1990中所述)。
基于文库的方法
本公开还包括筛选抗体或包含其抗原结合结构域(例如包含其可变区)的蛋白质的文库,以鉴定vegf-b结合抗体或包含其可变区的蛋白质。
本公开所涵盖的文库的实例包括初始文库(
根据本公开的蛋白质可以是可溶性分泌蛋白质,或者可以作为融合蛋白展示于颗粒(例如,噬菌体或其它病毒、核糖体或孢子)或细胞表面上。各种展示文库形式在本领域中是已知的。例如,文库是体外展示文库(例如,核糖体展示文库、共价展示文库或mrna展示文库,例如,如us7270969中所述)。在另一个实例中,展示文库是噬菌体展示文库,其中,包含抗体的抗原结合结构域的蛋白质在噬菌体上表达,例如如us6300064;us5885793;us6204023;us6291158;或us6248516所述。其它噬菌体展示方法是本领域已知的,并且为本公开所涵盖。类似地,细胞展示的方法也为本公开所涵盖,例如细菌展示文库,例如us5516637中所述;酵母展示文库,例如如us6423538所述,或哺乳动物展示文库。
筛选展示文库的方法是本领域已知的。在一个实例中,使用亲和纯化筛选本公开的展示文库,例如如scopes所述(《蛋白质纯化:原理和实践》第三版中,(proteinpurification:principlesandpractice,thirdedition)springerverlag公司,1994)。亲和纯化方法通常包括使包含文库展示的抗原结合结构域的蛋白质与靶抗原(例如vegf-b)接触,并且在洗涤后洗脱那些仍然结合抗原的结构域。
如果需要,通过筛选鉴定的任何可变区或scfv很容易修饰成完整的抗体。将可变区或scfv修饰或重排成完整抗体的示例性方法描述于例如jones等,jimmunolmethods.354:85-90,2010;或jostock等,jimmunolmethods,289:65-80,2004。或者或另外,采用标准克隆方法,例如,如ausubel等(刊于:《新编分子生物学方法》(currentprotocolsinmolecularbiology),韦利科学出版社;isbn047150338,1987)和/或sambrook等(刊于:《分子克隆:实验室手册》(molecularcloning:alaboratorymanual),冷泉港实验室出版社,纽约,第三版2001)中所述。
去免疫化的、嵌合的、人源化的、同人源化的、灵长类化的和人的蛋白质
本公开的蛋白质可以是人源化蛋白。
术语“人源化蛋白”应理解为指包含人样可变区(human-likevariableregion)的蛋白质,其包含移植于源自人抗体的fr上或插入源自人抗体的fr中的源自非人物种(如小鼠或大鼠或非人灵长类动物)抗体的cdr(该抗体类型也称为“cdr移植抗体”)。人源化蛋白还包含下述蛋白质:其中人蛋白质的一个或多个残基被一个或多个氨基酸取代修饰和/或人蛋白质的一个或多个fr残基被相应非人残基替代。人源化蛋白还可包含在人抗体和非人抗体中均未发现的残基。该蛋白质的任何其他区域(如fc区)通常是人的。可使用本领域已知的方法进行人源化,例如us5225539、us6054297、us7566771或us5585089。术语“人源化蛋白”还包括超人源化蛋白质,例如如us7732578中所述。
本公开的蛋白质可以是人蛋白质。本文所用术语“人蛋白质”指具有人中所见可变抗体区域和可选的恒定抗体区域的蛋白质,“人中所见”例如人生殖细胞或体细胞中所见或来自使用这类区域生成的文库。此类“人”抗体可包含不是由人序列编码的氨基酸残基,例如通过体外随机或定点突变导入的突变(特别是涉及少量蛋白质残基(例如该蛋白质的残基中的1、2、3、4或5个)中的保守取代或突变的突变)。这些“人抗体”无需作为人免疫应答的结果而生成,而是可采用重组方式(如筛选噬菌体展示文库)和/或通过包含人抗体恒定和/或可变区编码核酸的转基因动物(如小鼠)和/或采用定向选择(例如us5565332中所述)来产生。该术语还包括这类抗体的亲和成熟形式。就本公开而言,人抗体也可被认为包含如下蛋白质:该蛋白质包含源自人抗体的fr或含有源自人fr共有序列的序列的fr且其中一个或多个cdr是随机或半随机的,例如如us6300064和/或us6248516中所述。
本公开的蛋白质可以是同人源化蛋白。术语“同人源化蛋白”是指通过wo2007/019620中所述方法制备的蛋白质。同人源化蛋白包含抗体的可变区,其中该可变区包含源自新世界(newworld)灵长类动物抗体可变区的fr和源自非新世界灵长类动物抗体可变区的cdr。例如,同人源化蛋白包含抗体的可变区,其中该可变区包含源自新世界灵长类动物抗体可变区的fr和源自小鼠或大鼠抗体的cdr。
本公开的蛋白质可以是灵长类化蛋白。“灵长类化蛋白”包含源自抗体的可变区,该抗体在非人灵长类动物(如猕猴)的免疫后产生。可任选地,该非人灵长类动物抗体的可变区与人恒定区相连以产生灵长类化抗体。用于生产灵长类化抗体的示例性方法描述于us6113898。
在一个实例中,本公开的蛋白质是嵌合蛋白。术语“嵌合蛋白”是指如下蛋白质:其中的抗原结合结构域源自特定物种(例如鼠,如小鼠或大鼠)或属于特定抗体类或亚类,而该蛋白质的其余部分源自来源于其他物种(例如人或非人灵长类动物)的蛋白质或属于另一抗体类或亚类。在一个实施例中,嵌合蛋白是嵌合抗体,其包含源自非人抗体(如鼠抗体)的vh和/或vl且该抗体的其余部分源自人抗体。这类嵌合蛋白的生产是本领域已知的且可通过标准方法实现(描述于例如us6331415;us5807715;us4816567和us4816397)。
本公开还涉及去免疫化蛋白,例如如wo2000/34317和wo2004/108158中所述。去免疫化抗体和蛋白去除(即突变)了一个或多个表位(如b细胞表位或t细胞表位),从而降低对象发生针对该抗体或蛋白质的免疫应答的可能性。
包含抗体可变区的其他蛋白质
本公开还涉及包含抗体的可变区或抗原结合结构域的其它蛋白质,例如:
(i)单结构域抗体,其是包含抗体vh或vl的全部或部分的单个多肽链(参见例如us6248516);
(ii)双抗体、三抗体和四抗体,例如如us5844094和/或us2008152586中所述;
(iii)scfv,例如如us5260203中所述;
(iv)微小抗体(minibody),例如如us5837821中所述;
(v)“钥匙和匙孔”双特异性蛋白,如us5731168中所述;
(vi)异源偶联蛋白,例如如us4676980中所述;
(vii)使用化学交联剂生产的异源偶联蛋白,例如如us4676980中所述;
(viii)fab'-sh片段,例如如shalaby等,j.exp.med.,175:217-225,1992所述;或
(ix)fab3(例如如ep19930302894中所述)。
恒定域融合
本公开内容涵盖包含抗体的可变区和恒定区或fc或其结构域例如ch2和/或ch3结构域的蛋白质。合适的恒定区和/或结构域对本领域技术人员来说是显而易见的,和/或这些多肽的序列可从公众可获得的数据库中很容易地获得。kabat等人还提供了一些合适的恒定区/结构域的描述。
恒定区和/或其结构域可用于提供生物活性,例如二聚化、延长的血清半衰期,例如通过结合fcrn(新生儿fc受体)、抗原依赖性细胞毒性(adcc)、补体依赖性细胞毒性(cdc)、抗原依赖性细胞吞噬作用(adcp)。
本公开还涉及包含突变恒定区或结构域的蛋白质,例如如us7217797;us7217798;或us20090041770(具有增加的半衰期)或us2005037000(增加的adcc)中所述。
稳定化的蛋白质
本公开的中和蛋白可以包含igg4恒定区或稳定化的igg4恒定区。术语“稳定化的igg4恒定区”应理解为指经修饰以降低fab臂交换或发生fab臂交换的倾向性或形成半抗体或形成半抗体的倾向的igg4恒定区。“fab臂交换”指人igg4的一种蛋白质修饰类型,其中igg4重链和与之结合的轻链(半分子)被交换成源自另一igg4分子的重链-轻链对。这样,igg4分子可能获得识别两种不同抗原的两个不同的fab臂(形成双特异性分子)。fab臂交换在体内自然发生并可在体外用纯化的血细胞或还原剂(如还原型谷胱甘肽)诱导。当igg4抗体解离从而形成各自含有单条重链和单条轻链的两个分子时,形成“半抗体”。
在一个实例中,稳定化的igg4恒定区包含根据kabat系统(kabat等,sequencesofproteinsofimmunologicalinterest(免疫学感兴趣的蛋白质序列),华盛顿特区,美国,健康与人类服务部,1987和/或1991)确定的铰链区第241位处的脯氨酸。该位置对应于根据eu编码系统(kabat等,sequencesofproteinsofimmunologicalinterest(免疫学感兴趣的蛋白质序列),华盛顿特区,美国,健康与人类服务部,2001和edelman等,proc.natl.acad.usa,63,78-85,1969)确定的铰链区第228位。在人igg4中,该残基通常是丝氨酸。在用脯氨酸取代丝氨酸后,该igg4铰链区包含序列cppc。就此而言,本领域技术人员应理解,“铰链区”是连接fc和fab区的抗体重链恒定区的富脯氨酸部分,其赋予抗体两条fab臂移动性。该铰链区包含半胱氨酸残基,其涉及重链间二硫键。根据kabat的编号系统,其通常定义为从人igg1的glu226至pro243。可通过形成重链间二硫(s-s)键的第一和最后一个半胱氨酸残基的对其来进行其他igg同种型的铰链区与igg1序列的比对(参见例如wo2010/080538)。
基于其他蛋白质的vegf-b信号转导抑制剂
可能干扰vegf-b与其受体的有效相互作用的其它蛋白质包括突变型vegf-b蛋白。
在一个实例中,抑制剂是包含结合vegf-b(且,例如基本上不与vegf-a结合)的vegf-r1的一个或多个结构域的可溶性蛋白。在一个实例中,可溶性蛋白另外包含抗体(例如igg1抗体)的恒定区。例如,可溶性蛋白另外包含fc区和可任选的抗体(例如igg1抗体)的铰链区。
在一个实例中,蛋白抑制剂是抗体模拟物,例如包含以类似于抗体的方式结合靶蛋白的可变区的蛋白质支架。关于示例性抗体模拟物的描述如下。
免疫球蛋白和免疫球蛋白片段
本公开的化合物的实例是包含免疫球蛋白可变区的蛋白质,例如t细胞受体或重链免疫球蛋白(例如,ignar,骆驼抗体)。
重链免疫球蛋白
重链免疫球蛋白在结构上与许多其他形式的免疫球蛋白(例如抗体)不同在于虽然其包含重链,但不包含轻链。因此,这些免疫球蛋白也被称为“仅重链抗体”。重链免疫球蛋白存在于例如骆驼科动物和软骨鱼中(也称作ignar)。
天然重链免疫球蛋白中的可变区通常称作骆驼科ig中的“vhh结构域”和ignar中的v-nar,从而将其与常规四链抗体中的重链可变区(其称作“vh结构域”)和常规四链抗体中的轻链可变区(其称作“vl结构域)区分开。
重链免疫球蛋白不需要轻链的存在来实现与相关抗原的高亲和力和高特异性结合。这意味着单结构域结合片段可以衍生自重链免疫球蛋白,它们易于表达并且通常是稳定和可溶的。
源自骆驼科的重链免疫球蛋白及其可变区和其生产和/或分离和/或使用方法的一般描述参见以下参考文献(但不限于此):wo94/04678、wo97/49805和wo97/49805。
源自软骨鱼的重链免疫球蛋白及其可变区和其生产和/或分离和/或使用方法的一般描述参见wo2005/118629(但不限于此)。
v-样蛋白
本公开中化合物的一个实例是t细胞受体。t细胞受体具有两个v结构域,其结合成类似于抗体fv模块的结构。novotny等,procnatlacadsciusa88:8646-8650,1991描述了t细胞受体的两个v-结构域(称为α和β)如何融合并表达为单链多肽,以及如何改变表面残基以类似于抗体scfv地直接降低疏水性。描述包含两个v-α和v-β结构域的单链t细胞受体或多聚体t细胞受体的生产的其他公开文献包括wo1999/045110或wo2011/107595。
包含抗原结合结构域的其它非抗体蛋白包括通常为单体的具有v样结构域的蛋白质。包含这种v样结构域的蛋白质的实例包括ctla-4、cd28和icos。包含这种v样结构域的蛋白质的进一步公开包括在wo1999/045110中。
附着连接蛋白(adnectin)
在一个实例中,本公开中的化合物是附着连接蛋白(adnectin)。附着连接蛋白基于人纤维连接蛋白的第十纤连蛋白iii型(10fn3)结构域,其中环区被改变以赋予抗原结合能力。例如,可以对10fn3结构域β-夹心的一端的三个环进行工程改造以使附着连接蛋白能够特异性识别抗原。更详细内容参见us20080139791或wo2005/056764。
抗运载蛋白(anticalins)
在另一个实例中,本公开中的化合物是抗运载蛋白。抗运载蛋白衍生自脂质运载蛋白,其是运输小疏水分子如类固醇、胆汁三烯、类维生素a和脂质的胞外蛋白家族。脂质运载蛋白具有刚性β-折叠二级结构,在锥形结构的开口端具有多个环,它们可被工程化改造以结合抗原。这种工程化改造的脂质运载蛋白被称为抗运载蛋白。有关抗运载蛋白的进一步描述,请参见us7250297b1或us20070224633。
亲和体
在另一个实例中,本公开中的化合物是亲和体。亲和体是衍生自金黄色葡萄球菌(staphylococcusaureus)蛋白a的z结构域(抗原结合结构域)的骨架,可被工程化改造以结合抗原。z结构域由约58个氨基酸的三螺旋束组成。已通过表面残基的随机化产生文库。详见ep1641818。
高亲合性多聚体(avimer)
在另一个实例中,本公开中的化合物是高亲合性多聚体。高亲合性多聚体是衍生自a结构域骨架家族的多结构域蛋白。约35个氨基酸的天然结构域采用确定的二硫键合结构。多样性产生于a结构域家族所展示的自然变异的重组。详见wo2002088171。
darp蛋白(darpins)
在另一个实例中,本公开中的化合物是设计的锚蛋白重复蛋白(designedankyrinrepeatprotein,darpin)。darp蛋白衍生自锚蛋白,是介导整合膜蛋白与细胞骨架附着的蛋白家族。单个锚蛋白重复是由两个α-螺旋和一个β-转角组成的33个残基基序。它们可以被工程化改造成通过随机化每个重复的β-转角和第一α-螺旋中的残基来结合不同的靶抗原。可以通过增加模块数量(亲和力成熟法)来增加它们的结合界面。详见us20040132028。
生产蛋白质的方法
重组表达
就重组蛋白而言,可将其编码核酸克隆至表达载体,随后将该表达载体转染至宿主细胞,例如大肠杆菌细胞、酵母细胞、昆虫细胞或哺乳动物细胞(如猿cos细胞、中华仓鼠卵巢(cho)细胞、人胚胎肾(hek)细胞)或本不生产抗体的骨髓瘤细胞。用于表达本公开的蛋白质的示例性细胞是cho细胞、骨髓瘤细胞或hek细胞。实现这些目的的分子克隆技术是本领域已知的且描述于例如ausubel等(编),currentprotocolsinmolecularbiology(《新编分子生物学实验指南》),格林出版联合公司和韦利科学公司(1988,包括直至今日的所有更新)或sambrook等,molecularcloning:alaboratorymanual(《分子克隆:实验室手册》),冷泉港实验室出版社(1989)。多种克隆和体外扩增方法适用于重组核酸的构建。生产重组抗体的方法是本领域已知的,参见例如us4816567或us5530101。
分离后,插入核酸使其可操作地连接于表达构建体或表达载体中的启动子以用于进一步克隆(dna的扩增)或用于在无细胞系统或细胞中表达。
本文所用术语“启动子”应取其最广泛的含义,并包括基因组基因的转录调控序列,包括精确的转录起始所必需的起始元件或tata盒,其具有或不具有改变核酸表达的其他调控元件(例如上游激活序列、转录因子结合位点、增强子和沉默子),例如在对发育和/或外部刺激的应答中,或以组织特异性方式。本文中,术语“启动子”还用于描述重组、合成或融合核酸或衍生物,其赋予、激活或增强与之可操作地连接的核酸的表达。示例性的启动子可含有一个或多个特定调控元件的更多拷贝以进一步增强所述核酸的表达和/或改变所述核酸的空间表达和/或时间表达。
本文所用术语“可操作地连接”指相对于核酸来设置启动子的位置从而使得该核酸的表达受该启动子的控制。可以获得用于在细胞中表达的许多载体。载体组分一般包括但不限于下述的一种或多种:信号序列、抗体编码序列(例如衍生自本文所提供的信息)、增强子元件、启动子和转录终止序列。本领域技术人员知道用于抗体表达的合适序列。示例性的信号序列包括原核分泌信号(如pelb、碱性磷酸酶、青霉素酶、ipp或热稳定肠毒素ii)、酵母分泌信号(如转化酶前导序列、α因子前导序列或酸性磷酸酶前导序列)或哺乳动物分泌信号(如单纯疱疹gd信号)。
在哺乳动物细胞中有活性的示例性启动子包括巨细胞病毒立即早期启动子(cmv-ie)、人延伸因子1-α启动子(ef1)、小核rna启动子(u1a和u1b)、α-肌球蛋白重链启动子、猿病毒40启动子(sv40)、劳氏肉瘤病毒启动子(rsv)、腺病毒主要晚期启动子、β-肌动蛋白启动子;包含cmv增强子/β-肌动蛋白启动子或免疫球蛋白启动子或其活性片段的杂交调控元件。有用的哺乳动物宿主细胞系的示例是用sv40转化的猴肾cv1系(cos-7,atcccrl1651);人胚胎肾系(293或亚克隆的293细胞,用于在悬浮培养物中生长);幼仓鼠肾细胞(bhk,atccccl10);或中华仓鼠卵巢细胞(cho)。
适用于酵母细胞(例如选自下组的酵母细胞:毕赤酵母(pichiapastoris)、酿酒酵母(saccharomycescerevisiae)和粟酒裂殖酵母(s.pombe))中表达的典型启动子包括但不限于:adh1启动子、gal1启动子、gal4启动子、cup1启动子、pho5启动子、nmt启动子、rpr1启动子或tef1启动子。
将分离的核酸或包含该物质的表达构建体导入细胞用于表达的方法是本领域技术人员已知的。用于给定细胞的技术依赖于已知的成功技术。将重组dna导入细胞的方法包括微注射、deae-葡聚糖介导的转染、脂质体介导的转染(如通过使用脂质转染胺试剂(美国马里兰州的吉布科公司(gibco))和/或细胞转染试剂(美国马里兰州的吉布科公司))、peg介导的dna摄取、电穿孔和微粒轰击(例如通过使用dna包覆的钨或金颗粒(美国威斯康星州的安哥路斯特公司(agracetusinc.))等。
用于生产抗体的宿主细胞可在多种培养基中培养,这取决于使用的细胞类型。市售可得的培养基(如ham'sf10(西格玛公司)、极限必需培养基(mem)(西格玛公司)、rpml-1640(西格玛公司)和达尔伯克改良伊格尔培养基(dmem)(西格玛公司))适用于培养哺乳动物细胞。用于培养本文所讨论的其他细胞类型的培养基是本领域已知的。
蛋白质纯化
生产/表达后,使用本领域已知的方法纯化本公开中的蛋白质。这种纯化提供了基本上不含非特异性蛋白质、酸、脂质、碳水化合物等的本公开中的蛋白质。在一个实例中,蛋白质将处于制剂中,其中制剂中超过约90%(例如95%,98%或99%)的蛋白质是本公开的蛋白质。
使用肽纯化的标准方法来获得本公开的分离的蛋白质,包括但不限于各种高压(或高效)液相色谱(hplc)和非hplc多肽分离方案,例如尺寸排阻色谱法,离子交换色谱法,疏水相互作用色谱法,混合模式色谱法,相分离方法,电泳分离,沉淀方法,盐溶/盐析方法,免疫色谱法和/或其他方法。
在一个实例中,亲和纯化可用于分离包含标记的融合蛋白。使用亲和层析法分离蛋白质的方法是本领域已知的,例如scopes所述(刊于:proteinpurification:principlesandpractice(《蛋白纯化:原理和实践》),第三版,施普林格弗莱格公司(springerverlag),1994)。例如,结合标记的抗体或化合物(在多组氨酸标签的情况下,可以是例如镍-nta)被固定在固体支持物上。然后将包含蛋白质的样品与固定的抗体或化合物在足以发生结合的条件下接触一段时间。洗涤后除去任何未结合或非特异性结合的蛋白质,蛋白质被洗脱。
在包含抗体fc区的蛋白质的情况下,蛋白a或蛋白g或其修饰形式可用于亲和纯化。蛋白a可用于分离包含人γ1、γ2或γ4重链fc区的纯化蛋白。蛋白g被推荐用于所有小鼠fc同种型和人γ3。
基于核酸的vegf-b信号转导抑制剂
在本公开的一个实例中,根据本公开任何实例的本文所述的治疗和/或预防方法涉及降低vegf-b的表达。例如,这种方法包括给予减少核酸的转录和/或翻译的化合物。在一个实例中,所述化合物是核酸,例如反义多核苷酸、核酶、pna、干扰rna、sirna、微小rna。
反义核酸
术语“反义核酸”应被理解是指与编码如本公开的任何示例中所述的多肽的特定mrna分子的至少一部分互补并且能够干扰转录后事件(例如mrna翻译)的dna或rna或其衍生物(例如,lna或pna)或其组合。反义方法的使用在本领域中是已知的(参见例如hartmann和endres(编辑),反义方法手册(manualofantisensemethodology),kluwer出版社(1999))。
本公开中的反义核酸在生理条件下与靶核酸杂交。反义核酸包括对应于结构基因或编码区的序列或对应于影响对基因表达或剪接的控制的序列。例如,反义核酸可以对应于编码vegf-b的核酸的靶向编码区或5'非翻译区(utr)或3'-utr或它们的组合。其可与在转录过程之中或之后被剪接掉的内含子序列部分互补,例如仅与靶基因的外显子序列互补。反义序列的长度应为编码vegf-b的核酸的至少19个连续核苷酸,例如至少50个核苷酸,例如至少100、200、500或1000个核苷酸。可以使用与整个基因转录产物互补的全长序列。长度可以是100-2000个核苷酸。反义序列与靶转录产物的同一性程度应至少为90%,例如95-100%。
针对vegf-b的示例性反义核酸描述于例如wo2003/105754中。
催化性核酸
术语“催化性核酸”是指特异性识别不同的底物并催化该底物的化学修饰的dna分子或含dna分子(在本领域中也称为“脱氧核酶”或“dna酶”)或rna或含rna分子(也称为“核酶”或“rna酶”)。催化性核酸中的核酸碱基可以是碱基a、c、g、t(以及用于rna的u)。
通常,催化性核酸含有用于特异性识别靶核酸的反义序列和切割酶活性的核酸(本文中也称为“催化结构域”)。在本公开中有用的核酶类型是锤头核酶和发夹核酶。
rna干扰
rna干扰(rnai)可用于特异性抑制特定蛋白质的产生。不受理论的限制,该技术依赖于dsrna分子的存在,所述dsrna分子含有基本上与目的基因的mrna或其一部分(在本文情况下是编码vegf-b的mrna)相同的序列。方便地,该dsrna可以在重组载体宿主细胞中由单个启动子产生,其中正义和反义序列侧翼的无关序列使得正义和反义序列能够杂交以形成dsrna分子,而无关序列则形成环状结构。适于本公开的dsrna分子的设计和生产完全在本领域技术人员的能力范围内,特别是考虑到wo99/32619、wo99/53050、wo99/49029和wo01/34815。
杂交的正义和反义序列的长度应分别为至少19个连续核苷酸,例如至少30或50个核苷酸,例如至少100、200、500或1000个核苷酸。可以使用与整个基因转录产物相对应的全长序列。长度可以是100-2000个核苷酸。正义和反义序列与靶转录产物的相同性程度应至少为85%,例如至少90%,例如95-100%。
示例性的小干扰rna(“sirna”)分子包含与靶mrna的约19-21个连续核苷酸相同的核苷酸序列。例如,sirna序列以二核苷酸aa开头,包含约30-70%的gc含量(例如30-60%,如40-60%,例如约45%-55%),并且与其将被引入的哺乳动物基因组中的靶基因之外的任何核苷酸序列不具有高百分比非相同性(例如通过标准blast检索确定)。减少vegf-b表达的示例性sirna可从santacruz生物科技公司或novus生物公司购得。
减少vegf-b表达的短发夹rna(shrna)也是本领域已知的,可从santacruz生物科技公司购得。
筛选试验
可以使用本领域已知的技术来鉴定抑制vegf-b信号转导的化合物,例如如下所述。类似地,可以采用本领域已知的技术来确定或估计适用于本文所述方法的vegf-b信号转导抑制剂的量,例如如下所述。
中和试验
对于结合vegf-b并抑制信号转导的化合物,可以采用中和试验。
在一个实例中,中和试验涉及在存在或不存在可检测标记的可溶性vegf-r1的条件下将vegf-b与化合物接触,或在存在或不存在表达vegf-r1或可溶性vegf-r1的细胞的条件下将可检测标记的vegf-b与化合物接触。然后评估与vegf-r1结合的vegf-b的水平。与不存在该化合物相比,在该化合物存在下结合的vegf-b的水平降低表明该化合物抑制vegf-b与vegf-r1的结合,并且因此抑制vegf-b信号转导。
在wo2006/012688中描述了另一种中和试验法,并且涉及将固定在固体支持物上的包含第二ig样结构域的vegf-r1片段与和亚饱和浓度的经化合物预孵育的重组vegf-b接触。洗涤后除去未结合的蛋白质,将固定化的蛋白质与抗vegf-b抗体接触,测定结合的抗体量(指示固定化的vegf-b)。相比不存在该化合物时的水平,降低结合抗体水平的化合物被认为是vegf-b信号转导的抑制剂。
在另一个实例中,采用依赖于vegf-b信号转导增殖的细胞来鉴定抑制vegf-b信号转导的化合物,例如,如wo2006/012688中所述修饰baf3细胞以表达掺入了人红细胞生成素受体胞内结构域和vegf-r1胞外结构域的嵌合受体。细胞在存在vegf-b且存在或不存在化合物的条件下培养。然后采用标准方法,例如集落形成试验、胸苷掺入或其他合适细胞增殖标记物的摄取(例如mts染料还原试验)来评估细胞增殖。在vegf-b存在下降低增殖水平的化合物被认为是vegf-b信号转导的抑制剂。
还可以采用标准方法评价化合物与vegf-b结合的能力。评估与蛋白质结合的方法是本领域已知的,例如scopes所述(刊于:proteinpurification:principlesandpractice(《蛋白纯化:原理和实践》),第三版,施普林格弗莱格公司(springerverlag),1994)。这种方法通常包括标记化合物并使其与固定化的vegf-b接触。清洗以除去非特异性结合的化合物后,检测标记的量并由此检测结合的化合物的量。当然,化合物可以被固定化,并且vegf-b可以被标记。还可使用淘选型试验(panning-typeassay)。或者或此外,可以采用表面等离振子共振试验。
表达试验
通过使细胞与化合物接触并确定vegf-b的表达水平来鉴定减少或阻止vegf-b表达的化合物。在核酸水平上确定基因表达的合适方法是本领域已知的,包括例如定量聚合酶链反应(qpcr)或微阵列试验。在蛋白质水平上确定表达的合适方法也是本领域已知的,包括例如酶联免疫吸附试验(elisa)、荧光免疫吸附试验(flisa)、免疫荧光或western印迹法。
体内试验
可在nafld动物模型中测试本文所述的化合物。
例如,高脂饮食饲喂的小鼠(例如c57/bl6小鼠)表现出类似于患有nash的人中所见的代谢特征,具有肥胖症、葡萄糖耐受不良、胰岛素抵抗、血脂异常和脂肪生成和促炎细胞因子调控因子表达增加。
在另一实例中,胆碱缺乏高脂饮食饲喂的小鼠(例如c57/bl6小鼠)表现出类似于患有nash的人中所见的特征,包括肥胖症、葡萄糖耐受性不良、胰岛素抵抗、免疫细胞浸润和卫星现象。这些小鼠还可继续发展成纤维化和肝硬化,并远期发展成肝细胞癌。
通过以包含高脂肪和高果糖水平的“西式饮食”饲喂小鼠来诱导另一适合的小鼠模型。这些小鼠显示肥胖症、胰岛素抵抗、血脂异常、高血糖和nafld。
其他适合的基于饮食的模型包括用低甲硫氨酸饮食饲喂的小鼠。
还存在多种nafld/nash遗传模型,如固醇调节元件结合蛋白(srebp)-1c转基因小鼠以及第10号染色体上同源性磷酸酶和张力蛋白(pten)缺失的小鼠。在这些模型中,首先发生肝脂肪变性,然后发展为脂肪性肝炎。
药物组合物和治疗方法
抑制vegf-b信号转导的化合物(合成活性成分)可用于胃肠外、外用、口服或局部给药,气雾剂给药或透皮给药,用于预防性或治疗性治疗。在一个实例中,化合物通过肠胃外给药,例如皮下或静脉内给予。
待给予的化合物的配制将根据所选择的给药途径和制剂(例如溶液、乳剂、胶囊)而不同。可以在生理上可接受的运载体中制备包含待给予化合物的合适药物组合物。对于溶液或乳剂,合适的运载体包括例如水溶液或醇/水溶液、乳液或悬浮液,包括盐水和含缓冲的介质。胃肠道外载剂可包括氯化钠溶液、林格右旋糖、右旋糖和氯化钠、乳酸林格溶液或非挥发性油。各种合适的水性运载体是本领域技术人员已知的,包括水、含缓冲的水、含缓冲的盐水、多元醇(例如甘油、丙二醇、液体聚乙二醇)、右旋糖溶液和甘氨酸。静脉内载剂可以包括各种添加剂、防腐剂或流体、营养物质或电解质补充剂(通常可参见《雷明顿药物科学》(remington'spharmaceuticalscience)第16版,mack编,1980)。组合物可根据需要可任选地含有药学上可接受的辅助物质以接近生理条件,如ph调节和缓冲剂和毒性调节剂,例如乙酸钠、氯化钠、氯化钾、氯化钙和乳酸钠。根据本领域已知的冻干和重建技术,该化合物可以在使用前冻干储存并在合适的运载体中重建。
所选介质中活性成分的最佳浓度可以根据本领域技术人员已知的程序经验性地确定,并且将取决于所需的最终药物制剂。
本公开的化合物的给药剂量范围是大到足以产生所需效果的剂量范围。例如,组合物包含治疗或预防有效量的化合物。
如本文所用,术语“有效量”应被理解为指足以抑制/减少/防止对象中vegf-b信号转导的量的化合物。本领域技术人员应知道,这样的量将根据例如化合物和/或特定对象和/或所治疗的nafld的类型和/或严重程度而不同。因此,该术语不应被解释为将本公开限制于特定量,例如化合物的重量或数量。
如本文所用,术语“治疗有效量”应被理解为指足以减少或抑制一种或多种nafld症状或其并发症的量的化合物。
本文所用术语“预防有效量”应理解为指足以预防或抑制或延迟nafld或其并发症的一种或多种可检测症状发生的量的化合物。
在一个实例中,化合物以有效地具有以下一种或多种效果的量给予:
·降低或防止脂质(例如中性脂质)在对象肝脏中堆积,例如由肝脏活检样品所评估;
·降低或防止对象肝脏中的炎症,例如通过减少对象肝脏中免疫细胞的数量;
·降低或防止对象肝脏中nafld的病理变化(如mallory-denk体或肝细胞膨胀或炎性病灶或卫星现象)的发展;
·减少或防止肝纤维化和/或肝硬化;
·减少或防止肝细胞癌的形成。
在一个实例中,化合物的给予量足以将对象肝脏中脂质堆积水平降低到非患有nafld对象群体中所见的水平。
剂量不宜大到引起不良副作用,如高粘滞综合征、肺水肿、充血性心力衰竭等。通常,剂量将随着患者的年龄、病症、性别和疾病的程度而不同,并且可以由本领域技术人员确定。如果发生任何并发症,可由医师调整剂量。
剂量可以在约0.1mg/kg至约300mg/kg之间变化,例如约0.2mg/kg至约200mg/kg,如约0.5mg/kg至约20mg/kg,每天给药一次或多次,持续一天或多天。
在一些实例中,化合物以高于后续(维持剂量)剂量的初始(或加载)剂量给予。例如,化合物以约1mg/kg至约30mg/kg的初始剂量给予。然后,以约0.0001mg/kg至约1mg/kg的维持剂量给予该化合物。维持剂量可以每7-35天给予,如每14或21或28天给予。
在一些实例中,采用剂量递增方案,其中化合物最初以比后续剂量所用更低的剂量给予。该剂量方案在对象最初遭受不良事件的情况下是有用的。
在对象未对治疗产生充分应答的情况下,可在一周内给予多重剂量。或者或此外,可给予提高的剂量。
通过给予多于一次的接触或一组剂量,如接触化合物至少约两次,例如接触约2-60次,更具体为接触约2-40次,更具体为接触约2-20次,可以用化合物再次治疗对象。
在一个实例中,可在疾病征兆或症状再次出现(例如当微量蛋白尿发展时)时给予各自再治疗。
在另一实例中,可按确定的间隔给予各自再治疗。例如,可按照多种间隔,例如约24-28周或48-56周或更长的间隔给予后续接触。例如,此类接触可按照各自为约24-26周或38-42周或约50-54周的间隔给予。
本公开的方法还可包括共同给予本公开的至少一种化合物和另一治疗有效的物质以预防或治疗糖尿病和/或肥胖症。
在一个实例中,本公开的化合物与目前正在使用或正在开发的用于预防或治疗糖尿病的至少一种其他已知化合物组合使用。此类已知化合物的例子包括但不限于常见的抗糖尿病药物,例如磺酰脲类(例如格列齐特、格列吡嗪),二甲双胍,格列酮类(例如罗格列酮,吡格列酮),钠-葡萄糖协同转运蛋白-2(sglt2)抑制剂(例如,卡格列净(canagliflozin)、达格列净(dapagliflozin)、恩帕列净(empagliflozin)),餐食葡萄糖释放剂(如瑞格列奈、那格列奈),阿卡波糖和胰岛素(包括所有天然的、合成的和修饰形式的胰岛素,如人、牛或猪来源的胰岛素;悬浮于例如低精蛋白(isophane)或锌中的胰岛素及其衍生物,例如谷赖胰岛素、赖脯胰岛素、赖脯胰岛素鱼精蛋白、甘精胰岛素、地特胰岛素或门冬胰岛素)。
另外,本公开的方法还可以包括共同施用至少一种其他治疗剂以治疗与nafld直接或间接相关的其他疾病。可以与根据本发明的化合物共同施用的物质的其他例子是用于降低胆固醇和甘油三酯的化合物(例如贝特类(例如,gemfibroziltm)和hmg-coa抑制剂,例如lovastatintm、atorvastatintm、fluvastatintm、lescoltm)、lipitortm、mevacortm)、pravacholtm、pravastatintm、simvastatintm、zocortm、cerivastatintm等);抑制脂质的肠吸收的化合物(例如,依替米德(ezetiminde));烟酸;法呢醇x受体激动剂(例如,奥贝胆酸、6α-乙基-鹅去氧胆酸(6-ecdca))和维生素d。
从上文将显而易见,本公开提供了对对象的联合治疗性处理(concomitanttherapeutictreatment)的方法,其包括向有需要的对象给予有效量的第一化合物和第二化合物,其中所述第一化合物是本公开的化合物(即vegf-b信号转导的抑制剂),第二化合物用于预防或治疗糖尿病或肥胖症。
如本文所用,术语“联合”用于短语“联合治疗性处理”包括在第二化合物存在下给予第一化合物。联合治疗性处理的方法包括共同给予第一、第二、第三或其它化合物的方法。联合治疗性处理方法还包括其中在第二或其他化合物的存在下给予第一或其他化合物的方法,其中例如可以先给予第二或其它化合物。可通过不同实施者(actor)分步骤实施联合治疗性处理方法。例如,一个实施者可给予对象第一化合物,而第二实施者可给予该对象第二化合物,并且可以在同一时间或几乎相同的时间或相隔较远的时间实施给药步骤,只要第一化合物(和/或其他化合物)在第二化合物(和/或其他化合物)存在下给药之后。实施者和该对象可以是相同的实体(例如同一人)。
在一个实例中,本公开还提供了在对象中治疗或预防nafld的方法,该方法包括给予该对象包含至少一种本公开化合物的第一药物组合物以及包含一种或多种其他化合物的第二药物化合物。
在一个实例中,本公开的方法包括给予患有nafld并接受其他治疗(例如针对糖尿病的治疗)的对象vegf-b信号转导抑制剂。
试剂盒/药盒
本公开的另一个实例提供了包含如上所述用于治疗nafld的化合物的试剂盒/药盒。
在一个实例中,试剂盒/药盒包含:(a)容器,其包含本文所述的抑制vegf-b信号转导的化合物,可任选地包含于药学上可接受的运载体或稀释剂中;和(b)含有关于治疗对象中nafld或其并发症的说明的包装插页。
根据本公开的该实例,包装插页在容器上或与容器相关联。合适的容器包括例如,瓶、小瓶和注射器等。该容器可由各种材料如玻璃或塑料制成。容器装载或包含有效治疗nafld的组合物,并且可具有无菌进入端口(例如,所述容器可以是具有皮下注射针可刺穿塞子的静脉输液袋或小瓶)。组合物中的至少一种活性剂是抑制vegf-b信号转导的化合物。标签或包装插页指示组合物用于治疗符合治疗条件的对象,例如具有或易患nafld的对象,并提供关于化合物和任何其他药物的给药量和间隔的具体指导。试剂盒/药盒还可以包含其他的容器,其包含药学上可接受的稀释缓冲液,例如用于注射的抑菌水(bwfi)、磷酸盐缓冲盐水、林格氏溶液和/或右旋糖溶液。试剂盒/药盒还可以包括就商业和用户角度而言所需的其它材料,包括其它缓冲液、稀释剂、过滤器、针头和注射器。
试剂盒/药盒可任选地还包含含第二药物的容器,抑制vegf-b信号转导的化合物是第一药物,且该制品还包含包装插页上指导用有效量的第二药物治疗对象的说明。该第二药物可任意选自前文所述。
本发明包括以下非限制性实施例。
实施例1:vegf-b缺陷小鼠抵抗非酒精性脂肪肝病(nafld)和非酒精性脂肪性肝炎(nash)的发展
vegf-b缺陷糖尿病小鼠受保护而免受肝损伤
用高脂饮食(60%卡路里来自脂肪)饲喂5周龄c57bl/6野生型(wt)和c57bl/6-vegfb-/-小鼠30周。用低脂对照饮食(正常饲料,10%卡路里来自脂肪)饲喂周龄和性别匹配c57bl/6wt小鼠30周。每两周于断食2小时后的同一时间测量血糖,作为稳定血糖水平的平均值。切断尾尖,用葡萄糖计测量血滴。在终点时,测定血清氨基转移酶(alat)水平。
图1a和1b显示与周龄匹配的饲料饲喂小鼠相比,高脂饮食(hfd)饲喂小鼠显示提高的血糖水平和体重(分别见图1a和1b)。
图1c显示血清alat水平在hfd饲喂小鼠中提高了15倍,而vegf-b缺陷hfd饲喂小鼠的血清alat水平降低至与周龄匹配的hfd饲喂wt小鼠相仿的水平。
这些数据证明了hfd饲喂小鼠中的vegfb消除减少了肝损伤,但不指向高血糖症。
vegfb缺失在hfd饲喂小鼠中降低肝脂质堆积
在分离自hfd饲喂野生型、hfd饲喂vegfb-/-和饲料饲喂野生型小鼠的肝脏上进行油红o(oro)分析。简而言之,切取肝脏,在干冰上急冻,并直接在低温恒温器的模具中包埋于tissue-
检测分离的肝脏中脂肪酸合成酶(fasn)的表达水平。采用rneasymini试剂盒(英国凯杰公司(qiagen))根据生产商说明书从肝脏提取和纯化总rna。采用iscriptcdna合成试剂盒(bio-rad公司)由0.5-1μg总rna合成第一链cdna。根据制造商的说明书,采用kapasybrfastqpcrkitmastermix(2×)universal(kapabiosystems公司)在rotor-geneq(qiagen公司)实时pcr热循环仪上进行实时定量pcr。表达水平相对于l19和β-2微球蛋白的表达标准化。
在vegf-b表达降低的hfd饲喂小鼠中,肝脂质液滴堆积和结构得以改善。具体而言,与野生型hfd饲喂小鼠相比,获自vegfb缺陷hfd饲喂小鼠的肝脏切片中脂质液滴的数量和尺寸均减小。
图2显示了hfd饲喂小鼠中vegf-b水平的降低减少了肝脏中性脂质的含量。
hfd饲喂小鼠中vegfb缺失防止肝脂肪变性发展
将hfd饲喂野生型、hfd饲喂vegfb-/-和饲料饲喂野生型小鼠用于分析。切取肝脏,在4%pfa中固定24小时,然后采用标准程序进行石蜡包埋并制备6μm切片。简而言之,采用抗原修复溶液ph6(dako#s2367)进行抗原修复,并在98℃加热10分钟。将切片与如下一抗在4℃一起孵育过夜:豚鼠抗亲脂素(fitzgerald公司)或豚鼠抗tip47(progen公司)抗体。在加入合适的荧光标记二抗(invitrogen公司alexafluor)前,将样品与生物素化驴抗豚鼠抗体(jackson公司)一起在室温下孵育1小时。用axiovision显微镜(carlzeiss公司)以20倍的放大率,对每只动物各切片中对亲脂素或tip47的染色拍摄至少10帧照片。采用用于肝脏i)亲脂素染色(像素2/μm2)或ii)tip47染色(像素2/μm2)的axiovisonrun向导程序对相应染色的量进行定量。
还采用前述方法对饲料饲喂野生型、hfd饲喂野生型和hfd饲喂vegfb-/-小鼠中的亲脂素(plin2a)表达进行了测定。
图3显示了与hfd饲喂的野生型小鼠相比,hfd饲喂vegfb-/-小鼠肝脏中的脂质含量降低了5-10倍(通过pat蛋白、亲脂素(a,c)和甘露糖-6-磷酸受体结合蛋白(tip47;b)表达测定)。与hfd饲喂的野生型小鼠相比,hfd饲喂vegfb-/-小鼠中的脂质vegf-b表达减少保持了肝脏具有较小脂质液滴的形态学。这些数据表明在hfd饲喂小鼠中降低vegf-b水平防止肝脏脂肪变性的发展,并且vegf-b信号转导途径是治疗非酒精性脂肪肝病的适宜靶点。
hfd饲喂小鼠中vegfb缺失防止肝脏炎症发展
将hfd饲喂野生型、hfd饲喂vegfb-/-和正常饲料饲喂野生型小鼠用于分析。分离肝脏并在干冰上急冻。将肝脏活检样品直接在低温恒温器的模具上包埋于tissue-
还采用前述方法对饲料饲喂野生型、hfd饲喂野生型和hfd饲喂vegfb-/-小鼠中的单核细胞化学诱导蛋白-1(mcp1)的表达进行了测定。
如图4所示,hfd饲喂造成脂肪变性肝脏中的炎症细胞群增加了2-3倍(图4a和4b)。hfd饲喂小鼠中的mcp1上调证实了肝脏炎症的增加。在vegf-b表达降低的hfd饲喂小鼠中肝脏脂肪变性和炎症细胞数量均减少(图4a-c)。
hfd饲喂小鼠中vegfb缺失减少nash和nash相关病变
将hfd饲喂野生型、hfd饲喂vegfb-/-和饲料饲喂野生型小鼠用于分析。切取肝脏,在4%pfa中后固定24小时,然后采用标准方法进行石蜡包埋。包埋后,制备6μm切片,根据生产商说明书用苏木精-伊红(h&e)进行染色。用亮视野显微镜(axiovision显微镜,carlzeiss公司)以40倍的放大率,对每只动物各切片中的h&e染色拍摄至少20帧照片,并分析h&e染色切片中膨胀肝细胞、mdb形成、炎症灶和卫星现象的存在。基于h&e染色切片各帧中膨胀肝细胞、mdb形成、炎症灶和卫星现象的数量进行评分。对于各动物,计算在h&e染色肝脏切片中鉴别到的所有膨胀肝细胞、mdb形成、炎症灶和卫星现象的平均值。nash总评分计算为各组中平均值的总和。
如表1所示,hed饲喂小鼠的肝脏显示有膨胀肝细胞和mdb形成,以及程度较轻的免疫细胞浸润和卫星现象。hfd饲喂小鼠中vegf-b水平的降低则减少了这些人nash相关病变的出现。
图5显示与hfd饲喂小鼠相比,hfd饲喂小鼠中vegf-b水平降低使得nash总评分降低了超过50%。
表1,vegfb基因缺失的hfd饲喂小鼠中的肝脏nash评分
结果表示为平均值s.e.m。####表示与饲料饲喂野生型相比p<0.0001,*表示与hfd饲喂野生型小鼠相比p<0.05。采用双向anova进行统计学分析。
实施例2:中和性抗vegf-b抗体治疗或预防非酒精性脂肪肝病(nafld)和非酒精性脂肪性肝炎(nash)发展
抗体介导的vegf-b抑制中等程度地地影响hfd饲喂小鼠的肝功能
用高脂饮食(60%卡路里来自脂肪)饲喂5周龄c57bl/6野生型(wt)小鼠30周。用低脂对照饮食(正常饲料,10%卡路里来自脂肪)饲喂周龄和性别匹配c57bl/6wt小鼠30周。在第11周开始抗体治疗,给小鼠每周两次腹腔内注射400μg2h10(中和性抗vegf-b抗体)或同种型匹配对照抗体,共20周。每两周监测小鼠断食2小时后的餐后血糖水平。采用拜耳contour血糖仪,对尾静脉取样的血液进行葡萄糖测定。测定终点血清氨基转移酶(alat)水平。
图6a和b显示了用抗体2h10进行治疗性处理的hfd饲喂小鼠的血糖水平和体重。
图6c和d显示了用抗体2h10进行治疗性处理的hfd饲喂小鼠的肝重和肝重体重比。
图6d显示了用抗体2h10进行治疗性处理的hfd饲喂小鼠中alat水平的血清分析。
这些数据表明采用抗vegf-b抗体治疗(2h10)降低vegf-b水平能防止因hfd饲喂导致的肝功能衰减。
治疗性抗vegf-b处理(采用2h10)减少hfd饲喂小鼠中的肝脏脂质堆积
对分离自用2h10或同种型匹配对照抗体处理20周的30周龄饲料饲喂和hfd饲喂小鼠的肝脏进行油红o(oro)分析。简而言之,收集肝脏,在干冰上急冻,并直接在低温恒温器的模具中包埋于tissue-
还采用上述方法测定了脂肪酸合成酶(fasn)的表达。
如图7所示,oro染色的量在接受抗vegf-b抗体处理的hfd饲喂小鼠中降低。对于染色切片的这些数据和分析表明在抗vegf-b抗体处理的hfd饲喂小鼠中脂质液滴的数量和尺寸均减小,且在hfd饲喂小鼠中给予2h10提供防止中性脂质的肝脏堆积的保护。
治疗性抗vegf-b处理(采用2h10)防止肝脏脂肪变性的发展
收集来自用2h10或同种型匹配对照抗体处理20周的30周龄hfd饲喂小鼠的肝脏,用4%pfa固定24小时,包埋并制备6μm切片用于免疫染色。简而言之,采用抗原修复溶液ph6(dako#s2367)进行抗原修复并在98℃加热10分钟。将切片与如下一抗在4℃一起孵育过夜:豚鼠抗亲脂素(fitzgerald公司)或豚鼠抗tip47(progen公司)抗体。在加入合适的荧光标记二抗(invitrogen公司alexafluor)前,将样品与生物素化驴抗豚鼠抗体(jackson公司)一起在室温下孵育1小时。用axiovision显微镜(carlzeiss公司)以20倍的放大率,对每只动物各切片中对亲脂素或tip47的染色至少拍摄10帧照片。采用用于肝脏i)亲脂素染色(像素2/μm2)或ii)tip47染色(像素2/μm2)的axiovisonrun向导程序对相应染色的量进行定量。
还采用上述方法测定了亲脂素(plin2a)的表达。
图8显示采用2h10进行抗vegf-b抗体处理,在hfd饲喂小鼠中减少了脂肪变性肝脏中pat蛋白的表达。抗vegf-b抗体处理将肝脏脂质含量降低到与饲料饲喂野生型和hfd饲喂vegfb-/-小鼠的水平相近。通过肝脏表达分析中2h10处理在hfd饲喂小鼠中降低plin2mrna转录水平验证了对肝脏脂肪变性发展的影响。
治疗性抗vegf-b处理(采用2h10)阻止hfd饲喂小鼠中的肝脏炎症发展
收集来自用2h10或同种型匹配对照抗体处理20周的30周龄hfd饲喂小鼠的肝脏,在干冰上急冻,并直接在低温恒温器的模具中包埋于tissue-
还采用上述方法测定了单核细胞化学诱导蛋白-1(mcp1)的表达。
图9显示用抗vegf抗体治疗性处理的hfd饲喂小鼠的肝脏中的cd45(a)和f4/80(b)水平降低。用抗vegf抗体2h10处理hfd饲喂小鼠将肝脏炎症细胞数量降低到与饲料饲喂野生型和hfd饲喂vegfb-/-小鼠相似的水平。抗vegf抗体处理也降低了mcp1的表达水平。因此,这些数据表明用抗vegf-b抗体的治疗性处理阻止nash中主要病变的发展。
治疗性抗vegf-b处理(采用2h10)减少nash和nash相关病变
收集源自用2h10或同种型匹配对照抗体处理20周的30周龄hfd饲喂小鼠的肝脏,用4%pfa固定24小时,包埋并制备6μm切片,根据制造商说明书用苏木精-伊红(h&e,sigma公司)进行染色。用亮视野显微镜(axiovision显微镜,carlzeiss公司)以40倍的放大率,对每只动物各切片中的h&e染色拍摄至少20帧照片。对于各动物,计算在h&e染色肝脏切片中鉴别到的所有膨胀肝细胞、mdb形成、炎症灶和卫星现象的平均值。nash总评分计算为各组中平均值的总和。
如表2所示,hed饲喂小鼠的肝脏显示有膨胀肝细胞、mdb形成,以及程度较轻的免疫细胞浸润和卫星现象。采用抗vegf-b抗体的治疗性处理减少了这些人nash相关病变的出现。
图10显示采用2h10抗体处理在hfd饲喂小鼠中降低vegf-b水平使得nash总评分降低了超过50%。
表2.用2h10或对照抗体处理的hfd饲喂小鼠中的肝脏nash评分
结果表示为平均值s.e.m。####表示与饲料饲喂野生型动物相比p<0.0001,*表示与对照处理hfd饲喂小鼠相比p<0.05。采用双向anova进行统计学分析。
实施例3:短期胆碱缺乏高脂(cd)饮食的vegf-b缺陷小鼠抵抗非酒精性脂肪肝病(nafld)和非酒精性脂肪性肝炎(nash)的发展
vegfb缺失提高葡萄糖和胰岛素敏感性
给五周龄雄性c57bl/6小鼠和周龄匹配vegfb+/-和vegfb-/-小鼠提供5个月的胆碱缺乏高脂(cd)饮食(researchdiets公司;d05010402)(cd5)。在试验期间记录体重(bw)和血糖(bg)水平。在bg记录前2小时断食。采用拜耳contour血糖仪,对尾静脉取样的血液进行葡萄糖测定。在cd饮食17周后对未禁食小鼠或试验前2小时断食的小鼠进行腹膜内葡萄糖耐受测试(ipgtt)和腹膜内胰岛素耐受测试(ipitt)。对于耐受测试,以1mg葡萄糖/g体重(ipgtt)和0.75mu胰岛素/g体重(ipitt)的量对动物进行腹膜内注射。
短期cd导致c57bl/6小鼠中提高的体重增加、血糖水平、葡萄糖不耐和胰岛素抵抗。cd饮食的c57bl/6小鼠中的vegfb缺失没有改变体重或高血糖发展。然而,cd饮食的c57bl/6小鼠中通过遗传方法降低vegf-b水平对葡萄糖耐受和胰岛素敏感性有一定效果,但并不指向高血糖。
图11显示在短期胆碱缺乏高脂(cd)饮食的小鼠中vegfb缺失并不影响体重(a)或餐后血糖水平(a),但提高葡萄糖和胰岛素敏感性(b和c)。
vegfb缺失提供免受肝损伤的保护
将c57bl/6、vegfb-/-和vegfb+/-cd饲喂小鼠用于分析。切取肝脏,称重,并通过心脏穿刺取全血。血液在4℃下以14000rpm离心10分钟,分离血清,并分成等份冷冻于-80℃。在瑞典乌普萨拉的瑞典农科大学(swedishuniversityofagriculturalscienceinuppsala,sweden)分析丙氨酸氨基转移酶(alat)血清水平。
与vegfb+/-andvegfb-/-小鼠相比,野生型小鼠中短期cd诱导了肝损伤以及血清alat水平提高。
图12a显示短期cd小鼠中vegfb缺失对于肝重或肝重/体重比没有影响。
图12b显示血清alat水平在cd饲喂的野生型小鼠中提高,而与周龄匹配的cd饲喂野生型小鼠相比,vegf-b缺陷的cd饲喂小鼠则具有降低的血清alat水平。
这些数据证明了cd饲喂小鼠中vegfb消除减少了肝损伤,而不指向高血糖症。
vegfb缺失减少肝脏脂质堆积
将c57bl/6、vegfb-/-和vegfb+/-cd饲喂小鼠用于分析。切取肝脏,急冻,并通过心脏穿刺取全血。血液在4℃下以14000rpm离心10分钟,分离血清,并分成等份冷冻于-80℃。
对分离的肝脏进行油红o(oro)分析。简而言之,将肝脏活检样品直接在低温恒温器的模具上包埋于tissue-
采用市售可获得的试剂盒对非酯化脂肪酸(nefa;wakochemicals公司)、β-羟基丁酸(stanbio实验室)和甘油三酯(sigma-aldrich公司)进行酶法测定。
短期cd导致c57bl/6小鼠中非酒精性脂肪酸肝病(nafld)的发展。通过oro分析检测到cd饮食诱导了中性脂质肝脏含量的急剧提高,以及肝功能同时降低(图12)。cd饮食的c57bl/6小鼠中vegfb的基因消除减少了肝脏脂质堆积。脂质液滴的数量和尺寸均减小。短期cd导致血脂异常,而降低vegf-b水平则降低了酮体(kb)、nefa和甘油三酯(tg)的血浆水平。
图13显示了vegfb的消除在短期cd饮食小鼠中减少了肝脏脂质堆积和由其所致的肝脂肪变性。
vegfb缺失阻止肝脏炎症发展
将c57bl/6、vegfb-/-和vegfb+/-cd饲喂小鼠用于分析。将肝脏活检样品直接在低温恒温器的模具上包埋于tissue-
短期cd可在c57bl/6小鼠中用于诱导全面(fullspectrum)非酒精性脂肪肝病(nash),即异常肝脏脂质堆积和炎症。在cd饮食的杂合或纯合vegfb消除小鼠中,肝脏脂肪变性(图13和14)以及炎症细胞数量均减少。这些数据表明减少vegf-b信号转导可用于阻止nash中主要病变的发展。
图14显示据cd45和f4/80表达降低所示,短期cd饮食小鼠中vegfb缺失阻止肝脏炎症的发展。
实施例4:短期胆碱缺乏高脂(cd)饮食小鼠中,中和性抗vegf-b抗体治疗或预防非酒精性脂肪肝病(nafld)和非酒精性脂肪性肝炎(nash)发展
治疗性抗vegf-b处理(采用2h10)不影响体重、血糖水平、葡萄糖耐受性或胰岛素敏感性
对5周龄雄性c57bl/6小鼠进行5个月的cd饮食饲喂(researchdiets公司;d05010402)。在第12周开始抗体处理,用2h10或同种型匹配对照抗体处理小鼠10周。动物每周两次腹腔内注射(i.p.)80μg剂量的抗vegf-b抗体。该研究还包括周龄和性别匹配的饲料饲喂野生型小鼠。在试验期间记录bw和bg水平。在bg记录前2小时断食。采用拜耳contour血糖仪,对尾静脉取样的血液进行葡萄糖测定。在cd饮食17周后对未禁食小鼠或试验前2小时断食的小鼠进行ipgtt和ipitt。对于耐受测试,以1mg葡萄糖/g体重(ipgtt)和0.75mu胰岛素/g体重(ipitt)的量对动物进行腹膜内注射。
抗vegf-b处理并不影响短期cd组的体重或葡萄糖和胰岛素敏感性。这些数据表明:与vegfb-/-小鼠和野生型小鼠相比,在cd饮食vegfb+/-中观察到的葡萄糖耐受和胰岛素敏感性改善或可关联与vegfb-/-小鼠模型相关的发展效果(developmentaleffects)。
图15显示短期cd饮食(采用2h10)小鼠中抗vegf-b处理不影响(a)体重、血糖水平、(b)葡萄糖耐受性或(c)胰岛素敏感性。
治疗性抗vegf-b处理(采用2h10)改善肝功能
对5周龄雄性c57bl/6小鼠进行5个月的cd饮食饲喂(researchdiets公司;d05010402)。在第12周开始抗体处理,用2h10或同种型匹配对照抗体处理小鼠10周。动物每周两次腹腔内注射(i.p.)80μg剂量的抗vegf-b抗体。该研究还包括周龄和性别匹配的饲料饲喂野生型小鼠。
用异氟烷麻醉处死动物,切取肝脏并称重,通过心脏穿刺取全血。血液在4℃下以14000rpm离心10分钟,分离血清,并分成等份冷冻于-80℃。在瑞典乌普萨拉的瑞典农科大学(swedishuniversityofagriculturalscienceinuppsala,sweden)分析alat血清水平。
据短期cd饮食抗vegf-b处理的c57bl/6中测得alat水平降低,2h10治疗防止了肝损伤。
图16显示如肝重和肝重体重比(a)和血清alat水平分析(b)所示,短期cd饮食小鼠中的抗vegf-b处理(采用2h10)改善了肝功能。
治疗性抗vegf-b处理(采用2h10)减少肝脏脂质堆积
将cd饲喂c57bl/6小鼠和周龄和性别匹配的饲料饲喂野生型小鼠用于分析。动物如前所述地接受2h10或同种型匹配对照抗体处理。
如前所述对分离的肝脏进行油红o(oro)分析。通过在短期cd的c57bl/6小鼠中采用2h10来降低vegf-b水平,肝脏脂肪变性减少且脂质液滴的数量和尺寸均减小。
采用市售可获得的试剂盒对分离的血清的非酯化脂肪酸(nefa;wakochemicals公司)、β-羟基丁酸(stanbio实验室)和甘油三酯(sigma-aldrich公司)进行酶法测定。抗vegf-b治疗使得cd饮食小鼠中的酮类(kb)、非酯化脂肪酸(nefa)和甘油三酯(tg)正常化。
图17显示短期cd饮食c57bl/6小鼠中抗vegf-b处理(采用2h10)减少肝脏脂质堆积。
治疗性抗vegf-b处理(采用2h10)防止肝脏脂肪变性的发展
将cd饲喂c57bl/6小鼠和周龄和性别匹配的饲料饲喂野生型小鼠用于分析。动物如前所述地接受2h10或同种型匹配对照抗体处理。
在分离的肝脏上进行免疫染色。简而言之,用异氟烷麻醉处死动物,切取肝脏,在4%pfa中固定24小时,然后采用标准程序进行石蜡包埋并制备6μm切片。采用抗原修复溶液ph6(dako#s2367)进行抗原修复并在98℃加热10分钟。在4℃将切片与豚鼠抗亲脂素(fitzgerald公司)一起孵育过夜。在加入合适的荧光标记二抗(invitrogen公司alexafluor)前,将样品与生物素化驴抗豚鼠抗体(jackson公司)一起在室温下孵育1小时。用axiovision显微镜(carlzeiss公司)以20倍的放大率,对每只动物各切片中对亲脂素或tip47的染色至少拍摄10帧照片。采用用于肝脏oro染色的axiovisonrun向导程序对脂质滴的量进行定量(像素2/μm2)。
通过用2h10降低短期cd的c57bl/6小鼠中的vegf-b水平,防止了肝脏脂肪变性和nash的发展。与cd饮食的对照处理小鼠相比,抗vegf-b抗体处理使肝脏脂质含量降低了超过50%。
图18显示在短期cd饮食c57bl/6小鼠中进行抗vegf-b处理(采用2h10)防止了肝脂肪变性的发展,据肝脏亲脂素表达降低所示。
治疗性抗vegf-b处理(采用2h10)防止肝脏炎症的发展
将cd饲喂c57bl/6小鼠和周龄和性别匹配的饲料饲喂野生型小鼠用于分析。动物如前所述地接受2h10或同种型匹配对照抗体处理。
对分离的肝脏进行免疫染色。简而言之,用异氟烷麻醉处死动物,切取肝脏并在干冰上急冻。将肝脏活检样品直接在低温恒温器的模具上包埋于tissue-
将2h10用作对cd饮食小鼠的抗vegf-b治疗使得肝脏炎症细胞的量降低到了与饲料饲喂小鼠类似的水平。这些数据表明减少vegf-b信号转导(采用2h10处理)能用于靶向nash发展中的炎症期。
图19显示在短期cd饮食c57bl/6小鼠中进行抗vegf-b处理(采用2h10)防止了肝脏炎症的发展,据(a)cd45和(b)f4/80表达降低所示。
治疗性抗vegf-b处理(采用2h10)防止轻度肝纤维化的发展
将cd饲喂c57bl/6小鼠和周龄和性别匹配的饲料饲喂野生型小鼠用于分析。动物如前所述地接受2h10或同种型匹配对照抗体处理。
对分离的肝脏进行马森三色染色(massontrichrome)。简而言之,用异氟烷麻醉处死动物。切取肝脏,在4%pfa中后固定24小时,然后采用标准方法进行石蜡包埋。包埋后,制备6μm切片,根据生产商说明书用马森三色(mt,sigma)进行染色。用亮视野显微镜(axiovision显微镜,carlzeiss公司)以20倍的放大率,对每只动物各切片中的mt染色拍摄至少20帧照片。采用用于mt+染色的axiovisonrun向导程序对纤维化的量进行定量(像素2/μm2)。
短期cd可用于诱导纤维化nash。纤维化nash被认为是nash的更后期阶段,是肝硬化和肝相关致死的主要原因。血管壁中可见cd饮食诱导了轻度肝纤维化,提示正常的胞外基质(ecm)沉积,同时在实质中检测到纤维化,并且纤维化在一些情况下还在整个肝小叶中以“桥接”模式存在。采用2h10在cd饮食小鼠中降低vegf-b水平降低了纤维化发展,这表明抗vegf-b治疗可用于治疗纤维化nash。
图20采用马森三色染色显示短期cd饮食小鼠中的抗vegf-b治疗(采用2h10)防止了肝脏切片的纤维化发展。
治疗性抗vegf-b处理(采用2h10)减少了nash和nash相关病变
将cd饲喂c57bl/6小鼠和周龄和性别匹配的饲料饲喂野生型小鼠用于分析。动物如前所述地接受2h10或同种型匹配对照抗体处理。
切取肝脏,在4%pfa中后固定24小时,然后采用标准方法进行石蜡包埋。包埋后,制备6μm切片,根据生产商说明书用苏木精-伊红(h&e)进行染色。用亮视野显微镜(axiovision显微镜,carlzeiss公司)以20倍的放大率,对每只动物各切片中的h&e染色拍摄至少20帧照片,并分析肝细胞降解、mdb形成、炎症灶和卫星现象的存在。总评分是h&e染色肝脏切片中所有鉴别的膨胀肝细胞、mdb、炎症灶和卫星现象的数量。
如表3所示,cd饲喂小鼠肝脏显示出人nash的多种特征,如肝细胞膨胀、mallorydenck体形成、炎症灶和卫星现象。采用抗vegf-b抗体的治疗性处理减少了这些人nash相关病变的出现。
图21显示采用2h10抗体处理在cd饲喂小鼠中降低vegf-b水平使得nash总评分降低了超过50%。
表3.用2h10或对照抗体处理的短期cd饮食小鼠中的肝脏nash评分
结果表示为平均值s.e.m。采用单向anova进行统计学分析。#表示p<0.05,###表示p<0.001,####表示p<0.0001,均与饲料饲喂野生型相比。*表示p<0.05,**表示p<0.001,***表示p<0.0001,均与用对照处理的cd饮食小鼠相比。动物数量为:饲料饲喂野生型(n=5),对照处理的cd饮食小鼠(n=8)以及抗vegf-b处理的cd饮食小鼠(n=7)。
实施例5:长期cd饮食小鼠中,中和性抗vegf-b抗体治疗或预防非酒精性脂肪肝病(nafld)和非酒精性脂肪性肝炎(nash)发展
治疗性抗vegf-b处理(采用2h10)不影响体重、餐后血糖水平、葡萄糖耐受性或胰岛素敏感性
对5周龄雄性c57bl/6小鼠进行12个月的cd饮食饲喂(researchdiets公司;d05010402)(cd12)。在第32周龄时开始抗体处理,用2h10或同种型匹配对照抗体处理小鼠20周。动物每周两次腹腔内注射(i.p.)80μg剂量的抗vegf-b抗体。该研究还包括周龄和性别匹配的饲料饲喂野生型小鼠。在试验期间记录bw和bg水平。在bg记录前2小时断食。采用拜耳contour血糖仪,对尾静脉取样的血液进行葡萄糖测定。在cd饮食17周后对未禁食小鼠或试验前2小时断食的小鼠进行ipgtt和ipitt。对于耐受测试,以1mg葡萄糖/g体重(ipgtt)和0.75mu胰岛素/g体重(ipitt)的量对动物进行腹膜内注射。
如图22所示,抗vegf-b处理并不影响长期cd饮食的c57bl/6小鼠中的体重(a)或葡萄糖和胰岛素敏感性(b和c)。
治疗性抗vegf-b处理(采用2h10)改善肝功能并缓解肝细胞癌的发展
将12个月cd饲喂c57bl/6小鼠和周龄和性别匹配的饲料饲喂野生型小鼠用于分析。动物如前所述地接受2h10或同种型匹配对照抗体处理。
磁共振成像(mri)数据如下获得:采用水平孔,9.4t扫描仪(agilent公司,英国雅屯(yarnton,uk)),其配备有内径为40mm的千足径发射/接收体积线圈(agilent公司,英国雅屯)。对于mri分析,用造影剂普美显(primovist)注射动物。用盐水(9mg/ml)将250mm普美显溶液(bayerpharma公司,德国柏林)稀释为12.5mm。以2ul/g体重通过尾静脉推注递送给位于等中心处的小鼠,该尾静脉通过连接到位于孔附近的输注泵的2m聚乙烯(pe-20)软管连接。对于mri扫描,脂肪饱和的t1加权图像(快速自旋回波数据etl4,k0=1矩阵256×192,回波有效时间=7.01ms,30个连续切片,1mm厚度,视野35.2×26.4mm2。在每个呼气期间连续激发15个切片,使得恢复时间为呼吸期的两倍。呼吸期为750-950ms,且通过异氟烷水平(1.6-2.5%)控制。每个3d数据组的获取需要约1.5分钟。在推注前获得一个数据组,然后是推注后的5个连续数据组。健康肝脏的强度在3分钟内通过造影剂增加,而肿瘤的强度不能通过造影剂增强,且肿瘤出现造影后低强度。
mri分析后,用异氟烷麻醉处死动物,切取肝脏,称重,通过心脏穿刺取全血。
长期cd造成c57bl/6小鼠中的肝脏肥大、肝功能减退和肝细胞癌。mri联合钆增强对比度扫描可用于肝脏肿瘤的可视化。肝脏中肿瘤最多的部位是尾状突和右侧叶。12个月的cd饮食后,50%的对照ig处理c57bl/6小鼠发展为肝细胞癌,而在2h10处理的小鼠中未检测到肿瘤。此外,抗vegf-b治疗防止了肝脏肥大并改善了肝功能,这表明抗vegf-b治疗可用于防止肝细胞癌发展。
图23显示抗vegf-b治疗改善了肝功能且缓解了肝细胞癌的发展。
治疗性抗vegf-b处理(采用2h10)减少肝脏脂质堆积
将12个月cd饲喂c57bl/6小鼠和周龄和性别匹配的饲料饲喂野生型小鼠用于分析。动物如前所述地接受2h10或同种型匹配对照抗体处理。
对分离的肝脏进行油红o(oro)分析。简而言之,切取肝脏,在干冰上急冻,并将肝活检样品直接在低温恒温器的模具中包埋于tissue-
通过在长期cd饮食小鼠中采用2h10来降低vegf-b水平,肝脏脂肪变性可被减少且脂质液滴的数量和尺寸均减小。cd饮食小鼠中的肝脏脂质含量通过2h10治疗降低了超过50%。
图24显示在长期cd饮食小鼠中,通过oro染色测定的肝脏脂质堆积在抗vegf-b处理(采用2h10)后减少。
治疗性抗vegf-b处理(采用2h10)防止肝脏炎症的发展
将12个月cd饲喂c57bl/6小鼠和周龄和性别匹配的饲料饲喂野生型小鼠用于分析。动物如前所述地接受2h10或同种型匹配对照抗体处理。
对分离的肝脏进行针对cd45和f4/80的免疫染色。简而言之,切取肝脏并在干冰上急冻。将肝脏活检样品直接在低温恒温器的模具上包埋于tissue-
长期cd导致c57bl/6小鼠中肝脏炎症增加。与饲料饲喂小鼠相比,在带肿瘤和不带肿瘤的经对照处理的cd饮食小鼠中,炎症反应分别增加了约2倍和约5倍。在cd饮食小鼠中采用2h10来降低vegf-b水平使得肝脏炎症细胞的数量正常化。因此,数据表明减少vegf-b信号转导(采用2h10处理)有效靶向nash/肝细胞癌发展中的炎症阶段。
图25显示长期cd饮食小鼠中的抗vegf-b处理防止了肝脏炎症的发展,据cd45和f4/80表达降低所示。
序列表
<110>csl有限公司(csllimited)
b-创新瑞典股份公司(bcreativeswedenab)
<120>治疗或预防肝病的方法
<130>525380
<150>au2016901494
<151>2016-04-21
<150>au2016901483
<151>2016-04-21
<160>46
<170>patentinversion3.5
<210>1
<211>207
<212>prt
<213>智人(homosapiens)
<220>
<221>信号
<222>(1)..(21)
<223>信号序列
<400>1
metserproleuleuargargleuleuleualaalaleuleuglnleu
151015
alaproalaglnalaprovalserglnproaspalaproglyhisgln
202530
arglysvalvalsertrpileaspvaltyrthrargalathrcysgln
354045
proarggluvalvalvalproleuthrvalgluleumetglythrval
505560
alalysglnleuvalprosercysvalthrvalglnargcysglygly
65707580
cyscysproaspaspglyleuglucysvalprothrglyglnhisgln
859095
valargmetglnileleumetileargtyrproserserglnleugly
100105110
glumetserleuglugluhisserglncysglucysargprolyslys
115120125
lysaspseralavallysproaspargalaalathrprohishisarg
130135140
proglnproargservalproglytrpaspseralaproglyalapro
145150155160
serproalaaspilethrhisprothrproalaproglyproserala
165170175
hisalaalaproserthrthrseralaleuthrproglyproalaala
180185190
alaalaalaaspalaalaalaserservalalalysglyglyala
195200205
<210>2
<211>188
<212>prt
<213>智人(homosapiens)
<220>
<221>信号
<222>(1)..(21)
<223>信号序列
<400>2
metserproleuleuargargleuleuleualaalaleuleuglnleu
151015
alaproalaglnalaprovalserglnproaspalaproglyhisgln
202530
arglysvalvalsertrpileaspvaltyrthrargalathrcysgln
354045
proarggluvalvalvalproleuthrvalgluleumetglythrval
505560
alalysglnleuvalprosercysvalthrvalglnargcysglygly
65707580
cyscysproaspaspglyleuglucysvalprothrglyglnhisgln
859095
valargmetglnileleumetileargtyrproserserglnleugly
100105110
glumetserleuglugluhisserglncysglucysargprolyslys
115120125
lysaspseralavallysproaspserproargproleucysproarg
130135140
cysthrglnhishisglnargproaspproargthrcysargargarg
145150155160
cysargargargserpheleuargcysglnglyargglyleugluleu
165170175
asnproaspthrcysargcysarglysleuargarg
180185
<210>3
<211>119
<212>prt
<213>人工
<220>
<223>来自抗体2h10的vh的氨基酸序列
<400>3
valglnleuglnglnproglythrgluleuvallysproglyalaser
151015
vallysleusercyslysalaserglytyrthrphethrglyphetrp
202530
ilehistrpvallysglnargproglyglnglyleuglutrpilegly
354045
hisileasnproglyasnglyglythrasntyrasnglulysphelys
505560
argmetalathrleuthrvalasplysserserserthralatyrmet
65707580
glnleuserserleuthrsergluaspseralavaltyrtyrcysala
859095
argsertyrserasntyrvalargalametasptyrtrpglyglngly
100105110
thrservalthrvalserser
115
<210>4
<211>106
<212>prt
<213>人工
<220>
<223>来自抗体2h10的vl的氨基酸序列
<400>4
ileglnmetthrglnthrthrserserleuseralaserleuglyasp
151015
argvalthrilesercysargalaserglnaspileserasnpheleu
202530
asntrptyrglnglnlysproaspglythrvallysleuleuiletyr
354045
tyrthrserthrleuhisserglyvalproserargpheserglyser
505560
glyserglythrasptyrserleuthrileserasnleugluglnglu
65707580
aspilealathrtyrphecysglnglnglylysthrleuproprothr
859095
pheglyglyglythrlysleugluilelys
100105
<210>5
<211>119
<212>prt
<213>人工
<220>
<223>来自抗体2h10的人源化形式vh的氨基酸序列
<400>5
valglnleuvalglnserglyalagluvallyslysproglyalaser
151015
vallysvalsercyslysalaserglytyrthrphethrglyphetrp
202530
ilehistrpvalargglnalaproglyglnglyleuglutrpmetgly
354045
hisileasnproglyasnglyglythrasntyrasnglulysphelys
505560
argargvalthrmetthrargasplysserileserthralatyrmet
65707580
gluleuserargleuargseraspaspthralavaltyrtyrcysala
859095
argsertyrserasntyrvalargalametasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
<210>6
<211>107
<212>prt
<213>人工
<220>
<223>来自抗体2h10的人源化形式vl的氨基酸序列
<400>6
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnaspileserasnphe
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrtyrthrserthrleuhisserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglnglnglylysthrleupropro
859095
thrpheglyglyglythrlysvalgluilelys
100105
<210>7
<211>116
<212>prt
<213>人工
<220>
<223>来自抗体4e12的vh的氨基酸序列
<400>7
valglnproglnglnproglyalagluleuvallysproglyalaser
151015
vallysmetsercyslysalaserglyaspthrphethrasnsertrp
202530
ileglytrpvalthrglnargproglyglnglyleuglutrpilegly
354045
aspilepheproglyserglyhisthrasntyrasnglulysphelys
505560
asnargalathrleuthrvalaspthrserserserthralatyrmet
65707580
leuleuserserleuthrseraspaspseralavaltyrtyrcysval
859095
ilegluasntyralatrpphealatyrtrpglyglnglythrleuval
100105110
thrvalserala
115
<210>8
<211>107
<212>prt
<213>人工
<220>
<223>来自抗体4e12的vl的氨基酸序列
<400>8
aspilevalmetthrglnserglnlysphemetserserservalgly
151015
aspargvalservalthrcyslysalaserglnasnvalasnthrasn
202530
valalatrptyrglnglnlysglnglyglnserproargproleuile
354045
tyrseralaserserargcysserglyvalproaspargphethrgly
505560
serglypheglythraspphethrleuthrileserasnvalglnser
65707580
gluaspleualaglutyrphecysglnglntyrhisserpheproleu
859095
thrpheglyalaglyalalysleuaspleulys
100105
<210>9
<211>118
<212>prt
<213>人工
<220>
<223>来自抗体2f5的vh的氨基酸序列
<400>9
valglnleuglnglnserglyprogluleuvallysproglythrser
151015
valargilesercyslysalaserglytyrthrphethrthrphetyr
202530
ilehistrpvallysglnargproglyglnglyleuglutrpilegly
354045
trpphetyrproglyasnvalasnthrasntyrasnglulysleulys
505560
glylysalathrleuthralaasplysserserseralaalatyrleu
65707580
glnleuasnserleuthrsergluaspseralavaltyrphecysthr
859095
argserprotyrtyrglytyrvalpheasptyrtrpglyglnglythr
100105110
thrleuthrvalserser
115
<210>10
<211>107
<212>prt
<213>人工
<220>
<223>来自抗体2f5的vl的氨基酸序列
<400>10
aspilevalmetthrglnserhislysphemetserthrservalgly
151015
aspargvalserilethrcyslysalaserglnaspvalglythrala
202530
valalatrptyrglnglnlysproglyglnserprolysleuleuile
354045
tyrtrpalaserthrarghisthrglyvalproaspargphethrgly
505560
serglyserglythraspphethrleuthrileserasnvalglnser
65707580
gluaspleualaasptyrphecysglnglntyrserserserleuthr
859095
pheglyalaglyalathrlysleugluleulys
100105
<210>11
<211>33
<212>dna
<213>人工序列
<220>
<223>2h10vlcdr1的核苷酸序列
<400>11
agggcaagtcaggacattagcaattttttaaac33
<210>12
<211>21
<212>dna
<213>人工序列
<220>
<223>2h10vlcdr2的核苷酸序列
<400>12
tacacatcaacattacactca21
<210>13
<211>27
<212>dna
<213>人工序列
<220>
<223>2h10vlcdr3的核苷酸序列
<400>13
caacagggtaaaacgcttcctcccacg27
<210>14
<211>30
<212>dna
<213>人工序列
<220>
<223>2h10vhcdr1的核苷酸序列
<400>14
ggctacactttcactggcttctggatacac30
<210>15
<211>51
<212>dna
<213>人工序列
<220>
<223>2h10vhcdr2的核苷酸序列
<400>15
catattaatcctggcaatggtggcactaactacaatgagaagttcaagaga51
<210>16
<211>33
<212>dna
<213>人工序列
<220>
<223>2h10vhcdr3的核苷酸序列
<400>16
tcctatagtaactacgtgcgggctatggactac33
<210>17
<211>11
<212>prt
<213>人工序列
<220>
<223>2h10vlcdr1的氨基酸序列
<400>17
argalaserglnaspileserasnpheleuasn
1510
<210>18
<211>7
<212>prt
<213>人工序列
<220>
<223>2h10vlcdr2的氨基酸序列
<400>18
tyrthrserthrleuhisser
15
<210>19
<211>9
<212>prt
<213>人工序列
<220>
<223>2h10vlcdr3的氨基酸序列
<400>19
glnglnglylysthrleuproprothr
15
<210>20
<211>10
<212>prt
<213>人工序列
<220>
<223>2h10vhcdr1的氨基酸序列
<400>20
glytyrthrphethrglyphetrpilehis
1510
<210>21
<211>17
<212>prt
<213>人工序列
<220>
<223>2h10vhcdr2的氨基酸序列
<400>21
hisileasnproglyasnglyglythrasntyrasnglulysphelys
151015
arg
<210>22
<211>11
<212>prt
<213>人工序列
<220>
<223>2h10vhcdr3的氨基酸序列
<400>22
sertyrserasntyrvalargalametasptyr
1510
<210>23
<211>33
<212>dna
<213>人工序列
<220>
<223>2f5vlcdr1的核苷酸序列
<400>23
aaggccagtcaggatgtgggtactgctgtagcc33
<210>24
<211>21
<212>dna
<213>人工序列
<220>
<223>2f5vlcdr2的核苷酸序列
<400>24
tgggcatccacccggcacact21
<210>25
<211>24
<212>dna
<213>人工序列
<220>
<223>2f5vlcdr3的核苷酸序列
<400>25
caacaatatagcagctctctcacg24
<210>26
<211>30
<212>dna
<213>人工序列
<220>
<223>2f5vhcdr1的核苷酸序列
<400>26
ggctacaccttcacaaccttctatatacac30
<210>27
<211>51
<212>dna
<213>人工序列
<220>
<223>2f5vhcdr2的核苷酸序列
<400>27
tggttttatcctggaaatgttaataccaactacaatgagaagctcaagggc51
<210>28
<211>30
<212>dna
<213>人工序列
<220>
<223>2f5vhcdr3的核苷酸序列
<400>28
tccccttactacggctacgtttttgactac30
<210>29
<211>11
<212>prt
<213>人工序列
<220>
<223>2f5vlcdr1的氨基酸序列
<400>29
lysalaserglnaspvalglythralavalala
1510
<210>30
<211>7
<212>prt
<213>人工序列
<220>
<223>2f5vlcdr2的氨基酸序列
<400>30
trpalaserthrarghisthr
15
<210>31
<211>8
<212>prt
<213>人工序列
<220>
<223>2f5vlcdr3的氨基酸序列
<400>31
glnglntyrserserserleuthr
15
<210>32
<211>10
<212>prt
<213>人工序列
<220>
<223>2f5vhcdr1的氨基酸序列
<400>32
glytyrthrphethrthrphetyrilehis
1510
<210>33
<211>17
<212>prt
<213>人工序列
<220>
<223>2f5vhcdr2的氨基酸序列
<400>33
trpphetyrproglyasnvalasnthrasntyrasnglulysleulys
151015
gly
<210>34
<211>10
<212>prt
<213>人工序列
<220>
<223>2f5vhcdr3的氨基酸序列
<400>34
serprotyrtyrglytyrvalpheasptyr
1510
<210>35
<211>33
<212>dna
<213>人工序列
<220>
<223>4e12vlcdr1的核苷酸序列
<400>35
aaggccagtcagaatgtgaacactaatgtagcc33
<210>36
<211>21
<212>dna
<213>人工序列
<220>
<223>4e12vlcdr2的核苷酸序列
<400>36
tcggcatcctcccggtgcagt21
<210>37
<211>27
<212>dna
<213>人工序列
<220>
<223>4e12vlcdr3的核苷酸序列
<400>37
cagcaatatcacagctttccgctcacg27
<210>38
<211>30
<212>dna
<213>人工序列
<220>
<223>4e12vhcdr1的核苷酸序列
<400>38
ggcgacaccttcaccaactcctggataggc30
<210>39
<211>51
<212>dna
<213>人工序列
<220>
<223>4e12vhcdr2的核苷酸序列
<400>39
gatatttttcctgggagtggtcatactaactacaatgagaagttcaagaac51
<210>40
<211>24
<212>dna
<213>人工序列
<220>
<223>4e12vhcdr3的核苷酸序列
<400>40
gagaattatgcctggtttgcttat24
<210>41
<211>11
<212>prt
<213>人工序列
<220>
<223>4e12vlcdr1的氨基酸序列
<400>41
lysalaserglnasnvalasnthrasnvalala
1510
<210>42
<211>7
<212>prt
<213>人工序列
<220>
<223>4e12vlcdr2的氨基酸序列
<400>42
seralaserserargcysser
15
<210>43
<211>9
<212>prt
<213>人工序列
<220>
<223>4e12vlcdr3的氨基酸序列
<400>43
glnglntyrhisserpheproleuthr
15
<210>44
<211>10
<212>prt
<213>人工序列
<220>
<223>4e12vhcdr1的氨基酸序列
<400>44
glyaspthrphethrasnsertrpilegly
1510
<210>45
<211>17
<212>prt
<213>人工序列
<220>
<223>4e12vhcdr2的氨基酸序列
<400>45
aspilepheproglyserglyhisthrasntyrasnglulysphelys
151015
asn
<210>46
<211>8
<212>prt
<213>人工序列
<220>
<223>4e12vhcdr3的氨基酸序列
<400>46
gluasntyralatrpphealatyr
15
- 还没有人留言评论。精彩留言会获得点赞!