具有效率算法的心脏标测系统的制作方法
本申请根据35usc119(e),要求在2016年10月26日提交的题为“具有效率算法的心脏标测系统”的美国临时专利申请62/413,104号的优先权,以及在2016年5月3日提交的题为“具有效率算法的心脏标测系统”的美国临时专利申请62/331,364号的优先权,其中每一个都通过参考方式整体并入本文。
本申请虽然未要求以下的优先权,但可以与其相关:在2015年9月25日提交的题为“用于确定和呈现心壁上的表面电荷和偶极子密度的方法和装置”的美国专利申请14/865,435号,其是在2014年11月19日提交的题为“用于确定和呈现心壁上的表面电荷和偶极子密度的方法和装置”的美国专利9,167,982号的延续案,其是在2014年12月23日发布的题为“用于确定和呈现心壁上的表面电荷和偶极子密度的方法和装置”的美国专利8,918,158号(下称为’158专利)的延续案,其是在2014年4月15日发布的题为“用于确定和呈现心壁上的表面电荷和偶极子密度的方法和装置”的美国专利8,700,119号(下称为’119专利)的延续案,其是在2013年4月9日发布的题为“用于确定和呈现心壁上的表面电荷和偶极子密度的方法和装置”的美国专利8,417,313号(下称为’313专利)的延续案,其是在2007年8月3日提交的公布为wo2008/014629的题为“用于确定和呈现心壁上的表面电荷和偶极子密度的方法和装置”的pct申请ch2007/000380号的35usc371国家阶段申请,其要求在2006年8月3日提交的瑞士专利申请1251/06号的优先权,其中每一个都通过参考方式并入本文。
本申请虽然未要求以下的优先权,但可以与其相关:在2015年10月19日提交的题为“用于几何确定心壁上的电偶极子密度的装置和方法”的美国专利申请14/886,449号,其是在2013年7月19日提交的题为“用于几何确定心壁上的电偶极子密度的装置和方法”的美国专利9,192,318号的延续案,其是2013年8月20日发布的公布为us2010/0298690(下称为’690公布)的题为“用于几何确定心壁上的电偶极子密度的装置和方法”的美国专利8,512,255号的延续案,其是2009年1月16日提交的公布为wo2009/090547的题为“用于几何确定心壁上的电偶极子密度的装置和方法”的专利合作条约申请pct/ib09/00071号的35usc371国家阶段申请,其要求在2008年1月17日提交的瑞士专利申请00068/08的优先权,其中每一个都通过参考方式并入本文。
本申请虽然未要求以下的优先权,但可以与其相关:在2013年9月6日提交的题为“用于几何确定心壁上的电偶极子密度的装置和方法”的美国申请14/003671号,其是公布为wo2012/122517(下称为’517公布)的题为“用于几何确定心壁上的电偶极子密度的装置和方法”的专利合作条约申请pct/us2012/028593号的35usc371国家阶段申请,其要求美国临时专利申请61/451,357号的优先权,其中每一个都通过参考方式并入本文。
本申请虽然未要求以下的优先权,但可以与其相关:在2013年12月2日提交的题为“导管系统和其医疗用途的方法,包括心脏的诊断和治疗用途”的美国设计申请29/475,273号,其是在2013年8月30日提交的题为“导管系统和其医疗用途的方法,包括心脏的诊断和治疗用途”的专利合作条约申请pct/us2013/057579号的35usc371国家阶段申请,其要求在2012年8月31日提交的题为“诊断和治疗心脏组织的系统和方法”的美国临时专利申请61/695,535号的优先权,其中每一个都通过参考方式并入本文。
本申请虽然未要求以下的优先权,但可以与其相关:在2014年2月7日提交的题为“具有柔性印刷电路板(pcb)电通路的可膨胀导管组件”的专利合作条约申请pct/us2014/15261号,其要求在2013年2月8日提交的题为“具有柔性印刷电路板(pcb)电通路的可膨胀导管组件”的美国临时专利申请61/762,363号的优先权,其中每一个都通过参考方式并入本文。
本申请虽然未要求以下的优先权,但可以与其相关:在2015年1月14日提交的题为“消气患者接入装置”的专利合作条约申请pct/us2015/11312号,其要求在2014年1月17日提交的题为“消气患者接入装置”的美国临时专利申请61/928,704号的优先权,其中每一个都通过参考方式并入本文。
本申请虽然未要求以下的优先权,但可以与其相关:在2015年3月24日提交的题为“心脏分析用户界面系统及方法”的专利合作条约申请pct/us2015/22187号,其要求在2014年3月28日提交的题为“心脏分析用户界面系统及方法”的美国临时专利申请61/970,027号的优先权,其中每一个都通过参考方式并入本文。
本申请虽然未要求以下的优先权,但可以与其相关:在2014年9月10日提交的题为“用于确定心脏表面上的电偶极子密度的装置和方法”的专利合作条约申请pct/us2014/54942,其要求在2013年9月13日提交的题为“用于确定心脏表面上的电偶极子密度的装置和方法”的美国临时专利申请61/877,617的优先权,其中每一个都通过参考方式并入本文。
本申请虽然未要求以下的优先权,但可以与其相关:在2015年5月13日提交的题为“用于获取和分析心脏信息的定位系统和方法”的美国临时专利申请62/161,213号,其通过参考方式并入本文。
本申请虽然未要求以下的优先权,但可以与其相关:在2015年5月12日提交的题为“心脏虚拟化试验箱和测试系统及方法”的美国临时专利申请62/160,501号,其通过参考方式并入本文。
本申请虽然未要求以下的优先权,但可以与其相关:在2015年5月12日提交的题为“超声测序系统及方法”的美国临时专利申请62/160,529号,其通过参考方式并入本文。
本发明一般涉及可能有用于诊断和治疗心律失常或其他异常的系统和方法,特别是,本发明涉及有用于显示与诊断和治疗这些心律失常或其他异常相关联的心脏活动的系统、装置和方法。
背景技术:
心脏信号(例如电荷密度、偶极子密度、电压等)在心内膜表面上各处的幅度不同。这些信号的幅度取决于若干因素,包括局部组织特征(例如健康与疾病/疤痕/纤维化/损伤)和区域激活特征(例如被激活组织在激活局部细胞之前的“电质量(electricalmass)”)。通常的做法是为表面上所有时间的所有信号分配单个阈值。使用单个阈值可导致错过了低振幅激活,或者使高振幅激活主导/饱和,导致对图像的解释混淆。未能正确检测激活可导致对治疗递送的感兴趣区域的识别不精确,或者对消融功效的鉴定不完全(过量或缺乏阻断)。
心房颤动的连续全局标测产生了大量时间和空间可变的激活模式。图像数据的有限离散采样可能不足以提供用于心律失常的驱动器、机制和支撑基板的全貌。长时间的af临床审视可能很难记住,难以拼凑成“较大的面貌”。
技术实现要素:
根据本发明构思的一个方面,一种心脏信息动态显示系统包括:一个或多个电极,其配置为在多个时间间隔记录表示心脏活动的电势数据组;和心脏信息控制台,包括:信号处理器,其配置为:使用记录的电势数据组在多个时间间隔计算心脏活动数据组,其中心脏活动数据与一个或多个心脏腔室的表面位置相关联;和用户界面模块,其配置为显示一系列图像,每个图像包括:心脏活动的图形表示;其中信号处理器包括:自动定向系统,其配置为将一个或多个定位轴定向在期望的方向上和/或将定位坐标系统朝向生理定向旋转。
根据本发明构思的另一方面,一种心脏信息动态显示系统包括:一个或多个电极,其配置为在多个时间间隔记录表示心脏活动的电势数据组;和心脏信息控制台,包括:信号处理器,其配置为:使用记录的电势数据组在多个时间间隔计算心脏活动数据组,其中心脏活动数据与一个或多个心脏腔室的表面位置相关联;和用户界面模块,其配置为显示一系列图像,每个图像包括:心脏活动的图形表示;其中信号处理器包括:心脏信息算法,其直接执行截断的svd计算以计算心脏活动数据组。
根据本发明构思的另一方面,一种心脏信息动态显示系统包括:一个或多个电极,其配置为在多个时间间隔记录表示心脏活动的电势数据组;和心脏信息控制台,包括:信号处理器,其配置为:使用记录的电势数据组在多个时间间隔计算心脏活动数据组,其中心脏活动数据与一个或多个心脏腔室的表面位置相关联;和用户界面模块,其配置为显示一系列图像,每个图像包括:心脏活动的图形表示;其中信号处理器包括:非功能性电极检测算法,其配置为对于足够的功能性评估一个或多个电极。
在一些实施例中,信号处理器还配置为不包括从非功能性电极检测算法所识别的电极测量到的电压来计算心脏活动数据组。
根据本发明构思的另一方面,一种心脏信息动态显示系统包括:一个或多个电极,其配置为在多个时间间隔记录表示心脏活动的电势数据组;和心脏信息控制台,包括:信号处理器,其配置为:使用记录的电势数据组在多个时间间隔计算心脏活动数据组,其中心脏活动数据与一个或多个心脏腔室的表面位置相关联;和用户界面模块,其配置为显示一系列图像,每个图像包括:心脏活动的图形表示;其中所述控制台包括:模数转换器;和子系统,其配置为在某些条件下自动关闭模数转换器。
根据本发明构思的另一方面,一种心脏信息动态显示系统包括:一个或多个电极,其配置为在多个时间间隔记录表示心脏活动的电势数据组;和心脏信息控制台,包括:信号处理器,其配置为:使用记录的电势数据组在多个时间间隔计算心脏活动数据组,其中心脏活动数据与一个或多个心脏腔室的表面位置相关联;和用户界面模块,其配置为显示一系列图像,每个图像包括:心脏活动的图形表示;其中信号处理器包括:配置为减少心室远场信号的影响的算法。
根据本发明构思的另一方面,一种心脏信息动态显示系统包括:一个或多个电极,其配置为在多个时间间隔记录表示心脏活动的电势数据组;和心脏信息控制台,包括:信号处理器,其配置为:使用记录的电势数据组在多个时间间隔计算心脏活动数据组,其中心脏活动数据与一个或多个心脏腔室的表面位置相关联;和用户界面模块,其配置为显示一系列图像,每个图像包括:心脏活动的图形表示;其中信号处理器包括:配准处理子系统,其配置为将电压测量与位置相关联。
根据本发明构思的另一方面,一种心脏信息动态显示系统包括:一个或多个电极,其配置为在多个时间间隔记录表示心脏活动的电势数据组;和心脏信息控制台,包括:信号处理器,其配置为:使用记录的电势数据组在多个时间间隔计算心脏活动数据组,其中心脏活动数据与一个或多个心脏腔室的表面位置相关联;和用户界面模块,其配置为显示一系列图像,每个图像包括:心脏活动的图形表示;其中信号处理器包括:改进的场估计算法。
根据本发明构思的另一方面,一种心脏信息动态显示系统包括:一个或多个电极,其配置为在多个时间间隔记录表示心脏活动的电势数据组;和心脏信息控制台,包括:信号处理器,其配置为:使用记录的电势数据组在多个时间间隔计算心脏活动数据组,其中心脏活动数据与一个或多个心脏腔室的表面位置相关联;和用户界面模块,其配置为显示一系列图像,每个图像包括:心脏活动的图形表示;其中信号处理器包括:正向矩阵和逆解;和放缩算法,其包括配置为减少对正向矩阵的距离影响的预放缩部分,以及用于调整逆解的输出的后放缩部分。
附图说明
图1是根据本发明构思的方面的心脏信息处理系统的实施例的框图。
图1-1(a)和图1-1(b)是示出根据本发明构思的方面的用于执行svd计算的方法的两个流程图。
图2是根据本发明构思的方面的患者和相对电极放置的正视图和后视图。
图3是根据本发明构思的方面的识别非功能性电极的流程图。
图4是根据本发明构思的方面的执行v波去除的流程图。
图4-1至4-3示出了根据本发明构思的方面的v波去除曲线图的各种示例。
图5是根据本发明构思的方面的用于执行定位的算法的流程图。
图6是根据本发明构思的方面的到达目标系(frame)的集成路径的3d显示。
图7是根据本发明构思的方面的到达目标系的集成路径的3d显示。
图8是根据本发明构思的方面的放缩算法的流程图。
图9示出了根据本发明构思的方面的用于映射多个篮子(basket)位置的流程图。
图10示出了根据本发明构思的方面的用于重新分类非功能性电极以用于计算心脏活动的步骤的流程图。
图11a和11b示出了v波去除(vwr)的两个示例。
图12是根据本发明构思的方面的心脏激活数据的视图的显示的实施例。
图13示出了根据本发明构思的方面的中值滤波器应用于传播历史图像的一些示例。
图14示出了根据本发明构思的方面的假阳性(falsepositive)激活注释去除的一个示例性实现。
图15示出了根据本发明构思的方面的套索型导管。
图16是示出了根据本发明构思的方面的将点拟合到表示导管的曲线的方法的流程图。
图17a至17c示出了根据本发明构思的方面的用于一个或多个信道的起搏消隐(paceblanking)方法的示例。
图18a和18b示出了根据本发明构思的方面的使用体素的两个示例。
图19是根据本发明构思的方面的用于产生心脏的跳动解剖模型的方法的实施例的流程图。
图20是根据本发明构思的方面的用于显示心脏的动态模型的方法的实施例的流程图。
图21是根据本发明构思的方面的用于编辑心脏模型的方法的实施例的流程图。
具体实施方式
参考附图,下文将更充分描述各示意性实施例,附图示出了一些示意性实施例。然而,本发明构思可以以不同形式体现并且不应该视为对本文所阐述的示例性实施例的限制。
应该理解的是,尽管在本文中使用术语第一、第二等来描述各种元件,但是这些元件不受这些术语限制。使用这些术语来区分一个元件与另一个元件,但并不意味着元件的所需序列。例如,第一元件可以被称为第二元件,并且类似地,第二元件可以被称为第一元件,而不偏离本发明的范围。如本文所使用的,术语“和/或”包括一个更多个相关所列项目的任意和所有组合。并且,相关列出项目的“组合”不需要包括所有的所列项目,但可以包括所有的所列项目。
应当理解,当一个元件在另一个元件“上”或“附接”、“连接”或“耦合”至另一元件时,它可以直接位于另一个元件上或连接或耦合至另一个元件,或者可以存在中间元件。相反,当元件被称为“直接在……上”或“直接连接”或“直接耦合”到另一元件时,不存在中间元件。用于描述元件之间的关系的其它词语应该以类似的方式解释(例如,“在......之间”与“直接在......之间”、“相邻”与“直接相邻”等)。
本文所用的术语仅是出于描述具体实施例的目的,而不旨在限制本发明。除非上下文清楚地指出,否则,如本文所用的单数形式“一”、“一个”和“所述”旨在也包括复数形式。将进一步理解的是,当在本文中使用术语“包括”、“包含”和/或“含有”时,术语特指所陈述的特征、步骤、操作、元件和/或部件的存在,但不排除一个或多个其他特征、步骤、操作、元件、部件和/或其分组的存在或增加。
空间关系术语,例如“在......之下”、“以下”、“下面”、“上方”、“上面”等可用于描述一个元件和/或特征与另一元件和/或特征的关系,例如,如图所示那样。将可以理解的是,除了在附图中描绘的定向外,空间关系术语旨在包含使用和/或操作中装置的不同定向。例如,如果在图中的装置被翻转,则描述为“以下”和/或“在......之下”的元件或特征将被定向为在其它元件或特征“上方”。装置可以以其他方式定向(例如,旋转90度或在其它定向),本文使用的空间相对描述符相应地解释。
定位描述了建立坐标系统的过程,并使用一个或多个信号(例如电子信号)来确定该系统内一个或多个对象的位置。在一些实施例中,定位过程包含从一个或多个源产生的随着空间和/或时间而改变的一个或多个信号,以及测量来自一位置的所产生信号的传感器、检测器或其他换能器。传感器的位置可以在被定位的对象上,或者可以与被定位的对象分开。对所测量信号的分析和/或计算可以用于确定传感器和/或对象与所产生信号的一个或多个源的位置关系。定位方法可以包含两个或更多个所产生信号以增加传感器和源之间的位置关系的数量或准确度。源、传感器和/或对象可以被共同定位或可以是相同的装置。在一些实施例中,随着时间和/或空间的改变包括所产生信号与测量环境的相互作用。在其他实施例中,定位过程测量对象、传感器或环境的固有或现有性质或特性,例如测量来自位于对象或传感器上的加速度计的信号。
本文参考说明理想化或代表性结构和中间结构来描述各种示例性实施例。这样,示例形状的变型作为例如制造技术和/或公差的结果是可预期的。因此,示例性实施例不应被解释为限制本文示出的区域的特定形状,而是包括例如由制造导致的形状上的偏差。
只要功能特征、操作和/或步骤本文中被描述,或以其他方式被理解为包括在本发明构思的各种实施例,这些功能特征、操作和/或步骤便可以体现在功能块、单元、模块、操作和/或方法中。而且,只要这些功能块、单元、模块、操作和/或方法包括计算机程序代码,这样的计算机程序代码便可以存储在计算机可读介质中,例如可由至少一个计算机处理器执行的非暂时性存储器和介质。
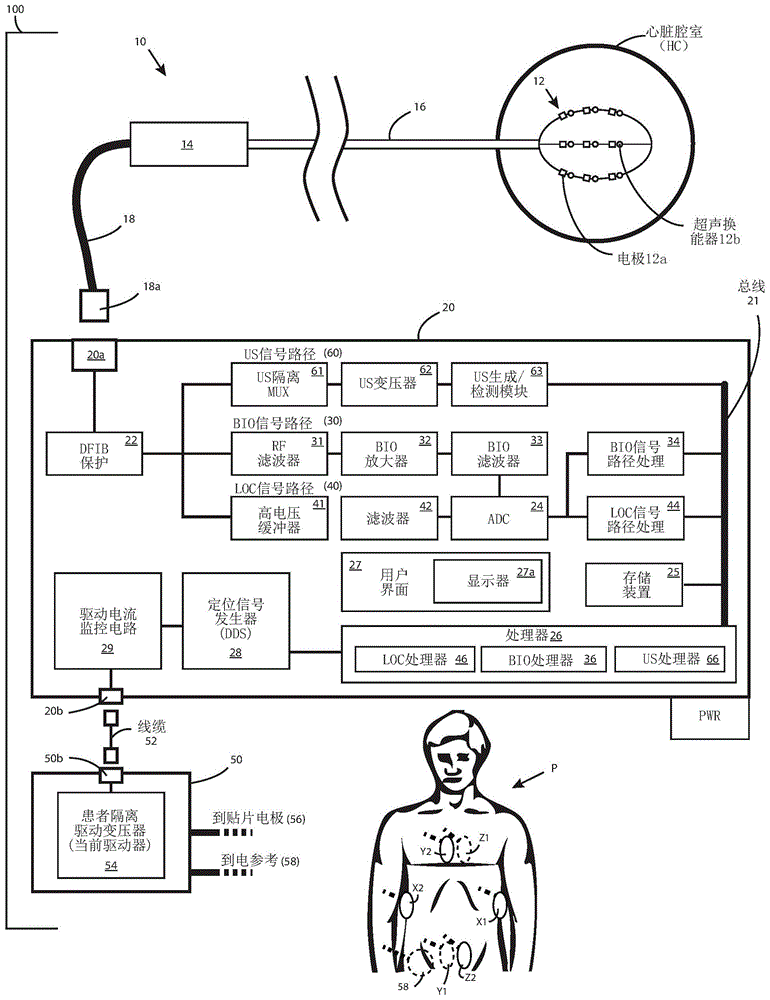
现在参考图1,提供了根据本发明构思的方面的心脏信息处理系统100的实施例的框图。心脏信息处理系统100可以是或包括配置为执行心脏标测、诊断和/或治疗的系统,例如用于治疗患者诸如心律失常的疾病或病症。附加地或替代地,系统可以是配置为用于教学和/或验证诊断和/或治疗患者p的心脏异常或疾病的装置和方法的系统。系统还可以用于产生心脏活动的显示,例如在心脏表面上传播的活动波阵面的动态显示。
心脏信息处理系统100包括导管10、心脏信息控制台20和患者界面模块50,其可以配置为协作以实现心脏信息处理系统100的各种功能。心脏信息处理系统100可以包括单个电源(pwr),其可以由心脏信息控制台20和患者界面模块50共享。以这种方式使用单个电源可以大大减少泄漏电流传播到患者界面模块50中并导致定位(即在患者p体内确定一个或多个电极的位置的过程)中的误差的机会。心脏信息控制台20包括总线21,其将控制台20的各种部件彼此电连接或可操作地连接,如图1所示。
导管10包括电极阵列12,其可以经皮递送至心脏腔室(hc)。在该实施例中,电极阵列12在三维(3d)空间中具有已知的空间配置。例如,在膨胀状态下,电极阵列12的物理关系可以是已知或可靠地假设的。诊断导管10还包括手柄14和从手柄14延伸的细长柔性轴16。附接到轴16的远端的是电极阵列12,例如径向可膨胀和/或可压缩的组件。在该实施例中,电极阵列12被示出为篮子阵列(basketarray),但是电极阵列12在其他实施例中可以采用其他形式。在一些实施例中,可膨胀电极阵列12可以参照申请人的以下申请所述的那样构造和布置:在2013年8月30日提交的题为“用于诊断和治疗心脏组织的系统和方法”的国际pct专利申请pct/us2013/057579号,以及在2014年2月7日提交的题为“具有柔性印刷电路板的可膨胀导管组件”的国际pct专利申请pct/us2014/015261,其内容通过参考方式整体并入本文。在其他实施例中,可膨胀电极阵列12可以包括球囊、可径向展开的臂、螺旋阵列和/或其他可膨胀和可压缩的结构(例如弹性偏置的结构)。
轴16和可膨胀电极阵列12构造和布置成插入身体(例如动物体或人体,例如患者p的身体),并且通过血管(例如股静脉和/或其他血管)推进。轴16和电极阵列12可以构造和布置成通过导引器(未示出)插入,例如当电极阵列12处于压缩状态时,并且通过导引器的内腔滑动地进入身体空间,例如心脏的腔室(hc),例如右心房或左心房。
可膨胀电极阵列12可以包括多个样条(spline)(例如,弹性偏置在图1所示的篮子形状中的多个样条),每个样条具有多个生物电势电极12a和/或多个超声(us)换能器12b。在图1中可以看到三个样条,篮子阵列不限于三个样条,篮子阵列中可以包括更多或更少样条。每个电极12a可以配置为记录生物电势(或电压),例如在心脏表面上某点或在心脏腔室hc内某个位置确定(例如测量或感测)的电压。每个us换能器12b可以配置为发送超声信号和接收超声反射以确定到反射目标的范围,例如在心脏腔室(hc)表面上的某点,其在解剖结构的数字模型创建中使用。
作为非限制性示例,在该实施例中,在每个样条上示出了三个电极12a和三个us换能器12b。然而,在其他实施例中,篮子阵列可以包括更多或更少电极和/或更多或更少us换能器。此外,电极12a和换能器12b可以成对布置。这里,一个电极12a与一个换能器12b成对,每个样条有多个电极-换能器对。然而,本发明构思不限于这种特定的电极-换能器布置。在其他实施例中,并非所有电极12a和换能器12b都需要成对布置,一些可以成对布置而另一些不成对布置。而且,在一些实施例中,不是所有样条都需要与电极12a和换能器12b具有相同的布置。另外,在一些实施例中,电极12a可以布置在一些样条上,而换能器12b可以布置在其他样条上。
导管10可以包括线缆或其他管线,例如线缆18,其配置成分别通过连接器18a和20a将导管10电连接、光学连接和/或电光连接到心脏信息控制台20。在一些实施例中,线缆18包括选自下组的机构:线缆,例如转向线缆;机械连接;液压管;气动管;以及这些中的一个或多个的组合。
患者界面模块50可以配置为将心脏信息控制台20的一个或多个部件与患者p电隔离(例如,以防止不期望地将冲击或其他不期望的电能传递给患者p)。患者界面模块50可以与心脏信息控制台20集成在一起,和/或它可以包括单独的分立部件(例如单独的壳体),如图所示。心脏信息控制台20包括一个或多个连接器20b,每个包括插孔、插头、端子、端口,或其他定制或标准的电连接器、光连接器和/或机械连接器。在一些实施例中,连接器20b被端接(terminate)以在不同的rf频率下(例如10千赫兹至20兆赫兹)保持期望的输入阻抗。在一些实施例中,可以通过用滤波器端接线缆屏蔽来实现端接。在一些实施例中,端接滤波器可以在一个频率范围内提供高输入阻抗,例如以最小化定位频率的泄漏,以及在不同的频率范围内提供低输入阻抗,例如以在超声频率下实现最大信号完整性。类似地,患者界面模块50包括一个或多个连接器50b。至少一个线缆52通过连接器20b和50b将患者界面模块50与心脏信息控制台20连接。
在该实施例中,患者界面模块50包括隔离的定位驱动系统54、贴片电极56组,以及一个或多个参考电极58。隔离的定位驱动系统54将定位信号与系统的其余部分隔离,以防止电流泄漏,例如信号丢失,导致性能下降。在一些实施例中,定位信号与系统的其余部分的隔离包括大于100千欧姆的阻抗范围,例如在定位频率下的大约500千欧姆。定位驱动系统54的隔离可以最小化定位位置的漂移(drift)和保持轴之间的高度隔离。定位驱动系统54可以操作为电流、电压、磁、声或其他类型的能量模式驱动器。基于定位驱动系统54所采用的能量模式,贴片电极56组和/或一个或多个参考电极58可以由导电电极、磁线圈、声换能器和/或其他类型的换能器或传感器组成。另外,隔离的定位驱动系统54保持所有轴上的同时输出,例如定位信号存在于每个轴电极对上,同时还增加在每个电极位置的有效采样率。在一些实施例中,定位采样率包括10khz至20mhz的速率,例如大约625khz的采样率。
在该实施例中,贴片电极56组包括三(3)对贴片电极:“x”对,其具有两个放置在肋部的相对两侧上的两个贴片电极(x1、x2);“y”对,其具有放置在下背部上的一个贴片电极(y1)和放置在上胸部上的一个贴片电极(y2);以及“z”对,其具有放置在上背部上的一个贴片电极(z1)和放置在下腹部上的一个贴片电极(z2)。贴片电极56对可以放置在任何正交和/或非正交轴组上。在图1的实施例中,示出了在患者p上电极的放置,其中在背部上的电极以虚线示出。(也参见图2)
图2是根据本发明构思的方面的患者p和相对电极放置的正视图和后视图。该图示出了优选的贴片电极放置,如上所述。在图1中,例如,x电极x1和x2分别被示为贴片电极1和2;z电极z1和z2分别被示为贴片电极3和4;并且,y电极y1和y2分别被示为贴片电极5和6。因此,贴片1和2放置在肋部上,在体内形成x轴;贴片3和4(分别地)放置在下背部和上胸部,形成z轴;并且,贴片5和6分别放置在上背部和下腹部(躯干)上,形成y轴。三个轴有类似的长度,并且不与身体的“自然”轴对准(即,从头到脚、从胸到背,以及从一侧到另一侧)。
参考贴片电极58可以放置在下背部/臀部上。附加地或替代地,参考导管可以放置在身体血管内,例如在下背部/臀部中和/或附近的血管。
电极56的放置限定了由三个轴构成的坐标系统,其中每对贴片电极56一个轴。在一些实施例中,例如如图2所示,轴与身体的自然轴是非正交的,例如与从头到脚、从胸到背以及从一侧到另一侧(即从肋到肋)非正交。电极可以放置为使得轴在原点(origin)相交,例如位于心脏中的原点。例如,三个相交轴的原点可以在心房的容积中居中。系统100可以配置为提供位于心脏外部的“电零点”(electricalzero),例如通过定位参考电极58使得所得的电零点在心脏外部(例如,以避免在被定位的一个或多个位置从正电压跨到负电压)。
如上所述,贴片对可以差分地操作,即对中的贴片56都不操作为参考电极,并且皆由系统100驱动以在两者之间产生电场。替代地或附加地,一个或多个贴片电极56可以用作参考电极58,使得它们以单端模式操作。任何一对贴片电极56中的一个贴片电极56可以用作该贴片对的参考电极58,形成单端贴片对。一个或多个贴片对可以配置为独立地单端。一个或多个贴片对可以共享贴片作为单端参考,或者多于一对贴片的参考贴片可以被电连接。
通过心脏信息控制台20执行的处理,轴可以从第一定向(例如,基于电极56的放置的非生理定向)变换(例如旋转)到第二定向。第二定向可以包括标准的左-后-上(lps)解剖定向,即“x”轴从患者的右侧到左侧定向,“y”轴从患者的前部到后部定向,而“z”轴从患者的尾侧到颅侧定向。贴片电极56的放置和由此限定的非标准轴可以选择为提供比导致所得轴的正常生理定向的贴片电极放置改进了的空间分辨率,例如由于非标准定向的电极56之间的优选组织特性。例如,非标准电极56放置可以导致减少肺部的低阻抗容积对定位场的负面影响。此外,电极56放置可以选择为产生沿着等效或至少相似长度的路径穿过患者身体的轴。相似长度的轴将在体内具有更相似的每单位距离的能量密度,沿着这些轴产生更均匀的空间分辨率。将非标准轴变换为标准定向可以为用户提供更直接的显示环境。一旦实现期望的旋转,可以根据需要放缩每个轴,即,使其更长或更短。基于比较预定的(例如预期的或已知的)电极阵列12形状和相对维度与对应于贴片电极建立的坐标系统中的电极阵列的形状和相对维度的测量值,执行旋转和放缩。例如,可以执行旋转和放缩以将相对不准确的(例如未校准的)表示变换为更准确的表示。对电极阵列12的表示进行整形和放缩可以调整、对准和/或以其他方式改善轴的定向和相对尺寸,以进行更加准确的定位。
电参考电极58可以是或至少包括贴片电极和/或电参考导管,其用作患者“模拟接地”参考。贴片电极58可以放置在皮肤上,并且可以用作用于除颤的电流的返回(即,提供次要目的)。电参考导管可包括用于增强共模抑制的单极参考电极。单极参考电极或参考导管上的其他电极可用于测量、跟踪、校正和/或校准心脏信号中的生理、机械、电和/或计算伪影。在一些实施例中,这些伪影可能是由于呼吸、心脏运动和/或所应用的信号处理(例如滤波器)引起的伪影。另一种形式的电参考导管可以是内部模拟参考电极,其可以用作所有内部导管电极的低噪声“模拟接地”。这些类型的参考电极中的每一个可以放置在相对类似的位置,例如在下背部附近的内部血管中(作为导管)和/或在下背部上(作为贴片)。在一些实施例中,系统100包括参考导管58,其包括固定机构(例如,用户激活的固定机构),其可被构造和布置成减少参考导管58的一个或多个电极的位移(例如,意外或其他无意的移动)。固定机构可包括选自下组的机构:螺旋膨胀机;球形膨胀机;圆周膨胀机;轴向驱动的膨胀机;旋转驱动的膨胀机;以及这些中的两种或更多种的组合。
在图1中,描绘了心脏信息控制台20的接收器部件的方面。心脏信息控制台20包括连接到连接器20a的除颤(dfib)保护模块22,其配置为从导管10接收心脏信息。dfib保护模块22配置为具有精确的钳位电压和最小电容。在功能上,dfib保护模块22用作电涌保护器,其配置为在向患者应用高能量期间保护控制台20的电路,例如在患者的除颤期间(例如,使用标准的除颤装置)。
dfib保护模块22耦合到三个信号路径:生物电势(bio)信号路径30、定位(loc)信号路径40和超声(us)信号路径60。通常,bio信号路径30滤除噪声并保留测量的生物电势数据,并且还使得能够在消融时读取(例如成功记录)生物电势信号,在其他系统中不是这种情况。通常,loc信号路径40允许高电压输入,同时从接收的定位数据中滤除噪声。通常,us信号路径60使用超声换能器12b从解剖结构的物理结构获取范围数据,以产生心脏腔室hc的2d或3d数字模型,其可以存储在存储器中。
bio信号路径30包括耦合到dfib保护模块22的rf滤波器31。在该实施例中,rf滤波器31操作为具有高输入阻抗的低通滤波器。在该实施例中,高输入阻抗是优选的,因为它最小化来自源(例如导管10)的电压的丢失,从而更好地保留接收的信号,例如在rf消融期间。rf滤波器31配置为允许来自导管10上的电极12a的生物电势信号通过rf滤波器31,例如通过小于500hz的频率,例如0.5hz至500hz范围内的频率。然而,从生物电势信号路径30滤出高频,例如rf消融中使用的高电压信号。在一些实施例中,rf滤波器31可包括10khz和50khz之间的转角频率。
bio放大器32可以包括低噪声单端输入放大器,其放大rf滤波信号。bio滤波器33(例如低通滤波器)将噪声从放大的信号滤走。bio滤波器33可包括大约3khz的滤波器。在一些实施例中,bio滤波器33包括大约7.5khz的滤波器,例如当系统100配置为适应心脏的起搏时(例如,避免在心脏起搏期间显著的信号丢失和/或损耗)。
bio滤波器33可以包括用于从生物电势数据中去除共模电力线信号的差分放大器级。该差分放大器可以实现基线恢复功能,其从生物电势信号中去除dc偏移和/或低频伪影。在一些实施例中,该基线恢复功能包括可编程滤波器,其可包括一个或多个滤波器级。在一些实施例中,滤波器可包括状态依赖滤波器。状态依赖滤波器的特性可以基于阈值和/或参数(例如电压)的其他水平,滤波器速率基于滤波器状态而变化。基线恢复功能的部件可以包含降噪技术,例如基线恢复电压的脉冲宽度调制和/或抖动。基线恢复功能还可以通过测量、反馈和/或鉴定来确定一个或多个级的滤波器响应。基线恢复功能还可以确定和/或区分表示来自滤波器响应的伪影的生理信号形态的信号部分,并计算地恢复原始形态或其部分。在一些实施例中,原始形态的恢复可以包括直接和/或在滤波器响应的附加信号处理后,例如通过静态、时间依赖和/或空间依赖的加权、乘法、滤波、求逆,以及这些的组合,减去滤波器响应。在一些实施例中,基线恢复功能可以在bio滤波器33、bio处理器36或两者中实现。
loc信号路径40包括耦合到dfib保护模块22的高电压缓冲器41。在该实施例中,高电压缓冲器41配置为适应治疗技术中使用的相对高的电压,例如rf消融电压。例如,高电压缓冲器可以具有±100v的电源轨道。在一些实施例中,每个高电压缓冲器41具有高输入阻抗,例如在定位频率的100千欧姆至10兆欧的阻抗。在一些实施例中,所有高电压缓冲器41一起作为总并联电等价,也具有高输入阻抗,例如在定位频率的100千欧姆至10兆欧的阻抗。在一些实施例中,高电压缓冲器41具有在高频率范围(例如100千赫和10兆赫之间的频率,例如大约2兆赫的频率)内保持良好性能的带宽。在一些实施例中,高电压缓冲器41不包括无源rf滤波器输入级,例如当高电压缓冲器41具有±100v的电源时。高频带通滤波器42可以耦合到高电压缓冲器41,并且可以具有大约20khz到80khz的通带频率范围,以用于定位。在一些实施例中,滤波器42具有带单位增益(unitygain)(例如1或约1的增益)的低噪声。
us信号路径60包括us隔离多路复用器mux61、具有tx/rx开关的us变压器、us变压器62、us生成和检测模块63,以及us信号处理器66。us隔离mux61连接到dfib保护模块22,并且用于例如以预定的顺序或模式打开/关闭us换能器12b。us隔离mux61可以是高输入阻抗开关组,其打开时,隔离us系统和剩余的us信号路径元件,将接地阻抗(通过换能器和us信号路径60)与bio路径和loc的输入去耦。us隔离mux61还将一个发射/接收电路多路复用到导管10上的一个或多个多个换能器12b。us变压器62在us隔离mux61和us生成和检测模块63之间在两个方向上操作。us变压器62在us换能器12b超声发送和接收时将患者与模块63中的us发送和接收电路产生的电流隔离。us变压器62可以配置为基于换能器12b的操作模式选择性地接合模块63的发送和/或接收电子器件,例如通过使用发送/接收开关。也就是说,在发送模式中,模块63从us处理器66(在数据处理器26内)接收控制信号,其激活us信号产生,并将tx放大器的输出连接到us变压器62。us变压器62将信号耦合到us隔离mux61,其选择性地激活us换能器12b。在接收模式中,us隔离mux61从一个或多个换能器12b接收反射信号,其被传递到us变压器62。us变压器62将信号耦合到us生成和检测模块63的接收电子器件中,其又将反射数据信号传送到us处理器66以供处理并由用户界面系统27和显示器27a使用。在一些实施例中,处理器66命令mux61和us变压器62允许超声的发送和接收以激活一个或多个相关换能器12b,例如以预定顺序或模式。作为示例,us处理器66可以包括检测单个第一反射,检测和识别来自多个目标的多个反射,从多普勒方法和/或来自后续脉冲确定速度信息,从反射的信号的幅度、频率和/或相位特性确定组织密度信息,以及这些中的一个或多个的组合。
模数转换器(adc)24耦合到bio信号路径30的bio滤波器33和loc信号路径40的高频滤波器42。由adc24接收的是单独的时变模拟生物电势电压信号组,每个电极12a一个。通过bio信号路径30,这些生物电势信号已经在逐个信道的基础上被差分地参考到单极电极以用于增强的共模抑制、滤波和增益校准。由adc通过loc信号路径40接收的还有每个贴片电极56的每个轴的单独时变模拟定位电压信号组,其被输出到adc24,作为电极12a在同一时间测量的(在该实施例中)48个定位电压的集合。adc24具有高过采样以允许噪声整形和滤波,例如以大约625khz的过采样率。在一些实施例中,在系统100的奈奎斯特频率或以上执行采样。adc24是多信道电路,其可以组合bio和loc信号或将它们分开。在一个实施例中,作为多信道电路,adc24可以配置为容纳48个定位电极12a和32个辅助电极(例如用于消融或其他过程),总共80个信道。在其他实施例中,可以提供更多或更少信道。在图1中,例如,几乎所有心脏信息控制台20的元件都可以为每个信道而重复(例如,除了ui系统27之外)。例如,心脏信息控制台20可以为每个信道包括单独的adc,或80个信道adc。在该实施例中,来自bio信号路径30和loc信号路径40的信号信息被输入到adc24的各个信道并从adc24的各个信道输出。来自adc24的信道的输出被耦合到bio信号处理模块34或loc信号处理模块44,其预处理其各自的信号以便后续处理,如下文所述。在每种情况下,预处理准备接收的信号,以便由它们如下讨论的各自的专用处理器进行处理。在一些实施例中,bio信号处理模块34和loc信号处理模块44可以全部或部分地在固件中实现。
生物电势信号处理器模块34可以提供增益和偏移调整和/或数字rf滤波,其具有非色散低通滤波器和中频频带。中频频带可以消除消融和定位信号。生物电势信号处理器模块34还可以包括数字生物电势滤波,其可以优化输出采样率。
另外,生物电势信号处理器模块34还可以包括“起搏消隐”,其是例如医生为心脏进行“起搏”的时间帧期间所接收的信息的消隐。例如,通过插入或应用心内、食管内或经皮起搏导线可以实现临时心脏起搏。临时心脏起搏的目标是交互地测试和/或改善心律和/或血液动态。为了实现上述目的,可以例如由系统100执行主动和被动起搏触发和输入算法触发确定。算法触发确定可以使用信道子集、边缘检测和/或脉冲宽度检测来确定患者的起搏是否已经发生。可选地,起搏消隐可以应用于所有信道或信道子集,包括未发生检测的信道。
起搏消隐
图17a至17c图示出了用于一个或多个信道的起搏消隐的实施例的非限制性示例。可以出于多种原因对一个或多个信道进行分组,包括但不限于功能的相似性(例如表面ecg)、位置的相似性(例如按系统架构共享物理系统板的信道),或便利性。在附图中,虚线框中的框(在图17中,并标记为“n个信道”)在单独的信道上操作,其余的框(图17a至c)则在信道组上操作。
最佳地,为了特定于信道的增益和偏移而校正传入数据。输入数据也可以在输入被滤波或抽取,例如,以降低计算复杂度和/或满足数据速率要求。然后将数据流分成两个路径:延迟路径和保持路径,其在输出数据开关会聚。
以类似于或等于数据宽度和数据窗口的处理时间的持续时间来延迟延迟路径,该数据窗口被处理以检测起搏脉冲,例如0.1至100ms的延迟,例如0.5至10ms,例如4ms。
保持路径包括滤波器和数据锁存器。保持滤波器配置有频率响应以排除信号或电力线频率的较高频率分量和低频基线的变化,例如通带范围为1至40hz的带通滤波器。保持滤波器还可以包括平均数据的持续时间以平滑输出数据开关的输出信号中的任何不连续转变,例如1微秒至1秒的持续时间,例如10至500微秒,例如100微秒。保持路径的数据锁存器配置为将其输入的值保持一段特定的持续时间,或直至被控制输入命令释放。
输出数据开关配置为基于消隐控制逻辑所确定的配置,在来自延迟路径的所得信号和保持路径的所得信号之间切换其输出。当输出数据开关输出保持路径信号时,该信号被认为被消隐。当输出数据开关输出延迟路径信号时,该信号被认为不被消隐。
消隐控制逻辑是起搏检测路径的末级,其使用输入数据来确定输入数据的当前窗口内起搏脉冲的存在或缺乏。对于包括输入数据的组中的每个信道,在用于检测起搏脉冲的子集中单独地包括或排除信道。从外部输入接收每个信道的启用信号,并将其用于在子集中包括或排除每个信道。外部输入可以由系统100自动确定或由用户手动配置。对于子集中包括的每个信道,使用处理算法来处理信号。处理算法可以包括但不限于以下中的一个或多个:滤波器、导数、积分、下采样、上采样、绝对值、平均、诸如中值的统计计算等。
子集的每个信道被汇集到求和节点中,其操作算法以将来自子集的所有信道的信息组合成代表性输出。求和节点使用的算法可以但不限于以下中的一个或多个:和、平均、差异、交织(interleave)等。
求和节点的代表输出被传递到起搏脉冲检测算法。起搏脉冲检测算法可包括但不限于以下一个或多个:斜率检测器、持续时间测量、幅度检测器、阈值、导数、绝对值、平均值、滤波器等。可以基于每个标准的状态,以逻辑或决策树布置用于起搏脉冲检测的标准的序列。可以启用一个或多个标准以允许起搏消隐,可以启用一个或多个标准以禁止起搏消隐,或这些的组合。起搏脉冲检测算法的结果被传递到消隐控制逻辑以控制输出数据开关的输出。
消隐控制逻辑包括通信功能,用于在信道组之间传送起搏脉冲检测的状态。输出状态向所有其他组报告当前信道组存在或缺乏检测的起搏脉冲。输入状态接收一个或多个其他信道组的状态。消隐控制逻辑可以配置为将接收的状态与消隐控制逻辑中的起搏脉冲检测的结果结合,以推翻起搏脉冲检测的结果,和/或忽略接收的状态。
另外,生物电势信号处理器模块34还可以包括专用滤波器,其从生物电势数据中去除超声信号和/或其他不需要的信号,例如伪影。在一些实施例中,为了执行这种滤波,可以使用边缘检测、阈值检测和/或定时相关。
定位信号处理模块44可以提供单独的信道/频率增益校准、具有调谐的解调相位的iq解调、同步和连续解调(没有多路复用)、窄带r滤波和/或时间滤波(例如交织、消隐等),如下文所述。定位信号处理模块还可以包括数字定位滤波,其优化输出采样率和/或频率响应。
在这个实施例中,bio信号路径30、loc信号路径40和us信号路径60的算法计算在心脏信息控制台20中执行。这些算法计算包括但不限于:一次处理多个信道,测量信道之间的传播延迟,将x、y、z数据转换为电极位置的空间分布,包括计算和应用对位置集合的校正,将单独的超声距离与电极位置组合以计算检测的心内膜表面点,以及从表面点构造表面网格。由心脏信息控制台20处理的信道的数量可以在1到500之间,例如24到256之间,例如48、80或96个信道。
数据处理器26可以包括多个类型的处理电路(例如微处理器)和存储器电路中的一个或多个,执行对处理来自bio信号处理模块34、定位信号处理模块44和ustx/rxmux61的预处理信号是必需的计算机指令。数据处理器26可以配置为执行计算,以及执行数据存储和检索,这对执行心脏信息处理系统100的功能是必需的。
在这个实施例中,数据处理器26包括生物电势(bio)处理器36、定位(loc)处理器46和超声(us)处理器66。生物电势处理器36可以执行对例如从电子器件12a记录的、测量的或感测的生物电势的处理。loc处理器46可以执行对定位信号的处理。而us处理器66可以执行对例如来自换能器12b的反射的us信号的图像处理。
生物电势处理器36可以配置为执行各种计算。例如,bio处理器36可以包括增强型共模抑制滤波器,其可以是双向的,以使失真最小化,并且可以种有(seed)共模信号。bio处理器36还可以包括优化的超声反射滤波器,并且配置用于可选择的带宽滤波。信号路径60中的数据的处理步骤可以由生物信号处理器34和/或生物处理器36执行。
定位处理器46可以配置为执行各种计算。如下面更详细讨论的,loc处理器46可以基于电极阵列12的已知形状电子地对轴进行校正(计算),基于电极阵列12的已知形状对一个或多个轴的放缩或歪斜进行校正,以及执行“拟合”以使测量的电极位置与已知的可能配置对准,这可以以通过一个或多个约束来优化(例如物理约束,例如单一样条上两个电极12a之间的距离、两个不同的样条上的两个电极12a之间的距离、两个电极12a之间的最大距离、两个电极12a之间的最小距离,和/或样条的最小和/或最大曲率等)。
us处理器66可以配置为执行各种计算,其与通过us换能器12b的us信号的生成和us换能器12b所接收的us信号反射的处理相关联。us处理器66可以配置为与us信号路径60交互,以选择性地向us换能器12b发送和从us换能器12b接收us信号。us换能器12b可以在us处理器66的控制下各自设为发送模式或接收模式。us处理器66可以配置为使用通过us路径60从us换能器12b接收的反射us信号,构建其中设置有电极阵列12的心脏腔室(hc)的2d和/或3d图像。
心脏信息控制台20还可以包括定位驱动电路,包括定位信号发生器28和定位驱动电流监控电路29。定位驱动电路提供高频定位驱动信号(例如10khz至1mhz,例如10khz至100khz)。使用这些高频率的驱动信号的定位减少了对定位数据的例如来自血细胞变型的细胞响应影响,和/或允许更高的驱动电流,例如以实现更好的信噪比。信号发生器28产生具有超低相位噪声定时的驱动信号(例如正弦波)的高分辨率数字合成。驱动电流监控电路提供高电压、宽带宽电流源,其被监控以测量患者p的阻抗。
心脏信息控制台还可以包括至少一个数据存储装置25,用于存储各种类型记录的、测量的、感测的和/或计算的信息和数据,以及体现可从心脏信息控制台20获得的功能的程序代码。
心脏信息控制台20还可以包括用户界面(ui)系统27,其配置为输出定位、生物电势和us处理的结果。ui系统27可包括至少一个显示器27a,以2d、3d或其组合用图呈现这些结果。在一些实施例中,显示器27a可以包括3d结果的两个同时视图,其具有可独立配置的视图/相机特性,例如视图方向、变焦水平、平移位置和对象特性,例如颜色、透明度、光亮度、亮度等。ui系统27可以包括一个或多个用户输入部件,例如触摸屏、键盘和/或鼠标。
自动定向
如上所述,系统100可以使用以下的组合:在电极12a(放置在心脏内容积中,例如左心房或心脏的其他腔室中)上测量的电压、这些电极12a的测量位置,以及心脏表面的电子模型,以产生图像。系统100可包括用于确定电极12a的位置的定位系统。而且,来自超声换能器12b的信号可以与定位信息结合使用,以估计心脏表面(例如创建心脏表面的电子模型)。系统100可以包括多组(例如三组)贴片电极56,它们被放置为彼此标称正交,以产生三个定位轴:x轴(x1-x2)、y轴(y1-y2)和z轴(z1-z2),如图1所示。每组贴片电极56包括放置在身体各处的皮肤电极对。虚线示出的贴片电极56位于患者的背部。系统100可以配置为提供在贴片电极56对之间通过它们之间的分布阻抗流动的电流(例如ac电流),在空间中(例如在贴片电极56之间的患者组织中)产生可变电压分布。基于由系统100应用的波形的形态(例如幅度调制波形、相位调制波形、扫频波形和/或啁啾),这种电压可以随时间变化。使用询问解调信号和应用到贴片电极56的源之间的固定相位关系,同步解调所得的时变信号(同相和正交)。这种解调导致由贴片产生的三组信号测量(例如测量的电压)和它们沿三个轴的位置之间的一对一对应。这种配置允许在空间中定位电极12a。
定位坐标系统可以处于不同于标准(正常)生理定向的定向,换句话说,即不同于前-后、颅-尾和左-右。在一些实施例中,系统100配置为执行定位坐标系统的自动定向,其基于期望的方向定向一个或多个定位轴。这种自动定向通过以下方式实现:比较从具有相对于贴片电极56(例如身体上的ecg电极和/或系统100的其他电极)的已知定向的电极测量的定位电压与关于患者身体上的贴片电极56的实际定向(由用户放置)的信息。替代地或附加地,系统100可以配置为执行自动定向,其旋转定位坐标系统以匹配标准生理定向。确定性地定向(例如通过传递函数)定位坐标系统以匹配标准生理定向的能力是有用的,特别是当使用差分驱动定位系统时,其中测量的电压可以随着身体上或体内的参考贴片或电极的定位(位置)而变化。
系统100可以配置为根据以下步骤将一个或多个定位轴定向在期望的方向上:
在第一步骤中,以相对于定位轴的已知定向放置的两个或更多个电极之间的电压变化方向可用于建立定位轴的期望方向,如每对贴片电极56所限定的。
在一些实施例中,ecg导联放置在身体上相对于心脏的各个固定位置。这种放置给出了相对于心脏腔室的已知定向的电极集合,并且可用于建立定位轴的方向。在一些实施例中,定位x轴跨越身体的左右方向,并且两个ecg导联(例如v5和v6)定位在心脏腔室的左侧。然后,将来自这些ecg导联的电压与来自心脏容积内部或附近的电极(例如电极12a)的电压进行比较,以建立x轴的方向。
参考电极58可以定位在患者的下背部上,靠近其中一个贴片电极56,从而产生y轴(例如,靠近图1所示的y1)。参考电极58的这种放置将y轴的原点定位在下背上。参考电极58的电压可以设置为零伏(例如参考电极58接地);并且,与从放置在心脏附近的电极(例如电极12a和/或其他电极)测量的电压比较,可以建立该定位轴的定向。
在第二步骤中,系统100可以使用满足右手规则的坐标系统。这种使用对建立定位坐标系统的轴的定向提供了附加的约束。在贴片电极56之间流动的电流指示贴片电极56定向的方向,这转而建立了定位轴的方向。还可以使用电压的变化方向(例如梯度)来建立电流的方向。在以标称正交方向注入电流的三轴系统中,电压分布的主分量还指示或逼近贴片的方向定向。在一些实施例中,右手性条件与来自心脏腔室中的三个轴的电流的估计方向一起使用,以固定z轴的方向。
一旦建立了定位轴(例如,由成对的贴片电极56限定的轴)的期望定向,系统100就可以基于对贴片电极56的标称位置的认知,将定位坐标系统旋转到生理定向。在一些实施例中,y-z平面旋转大约45°以与生理定向(例如自然生理坐标系统)对准。
更高速度的偶极子密度算法
为了获得心脏信息的表面分布(例如,表面电荷密度和/或偶极子密度),系统100可以将从电极12a测量的信息映射到心房的心内膜表面。这种映射可以作为逆问题执行,并且测量点的数量(来自阵列12上48个电极12a的大约48个点)远远小于期望解法(例如,在心房表面上包括超过3000个点的解法)期望基于的点的数量。逆问题是不适定的问题,需要特殊的方法来求解。在一些实施例中,根据以下目标函数,系统100使用tikhonov正则化[1]来解决逆问题:
其中
与奇异值分解(svd)相关,矩阵a的奇异值分解是
a=u∑v(2)
其中u∈rm×m、v∈rn×n是奇异向量矩阵,∑∈rm×n是对角矩阵,对角元素为下降的奇异值。svd可以用于计算线性系统的最小二乘解的伪逆。
与最小范数估计(mne)相关,系统100可以配置为使用矩阵a的svd,使得由等式1限定的逆问题的正则化解法将是:
其中vm=v(:,1:m),∑m=∑(:,1:m)包含来自v和∑的首m个列。
在早期设计中,系统100实现了等式3的mne,通常需要大约3000毫秒(3秒)。
由于逆问题的求解方法的以下特定于ep的改进,可以实现心脏的电活动的连续映射,如本文稍后所述。
在一些实施例中,系统100配置为更有效地操作(例如,以近实时或实时计算逆问题的解法,在此为“实时”),例如通过使用截断的svd计算(例如,而不用上面的完整svd计算)和/或cpu优化的存储器分配算法。
系统100可以包括逆解算法,其包括包含calculatetikhonovinversedouble功能的c++代码,如图1所示。svd计算使用英特尔数学核心c++库(mkl)执行,这是一个高效且快速的库,尤其适用于基于英特尔的cpu。使用mkl,在系统100测量生物电势的每个时间帧计算矩阵am×n的所有奇异值。在算法的后面,可以截断奇异值的数量以寻找等式3的解法。下面提供了计算等式3的解法的算法c++函数的接口:
在早期设计中,系统100实现了用于执行svd计算的方法,如图1-1(a)所示。在步骤152中,对矩阵执行完整的svd:
a=u1s1v1t
在步骤154中,根据以下等式组合并截断所执行的计算的结果:
在步骤156中,计算转置(transpose),表示为:
在步骤158中,再次,根据以下等式对来自步骤156的结果执行另一个完整的svd计算:
然后,在步骤160中,找到了转置,其表示为:
从步骤160中的结果计算截断的tikhonov。
图1-1左侧(即图1-1(a))所示的实现方式是计算上昂贵的,并且存在性能改进的空间。由于等式3只需要m个奇异值,不需要计算a的所有奇异值,并且a的截断的svd可以在单个步骤164中直接找到(通过使用mkl,如图1-1(b)所示)。因此,图1-1(b)的方法比图1-1(a)的方法明显更有效,例如计算密集度更低。
图1-1(b)的实现使得在先前实现中的若干数学计算变得不必要,进一步增强了处理器性能。这种改进包括安全消除转置和附加的svd计算(图1-1(a)的流程图的步骤158)。换句话说,使用新的实现,不需要执行两次转置和svd计算。总之,图1-1(a)所示的流程图可以减小为直接计算奇异值的单个步骤,如图1-1(b)所示。
以下代码段表示执行如上讨论的图1-1(b)的步骤164的方法:
在这种上述改进的svd实现中,仅直接计算了等式3所需的奇异值。
如上所述,早期设计实现了等式3的mne,其导致逆解计算时间中的大约3000毫秒。在一些实施例中,系统100包括具有改进的存储器分配的算法,例如图4所示。在实验中,发现在先前的算法中,存储器分配占整个功能时间的70%,而svd占约30%。由于用于svd计算的矩阵的大小,可以通过使用acmmatrix2d类来有效且以串行方式(而不是使用gpu)计算和消除存储器分配的高成本。对于连续映射(例如,实时示出的表面电荷信息和/或偶极子密度的变化),系统100可以使用mkl存储器分配(即mkl_malloc,其针对英特尔cpu进行了优化),如图5所示。
在一些实施例中,系统100包括上文描述的改进并且以相同的准确度实现快大约40倍的性能(例如,逆解的计算时间将小于100毫秒,例如大约70毫秒)。
下面是使用acmmatrix2dc++类为svd计算a=u∑v提供改进的存储器分配的代码示例:
if(u!=null)deleteu;
u=newacmmatrix2d<double>():
u->setsize(onmainmemory,m,m,true);
if(v!=null)deletev;
v=newacmmatrix2d<double>();
v->setsize(onmainmemory,n,n,true);
if(s!=null)deletes;
s=newacmmatrix2d<double>();
s->setsize(onmainmemory,1,mindim,true);
以下代码为svd计算提供了用于有效存储器分配的改进的方法:
void*mkl_malloc(size_talloc_size,intalignment);
作为示例,以下参考文献可以提供与用于数学地解决此类问题的上述方法相关的信息:
1.a.n.tikhonov和v.y.arsenin,“解决不适定问题的解法”,数学计算,第32卷,第1320-1322页,1978年。
2.英特尔,“
使用多个篮子位置进行映射
一些实施例使用单个电极阵列12(在此也称为“篮子”)位置来计算逆映射中的传递矩阵(transfermatrix),这可以限制映射段的长度和映射的准确度。在其他实施例中,每个篮子位置可用于计算逆映射中的传递矩阵。将篮子的每个位置用于传递矩阵可以引致显著的计算成本,这会减慢映射工作流程——只能实现这些位置的子集的最小的准确度改进。在另一个实施例中,可以在算法上确定可以实现准确度的实质性改进的位置子集——例如,基于篮子的位置的相对变化。
对于多个篮子位置,监控篮子相对于篮子的先前参考位置的当前位置,并且如果篮子改变位置超过了期望的阈值,则基于篮子的当前位置更新计算中篮子的位置,如图9所示。在一个实施例中,篮子的参考位置可以是前一时间样本中的位置。在另一个实施例中,参考位置可以是在随着位置变化超过阈值而动态地更新的某个先前间隔的位置。在另一个实施例中,参考位置可以是在某个确定的时间点的位置,在整个计算过程中保持静态。这个算法提供映射准确度,同时节省处理能力,这与更快的计算相关。在1至5秒的记录中,可能存在与篮子位置(医生通常在记录期间试图保持其静止)相关的3至4mm(或更多)的不确定性。在一个实施例中,对于输入映射段,算法使用一个位置(例如第一位置)作为参考位置,然后检查位置的变化(例如,以确定是否应该调整参考位置)。例如,如果检测到1mm的位置变化,则可以对计算触发位置更新。重复这个过程,直至映射段的结尾。心内电描记图(egm)和时间与篮子位置对准,以便在逆解中计算准确的映射。在另一个实施例中,第一位置可以用作初始参考位置。当检测到触发计算中的位置更新的位置变化时,更新参考位置。在另一个实施例中,可以连续地更新参考位置,例如当获取了新位置并且将其位置与参考位置进行比较时,可以将参考位置更新为新获取的位置,以便下一次测量。
非功能性电极检测
系统100使用在电极12a(例如篮子或其他阵列配置中的至少24个电极和/或大约48个电极)的位置测量的电压,目的是记录电压组以计算心内膜表面上的偶极子密度和/或表面电荷密度。不可靠的电压测量可能有害地影响涉及定位和/或生物电势记录的任何计算,导致不良定位和/或异常的心脏信息估计。为此,系统100可以包括用于识别怀疑有异常电压测量的任何电极12a(“非功能性”电极)的自动程序。
系统100可以包括下面描述的算法:算法nfe,用于识别非功能性电极12a。nfe算法采用三种不同的策略来识别所测量的定位电势,这可能无法准确反映测量时的真实电极环境。可以在解剖重建期间执行这个程序,使得解剖记录的每个帧(例如视频帧或其他解剖图像,例如表示大约25至100毫秒的时间增量的帧)与电极12a的列表相关联,该列电极12a被确定为在与该帧相关联的数据收集期间是非功能性的。涉及定位或生物电势记录的后续计算可以访问与每个帧相关联的存储的非功能性电极12a列表,从而可以从关键计算中消除不可靠的记录。
在一些实施例中,系统100包括识别nfe算法的非功能性电极,该算法在为数字心脏模型创建和/或再创建(在此为“创建”)做出的数据记录期间(在最低程度)操作。nfe算法可以配置为处理连续数据和与超声数据交织的数据。nfe算法可以配置为在其与空间坐标关联之前评估测量的电压。nfe算法可以配置为产生非功能性电极12a列表,其不同于包含从其测量的电势不可靠的电极12a列表的每个帧。
现在参考图3,示出了方法300的细节,该方法包括用于检测非功能性电极12a的nfe算法的一系列步骤。
在第一步骤302中,加载包括i/q数据的解剖文件,例如至少一个心脏腔室的解剖文件。在第二步骤304中,系统100从i/q数据计算i/q幅度和相位。在第三步骤306中,将i/q幅度数据转换为电势数据。在步骤308中,识别来自具有异常相位的解剖结构的节点。在步骤310中,基于电势数据,按最大电压范围放缩每个轴。在步骤312中,识别具有相对于均值的异常半径的节点。在步骤314中,计算电压数据的协方差。在步骤316中,将数据旋转到协方差特征向量的基础。在步骤318中,对旋转的数据计算最佳拟合的三轴椭球。在步骤320中,识别相对于椭球表面的异常点。由此可以识别出nfe。
更具体地,nfe算法包括各个输入,例如i数据和q数据,每个都是整数阵列,大小为n乘以信道数量(numch)x3。第一维度包括样本数量,第二维度包括信道数量,第三维度包括3个定位轴频率。i/q数据(在电极12a测量的复电压)可以源自记录的文件或实时流式数据。另一个输入可以是gain_rawdatatovolts,其包括浮点(float),其限定系统100硬件的adc计数到电压转换增益。gain_rawdatatovolt的典型值可以是0.52074e-6。另一个输入可以是整数阵列refnodes_aux。阵列的内容指定可用于运动校正的辅助导管电极的指数。
非功能性电极nfe算法可包括一个或多个输出。nfe算法的输出可以是特定于每个帧的阵列,包括从其测量的电压不可靠的非功能性电极12a列表。在一些实施例中,通知用户所识别的非功能性电极列表。在一些实施例中,用户可以手动选择要移除的任何电极12a,不论所选择的电极是否是所识别的非功能性电极列表的一部分。在一些实施例中,系统100允许用户接受移除所识别的非功能性电极,这是选择加入条件。在一些实施例中,系统100允许用户接受移除所识别的非功能性电极的子集,这是部分选择加入条件,其中子集由用户输入确定。在一些实施例中,系统100推荐所识别的非功能性电极12a的子集以进行移除,其中该子集由算法确定,该算法以时间条件组(例如持续时间内功能性的占空比和/或连续持续时间)识别出已被识别为非功能性的电极12a。在一些实施例中,系统100从显示、从后续计算或两者的组合中自动移除非功能性电极12a列表。在一些实施例中,系统100从装置的位置、定向和/或形状拟合的计算中自动移除非功能性电极12a列表。
在一些实施例中,通过一个、两个或三个不同的程序来识别每个帧中不可靠的电极电压测量值,下面单独描述。
基于i/q相位异常识别异常值
每个电极12a可以与涉及三个定位轴上的定位电势的幅度和相位相关联(即,在复平面中由定位电压测量的实分量和虚分量所对应的角度)。可以在程序(例如临床程序或临床程序的一部分)开始时设置(例如调整)定位相位,使得所有起作用的电极12a表现出接近设定值的相位(例如远离0和/或pi的某处)。可以从每个电极12a的相位值计算出均值和标准偏差。表现出高于阈值的相位(例如与均值相差多于常数乘以标准偏差)的电极12a被识别为非功能性,并且加载到与当前帧相关联的非功能性电极列表中。
基于电势相对于均值识别异常值
在一些实施例中,将表现出与所选值一致的相位的电极12a的子集的电压调整为零均值,并计算沿每个定位轴的最大范围。将每个定位轴上的电极12a电势放缩到该轴上的最大范围,并计算放缩的点的半径(相对于消失的均值)。表现出大于阈值(例如特定的常数乘以平均半径)的半径的任何点被识别为异常,并加载到与当前帧相关联的非功能性电极列表中。
识别偏离最佳拟合椭球面的点
剩余的电极12a电压再次调整到零均值。数据阵列的协方差通过下式计算:
cij=pikpkj
其中重复的指数意味着,在消除上面所述的任一步骤或两个步骤中识别的非功能性电极12a之后,对剩余的电极12a的数量求和。
协方差矩阵的特征向量通过奇异值分解计算:
c=usvt
其中方阵列u的列是期望的特征向量。
电压数据变换为特征向量的基础:
p′k=uklpl
其中pl是与特定电极12a相关的3-d电势。
相对于正交基准表示放缩的电压,将数据拟合到具有与基向量对准的半长轴的广义三轴椭球:
a、b和c是分别沿着三个坐标方向的半长轴。拟合可以通过显式lls方法或通过使用奇异值分解(svd)计算伪逆来执行。
定义了半长轴,与特定电极k相关联的三个电势组各自可以分配有误差:
计算平均误差,并且将表现出大于阈值(例如特定的常数乘以平均误差)的误差的任何点识别为非功能性电极,并将其加载到与当前帧相关联的非功能性电极列表中。
由上述三个步骤中的一个或多个(例如全部)识别的非功能性电极12a的级联包括与当前帧相关联的非功能性电极12a的列表,这些电极表现出被认为对于包括在场估计(例如用于定位)或心脏信息(例如偶极子密度和/或表面电荷密度)计算是不可靠的电压。
递归识别
在识别非功能性电极或“坏”电极(关于定位电势)和计算局部场估计/放缩矩阵之后,定位所有电极12a(包括那些被识别为非功能性的)和与标准篮子(例如电极12a的阵列的几何形状)限定对准允许随后对电极与相应的“标准”位置分离的评估。被识别为非功能性的电极12a实际上仍然可以靠近相应的“标准”位置定位。可以从非功能性电极12a列表中去除这种“好”电极12a,从而提供最大数量的用于计算例如场估计和/或辅助电极定位的电极。
图10是示出了重新分类非功能性电极或“坏”电极以用于计算心脏活动的步骤的一个示例的流程图。步骤1包括使用多电极导管(例如导管10)记录定位和生物电势数据。步骤2使用上面讨论的用于确定好/坏的标准(第一标准)来过滤非功能性电极或“坏”电极的数据。在一些实施例中,第一标准偏向于将电极识别为坏的。然后,步骤3使用第二标准过滤所识别的非功能性电极或“坏”电极,确定是否可以再次将“坏”电极重新分类为“好”。在一些实施例中,第二标准偏向于将电极识别为坏的。如果将一些非功能性电极或“坏”电极重新分类为“好”,则使用来自“好”电极的最终组的数据来计算心脏活动数据。在一个实施例中,将所识别的非功能性电极过滤以再次重新分类为“好”的步骤3可以通过以下方式执行:a)将所识别的非功能性电极的(一个或多个)测试子集替换到“好”分类中,b)确定测试子集中的电极对篮子位置的误差的贡献,c)对测试子集中包括的电极的所有排列/组合(或子集)重复步骤(a)和(b)。例如,可以通过递归方法执行所述重复。返回到“好”分类的最终电极组可以通过比较方法确定,例如,总误差贡献低于阈值的最大测试子集,或者所有测试子集中具有最低误差贡献的测试子集。测试子集中的电极对篮子位置中的误差的贡献可以例如通过以下方式确定:将具有和不具有测试子集中的电极的篮子位置变化量化为平移、旋转、一般仿射变换,或两个篮子位置中的匹配电极之间的成对距离的总和、均值和/或rms(例如电极12a位置的阵列)。确定误差的篮子位置可以是原始的、局部的电极位置或来自几何拟合(例如svd拟合)的电极位置。
adc卡开/关
在一些实施例中,系统100包括子系统,其在某些条件下关闭adc24,例如以提高系统效率或重置数据流以清除数据存库,例如缓冲器、滤波器或存储器。例如,系统100可以配置为关闭adc24以减少负载,从而减少进入处理器26或系统100的其他组件的数据吞吐量。在一些实施例中,系统100配置为在计算逆解以从电压数据确定偶极子密度和/或表面电荷密度时关闭adc24。在一些实施例中,系统100配置为每当退出采集模式时关闭adc24,例如从电极12a和/或超声换能器12b收集(例如主动收集)数据的模式。系统100可以配置为自动地、基于用户输入或两者的组合关闭adc24。在一些实施例中,系统100配置为关闭adc24,并且在一段时间后自动开启adc24,作为重置功能。重置可以基于时间自动(周期性),基于检测的输入自动(触发),或基于用户输入手动。在一些实施例中,与adc24并联或串联的过程(例如滤波、缓冲、消隐算法、交织等)可以配置为以适当的顺序被禁止,以最小化由adc24的瞬态变化引起的伪影,例如从关闭状态开启,或从开启状态关闭。在一些实施例中,在adc24已被重置之后,被禁止以最小化伪影的过程可以自动返回其在adc24重置之前的操作状态。
v-wave去除(vwr)
系统100可以配置为至少部分地移除可以施加在感兴趣的心房信号上的心室远场信号(v波)(例如以评估心律失常,例如心房扑动和/或心房颤动)。例如,系统100可以包括算法(vwr算法),其配置为识别和移除由于心室激动而引起的心内电描记图(egm)的分量。vwr算法可以采用分析来自电极12a和用户输入的记录的过程。可以从egm中显著减去心室远场信号(v波),同时良好地保持心房活动。
在至少一些信号滤波之后,vwr算法可以(在最低程度)对记录的数据进行操作。vwr算法可以假设用户在egm上选择了对应于v波的适当段。vwr算法可以假设v波在整个记录中是一致的。
参考图4,示出了框图,其详细描述了v波去除(vwr)算法所需的方法400的整个步骤顺序。
vwr算法可以包括一个或多个输入。vwr算法的输入可以包括数据记录的egm,例如包括心房活动和心室分量的egm。vwr算法的输入可以包括开始和结束样本号,其可以表示一个心室段,并且可以为egm中的v波限定用户选择的心室示例。
vwr算法可以包括一个或多个输出。vwr算法的输出可以包括输入egm中的估计的v分量。vwr算法的输出可以包括减去了v波的egm。
v波去除(vwr)算法可以配置为滤波器或伪滤波器(在此为“滤波器”)和/或包括滤波器。开始和结束样本点可以是这个过滤器的输入参数。过滤器可用于去除egm中的心室分量。
在一些实施例中,vwr算法包括三个步骤:1)自动识别v波段,步骤402和404;2)创建v波模板(例如,特定于信道的v波模板),步骤406和408;以及3)从egm中减去v波,并平滑边界,步骤410。
例如,参考图4,在第一步骤402中,系统(例如处理器10)自动选择峰值作为基准时间点和分段间隔。在步骤404中,系统计算样本v段和所选择v段之间的互相关值(“cc值”),cc<0.9的v段被拒绝。在步骤406中,平均所有v段以生成v模板。在步骤408中,系统对准v模板,并根据时滞调整时移。而且,在步骤410中,系统平滑v模板的边界以创建平滑的事务和避免突然跳转(jump)。
在一些用于心内电描记图(egm)的基于模板的v波去除算法中,具有与心室信号相当的幅度的大心房信号可以导致将一些心房信号检测为心室段,这可以导致去除或改变期望用于映射的心房信号。通过使用egm和ecg的同时记录,可以识别通过峰值检测的来自表面ecg信道的心室定时。由于心房与心室信号的比例辐度较小(与心内ecm相比,通常在ecg中可见),ecg信道可以优选作为心室定时选择的辅助参考。然后,将从ecg信道检测到的峰值用作定时参考以保留来自egm的定时(例如,定时差<=50ms)。然后保留与心室活动相关的定时,然后从进一步的心室模板生成和减法中移除与心房活动相关的定时。
图11a和11b示出了v波去除(vwr)的两个示例。在每个图中,从显示大心房信号的ecg导联收集顶部迹线,中间迹线是系统100的电描记图,底部迹线是去除了v波的电描记图。在这些示例中,v波和随后的高通滤波器伪影被选择去除。
v波段识别
为了从egm中去除v波信号,初始步骤是识别包括v波分量的段。由于在生物电势信道上测量的v波(例如电极12a上的电压测量)具有一致的波形和幅度,因此可以通过在每个时间点平均所有信道来计算bct电压(电极12a阵列的几何中心的估计电压)。然后,bct中的峰值可以用作v波的基准时间点。
然后,用户特定的v波样本可用于查找v波段。v波样本中的峰值可以与基准时间点对准。可以计算基准点的段和v波样本之间的最大互相关。然后可以根据最大互相关产生的时滞来调整初始对准。然后可以将egm中的对准段标记为v波段。
创建特定于信道的v波模板
一旦在48个信道中识别了v段,特定于信道的v波模板可以通过对准该通道内的v段和取其平均值来创建。图4-1中的曲线“a”示出了单个信道的v波模板的示例。
图4-1中的曲线“b”示出了去除v波之后的egm的一个示例。心室远场信号降低至80%。心房活动和基线得以保留。
减去v波并平滑边界
一旦创建了特定于信道的v波模板,就从egm中的v波段减去来自v波模板的数据。然而,在v波模板的开始和结束点,来自v段的信号中可以存在“跳转”。这种现象的示例参见图4-2。汉宁(hanning)窗口可以用于平滑边界,例如图4-3中所示。
v波消隐或归零
在其他实施例中,可以使用egm中的v波的消隐或归零来代替v波的减法,使得从信号中去除任何心室贡献,接受心房信号的同时丢失。在一些实施例中,可以手动选择(例如使用屏幕上的“卡尺”(caliper)进行的选择)和/或使用基于模板的检测方法(例如,系统100使用信号模板自动检测v波)选择包含v波数据的信号段。可以通过将段中的所有值设置为设置值(例如零)和/或通过跨越段持续时间的内插(interpolation)(例如,就在所选择时间段之前或之后的数据值之间的线性内插)来消隐或“归零”该段。在段的开始和结束样本或其附近的边界的平滑化可用于最小化来自与其他滤波器交互的过渡伪影。
具有减小的基线偏移的v波消隐或归零
在一些实施例中,使用原始信号(例如在应用诸如高通滤波器(hpf)的滤波器之前)执行egm中的v波的消隐或归零。如上所述,在应用hpf后执行的v波归零可导致形态样伪影和/或心房基线的偏移,这是由于hpf处理中包含大且不平衡的信号(例如v波)。
替代地,在应用hpf之前执行的v波归零可以通过在hpf的应用和处理之前去除大且不平衡的信号(例如v波)来防止心房基线的偏移。在一些实施例中,在应用hpf之前v波归零的内插匹配任何低频分量的斜率和曲率(例如呼吸或漂移)。
传播历史图像的激活检测
图12是心脏激活数据的视图的显示的实施例。在右侧视图中,从第一视角示出心脏,其中示出了各个激活带。最外面的带是激活的节点带。随后的带代表最近激活的状态。激活状态涉及由覆盖在egm上的滑动窗口所指示的时间,其具有水平时间轴。滑动窗口的宽度反映了50ms的窗口宽度,称为“传播历史”。在左侧视图中,示出了相同心脏的不同视角。该视图显示激活波已经在心脏周围传播。可以在显示中提供各种用户交互装置,用于操纵心脏的3d图像,例如旋转图像,向图像添加标签等。
在各种实施例中,心脏信息动态显示系统可以包括视频显示控制工具,其允许用户播放、重放、倒带、快进、暂停和/或控制在心脏上传播的动态激活波的回放速度。
激活时间的自动注释对于产生传播历史图像是至关重要的。然而,虚拟egm中的噪声可能在传播历史图像中引入伪影,这不仅会引起视觉噪声,还会导致较不准确的激活检测。
用于传播历史图像的中值滤波器
可以将中值滤波器应用于传播历史图像。对于心脏解剖结构中的每个节点,将传播历史值更新为节点及其相邻节点的原始传播历史值的中值。这些相邻节点被限定为正在更新的节点的特定距离内的节点。随着这个距离增加,噪声去除更多,但局部传播历史细节越少。为了进一步滤波,可以将中值滤波器多次应用于传播历史图像。
使用中值滤波器对传播历史进行后处理的一个基本原理是传播历史图像可被认为是一连串图像。传播历史中的噪声最类似于在图像处理中通常被参考的“椒盐噪声”(saltandpeppernoise)。传统低通滤波器(模糊滤波器)很难在不在图像中导致其他伪影(例如失真边界)的情况下去除椒盐噪声。中值滤波器可以去除椒盐噪声,同时保持清晰的边界(见图13)。
图13示出应用于传播历史图像的中值滤波器的一些示例。a)传播历史图像的原始帧。b)中值滤波器已应用于a)中的传播历史,使得与a)相比减少了许多伪影。c)第二中值滤波器应用于b)中的图像,与a)和c)相比导致更少的伪影。
假阳性激活去除
激活时间的自动注释对于产生传播历史图像是至关重要的。然而,虚拟egm中的噪声可能引入假激活,这可能导致传播历史图像的不正确解释。
在一些实施例中,使用算法通过在潜在激活周围的时间窗口中检查电描记图的幅度来检测来自真实激活的噪声。如果电描记图超过幅度阈值,则潜在激活被称为真实激活。潜在激活周围的时间窗口的这种大小不仅作为严格的幅度阈值,而且还充当最小斜率阈值。较大的时间窗口允许显示较低的倾斜激活(例如在慢去极化组织中发现的那些),而激活周围的较小时间窗口将发现更快的去极化组织区域。
图14示出了假阳性激活注释去除的一个示例性实现。a)示为绿色的最初检测到的激活。b)从激活去除假阳性的示例在a)中圈出。在时间窗口内,检查电描记图的幅度。由于此激活不满足幅度阈值,因此在c)中将其移除。c)在假阳性去除后自动检测到的激活。来自a)的低幅度/斜率的激活被去除。
配准处理
在一些实施例中,系统100包括配准处理子系统(例如算法)以将电场测量(电压测量)与位置相关联,并且在整个程序中保持已定位心内装置与ui上显示的重建的心脏表面之间的坐标配准,适应有意和无意的变化条件,例如:功率丢失、系统硬件或软件重启、定位源输出的变化,和/或体内定位场分布的变化。系统100的定位系统对获取和分析心脏信息起重要作用,例如引导消融导管和/或提供用于映射和其他感测导管的准确位置信息。定位的最后一步是从其定位电压读数计算电极或其他导管部件的坐标。输入和输出如下限定:
导管组件坐标(x,y,z)=f(导管定位电压(vx,vy,vz)),
其中f是从电压空间到坐标空间映射的函数。
电压空间和坐标空间之间的映射函数f(配准)由以下因素限定:
1.定位系统,例如如申请人在2015年5月13日提交的题为“用于获取和分析心脏信息的定位系统和方法”的共同待审的美国临时申请62,161,213号所述,其内容整体并入本文作所有用途,
2.患者。
由于函数f在不同条件下(例如不同参考电极56位置、不同患者解剖结构等)不同,因此它不能是系统100的静态部分。结果,必须动态地确定函数f,并且适当地将其保存,以便于患者治疗和潜在的程序后分析。
在一些实施例中,电压至位置的映射函数f如下配置。
1.函数f包含将电压转换为坐标的信息,包括但不限于:
a.使用中的导管(例如类型或模式)、系统输入通道列表和所排除的信道的列表(例如,如本文所述具有非功能性电极12a的信道)。
b.电压和坐标之间的放缩变换
c.可选地,从系统输入信道组(例如电极、贴片等)测量或计算的位置或坐标参考,包括系统输入信道列表、所排除的信道的列表和原始或初始电压。
2.配准数据的存库
a.配准数据的主要副本与相应的解剖3d模型一起保存。
b.配准数据的辅助副本与每个记录一起保存,包含:
i.来自主要副本的内容
ii.在获取主要副本之后的更新,例如导管不同的排除的信道和位置参考信息
3.配准搜索路径
当需要配准数据来计算时,不论是用于后分析或实时引导消融导管,心脏信息算法(例如,如本文所述的偶极子密度和/或表面电荷密度算法)将在跟从以下路径搜索正确的配准:
辅助副本
如果未找到相应的辅助副本,则搜索主要副本。
如果未找到主要副本,则向用户显示警告消息并使用默认配置。
4.独立配准配置的对齐
当独立的主要配置和独立的辅助配置不匹配时,例如当将不适当的解剖结构分配给分析记录时,心脏信息算法将执行配准校正以使辅助配置与主要配置对齐,或反之亦然,例如两个配置的所得坐标系统是统一的,并可以在同一坐标空间中使用。
5.配准变更的检测和校正
在变化条件下,例如功率丢失、系统硬件或软件重启、定位源输出的变化,和/或体内定位场分布的变化等,配准处理子系统可以检测该变化、通知用户、自动重新加载先前的设置、自动执行与在更改前的配置一致的状态的校正,或其任何组合。在一些实施例中,自动校正可包括来自身体内的电极和/或传感器(例如心内电极)和/或身体表面上或附近(例如定位源贴片或ecg电极)的测量。
位置或坐标参考
作为配准的分量,可以使用所测量输入组来稳定、减少或消除定位系统不期望的、时变的变化。这些可以包括由于呼吸或心脏运动引起的周期性变化、由于在定位场(特别是具有低输入阻抗)内引入、移除和/或操纵装置而引起的离散变化,和/或与生理或临床现象(例如患者出汗、输注盐水、体表贴片或电极的粘合层、电凝胶和/或水凝胶与皮肤的相互作用)相关的缓慢变化。测量的输入可以:
1.直接用于使用减法抵消时变变化,以消除共模信号分量
2.与权重(或线性模型)一起使用,其中权重由以下各项确定:
a.分析模型,例如来自场理论或主分量分析
b.数据组的经验推导,用于训练动态算法
c.滤波
d.a、b和/或c的组合
3.与基于较高阶函数的模型一起使用,可能是非线性模型
4.与几何变换(例如仿射变换)或几何最小化拟合方法一起使用
输入可以完全由身体内部的电极组成,或者输入可以完全由体表贴片和电极组成,或者这些的组合。
当测量的输入偏离定量模型或偏离预期输出时,阈值可用于触发对ui的用户消息或警告。
在一些实施例中,系统100包括物理位置参考,其包括装置(例如,包括至少一个电极的装置),其定位在“感兴趣区域”(例如,要补偿漂移和/或其他运动伪影的区域,例如心脏腔室附近和/或心脏腔室内)附近的坐标系统内的固定位置。该装置可以定位在解剖结构的一部分中,使得它不可能相对于感兴趣的区域移动,例如当定位在冠状窦中时。然后假设装置的位置相对于感兴趣的区域是静止的(例如,通过定位处理器46),并且确定装置的任何运动都是由运动伪影引起的。从相对于感兴趣区域内的所有其他装置收集的位置数据(例如定位数据)中去除这些运动伪影。运动伪影可能由以下原因引起:呼吸;心脏运动;定位贴片吸收了汗液;程序期间贴片粘贴的退化;程序期间输送的盐水;身体传导的变化;将一种或多种导电和/或绝缘材料引入患者体内(例如附加的导管);将连接到低阻抗接地源的一个或多个装置引入患者体内;以及这些中的一个或多个的组合。
替代地或附加地,系统100可以包括“虚拟坐标”参考,在本文中也称为“虚拟位置”参考。系统100可以配置为“学习”(或被“训练”)以提供虚拟位置参考,如下文所述。可以使用由位于患者上的外部电极(例如本文所述的表面贴片x1、x2、y1、y2、z1、z2和/或58,和/或任何其他类似的放置在皮肤上的贴片)记录的“伪影校准信号”,从身体表面测量定位系统上的生理和/或环境影响(例如呼吸的影响或其他产生伪影的运动影响)。可以在向一个或多个外部电极提供驱动信号(例如由定位信号发生器28提供的驱动信号)和/或驱动信号在一个或多个外部电极之间时记录伪影校准信号。系统100可以被训练为(作为校准或“训练”程序的一部分)识别这些影响,使得在患者体内不需要物理位置参考,而是使用由外部电极测量的信号来计算虚拟位置参考。为了训练系统100,物理训练装置(例如装置10、系统100的消融导管和/或任何含有电极的导管)被定位在患者体内靠近感兴趣区域,并保持静止,并且使用系统100定位物理训练装置,如本文所述。通常与物理训练装置的运动相关的定位信号(例如,由定位处理器46)假设为由定位系统的一个或多个伪影引起(即,因为物理训练装置保持静止)。在该定位期间,外部电极同时记录伪影校准信号。然后将所记录的定位信号与同时记录的伪影校准信号相关联,并且进行数学处理以建立定位系统与外部电极所记录的伪影校准信号之间的代表关系。代表关系可以包括要应用于定位场内的所有装置的变换(例如变换成为虚拟位置参考)。数学处理可以包括:拟合方法;一系列加权系数;线性系统;机器学习;自适应拟合和/或滤波方法;主分量;滤波(例如低通和/或高通滤波);其他数学方法;和/或这些中一个或多个的组合。
在训练之后,可以移除(或重新利用,例如如果系统100的导管10用作物理训练装置)物理训练装置,并且系统100可以使用变换(例如以通过消除运动伪影和其他生理和/或环境影响而改进的精确度)来有效地定位场内的装置。在一些实施例中,可以手动和/或自动重复训练以确认和/或更新变换。例如,系统100可以周期性地执行诊断(例如通过使用一个或多个算法)以确定用户是否正在移动位于患者体内的任何电极或装置,如果不是的话,则可以开始如上所述的系统100的训练(例如在背景进行)。一旦完成训练,就可以将新产生的数学变换与先前的变换进行比较。如果变换不同,则可以使用新计算的变换更新。在一些实施例中,使用了缓冲器来存储历史数据,从而在较长的时间段内处理数据(例如,可以基于累积训练随时间调整变换)。
手动配准
用于稳定、减少或消除定位系统不期望的时变变化的建模和自动补偿可导致具有静态或恒定分量的残余偏移/误差。可以通过为每个坐标轴分配恒定值(即恒定矢量)来应用整体补偿或残差的任何恒定分量。这个恒定矢量可以通过用户与用户界面和系统显示器的交互来确定以用于手动校准。系统显示器可以显示与坐标系统中的位置稳定或固定的对象(例如心脏腔室表面、模型和/或点集)相关的所定位装置的一个或多个视图。
用户与输入装置(例如鼠标、键盘和/或触模屏)的交互可以启动允许所定位装置相于固定对象的位移的模式。该模式的启动可以通过按键、按钮和/或其他命令并入工作流程中,或者可以是具有不同进入和退出模式的单独窗口或界面。
所定位装置相对于固定对象的位移可以在记录的数据上执行,或者可以应用于实时流式数据,使得所定位装置受其在体内的应用或施加的运动支配而继续移动,将用户所施加的位移加至计算的坐标位置,这基于映射函数f,如上所述,或者任何其他配准分量。
在一些实施例中,位移仅应用于显示器的视觉引擎,并且必须在应用于映射函数f或任何其他定位引擎计算之前由用户确认。对映射函数f的应用可以是临时的,或者可以永久保持,或者直到另行修改。
用户与系统的交互可以通过在交互时间或接近交互时间获取的表面信息数据组在视觉上或图形上引导。所获取的表面信息数据组可以由与表面接触的传感器或电子器件提供,和/或它可以由非接触式传感器或传感器组提供。非接触式传感器或传感器组可以是光学传感器、超声换能器和/或其他测距或成像模态。所获取的表面信息的同时视觉或图形显示可以用于帮助确定要通过对准两个表面或对象来应用的位移。在一些实施例中,成像模态可以是超声表面反射。在一个实施例中,可以显示超声矢量组,长度等于到表面的范围。然后,矢量的端点可以与固定对象(例如心脏腔室模型、表面和/或点集)对准。在另一个实施例中,新表面可以部分地或全部地重建,并且可以用于确定要通过将对准新表面与固定对象或心脏腔室表面、模型和/或点集来应用的位移。
自动或辅助成像介导的配准
所获取的表面信息数据组与固定对象(例如心脏腔室或表面)的对准可以基于算法来执行。算法可以包括距离、角度和/或其他成本函数或几何量的最小化。可以对点、矢量、线、平面和/或其他几何结构执行最小化。算法可以是分析的和/或迭代的。算法还可以包括仿射变换的计算,以修改所获取的表面信息数据组的位置、形状、放缩和/或其他几何特性,以改进对准。所修改的几何特性可以包括所有仿射变换或限于一个或两个。在一些迭代实施例中,使用用于中断迭代的标准(退出条件)。标准可以包括误差、最小误差、最大误差、均方误差、均方根误差、聚合误差、总误差和/或成本函数的其他条件。在一些实施例中,最小化技术可以使用迭代最近点算法。
在一个实施例中,对准算法使用来自多方向非接触测量方法(例如超声测距)的新获取的点集,其可被变换以最佳地匹配固定参考对象(例如心脏腔室表面、模型或点集)。变换可以仅限于平移。新获取的点可以直接与最初获取的点集进行比较。替代地,新获取的点可以用于计算代表性表面并与最初获取的点集比较,或者最初获取的点集可以用于计算代表性表面并与新获取的点集比较,或者新获取和最初获取的点都可以用于计算要比较的两个代表性表面。
使用场估计定位
在一些实施例中,系统100包括改进的场估计(ife)算法。使用电阻抗技术在体腔或腔室内定位装置或装置的部件需要准确且精确理解腔室内所有点的电场。装置的定位可以使用以下方法或部分或全部地与在2016年5月13日提交的题为“用于获取和分析心脏信息的定位系统和方法”的国际pct专利申请pct/us2016/032420号所述的方法组合执行,该申请通过参考方式并入本文。考虑到场的非均匀性的可能性,必须知道任何一对点之间的空间中场的(相对)方向和幅度,从而通过场梯度的集成来获得(相对)位置。在一些实施例中,系统100包括增强的场鉴定,用于如下所述的导管定位。
定位导管的第一步可以是鉴定感兴趣的心脏腔室内的电场。导管10可以与控制台20共同配置为在球形表面(例如直径约为1英寸的球形表面)上的多个空间上不同的位置(例如电极12a的位置,例如48个电极12a)检测多个ac电场(例如沿着三个相互垂直或几乎垂直的方向定向并且通过频率区分的三个场)。在每个电极12a获得电压样本后,在每个已知频率下,可以使用最小二乘法和/或其他误差最小化技术来计算电场相对于阵列12的已知几何形状的方向、幅度和梯度。随着阵列12在体腔或腔室中移动,获得在每个电极12a相对于阵列12几何形状的电场记录。由于未知阵列12的定向,可以通过沿着连接每个电极12a与原点的路径的空间变化场的积分,获得相对于任意选择的原点的先验(priori)阵列12位置和定向。
作为示例,以下参考文献可以提供与用于数学解决此类问题的上述方法有关的信息:
1.kabsch,wolfgang,(1976)“联系两组矢量的最佳旋转的解法”,actacrystallographica32:922(在kabsch,wolfgang(1978)“关于联系两组矢量的最佳旋转的解法的讨论”,actacrystallographica,″a34″,827-828进行了修正)
在一些实施例中,ife算法处理在解剖/几何获取期间记录的数据。在一些实施例中,ife算法能够处理连续数据和与超声数据交织的数据。在一些实施例中,ife算法利用位置参考来校正共模误差源,例如在呼吸(机械/阻抗)和/或心脏运动期间发生的那些。位置参考可以是单独的导管,其在不被操纵时与阵列12同步(共模)移动。
在一些实施例中,ife算法不需要辅助内部装置作为位置参考。在一些实施例中,执行阵列12位置的计算,而不需要固定形状的阵列12。
参考图5,示出了框图,详述了ife算法的方法的实施例。框图包括关于超声和/或表面重建的部分,并且描述流控制、场估计和辅助定位。
ife算法包括一个或多个输入。例如,i数据和q数据是整数阵列,大小为nx信道数量(numch)x3。第一维度n是样本数量,第二维度是信通数量,第三维度对应于3个定位轴频率。i/q数据可以源自所记录的文件和/或实时流式数据。ife算法可以包拾输入gain_rawdatatovolts,其是浮点,限定了系统硬件的adc24计数到电压转换增益。在一些实施例中,gain_rawdatatovolts包括大约0.52074e-6的值。ife算法可以包括输入stdbskdata,这是大小为电极12a数量(例如48)x3的阵列。这些值将是阵列12的电极12a的标准(例如弹性偏置)xyz位置。这些值用于执行拟合和场计算。ife算法还可以包括输入refnodes_aux,这是整数阵列。refnodes_aux的内容指定可用于运动校正的辅助导管电极的指数。
ife算法包括一个或多个输出。ife算法的输出是系统100中所有连接的电极的坐标和与每个阵列12矩心(centroid)位置相关联的场估计(以放缩矩阵的形式)。坐标作为nx3浮点阵列给出,而放缩矩阵是与解剖/几何记录的每个系相关联的9个元素阵列。
在一些实施例中,ife算法配置如下。
场鉴定和篮子矩心的定位
识别原点系。这种识别可以作为解剖/几何构造数据记录的第一系。在从局部系变换之后,所有矩心和辅助位置矢量都涉及这个参考系。原点系中的基向量由阵列12上的电极12a的标准(例如偏置)位置测量值所限定。
在每个矩心位置的场鉴定(场强度/定向的确定):
计算每个矩心位置的空间场梯度(即,随电势变化的位置变化率)。局部参考系中的每个坐标维度(x,y,z)将随着每个源电势变化,产生放缩因子的3x3阵列。该矩阵是附加到特定矩心的标准阵列12参考系中从电压到位置的转换:
通过将标准阵列12参考系中电极12对之间的位置矢量表示为相同两个电极之间的三个所测量电压的差的线性函数来计算放缩矩阵:
其中下标“i”和“j”表示阵列12上的电极12a位置。每个指数在所有电极12a(例如48个电极)上运行,除了如本文所述由非功能性电极算法识别为不可用的任何电极之外。这是针对每个电极12a可能对而执行的:
其中“del”表示相对于三个源电势中的每一个的位置微分,dx表示(在这种情况下)x坐标差的矢量。在理想情况下,我们获得了用于每个坐标轴上的三个导数项的numchan2等式(其中numchan等于电极12a的数量)。在最小二乘意义上对所得的超定系统求解,以计算由电子器件12a在三个维度的已知位置和电势限定的9个“平均”放缩因子。使用奇异值分解a=usvt,并且沿每个坐标轴的导数由以下式给出:
注意,矩阵a在三个坐标轴上是相同的,因此奇异值分解仅需要执行一次。除非忽略了大量共同定位的电极(例如,如果消除了来自阵列12的2或3个相邻样条的所有电极),则获得稳健的放缩因子。
由放缩矩阵对电压值组进行矩阵乘法,产生了相对于局部参考系的原点在物理空间中的位置:
将9元素放缩矩阵的列识别为通过沿着相应源电压的梯度移动而获得的矢量(例如,第一列是与x源电压的梯度相切的矢量)。场线不限于均匀或正交,并且场的完整描述将需要知道空间中每个点的放缩矩阵。
系统100可以配置为执行以下步骤。
使用局部放缩矩阵重建与局部坐标中的每个矩心相关联的阵列12电极12a位置。局部坐标由标准阵列12中的电极12a的位置(例如弹性偏置位置)再次限定。注意,在不知道相对于某个外部参考系的电场矢量的情况下,每个局部参考系的定向是未知的。
识别在电压空间中到达原点系的路径。沿着该路径移动,找出最接近所识别的原点路径的矩心位置(在电压空间中)。这组矩心(包括目标和原点)构成了到达原点的实际分段连续路径的集成。(见图6)
使用与最接近原点的矩心(例如段1的矩心1)相关联的放缩因子计算集成路径上相邻矩心之间的距离(图6中的段1至4)。每个距离都是在较接近原点的矩心的参考系中表示的位置矢量(如图6所示)。原点系中的目标矩心的位置是集成路径上的相邻矩心之间的距离的矢量和,但是这些距离必须首先在一致的参考系(即原点系)中表示。因此,必须将沿着集成路径的每个距离间隔变换成原点系。
为了确定每个矩心和原点系之间的坐标变换,系统100构造沿着集成路径的每对相邻矩心之间的一系列变换。这组沿着集成路径的变换的积(product)是原点系的所需变换。
参考图7,为了将最远的位置矢量(即目标系和系1之间的分离)变换回原点系,我们首先要找到系1和系2之间的变换。
该变换通过比较该两个系中的阵列12来获得,其利用更近的系(在此示例中为系2)的放缩矩阵重建。系统100使用与更近的系(系2)相关联的放缩矩阵重建更远的系(例如系1)中的阵列12。然后,系统100使用kabsch算法来对准两个阵列12(即,与系2相关联的阵列12,以及使用在系2的放缩矩阵重建的系1的阵列12)。所得的变换将坐标从更远的系(1)传递到更近的系(2)。系统100使用通过如上所述对准相邻阵列12而获得的一系列变换,将每个距离间隔(矩心之间)变换回原点系。然后,系统100为下一个最远的位置矢量(段2,再次参见图6)重复程序。变换的距离间隔组的矢量和是原点参考系中目标矩心的位置。使用唯一识别的原点路径和通过在相邻矩心之间应用kabsch算法获得的相关联的坐标变换组,对每个矩心重复这个过程。
因此,对于每个目标系,系统100获得变换组,其在应用于利用与目标矩心相关联的局部放缩因子获得的位置矢量时,送还原点参考系中的位置矢量:
其中,例如,[t1,2]表示从参考系1到参考系2的正交(即长度保持)变换等。
再次参考图6,净效果是将位置矢量1变换成原点系。与类似地变换的位置矢量2至4组合,该(矢量)和是原点坐标系统中目标系的位置。
通过比较电场矢量(原点系中放缩矩阵的列)与原点系中的基向量,获取原点系相对于全局坐标的定向,其例如由电势激励轴(即参考电极58参考系)限定。如果
其中“i”和“j”是矢量指数(与为了定位目标矩心而识别沿着集成路径的矩心的变换中的下标1、2等无关)。注意,两个矢量必须在欧几里得参考系中给出,以便限定内积。
虽然原点系中的电场矢量是已知的(作为放缩矩阵的列),但实际上,电场矢量可以逼近为原点系中阵列12电压的协方差的特征矢量。这些矢量在原点参考系中是已知的,并且上述变换适用。这方法的优点在于协方差矩阵的特征矢量是正交的,并且不需要后续的正交化。
还获得了变换成例如ap参考系的附加变换。
鉴定了场(例如每个矩心位置已知的9元素放缩矩阵)和限定了位置矢量从每个矩心(目标系)到原点系的变换后,所鉴定场附近的任何电极的位置如下获得(见图7)。
识别在电压空间中“接近”目标电极的矩心的子集。较大数量的矩心不一定能保证更准确的定位,例如因为以下原因:电压空间中的分离增加可能导致电场鉴定的保真度降低(即,在矩心的场可能不代表在电极位置的场)。
对于每个所识别的矩心,来自平均篮子位置(即阵列12位置)的电势偏移乘以局部放缩矩阵,以获得在局部坐标中相对于该矩心的位置矢量。
如上所述(参考图6)和在每种情况下通过从目标系变换成系1来增强的变换成原点系的一系列变换提供了电极位置从目标系变换成原点系的变换。然后,电极位置是矩心位置和局部偏移之和的平均值(在参考原点系中表示):
在所有识别的矩心上的上述量的平均值是原点系中电极的估计位置。
注意,感兴趣的容积中的场的非均匀性可以使得位置估计的误差增加,因为与场被良好地鉴定的容积的距离增加。
还可以获得变换成贴片或ap系的变换。
上述增强的定位技术的体内应用已经显示了在静止环境(即可以保持位置稳定的环境)中约1mm的准确度。
具有改进的分辨率和空间维度的场鉴定
在上述用于场鉴定和篮子矩心定位的方法中,定位场的估计利用了从具有已知几何形状的装置测量的时空相关的电势组。在已知几何形状的矩心的场估计代表了该已知几何形状的内部容积的稳定性和准备性。定位场可以在阻抗变化边界或其附近变化,例如靠近心内膜表面或连接解剖结构的孔口(ostia),例如静脉、瓣膜和心耳(appendage)等。在已知几何形状的矩心场估计可以限制实现场估计的完全准确度的空间维度。已知几何形状的矩心的最远位置与已知几何形状的装置的可导航容积之间的区间区域中的定位场可以通过电极子集直接对该区域采样来鉴定,而不是通过测量装置的完整代表性容积。
为了以高分辨率估计区间区域中的局部场变化,还可以通过将来自测量装置的场采样数据的空间和时间相关性去耦来实现场估计。在一些实施例中,可以放宽(例如电极阵列12的)已知几何形状的几何约束,例如装置的电极对的所有排列之间的全距离矩阵,以有利于更精细的采取分辨率。
在一个实施例中,这种局部场变化的估计可以通过仅使用相邻电极对之间的已知距离来实现。对于单独的电极对,仅在电极之间的距离矢量的方向上对场变化进行采样,并且不确定性或误差随着所采样的矢量和场变化方向之间的角度而增加。可以通过消除所采样的数据的时间相关性,并且随着时间聚合穿过有限容积的空间的多个电极对(以及因此多个所采样的矢量)的场采样数据,从而减少方向依赖性。可以通过将坐标系统划分为三维体素组来构成有限容积的空间。在一段时间内,可以将离散电极对的采样定位场电势“分箱”(bin)(例如分组为“箱”)为体素组。在一些实施例中,可以使用简化一般定位方法来确定所述分箱,例如上面描述为场鉴定和篮子矩心定位的方法。可以改变箱的大小以包围来自电极对的统计上显著的电势样本组。箱内的采样矢量组限定了局部场的估计。这种估计可以通过将svd应用于将空间场梯度关联到采样矢量的空间和电势幅度和方向相关联的等式组来确定。图18a示出了一个示例。
在另一个实施例中,可以随着时间聚合来自穿过定位场内的有限容积的空间的任何单独电极的采样电势。再次,可以通过将坐标系统划分为三维体素组来构成有限容积的空间。在一段时间内,可以将任何单独电极的采样定位场电势分箱成体素组。在一些实施例中,可以使用简化一般定位方法来确定所述分箱,例如上面描述为场鉴定和篮子矩心定位的方法。可以改变箱的大小以包围统计上显著的单独的电势样本组。相邻或附近箱之间的电势差及其相对方向和距离限定了局部场的估计。该估计可以通过将svd应用于将空间场梯度关联到相邻或附近箱的位置和电势差相关联的超定等式组来确定。图18b示出了一个示例。
通过将在每个体素的已知梯度值应用于所测量的电势,实现所测量的电势的定位,例如来自导航的辅助导管。
辅助装置的定位和形状建模
通过消除定位场在腔室各处的变化,心内场估计改进了辅助装置(例如套索导管或冠状窦标测导管)的定位的准确性。方法允许该场跨越空间的变化以较少失真结合到放置在室壁附近和静脉/心耳/瓣膜中的导管的定位。场变化被电子器件12a(在解剖结构重建期间)捕获并且处理以集成场变化。
在一些实施例中,定位的电极位置可以从辅助导管获得,例如图15中所示的非线性、标称圆形的″套索″型导管,并且可以通过各种方式进行形状建模,例如:
1.三次样条沿着三个空间坐标轴中的每一个独立地拟合到定位的电极数据
2.更高阶(例如四阶或五阶)多项式沿着三个空间坐标轴中的每一个独立地拟合到定位的电极数据
3.先验未知的半径和定向的圆拟合到定位的电极数据,并且可以修改所得到的圆以允许相对于旋转对称轴的螺旋变形。
在一些实施例中,形状建模的计算方法可以是方法的组合。在一些实施例中,可以基于对定位的电极位置组的测量或用户限定的变化来改变形状建模的方法,例如当可变形状导管配置为圆形环时,使用适合于对环进行形状建模的方法;当导管配置为曲线时,使用适合于对曲线进行形状建模的方法;并且当导管配置为线时,使用适合于对线进行形状建模的方法。
在一些实施例中,形状建模使用辅助导管的物理规格,例如电极间距、电极半径、电极长度、曲率半径等。在一些实施例中,使用可用物理电极的子集的定位的电极位置来计算形状建模。在一些实施例中,基于几何和/或时间标准,电极位置可以从形状建模计算中排除为“无效”。
参考图16,示出了为对导管进行形状建模而选择点(例如位置的2d或3d坐标)的方法。在步骤1610中,记录电信号(例如通过系统100的一个或多个部件),与位于患者体内(例如患者的心脏腔室中)的导管上的多个电极的位置相关。这些位置存储为点集。在一些实施例中,导管包括可变形状的辅助导管,其包括沿其长度的一部分的多个电极。导管可包括多个电极,例如包括至少8、12或20个电极的导管。在步骤1620中,计算点集的矩心。在步骤1630中,将点集中的每个点与所计算的矩心和/或其相邻点进行比较。在一些实施例中,每个点与矩心之间的距离与阈值进行比较,例如等于被建模的形状的预期半径的两倍的阈值。在一些实施例中,每个点与其相邻点之间的距离与同一阈值或不同的阈值进行比较。在步骤1640中,如果距离比较超过阈值,则将该点确定为无效,并从点集中移除(步骤1645a)。在一些实施例中,如果至少一个、至少两个或所有所做的比较超过比较的阈值,或者如果至少一个比较超过阈值,则将该点确定为无效。
在对点集的所有点进行比较之后,确定该集中是否剩余足够的点以计算形状模型(步骤1650)。在一些实施例中,计算形状建模所需的点(例如电极)的最少数量基于用于计算的多项式的阶数。在一些实施例中,剩余点必须多于8个点,例如多于10或12个点。在步骤1660中,如果满足不到所需的最少点数量,则系统可以显示原始位置数据(例如,迭加在心脏腔室的3d或2d显示上),并且不执行形状建模计算。在步骤1670中,如果满足了最少点数量,则系统可以执行形状建模计算,并显示导管的最佳拟合模型。在一些实施例中,形状建模的显示输出示出了物理导管上的所有电极的图形表示,不论它们是否连接到系统100并由系统100定位。在一些实施例中,连接到系统100并由系统100定位的电极与不连接到系统100并不由系统100定位的电极不同地图形显示,例如通过颜色、尺寸和/或形状差异。
运动校正
3d电生理标测系统中准确的导管位置和运动跟踪对于心律失常诊断和消融治疗策略是必不可少的。本发明构思的系统具有高准确度,并可以灵敏地响应于运动。如果环境有噪声,心房壁颤动可以产生高频运动,在程序中视觉上感知为导管的“抖动”(jittering)。“抖动”运动可能分散医生的注意力,并且导致视觉疲劳所致的不必要的疲劳。
在一些实施例中,系统10的算法对定位信号进行滤波以消除抖动运动,同时保持导管运动的适当响应性。为了滤除高频噪声或运动,可能需要缩小iq滤波器的带宽。但是,这可能会引入额外的延迟并延长响应时间。最佳地滤波器的延迟和频率带宽是很重要的。cic(级联积分梳状)滤波器是达到这个目的的唯一选择。与iir、均值和中值滤波器相比,cic滤波器在延迟方面表现更好,并类似地减少了抖动运动。此外,它在嵌入式(例如fpga)和pc应用中快速地(例如有效地)运行。滤波器本身只需要加法和减法。仅在输出放缩(如果需要)时需要乘法,以使滤波器增益为1。
cic滤波器的特性由三个参数决定。通过不同的参数组合,滤波器提供不同的带宽和噪音衰减,同时保持计算复杂性简单。这三个参数是:顺从性延迟(deferentialdelay)(dd)、段数(nsect)和下采样数(nds)。
放缩算法
系统100可以使用逆解来计算心脏信息,例如心脏腔室表面(例如心房腔室表面)上的表面电荷密度分布和/或电荷密度分布。电极12a在腔室(例如心房)内的位置和腔室表面(例如心房表面)的几何形状是用于制定逆解的两个必不可少的输入。由于阵列12可以位于腔室内的不同位置,因此从腔室表面到最近的电极12a的距离可以显著变化。这种变化会影响逆解的分辨率。例如,重建的电荷密度的幅度在空间上靠近电极12a的区域中比在空间上远离电极12a的区域中更趋于主导。
系统100可以包括下面描述的放缩算法,其使用加权最小范数估计方法来减轻对正向矩阵的距离影响(预放缩);然后,使用均匀分布的电荷源来计算用于相应地调整逆解的输出的后放缩值(后放缩)。这种技术显著改进了使用逆解的焦点源的定位准确度。
在适当的信号滤波之后,放缩算法可以(在最低程度)对记录的数据进行操作。在一些实施例中,算法还执行v波减法,如上所述。在这些实施例中,算法可以假设用户选择了对应于v波的egm上的适当段,和/或算法假设v波在整个记录中是一致的。
参考图8,框图示出了放缩算法的一系列步骤的实施例,包括预放缩和后放缩。
系统100的放缩算法可包括一个或多个输入。在一些实施例中,放缩算法的输入与系统100的电荷密度算法相同或相似,例如当放缩算法包括与阵列12电极12a的位置有关的输入时。输入可以是限定腔室表面几何形状(例如心房表面几何形状)的顶点和/或三角形。输入可以包括从阵列12电极12a测量的egm。
系统100的放缩算法可以提供一个或多个输出,例如包括表面电荷密度、偶极子密度和/或与腔室表面相关的其他心脏信息的输出。
在一些实施例中,放缩算法包括两个主要分量。首先,使用加权最小范数估计来改进tikhonov正则化方法;然后,使用均匀的源分布为计算用于调整来自第一步的心脏信息(例如电荷密度)的后放缩值。
正向问题(以心房表面上的电荷密度描述)
电荷密度s和导管上测量的电势φ的线性关系由下式描述:
φ=as(4)
其中a是测量矩阵,其对心房表面上的电荷密度和每个电极12a上的电势之间的关系进行编码,这不仅涉及从电极12a到心房表面的距离,还涉及心房几何形状。通过给出已知源s和电极12a的位置,可以由等式(4)预测电极12a上测量的电压。
在电极12a上测量了电压后,系统100可以使用逆解计算心房表面上的电荷密度(和/或偶极子密度)。由于线性系统是久定的(under-determined),所以可以使用正则化算法。在一些实施例中,放缩算法使用加权最小范数估计来进行正则化。
加权最小范数估计(wmne)
放缩算法可以使用加权最小范数估计(wmne)来通过在目标函数中引入加权矩阵来补偿距离效应:
其中加权矩阵w∈rn×n是对角矩阵,对角元素作为a的列的范数。
(5)的解法是
表示g=(wtw)-1=diag(1/||a(:,i)||2),i=1,2,…,n,(6)便可重写为:
可以使用奇异值分解将正向矩阵重写为a=u∑vt,并且替换回(7),导致wmne的简化解法
后放缩
一旦使用加权最小范数估计正则化方法计算电荷密度,系统100就可以计算后放缩值以调整电荷密度幅度。首先,系统100使用均匀电荷分布来计算阵列12电极12a上的电压。然后,可以使用由均匀源产生的电压来计算校准电荷密度。可以将校准电荷密度与均匀电荷密度进行比较来计算后放缩值。最后,可以使用后放缩值来调节心房表面上的电荷密度。
通过对测量矩阵进行预加权以补偿源深度,并对重建源进行后放缩以消除系统误差,前后放缩技术增加了对空间上远离电极12a的源的灵敏度。申请人的模拟和临床研究都显示了这些改进。
较少伪影的改进的高通滤波器
生物电势信号(例如心内电描记图和表面ecg信号)可以包含不期望的信号分量组,例如表现为基线扩散、呼吸和低频漂移的信道之间的不同幅度的dc偏移。与心脏激活形态的光谱含量相比,这些信号分量通常由相对低的频率组成,例如频率<=0.5hz。高通滤波器(hpf)是一种常用的信号处理工具,用于从信号中去除或减少低频信息。然而,传统的高通滤波器还可以将伪影引入egm/ecg信号的形态,这可能影响3d电生理学图像的准确度和分辨率。高通滤波器通常难以在单一设计中同时提供高阻带衰减、急剧过渡带和低信号失真。
在一些实施例中,bio滤波器33、生物信号处理器34或生物处理器36可以包括改进的高通滤波器,其以高阻带衰减、急剧过渡带和低信号失真来减少上述不期望的低频信号成分。低通滤波器用于去除指定频率以上的频率分量,例如0.01至2.0hz范围内的频率,例如0.5hz。然后,从原始信号中减去低通滤波器的输出。低通滤波器可以包括两个阶段,具有独特的截止频率并且以不同的采样率操作。与标准高通滤波器相比,两阶段布置允许更大过渡带和更小失真,同时保持低计算复杂度,允许滤波器可在软件或固件中实现。与标准高通滤波器相比,这种滤波器保留了生物电势信号的基线的形态、信号幅度和平坦度。
基于逆的远场源拒绝
可以通过针对人工定位的远场源执行场计算,拒绝来自3d电生理学图像中的感兴趣区域外的源的远场激活。作为示例,在感兴趣的心脏腔室(例如心房)表面a的激活的测量可以包括来自另一腔室(例如心室)中的源的贡献。然后,当映射心房的激活模式时,来自心室中的远场源的激活可能被不适当地分配给心房表面a上的源。在一些实施例中,系统100可以包括通过执行以下步骤来帮助从感兴趣腔室的图像中拒绝来自远场源的激活的方法(例如算法):
1.创建附加源区域b(点、点集或表面)并使用解剖学上准确的相对定向来附加到解剖表面a,例如当感兴趣的腔室是心房,并且远场源源自心室时,则为瓣膜的位置。
2.对表面a和b的并集进行逆解。
3.仅显示表面a的所得图像
i.应该将本质上与测量的电描记图共模的远场源分配给表面b上的源,从而减少感兴趣腔室的图像上的任何远场伪影。
4.从表面a上的源执行正向解法,仅产生没有远场分量的电描记图,例如用于基于逆的v波去除。
所述方法可以减少由滤波器或基于模板的方法引起的图像和电描记图上的伪影或残差。
具有连接结构的表面重建
在2016年5月12日提交的题为“超声测序系统及方法”的国际pct专利申请pct/us2016/032017号中所述的解剖腔室或表面的重建可能缺乏连接或相邻结构的细节。作为示例,左心房的重建可以准确地产生心房体的表示,但是附接的静脉结构在静脤孔口之外可能缺乏限定。系统100可以包括并入以下一项或多项的方法(算法)以改进连接结构的解剖定义。
方法可以包括对表面点云进行数据处理以创建主表面(根据pct/us2016/032017重建的表面),其识别包括来自连接结构内/附近或包括连接结构的表面点的区域。在一些实施例中,数据处理器可以包含区域中的表面点的空间分布。在一些实施例中,数据处理器可以包含区域中表面点相对于主表面的空间分布。
方法还可以包括由感兴趣的腔室内的装置采样的定位数据的数据处理,例如篮子标测导管和/或辅助诊断导管,其分布在腔室的整个容积内。在一些实施例中,这种定位数据从表面重建过程期间记录的数据提供。在一些实施例中,这种定位数据从独立获取期间记录的数据提供。在一些实施例中,可以通过以上对心内场估计的描述中公开的一种或多种方法来逼近场特征。在一些实施例中,包括和/或邻近于来自连接结构内/附近和/或包括连接结构的表面点的区域基于这些区域中的定位场的差异来识别,这些差异由连接结构的解剖学存在本质地施加。在一些实施例中,描述连接结构的定向的主方向矢量可以通过以下各项确定:估计的心内定位场相对于周围区域的局部差异、区域中或附近的表面点的空间分布、区域中或附近的表面点的主分量、主表面的表面特征、区域中的表面点相对于主表面的位置或定向、来自采样定位数据的场估计组的位置或定向,或者这些的组合。
方法还可以包括基于以下各项拒绝考虑表面点的处理步骤:估计的心内定位场相对于周围区域的局部差异、区域中或附近的表面点的空间分布、区域中或附近的表面点的主分量、主表面的表面特征、区域中的表面点相对于主表面的位置或定向、来自区域的场估计组的位置或定向、来自感兴趣的腔室内的装置的采样定位数据组的位置或定向、来自测距传感器组(例如超声换能器)的范围数据,或者这些的组合。
方法还可以包括处理步骤以重建代表性表面或表面段,其包括来自连接结构内或附近和/或包括连接结构的表面点的所识别区域中的一个或多个。在一些实施例中,代表性表面是从表面点的一个或多个所识别区域重建的,与来自其他表面数据的信息无关。在一些实施例中,代表性表面的处理步骤包含来自主表面的信息。可以对每个连接结构重复这个过程。在一些实施例中,代表性表面的重建可以利用网格划分算法,例如球轴(ball-pivot)或α形状算法。在一些实施例中,代表性表面的重建可以使用迭代拟合或变形算法,例如执行以下各项的算法:以广义表面形状开始,将表面形状的一个或多个区域修改为点集,估计诸如距离误差的成本函数,根据诸如阈值的结束标准评估成本函数,以及如果满足不到结束标准,则迭代地继续确定对表面形状的下一修改。在一些实施例中,代表性表面的重建可利用空间序列基函数的分析组,例如球面谐波展开,以逼近点集的最佳拟合表面。
方法还包括处理步骤,以将一个或多个代表性表面和/或连接结构的表面段组合或合并到主表面或其一部分。在一些实施例中,表面的合并与每个连接结构的代表性表面和/或表面段的重建同时进行。在一些实施例中,使用网格混合程序进行表面的合并。在一个实施例中,合并程序可包括以下步骤中的一个或多个:
1.使用网格生成算法(例如α形状算法)创建粗网格以联合两个结构,该粗网格包括主表面和来自连接结构内部或附近和/或包括连接结构的所识别的表面点集。
2.使用拟合算法(例如主分量分析)确定所识别表面点的最佳拟合壳。最佳拟合壳可以具有简单的形状,例如椭球、圆柱体、球体或类似的几何形状。
3.粗网格的三角形的子集在与最佳拟合壳的交叉点被识别为连接结构的开口或孔口。
4.粗网格超出孔口的部分被保留,并通过沿着孔口的三角形连接到主表面。
5.使用孔口的三角形的表面法线作为指导,基于连续表面法线方向去除内部三角形。
6.封闭所得表面中的孔。
7.对所得表面进行平滑、重新网格化或两者兼行。
现在参考图19,示出了与本发明构思一致的记录心脏活动和显示“跳动”心脏解剖模型的方法。方法1900包括:记录多个心动周期的心脏活动数据,包括电活动数据和壁位数据;分析电活动数据以所确定记录的心动周期的阶段的离散段;按离散阶段分段壁位数据;为每个离散阶段分量生成心脏腔室的解剖模型;以及基于记录的心脏活动数据显示跳动解剖模型。
在步骤1910中,记录心脏活动数据,例如使用系统100的一个或多个记录装置(例如导管10)记录的数据,如本文所述。电极阵列12可包括一个或多个电极12a和/或一个或多个超声换能器12b。系统100可以配置为定位心脏腔室内的电极阵列12(即,确定阵列12相对于患者体内产生的定位场的位置和定向),并记录患者的心脏活动数据。可以通过一个或多个超声换能器12b记录心脏壁位数据(“解剖”数据),如本文所述。同时(或相对同时地,例如以交织模式),可以通过一个或多个电极12a记录心脏电活动数据(“生物电势”数据),也如本文所述。在一些实施例中,数据被记录一段时间(例如在多个心动周期),在记录完整的数据组后,如下所述操纵数据,并且生成跳动解剖模型并将其显示为“记录”的视频。替代地或附加地,记录和操纵(例如分析)第一数据子集,记录后续的第二数据子集,并且可以基于第一数据子集和第二数据子集生成和显示跳动解剖模型。在这种配置中,可以显示跳动解剖模型的“实时视图”(例如,在实际解剖运动和对应的视频表示之间具有短延迟的视图)。
在步骤1920中,例如通过图1的控制台20的处理器分析所记录的生物电势数据,以确定表示心动周期的各个阶段(例如心跳阶段)的时间周期或段。例如,可以将规则和/或接近规则的心律(例如窦性心律或颤动)的记录的生物电势数据分段成周期性的时间段组,表示心动周期的阶段。在一些实施例中,这些段在周期之间以很小的变化重复。在一些实施例中,分析生物电势数据以确定心动周期的唯一阶段的关键时间指数(例如v波的上升或下降),并且将每个识别的连续关键时间指数之间的数据分段为设定数量的可变持续时间段。替代地,将每个连续的关键时间指数之间的数据分段为可变数量的设定持续时间段。
在步骤1930中,根据在步骤1920中确定的时间段聚合所记录的解剖数据。例如,对于每个记录周期的每个共同时间段,将记录的解剖数据(包括表示每个时间段期间心脏表面的至少一部分的点集)聚合以形成解剖数据组,其包括来自表示共同时间段(例如心动周期的共同阶段)的多个周期的点。对于每个记录的周期,对每个时间段执行这个过程,并将其编译成数据组,例如包括多个“箱”的数据组。可以将箱的总数设置为等于所记录的周期的时段的平均数量。在一些实施例中,例如当将生物电势数据分段成设定的持续时间段时时,连续的周期可以包括比箱的数量更多或更少的段,并且可以调整数据以消除差异。例如,如果周期包括多于箱的数量,则可以跳过(例如忽略)附加段。可以通过从周期的“结束”去除附加段来跳过附加段,和/或可以使用算法来确定要跳过的段,例如如果在包括33个段的周期中存在三个附加段,则可以跳过段11、22和33。附加地或替代地,可以将附加时间段“分配”到不同的箱,例如周期的最后一个箱或最后两个箱。在一些实施例中,附加时间段被分配到的箱是抖动的。
在一些实施例中,如果周期包括少于箱的数量,则时间段可以分布到箱的子集中。可以均匀地对分布进行采样(例如将较早的段“分配”到较早的箱),或者可以分析段,并且基于具有与要分配的箱中的数据(例如已经存在的数据)类似的特性来将其分配给箱。
在步骤1940,对于每个箱,其中包含的数据用于创建所表示的心动周期的相关时间段的心脏腔室的解剖模型。在一些实施例中,解剖模型如本文所述创建,和/或参照申请人在2016年9月23日提交的题为“,心脏分析用户界面系统和方法”的共同待审的美国专利申请15/128,563号创建,该申请通过参考方式整体并入本文作一切用途。在一些实施例中,创建“基础模型”,其包括从单个箱创建的模型,其表示单个时间段,例如表示心脏收缩或心脏舒张的时间段。可以基于基础模型生成表示剩余箱的解剖模型,例如通过使用共形网格。基础模型的每个顶点可以沿其法线轴向内和向外投影,并且每个顶点可以沿着投影调整以匹配和/或至少逼近后续箱中的数据,例如以基于基础模型创建表示每个箱中的数据的解剖模型。可以使用一个或多个平滑滤波器来改进(例如平滑)所创建的解剖模型。例如,基于从固定位置(例如坐标原点)到每个解剖模型的每个顶点的距离,可以使用低通滤波器来调整每个解剖模型中的每个顶点。当解剖模型被显示为动态模型(本文也称为跳动心脏模型)时,例如在步骤1950中,这种滤波可以产生“更平滑”和/或更连贯的运动。
在步骤1950中,将每个表示心动周期的阶段的连续解剖模型显示为动态模型。在一些实施例中,电数据,例如基于如本文所述的记录的心脏活动数据的计算数据(例如电压数据、偶极子密度数据和/或表面电荷数据)被迭加在动态模型上。迭加的图像允许操作者可视化所记录的解剖结构的一个或多个特征,例如电-机耦合和/或延迟。在一些实施例中,系统100处理表示动态模型的数据,以确定与电活动和/或解剖结构的大小、形状和/或运动有关的一个或多个度量。例如,系统100可以测量和/或显示以下中的一个、两个或更多个:射血分数、每搏输出量、腔室容积、腔室尺寸、区域壁位移、速度,或者僵硬度或功能丢失的其他指数/表示等。系统100可以随着时间计算和显示某些生理参数,例如腔室容积(例如心房容积)。例如,可以在表示腔室容积与时间的图表中呈现心房或其他腔室容积(例如作为曲线)。功能特征,例如每个顶点或区域的壁的位移或速度可以(瞬间地在时间窗口)显示为描绘收缩性的表示(例如指数)的图像(例如彩色图)。临床事件(例如消融手术)之前和之后的功能特征的差异和/或变化可以类似地显示为描绘由临床事件引起的改变功能的区域的彩色图。附加地或替代地,可以测量和/或显示一个或多个表面动态,例如组织应力或应变、血液速度、区域壁收缩性,或者僵硬度或功能丢失的其他指数/表示。
系统100可以配置为确定与患者心脏的大小、形状和/或运动相关的度量,例如通过创建如上所述的动态模型。这些度量的评估可以由系统100执行,作为(例如处理器26或控制台20的其他部件的)安全算法的一部分。安全算法可以持续运行,或者至少在对患者执行手术时运行,例如使用心脏消融装置(例如心内膜消融导管或心外膜消融装置)执行的心脏手术。心脏消融装置可以连接到控制台20(例如当控制台20配置为向消融装置提供能量时)或可操作地连接到控制台20的能量输送装置(例如使得控制台20可以控制对心脏消融装置的能量输送)。当检测到不安全或不期望的状况时,系统100可以警告(例如通过用户界面27的听觉、视觉和/或触觉用户输出部件)和/或调整(例如停止或至少减少)心脏消融装置的操作。例如,系统100可以配置为检测从包括以下组中选择的不期望状况:压塞(例如由于心包出血);中风;偏离稳定的血液动态状况;射血分数减少;每搏输出量减少;壁运动减少;腔室容积的不期望降低(例如平均腔室容积的不期望降低);腔室容积的不期望增加(例如平均腔室容积的不期望增加);以及其组合。不期望状况可以是全局心脏腔室特征(即整个腔室)或区域心室特征(例如室壁的一部分)的状况。在一些实施例中,不期望状况是心房容积减少(例如在相当的心率下心房容积减少),其指示心房充盈减少,这可以与导致压塞的出血相关。在一些实施例中,系统100配置成检测压塞(例如如上所述),并警告用户和/或递送(或促使递送)凝结剂或其他治疗(其他药物或介入治疗)以控制出血和/或压塞。
在一些实施例中,一个或多个连续解剖模型可以由用户改进,例如使用网格划分和/或平滑技术,例如下面参考图21所描述的。
现在参考图20,示出了与本发明构思一致的记录心脏活动数据和基于数据的“快照”更新心脏的解剖模型(例如心脏的腔室)的方法。方法2000包括:记录心脏活动数据和生成心脏的解剖模型;记录心脏活动数据的“快照”,包括壁位数据;对记录的数据进行滤波;根据数据的快照确定所记录的解剖结构的大小和形状的近似值;以及基于解剖结构的近似大小和形状更新解剖模型。
在步骤2010,记录心脏活动数据,例如使用系统100的一个或多个记录装置(例如导管10)记录的数据,如本文所述,并且生成心脏的解剖模型。电极阵列12可包括一个或多个电极12a和/或一个或多个超声换能器12b。系统100配置为定位心脏腔室内的电极阵列12(即,确定阵列12相对于患者体内产生的定位场的位置和定向),并记录患者的心脏活动数据。可以通过一个或多个超声换能器12b记录心脏壁位数据(“解剖”数据),如本文所述。同时(或相对同时地,例如以交织模式),可以通过一个或多个电极12a记录心脏电活动数据(“生物电势”数据),也如本文所述。可以在第一段时间记录第一组数据,例如至少5秒、15秒,或30秒,或少于1分钟或少于5分钟。使用第一组记录数据生成心脏(例如从中记录数据的心脏腔室)的静态解剖模型,例如表示心脏收缩、心脏舒张的腔室形状和/或这两个阶段之间的中间形状的模型。生成静态模型的方法在本文描述,也在申请人在2016年9月23日提交的题为“心脏分析用户界面系统和方法”的共同待审的美国专利申请15/128,563号描述,该申请通过参考方式整体并入本文作一切用途。在一些实施例中,从在方法2000之前和/或期间记录的ct和/或mri数据生成解剖模型。另选地,解剖模型可以包括配置成由方法2000更新的通用解剖模型。在一些实施例中,静态解剖模型可以由用户改进,例如使用网格划分和/或平滑技术,例如下文参考图21所描述的。
在步骤2020中,可以在第二时间段(例如短于第一时间段的时间段)记录第二组数据。在一些实施例中,第二组记录数据表示心脏腔室的瞬时“快照”,例如当第二时间段包括少于0.5秒的时间段时,例如少于100ms,或少于30ms。第二组记录数据可以包括心脏腔室的稀疏采样,例如包括少于96个样本的采样(即,少于96个超声测量)。第二组记录数据可包括同时和/或几乎同时在多个方向上由电极阵列12进行的多个超声测量,例如以允许从解剖结构的稀疏采样中逼近解剖结构的大小和/或形状,如下所述。
在步骤2030,可以对所记录的第二数据组进行滤波和/或操纵。在一些实施例中,数据组中可以缺失一个或多个超声反射(例如,如果未响应于超声脉冲或“砰”(ping)检测到反射),并且系统100可以配置为“填充”缺失的数据,如下所述。在一些实施例中,可以插入固定值(例如由系统100确定的固定值)以最小化后续计算对数据组的负面影响,例如解剖结构的“中间”或中性(不是心脏收缩也不是心脏舒张)位置的固定值代表。在一些实施例中,可以插入基于历史平均值的固定值(例如,基于来自第一数据组的平均值)来替换缺失的数据点。在一些实施例中,可以插入基于单个历史值的固定值,例如“最近的”有效数据点(例如,来自具有缺失数据的换能器的最近记录的有效数据点)。在一些实施例中,可以使用拟合算法插入缺失数据,例如内插算法,例如使用线性、样条、分段连续和/或其他内插方法的算法。在一些实施例中,可以基于由自适应和/或机器学习算法确定的值来插入缺失的数据,例如基于数据组内的有效数据的一个或多个子集的算法。
在步骤2040中,确定由第二组记录数据表示的解剖结构的大小和/或形状。在一些实施例中,可以实现“包络型”算法(例如凸包)以通过将所有测量的超声点封装在复杂形状内来确定解剖结构的大小和形状的粗略估计。替代地或附加地,可以将应力/应变模型应用于从第一数据组生成的静态模型,并且可以将推/拉算法应用于使用第二数据组的应力/应变模型,例如以找到应力/应变模型与“瞬时”点的第二数据组的符合“拟合”。
在一些实施例中,静态模型可以由顶点网格p原始(x,y,z)表示,其可以由下式“更新”到p瞬间(x,y,z):
p原始(x,y,z)=p瞬间(x,y,z)+δp,
其中使用第二组记录数据估计δp,并且p原始(x,y,z)的每个顶点的变化限于在局部法线方向上。δp可以限定为函数的组合,即具有加权参数λn的全局解剖结构拟合、区域解剖结构拟合、时间和空间平滑:
δp=λ1(f全局拟合)+λ2(f区域拟合)+λ3(f空间平滑)
+λ4(f时间和空间平滑)
例如,可以使用每个超声数据点与解剖结构上的最近位置的均值或中值分离来实现全局拟合函数。可以使用区域拟合来建立每个超声点和解剖结构上的顶点之间的关系。可以通过限定第二数据组的所有超声点与静态模型的顶点之间的函数(例如反距离或高斯)来建立这种关系。一旦建立了测量和解剖结构之间的这种关系,解剖结构就可以被变型。λ值对解法的不同方面进行加权,或者它们本身可以是顶点的函数,并且可以由于超声测量的置信度或由于最近的超声测量的距离而设置。
在一些实施例中,静态模型可以由顶点格p原始表示,其可以由下式“更新”为p瞬间(t):
p瞬间(t)=p原始+δp(t),(1)
其中使用瞬间超声数据点(第二数据点集)的全部或子集来估计δp。等式(1)中的公式允许静态网格变成可变型网格,其中变形是由于与心壁位置的变化(因此收缩性和容积)相关的超声范围数据的变化。在一些实施例中,将存在比顶点更少的超声数据点,因此需要在大多数位置估计δp(t)。
可以使用内插和/或外插方法、能量函数最小化和/或诸如应力应变关系的数据模型来估计未知的δp(t)。内插和/或外插方法可以包括反距离加权、最近邻居反距离加权、基函数内插和/或克里金(kriging)法。基函数内插实现可以包括限定基函数(例如球谐函数基函数),并使用这些函数来估计未知数据点。能量(成本函数)公式也可以用于确定最小化瞬时能量的δp(t)
其中可以使用权数wn来限定不同的能量en,表示能量项对总能量的相对影响。加权项wn可以是其他可测量的量的函数。能量项的一个示例可以是e数据拟合,其可以限定为超声范围数据与其解剖结构上的相应顶点之间的误差。另一个能量项可以限定为e原始形状,其可以限定为与原始解剖结构的空间梯度的偏差。然后可以将具有这些项的总能量限定为
基于模型的变形方法可以包括限定解剖结构的应力/应变模型。在已知变型的情况下,可以在每个位置估计应力/应变。然后可以插入应力/应变或者可以建立和最小化能量函数,以确定每个顶点的应力和应变。然后可以更新顶点位置以对应于估计的应力/应变。一旦为每个顶点和时间点计算了δp(t),可以计算若干度量,例如瞬时血容量、主动和被动血容量排空和/或基于区域的收缩性。
在一些实施例中,基于内插的可变形网格如下配置。对于每个时刻,确定心脏腔室内的超声换能器的坐标。对于每个时刻,为每个超声换能器确定矢量vecn,其限定超声范围数据usposn和超声换能器的m模式位置线。确定m模式超声换能器与静态心脏解剖结构之间的交叉点。确定最接近超声矢量(vecn)和解剖结构的交叉点的顶点顶点vertexn。计算超声范围数据usposn和vertexn之间的距离distn。将δp(n,t)分配为distn的投影和在顶点vertexn的局部表面法线。一旦确定了有效超声数据的所有δp(n,t),使用最近邻居的反距离放缩确定对其余顶点的内插。对于每个时刻,使用更新的顶点位置计算解剖结构的容积。
在步骤2050中,基于第一数据组和由第二数据组更新,可以显示动态解剖模型,类似于上文参考图19的步骤1950所描述的。
现在参考图21,示出了与本发明构思一致的生成和编辑心脏的解剖模型的方法。方法2100包括:记录第一组心脏活动数据,包括壁位数据;基于第一组心脏活动数据,创建心脏的基础解剖模型(例如心脏的腔室);收集附加的心脏壁位数据并更新基础解剖模型;并且例如通过图形用户界面编辑基础解剖模型。
在步骤2110中,记录第一组心脏活动数据,例如使用系统100的一个或多个记录装置(例如导管10)记录的数据,如本文所述。电极阵列12可包括一个或多个电极12a和/或一个或多个超声换能器12b。系统100配置为定位心脏腔室内的电极阵列12(即,确定阵列12相对于患者体内产生的定位场的位置和定向),并记录患者的心脏活动数据。可以通过一个或多个超声换能器12b记录心脏壁位数据(“解剖”数据),如本文所述。同时(或相对同时地,例如以交织模式),可以通过一个或多个电极12a记录心脏电活动数据(“生物电势”数据),也如本文所述。如本文所用,解剖数据可以指由系统100(例如通过电极阵列12或系统100的其他数据收集装置)收集的任何数据,用于生成解剖模型。解剖数据可以包括来自以下组的数据:包括通过超声测量的表面点(例如表面位置)的数据;使用定位方法确定容积数据,例如随时间跟踪腔室(例如至少包括所收集的电极位置的凸包的容积的心脏腔室)内的电极的位置;包括使用定位方法收集的表面点的数据,例如通过与定位系统一起使用的系统100的接触传感导管收集的数据;从身体外部采集的数据(例如使用外部可视化装置),例如mri和/或ct数据;以及这些中的一个或多个的组合。
在步骤2120中,基于第一组记录数据,生成心脏的基础解剖模型(例如包括限定3d表面的顶点和多边形集)。如下所述,方法2100用于生成和编辑心脏(例如从中记录数据的心脏腔室)的静态解剖模型,例如表示心脏收缩、心脏舒张的腔室形状和/或在这两个阶段之间的中间形状的模型。生成静态模型的方法在本文描述,也在申请人在2016年9月23日提交的题为“心脏分析用户界面系统和方法”的共同待审的美国专利申请15/128,563号描述,该申请通过参考方式整体并入本文作一切用途。另外,可以迭代方法2100(例如通过表示心动周期的连续阶段的连续静态解剖模型迭代)以生成和编辑腔室的动态模型,例如本文所述的动态模型。在一些实施例中,基础解剖模型包括从外部成像源(例如mri和/或ct)导入系统100的解剖模型。
在一些实施例中,静态解剖模型包括使用在收集点集期间或之后围绕它们“构建”复杂3d几何形状的方法所生成的模型,例如通过使用α形状方法和/或“生长”方法。例如,可以使用如下所述的生长方法来在心脏舒张(即,心肌松弛并允许腔室充满血液时,并且腔室为最大时的心跳阶段)期间构建腔室的静态模型。在这些实施例中,当记录第一组数据时,点集被认为仅存于腔室内,并且在所有心跳阶段中,拟合算法(例如凸包,包括所有(不包括异常值)所收集的点)可以被认为代表腔室处于其最大容积(即,心脏舒张)。在一些实施例中,可以使用类似的方法,并且可以包含选通机制(gatingmechanism)(例如基于心脏电活动数据的选通机制),以仅包括在心跳的特定阶段期间(例如在心脏收缩期间,当腔室处于最小容积时)收集的点。
在步骤2130中,记录第二组心脏活动数据(“附加”数据),并且可以基于附加数据更新基础解剖模型。在一些实施例中,例如当基础解剖模型包括mri和/或ct图像时,可以使用附加数据将导入的模型配准到在系统100的坐标系统内的解剖结构。附加地或替代地,附加数据可用于“填充”或增加解剖模型的区域的分辨率。例如,系统100可以(例如通过用户界面)通知用户低数据密度的区域(例如稀疏采样的区域)。用户可以收集与该区域相关的附加数据,例如通过将导管10“指向”(例如转向)所指示的区域,并记录附加数据。可以使用第一组数据来编译所收集的附加数据,以生成改进的基础解剖模型。替代地,可以使用附加信息更新基础解剖模型。在一些实施例中,用户可以重新采样区域,例如当用户怀疑模型存在问题时。附加数据可用于确认基础解剖模型的准确性和/或更新基础解剖模型。
在步骤2140中,系统100可以提供一个或多个手动和/或自动工具,用于编辑基础解剖模型,例如通过图形用户界面和一个或多个用户输入装置,例如鼠标、键盘、触摸屏显示器等。如下所述,使用系统100中包括和/或由系统100启用的控制、程序和/或算法来执行用户“动作”。在一些实施例中,将一个或多个结构(例如“解剖投影”)添加到基础解剖模型,例如以表示左心耳和/或肺静脉,可能是有利的。系统100可以允许用户添加“简单”几何投影(例如具有基本形状、沿直线或近似直线路径投影、基本形状沿投影很少或没有变化的投影),和/或更复杂的几何投影,例如通过沿用户限定的矢量添加“应力”以变形基础解剖模型而形成的投影,两者均如下文所定义。
在一些实施例中,用户通过输入投影的交叉点、投影的矢量(方向和长度)和投影的形状来限定要添加到基础解剖模型的投影。可以通过选择基础解剖模型的顶点来选择交叉点。用户可以通过将基础解剖结构定向在屏幕的特定位置上(例如通过旋转模型,使得期望的矢量处于“向上”方向,或“进入”屏幕等),或者通过“绘制”期望的矢量(例如通过选择第一点和第二点在3d空间中创建线),或者通过限定矢量的任何其他方法来限定投影的矢量。用户可以调整矢量的长度和方向,例如通过沿矢量的方向“拖动”矢量的终点(以改变矢量的长度),或者在空间中自由地“拖动”矢量的终点(以改变矢量的方向和/或长度)。然后,用户可以通过绘制形状,突出显出基础解剖模型的部分,或者选择基础解剖模型的部分(例如一个或多个顶点和/或多边形)来限定要沿着矢量投影的基本形状。用户可以使用系统100提供的一个或多个绘图工具来限定基本形状,例如绘制圆形、椭圆形或其他限定的形状,或者自由形状的形状。可以沿着矢量投影该绘制的形状以选择包围在投影内的解剖模型的顶点,并且可以沿着矢量投影这些顶点以形成要添加到基础模型的最终投影。在一些实施例中,投影遵循用户限定的形状(例如系统不将投射限于包围的顶点),并且系统执行拟合函数(例如圆角(fillet))以逼近基础模型和投影之间的过渡。在一些实施例中,用户可以通过使用粗略选择工具以通过使用“画笔式”功能选择(或取消选择)基础模型的顶点,从而限定投影的基础。附加地或替代地,粗略选择工具可以包括“套索”类型编辑功能,自动选择包围在所选顶点组的顶点。附加地或替代地,用户可以通过单独地选择基础解剖模型的顶点和/或多边形,例如使用精细选择工具,从而限定投影的基础。
在一些实施例中,投射基础解剖模型的顶点允许系统将改进的解剖模型处理(例如改进)为单一“网格”(限定3d表面的多边形组),使得投影与解剖结构的剩余基础模型一起处理。处理可以包括但不限于:平滑、重新划分、细分、洞闭合、隔离或浮动三角形识别和移除等。附加地或替代地,投影可以与剩余基础模型分开地处理,使得当处理改进的解剖模型时,用户限定的结构不被修改。
在一些实施例中,系统100允许用户执行以下动作之一:确认创建的投影(例如将投影保存到改进的模型中);清除创建的投影和/或用于创建投影的解剖点,并创建新投影;限定投影相对于模型上的电活动日显示的“行为”(例如,将投影视为解剖模型中的“洞”而不显示电活动);修改投射的几何参数,例如长度、横截面的放缩、交叉点和/或结构的矢量方向;删除以前创建的结构;擦除解剖点;移除投影的部分和/或解剖模型的其他部分;通过使用用户输入装置(例如鼠标)“推或拉”元素来修改顶点或多边形的区域;以及这些中的一个或多个的组合。
可以半自动地和/或自动地(在本文为“自动地”)执行创建改进的解剖模型的一个或多个步骤。在一些实施例中,系统100对基础模型的自动修改可以被用户推翻。在一些实施例中,用于限定投影的一个或多个参数(例如其方向、形状、尺寸、长度、横截面、位置和/或交叉)可以由系统100基于一个或多个输入(例如第一组解剖数据)定义。在一些实施例中,如上所述,用户可以收集附加数据点来更新解剖模型,并且系统100可以自动更新解剖模型,例如通过向模型添加投影。基于数据的增量获取(例如,基于系统100以什么速度收集数据和确定附加数据以保证对模型的更新),系统100可以基于该附加数据以每1毫秒一次至每10秒一次的速率更新模型,例如每100ms或每500ms一次。系统100可以基于数据的一个或多个特性确定附加数据是否与投影相关。例如,附加数据自身可以包括主要与解剖结构的一段相关联的数据组,其最佳地建模为来自基础解剖模型的投影,并且该数据表示具有一个或多个主分量的形状(例如,逼近解剖结构的形状)。
系统100可以配置为提供这些一个或多个主分量,并确定要添加到解剖模型的投影的一个或多个特性。例如,数据的主分量矢量可用于确定结构的主轴。投影的交叉点可以通过主方向矢量与基础解剖模型的交叉点来确定。投影的形状可以通过附加数据的横截面、外边界或其他度量来确定。确定投影参数的横截面或外边界方法可以利用垂直于交叉点的基础模型和/或垂直于附加数据的方向矢量的平面来确定投影的形状。在一些实施例中,这些方法可以利用在距离交叉点的阈值内的基础模型的顶点子集来限定投影。在一些实施例中,这些方法可以仅利用被确定为在基础模型“外部”的附加数据的子集。在一些实施例中,投影可以基于附加数据中的点与最近的基础模型顶点之间的矢量和来自基础模型顶点的法线矢量的点积。
在一些实施例中,系统100使用如下所述的边界方法添加投影。使用凸包确定边界表面,所述凸包界定所有解剖数据“点”(例如来自第一组数据和所收集的任何附加数据)的集合。使用界定解剖点集的α形状确定边界表面。从数据中移除内部顶点和三角形,并且可以从要创建的投影中排除数据的子集,例如确定为基础解剖结构内部的点的子集,或者在基础解剖结构的表面一段距离内的点的子集。从基础解剖结构移除与边界表面相交的基础解剖结构的顶点(“贴片”)的子集,创建与所创建的结构连接的洞和/或边界。在基础解剖结构上创建的洞的边界和所创建的结构的边缘可以混合以产生“水密”边界(例如无缝边界)。在一些实施例中,系统100可以从改进的解剖结构计算新的α形状,从而创建新的改进的解剖结构,填充通过添加投影产生的任何潜在的洞。在一些实施例中,可以通过(例如由用户)获取附加数据和/或擦除顶点或数据点来动态地改变或更新自动的解剖结构。
虽然上文已经描述了被认为是最佳的模式和/或其他优选实施例,但应当理解,可以在其中进行各种修改,并且本发明可以以各种形式和实施例来实现,并且它们可以应用在许多应用中,本文只描述了它们其中一些。所附权利要求旨在要求保护字面上描述的及其所有等同物,包括落入每个权利要求范围内的所有修改和变化。
- 还没有人留言评论。精彩留言会获得点赞!