用于核苷酸测序数据的二级分析的系统和方法与流程
本申请要求2016年10月7日提交的美国临时申请no.62/405824的优先权;其内容通过引用整体并入本文。
背景技术:
本公开一般涉及dna测序领域,并且更具体地涉及用于进行下一代测序应用的实时二级分析的系统和方法。
相关技术的描述
可以通过鉴定序列读段中-相对于参考序列-的变异来鉴定遗传突变。为了鉴定变异,可以使用测序仪器对来自受试者的样品进行完全测序以获得序列读段。在获得序列读段之后,可以在变异识别之前组装或比对序列读段。因此,鉴定变异包括依序进行的不同步骤,并且在测序过程结束后执行可能是耗时的。
发明概述
本文公开了用于对多核苷酸进行测序的系统和方法。在一个实施方案中,该系统包括:存储器,其包括参考核苷酸序列;处理器,其被配置为执行指令,该指令进行包括以下的方法:从测序系统接收读段的第一核苷酸子序列;使用第一比对路径处理第一核苷酸子序列,以确定参考序列上读段的第一多个候选位置;根据确定的候选位置确定第一核苷酸子序列是否比对至参考序列;从测序系统接收第二核苷酸子序列;使用以下路径处理第二核苷酸子序列以确定比对至参考序列的读段的第二多个候选位置:如果读段比对至参考序列,则使用第二比对路径,并且如果不是这样,则使用第一比对路径,其中第二比对路径比第一比对路径计算效率更高,以确定读段的第二多个候选位置。
在一个实施方案中,该方法包括:在测序运行期间从测序系统接收第一核苷酸子序列;并且使用第一分析路径或第二分析路径基于参考序列进行读段的第一核苷酸子序列的二级分析,其中第二分析路径在进行二级分析方面比第一处理路径计算效率更高。
附图简述
图1是示出用于进行实时分析的示例测序系统的示意图。
图2示出了用于进行实时分析的示例计算机系统的功能框图。
图3是通过边合成边测序的示例方法的流程图。
图4是用于进行碱基识别的示例方法的流程图。
图5a和图5b示出了示例迭代比对和变异识别。
图6是用于进行实时二级序列分析的示例方法的流程图。
图7a和图7b是将二级分析的传统方法(图7a)与二级分析的迭代方法(图7b)进行比较的示意图。
图8是以16个碱基间隔生成读段的示意图。
图9a是用于进行实时二级分析的示例方法的流程图。图9b是示出按k-mer处理的数据的预测线图。图9c是示出运行时间的条形图。
图10是用于进行实时二级分析的示例方法的另一流程图。
图11a和图11b将现有变异识别器(variantcaller)(图11a)与使用如本文所述的高置信度低处理路径的变异识别器(图11b)进行比较。
发明详述
在以下详述中,参考了附图,附图形成了其的一部分。在附图中,除非上下文另有指示,否则类似的符号通常标识类似的组件。在详述、附图和权利要求中描述的说明性实施方案不旨在限制。在不脱离本文提出的主题的精神或范围的情况下,可以利用其他实施方案,并且可以进行其他改变。容易理解的是,如本文一般描述的和附图中所示的本公开的方面可以以各种不同的配置来布置、替换、组合、分离和设计,所有这些都是本文明确考虑的。
本文公开了用有时效性的方式进行核苷酸测序数据的二级分析的系统和方法。在一些实施方案中,该方法包括迭代地进行二级分析,而序列读段由测序系统生成。二级分析可以包括序列读段与参考序列(如,人参考基因组序列)的比对以及利用该比对来检测样品和参考之间的差异。二级分析可以能够检测遗传差异、变异检测和基因分型,鉴定单核苷酸多态性(snp)、小插入和缺失(indel)以及dna中的结构变化,诸如拷贝数变异(cnv)和染色体重排。
通过在生成序列读段的同时进行二级分析,该系统和方法可以实时(或以零或低延时)迭代地确定初步变异识别。变异确定的最终结果可在测序运行结束后不久(或紧接其后)获得。或者,如果在运行期间以足够的置信度获得变异识别,则可以提前终止测序运行。在一些实施方案中,仅将与变异确定(如,变异识别)有关的信息从测序系统传送出去。与在外部系统中进行的变异确定相比,这可以减少或最小化所需的数据带宽。另外,可以仅将变异信息发送到计算系统(如,云计算系统)以进行进一步处理。在该实施方案中,可以在完成整个测序过程之前终止测序运行。例如,如果在测序运行的多个测序循环后确定目标病原体的身份,则可以终止测序运行。因此,可以减少特定应答(如,病原体鉴定)的时间。在一个实施方案中,系统的输出和中间结果可以包括以下的直方图:重复、精确匹配、单和双snp以及单和双插入缺失。
定义
除非另外定义,否则本文使用的技术和科学术语具有与本公开所属领域的普通技术人员通常理解的含义相同的含义。参见,如singleton等人,dictionaryofmicrobiologyandmolecularbiology第2版,j.wiley&sons(newyork,ny1994);sambrook等人,molecularcloning,alaboratorymanual,coldspringsharborpress(coldspringsharbor,ny1989)。出于本公开的目的,以下术语定义如下。
用于进行实时二级分析的测序仪
本文公开了用于以时间和/或计算资源有效方式迭代地进行二级分析的系统和方法。二级分析可以包括序列读段与参考序列(比,人参考基因组序列)的比对和利用该比对来检测样品和参考之间的差异。二级分析可以能够检测遗传差异、变异检测和基因分型,鉴定单核苷酸多态性(snp)、小插入和缺失(indel)以及dna中的结构变化,诸如拷贝数变异(cnv)和染色体重排。可以对一个测序循环进行二级分析,同时为下一个测序循环生成测序数据。
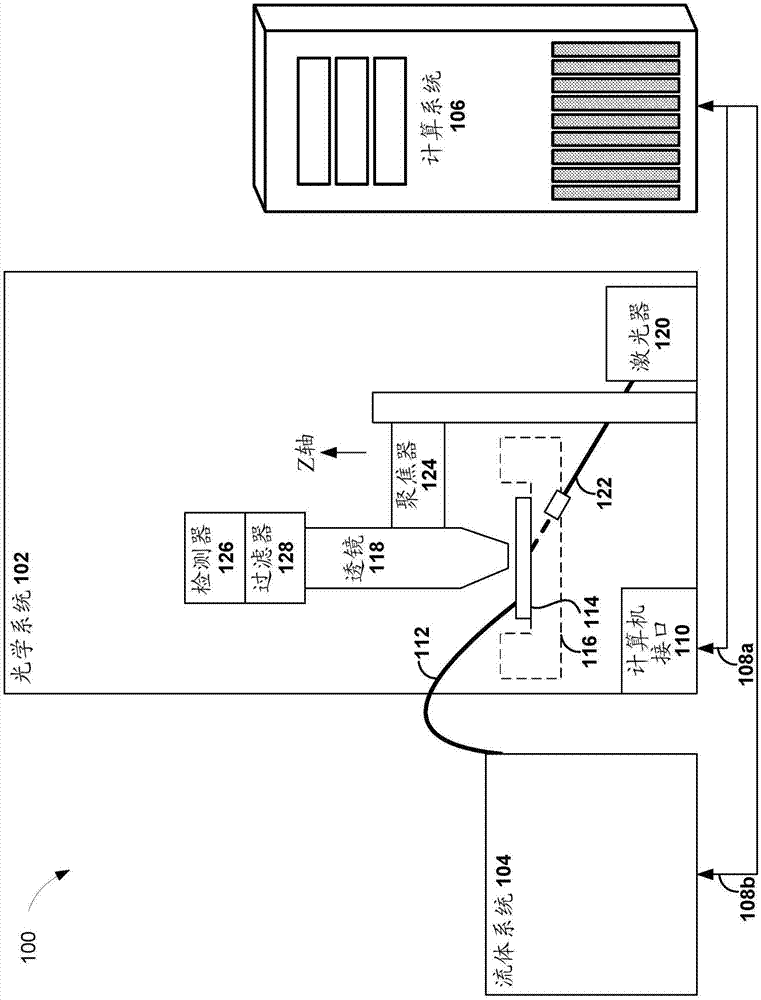
图1是示出用于进行实时二级分析的示例测序系统100的示意图。由测序系统100利用的测序方法的非限制性实例可包括边合成边测序和heliscope单分子测序。测序系统100可以包括光学系统102,其被配置为使用由作为测序系统100的一部分的射流系统104供应的测序试剂来生成原始测序数据。原始测序数据可以包括由光学系统102捕获的荧光图像。作为测序系统100的一部分的计算机系统106可以被配置为经由通信通道108a和108b控制光学系统102和射流系统104。例如,光学系统102的计算机接口110可以被配置为通过通信通道108a与计算机系统106通信。
在测序反应期间,射流系统104可以将试剂流通过一个或多个试剂管112引导入位于安装台116上的流动池114并从位于安装台116上的流动池114引导出。试剂可以是,例如荧光标记的核苷酸、缓冲液、酶和裂解试剂。流动池114可包括至少一个流体通道。流动池114可以是图案化阵列流动池或随机阵列流动池。流动池114可包括多个单链多核苷酸簇,以在至少一个流体通道中测序。多核苷酸的长度可以是变化的,例如为200个碱基至1000个碱基。多核苷酸可以附接至流动池114的一个或多个流体通道。在一些实施方案中,流动池114可以包括多个珠粒,其中每个珠粒可以包括待测序的多核苷酸的多个拷贝。安装台116可以被配置为允许流动池114相对于光学系统102的其他组件适当地比对和移动。在一个实施方案中,安装台116可用于将流动池114与透镜118比对。
光学系统102可包括多个激光器120,其被配置为生成预定波长的光。由激光器120生成的光可以穿过纤维光缆122以激发流动池114中的荧光标签。安装在聚焦器124上的透镜118可以沿z轴移动。聚焦的荧光发射可以由检测器126检测,例如电荷耦合装置(ccd)传感器或互补金属氧化物半导体(cmos)传感器。
光学系统102的过滤器总成128可以被配置为过滤流动池114中的荧光标签的荧光发射。过滤器总成128可包括第一过滤器和第二过滤器。每个过滤器可以是长通过滤器、短通过滤器或带通过滤器,这取决于系统中使用的荧光分子的类型。第一过滤器可以被配置为通过检测器126检测第一荧光标签的荧光发射。第二过滤器可以被配置为通过检测器126检测第二荧光标签的荧光发射。利用过滤器总成128中的两种过滤器,检测器126可以检测到两种不同波长的荧光发射。
在一些实施方案中,光学系统102可以包括分色器,其经配置以分离荧光发射。光学系统102可包括两个检测器,与用于检测第一波长处的荧光发射的第一过滤器耦合的第一检测器,以及与用于检测第二波长处的荧光发射的第二过滤器耦合的第二检测器。
在使用中,将具有待测序的多核苷酸的样品加载到流动池114中并放置在安装台116中。然后计算机系统106激活射流系统104以开始测序循环。在测序反应期间,计算机系统106通过通信接口108b指示流控系统104向流动池114供应试剂,如核苷酸类似物。通过通信接口108a和计算机接口110,计算机系统106被配置为控制光学系统102的激光器120以生成预定波长的光并照射到与荧光标签耦接的核苷酸类似物上,所述荧光标签掺入与被测序的多核苷酸杂交的生长引物中。计算机系统106控制光学系统102的检测器126以捕获荧光图像中的核苷酸类似物的发射光谱。计算机系统106从检测器126接收荧光图像并处理接收的荧光图像以确定被测序的多核苷酸的核苷酸序列。
计算机系统
如上所讨论,测序系统100的计算机系统106可以被配置为控制光学系统102和射流系统104。计算机系统106可以有许多配置,图2示出了一个实施方案。如图2所示,计算机系统106可包括处理器202,其与存储器204、存储装置206和通信接口208电通信。在一个实施方案中,计算机系统106包括现场可编程门阵列(fpga)、图形处理单元(gpu)和/或矢量中央处理单元(cpu),以进行序列比对并生成变异识别。
处理器202可以被配置为执行指令,该指令使射流系统104在测序反应期间向流动池114供应试剂。处理器202可以执行控制光学系统102的激光器120以产生预定波长的光的指令。处理器202可以执行控制光学系统102的检测器126并从检测器126接收数据的指令。处理器202可以执行指令以处理从检测器126接收的数据例如荧光图像,并基于从检测器126接收的数据确定多核苷酸的核苷酸序列。
存储器204可以被配置为存储指令,所述指令用于配置处理器202以在测序系统100通电时执行计算机系统106的功能。当测序系统100断电时,存储装置206可以存储指令,所述指令用于配置处理器202以执行计算机系统106的功能。通信接口208可以被配置为促进计算机系统106、光学系统102和射流系统104之间的通信。
计算机系统106可以包括用户接口210,其被配置为与用于显示测序系统100的测序结果(包括二级分析(诸如变异识别)的结果)的显示设备(未示出)通信。用户接口210可以被配置为接收来自测序系统100的用户的输入。计算机系统106的光学系统接口212和射流系统接口214可被配置为通过图1所示的通信链路108a和108b控制光学系统102和射流系统104。例如,光学系统接口212可以通过通信链路108a与光学系统102的计算机接口110通信。
计算机系统106可包括核酸碱基确定器216,其被配置为使用从检测器126接收的数据确定多核苷酸的核苷酸序列。核酸碱基确定器216可以使用由检测器126捕获的荧光图像在流动池114中生成多核苷酸簇的位置的模板。核酸碱基确定器216可以基于所生成的位置模板在由检测器126捕获的荧光图像中记录流动池114中的多核苷酸簇的位置。核酸碱基确定器216可以从荧光图像中提取荧光发射的强度以生成提取的强度。核酸碱基确定器216可以从提取的强度确定多核苷酸的碱基。核酸碱基确定器216可以确定所确定的多核苷酸碱基的质量评分。
计算机系统106可以包括迭代比对器218和变异识别器220,诸如strelka变异识别器(sites.google.com/site/strelkasomaticvariantcaller/home/faq)。在测序循环期间,迭代比对器218可以将由核酸碱基确定器216所确定的序列读段与参考序列比对。比对的序列读段可以具有相关的评分。评分可以是序列读段已正确地比对至参考序列的概率(如,错配百分比)。在一些实施方式中,计算机系统106可以包括硬件,诸如现场可编程门阵列(fpga)或图形处理单元(gpu),用于将序列读段与参考序列比对并用于确定变异识别。在一些实施方案中,迭代比对器218和变异识别器220可以由与计算机系统106不同的计算机系统来实现。在一些实施方案中,计算机系统106可以是测序系统100的集成组件。在一些实施方案中,光学系统102、射流系统104和/或计算机系统106可以集成到一个机器中。
边合成边测序
图3是用于利用测序系统100的边合成边测序的示例方法300的流程图。在框305处开始方法300之后,在框310处接收包括片段化双链多核苷酸片段的流动池114。片段化的双链多核苷酸片段可以由脱氧核糖核酸(dna)样品生成。dna样品可以来自各种来源,例如生物样品、细胞样品、环境样品或其任意组合。dna样品可包括来自患者的生物流体、组织和细胞中的一种或多种。例如,dna样品可以取自或包括血液、尿液、脑脊髓液、胸膜液、羊水、精液、唾液、骨髓、活检样品或其任意组合。
dna样品可包括来自目标细胞的dna。目标细胞可以变化,并且在一些实施方案中表达恶性表型。在一些实施方案中,目标细胞可包括肿瘤细胞骨髓细胞、癌细胞、干细胞内皮细胞、病毒感染的病原体细胞、寄生生物体细胞或其任意组合。
片段化的双链多核苷酸片段的长度可以为200个碱基至1000个碱基。当在框310处接收包括片段化的双链多核苷酸片段的流动池114,方法300进行至框315,其中将双链多核苷酸片段桥扩增至附接于流动池(例如流动池114)的一个或多个通道的内表面的双链多核苷酸片段簇。流动池的一个或多个通道的内表面可以包括两种类型的引物,例如第一引物类型(p1)和第二引物类型(p2),并且dna片段可以通过熟知的方法扩增。
在流动池114内生成簇之后,方法300可以开始边合成边测序过程。边合成边测序过程可以包括确定单链多核苷酸片段的簇的核苷酸序列。为了确定具有序列5’-p1-f-a2r-3’的单链多核苷酸片段的簇的序列,可以添加具有序列a2f(其是序列a2r的互补序列)的引物,并在框320处用具有0个、1个或2个标签的核苷酸类似物通过dna聚合酶延伸以形成生长引物-多核苷酸。
在每个测序循环期间,可以添加四种类型的核苷酸类似物并将其掺入生长的引物-多核苷酸中。四种类型的核苷酸类似物可以具有不同的修饰。例如,第一类型的核苷酸可以是不与任何荧光标记缀合的脱氧鸟苷三磷酸(dgtp)的类似物。第二类型的核苷酸可以是经由接头与第一类型的荧光标签缀合的脱氧胸苷三磷酸(dttp)的类似物。第三类型的核苷酸可以是经由接头与第二类型的荧光标签缀合的脱氧胞苷三磷酸(dctp)的类似物。第四类型的核苷酸可以是经由一个或多个接头与第一类型的荧光标签和第二类型的荧光标签缀合的脱氧腺苷三磷酸(datp)的类似物。接头可包含一种或多种裂解基团。在随后的测序循环之前,可以从核苷酸类似物中去除荧光标签。例如,将荧光标签附接至核苷酸类似物的接头可以包含叠氮化物和/或烷氧基基团,例如在相同的碳上,使得接头可以在每次掺入循环后被膦试剂裂解,从而从随后的测序循环中释放荧光标签。
核苷酸三磷酸可以在3’位置处被可逆地阻断,使得控制测序,并且每个循环中每个延伸的引物-多核苷酸上可以添加不超过一个核苷酸类似物。例如,核苷酸类似物的3’核糖位置可以包含烷氧基和叠氮基官能团,其可以通过用膦试剂裂解去除,从而产生可以进一步延伸的核苷酸。在掺入核苷酸类似物之后,射流系统104可以洗涤流动池114的一个或多个通道,以便去除任何未掺入的核苷类似物和酶。在随后的测序循环之前,可以去除可逆的3’嵌段,从而可以将另一种核苷酸类似物添加到每个延伸的引物-多核苷酸上。
在框325处,激光器诸如激光器120可以在预定的波长处激发两个荧光标签。在框330处,可以检测来自荧光标签的信号。检测荧光标签可以包括例如通过使用两个过滤器的检测器126在两个荧光图像中捕获第一波长和第二波长处的荧光发射。第一荧光标签的荧光发射可以在第一波长处或周围,且第二荧光标签的荧光发射可以在第二波长处或周围。可以存储荧光图像以供以后离线处理。在一些实施方案中,可以处理荧光图像以实时确定每个簇中生长的引物-多核苷酸的序列。
在在线实时荧光成像处理中,可以在框335处理包含检测到的荧光信号的荧光图像,并且可以确定掺入的核苷酸的碱基。对于确定的每个核苷酸碱基,可以在框340处确定质量评分。可以在决策框345处确定是否基于例如信号的质量或在预定数量的碱基之后检测更多的核苷酸。如果要检测更多的核苷酸,则可以在框320处进行下一个测序循环的核苷酸确定。在一些实施方案中,标记的核苷酸可以添加到对应于簇的dna链的一端。标记的核苷酸也可以添加到对应于簇的dna链的另一端。dna链的一端上的读段通常称为读段1组,而dna链的另一端上的读段通常称为读段2组。允许确定来自单个多核苷酸双链体上的两个位置的序列的两个或更多个读段的测序技术被称为配对末端(pe)测序。来自单个多核苷酸双链体上的两个位置的序列的两个或更多个读段被称为读段1组、读段2组等。配对末端测序已在美国专利申请no.14/683,580中描述;其内容通过引用整体并入本文。配对末端方法的优点在于,从单个模板对两个链段进行测序,相比以随机方式对两个独立模板中的每一个进行测序,可获得更多的信息。
在下一个测序循环之前,可以从核苷酸类似物中去除荧光标签,并且可以去除可逆的3’嵌段,使得可以将另一种核苷酸类似物添加至每个延伸的引物-多核苷酸上。在处理完所有荧光图像之后,方法300可以在框350处终止。
碱基识别
碱基识别可以指确定掺入正在测序的生长引物-多核苷酸簇中的核苷酸的碱基为鸟嘌呤(g)、胸腺嘧啶(t)、胞嘧啶(c)或腺嘌呤(a)的过程。图4是用于利用测序系统100进行碱基识别的示例方法400的流程图。在图3所示的框335处处理检测到的信号可以包括进行方法400的碱基识别。在框405处开始之后,可以使用激光器生成预定波长的光。所生成的光可以在框410处照射到核苷酸类似物上。例如,计算机系统106通过其光学系统接口212和通信通道108a可以使激光器120生成预定波长的光。
激光器生成的光可以照射到核苷酸类似物上,所述核苷酸类似物合并入附接至流动池(例如流动池114)的一个或多个通道的内表面上的生长引物-多核苷酸中的核苷酸类似物上。引物-多核苷酸可以包括与测序引物杂交的单链多核苷酸片段的簇。核苷酸类似物各自可包含0个、1个或2个荧光标签。两个荧光标签可以是第一荧光标签和第二荧光标签。荧光标签在被激光器生成的光激发后,可以发出荧光发射。例如,第一荧光标签可以在第一波长处产生荧光发射,其可以在例如第一荧光图像中被捕获。第二荧光标签可以在第二波长处产生荧光发射,其可以在例如第二荧光图像中被捕获。
核苷酸类似物可包括第一类型的核苷酸、第二类型的核苷酸、第三类型的核苷酸和第四类型的核苷酸。第一类型的核苷酸,例如脱氧鸟苷三磷酸(dgtp)的类似物,不缀合至第一荧光标签或第二荧光标签。第二类型的核苷酸,例如脱氧胸苷三磷酸(dttp)的类似物,可以与第一类型的荧光标签缀合,而不是与第二类型的荧光标签缀合。第三类型的核苷酸,例如脱氧胞苷三磷酸(dctp)的类似物,可以与第二类型的荧光标签缀合,而不与第一类型的荧光标签缀合。第四类型的核苷酸,例如脱氧腺苷三磷酸(datp)的类似物,可以与第一类型的荧光标签和第二类型的荧光标签两者缀合。
在框415处,可以使用至少一种检测器检测核苷酸类似物在第一波长和第二波长处的荧光发射。例如,检测器126可以捕获两个荧光图像,第一波长处的第一荧光图像和第二波长处的第二荧光图像。在从光学系统102接收到两个荧光图像之后,核酸碱基确定器216可以确定两个荧光图像中荧光发射的存在或不存在。
由于第一类型的核苷酸不与第一荧光标签或第二荧光标签缀合,第一类型的核苷酸在第一波长处或在第二波长处不能产生或产生最小的荧光发射。在决策框420处,如果未检测到荧光发射,则可以确定核苷酸是第一类型的核苷酸,例如dgtp。如果检测到任何或多于最小的荧光发射,则方法400可以进行至决策框425。
由于第二类型的核苷酸与第一类型的荧光标签缀合而不与第二类型的荧光标签缀合,第二类型的核苷酸可以在第一波长处产生荧光发射而在第二波长处不产生或产生最小荧光发射。在决策框425处,如果在第二荧光图像中没有检测到第二波长处的荧光发射,并且从决策框420,在第一波光图像中检测到第一波长处的荧光发射,则核苷酸可以被确定为第二类型的核苷酸,例如dttp。如果在第二波长处检测到荧光发射,则方法400可以进行至决策框430。
由于第三类型的核苷酸与第二类型的荧光标签缀合而不与第一类型的荧光标签缀合,所以第三类型的核苷酸可以在第二波长处产生荧光发射而在第一波长处没有产生或产生最小的荧光发射。在决策框430处,如果在第一荧光图像中没有检测到第一波长处的荧光发射,并且从决策框425处,在第二荧光图像中检测到第二波长处的荧光发射,则核苷酸可以被确定为第三类型的核苷酸,例如dctp。
由于第四类型的核苷酸与第一类型的荧光标签和第二类型的荧光标签两者缀合,所以第四类型的核苷酸可以在第一波长处或第二波长处产生荧光发射。在决策框430处,如果在第一荧光图像中在第一波长处检测到荧光发射,并且从决策框425处,可以在第二荧光图像中在第二波长处检测到荧光发射,则核苷酸可以被确定为第四类型的核苷酸,例如datp。
流动池114可以包括待测序的生长引物-多核苷酸的簇。在决策框435处,对于给定的测序循环,如果还存在至少一个具有荧光发射的簇待处理,则方法400可以在框410处继续。如果没有更多单链多核苷酸簇待处理,则方法400可以在框440处结束。
测序方法
本文描述的方法可以与多种核酸测序技术结合使用。特别适用的技术是其中核酸附接在阵列中的固定位置使得它们的相对位置不改变并且其中阵列被重复成像的那些。其中在不同颜色通道中获得图像(例如,其与用于将一种核苷酸碱基类型与另一种核苷酸碱基类型区分开的不同标签相一致)的实施方案是特别适用的。在一些实施方案中,确定靶核酸的核苷酸序列的过程可以是自动化过程。优选的实施方案包括边合成边测序(“sbs”)技术。
“边合成边测序(“sbs”)技术”通常涉及通过针对模板链迭代添加核苷酸来酶促延伸新生核酸链。在sbs的传统方法中,可以在每次递送中在聚合酶存在下将单个核苷酸单体提供给靶核苷酸。然而,在本文所述的方法中,可以在递送中在聚合酶存在下向靶核酸提供一种以上类型的核苷酸单体。
迭代比对和变异识别
图5a和图5b示出了根据一个实施方案的示例迭代比对和变异识别过程。在对一定数量的最小测序循环进行成像后,可以进行实时初步分析,以确定每个未比对读段的碱基识别和质量评分。在图5a中,显示的最小测序循环数是3。在一些实施方案中,最小测序循环可以是16、32或更多个循环。以上参照图3说明了碱基识别和质量评分确定。每个读段可以选择最可能的比对以比对至参考序列,然后读段可以堆叠在堆积(pile-up)中并且可以进行变异识别。
在图5a中,主要分析包括从流动池上显示的16个簇确定未比对的序列读段,诸如cca504a、tta504d和tag504k。在一级分析标题下,每个簇表示为一行字母,每个字母代表经测序的多核苷酸。当对最小循环数(如3个循环)进行测序,二级分析可以包括将16个序列读段与图5a中的二级分析标题下所示的参考序列(gattacataagattctttcatcg508)进行比对。在二级分析图中,在参考序列下比对的序列构成了多核苷酸的堆积。作为一个实例,序列读段cca504a(“一级分析”标题下的第1行)、tta504d(第4行)和tag504k(第11行)可以分别比对至参考序列508的ttacat512子序列内的序列aca、tta和tac,其分别具有1个、0个和1个错配。因此,ttacat512子序列的第三位置可以具有一定的正确概率地被确定为c516a而不是参考序列508中的a,并且ttacat512子序列的第四位置可以具有一定的正确概率地被确定为g516b而不是参考序列中的c。可以类似地确定参考序列的其他变异。
当进行新的测序循环并确定碱基识别时,可以改进比对概率,并且读段比对可以转变到新的最可能的比对。这种转变将触发在受影响的区域中进行新的变异识别。在图5b中,在第四测序循环之后,来自第三测序循环的测序读段cca504a、tta504d和tag504k分别变为ccat504a’(“一级分析”标题下的第1行)、ttac504d’(第4行)和tagg504k’(第11行)。序列读段ccat504a’和ttac504d’仍然可以与参考序列508的ttacat512子序列比对,分别具有1个和0个错配。对于序列读段ccat504a’和ttac504d’,比对位置在图5a所示的迭代和图5b所示的迭代之间不改变;ttacat512子序列的第三位置可以确定为c516a而不是参考序列中的a。为了使读段tagg504k’比对至ttacat512子序列,需要两个错配。然而,序列读段tagg504k’可以以更高的概率比对至参考序列508的taag520,是因为该比对仅具有一个错配。图5a和图5b的实例示出比对位置可以随着测序运行进行转变,并且可以改善变异识别。
在一个实施方案中,将序列读段与参考序列比对包括对于每个序列读段将最可能比对的列表保持为节点上的叶。每个叶可以具有相关的概率。可以修剪具有低于某个阈值的概率的叶。
实时二级分析
图6是用于进行实时二级序列分析的示例方法600的流程图。在方法600在框605开始之后,可以在框610处接收测序循环的成像数据。例如,计算机系统106可以从检测器126接收成像数据。在框615处,可以确定碱基并且可以确定碱基的质量评分。参考图3-图4,说明了生成成像数据并确定所确定的碱基和质量。在每个测序循环后,测序读段的长度变为长一个核苷酸。例如,在第31个测序循环后,测序读段的长度为31个核苷酸,并且在第32个测序循环后,测序读段变为长一个核苷酸至长度为32个核苷酸。
在决策框620处,可以确定是否已经进行了一定数量的最小测序循环。最小测序循环可以是16、32或更多个循环。如果进行的测序循环的数量低于所需的最小测序循环,则方法600进行至框610。如果进行的测序循环的数量至少是所需的最小测序循环,则方法600进行至框625。
在框625处,确定的序列读段可以比对至参考序列。方法600可以在不同的实施方式中使用不同的比对方法。比对方法的非限制性实例包括全局比对(诸如needleman–wunsch算法)、局部比对、动态编程(诸如smith–waterman算法)、启发式算法或概率方法、渐进方法、迭代方法、基序发现或谱分析、遗传算法、模拟退火、成对比对、多序列比对。
在框630处,可以确定变异。只有在达到预定的变异阈值之后,才可以识别初始变异。由于可能的pcr或测序错误,变异阈值可能是重要的。变异阈值可以基于与参考序列位置的碱基比对(不同于参考序列的对应位置处的碱基)。
在图5a中,变异阈值是一个观察值。因此,ttacat的第三位置可以被确定为参考序列中的c而不是a。如果变异阈值是两个或更多,则在特定测序循环的框630处不会识别c变异。在图5b中,如果变异阈值最多是两个观察值,则ttacat的第三位置可以被确定为参考序列中的c而不是a。在一些实施方案中,变异阈值可以是对比至参考序列的特定位置的所有碱基的百分比,诸如1%、5%、10%、25%、50%或更大。如下面进一步详细描述的,对于每个序列读段,最可能的比对可以作为叶存储在节点上。每个叶可以具有相关的概率。可以修剪具有低于某个阈值的概率的叶。因此,在参考序列上识别核苷酸位置的变异可以被改进或者可以在随后的循环期间减少。
可以在决策框635处确定是否有更多的核苷酸待读取或是否所有测序循环完整。该确定可以基于例如信号的质量或者在预定数量的碱基之后。如果有更多的核苷酸待读取并且并非所有测序循环都完整,则方法600进行至框610,其中可以为下一个测序循环生成测序数据。如果没有更多的核苷酸待读取并且所有测序循环都完整,则方法600在框650处结束。
在一些实施方案中,可以在已经进行最小数量的测序循环之后并行地进行框625和框630以及框610和框615。例如,在进行32个测序循环之后,该方法可以进行至框625以进行长度为32个核苷酸的序列读段的比对。虽然方法600在框625进行比对并且在框630处进行变异识别,但是可以进行下一个测序循环(即,第33个测序循环)。因此,可以在完成第33个测序循环之前在框630处确定变异。并且方法600可以在进行测序循环时,实时地(或以零或低延时地)实现比对和变异识别。此外,可以在后续循环期间改进在早期测序循环期间识别的变异。因此,图6中所示的变异识别可以是迭代过程。例如,在第32个测序循环后或在第33个测序循环期间识别的变异可以是识别的初始变异。在随后的测序循环期间,可以改进所识别的变异(包括在特定核苷酸位置上先前识别的变异不再被识别和减少)。作为另一个实例,如图5a和图5b所示,ttacat的第四个位置的变异在第三个循环之后被识别为g,而在第四个位置之后没有识别该位置的变异。
在另一个实施方案中,可以在所有测序循环完整之前终止测序过程。例如,如果在完成所有测序循环之前鉴定出特定的靶变异,则测序过程可以终止。这使得该系统比在进行靶变异识别之前需要完成所有循环的系统节省试剂成本并且更早地提供期望的结果。
在一些实施方案中,比对可以不在框625处执行,并且在每个测序循环在框630处识别变异。可以进行比对,并且每个第n个测序循环识别变异,其中n是1、2、3、4、5、10、20或更多个测序循环。在一些实施方案中,在框625处进行的比对和在框630处识别的变异的频率可以基于在先前的测序循环中识别的变异的数量。例如,如果在一个测序循环中识别大量变异,则可以更频繁地(例如,下一个循环)或更不频繁地进行比对和变异识别。作为另一个实例,如果在一个测序循环中没有识别变异或没有识别新变异,则可以更频繁地或更不频繁地进行比对和变异识别(如,不是下一个循环)。
在一些实施方案中,可以对于参考序列的区域选择性地进行框630处的变异识别。参考序列的比对部分在不同的实施方式中可以是不同的。例如,对于参考序列的区域,可以选择性地进行变异识别,其中序列读段与参考序列的比对在先前的测序循环(如,紧邻的先前测序循环)期间已经改变。作为另一个实例,可以基于已知的单核苷酸多态性(snp)位置确定参考序列的比对区域。
在一些实施方案中,用于进行实时二级序列分析的方法600可以基于每个读段的树结构。树根可以用“$”标记,表示序列的开始。根的子节点对应于四个可能的碱基识别:‘a’、‘c’、‘g’和‘t’。树中的每个节点都可以有三个与之关联的变量:从根通至此节点的当前分支的序列的差异总数(称为序列s)、来自当前读段的碱基(称为序列w)、以及用于与序列s匹配的参考中的所有位置的参考序列的burrows-wheeler变换(bwt)中的开始和停止指数。bwt的一个重要特性是保证具有共同起始序列的所有行在变换中是连续的,而不是将各个指数的列表保持在与序列s匹配的参考中,这足以追踪起始和停止指数。因为存在非常多的重复区域,这在将读段作图至人类参考基因组的情况下是有价值的。
然后,根的每个子节点也将具有其自己的4个子节点,也对应于四个可能的碱基‘a’、‘c’、‘g’和‘t’。同样,可以追踪与当前读段的序列的差异的数量w。例如,如果前两个循环的读段是‘c’然后是‘t’,则读段可以具有通过由根->c->t定义的树的路径。因此,对于最后的t节点,总累积差将为零。相反,对于由根->a->g定义的路径,g节点处的总累积差将为2,这是因为a和g都不匹配当前读段中的对应循环。
在一些实施方案中,可以定义与可接受的参考的差异数量的限值。一旦达到该限值,该分支就会死亡,并且在后续循环中将不再对其进行分析。具有适当指数的bwt变换可用于在常量o(1)时间内进行每个节点所必需的计算。计算所需的存储器的数量以及树中的节点数受允许的错误阈值总数的影响。在一些实施方案中,可以实现对小插入和缺失的支持。
在一些实施方案中,将通过多个种子处理更复杂的重排。也就是说,如果发现特定读段在任何地方都不匹配,则该过程可以在稍后的某些循环再次开始,期望读段的另一部分将作图至某处。可以追踪所有这些读段,并且当存在可用的计算能力时,可以进行更复杂的分析(如,像smith-waterman算法的动态编程方法)。
可替代的实施方案
另外的实施方案是用于二级分析的系统和方法,其包括对测序读段的迭代处理。二级分析可以包括序列读段与参考序列(如,人类参考基因组序列)的比较,并利用该比对来检测样品和参考之间的差异,诸如变异检测和识别。在一个实施方式中,可以在测序仪完成运行之前获得比对和变异识别结果。例如,可以根据可用的计算资源按时间间隔提供这些结果。这可以通过使用来自当前迭代的比对结果来扩展来自先前迭代的中间比对结果来实现。通过将当前迭代的新测序的碱基与先前比对的位置处的参考序列的碱基进行比较,产生来自当前迭代的比对结果。比较结果与来自先前迭代的比对结果相结合,并且结合的输出被存储用于下一次迭代。
图7a和图7b是将传统的二级分析方法(图7a)与本公开的实施方案的二级分析(图7b)进行比较的示意图。图7a说明对于传统的二级分析方法,比对直到读段中的全套碱基被测序才进行。比对过程可以包括多个比对处理步骤。第一比对处理步骤等待读段中的全套测序碱基可用。在比对过程完成之后,可以开始变异识别器过程,其包括多个变异识别器处理步骤。第一变异识别器处理步骤等待全套比对数据可用。
图7b说明了根据本公开的一个实施方案的二级分析的迭代方法。如所示,比对和变异识别实时运行并生成临时结果。可以按固定间隔安排处理。固定间隔可以包括n个碱基的子序列的到达,其中n是正整数,诸如16。例如,处理可以以16个碱基的间隔发生。作为另一个实例,处理可以以1、2、4、8、16、32、64、128、151或更多个碱基的间隔发生。在一个实施方式中,处理可以以1至152之间的任意数量的间隔发生,最优选地以16+/-8的间隔发生。在一个实施方案中,间隔可以从一次迭代改变到另一次迭代。如图8所示,测序系统,诸如图1中的测序系统100,可以以16个碱基的间隔生成序列读段。可替代地,每个处理间隔中的碱基数可以不同。例如,在对16个碱基进行测序后可以处理第一间隔,并且可以在对18个碱基进行测序后处理第二次迭代。迭代中的碱基数可以低至1或高至读段中碱基的数量。
当使用配对的末端测序技术时,图7b中描述的过程可以应用于读段1组或读段2组。另外,在处理读段1组时捕获的信息可以应用于读段2组。例如,可能的是在对读段1组进行测序期间或之后使用常规方法执行比对步骤,并且该信息可以用于在对读段2多核苷酸进行测序时处理读段2组。
现在参考图8,可以从测序仪器产生单链多核苷酸的多个读段804a-804d。这些单链多核苷酸的长度可以是151个碱基,称为碱基0至碱基150。这些单链多核苷酸的序列可以通过上述边合成边测序来确定。在16个测序循环的迭代0(第一次迭代)之后,通过测序系统确定16个碱基的序列读段。例如,对于读段0(804a,)生成碱基0至碱基15的序列读段,并且对于读段1(804b)确定碱基0至碱基15的序列读段等。在另一16个测序循环的迭代1(第二次迭代)之后,为每个读段确定16个额外的序列碱基。例如,为读段0(804a)生成碱基16至碱基31。测序系统可以继续以16个间隔间隔生成读段,直到在迭代8处生成每个簇的碱基128至碱基143的序列读段。测序系统可以在迭代9(最后一次迭代)处生成每个簇的碱基144至碱基151的读段。在一个可替代的实施方案中,在每次迭代时生成的碱基数可以不同,每次迭代的碱基数由可用计算资源确定。例如,第一处理间隔可以由16个碱基组成,而第二处理间隔可以由18个碱基组成。处理间隔中最小的碱基数是1,并且处理间隔中最大的碱基数等于读段的长度。
参考图7b,如所示,比对可以以16个碱基的间隔发生。变异识别可以在比对完成后以16的间隔发生。例如,用于实时二级分析的测序系统每1.3小时可输出16个碱基的序列读段。对于读段-时间的二级分析,进行比对和变异识别所需的总时间应在1.3小时内,以便用户可以访问在序列读段的下一个16个碱基可用之前进行的变异识别。
在一个实施方案中,处理可以在可用的计算机资源上尽可能快地连续发生,没有固定的迭代步骤。分析可以自我调整,并尽可能接近测序进度。比对和变异识别结果可以随时按需生成。
可替代的实施方案-比对
图9a是用于进行实时二级分析的示例方法900的流程图。方法900包括两个路径:传统二级分析方法的低置信度、高计算处理路径和根据本公开的一个实施方案的高置信度、低计算处理路径。低置信度、高处理路径以及高置信度、低处理路径在本文中分别称为蓝色路径和黄色路径。
低置信度、高计算处理路径可包括每个读段比对至参考序列的序列。对于该路径,来自读段的可用迭代的所有碱基用于将读段比对至参考序列。例如,如果迭代0和迭代1各自由16个碱基组成,则比对器将处理32个碱基。许多常见的比对技术之一可以用于低置信度、高计算路径。一旦序列比对完成,就可以存储作图和比对位置并进行评分。在所有读段比对后,可以识别变异。
方法900通过添加高置信度、低计算处理路径来改进传统的二级分析方法。在迭代0处,方法900等待多个测序循环完成以生成每个读段的多个碱基。例如,方法900可以等待16个测序循环完成以生成每个读段的16个碱基。在迭代0期间,按照低置信度、高计算处理路径分析和处理每个读段的16个碱基。传统方法在本文中称为蓝色路径。在迭代1和任何后续迭代期间,按照低置信度、高计算处理路径或高置信度、低计算处理路径分析每个读段的接下来的16个碱基。如果读段在紧邻的先前迭代中以足够的置信度比对,则按照高置信度、低计算处理路径分析当前迭代的16个碱基。否则,按照高置信度、低计算处理路径分析当前迭代的16个碱基。
如果读段在紧邻的先前迭代中以足够的置信度比对,则当前迭代的16个碱基与参考序列的接下来的16个碱基比对。这种比对在本文中被称为简单比对,与常见的序列比对相比,它需要更少的处理。代替与整个参考序列的序列比对,可以确定当前迭代的16个碱基与参考序列的接下来的16个碱基之间的错配数。如果错配数高于阈值,则16个碱基的处理可以返回到低置信度、高计算处理路径。在返回低置信度、高处理路径时,比对(isaligned)变量可以设置为0或错误。可以相对于当前迭代的16个碱基或当前迭代和先前一次或多次迭代的所有碱基确定错配数。
如果错配数低于阈值,则16个碱基的处理可以保持在高置信度、低计算处理路径中,并且可以存储特定读段的比对结果。可以制定替代度量以确定比对(isaligned)变量是否设置为0或错误。例如,如果错配数低于阈值,则可以计算(作图质量)mapq评分。mapq评分可以等于-10log10pr{作图位置错误},四舍五入到最接近的整数。因此,如果正确作图一些随机读段的概率为0.99,则mapq评分应为20(即log10为0.01*-10)。如果正确匹配的概率增加到0.999,则mapq评分将增加到30。相反,由于正确匹配的概率趋于零,mapq评分也是如此。
当16个碱基的处理保持在高置信度、低计算处理路径中时,读段可以有助于堆积(当多个读段比对至参考序列的相似位置时,使得这些读段彼此“堆积”在参考序列顶部上。当16个碱基的处理返回到低置信度、高计算处理路径时,读段可以从堆积中移除。在一个实施方案中,只有当候选物的数量、序列比对位置的总数低于阈值诸如1000时,才在低置信度、高计算处理路径中处理读段。当处理读段时,存储比对的结果。
图9b是使用图9a中所示的方法900由两个处理路径处理的数据量的概念图。在16个测序循环之后,通过测序系统生成每个读段的16个碱基。读段全部在迭代0期间在低置信度、高计算处理路径中处理。在32个测序循环之后,在迭代1之后约75%的候选物被认为是比对的(aligned)。这些候选物在迭代2期间在高置信度、低计算处理路径中处理。在迭代2之后,大约90%的候选物被认为是比对的(aligned)并且在迭代3期间在高置信度、低计算处理路径中处理。当在高置信度、低计算处理路径中处理读段时,需要较少的计算和处理,这是因为只需要简单的比对。由于在高置信度、低计算处理路径中处理大量数据并且在该路径中需要更少的处理,所需的总时间低于仅在低置信度、高计算处理路径中处理读段的情况。因此,可以在测序仪完成运行之前获得比对和变异识别结果。可以根据可用计算资源按时间间隔向用户提供这些结果。因此,方法900可以以时间有效的方式进行二级分析以实现实时二级分析。
图9c示出了图10中描述的比对器的预测运行时间改进。仅使用图10中的“现有处理”(常规或蓝色路径)生成“碱基”数据。“加载读段1”数据示出了当来自读段1组的数据被比对、预先存储、然后用以加速读段2组中的数据处理时的减少的处理循环。方法900可以实现两种类型的用于高置信度、低计算处理路径的简单比对器中的一种:跳过精确匹配的简单比对器或跳过单个错配的简单比对器。跳过单个匹配的简单比对器允许0个或1个错配。“跳过精确匹配”数据示出了当如果当前迭代的16个碱基与参考序列的16个碱基在先前确定的参考位置处完全匹配,就跳过常规(蓝色)路径时减少的处理循环。“跳过单一错配”数据显示当如果当前迭代的16个碱基在先前确定的参考位置处比对至参考序列的16个碱基且具有至多1个错配就跳过常规(蓝色)路径时减少的处理循环。图9c示出了与基线相比,当方法900利用在高置信度、低计算处理路径中检测到单个错配,就跳过常规处理的简单比对器时,运行时间减少三倍。请注意,这些数字是由原型处理器生成,所述原型处理器不包括所有处理步骤并因此是预期的预测。
图10是用于进行实时二级分析的示例方法1000的另一流程图。图9a中所示的方法1000和方法900可以实现相同的低置信度、高计算处理路径和不同的高置信度、低计算处理路径。方法1000的高置信度、低计算处理路径在简单比对之后生成mapq评分并且使用mapq评分来确定是否在高置信度、低计算处理路径中继续处理或返回到低置信度、高处理路径。
高百分比的运行时间发生在小百分比的读段上。在一个实施方案中,如果使用度量所确定的成功置信度低,则方法900或1000的低置信度、高计算处理路径可以跳过比对和存储步骤。在一个实施方案中,可以生成度量,其指示子序列可以比对至参考序列的候选位置的数量。如果候选物质数量很高,比对成功的置信度将是低的。在第二个实施方案中,如果序列中碱基的多样性低,则比对成功的置信度是低的。碱基的多样性可以例如通过计算子序列中的独特n聚体的数量来确定,其中n聚体是子序列中的碱基序列,其长度小于或等于子序列本身的长度。
可替代的实施方案–变异识别器
图11a和图11b示出了现有变异识别方法,strelka小的变异识别器(图11a)和本公开的变异识别方法(图11b)的简化流程图。图11a示出了小的变异识别器使用从比对器生成的堆积信息作为输入。从堆积中,小的变异识别器鉴定被称为活性区域的序列变异区域。接下来,可以将从头重新组装应用于活性区域。在每个基因组位置,生成概率用以确定基因组位置处的测序的多核苷酸为a、c、t或g的可能性。根据这些概率,可以检测变异。
图11b示出了如本发明中公开的变异识别器的实施方案。在该实施方案中,生成度量用以确定是否可以高置信度地确定基因组位置处的多核苷酸。例如,如果给定基因组位置处的所有多核苷酸都相同,则可以生成高置信度决策。或者,如果基因组位置处相同类型的多核苷酸的数量高于阈值,则可以生成高置信度决策。还可以实现用于确定高置信度的替代度量。如果可以以高置信度确定多核苷酸,则可以跳过概率的公式并且可以执行简单的变异识别步骤。例如,简单的变异识别器可以识别以高置信度检测的任何变异。
现有变异识别方法的概率生成步骤和变异识别步骤可以组合需要高达40%的变异识别器的计算和处理。图11b示出了变异识别方法1100,其实现了现有变异识别方法的低置信度、高计算处理路径和高置信度、低计算处理路径。通过添加高置信度、低计算处理路径,strelka变异识别器得到优化,并且处理降低了近40%。可以将高置信度、低计算处理路径添加到可替代的变异识别器。
如图7b所示,可以在迭代处理窗口内执行变异识别器。图11a或图11b的变异识别器可以在迭代处理窗口内迭代地执行。另外,可以在迭代处理窗口内执行多于一种类型的变异识别器。例如,小的变异识别器,如strelka,以及可替代的变异识别器,诸如结构变异识别器或拷贝数变异识别器,可以在迭代处理窗口内执行。
在至少一些先前描述的实施方案中,实施方案中所使用的一个或多个要素可以互换地用于另一个实施方案中,除非这种替换在技术上不可行。本领域技术人员将理解,在不脱离所要求保护的主题的范围的情况下,可以对上述方法和结构进行各种其他省略、添加和修改。所有此类修改和变化都旨在落入由所附权利要求限定的主题的范围内。
关于本文中基本上任何复数和/或单数术语的使用,本领域技术人员可以根据上下文和/或应用适当地从复数转换为单数和/或从单数转换为复数。为清楚起见,本文可以明确地阐述各种单数/复数排列。
本领域技术人员将理解,通常,本文并且尤其是所附的权利要求(如,所附权利要求的主题)使用的术语通常旨在作为“开放式”术语(如,术语“包括”应当被解释为“包括但不限于”,术语“具有”应该被解释为“至少具有”,术语“包括”应该被解释为“包括但不限于”等)。本领域技术人员将进一步理解,如果意图列举特定数量的引入的权利要求,则在权利要求中将明确地叙述这样的意图,并且在没有这样的叙述的情况下,不存在这样的意图。例如,作为对理解的帮助,以下所附权利要求可包含使用引导短语“至少一个”和“一个或多个”以引入权利要求叙述。然而,这些短语的使用不应被解释为暗示由不定冠词“一”或“一个”引入权利要求叙述将包含这种引入的权利要求叙述的任何特定权利要求限制于仅包含一个这样的叙述的实施方案,即使当相同的权利要求包括引入短语“一个或多个”或“至少一个”和不定冠词诸如“一”或“一个”(如,“一”和/或“一个”应解释为意指“至少一个”或“一个或多个”);对于使用用于引入权利要去叙述的定冠词也是如此。另外,即使明确地叙述了特定数量的引入的权利要求叙述,本领域技术人员将认识到,这种叙述应该被解释为意指至少所叙述的数字(如,仅详细叙述“两个叙述”而没有其他修饰语意指至少两个叙述或两个或多个叙述)。此外,在使用类似于“a、b和c等中的至少一个”的惯例的那些情况下,通常这样的构造意图与本领域技术人员将理解该惯例的一样(如,“具有a、b和c中的至少一个的系统”将包括但不限于具有单独的a、单独的b、单独的c、a和b一起、a和c一起、b和c一起和/或a、b和c一起等的系统)。在使用类似于“a、b或c等中的至少一个”的惯例的那些情况下,通常这样的构造意图与本领域技术人员将理解该惯例的一样(如,“具有a、b或c中的至少一个的系统”将包括但不限于具有单独的a、单独的b、单独的c、a和b一起、a和c一起、b和c一起和/或a、b和c一起等的系统)。本领域技术人员将进一步理解,实际上任何呈现两个或更多个替代术语的析取词和/或短语,无论是在说明书、权利要求书还是在附图中,都应该被理解为考虑包括这些术语之一、任何一个术语或两个术语的可能性。例如,短语“a或b”将被理解为包括“a”或“b”或“a和b”的可能性。
另外,在根据马库什组描述本公开的特征或方面的情况下,本领域技术人员将认识到,本公开也因此以马库什组的任何单个成员或成员子组的形式描述。
如本领域技术人员将理解的,出于任何和所有目的,就提供书面描述而言,本文所公开的所有范围还涵盖任何和所有可能的子范围及其子范围的组合。任何列出的范围可以容易地被识别为充分描述并且使得相同的范围被分解为至少相等的一半、三分之一、四分之一、五分之一、十分之一等。作为非限制性实例,本文讨论的每个范围可以容易地被分解为下三分之一、中三分之一和上三分之一等。如本领域技术人员还将理解,所有措辞诸如“高达”、“至少”、“大于”、“小于”以及类似措辞包括所述的数字并且指的是可以随后分解成如上所讨论的子范围的范围。最后,如本领域技术人员将理解,范围包括每个单独的成员。因此,例如,具有1-3个物品的组是指具有1、2或3个物品的组。类似地,具有1-5个物品的组是指具有1、2、3、4或5个物品的组,等等。
虽然本文已经公开了各种方面和实施方案,但是其他方面和实施方案对于本领域技术人员来说将是显而易见的。本文公开的各个方面和实施方案是出于说明的目的而不是限制性的,真正的范围和精神由所附权利要求指示。
- 还没有人留言评论。精彩留言会获得点赞!