用ERK抑制剂治疗鳞状细胞癌的制作方法
本申请要求于2016年6月20日提交的序号为62/352,533的美国临时申请、于2016年11月30日提交的序号为62/428,379的美国临时申请和于2017年5月8日提交的序号为62/502,996的美国临时申请的权益,每个申请均通过引用以其整体并入本文。
背景技术:
erk激酶是介导参与肿瘤生长、进展和转移的细胞内信号转导途径的丝氨酸/苏氨酸激酶。erk参与ras/raf/mek/erk途径,该途径通过中继来自配体结合的细胞表面受体酪氨酸激酶(rtk)如erbb(例如egfr、her-2等)、vegf、pdgf和fgf受体酪氨酸激酶的细胞外信号,从而在调节细胞过程中起到中心作用。rtk的活化触发了一系列磷酸化事件,其开始于ras的活化,随后是raf的补充和活化。活化的raf然后将map激酶激酶(mek)1/2磷酸化,后者随之将erk1/2磷酸化。mek引起的erk磷酸化,对于erk1发生在y204和t202处,对于erk2发生在y185和t183处(ahn等人,methodsinenzymology2001,332,417-431)。磷酸化的erk发生二聚化,易位至细胞核并在其中积累(khokhlatchev等人,cell1998,93,605-615)。在细胞核中,erk参与几种重要的细胞功能,包括但不限于核转运、信号转导、dna修复、核小体装配和易位,以及mrna加工和翻译(ahn等人,molecularcell2000,6,1343-1354)。erk2使众多调节蛋白质磷酸化,这些蛋白质包括蛋白激酶rsk90和mapkapk2(bjorbaek等人,1995,j.biol.chem.270,18848;rouse等人,1994,cell78,1027),以及转录因子如atf2、elk-1、c-fos和c-myc(raingeaud等人,1996,mol.cellbiol.16,1247;chen等人,1993,proc.natl.acad.sci.u.s.a.90,10952;oliver等人,1995,proc.soc.exp.biol.med.210,162)。总的来说,用生长因子处理细胞导致erk1和erk2的活化,这会导致增殖以及在一些情况下导致分化(lewis等人,adv.cancerres.1998,74,49-139)。
大量的研究已表明,在增殖性疾病如癌症中,遗传突变和/或ras/raf/mek/erk途径中的蛋白激酶的超表达会导致不受控制的细胞增殖和肿瘤的形成。例如,一些癌症包含突变,这些突变将导致由于连续产生生长因子使得该途径连续激活。另一些突变可导致活化的gtp结合的ras复合物的失活缺陷,同样导致map激酶途径的激活。突变的、致癌形式的ras在50%的结肠癌和>90%的胰腺癌以及许多其它类型的癌症中被发现(kohl等人,science1993,260,1834-1837)。最近,braf突变已经不止在恶性黑素瘤(60%)、甲状腺癌(大于40%)和结直肠癌中被发现。这些braf的突变导致了组成性活性的ras/raf/mek/erk激酶级联。对原发性肿瘤样品和细胞系的研究也已表明在胰腺癌、结肠癌、肺癌、卵巢癌和肾癌中存在ras/raf/mek/erk激酶途径的组成性或过度激活(hoshino,r.等人,oncogene1999,18,813-822)。此外,erk2已经显示在乳腺癌细胞的负生长控制中发挥作用(frey和mulder,1997,cancerres.57,628),人乳腺癌中erk2的超表达也已有报道(sivaraman等人,1997,jclin.invest.99,1478)。活化的erk2也涉及到内皮素刺激的气道平滑肌细胞的增殖,提示此激酶在哮喘中起作用(whelchel等人,1997,am.j.respir.cellmol.biol.16,589)。鉴于raf/ras/mek/erk途径中的众多上游(例如ras、raf)和下游(例如atf2、c-fos、c-myc)信号蛋白已涉及包括但不限于癌症的众多病症,因此erk已成为药物开发的主要目标。
癌症是导致人类死亡的第二大原因。全世界每年有数百万人死于癌症。仅在美国,癌症每年就造成超过50万人死亡,并且每年诊断出约170万例新病例(皮肤基底细胞癌和鳞状细胞癌除外)。鳞状细胞癌(scc)是一种在组织学上独特的癌症形式,其由异常鳞状细胞不受控制的生长引起。据估计,在美国每年诊断出100万例scc病例。已知某些疗法在某些患者群体中比在其他患者中更有效。了解这些药物反应性亚型对患者和医疗保健专业人员具有重要意义,以便避免对治疗进行试错法。
技术实现要素:
因此,迫切需要基于预测的患者群体对包括erk抑制剂治疗在内的特定治疗的敏感性或抗性来将患者分层成群体的方法。本公开内容通过评估指示会对erk抑制剂治疗有反应的患者群体的生物标志物来满足本领域的这种需求。与试错法相比,这提供了更及时和积极的治疗。本文的组合物和方法可用于治疗erk活性依赖性的疾病,如癌症。优选地,所述癌症为鳞状细胞癌,如肺鳞状细胞癌、食管鳞状细胞癌、头颈鳞状细胞癌或宫颈鳞状细胞癌。
在某些方面,本公开内容提供了治疗有需要的受试者中的鳞状细胞癌的方法,包括向所述受试者施用有效剂量的细胞外信号调节激酶(erk)抑制剂。所述受试者可包含展现出以下的基因组:(1)至少两种促分裂原活化蛋白激酶(mapk)途径基因的高于第一参考水平的第一总表达水平;(2)至少两种ras-erk反馈调节子的高于第二参考水平的第二总表达水平;和/或(3)至少一种mapk途径基因和至少一种ras-erk反馈调节子的高于第三参考水平的第三总表达水平,其中所述第一参考水平、所述第二参考水平和所述第三参考水平各自指示对所述erk抑制剂的低敏感性。
在某些方面,本公开内容提供了治疗患有鳞状细胞癌的受试者的方法,包括:(a)针对是否存在指示对erk抑制剂的敏感性的基因特征来筛选所述受试者;以及(b)如果确定所述基因特征存在,则向所述受试者施用所述erk抑制剂。所述方法可进一步包括如果确定所述基因特征不存在,则向所述受试者施加替代疗法,如化疗、免疫疗法、放疗或外科手术。在一些实施方案中,所述基因特征包括至少两种mapk途径基因的高于第一参考水平的第一总表达水平。在一些实施方案中,所述基因特征包括至少两种ras-erk反馈调节子的高于第二参考水平的第二总表达水平。在一些实施方案中,所述基因特征包括至少一种mapk途径基因和至少一种ras-erk反馈调节子的高于第三参考水平的第三总表达水平。在一些实施方案中,所述基因特征包括至少一种mapk途径基因的拷贝数扩增。在一些实施方案中,所述筛选包括对从所述受试者分离的核酸进行核酸分析。所述核酸可来自鳞状细胞癌细胞。
在某些方面,本公开内容提供了用erk抑制剂下调多个鳞状细胞癌细胞中的mapk信号传导输出的方法。所述方法可包括:(a)在包含来自所述受试者的核酸的生物样品中评估:(1)至少两种mapk途径基因的第一总表达水平,(2)至少两种ras-erk反馈调节子的第二总表达水平和/或(3)至少一种mapk途径基因和至少一种ras-erk反馈调节子的第三总表达水平。任选地,如果所述第一总表达水平高于第一参考水平、所述第二总表达水平高于第二参考水平和/或第三总表达水平高于第三参考水平,则所述方法进一步包括向所述多个细胞施用有效剂量的erk抑制剂,其中所述第一参考水平、所述第二参考水平和所述第三参考水平各自指示对所述erk抑制剂的低敏感性。
在某些方面,本公开内容提供了对受试者的鳞状细胞癌状态进行分类的方法,包括:(a)获得来自所述受试者的生物样品,所述样品包含来自所述受试者的鳞状细胞癌细胞的基因组和/或转录组物质;(b)评估:(1)所述样品中的至少两种mapk途径基因的第一总表达水平,(2)所述样品中的至少两种ras-erk反馈调节子的第二总表达水平,和/或(3)所述样品中的至少一种mapk途径基因和至少一种ras-erk反馈调节子的第三总表达水平;(c)基于以下生成表达谱:(1)所述第一总表达水平与第一参考水平之间的比较,(2)所述第二总表达水平与第二参考水平之间的比较,和/或(3)所述第三总表达水平与第三参考水平之间的比较,其中所述第一参考水平、所述第二参考水平和所述第三参考水平从来自具有已知鳞状细胞癌状态的不同受试者的参考样品获得;以及(d)基于所述表达谱对(a)的所述受试者的鳞状细胞癌状态进行分类。如果所述第一总表达水平高于所述第一参考水平,则所述鳞状细胞癌状态可被分类为可能对erk抑制剂治疗敏感,其中所述第一参考水平指示对所述erk抑制剂的低敏感性。如果所述第二总表达水平高于第二参考水平,则所述鳞状细胞癌状态可被分类为可能对erk抑制剂治疗敏感,其中所述第二参考水平指示对所述erk抑制剂的低敏感性。如果所述第三总表达水平高于第三参考水平,则所述鳞状细胞癌状态可被分类为可能对erk抑制剂治疗敏感,其中所述第三参考水平指示对所述erk抑制剂的低敏感性。在一些实施方案中,所述不同受试者的已知鳞状细胞癌状态被分类为对erk抑制剂抗性或者对erk抑制剂敏感。在一些实施方案中,所述分类步骤包括基于所述表达谱使用计算机系统计算所述受试者对erk抑制剂治疗有反应的可能性,其中针对所述第一总表达水平相对于所述第一参考水平的每个倍增、所述第二总表达水平相对于所述第二参考水平的每个倍增和所述第三总表达水平相对于所述第三参考水平的每个倍增,上调所述可能性,其中所述第一参考水平、所述第二参考水平和所述第三参考水平各自指示对所述erk抑制剂的低敏感性。所述方法可进一步包括制作包括所述受试者对所述erk抑制剂治疗有反应的可能性的预测的报告。
在某些方面,本公开内容提供了评估患有鳞状细胞癌的受试者对erk抑制剂治疗展现出临床有益反应的可能性的方法,所述方法包括:(a)在包含来自鳞状细胞癌细胞的基因组和/或转录组物质的生物样品中评估:(1)至少两种mapk途径基因的第一总表达水平,(2)至少两种ras-erk反馈调节子的第二总表达水平,和/或(3)至少一种mapk途径基因和至少一种ras-erk反馈调节子的第三总表达水平;以及(b)使用计算机系统计算erk抑制剂反应性的加权概率,所述计算基于:(1)所述第一总表达水平与第一参考水平之间的比较,(2)所述第二总表达水平与第二参考水平之间的比较,和/或(3)所述第三总表达水平与第三参考水平之间的比较,其中所述第一参考水平、所述第二参考水平和所述第三参考水平从一个或多个参考样品获得。所述方法可进一步包括如果所述加权概率对应于基线概率的至少1.5倍,则将所述受试者指定为有较高概率对所述erk抑制剂治疗展现出临床有益反应,其中所述基线概率代表在获得(b)的所述加权概率之前,所述受试者将对所述erk抑制剂治疗展现出临床有益反应的可能性。任选地,所述方法进一步包括向接受者传递关于所述可能性的信息。任选地,所述方法进一步包括基于所述加权概率提供建议。所述建议可包括用所述erk抑制剂治疗所述受试者。备选地,所述建议可包括中断治疗、化疗、免疫疗法、放疗或外科手术。本文所述的方法可进一步包括基于所述加权概率选择治疗。在一些实施方案中,所述方法进一步包括基于所述加权概率施用所述erk抑制剂。
在实践主题方法中的任一种时,所述第一总表达水平、所述第二总表达水平和/或所述第三总表达水平可通过检测由以下转录的mrna的水平来评估:所述至少两种mapk途径基因;所述至少两种ras-erk反馈调节子;和/或所述至少一种mapk途径基因和所述至少一种ras-erk反馈调节子。在一些实施方案中,所述第一总表达水平、所述第二总表达水平和/或所述第三总表达水平通过检测由以下转录的mrna的逆转录所产生的cdna的水平来评估:所述至少两种mapk途径基因;所述至少两种ras-erk反馈调节子;和/或所述至少一种mapk途径基因和所述至少一种ras-erk反馈调节子。在一些实施方案中,所述第一总表达水平、所述第二总表达水平和/或所述第三总表达水平通过检测由以下编码的多肽的水平来评估:所述至少两种mapk途径基因;所述至少两种ras-erk反馈调节子;和/或所述至少一种mapk途径基因和所述至少一种ras-erk反馈调节子。多肽水平的检测可包括至少一种选自以下的技术:免疫组织化学(ihc)、质谱分析、western印迹法、酶联免疫吸附测定(elisa)、免疫细胞化学、免疫荧光和流式细胞术。在一些实施方案中,所述第一总表达水平、所述第二总表达水平和/或所述第三总表达水平通过核酸扩增测定、杂交测定、测序或其组合来评估。所述核酸扩增测定、所述杂交测定或所述测序可使用来自所述受试者的核酸样品进行。核酸样品可包括选自基因组dna、cdna、ctdna、无细胞dna、rna和mrna的核酸,所述核酸任选地来自鳞状细胞癌细胞。在一些实施方案中,所述第一总表达水平、所述第二总表达水平和/或所述第三总表达水平使用
在实践主题方法中的任一种时,所述第一参考水平、所述第二参考水平和/或所述第三参考水平可通过在来自患有鳞状细胞癌的对所述erk抑制剂治疗展现出低敏感性的受试者的生物样品中评估以下的表达来获得:所述至少两种mapk途径基因;所述至少两种ras-erk反馈调节子;和/或所述至少一种mapk途径基因和所述至少一种ras-erk反馈调节子。在一些实施方案中,所述第一参考水平代表多个鳞状细胞癌样品中所述至少两种mapk途径基因的平均总表达水平。在一些实施方案中,所述第二参考水平代表多个鳞状细胞癌样品中所述至少两种ras-erk反馈调节子的平均总表达水平。在一些实施方案中,所述第三参考水平代表多个鳞状细胞癌样品中所述至少一种mapk途径基因和所述至少一种ras-erk反馈调节子的平均总表达水平。
在实践主题方法中的任一种时,所述至少两种mapk途径基因可由四种mapk途径基因、六种mapk途径基因或八种mapk途径基因组成。在一些实施方案中,所述至少两种mapk途径基因选自cdk4、cdk6、egfr、erk1、ccnd1、kras、erk2和hras。在一些实施方案中,所述至少两种mapk途径基因选自egfr、erk1、ccnd1、kras、erk2和hras。在一些实施方案中,所述至少两种mapk途径基因选自egfr、erk1、ccnd1和kras。在一些实施方案中,所述至少两种mapk途径基因选自egfr、erk1和ccnd1。在一些实施方案中,所述至少两种mapk途径基因选自egfr、erk1和kras。在一些实施方案中,所述至少两种mapk途径基因选自erk1和ccnd1。在一些实施方案中,所述至少两种mapk途径基因选自erk1和egfr。在一些实施方案中,所述至少两种mapk途径基因选自egfr和ccnd1。
在实践主题方法中的任一种时,所述至少两种ras-erk反馈调节子可由四种ras-erk反馈调节子或五种ras-erk反馈调节子组成。在一些实施方案中,所述至少两种ras-erk反馈调节子选自dusp5、dusp6、spry2、spry4和spred1。在一些实施方案中,所述至少两种ras-erk反馈调节子选自dusp5、dusp6、dusp2和dusp4。在一些实施方案中,所述至少两种ras-erk反馈调节子选自dusp5和dusp6。
在实践主题方法中的任一种时,所述至少一种mapk途径基因和所述至少一种ras-erk反馈调节子可选自egfr、erk1、ccnd1、kras、erk2、hras、dusp5、dusp6、dusp2、dusp4、spry2、spry4、spred1和craf。在一些实施方案中,所述至少一种mapk途径基因和所述至少一种ras-erk反馈调节子选自ccnd1、craf、dusp5、egfr、erk1和kras。
在某些方面,本公开内容提供了治疗有需要的受试者中的头颈鳞状细胞癌的方法,其包括向所述受试者施用有效剂量的细胞外信号调节激酶(erk)抑制剂。在一些实施方案中,所述受试者包含展现出以下的基因组:(1)areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的高于第四参考水平的第四总表达水平;(2)dcun1d1、pik3ca、prkci、sox2和tp63的低于第五参考水平的第五总表达水平;(3)大于0.1,如大于1的所述第四总表达水平与所述第五总表达水平的比率;和/或(4)大于0.1,如大于1的hif1a与tp63表达水平的比率,其中所述第四参考水平和所述第五参考水平各自指示对所述erk抑制剂的低敏感性。
在某些方面,本公开内容提供了治疗患有头颈鳞状细胞癌的受试者的方法,其包括:(a)针对是否存在指示对erk抑制剂的敏感性的基因特征来筛选所述受试者;以及(b)如果确定所述基因特征存在,则向所述受试者施用所述erk抑制剂。在一些实施方案中,所述方法进一步包括如果确定所述基因特征不存在,则向所述受试者施加替代疗法,如化疗、免疫疗法、放疗或外科手术。在一些实施方案中,所述基因特征包括areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的高于第四参考水平的第四总表达水平。在一些实施方案中,所述基因特征包括dcun1d1、pik3ca、prkci、sox2和tp63的低于第五参考水平的第五总表达水平。在一些实施方案中,所述基因特征包括areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的第四总表达水平与dcun1d1、pik3ca、prkci、sox2和tp63的第五总表达水平的比率。在一些实施方案中,所述基因特征包括hif1a与tp63表达水平的比率。在一些实施方案中,所述基因特征包括hif1a与tp63蛋白质水平的比率。所述筛选可包括对从所述受试者分离的核酸进行核酸分析,所述核酸任选地来自头颈鳞状细胞癌细胞。
在某些方面,本公开内容提供了用erk抑制剂下调多个头颈鳞状细胞癌细胞中的mapk信号传导输出的方法,其包括:(a)在包含来自所述受试者的核酸的生物样品中评估:(1)areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的第四总表达水平;(2)dcun1d1、pik3ca、prkci、sox2和tp63的第五总表达水平;(3)所述第四总表达水平与所述第五总表达水平的比率;和/或(4)hif1a与tp63表达水平的比率;以及(b)如果(1)所述第四总表达水平高于第四参考水平,(2)所述第五总表达水平低于第五参考水平,(3)所述第四总表达水平与所述第五总表达水平的比率大于1,和/或(4)hif1a与tp63的比率大于1,则向所述多个细胞施用有效剂量的所述erk抑制剂,其中所述第四参考水平和所述第五参考水平各自指示对所述erk抑制剂的低敏感性。
在某些方面,本公开内容提供了对受试者的头颈鳞状细胞癌状态进行分类的方法,其包括:(a)获得来自所述受试者的生物样品,所述样品包含来自所述受试者的鳞状细胞癌细胞的基因组和/或转录组物质;(b)在所述样品中评估:(1)areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的第四总表达水平;(2)dcun1d1、pik3ca、prkci、sox2和tp63的第五总表达水平;和/或(3)hif1a和tp63的表达水平;(c)基于以下生成表达谱:(1)所述第四总表达水平与第四参考水平之间的比较,(2)所述第五总表达水平与第五参考水平之间的比较,(3)所述第四总表达水平与所述第五总表达水平之间的比较,和/或(4)hif1a与tp63的表达水平之间的比较,其中所述第四参考水平和所述第五参考水平从来自具有已知鳞状细胞癌状态的不同受试者的参考样品获得;以及(d)基于所述表达谱对(a)的所述受试者的鳞状细胞癌状态进行分类。如果所述第四总表达水平高于所述第四参考水平,则所述鳞状细胞癌状态可被分类为可能对erk抑制剂治疗敏感,其中所述第四参考水平指示对所述erk抑制剂的低敏感性。如果所述第五总表达水平低于第五参考水平,则所述鳞状细胞癌状态可被分类为可能对erk抑制剂治疗敏感,其中所述第五参考水平指示对所述erk抑制剂的低敏感性。如果所述第四总表达水平与所述第五总表达水平的比率大于1,则所述鳞状细胞癌状态可被分类为可能对erk抑制剂治疗敏感。如果hif1a与tp63表达水平的比率大于1,则所述鳞状细胞癌状态可被分类为可能对erk抑制剂治疗敏感。任选地,所述分类步骤包括基于所述表达谱使用计算机系统计算所述受试者对erk抑制剂治疗有反应的可能性,其中针对所述第四总表达水平相对于所述第四参考水平的每个倍增上调所述可能性,并针对所述第五总表达水平相对于所述第五参考水平的每个倍增下调所述可能性,其中所述第四参考水平和所述第五参考水平各自指示对所述erk抑制剂的低敏感性。在一些实施方案中,所述方法进一步包括制作包括所述受试者对所述erk抑制剂治疗有反应的可能性的预测的报告。
在某些方面,本公开内容提供了评估患有头颈鳞状细胞癌的受试者对erk抑制剂治疗展现出临床有益反应的可能性的方法,所述方法包括:(a)在包含来自鳞状细胞癌细胞的基因组和/或转录组物质的生物样品中评估:(1)areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的第四总表达水平;(2)dcun1d1、pik3ca、prkci、sox2和tp63的第五总表达水平;和/或(3)hif1a和tp63的表达水平;以及(b)基于以下使用计算机系统计算erk抑制剂反应性的加权概率:(1)所述第四总表达水平与第四参考水平之间的比较,(2)所述第五总表达水平与第五参考水平之间的比较,(3)所述第四总表达水平与所述第五总表达水平之间的比较,和/或(4)hif1a与tp63的表达水平之间的比较,其中所述第四参考水平和所述第五参考水平从一个或多个参考样品获得。在一些实施方案中,所述方法进一步包括如果所述加权概率对应于基线概率的至少1.5倍,则将所述受试者指定为有较高概率对所述erk抑制剂治疗展现出临床有益反应,其中所述基线概率代表在获得(b)的所述加权概率之前所述受试者将对所述erk抑制剂治疗展现出临床有益反应的可能性。在一些实施方案中,所述方法进一步包括向接受者传递关于所述可能性的信息。在一些实施方案中,所述方法进一步包括基于所述加权概率提供建议。所述建议可包括用所述erk抑制剂治疗所述受试者。在一些实施方案中,所述方法进一步包括基于所述加权概率选择治疗。在一些实施方案中,所述方法进一步包括基于所述加权概率施用所述erk抑制剂。
在实践主题方法中的任一种时,表达水平可通过检测mrna的水平来评估。在一些实施方案中,表达水平通过检测由mrna逆转录产生的cdna的水平来评估。在一些实施方案中,表达水平通过检测多肽的水平来评估。多肽水平的检测可包括至少一种选自以下的技术:免疫组织化学(ihc)、质谱分析、western印迹法、酶联免疫吸附测定(elisa)、免疫细胞化学、免疫荧光和流式细胞术。在一些实施方案中,表达水平通过核酸扩增测定、杂交测定、测序或其组合来评估。所述核酸扩增测定、所述杂交测定或所述测序可使用来自所述受试者的核酸样品进行。在一些实施方案中,所述核酸样品包括选自基因组dna、cdna、ctdna、无细胞dna、rna和mrna的核酸,所述核酸任选地来自头颈鳞状细胞癌细胞。在一些实施方案中,所述表达水平使用
在实践主题方法中的任一种时,所述第四参考水平和/或所述第五参考水平可通过在来自患有鳞状细胞癌的展现出对所述erk抑制剂治疗的低敏感性的受试者的生物样品中分别评估以下的表达来获得:(1)areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa;和/或(2)dcun1d1、pik3ca、prkci、sox2和tp63。在一些实施方案中,所述第四参考水平代表多个鳞状细胞癌样品中的areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的平均总表达水平。在一些实施方案中,所述第五参考水平代表多个鳞状细胞癌样品中的dcun1d1、pik3ca、prkci、sox2和tp63的平均总表达水平。
在某些方面,本公开内容提供了治疗有需要的受试者中的鳞状细胞癌的方法,其包括向所述受试者施用有效剂量的细胞外信号调节激酶(erk)抑制剂,所述受试者包含具有拷贝数谱的基因组,所述拷贝数谱包含至少一种促分裂原活化蛋白激酶(mapk)途径基因的拷贝数扩增。
在某些方面,本公开内容提供了用erk抑制剂下调多个鳞状细胞癌细胞中的mapk信号传导输出的方法,其包括:(a)在包含来自所述受试者的核酸的生物样品中评估至少一种mapk途径基因的拷贝数谱;以及(b)如果所述拷贝数谱包含大于2的所述至少一种mapk途径基因的平均拷贝数,则向所述多个细胞施用有效剂量的所述erk抑制剂。
在某些方面,本公开内容提供了对受试者的鳞状细胞癌状态进行分类的方法,其包括:(a)获得来自所述受试者的生物样品,所述样品包含来自所述受试者的鳞状细胞癌细胞的基因组和/或转录组物质;(b)评估所述样品中的至少一种mapk途径基因的拷贝数谱;以及(c)基于所述拷贝数谱对所述受试者的鳞状细胞癌状态进行分类。如果所述拷贝数谱包含大于2的所述至少一种mapk途径基因的平均拷贝数,则所述鳞状细胞癌状态可被分类为可能对erk抑制剂治疗敏感。在一些实施方案中,所述分类步骤包括基于所述拷贝数谱使用计算机系统计算所述受试者对erk抑制剂治疗有反应的可能性,其中每有一个额外的拷贝数大于2的所述至少一种mapk途径基因,上调所述可能性。任选地,所述方法进一步包括制作包括所述受试者对所述erk抑制剂治疗有反应的可能性的预测的报告。
在某些方面,本公开内容提供了评估患有鳞状细胞癌的受试者对erk抑制剂治疗展现出临床有益反应的可能性的方法,所述方法包括:(a)在包含来自鳞状细胞癌细胞的基因组和/或转录组物质的生物样品中评估至少一种mapk途径基因的拷贝数谱;以及(b)基于所述拷贝数谱使用计算机系统计算erk抑制剂反应性的加权概率。在一些实施方案中,所述方法进一步包括如果所述加权概率对应于基线概率的至少1.5倍,则将所述受试者指定为有较高概率对所述erk抑制剂治疗展现出临床有益反应,其中所述基线概率代表在获得(b)的所述加权概率之前,所述受试者将对所述erk抑制剂治疗展现出临床有益反应的可能性。任选地,所述方法进一步包括向接受者传递关于所述可能性的信息。在一些实施方案中,所述方法进一步包括基于所述加权概率提供建议。所述建议可包括用所述erk抑制剂治疗所述受试者。所述建议可包括中断治疗、化疗、免疫疗法、放疗或外科手术。在一些实施方案中,所述方法进一步包括基于所述加权概率选择治疗。在一些实施方案中,所述方法进一步包括基于所述加权概率施用所述erk抑制剂。
在实践主题方法中的任一种时,所述至少一种mapk途径基因的拷贝数谱可通过选自以下的方法评估:原位杂交、southern印迹法、免疫组织化学(ihc)、聚合酶链反应(pcr)、定量pcr(qpcr)、定量实时pcr(qrt-pcr)、比较基因组杂交、基于微阵列的比较基因组杂交和连接酶链反应(lcr)。在一些实施方案中,所述至少一种mapk途径基因的拷贝数谱通过选自以下的方法来评估:荧光原位杂交、显色原位杂交和银原位杂交。在一些实施方案中,所述拷贝数谱使用来自所述受试者的核酸样品来评估,任选地,其中所述核酸样品包括选自基因组dna、cdna、ctdna、无细胞dna、rna和mrna的核酸。在一些实施方案中,所述核酸来自鳞状细胞癌细胞。
在实践主题方法中的任一种时,所述至少一种mapk途径基因可选自cdk4、cdk6、egfr、erk1、ccnd1、kras、erk2和hras,如egfr。在一些实施方案中,所述鳞状细胞癌为食管鳞状细胞癌。
在实践主题方法中的任一种时,所述生物样品可为组织样品,任选地,其中所述组织样品为固定的、石蜡包埋的、新鲜的或冷冻的。所述组织样品可由细针、芯针或其他类型的活检而获得。在一些实施方案中,所述生物样品为全血或血浆样品。
在实践主题方法中的任一种时,所述鳞状细胞癌可选自肺鳞状细胞癌、食管鳞状细胞癌、宫颈鳞状细胞癌和头颈鳞状细胞癌。在一些实施方案中,所述erk抑制剂作为单一疗法施用。在一些实施方案中,所述erk抑制剂与至少一种其他抗癌疗法一起施用。
在某些方面,本公开内容提供了治疗有需要的受试者中的癌症的方法,其包括向所述受试者施用有效剂量的细胞外信号调节激酶(erk)抑制剂,其中所述受试者展现出对ras、raf或mek抑制剂治疗的抗性。
在某些方面,本公开内容提供了治疗患有癌症的受试者的方法,其包括:(a)针对对ras、raf或mek抑制剂治疗的抗性来筛选所述受试者;以及(b)如果确定所述受试者对所述ras、raf或mek抑制剂治疗有抗性,则向所述受试者施用erk抑制剂。
任选地,所述受试者展现出对b-raf抑制剂治疗的抗性。所述b-raf抑制剂可选自维罗非尼、gdc-0879、plx-4720、plx-3603、plx-4032、raf265、xl281、az628、索拉非尼、达拉非尼和lgx818,如维罗非尼。任选地,所述受试者展现出对mek抑制剂治疗的抗性。所述mek抑制剂可选自曲美替尼、考比替尼(cobimetinib)、binimetinib、司美替尼(selumetinib)、pd-325901、ci-1040、pd-035901、tak-733、pd98059、pd184352、u0126、rdea119、azd8330、ro4987655、ro4927350、ro5068760、as703026和e6201,如曲美替尼。在一些实施方案中,所述癌症包括b-raf或n-ras突变。任选地,所述癌症选自乳腺癌、胰腺癌、肺癌、甲状腺癌、精原细胞瘤、黑素瘤、膀胱癌、肝癌、肾癌、骨髓增生异常综合征、急性髓性白血病和结直肠癌。任选地,所述癌症选自胰腺癌、肺癌、黑素瘤和结直肠癌,如黑素瘤。
在某些方面,本公开内容提供了抑制癌细胞生长的方法,所述方法包括向所述细胞施用erk抑制剂,其中所述细胞展现出对ras、raf或mek抑制剂治疗的抗性。任选地,所述细胞展现出对b-raf抑制剂治疗的抗性,所述b-raf抑制剂如维罗非尼、gdc-0879、plx-4720、plx-3603、plx-4032、raf265、xl281、az628、索拉非尼、达拉非尼和lgx818。任选地,所述b-raf抑制剂为维罗非尼。任选地,所述细胞展现出对mek抑制剂治疗的抗性,所述mek抑制剂如曲美替尼、考比替尼、binimetinib、司美替尼、pd-325901、ci-1040、pd-035901、tak-733、pd98059、pd184352、u0126、rdea119、azd8330、ro4987655、ro4927350、ro5068760、as703026和e6201。任选地,所述mek抑制剂为曲美替尼。在一些实施方案中,所述细胞包含b-raf或n-ras突变。任选地,所述细胞选自胰腺癌细胞、肺癌细胞、黑素瘤细胞和结直肠癌细胞,如黑素瘤细胞。
在某些方面,本公开内容提供了治疗有需要的受试者中的癌症的方法,其包括向所述受试者施用有效剂量的细胞外信号调节激酶(erk)抑制剂。所述受试者可包含展现出至少一种位于染色体11q13.3-13.4处的基因的扩增和/或超表达的基因组。在一些实例中,所述方法进一步包括:(a)针对所述至少一种位于染色体11q13.3-13.4处的基因的扩增和/或超表达来筛选所述受试者;以及(b)如果确定存在所述扩增和/或超表达,则向所述受试者施用所述erk抑制剂。
在某些方面,本公开内容提供了治疗患有癌症的受试者的方法,其包括:(a)针对至少一种位于染色体11q13.3-13.4处的基因或与位于染色体11q13.3-13.4处的基因共扩增的基因的扩增和/或超表达来筛选所述受试者;以及(b)如果确定存在所述扩增和/或超表达,则向所述受试者施用所述erk抑制剂。
本公开内容的方法可进一步包括如果不存在所述扩增和/或超表达,则向所述受试者施加替代疗法,如化疗、免疫疗法、放疗或外科手术。在一些实施方案中,所述筛选包括对从所述受试者分离的核酸进行核酸分析。所述核酸可来自癌细胞。在一些实施方案中,所述方法进一步包括如果确定同时存在所述至少一种基因的扩增和超表达,则向所述受试者施用所述erk抑制剂。所述方法可包括如果所述受试者展现出ccnd1或ano1的扩增和/或超表达,则向所述受试者施用所述erk抑制剂。所述方法可包括如果所述受试者展现出ccnd1和ano1的扩增或超表达,则向所述受试者施用所述erk抑制剂。所述方法可包括如果所述受试者展现出ccnd1和ano1的扩增和超表达,则向所述受试者施用所述erk抑制剂。
在某些方面,本公开内容提供了用erk抑制剂下调多个癌细胞中的mapk信号传导输出的方法。所述方法可包括:(a)在包含来自所述多个细胞的核酸的生物样品中评估至少一种位于染色体11q13.3-13.4处的基因的拷贝数谱和/或表达谱;以及(b)如果所述拷贝数谱包含>2的所述至少一种基因的平均拷贝数和/或如果所述表达谱高于参考水平,则向所述多个细胞施用有效剂量的所述erk抑制剂,其中所述参考水平指示对所述erk抑制剂的低敏感性。
在某些方面,本公开内容提供了对受试者的癌症状态进行分类的方法,其包括:(a)获得来自所述受试者的生物样品,所述样品包含来自受试者的癌细胞的基因组和/或转录组物质;(b)评估所述样品中至少一种位于染色体11q13.3-13.4处的基因的拷贝数谱和/或表达谱;以及(c)基于所述拷贝数谱和/或所述表达谱对(a)的所述受试者的癌症状态进行分类。如果所述拷贝数谱包含>2的所述至少一种基因的平均拷贝数,则所述癌症状态可被分类为可能对erk抑制剂治疗敏感。在一些实施方案中,如果所述表达谱高于参考水平,则所述癌症状态被分类为可能对erk抑制剂治疗敏感,其中所述参考水平指示对所述erk抑制剂的低敏感性。所述分类步骤可包括基于所述拷贝数谱和/或所述表达谱使用计算机系统计算所述受试者对erk抑制剂治疗有反应的可能性,其中每有一个额外的拷贝数大于2的所述至少一种基因以及所述表达谱相对于参考水平的每个倍增,上调所述可能性,其中所述参考水平指示对所述erk抑制剂的低敏感性。在一些实施方案中,所述方法进一步包括制作包括所述受试者对所述erk抑制剂治疗有反应的可能性的预测的报告。
在某些方面,本公开内容提供了评估患有癌症的受试者对erk抑制剂治疗展现出临床有益反应的可能性的方法,所述方法包括:(a)评估包含来自癌细胞的基因组和/或转录组物质的生物样品中的至少一种位于染色体11q13.3-13.4处的基因的拷贝数谱和/或表达谱;和(b)基于所述拷贝数谱和/或所述表达谱使用计算机系统计算erk抑制剂反应性的加权概率。所述方法可进一步包括如果所述加权概率对应于基线概率的至少1.5倍,则将所述受试者指定为有较高概率对所述erk抑制剂治疗展现出临床有益反应,其中所述基线概率代表在获得(b)的所述加权概率之前所述受试者将对所述erk抑制剂治疗展现出临床有益反应的可能性。任选地,所述方法进一步包括向接受者传递关于所述可能性的信息。任选地,所述方法进一步包括基于所述加权概率提供建议。所述建议可包括用所述erk抑制剂治疗所述受试者。备选地,所述建议可包括中断治疗、化疗、免疫疗法、放疗或外科手术。本文所述的方法可进一步包括基于所述加权概率选择治疗。在一些实施方案中,所述方法进一步包括基于所述加权概率施用所述erk抑制剂。
在实践主题方法中的任一种时,所述表达可通过检测由所述至少一种基因转录的mrna的水平来评估。在一些实施方案中,所述表达通过检测由通过所述至少一种基因转录的mrna的逆转录所产生的cdna的水平来评估。在一些实施方案中,所述表达通过检测由所述至少一种基因编码的多肽的水平来评估。所述多肽水平的检测可包括至少一种选自以下的技术:免疫组织化学(ihc)、质谱分析、western印迹法、酶联免疫吸附测定(elisa)、免疫细胞化学、免疫荧光和流式细胞术。在一些实施方案中,所述表达通过核酸扩增测定、杂交测定、测序或其组合来评估。所述核酸扩增测定、所述杂交测定或所述测序可使用来自所述受试者的核酸样品进行。所述核酸样品可包括选自基因组dna、cdna、ctdna、无细胞dna、rna和mrna的核酸。在一些实施方案中,所述核酸来自癌细胞。在一些实施方案中,所述表达使用
在实践主题方法中的任一种时,所述参考水平可通过在来自患有癌症的对所述erk抑制剂治疗展现出低敏感性的受试者的生物样品中评估所述至少一种基因的表达来获得。在一些实施方案中,所述参考水平代表多个癌症样品中所述至少一种基因的平均总表达水平。
在实践主题方法中的任一种时,所述至少一种基因的所述拷贝数谱可通过选自以下的方法来评估:原位杂交、southern印迹法、免疫组织化学(ihc)、聚合酶链反应(pcr)、定量pcr(qpcr)、定量实时pcr(qrt-pcr)、比较基因组杂交、基于微阵列的比较基因组杂交和连接酶链反应(lcr)。任选地,所述至少一种基因的所述拷贝数谱通过选自以下的方法来评估:荧光原位杂交、显色原位杂交和银原位杂交。在一些实施方案中,所述拷贝数谱使用来自所述受试者的核酸样品评估。所述核酸样品可包括选自基因组dna、cdna、ctdna、无细胞dna、rna和mrna的核酸。在一些实施方案中,所述核酸来自癌细胞。
在实践主题方法中的任一种时,所述至少一种基因可选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1和shank2。在一些实施方案中,所述至少一种基因为ccnd1或ano1。在一些实施方案中,所述至少一种基因为ccnd1和ano1。
在实践主题方法中的任一种时,所述生物样品可为组织样品。该组织样品可以是固定的、石蜡包埋的、新鲜的或冷冻的。在一些实施方案中,所述组织样品由细针、芯针或其他类型的活检而获得。在一些实施方案中,所述生物样品为全血或血浆样品。
在实践主题方法中的任一种时,所述癌症可选自鳞状细胞癌和腺癌,如选自肺鳞状细胞癌、食管鳞状细胞癌、宫颈鳞状细胞癌、头颈鳞状细胞癌、膀胱鳞状细胞癌和胃鳞状细胞癌的鳞状细胞癌。在一些实施方案中,所述鳞状细胞癌为食管鳞状细胞癌。在一些实施方案中,所述癌症为选自食管腺癌和胰腺腺癌的腺癌。在一些实施方案中,所述癌症选自肺癌、食管癌、宫颈癌、头颈癌、膀胱癌、胃癌和胰腺癌。在一些实施方案中,所述癌症选自乳腺癌、胰腺癌、肺癌、甲状腺癌、精原细胞瘤、黑素瘤、膀胱癌、肝癌、肾癌、骨髓增生异常综合征、急性髓性白血病和结直肠癌。在一些实施方案中,所述erk抑制剂作为单一疗法施用。在一些实施方案中,所述erk抑制剂与至少一种其他抗癌疗法一起施用。
任选地,所述erk抑制剂为式i化合物:
其中:
x1为c=o、c=s、so、so2或po2-;y为cr5;w为n或c;
x2为nr1或cr1r1’,且x3为空、cr3r3’或c=o;或者x2-x3为r1c=cr3或r1c=n或n=cr3或nr12-cr11=cr3;
x4为n或cr4;x5为n或c;x6为n或c;x7为o、n、nr72或cr71;x8为o、n、nr82或cr81;x9为o、n、nr22或cr21;x10为o、n、nr92或cr91;
r1为-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c2-10烯基-c3-10芳基、-c2-10烯基-c1-10杂芳基、-c2-10烯基-c3-10环烷基、-c2-10烯基-c1-10杂环基、-c2-10炔基-c3-10芳基、-c2-10炔基-c1-10杂芳基、-c2-10炔基-c3-10环烷基、-c2-10炔基-c1-10杂环基、-c1-10杂烷基-c3-10芳基、-c1-10杂烷基-c1-10杂芳基、-c1-10杂烷基-c3-10环烷基、-c1-10杂烷基-c1-10杂环基、-c1-10烷氧基-c3-10芳基、-c1-10烷氧基-c1-10杂芳基、-c1-10烷氧基-c3-10环烷基、-c1-10烷氧基-c1-10杂环基、-c3-10芳基-c1-10烷基、-c3-10芳基-c2-10烯基、-c3-10芳基-c2-10炔基、-c3-10芳基-c3-10杂芳基、-c3-10芳基-c3-10环烷基、-c3-10芳基-c1-10杂环基、-c1-10杂芳基-c1-10烷基、-c1-10杂芳基-c2-10烯基、-c1-10杂芳基-c2-10炔基、-c3-10杂芳基-c3-10芳基、-c1-10杂芳基-c3-10环烷基、-c1-10杂芳基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c2-10烯基、-c3-10环烷基-c2-10炔基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c2-10烯基、-c1-10杂环基-c2-10炔基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r1’为氢、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c2-10烯基-c3-10芳基、-c2-10烯基-c1-10杂芳基、-c2-10烯基-c3-10环烷基、-c2-10烯基-c1-10杂环基、-c2-10炔基-c3-10芳基、-c2-10炔基-c1-10杂芳基、-c2-10炔基-c3-10环烷基、-c2-10炔基-c1-10杂环基、-c1-10杂烷基-c3-10芳基、-c1-10杂烷基-c1-10杂芳基、-c1-10杂烷基-c3-10环烷基、-c1-10杂烷基-c1-10杂环基、-c1-10烷氧基-c3-10芳基、-c1-10烷氧基-c1-10杂芳基、-c1-10烷氧基-c3-10环烷基、-c1-10烷氧基-c1-10杂环基、-c3-10芳基-c1-10烷基、-c3-10芳基-c2-10烯基、-c3-10芳基-c2-10炔基、-c3-10芳基-c3-10杂芳基、-c3-10芳基-c3-10环烷基、-c3-10芳基-c1-10杂环基、-c1-10杂芳基-c1-10烷基、-c1-10杂芳基-c2-10烯基、-c1-10杂芳基-c2-10炔基、-c3-10杂芳基-c3-10芳基、-c1-10杂芳基-c3-10环烷基、-c1-10杂芳基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c2-10烯基、-c3-10环烷基-c2-10炔基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c2-10烯基、-c1-10杂环基-c2-10炔基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r21为氢、卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-so2nr31r32、-nr31c(=o)r32、-nr31c(=o)or32、-nr31c(=o)nr32r33、-nr31s(o)0-2r32、-c(=s)or31、-c(=o)sr31、-nr31c(=nr32)nr32r33、-nr31c(=nr32)or33、-nr31c(=nr32)sr33、-oc(=o)or33、-oc(=o)nr31r32、-oc(=o)sr31、-sc(=o)sr31、-p(o)or31or32、-sc(=o)nr31r32、-l-c1-10烷基、-l-c2-10烯基、-l-c2-10炔基、-l-c1-10杂烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基、-l-c1-10杂环基、-l-c1-10烷基-c3-10芳基、-l-c1-10烷基-c1-10杂芳基、-l-c1-10烷基-c3-10环烷基、-l-c1-10烷基-c1-10杂环基、-l-c2-10烯基-c3-10芳基、-l-c2-10烯基-c1-10杂芳基、-l-c2-10烯基-c3-10环烷基、-l-c2-10烯基-c1-10杂环基、-l-c2-10炔基-c3-10芳基、-l-c2-10炔基-c1-10杂芳基、-l-c2-10炔基-c3-10环烷基、-l-c2-10炔基-c1-10杂环基、-l-c1-10杂烷基-c3-10芳基、-l-c1-10杂烷基-c1-10杂芳基、-l-c1-10杂烷基-c3-10环烷基、-l-c1-10杂烷基-c1-10杂环基、-l-c1-10烷氧基-c3-10芳基、-l-c1-10烷氧基-c1-10杂芳基、-l-c1-10烷氧基-c3-10环烷基、-l-c1-10烷氧基-c1-10杂环基、-l-c3-10芳基-c1-10烷基、-l-c3-10芳基-c2-10烯基、-l-c3-10芳基-c2-10炔基、-l-c3-10芳基-c1-10杂芳基、-l-c3-10芳基-c3-10环烷基、-l-c3-10芳基-c1-10杂环基、-l-c1-10杂芳基-c1-10烷基、-l-c1-10杂芳基-c2-10烯基、-l-c1-10杂芳基-c2-10炔基、-l-c1-10杂芳基-c3-10芳基、-l-c1-10杂芳基-c3-10环烷基、-l-c1-10杂芳基-c1-10杂环基、-l-c3-10环烷基-c1-10烷基、-l-c3-10环烷基-c2-10烯基、-l-c3-10环烷基-c2-10炔基、-l-c3-10环烷基-c3-10芳基、-l-c3-10环烷基-c1-10杂芳基、-l-c3-10环烷基-c1-10杂环基、-l-c1-10杂环基-c1-10烷基、-l-c1-10杂环基-c2-10烯基、-l-c1-10杂环基-c2-10炔基、-l-c1-10杂环基-c3-10芳基、-l-c1-10杂环基-c1-10杂芳基或-l-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
r22为氢、-oh、-cf3、-c(o)r31、-co2r31、-c(=o)nr31、-s(o)0-2r31、-c(=s)or31、-c(=o)sr31、-l-c1-10烷基、-l-c2-10烯基、-l-c2-10炔基、-l-c1-10杂烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基、-l-c1-10杂环基、-l-c1-10烷基-c3-10芳基、-l-c1-10烷基-c1-10杂芳基、-l-c1-10烷基-c3-10环烷基、-l-c1-10烷基-c1-10杂环基、-l-c2-10烯基-c3-10芳基、-l-c2-10烯基-c1-10杂芳基、-l-c2-10烯基-c3-10环烷基、-l-c2-10烯基-c1-10杂环基、-l-c2-10炔基-c3-10芳基、-l-c2-10炔基-c1-10杂芳基、-l-c2-10炔基-c3-10环烷基、-l-c2-10炔基-c1-10杂环基、-l-c1-10杂烷基-c3-10芳基、-l-c1-10杂烷基-c1-10杂芳基、-l-c1-10杂烷基-c3-10环烷基、-l-c1-10杂烷基-c1-10杂环基、-l-c1-10烷氧基-c3-10芳基、-l-c1-10烷氧基-c1-10杂芳基、-l-c1-10烷氧基-c3-10环烷基、-l-c1-10烷氧基-c1-10杂环基、-l-c3-10芳基-c1-10烷基、-l-c3-10芳基-c2-10烯基、-l-c3-10芳基-c2-10炔基、-l-c3-10芳基-c1-10杂芳基、-l-c3-10芳基-c3-10环烷基、-l-c3-10芳基-c1-10杂环基、-l-c1-10杂芳基-c1-10烷基、-l-c1-10杂芳基-c2-10烯基、-l-c1-10杂芳基-c2-10炔基、-l-c1-10杂芳基-c3-10芳基、-l-c1-10杂芳基-c3-10环烷基、-l-c1-10杂芳基-c1-10杂环基、-l-c3-10环烷基-c1-10烷基、-l-c3-10环烷基-c2-10烯基、-l-c3-10环烷基-c2-10炔基、-l-c3-10环烷基-c3-10芳基、-l-c3-10环烷基-c1-10杂芳基、-l-c3-10环烷基-c1-10杂环基、-l-c1-10杂环基-c1-10烷基、-l-c1-10杂环基-c2-10烯基、-l-c1-10杂环基-c2-10炔基、-l-c1-10杂环基-c3-10芳基、-l-c1-10杂环基-c1-10杂芳基或-l-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
l为键、-o-、-n(r31)-、-s(o)0-2-、-c(=o)-、-c(=o)o-、-oc(=o)-、-c(=o)n(r31)-、-n(r31)c(=o)-、-nr31c(=o)o-、-nr31c(=o)nr32-、-nr31s(o)0-2-、-s(o)0-2n(r31)-、-c(=s)o-、-c(=o)s-、-nr31c(=nr32)nr32-、-nr31c(=nr32)o-、-nr31c(=nr32)s-、-oc(=o)o-、-oc(=o)nr31-、-oc(=o)s-、-sc(=o)s-、-p(o)or31o-、-sc(=o)nr31-;
r3、r3’和r4中的每一个独立地为氢、卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-so2nr31r32、-nr31c(=o)r32、-nr31c(=o)or32、-nr31c(=o)nr32r33、-nr31s(o)0-2r32、-c(=s)or31、-c(=o)sr31、-nr31c(=nr32)nr32r33、-nr31c(=nr32)or33、-nr31c(=nr32)sr33、-oc(=o)or33、-oc(=o)nr31r32、-oc(=o)sr31、-sc(=o)sr31、-p(o)or31or32、-sc(=o)nr31r32、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c2-10烯基-c3-10芳基、-c2-10烯基-c1-10杂芳基、-c2-10烯基-c3-10环烷基、-c2-10烯基-c1-10杂环基、-c2-10炔基-c3-10芳基、-c2-10炔基-c1-10杂芳基、-c2-10炔基-c3-10环烷基、-c2-10炔基-c1-10杂环基、-c1-10杂烷基-c3-10芳基、-c1-10杂烷基-c1-10杂芳基、-c1-10杂烷基-c3-10环烷基、-c1-10杂烷基-c1-10杂环基、-c1-10烷氧基-c3-10芳基、-c1-10烷氧基-c1-10杂芳基、-c1-10烷氧基-c3-10环烷基、-c1-10烷氧基-c1-10杂环基、-c3-10芳基-c1-10烷基、-c3-10芳基-c2-10烯基、-c3-10芳基-c2-10炔基、-c3-10芳基-c3-10杂芳基、-c3-10芳基-c3-10环烷基、-c3-10芳基-c1-10杂环基、-c1-10杂芳基-c1-10烷基、-c1-10杂芳基-c2-10烯基、-c1-10杂芳基-c2-10炔基、-c3-10杂芳基-c3-10芳基、-c1-10杂芳基-c3-10环烷基、-c1-10杂芳基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c2-10烯基、-c3-10环烷基-c2-10炔基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c2-10烯基、-c1-10杂环基-c2-10炔基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r13取代基取代;或者r3’为-or6、-nr6r34、-s(o)0-2r6、-c(=o)r6、-c(=o)or6、-oc(=o)r6、-c(=o)n(r34)r6或-n(r34)c(=o)r6,其中r6与r34一起可任选地形成杂环;或者r3’为-or6、-nr6r34、-s(o)0-2r6、-c(=o)r6、-c(=o)or6、-oc(=o)r6、-c(=o)n(r34)r6或-n(r34)c(=o)r6,其中r6与r34一起可任选地形成杂环;
r5、r71、r81和r91中的每一个独立地为氢、卤素、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-so2nr31r32、-nr31c(=o)r32、-nr31c(=o)or32、-nr31c(=o)nr32r33、-nr31s(o)0-2r32、-c(=s)or31、-c(=o)sr31、-nr31c(=nr32)nr32r33、-nr31c(=nr32)or33、-nr31c(=nr32)sr33、-oc(=o)or33、-oc(=o)nr31r32、-oc(=o)sr31、-sc(=o)sr31、-p(o)or31or32或-sc(=o)nr31nr32;
r6为氢、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c2-10烯基-c3-10芳基、-c2-10烯基-c1-10杂芳基、-c2-10烯基-c3-10环烷基、-c2-10烯基-c1-10杂环基、-c2-10炔基-c3-10芳基、-c2-10炔基-c1-10杂芳基、-c2-10炔基-c3-10环烷基、-c2-10炔基-c1-10杂环基、-c1-10杂烷基-c3-10芳基、-c1-10杂烷基-c1-10杂芳基、-c1-10杂烷基-c3-10环烷基、-c1-10杂烷基-c1-10杂环基、-c1-10烷氧基-c3-10芳基、-c1-10烷氧基-c1-10杂芳基、-c1-10烷氧基-c3-10环烷基、-c1-10烷氧基-c1-10杂环基、-c3-10芳基-c1-10烷基、-c3-10芳基-c2-10烯基、-c3-10芳基-c2-10炔基、-c3-10芳基-c3-10杂芳基、-c3-10芳基-c3-10环烷基、-c3-10芳基-c1-10杂环基、-c1-10杂芳基-c1-10烷基、-c1-10杂芳基-c2-10烯基、-c1-10杂芳基-c2-10炔基、-c3-10杂芳基-c3-10芳基、-c1-10杂芳基-c3-10环烷基、-c1-10杂芳基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c2-10烯基、-c3-10环烷基-c2-10炔基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c2-10烯基、-c1-10杂环基-c2-10炔基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r14或r15取代基取代;
r72、r82和r92中的每一个独立地为氢、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-c(o)r31、-co2r31、-c(=o)nr31、-s(o)0-2r31、-c(=s)or31、-c(=o)sr31;
r10和r14中的每一个独立地为-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基,其任选地被一个或多个独立的r11取代基取代;
r11、r12、r13和r15中的每一个独立地为氢、卤素、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-so2nr31r32、-nr31c(=o)r32、-nr31c(=o)or32、-nr31c(=o)nr32r33、-nr31s(o)0-2r32、-c(=s)or31、-c(=o)sr31、-nr31c(=nr32)nr32r33、-nr31c(=nr32)or33、-nr31c(=nr32)sr33、-oc(=o)or33、-oc(=o)nr31r32、-oc(=o)sr31、-sc(=o)sr31、-p(o)or31or32或-sc(=o)nr31nr32;
r31、r32、r33和r34中的每一个独立地为氢、卤素、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基,或者其中r31与r32一起形成杂环;
其中环a包含一个或多个选自n、o或s的杂原子;并且
其中如果x7为o,或者x2-x3为r1c=cr3,则环a包含至少两个选自n、o或s的杂原子;并且
其中如果x2-x3为r1c=n,则x7或x9中的至少一个不是n。
在一些实施方案中,所述erk抑制剂为式i-a化合物:
或其药学上可接受的盐。
在一些实施方案中,对于式i或式i-a化合物:
r1为-c1-10烷基、-c1-10烷基-c3-10芳基或-c1-10杂环基-c1-10烷基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r21为-l-c3-10芳基或-l-c1-10杂芳基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
l为键或-n(r31)-;
r72为氢;
每个r10独立地为-c3-10芳基、-c1-10杂芳基或-c1-10杂环基,其任选地被一个或多个独立的r11取代基取代;
r11和r12中的每一个独立地为卤素、-c1-10烷基、-oh、-cf3或-or31;并且
每个r31独立地为氢或-c1-10烷基。
在实践主题方法中的任一种时,所述erk抑制剂可选自:
本文所述的方法可进一步包括向所述受试者施用第二治疗剂。在某些方面,本公开内容提供了治疗有需要的受试者中的鳞状细胞癌的方法,其包括向所述受试者施用erk抑制剂和第二治疗剂。在一些实施方案中,所述第二治疗剂为化疗剂。在一些实施方案中,所述第二治疗剂选自吉西他滨、顺铂、egfr抑制剂和cdk抑制剂。在一些实施方案中,所述第二治疗剂选自吉西他滨、顺铂、帕博西尼、奥希替尼、奥姆替尼、盐酸埃克替尼、阿法替尼、奈昔木单抗、拉帕替尼、帕妥珠单抗、凡德他尼、尼妥珠单抗、帕尼单抗、厄洛替尼、吉非替尼和西妥昔单抗。在一些实施方案中,所述第二治疗剂选自吉西他滨、顺铂、西妥昔单抗、厄洛替尼和帕博西尼。本文所述的方法可进一步包括对所述受试者施用化疗、免疫疗法或放疗。
在某些实施方案中,本公开内容提供用于评估患有鳞状细胞癌的受试者对erk抑制剂治疗展现出临床有益反应的可能性的系统。在一些实施方案中,所述系统包含:(a)存储器单元,其被配置用于存储关于包含来自鳞状细胞癌细胞的基因组和/或转录组物质的生物样品中的以下各项的信息:(i)至少两种选自以下的基因的第一总表达水平:egfr、erk1、ccnd1、kras、erk2和hras;(ii)至少两种选自以下的基因的第二总表达水平:dusp5、dusp6、dusp2、dusp4、spry2、spry4和spred1;(iii)至少两种选自以下的基因的第三总表达水平:ccnd1、craf、dusp5、egfr、erk1和kras;(iv)至少一种mapk途径基因的拷贝数谱;(v)areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的第四总表达水平;(vi)dcun1d1、pik3ca、prkci、sox2和tp63的第五总表达水平;和/或(vii)hif1a和tp63的表达水平;(b)一个或多个处理器,其单独或组合地被编程用于:(1)基于所述第一总表达水平、所述第二总表达水平、所述拷贝数谱、所述第三总表达水平、所述第四总表达水平、所述第五总表达水平和/或所述hif1a和tp63的表达水平来确定erk抑制剂反应性的加权概率;和(2)如果所述加权概率对应于基线概率的至少1.5倍,则将受试者指定为有较高概率对所述erk抑制剂治疗展现出临床有益反应,其中所述基线概率代表在获得(b)(1)的所述加权概率之前所述受试者将对所述erk抑制剂治疗展现出临床有益反应的可能性。在一些实施方案中,所述第一总表达水平、所述第二总表达水平、所述第三总表达水平、所述第四总表达水平、所述第五总表达水平和/或所述hif1a和tp63的表达水平通过以下来评估:(a)检测mrna的水平;(b)检测由mrna逆转录产生的cdna的水平;(c)检测多肽的水平;(d)检测无细胞dna的水平;或者(e)核酸扩增测定、杂交测定、测序或其组合。在一些实施方案中,所述至少一种mapk途径基因的拷贝数谱通过选自以下的方法来评估:原位杂交、southern印迹法、免疫组织化学(ihc)、聚合酶链反应(pcr)、定量pcr(qpcr)、定量实时pcr(qrt-pcr)、比较基因组杂交、基于微阵列的比较基因组杂交和连接酶链反应(lcr)。在一些实施方案中,所述至少一种mapk途径基因选自egfr、erk1、ccnd1、kras、erk2和hras,如egfr。在一些实施方案中,所述鳞状细胞癌选自肺鳞状细胞癌、食管鳞状细胞癌、宫颈鳞状细胞癌和头颈鳞状细胞癌,如头颈鳞状细胞癌。
在某些方面,本公开内容提供了用于评估患有癌症的受试者对erk抑制剂治疗展现出临床有益反应的可能性的系统。在一些实施方案中,所述系统包含:(a)存储器单元,其被配置用于存储关于包含来自癌细胞的基因组和/或转录组物质的生物样品中的至少一种位于染色体11q13.3-13.4处的基因的拷贝数谱和/或表达水平的信息;以及(b)一个或多个处理器,其单独或组合地被编程用于:(1)基于所述拷贝数谱和/或所述表达水平来确定erk抑制剂反应性的加权概率;和(2)如果所述加权概率对应于基线概率的至少1.5倍,则将所述受试者指定为有较高概率对所述erk抑制剂治疗展现出临床有益反应,其中所述基线概率代表在获得(b)(1)的所述加权概率之前所述受试者将对所述erk抑制剂治疗展现出临床有益反应的可能性。在一些实施方案中,所述表达水平通过以下来评估:(a)检测mrna的水平;(b)检测由mrna逆转录产生的cdna的水平;(c)检测多肽的水平;(d)检测无细胞dna的水平;或者(e)核酸扩增测定、杂交测定、测序或其组合。在一些实施方案中,所述至少一种基因的拷贝数谱通过选自以下的方法来评估:原位杂交、southern印迹法、免疫组织化学(ihc)、聚合酶链反应(pcr)、定量pcr(qpcr)、定量实时pcr(qrt-pcr)、比较基因组杂交、基于微阵列的比较基因组杂交和连接酶链反应(lcr)。在一些实施方案中,所述至少一种基因选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1和shank2。在一些实施方案中,所述至少一种基因为ccnd1或ano1。在一些实施方案中,所述至少一种基因为ccnd1和ano1。在一些实施方案中,所述癌症选自鳞状细胞癌和腺癌。在一些实施方案中,所述癌症为选自肺鳞状细胞癌、食管鳞状细胞癌、宫颈鳞状细胞癌、头颈鳞状细胞癌、膀胱鳞状细胞癌和胃鳞状细胞癌的鳞状细胞癌,如食管鳞状细胞癌。在一些实施方案中,所述癌症为选自食管腺癌和胰腺腺癌的腺癌。在一些实施方案中,所述癌症选自肺癌、食管癌、宫颈癌、头颈癌、膀胱癌、胃癌和胰腺癌。在一些实施方案中,所述癌症选自乳腺癌、胰腺癌、肺癌、甲状腺癌、精原细胞瘤、黑素瘤、膀胱癌、肝癌、肾癌、骨髓增生异常综合征、急性髓性白血病和结直肠癌。
援引并入
本说明书中提及的所有出版物、专利和专利申请均通过引用并入本文,其程度如同具体地且单独地指明每个单独的出版物、专利或专利申请均通过引用而并入。
附图说明
本发明的新颖特征在所附权利要求书中具体阐述。通过参考以下对其中利用到本发明原理的说明性实施方案加以阐述的详细描述和附图,将会获得对本发明的特征和优点的更好理解,在附图中:
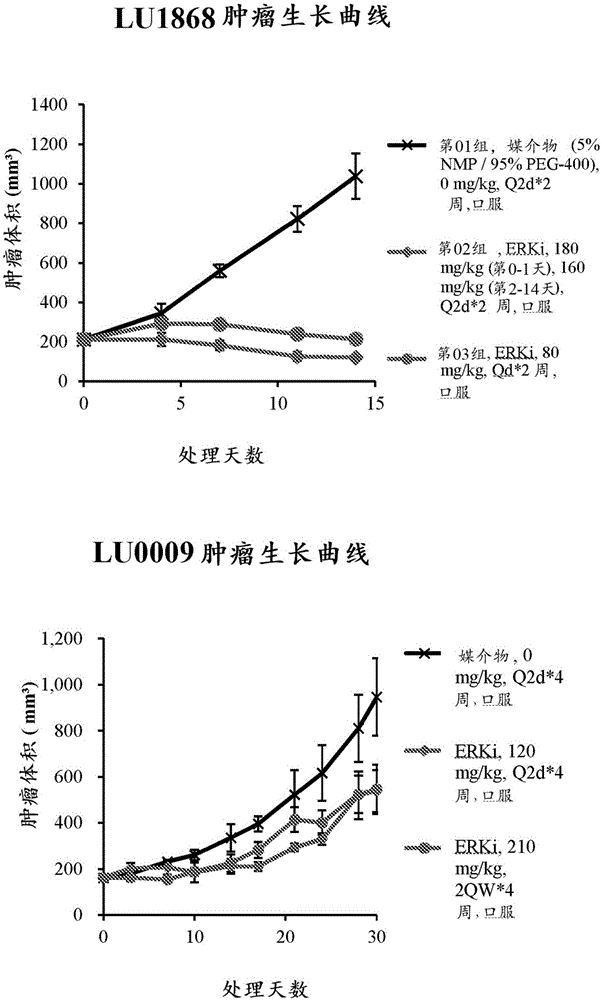
图1描绘了六组非小细胞肺鳞状细胞癌模型经过媒介物或erk抑制剂的2周和4周治疗方案后的肿瘤体积。
图2描绘了11个非小细胞肺鳞状细胞癌模型的基因拷贝数和用erk抑制剂治疗后的肿瘤生长抑制百分比。
图3描绘了5组食管鳞状细胞癌模型经过媒介物或erk抑制剂的6周和3周治疗方案后的肿瘤体积。
图4显示了9个食管鳞状细胞癌模型的基因拷贝数和用erk抑制剂治疗后的肿瘤生长抑制百分比。
图5描绘了5组头颈鳞状细胞癌模型经过媒介物或erk抑制剂的3周和4周治疗方案后的肿瘤体积。
图6显示了9个头颈鳞状细胞癌模型的基因拷贝数和用erk抑制剂治疗后的肿瘤生长抑制百分比。
图7图示了肿瘤生长抑制百分比与egfr基因拷贝数之间的相关性。
图8示出了3组头颈鳞状细胞癌模型在用媒介物或erk抑制剂治疗之后的平均肿瘤体积。
图9描绘了用erk抑制剂治疗后在携带皮下头颈鳞状细胞癌的小鼠中观察到的肿瘤消退。
图10图示,在鳞状细胞癌模型中包括mapk途径基因的6基因特征和4基因特征预测对erk抑制的反应。
图11图示,在鳞状细胞癌模型中包括mapk途径基因的两种3基因特征预测对erk抑制的反应。
图12图示,在鳞状细胞癌模型中包括mapk途径基因的三种2基因特征预测对erk抑制的反应。
图13图示,在鳞状细胞癌模型中包括nras、araf、braf、craf、mek1和mek2的6基因特征和包括egfr的1基因特征均无法预测对erk抑制的反应。
图14图示,在鳞状细胞癌模型中包括mapk途径基因和ras-erk反馈调节子的6基因特征和8基因特征预测对erk抑制的反应。
图15图示,在鳞状细胞癌模型中包括ras-erk反馈调节子的5基因特征、4基因特征和2基因特征预测对erk抑制的反应。
图16图示,与头颈鳞状细胞癌(hnscc)的“基底”亚型相关的12基因特征预测对erk抑制的良好反应,而衍生自位于在hnscc中通常被扩增的染色体3的区域(ch3a)中的基因的5基因特征预测对erk抑制的较低反应。该图还显示,12基因特征与5基因特征的比率,甚至hif1a与tp63的比率预测对erk抑制的良好反应。
图17图示了erk抑制剂在临床b-raf和mek抑制剂抗性模型中的活性。
图18描绘了用媒介物(黑色方形)或erk抑制剂(空心圆)处理的11个食管鳞状细胞癌模型的肿瘤体积。处理反应被分类为:完全反应(cr,>90%消退)、部分反应(pr,>30%消退)、稳定疾病(sd,<30%消退)或进行性疾病(pd,>20%肿瘤生长)。
图19图示了ccnd1扩增与细胞周期蛋白d1超表达之间的关系。
图20图示了腺癌和鳞状细胞癌对map激酶途径的依赖性。
图21显示了在22个食管鳞状细胞癌模型中ccnd1和位于染色体11q13.3-13.4处与ccnd1共扩增的6个额外基因的拷贝数。
图22图示了在扩增反应性(“amp”)和未扩增非反应性(“wt”)食管鳞状细胞癌模型中位于11q13扩增子中的6个额外基因的表达水平。
图23图示了在许多癌症亚型中ccnd1与ano1扩增之间的相关性。
图24图示了在食管鳞状细胞癌模型中,ccnd1扩增、ano1扩增与对erk抑制剂治疗的反应之间的关系。
图25比较了在肺鳞状细胞癌模型中ccnd1扩增状态与对erk抑制剂治疗的反应。
图26比较了在头颈鳞状细胞癌模型中ccnd1扩增状态与对erk抑制剂治疗的反应。
图27描绘了用媒介物(黑色方形)或erk抑制剂(空心圆)处理的4个kras突变体胰腺癌模型的肿瘤体积。
图28描绘了用媒介物(菱形)、120mg/kgeoderk抑制剂(方形)或300mg/kgqwerk抑制剂(三角形)处理的膀胱癌和胃癌模型的肿瘤体积。
图29图示了用erk抑制剂处理的食管鳞状细胞癌模型的肿瘤生长百分比。
图30图示了用erk抑制剂处理的食管鳞状细胞癌模型的肿瘤生长百分比。分别以白色条和黑色条来区分11q13扩增和11q13野生型模型。
图31图示了用erk抑制剂处理的食管鳞状细胞癌模型的肿瘤生长百分比。分别以白色条和黑色条来区分11q13扩增/ano1+和11q13野生型模型。
图32图示了在食管腺癌模型中ccnd1与ano1之间的相关性。
具体实施方式
除非另有定义,否则本文使用的所有技术和科学术语均具有与本发明所属领域的技术人员所通常理解的相同的含义。
当提及可测量值如量、持续时间等时,如本文所用的“约”意为涵盖规定的数字或值±10%的变量。
术语“多核苷酸”、“核苷酸”、“核苷酸序列”、“核酸”和“寡核苷酸”可互换使用。它们是指任何长度的聚合形式的核苷酸(脱氧核糖核苷酸或核糖核苷酸)或其类似物。多核苷酸可以具有任何三维结构,并且可以执行已知或未知的任何功能。以下为多核苷酸的非限制性实例:基因或基因片段的编码或非编码区、由连锁分析定义的基因座(locus)、外显子、内含子、信使rna(mrna)、转移rna、核糖体rna、核酶、cdna、重组多核苷酸、支链多核苷酸、质粒、载体、任何序列的分离dna、任何序列的分离rna、核酸探针、引物、无细胞dna(cfdna)和循环肿瘤dna(ctdna)。多核苷酸可包括经修饰的核苷酸,如甲基化核苷酸和核苷酸类似物。如果存在对核苷酸结构的修饰,则该修饰可以在聚合物组装之前或之后赋予。核苷酸序列可被非核苷酸组分中断。多核苷酸可在聚合后如通过与标记组分缀合而进一步修饰。
“核苷酸探针”或“探针”是指用于在杂交反应中检测或鉴定其相应的靶多核苷酸的多核苷酸。
“杂交”是指一个或多个多核苷酸反应形成复合体的反应,该复合体经由核苷酸残基的碱基之间的氢键来稳定。该氢键可以通过watson-crick碱基配对、hoogstein结合或以任何其他序列特异性方式而出现。该复合体可包含形成双链体结构的两条链、形成多链复合体的三条或更多条链、单条自杂交链或上述的任何组合。杂交反应可以构成更广泛过程如启动pcr或者通过核酶来酶切割多核苷酸中的步骤。
如本文所用的,“表达”是指多核苷酸转录成mrna的过程和/或转录的mrna(也称为“转录物”)随后翻译成肽、多肽或蛋白质的过程。转录物和编码的多肽被统称为“基因产物”。如果多核苷酸源自基因组dna,则表达可包括在真核细胞中的mrna的剪接。egfr基因的表达的水平(或者,“表达水平”)可以例如通过确定egfr多核苷酸、多肽和/或基因产物的水平来确定。
应用于受试者中的核苷酸序列(例如基因)或多肽序列的“差异表达”或“差异的表达”是指从核苷酸序列转录和/或翻译的mrna或者由核苷酸序列编码的蛋白质产物的差异产生。与参考样品的表达水平(即参考水平)相比,差异表达序列可以超表达或低表达。如本文所用的,超表达是表达的增加,并且通常是在参考样品中检测到的表达的至少1.25倍、或备选地至少1.5倍、或备选地至少2倍、或备选地至少3倍、或备选地至少4倍、或备选地至少10倍。如本文所用的,低表达是表达的减少,并且通常比在参考样品中检测到的表达低至少1.25倍、或备选地至少1.5倍、或备选地至少2倍、或备选地至少3倍、或备选地至少4倍,或备选地至少10倍。与参考样品相比时,低表达还包括特定序列没有表达,如通过在测试受试者中不存在可检测的表达所证明。
“信号转导”是一种过程,其中刺激性或抑制性信号传输到细胞中并在细胞内传输,以引起细胞内的响应。分子可经由与相同途径或相关途径的下游分子的直接或间接相互作用来介导其信号传导效应。例如,mapk信号传导可涉及许多下游分子,包括但不限于以下一种或多种蛋白质:egfr、erk1、ccnd1、kras、erk2和hras。
术语“多肽”、“肽”和“蛋白质”在本文可互换使用,是指任何长度的氨基酸聚合物。该聚合物可以是直链或支链的,它可包含经修饰的氨基酸,并且它可被非氨基酸中断。该术语还包括已经被修饰的氨基酸聚合物;例如,形成二硫键、糖基化、脂化、乙酰化、磷酸化或任何其他操作,如与标记组分缀合。如本文所用的,术语“氨基酸”是指天然氨基酸和/或非天然或合成氨基酸,包括甘氨酸和d或l光学异构体,以及氨基酸类似物和拟肽。
术语“生物标志物”和“标志物”在本文中可互换使用,是指一种分子,其在取自具有一种表型状态(例如,患有对erk抑制剂敏感的鳞状细胞癌)的受试者的样品中与取自具有另一种表型状态(例如,患有对erk抑制剂具有低敏感性的鳞状细胞癌)的受试者的样品中差异地存在。如果计算的不同组中生物标志物的平均或中值表达水平具有统计学显著性,则生物标志物在不同表型状态之间差异地存在。统计学显著性的常见测试包括,例如,t检验、anova、kruskal-wallis、wilcoxon、mann-whitney和优势率。单独或组合的生物标志物可提供受试者属于一种表型状态还是另一种表型状态的相对风险的度量。因此,它们可用作疾病(诊断)、药物治疗有效性(治疗诊断学)和药物毒性的标志物。本文所述的多核苷酸和多肽可用作本文所述的某些癌症的生物标志物。
“参考样品”是基于比较目的而在实验中所使用的替代样品或受试者。
术语“参考水平”是指用于评价测试水平的对照水平。在一些实例中,参考水平可以是对照。例如,当生物标志物的表达水平低于参考水平时,该生物标志物可被认为是低表达。参考水平可以通过多种方法来确定,条件是所得到的参考水平准确地提供一生物标志物水平,存在高于该水平的第一组受试者,该第一组受试者相比于具有低于该参考水平的生物标志物水平的第二组患者对erk抑制剂治疗展现出临床有益反应的可能性不同。该参考水平可以例如通过测量来自与待测试的癌细胞组织相同的组织的肿瘤或非肿瘤癌细胞中的生物标记的表达水平来确定。在一些实例中,参考水平可以是体外确定的生物标志物的水平。可以通过比较患有相同癌症的受试者群体中的生物标志物的水平来确定参考水平。可以通过鉴定具有相同或相似的生物标志物水平的群组中群体的子集来确定两个或更多个单独的受试者组。然后可基于区分这些单独组的水平来确定参考水平。参考水平可以是等同地适用于每个受试者的单个数字,或者参考水平可根据受试者的特定亚群而变化。例如,对于同一癌症,年龄较大的男性可能与年轻男性的参考水平不同,并且对于同一癌症,女性的参考水平可能与男性不同。此外,参考水平可以是针对每个受试者单独确定的某个水平。例如,参考水平可以是受试者的癌细胞中的生物标志物水平相对于同一受试者内的正常细胞中的生物标志物水平的比率。在一些实施方案中,参考水平是从患有癌症的个体群体的统计取样中获得的基因表达的数值范围。患有癌症的个体对erk抑制剂治疗的敏感性可以是已知的。在某些实施方案中,参考水平是通过将基因表达与以相对稳定的水平在相同的细胞环境中表达的对照基因(例如,持家基因如肌动蛋白)进行比较而得到。与参考水平的比较可以是定性评估或定量确定。
术语“确定”、“测量”、“评价”、“评估”、“测定”、“测试”和“分析”在本文可互换使用,是指任何形式的测量,并包括确定分析物是否存在(例如,检测)。这些术语可包括定量和/或定性确定。评估可以是相对的或绝对的。相对量可以是例如高、中或低。绝对量可反映测量的信号强度或者将该信号强度转换为另一种定量形式,如微克/ml。“检测是否存在”可包括确定存在的某物的数量,以及确定它是否存在。
如本文所用的,“药剂”或“生物活性剂”是指生物的、药学的或化学的化合物或其他部分。非限制性实例包括简单的或复杂的有机或无机分子、肽、蛋白质、寡核苷酸、抗体、抗体衍生物、抗体片段、维生素衍生物、碳水化合物、毒素或化疗的化合物。可合成多种化合物,例如,小分子和寡聚物(例如,寡肽和寡核苷酸),以及基于各种核心结构的合成有机化合物。此外,各种天然来源可提供供筛选的化合物,如植物或动物提取物等。技术人员可以容易地认识到,本公开内容的试剂的结构性质不受限制。
术语“拮抗剂”和“抑制剂”可互换使用,并且它们是指有能力抑制靶蛋白(例如,erk)的生物学功能的化合物,无论是通过抑制靶蛋白的活性还是抑制靶蛋白的表达。相应地,在靶蛋白的生物作用的背景下定义术语“拮抗剂”和“抑制剂”。尽管本文中优选的拮抗剂特异性地与靶标相互作用(例如,结合),但通过与信号转导途径(靶蛋白是其中的一员)的其他成员相互作用来抑制靶蛋白的生物活性的化合物也特别地包括在此定义内。优选的被拮抗剂抑制的生物活性与鳞状细胞癌的发展、生长或扩散相关。
术语“细胞增殖”是指一种由于分裂造成细胞数变化的现象。该术语还包括细胞生长,其中细胞形态学与增殖信号一致地改变(例如,大小增加)。
术语“共同施用”、“与...联合施用”和其语法上的等同语包括向受试者施用两种或更多种药剂,使得两种药剂和/或其代谢物同时存在于受试者中。共同施用包括在单独的组合物中同时施用,在单独的组合物中在不同的时间施用,或在其中存在两种药剂的组合物中施用。
术语“有效量”或“治疗有效量”是指足以实现预期应用的本文所述化合物的量,该预期应用包括但不限于如下文定义的疾病治疗。治疗有效量可根据预期的应用(体外或体内),或被治疗的受试者和疾病状况,例如,受试者的体重和年龄、疾病状况的严重程度、给药方式等而改变,这些可以容易地由本领域普通技术人员确定。该术语还适用于在靶细胞中诱导特定应答(例如,血小板粘附和/或细胞迁移的减少)的剂量。具体的剂量将根据所选择的特定化合物、所遵循的给药方案、是否与其他化合物联合施用、给药时机、其施用至的组织以及携带它的实体递送系统而改变。
如本文所用的,术语“治疗”、“对...进行治疗”、“缓解”和“改善”可互换使用。这些术语是指用于获得的有益或期望结果(包括但不限于治疗益处和/或预防益处)的方法。所谓治疗益处,是指被治疗的基础病症(例如,鳞状细胞癌)的根除或改善。另外,治疗益处也可以如下实现:一种或多种与基础病症相关的生理学症状得到根除或改善,使得在患者中观察到起色,虽然该患者可能仍受基础病症的折磨。对于预防益处,将药物组合物可施用至存在发展成特定疾病的风险的患者,或可施用至报告有疾病的一种或多种生理学症状的患者,即使该疾病的诊断可能尚未作出。
如本文所用的,“治疗效果”包括如上所述的治疗益处和/或预防益处。预防益处包括延迟或消除疾病或状况的出现,延迟或消除疾病或状况的症状的发作,减缓、停止或逆转疾病或状况的进展,或其任意组合。
应用于生物活性剂的术语“选择性的抑制”或“选择性地抑制”是指药剂经由与靶标的直接或间接相互作用,选择性地降低靶标信号传导活性而非脱靶信号传导活性的能力。
术语“受试者”包括但不限于任何年龄组的人,例如小儿受试者(例如,婴儿、儿童或青少年)或成人受试者(例如青年成年人、中年成年人或老年成年人),和/或其他灵长类动物(例如,食蟹猴或恒河猴);哺乳动物,包括商业相关的哺乳动物,如牛、猪、马、绵羊、山羊、猫和/或犬;和/或鸟类,包括商业相关的鸟类,如鸡、鸭、鹅、鹌鹑和/或火鸡。本文所述的方法均可用于人类治疗学和兽医应用。在一些实施方案中,患者是哺乳动物,并且在一些实施方案中,患者是人。
“放射疗法”或“放射治疗”意为采用从业人员已知的常规方法和组合物,使患者暴露于辐射发射体如发射α-粒子的放射性核素(例如,锕和钍放射性核素)、低线性能量转移(let)辐射发射体(即,β发射体)、转换电子发射体(例如,锶-89和钐-153-edtmp),或高能辐射,包括但不限于x-射线、γ射线和中子。
术语“体内”是指在受试者的身体中发生的事件。
术语“体外”是指在受试者的身体外发生的事件。例如,体外试验包括在受试者身体外运行的任何试验。体外试验包括采用活细胞或死细胞的基于细胞的试验。体外试验还包括不采用完整细胞的无细胞试验。
应用于生物活性剂的“erk1和/或erk2活性”是指药剂调节由erk1和/或erk2介导的信号转导的能力。例如,对erk1和/或erk2活性的调节由来自ras/raf/mek/erk途径的信号输出的改变来证明。
如本文所用的,术语“抑制erk活性”是指减缓、减少、改变以及完全消除和/或防止erk活性。
本发明人已经发现在鳞状细胞癌细胞中扩增和/或差异表达的某些基因,该鳞状细胞癌细胞对erk抑制剂如本文所述的化合物的疗法敏感。更具体地,本公开内容涉及细胞外信号调节激酶1和2(erk1和erk2)的抑制剂在治疗鳞状细胞癌如肺鳞状细胞癌(lscc)、食管鳞状细胞癌(escc)、头颈鳞状细胞癌(hnscc)和宫颈鳞状细胞癌中的用途。本文描述了使用关于基因的扩增或表达状态和/或基因表达产物的信息来鉴定可能对erk抑制剂的疗法有反应的鳞状细胞癌细胞的方法,以及鉴定患有经预测对erk抑制剂治疗展现出临床有益反应的鳞状细胞癌的受试者的方法。特别是,一种或多种基因的拷贝数扩增可表明对erk抑制剂治疗的敏感性。描述了使用某些基于dna和rna的生物标志物来鉴定更可能对erk抑制显示出可靠(robust)治疗反应的lscc、escc和hnscc肿瘤。
在某些实施方案中,本公开内容提供治疗有需要的受试者的鳞状细胞癌的方法。在一些实施方案中,该方法包括向受试者施用有效剂量的细胞外信号调节激酶(erk)抑制剂,所述受试者包含展现出以下的基因组:(1)至少两种促分裂原活化蛋白激酶(mapk)途径基因的高于第一参考水平的第一总表达水平,和/或(2)至少两种ras-erk反馈调节子的高于第二参考水平的第二总表达水平,其中第一参考水平和第二参考水平各自表明对该erk抑制剂的低敏感性。
在某些实施方案中,本公开内容提供治疗有需要的受试者的头颈鳞状细胞癌的方法,其包括向受试者施用有效剂量的细胞外信号调节激酶(erk)抑制剂,所述受试者包含展现出以下的基因组:(1)areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的高于第四参考水平的第四总表达水平;(2)dcun1d1、pik3ca、prkci、sox2和tp63的低于第五参考水平的第五总表达水平;(3)大于1的第四总表达水平与第五总表达水平的比率;和/或(4)大于1的hif1a表达水平与tp63表达水平的比率,其中第四参考水平和第五参考水平各自表明对该erk抑制剂的低敏感性。
在某些实施方案中,本公开内容提供治疗有需要的受试者的鳞状细胞癌的方法,其包括向受试者施用有效剂量的细胞外信号调节激酶(erk)抑制剂,所述受试者包含具有拷贝数谱的基因组,该拷贝数谱包括至少一种促分裂原活化蛋白激酶(mapk)途径基因的拷贝数扩增。在某些实施方案中,本公开内容提供治疗患有鳞状组织学的恶性肿瘤但没有egfr基因扩增的证据的受试者的方法。在某些实施方案中,本公开内容提供治疗患有鳞状组织学的恶性肿瘤且有egfr基因扩增的证据的受试者的方法。
在某些实施方案中,本公开内容提供治疗患有鳞状细胞癌的受试者的方法,其包括:(a)针对是否存在表明对erk抑制剂的敏感性的基因特征来筛选受试者;和(b)如果确定该基因特征存在,则向受试者施用erk抑制剂。如果确定该基因特征不存在,则向受试者应用替代疗法,如化疗、免疫疗法、放疗或外科手术。在一些实施方案中,基因特征包括至少两种mapk途径基因的高于第一参考水平的第一总表达水平。在一些实施方案中,基因特征包括至少两种ras-erk反馈调节子的高于第二参考水平的第二总表达水平。在一些实施方案中,基因特征包括areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的高于第四参考水平的第四总表达水平。在一些实施方案中,基因特征包括dcun1d1、pik3ca、prkci、sox2和tp63的低于第五参考水平的第五总表达水平。在一些实施方案中,基因特征包括areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的第四总表达水平与dcun1d1、pik3ca、prkci、sox2和tp63的高于参考水平的第五总表达水平的比率。在一些实施方案中,基因特征包括hif1a表达水平与高于参考水平的tp63表达水平的比率。在一些实施方案中,基因特征包括至少一种mapk途径基因的拷贝数扩增。本文描述了示例性mapk途径基因和ras-erk反馈调节子。基因特征可仅包括升高的第一总表达水平、升高的第二总表达水平、升高的第四总表达水平、降低的第五总表达水平或拷贝数扩增中的一种,或者基因特征可包括上述的组合,如升高的第一总表达水平和拷贝数扩增。在一些实施方案中,针对是否存在基因特征来筛选受试者包括对从受试者分离的核酸进行核酸分析。该核酸可来自鳞状细胞癌细胞。
在某些实施方案中,本公开内容提供用erk抑制剂来下调多个鳞状细胞癌细胞中的mapk信号传导输出的方法。在一些实施方案中,该方法包括:(a)在包含来自受试者的核酸的生物样品中评估:(1)至少两种mapk途径基因的第一总表达水平和/或(2)至少两种ras-erk反馈调节子的第二总表达水平;和(b)如果第一总表达水平高于第一参考水平和/或如果第二总表达水平高于第二参考水平,则向该多个细胞施用有效剂量的erk抑制剂,其中第一参考水平和第二参考水平各自表明对该erk抑制剂的低敏感性。
在某些实施方案中,本公开内容提供用erk抑制剂来下调多个头颈鳞状细胞癌细胞中的mapk信号传导输出的方法,其包括:(a)在包含来自受试者的核酸的生物样品中评估:(1)areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的第四总表达水平;(2)dcun1d1、pik3ca、prkci、sox2和tp63的第五总表达水平;(3)第四总表达水平与第五总表达水平的比率;和/或(4)hif1a表达水平与tp63表达水平的比率;和(b)如果:(1)第四总表达水平高于第四参考水平,(2)第五总表达水平低于第五参考水平,(3)第四总表达水平与第五总表达水平的比率大于1,和/或(4)hif1a与tp63的比率大于1,则向该多个细胞施用有效剂量的erk抑制剂,其中第四参考水平和第五参考水平各自表明对该erk抑制剂的低敏感性。
在某些实施方案中,本公开内容提供用erk抑制剂来下调多个鳞状细胞癌细胞中的mapk信号传导输出的方法,其包括:(a)在包含来自受试者的核酸的生物样品中评估至少一种mapk途径基因的拷贝数谱;和(b)如果拷贝数谱包含平均拷贝数大于2的至少一种mapk途径基因,则向该多个细胞施用有效剂量的erk抑制剂。
在某些实施方案中,本公开内容提供对受试者的鳞状细胞癌状态进行分类的方法。在一些实施方案中,该方法包括:(a)从受试者获得生物样品,该样品包含来自受试者的鳞状细胞癌细胞的基因组和/或转录组物质;(b)评估:(1)该样品中的至少两种mapk途径基因的第一总表达水平,和/或(2)该样品中的至少两种ras-erk反馈调节子的第二总表达水平;(c)基于以下生成表达谱:(1)第一总表达水平与第一参考水平之间的比较,和/或(2)第二总表达水平与第二参考水平之间的比较,其中第一参考水平和第二参考水平从来自具有已知鳞状细胞癌状态的不同受试者的参考样品中获得;和(d)基于表达谱,对(a)的受试者的鳞状细胞癌状态进行分类。如果第一总表达水平高于第一参考水平,则鳞状细胞癌状态可被分类为可能对erk抑制剂治疗敏感,其中第一参考水平表明对erk抑制剂的低敏感性。类似地,如果第二总表达水平高于第二参考水平,则鳞状细胞癌状态可被分类为可能对erk抑制剂治疗敏感,其中第二参考水平表明对erk抑制剂的低敏感性。在一些实施方案中,不同受试者的已知鳞状细胞癌状态被分类为对erk抑制剂有抗性或者对erk抑制剂敏感。在一些实施方案中,分类步骤包括基于表达谱,使用计算机系统来计算受试者对erk抑制剂治疗有反应的可能性,其中针对第一总表达水平相对于第一参考水平的每个倍增以及第二总表达水平相对于第二参考水平的每个倍增,上调该可能性,其中第一参考水平和第二参考水平各自表明对该erk抑制剂的低敏感性。任选地,该方法进一步包括制作包括受试者对erk抑制剂治疗有反应的可能性的预测的报告。
在某些实施方案中,本公开内容提供对受试者的头颈鳞状细胞癌状态进行分类的方法,其包括:(a)从受试者获得生物样品,该样品包含来自受试者的鳞状细胞癌细胞的基因组和/或转录组物质;(b)在样品中评估:(1)areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的第四总表达水平;(2)dcun1d1、pik3ca、prkci、sox2和tp63的第五总表达水平;和/或(3)hif1a和tp63的表达水平;(c)基于以下生成表达谱:(1)第四总表达水平与第四参考水平之间的比较,(2)第五总表达水平与第五参考水平之间的比较,(3)第四总表达水平与第五总表达水平之间的比较,和/或(4)hif1a和tp63的表达水平之间的比较,其中第四参考水平和第五参考水平从来自具有已知鳞状细胞癌状态的不同受试者的参考样品获得;和(d)基于表达谱,对(a)的受试者的鳞状细胞癌状态进行分类。如果第四总表达水平高于第四参考水平,则鳞状细胞癌状态可被分类为可能对erk抑制剂治疗敏感,其中第四参考水平表明对erk抑制剂的低敏感性。在一些实施方案中,如果第五总表达水平低于第五参考水平,则鳞状细胞癌状态被分类为可能对erk抑制剂治疗敏感,其中第五参考水平表明对erk抑制剂的低敏感性。在一些实施方案中,如果第四总表达水平与第五总表达水平的比率大于1,则鳞状细胞癌状态被分类为可能对erk抑制剂治疗敏感。在一些实施方案中,如果hif1a表达水平与tp63表达水平的比率大于1,则鳞状细胞癌状态被分类为可能对erk抑制剂治疗敏感。在一些实施方案中,分类步骤包括基于表达谱,使用计算机系统来计算受试者对erk抑制剂治疗有反应的可能性,其中针对第四总表达水平相对于第四参考水平的每个倍增,上调该可能性,并且针对第五总表达水平相对于第五参考水平的每个倍增,下调该可能性,其中第四参考水平和第五参考水平各自表明对该erk抑制剂的低敏感性。
在某些实施方案中,本公开内容提供对受试者的鳞状细胞癌状态进行分类的方法,其包括:(a)从受试者获得生物样品,该样品包含来自受试者的鳞状细胞癌细胞的基因组和/或转录组物质;(b)评估样品中的至少一种mapk途径基因的拷贝数谱;和(c)基于拷贝数谱,对受试者的鳞状细胞癌状态进行分类。如果拷贝数谱包含平均拷贝数大于2的至少一种mapk途径基因,则鳞状细胞癌状态可被分类为可能对erk抑制剂治疗敏感。在一些实施方案中,分类步骤包括基于拷贝数谱,使用计算机系统来计算受试者对erk抑制剂治疗有反应的可能性,其中每有一个额外的拷贝数大于2的至少一种mapk途径基因,上调该可能性。任选地,该方法进一步包括制作包括受试者对erk抑制剂治疗有反应的可能性的预测的报告。
在某些实施方案中,本公开内容提供评估患有头颈鳞状细胞癌的受试者对erk抑制剂治疗展现出临床有益反应的可能性的方法,该方法包括:(a)在包含来自鳞状细胞癌细胞的基因组和/或转录组物质的生物样品中评估:(1)areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的第四总表达水平;(2)dcun1d1、pik3ca、prkci、sox2和tp63的第五总表达水平;和/或(3)hif1a和tp63的表达水平;(b)基于以下使用计算机系统来计算erk抑制剂反应性的加权概率:(1)第四总表达水平与第四参考水平之间的比较,(2)第五总表达水平与第五参考水平之间的比较,(3)第四总表达水平与第五总表达水平之间的比较,和/或(4)hif1a和tp63的表达水平之间的比较,其中第四参考水平和第五参考水平来自一个或多个参考样品。
在某些实施方案中,本公开内容提供评估患有鳞状细胞癌的受试者对erk抑制剂治疗展现出临床有益反应的可能性的方法。在一些实施方案中,该方法包括:(a)在包含来自鳞状细胞癌细胞的基因组和/或转录组物质的生物样品中评估(1)至少两种mapk途径基因的第一总表达水平,和/或(2)至少两种ras-erk反馈调节子的第二总表达水平;(b)基于以下使用计算机系统来计算erk抑制剂反应性的加权概率:(1)第一总表达水平与第一参考水平之间的比较,和/或(2)第二总表达水平与第二参考水平之间的比较,其中第一参考水平和第二参考水平来自一个或多个参考样品。在一些实施方案中,该方法进一步包括如果加权概率对应于基线概率的至少1.5倍,则将受试者指定为有较高的概率对erk抑制剂治疗展现出临床有益反应,其中基线概率代表在获得(b)的加权概率之前受试者对erk抑制剂治疗将展现出临床有益反应的可能性。在一些实施方案中,该方法进一步包括向接受者传递关于可能性的信息。在一些实施方案中,该方法进一步包括基于加权概率而提供建议。该建议可包括用erk抑制剂来治疗受试者,或者备选地中止疗法,或者施用化疗、免疫疗法、放疗或外科手术中的一种或多种。在一些实施方案中,该方法进一步包括基于加权概率来选择治疗。在一些实施方案中,该方法进一步包括基于加权概率向受试者施用erk抑制剂。
在某些实施方案中,本公开内容提供评估患有鳞状细胞癌的受试者对erk抑制剂治疗展现出临床有益反应的可能性的方法,该方法包括:(a)评估包含来自鳞状细胞癌细胞的基因组和/或转录组物质的生物样品中的至少一种mapk途径基因的拷贝数谱;(b)基于拷贝数谱,使用计算机系统来计算erk抑制剂反应性的加权概率。在一些实施方案中,该方法进一步包括如果加权概率对应于基线概率的至少1.5倍,则将受试者指定为有较高的概率对erk抑制剂治疗展现出临床有益反应,其中基线概率代表在获得(b)的加权概率之前受试者对erk抑制剂治疗将展现出临床有益反应的可能性。可向接受者传递关于所述可能性的信息。在一些实施方案中,该方法进一步包括基于加权概率而提供建议。该建议可包括用erk抑制剂来治疗受试者,或者备选地中止疗法,或者施用化疗、免疫疗法、放疗或外科手术中的一种或多种。可基于加权概率来选择治疗。在一些实施方案中,该方法进一步包括基于加权概率来施用所述erk抑制剂。
在一些实施方案中,所述至少一种mapk途径基因的拷贝数谱通过选自以下的方法来评估:原位杂交(ish)、southern印迹法、免疫组织化学(ihc)、聚合酶链反应(pcr)、定量pcr(qpcr)、定量实时pcr(qrt-pcr)、比较基因组杂交(cgh)、基于微阵列的比较基因组杂交,以及连接酶链反应(lcr)。在一些实施方案中,原位杂交选自荧光原位杂交(fish)、显色原位杂交(cish)和银原位杂交(sish)。在一些实施方案中,拷贝数谱使用来自受试者的核酸样品来评估,如基因组dna、cdna、ctdna、无细胞dna、rna或mrna。在一些实施方案中,核酸来自鳞状细胞癌细胞。在一些实施方案中,所述至少一种mapk途径基因选自cdk4、cdk6、egfr、erk1、ccnd1、kras、erk2和hras。在一些实施方案中,所述至少一种mapk途径基因为egfr。在一些实施方案中,鳞状细胞癌为食管鳞状细胞癌。
在实践主题方法中的任一种时,可以将至少两种mapk途径基因中的每一种的单独表达水平加在一起以得到第一总表达水平。所述至少两种mapk途径基因可包括至少2种、至少3种、至少4种、至少5种、至少6种、至少7种或至少8种mapk途径基因,如2种、3种、4种、5种、6种、7种或8种mapk途径基因。在一些实施方案中,仅需2种mapk途径基因,如erk和ccnd1、erk1和egfr或者egfr和ccnd1,即可预测鳞状细胞癌对erk抑制剂的敏感性。在一些实施方案中,3种mapk途径基因,如egfr、erk1和ccnd1,或者egfr、erk1和kras,可预测鳞状细胞癌对erk抑制剂的敏感性。在一些实施方案中,4种mapk途径基因,如egfr、erk1、ccnd1和kras,可预测鳞状细胞癌对erk抑制剂的敏感性。在一些实施方案中,6种mapk途径基因,如egfr、erk1、ccnd1、kras、erk2和hras,可预测鳞状细胞癌对erk抑制剂的敏感性。在一些实施方案中,8种mapk途径基因,如cdk4、cdk6、egfr、erk1、ccnd1、kras、erk2和hras,可预测鳞状细胞癌对erk抑制剂的敏感性。
具有高于第一参考水平的第一总表达水平的鳞状细胞癌比具有低于第一参考水平的第一总表达水平的鳞状细胞癌更有可能对erk抑制剂治疗有反应。至少两种mapk途径基因的预测能力可随着第一总表达水平与第一参考水平之间的绝对差异的增加而增加。
第一参考水平可通过评估来自一个或多个患有对erk抑制剂治疗展现出低敏感性的鳞状细胞癌的受试者的生物样品中的至少两种mapk途径基因的总表达水平来获得。在一些实例中,第一参考水平是多个鳞状细胞癌样品中的至少两种mapk途径基因的平均总表达水平。所述多个可包括至少5个、10个、20个、30个、40个或至少50个样品。
在实践主题方法中的任一种时,可将至少两种ras-erk反馈调节子中的每一个的单独表达水平加在一起,得到第二总表达水平。所述至少两种ras-erk反馈调节子可包括至少2种、至少3种、至少4种、至少5种、至少6种、至少7种或至少8种ras-erk反馈调节子,如2种、3种、4种、5种、6种、7种或8种ras-erk反馈调节子。在一些实施方案中,仅需2种ras-erk反馈调节子,如dusp5和dusp6,即可预测鳞状细胞癌对erk抑制剂的敏感性。在一些实施方案中,4种ras-erk反馈调节子,如dusp5、dusp6、dusp2和dusp4,可预测鳞状细胞癌对erk抑制剂的敏感性。在一些实施方案中,5种ras-erk反馈调节子,如dusp5、dusp6、spry2、spry4和spred1,可预测鳞状细胞癌对erk抑制剂的敏感性。
具有高于第二参考水平的第二总表达水平的鳞状细胞癌比具有低于第二参考水平的第二总表达水平的鳞状细胞癌更有可能对erk抑制剂治疗有反应。至少种种ras-erk反馈调节子的预测能力可随着第二总表达水平与第二参考水平之间的绝对差异的增加而增加。
第二参考水平可通过评估来自一个或多个患有对erk抑制剂治疗展现出低敏感性的鳞状细胞癌的受试者的生物样品中的至少两种ras-erk反馈调节子的总表达水平来获得。在一些实例中,第二参考水平是多个鳞状细胞癌样品中的至少两种ras-erk反馈调节子的平均总表达水平。所述多个可包括至少5个、10个、20个、30个、40个或至少50个样品。
本文所述的任何方法和系统均可利用mapk途径基因和ras-erk反馈调节子的组合来选择适于用erk抑制剂治疗的鳞状细胞癌。因此,当本文所述的方法记载了选择至少两种mapk途径基因的第一总表达水平和/或至少两种ras-erk反馈调节子的第二总表达水平时,应当认识到,可将至少一种mapk途径基因和至少一种ras-erk反馈调节子的表达加在一起,得到可以替代本文所述任何方法的总表达水平。例如,ccnd1、craf、dusp5、egfr、erk1和kras的总表达水平可与相应的参考水平进行比较,其中总表达水平高于参考水平表明用erk抑制剂治疗受试者有可能产生临床有益反应。可以将至少一种mapk途径基因和至少一种ras-erk反馈调节子的总表达水平与相应的参考水平进行比较。参考水平可表明对erk抑制剂的低敏感性。在一些实施方案中,参考水平可以通过评估来自一个或多个患有对erk抑制剂治疗展现出低敏感性的鳞状细胞癌的受试者的生物样品中的至少一种mapk途径基因以及至少一种ras-erk反馈调节子的总表达水平来获得。在一些实例中,参考水平为多个鳞状细胞癌样品中的至少一种mapk途径基因和至少一种ras-erk反馈调节子的平均总表达水平。所述多个可包括至少5个、10个、20个、30个、40个或至少50个样品。当本文所述的方法记载了选择至少两种mapk途径基因的第一总表达水平和/或至少两种ras-erk反馈调节子的第二总表达水平时,还考虑至少一种mapk途径基因和至少一种ras-erk反馈调节子的第三总表达水平。该第三总表达水平可与第三参考水平进行比较。该第三总表达水平的至少一种mapk途径基因和至少一种ras-erk反馈调节子可选自egfr、erk1、ccnd1、kras、erk2、hras、dusp5、dusp6、dusp2、dusp4、spry2、spry4、spred1和craf,如ccnd1、craf、dusp5、egfr、erk1和kras,如ccnd1、craf、dusp5、egfr、erk1和kras。
在实践主题方法中的任一种时,可将areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa中的每一个的单独表达水平加在一起,得到第四总表达水平。具有高于第四参考水平的第四总表达水平的鳞状细胞癌如头颈鳞状细胞癌比具有低于第四参考水平的第四总表达水平的鳞状细胞癌更有可能对erk抑制剂治疗有反应。预测能力可随着第四总表达水平与第四参考水平之间的绝对差异的增加而增加。该第四参考水平可以通过评估来自一个或多个患有对erk抑制剂治疗展现出低敏感性的鳞状细胞癌的受试者的生物样品中的areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的总表达水平来获得。
在实践主题方法中的任一种时,可将dcun1d1、pik3ca、prkci、sox2和tp63中的每一个的单独表达水平加在一起,得到第五总表达水平。具有低于第五参考水平的第五总表达水平的鳞状细胞癌如头颈鳞状细胞癌比具有高于第五参考水平的第五总表达水平的鳞状细胞癌更有可能对erk抑制剂治疗有反应。预测能力可随着第五总表达水平与第五参考水平之间的绝对差异的增加而增加。该第五参考水平可通过评估来自一个或多个患有对erk抑制剂治疗展现出低敏感性的鳞状细胞癌的受试者的生物样品中的dcun1d1、pik3ca、prkci、sox2和tp63的总表达水平来获得。
在一些实施方案中,直接比较第四总表达水平与第五总表达水平而无需确定相应的参考水平。例如,第四总表达水平与第五总表达水平的比率大于0.4、大于0.5、大于0.6、大于0.7、大于0.8、大于0.9、大于1、大于1.1、大于1.2、大于1.3、大于1.4、大于1.5、大于2、大于2.5、大于3、大于4、大于5、大于6、大于7、大于8、大于9或大于10,如大于1的鳞状细胞癌如头颈鳞状细胞癌可比该比率小于0.4的鳞状细胞癌更有可能对erk抑制剂治疗有反应。预测能力可随着该比率的增加而增加。在一些优选实施方案中,第四总表达水平与第五总表达水平的比率大于1的鳞状细胞癌可比该比率小于1的鳞状细胞癌更有可能对erk抑制剂治疗有反应。
在一些实施方案中,直接比较hif1a与tp63的表达水平而无需要确定相应的参考水平。例如,hif1a与tp63a的比率大于0.4、大于0.5、大于0.6、大于0.7、大于0.8、大于0.9、大于1、大于1.1、大于1.2、大于1.3、大于1.4、大于1.5、大于2、大于2.5、大于3、大于4、大于5、大于6、大于7、大于8、大于9或大于10,如大于1的鳞状细胞癌如头颈鳞状细胞癌可比该比率小于0.4的鳞状细胞癌更有可能对erk抑制剂治疗有反应。预测能力可随着该比率的增加而增加。在一些优选实施方案中,hif1a与tp63的比率大于1的鳞状细胞癌可比该比率小于1的鳞状细胞癌更有可能对erk抑制剂治疗有反应。
在实践主题方法中的任一种时,可评估至少一种mapk途径基因的平均拷贝数。所述至少一种mapk途径基因可包括至少1种、至少2种、至少3种、至少4种、至少5种、至少6种、至少7种或至少8种mapk途径基因,如1种、2种、3种、4种、5种、6种、7种或8种mapk途径基因。在一些实施方案中,一种mapk途径基因如egfr可预测鳞状细胞癌对erk抑制剂的敏感性。所述至少一种mapk途径基因可选自cdk4、cdk6、egfr、erk1、ccnd1、kras、erk2和hras,如egfr。
具有至少一种mapk途径基因的拷贝数扩增的鳞状细胞癌可能更有可能对erk抑制剂治疗有反应。例如,具有平均拷贝数大于2的至少一种mapk途径基因的鳞状细胞癌比具有平均拷贝数小于2的至少一种mapk途径基因的鳞状细胞癌可能更有可能对erk抑制剂治疗有反应。至少一种mapk途径基因的预测能力可随着该平均拷贝数的增加而增加。例如,平均拷贝数大于3、大于4、大于5、大于6、大于7、大于8、大于9或大于10的至少一种mapk途径基因可预测鳞状细胞癌对erk抑制剂的敏感性。在一些实施方案中,如果多于一种mapk途径基因展现出拷贝数扩增,则至少一种mapk途径基因的预测能力增加。
可将第一总表达水平与第一参考水平进行比较以计算erk抑制剂反应性的加权概率。在一些实施方案中,将第二总表达水平与第二参考水平进行比较以计算erk抑制剂反应性的加权概率。在一些实施方案中,将第三总表达水平与第三参考水平进行比较以计算erk抑制剂反应性的加权概率。在一些实施方案中,将第四总表达水平与第四参考水平进行比较以计算erk抑制剂反应性的加权概率。在一些实施方案中,将第五总表达水平与第五参考水平进行比较以计算erk抑制剂反应性的加权概率。在一些实施方案中,使用至少一种mapk途径基因的拷贝数状态来计算erk抑制剂反应性的加权概率。任选地,计算erk抑制剂反应性的加权概率包括评估至少一种mapk途径基因的第一总表达水平、第二总表达水平、第三总表达水平、第四总表达水平、第五总表达水平或拷贝数状态中的一种或多种。任选地,计算erk抑制剂反应性的加权概率包括评估至少一种mapk途径基因的第一参考水平、第二参考水平、第三参考水平、第四参考水平、第五参考水平或拷贝数状态中的一种或多种。任选地,计算通过计算机系统进行。本公开内容的任何方法可进一步包括如果加权概率对应于基线概率的至少1.5倍、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少15倍或至少20倍,如至少2倍,则将患有鳞状细胞癌的受试者指定为有较高的概率对erk抑制剂治疗展现出临床有益反应,其中基线概率表示在获得加权概率之前受试者对erk抑制剂治疗将展现出临床有益反应的可能性。
在一些实施方案中,本公开内容的方法包括在癌细胞如鳞状细胞癌细胞中差异表达的一组生物标志物。这些生物标志物的相对表达可用于鉴定更可能对erk抑制剂治疗有反应的细胞。在一些实施方案中,本公开内容的方法包括作为erk抑制剂敏感性的预测物的生物标志物。在一些实施方案中,生物标志物是与细胞途径相关的基因或基因产物,其包括,例如,map激酶(mapk)途径或ras-erk反馈调节途径。在一些实施方案中,mapk途径基因选自cdk4、cdk6、craf、egfr、erk1、ccnd1、kras、erk2和hras。在一些实施方案中,ras-erk反馈调节子选自dusp2、dusp4、dusp5、dusp6、spry2、spry4和spred1。如本文所用的,术语生物标志物可指mapk途径基因和/或ras-erk反馈调节子中的一种或多种。其他生物标志物可包括areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa,它们的超表达与对erk抑制剂治疗的敏感性相关。其他生物标志物可包括dcun1d1、pik3ca、prkci、sox2和tp63,它们的超表达与对erk抑制剂治疗的抗性相关。
在一些实施方案中,本公开内容的方法可包括通过评估一种或多种mapk途径基因的相对拷贝数来鉴定更有可能对erk抑制剂治疗有反应的细胞。在一些实施方案中,mapk途径基因选自cdk4、cdk6、craf、egfr、erk1、ccnd1、kras、erk2和hras。
本文描述的用于定性或定量多肽和/或多核苷酸的表达的方法提供了可与病理状态、疾病易感性、治疗监测、危险分层等相关的信息。在一些实施方案中,本公开内容的方法特别适用于诊断状况、评价erk抑制剂是否将会具有所需效果(即预测对erk抑制剂的反应性),以及确定预后。本方法可用于优化治疗方案。在这种情况下,对本文公开的生物标志物的表达谱的评价可用于获得关于组织样品的用erk抑制剂的治疗潜力的信息。
在一些实施方案中,本公开内容提供基于至少两种基因或基因产物的表达谱来测量患有癌症特别是鳞状细胞癌的受试者对erk抑制剂治疗展现出临床有益反应的可能性的方法。“表达谱”是指至少一种生物标志物如至少两种生物标志物的表达模式,其在多个样品中重现并反映这些样品的共同性质,如组织类型、对erk抑制剂治疗的反应或者细胞中特定生物过程或途径的激活。此外,相比于通过将样品随机分配至两组所能达成的,表达谱更准确地将共享该共同性质的样品与不共享该共同性质的样品相区分。表达谱可用于预测未知状态的样品是否共享该共同性质。预期至少一种生物标志物的水平与典型谱之间存在一些差异,但是,表达水平与典型谱的总体相似性使得在统计学上不太可能在不共享表达谱所反映的共同性质的样品中偶然观察到该相似性。
可基于来自测试受试者的样品中的至少两种生物标志物的总表达水平与相应的参考水平之间的比较来产生表达谱。所述至少两种生物标志物可包括作为erk抑制剂敏感性的预测物的mapk途径基因和/或ras-erk反馈调节子。在一些实施方案中,基于2种或更多种、3种或更多种、4种或更多种、5种或更多种、6种或更多种、7种或更多种或者8种或更多种生物标志物的表达来产生表达谱。在一些实施方案中,基于2种、3种、4种、5种、6种、7种或8种生物标志物的表达来产生表达谱。
在一些实施方案中,在本公开内容的方法中使用表达谱来评估对erk抑制剂治疗有反应的可能性。每有一个作为erk抑制剂敏感性的预测物的生物标志物超表达,上调反应的可能性。在一些实施方案中,每有一个作为erk抑制剂敏感性的预测物的生物标志物低表达,下调反应的可能性。低表达或超表达的量级可用于将调节量加权至反应可能性。优选地,将作为erk抑制剂敏感性的预测物的至少两种生物标志物的单独表达水平相加,得到总表达水平。
在一些实施方案中,本公开内容的方法提供了参考水平,生物标志物必须以高于参考水平表达方可在评估对erk抑制剂治疗有反应的可能性时被考虑。生物标志物可能在以比参考水平高或低至少1.1倍、至少1.2倍、至少1.3倍、至少1.4倍、至少1.5倍、至少2.0倍、至少2.25倍、至少2.5倍、至少2.75倍、至少3.0倍、至少3.5倍、至少4.0倍、至少5.0或至少10倍地差异表达时方可在调整反应可能性时被考虑。在一些实施方案中,参考水平是生物标志物表达的数值范围,该生物标志物表达从患有具有对erk抑制剂治疗低敏感性的癌症的个体群体的统计取样中获得。在一些实施方案中,参考水平是生物标志物表达的数值范围,该生物标志物表达从患有具有对erk抑制剂治疗有抗性的癌症的个体群体的统计取样中获得。参考水平可以是生物标志物表达的数值范围,该生物标志物表达从患有例如与测试受试者相同的癌症的个体群体的统计取样中获得。在一些实施方案中,参考水平通过比较敏感群体和抗性群体得到。
本发明人已发现在对erk抑制剂(例如本文所述的化合物)的疗法敏感的鳞状细胞癌细胞或腺癌细胞中扩增和/或差异表达的某些基因。更具体地,本公开内容涉及细胞外信号调节激酶1和2(erk1和erk2)的抑制剂在治疗癌症中的用途,所述癌症如胰腺癌、膀胱癌、胃癌和肺鳞状细胞癌(lscc)、食管鳞状细胞癌(escc)、头颈鳞状细胞癌(hnscc)和宫颈鳞状细胞癌。本文描述了使用关于基因的扩增和/或表达状态和/或基因表达产物的信息来鉴定可能对erk抑制剂疗法有反应的癌细胞的方法,以及鉴定患有预测对erk抑制剂治疗展现出临床有益反应的癌的受试者的方法。特别是,至少一种位于染色体11q13.3-13.4处的基因的扩增和/或超表达可表明对erk抑制剂疗法的敏感性。描述了使用某些基于dna和rna的生物标志物来鉴定更可能显示出对erk抑制的可靠治疗反应的肿瘤,如escc肿瘤。
在某些实施方案中,本公开内容提供治疗有需要的受试者的癌症的方法。在一些实施方案中,该方法包括向受试者施用有效剂量的细胞外信号调节激酶(erk)抑制剂,所述受试者包含展现出至少一种位于染色体11q13.3-13.4处的基因的扩增和/或超表达的基因组。在一些实施方案中,该方法进一步包括:(a)针对至少一种位于染色体11q13.3-13.4处的基因的扩增和/或超表达来筛选受试者;和(b)如果确定存在扩增和/或超表达,则向受试者施用erk抑制剂。如果确定不存在扩增和/或超表达,则向受试者应用替代疗法,如化疗、免疫疗法、放疗或外科手术。在一些实施方案中,筛选包括对从受试者,如从分离于受试者的癌细胞分离的核酸进行核酸分析。在一些实施方案中,该方法包括如果确定至少一种基因的扩增和超表达均存在,则向受试者施用erk抑制剂。在一些实施方案中,所述至少一种基因选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1和shank2。在一些实施方案中,所述至少一种基因选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1、shank2、fgf3、fgf4和fgf19。
在某些实施方案中,本公开内容提供治疗患有癌症的受试者的方法,其包括:(a)针对至少一种位于染色体11q13.3-13.4处的基因或者与位于染色体11q13.3-13.4处的基因共扩增的基因的扩增和/或超表达来筛选受试者;和(b)如果确定存在扩增和/或超表达,则向受试者施用erk抑制剂。如果确定不存在扩增和/或超表达,则向受试者应用替代疗法,如化疗、免疫疗法、放疗或外科手术。在一些实施方案中,筛选包括对从受试者,如从分离于受试者分离的癌细胞分离的核酸进行核酸分析。在一些实施方案中,该方法包括如果确定至少一种基因的扩增和超表达均存在,则向受试者施用erk抑制剂。在一些实施方案中,所述至少一种基因选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1和shank2。在一些实施方案中,所述至少一种基因选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1、shank2、fgf3、fgf4和fgf19。
在实践主题方法中的任一种时,如果受试者展现出ccnd1或ano1的扩增和/或超表达,则可向受试者施用erk抑制剂。如果受试者展现出ccnd1和ano1的扩增或超表达,则可向受试者施用erk抑制剂。如果受试者展现出ccnd1和ano1的扩增和超表达,则可向受试者施用erk抑制剂。在一些实施方案中,如果检测出至少一种选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1和shank2的基因的扩增和/或超表达,则可向受试者施用erk抑制剂。如果检测到ccnd1、cttn、fadd、oraov1、ano1、ppfia1和shank2或其组合中的一种或多种的扩增、超表达或其组合,则可向受试者施用erk抑制剂。在一些实施方案中,评估一种或多种位于染色体11q13.3-13.4的基因的总扩增和/或表达水平。在一些实施方案中,如果检测到至少一种选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1、shank2、fgf3、fgf4和fgf19的基因的扩增和/或超表达,则可向受试者施用erk抑制剂。如果检测到ccnd1、cttn、fadd、oraov1、ano1、ppfia1、shank2、fgf3、fgf4和fgf19或其组合中的一种或多种的扩增、超表达或其组合,则可向受试者施用erk抑制剂。
在某些实施方案中,本公开内容提供用erk抑制剂下调多个癌细胞中的mapk信号传导输出的方法。在一些实施方案中,该方法包括:(a)在包含来自多个细胞的核酸的生物样品中评估至少一种位于染色体11q13.3-13.4处的基因的拷贝数谱和/或表达谱;和(b)如果拷贝数谱包含至少一种平均拷贝数>2的基因,和/或如果表达谱大于参考水平,则向所述多个细胞施用有效剂量的erk抑制剂,其中参考水平表明对erk抑制剂的低敏感性。
在某些实施方案中,本公开内容提供对受试者的癌症状态进行分类的方法。在一些实施方案中,该方法包括:(a)从受试者获得生物样品,该样品包含来自受试者的癌细胞的基因组和/或转录组物质;(b)评估样品中的至少一种位于染色体11q13.3-13.4处的基因的拷贝数谱和/或表达谱;和(c)基于拷贝数谱和/或表达谱,对(a)的受试者的癌症状态进行分类。如果拷贝数谱包含至少一种平均拷贝数>2的基因,则癌症状态可被分类为可能对erk抑制剂治疗敏感。类似地,如果表达谱大于参考水平,则癌症状态可被分类为可能对erk抑制剂治疗敏感,其中参考水平表明对erk抑制剂的低敏感性。在一些实施方案中,分类步骤包括基于拷贝数谱和/或表达谱,使用计算机系统来计算受试者对erk抑制剂治疗有反应的可能性,其中每有一个额外的拷贝数大于2的至少一种基因以及表达谱相对于参考水平每个倍增,上调该可能性,其中参考水平表明对erk抑制剂的低敏感性。任选地,该方法进一步包括制作包括受试者对erk抑制剂治疗有反应的可能性的预测的报告。
在某些实施方案中,本公开内容提供评估患有癌症的受试者对erk抑制剂治疗展现出临床有益反应的可能性的方法,该方法包括:(a)评估包含来自癌细胞的基因组和/或转录组物质的生物样品中的至少一种位于染色体11q13.3-13.4处的基因的拷贝数谱和/或表达谱;和(b)基于拷贝数谱和/或表达谱,使用计算机系统来计算erk抑制剂反应性的加权概率。在一些实施方案中,该方法进一步包括如果加权概率对应于基线概率的至少1.5倍,则将受试者指定为有较高的概率对erk抑制剂治疗展现出临床有益反应,其中基线概率代表在获得(b)的加权概率之前受试者对erk抑制剂治疗将展现出临床有益反应的可能性。在一些实施方案中,该方法进一步包括向接受者传递关于可能性的信息。在一些实施方案中,该方法进一步包括基于加权概率而提供建议。该建议可包括用erk抑制剂来治疗受试者,或者备选地进行中止疗法、化疗、免疫疗法、放疗或外科手术。在一些实施方案中,该方法进一步包括基于加权概率来选择治疗。在一些实施方案中,该方法进一步包括基于加权概率来施用erk抑制剂。
在一些实施方案中,通过选自以下的方法来评估至少一种位于染色体11q13.3-13.4处的基因的拷贝数谱:原位杂交(ish)、southern印迹法、免疫组织化学(ihc)、聚合酶链反应(pcr)、定量pcr(qpcr)、定量实时pcr(qrt-pcr)、比较基因组杂交(cgh)、基于微阵列的比较基因组杂交,以及连接酶链反应(lcr)。在一些实施方案中,原位杂交选自荧光原位杂交(fish)、显色原位杂交(cish)和银原位杂交(sish)。在一些实施方案中,拷贝数谱使用来自受试者的核酸样品来评估,如基因组dna、cdna、ctdna、无细胞dna、rna或mrna。在一些实施方案中,拷贝数谱通过使用来自受试者的无细胞dna样品来评估。在一些实施方案中,核酸来自癌细胞。在一些实施方案中,所述至少一种位于染色体11q13.3-13.4处的基因选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1和shank2。在一些实施方案中,所述至少一种位于染色体11q13.3-13.4处的基因选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1、shank2、fgf3、fgf4和fgf19。在一些实施方案中,所述至少一种位于染色体11q13.3-13.4处的基因为ccnd1和ano1。在一些实施方案中,所述至少一种位于染色体11q13.3-13.4处的基因为ccnd1或ano1。在一些实施方案中,癌症为鳞状细胞癌,如食管鳞状细胞癌、肺鳞状细胞癌或头颈鳞状细胞癌。在一些实施方案中,癌症为食管鳞状细胞癌。
在实践主题方法中的任一种时,可将位于染色体11q13.3-13.4的至少一种基因中的每一个的单独表达水平加在一起,提供总表达水平。至少一种位于染色体11q13.3-13.4处的基因可包括至少2种、至少3种、至少4种、至少5种、至少6种或至少7种基因,如2种、3种、4种、5种、6种或7种基因。
至少一种位于染色体11q13.3-13.4的基因的总表达水平大于参考水平的癌症比至少一种位于染色体11q13.3-13.4的基因的总表达水平小于参考水平的癌症可能更有可能对erk抑制剂治疗有反应。至少一种位于染色体11q13.3-13.4的基因的预测能力可随着总表达水平与参考水平之间的绝对差异的增加而增加。
参考水平可以通过评估来自一个或多个患有对erk抑制剂治疗展现出低敏感性的癌症的受试者的生物样品中至少一种位于染色体11q13.3-13.4的基因的总表达水平来获得。在一些实例中,参考水平是多个癌症样品中的至少一种位于染色体11q13.3-13.4处的基因的平均总表达水平。所述多个可包括至少5个、10个、20个、30个、40个或至少50个样品。
本文所述的任何方法和系统可以利用mapk途径基因、ras-erk反馈调节子和位于染色体11q13.3-13.4的基因的组合来选择适于用erk抑制剂治疗的癌症。
在实践主题方法中的任一种时,可评估所述至少一种位于染色体11q13.3-13.4处的基因的平均拷贝数。至少一种位于染色体11q13.3-13.4处的基因可包括至少1种、至少2种、至少3种、至少4种、至少5种、至少6种或至少种个基因,如1种、2种、3种、4种、5种个、6种个或7种基因。在一些实施方案中,一种位于染色体11q13.3-13.4处的基因如ccnd1可预测癌症对erk抑制剂的敏感性。所述至少一种位于染色体11q13.3-13.4处的基因可选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1和shank2,如ccnd1和ano1。所述至少一种位于染色体11q13.3-13.4处的基因可选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1、shank2、fgf3、fgf4和fgf19。
具有至少一种位于染色体11q13.3-13.4处的基因的拷贝数扩增的癌症可能更有可能对erk抑制剂治疗有反应。例如,具有平均拷贝数大于2的至少一种位于染色体11q13.3-13.4处的基因的癌症比具有平均拷贝数小于2的至少一种位于染色体11q13.3-13.4处的基因的癌症可能更有可能对erk抑制剂治疗有反应。所述至少一种位于染色体11q13.3-13.4处的基因的预测能力可以随平均拷贝数的增加而增加。例如,平均拷贝数大于3、大于4、大于5、大于6、大于7、大于8、大于9或大于10的至少一种位于染色体11q13.3-13.4处的基因可预测癌症对erk抑制剂的敏感性。在一些实施方案中,如果超过一种位于染色体11q13.3-13.4处的基因展现出拷贝数扩增,则所述至少一种位于染色体11q13.3-13.4处的基因的预测能力增加。
可以将至少一种位于染色体11q13.3-13.4处的基因的总表达水平与参考水平进行比较,以计算erk抑制剂反应性的加权概率。在一些实施方案中,使用所述至少一种位于染色体11q13.3-13.4处的基因的拷贝数状态来计算erk抑制剂反应性的加权概率。任选地,计算erk抑制剂反应性的加权概率包括评估至少一种位于染色体11q13.3-13.4处的基因的总表达水平和拷贝数状态中的一个或多个。任选地,计算通过计算机系统进行。本公开内容的任何方法可进一步包括如果加权概率对应于基线概率的至少1.5倍、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少15倍或至少20倍,如至少2倍,则将患有癌症的受试者指定为有较高的概率对erk抑制剂治疗展现出临床有益反应,其中基线概率代表在获得加权概率之前受试者对erk抑制剂治疗将展现出临床有益反应的可能性。
在一些实施方案中,本公开内容的方法包括在癌细胞如癌细胞中差异表达的一组生物标志物。这些生物标志物的相对表达可用于鉴定更有可能对erk抑制剂治疗有反应的细胞。在一些实施方案中,本公开内容的方法包括作为erk抑制剂敏感性的预测物的生物标志物。在一些实施方案中,生物标志物是位于染色体11q13.3-13.4的基因或该基因的产物。在一些实施方案中,染色体11q13.3-13.4基因选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1和shank2。在一些实施方案中,染色体11q13.3-13.4基因选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1、shank2、fgf3、fgf4和fgf19。
在一些实施方案中,本公开内容的方法可包括通过评估至少一种位于染色体11q13.3-13.4的基因的相对拷贝数来鉴定更可能对erk抑制剂治疗有反应的细胞。在一些实施方案中,所述至少一种位于染色体11q13.3-13.4处的基因选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1和shank2。在一些实施方案中,所述至少一种位于染色体11q13.3-13.4处的基因选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1、shank2、fgf3、fgf4和fgf19。
本文所述的用于定性或定量多肽和/或多核苷酸的表达的方法提供了可与病理状态、疾病易感性、治疗监测和风险分层等相关的信息。在一些实施方案中,本公开内容的方法特别适用于诊断病症、评价erk抑制剂是否将会具有所需效果(即预测对erk抑制剂的反应性)以及确定预后。本方法可用于优化治疗方案。在这种情况下,对本文公开的生物标志物的表达谱的评价可用于获得关于用erk抑制剂治疗组织样品的潜力的信息。
在一些实施方案中,本公开内容提供为基于至少一种基因或基因产物的表达谱和/或拷贝数谱来测量患有癌症特别是鳞状细胞癌的受试者对erk抑制剂治疗将展现出临床有益反应的可能性的方法。“表达谱”是指至少一种生物标志物如至少两种生物标志物的表达模式,其在多个样品中重现并反映这些样品的共同性质,如组织类型、对erk抑制剂治疗的反应,或者细胞中特定生物过程或途径的激活。此外,相比于通过将样品随机分配至两组所能达成的,表达谱更准确地将共享该共同性质的样品与不共享该共同性质的样品相区分。表达谱可用于预测未知状态的样品是否共享该共同性质。预期至少一种生物标志物的水平与典型谱之间存在一些差异,但是,表达水平与典型谱的总体相似性使得在统计学上不太可能在不共享表达谱所反映的共同性质的样品中偶然观察到该相似性。
可以基于来自测试受试者的样品中的至少一种生物标志物的总表达水平与相应的参考水平之间的比较来生成表达谱。至少一种生物标志物可包括作为erk抑制剂敏感性的预测物的位于染色体11q13.3-13.4的基因。在一些实施方案中,表达谱基于1种或多种、2种或更多种、3种或更多种、4种或更多种、5种或更多种、6种或更多种或7种或更多种生物标志物的表达而产生。在一些实施方案中,表达谱基于1种、2种、3种、4种、5种、6或7种生物标志物的表达而产生。
在一些实施方案中,本公开内容的方法中使用表达谱来评估对erk抑制剂治疗的反应的可能性。每有一个作为erk抑制剂敏感性的预测物的生物标志物超表达,上调反应的可能性。在一些实施方案中,每有一个作为erk抑制剂敏感性的预测物的生物标志物低表达,下调反应的可能性。低表达或超表达的量级可用于将调整量加权至反应可能性。优选地,将作为erk抑制剂敏感性的预测物的一种或多种生物标志物的单独表达水平相加,得到总表达水平。
在一些实施方案中,本公开内容的方法提供了参考水平,生物标志物必须以高于参考水平表达方可在评估对erk抑制剂治疗有反应的可能性时被考虑。生物标志物可能在以比参考水平高或低至少1.1倍、至少1.2倍、至少1.3倍、至少1.4倍、至少1.5倍、至少2.0倍、至少2.25倍、至少2.5倍、至少2.75倍、至少3.0倍、至少3.5倍、至少4.0倍、至少5.0或至少10倍地差异表达时方可在调整反应可能性时被考虑。在一些实施方案中,参考水平是生物标志物表达的数值范围,该生物标志物表达从患有具有对erk抑制剂治疗低敏感性的癌症的个体群体的统计取样中获得。在一些实施方案中,参考水平是生物标志物表达的数值范围,该生物标志物表达从患有具有对erk抑制剂治疗有抗性的癌症的个体群体的统计取样中获得。参考水平可以是生物标志物表达的数值范围,该生物标志物表达从患有例如与测试受试者相同的癌症的个体群体的统计取样中获得。在一些实施方案中,参考水平通过比较敏感群体和抗性群体得到。
在实践主题方法中的任一种时,癌症可选自鳞状细胞癌和腺癌。在一些实施方案中,癌症选自肺鳞状细胞癌、食管鳞状细胞癌、宫颈鳞状细胞癌、头颈鳞状细胞癌、膀胱鳞状细胞癌和胃鳞状细胞癌。在一些实施方案中,癌症为食管鳞状细胞癌。在一些实施方案中,癌症为选自食管癌和胰腺癌的腺癌。在一些实施方案中,癌症选自肺癌、食管癌、宫颈癌、头颈癌、膀胱癌、胃癌和胰腺癌。在一些实施方案中,癌症选自乳腺癌、胰腺癌、肺癌、甲状腺癌、精原细胞瘤、黑素瘤、膀胱癌、肝癌、肾癌、骨髓增生异常综合征、急性髓细胞性白血病和结直肠癌。
某些实施方案考虑人受试者,如已被诊断为患有癌症如鳞状细胞癌或者处于发展或获得癌症如鳞状细胞癌危险中的受试者。某些其他实施方案考虑非人受试者,例如非人类灵长类动物如猕猴、黑猩猩、大猩猩、长尾黑颚猴、猩猩或其他非人类灵长类动物,包括本领域已知的作为临床前模型的非人受试者。某些其他实施方案考虑为哺乳动物的非人受试者,例如小鼠、大鼠、兔、猪、绵羊、马、牛、山羊、沙鼠、仓鼠、豚鼠或其他哺乳动物。还考虑其他实施方案,其中受试者或生物来源可以是非哺乳动物脊椎动物,例如,另一高等脊椎动物,或禽类、两栖动物或爬行动物物种,或者另一受试者或生物来源。在本公开内容的某些实施方案中,使用转基因动物。转基因动物是非人动物,其中动物的一种或多种细胞包括非内源性(即,异源性)的核酸,并且作为染色体外元件存在于其细胞的一部分中或者稳定地整合到其种系dna中(即,在其大多数或所有细胞的基因组序列中)。
可以根据本公开内容的方法分析和/或治疗任何癌症。本文所述的方法在分析和/或治疗鳞状细胞癌中特别有效。示例性鳞状细胞癌包括皮肤鳞状细胞癌、头颈鳞状细胞癌、甲状腺鳞状细胞癌、食管鳞状细胞癌、肺鳞状细胞癌、阴茎鳞状细胞癌、前列腺鳞状细胞癌、阴道鳞状细胞癌、宫颈鳞状细胞癌和膀胱鳞状细胞癌。优选地,鳞状细胞癌选自肺鳞状细胞癌、食管鳞状细胞癌和头颈鳞状细胞癌。在一些实施方案中,鳞状细胞癌为肺鳞状细胞癌。在一些实施方案中,鳞状细胞癌为食管鳞状细胞癌。在一些实施方案中,鳞状细胞癌为头颈鳞状细胞癌。在一些实施方案中,鳞状细胞癌为宫颈鳞状细胞癌。
通常,受试者的样品(例如生物样品)包含癌细胞或前癌细胞。生物样品可为组织样品。样品可以是固体生物样品,例如,肿瘤活检物。活检物可以是固定的、石蜡包埋的、新鲜的或冷冻的。样品通过任何合适的方式获得,包括但不限于针吸、细针抽吸、芯针活检、真空辅助活检、大芯针活检、切口活检、切除活检、穿刺活检、刮取活检、皮肤活检和静脉穿刺。样品可以源自细针活检物、芯针活检物或其他类型的活检物,或者可以包含循环肿瘤细胞。在一些实例中,样品包含无细胞dna(cfdna)。生物样品可以是全血或血浆样品。可直接分析样品的内容物来,或者可对样品进行处理从而纯化其一种或多种内容物以供分析。直接分析样品的方法是本领域已知的,包括但不限于质谱法和组织学染色程序。在一些实施方案中,从样品中纯化一种或多种组分,用于检测生物标志物的erk抑制剂反应。在一些实施方案中,纯化的样品组分为蛋白质(例如,总蛋白、胞质蛋白或膜蛋白)。在一些实施方案中,纯化的样品组分为核酸,如dna(例如,基因组dna、cdna、ctdna或cfdna)或rna(例如,总rna或mrna)。在一些实施方案中,核酸来自癌细胞,如鳞状细胞癌细胞。
本领域已知用于提取、纯化和扩增核酸的方法。例如,核酸可以通过用苯酚、苯酚/氯仿/异戊醇或类似制剂(包括trizol和trireagent)进行有机提取来纯化。提取技术的其他非限制性实例包括:有机提取然后乙醇沉淀,例如,使用苯酚/氯仿有机试剂(ausubel等人,1993),使用或不使用自动核酸提取器,例如,可从appliedbiosystems(fostercity,calif)获得的model341dna提取器;固定相吸附法(美国专利号5,234,809;walsh等人,1991);和盐诱导的核酸沉淀法(miller等人,(1988),这种沉淀方法通常被称为“盐析”方法。核酸分离和/或纯化的另一个实例包括使用核酸可以特异性或非特异性结合的磁性颗粒,然后使用磁体分离珠粒,并洗涤以及从珠粒洗脱核酸(参见例如美国专利号5,705,628)。在一些实施方案中,在上述分离方法之前可以进行酶消化步骤从而实现从样品除去不需要的蛋白质,例如用蛋白酶k或其他类似的蛋白酶来消化。参见例如美国专利号7,001,724。如果需要,可以将rna酶抑制剂添加至裂解缓冲液中。对于某些细胞或样品类型,可能需要在方案中增加蛋白质变性/消化的步骤。纯化方法可涉及分离dna、rna或两者。当在提取程序期间或之后将dna和rna两者一起分离时,则可以采用另外的步骤纯化其中一者或单独纯化二者。还可以产生所提取的核酸的亚级分,例如,通过大小、序列或其他物理或化学特征来进行纯化。除了初始核酸分离步骤之外,可在本公开内容的方法中的任何步骤之后进行核酸的纯化(,如以便除去过量或不需要的试剂、反应物或产物。
在一些实施方案中,将样品多核苷酸片段化成一个或多个特定大小范围的片段化dna分子群。在一些实施方案中,片段从约或至少约1、10、100、1000、10000、100000、300000、500000或更多的基因组当量的起始dna产生。片段化可以通过本领域已知的方法完成,包括化学片段化、酶促片段化和机械片段化。在一些实施方案中,片段具有约10至约10,000个核苷酸的平均长度。在一些实施方案中,片段具有约50至约2,000个核苷酸的平均长度。在一些实施方案中,片段具有约10-2,500、10-1,000、10-800、10-500、50-500、50-250、50-150或100-2,500个核苷酸的平均或中值长度。在一些实施方案中,片段化通过使样品多核苷酸经受声学超声处理而机械地完成。在一些实施方案中,片段化包括在适于一种或多种酶的条件下用一种或多种酶处理样品多核苷酸,以产生双链核酸断裂。可用于产生多核苷酸片段的酶的实例包括序列特异性核酸酶和非序列特异性核酸酶。核酸酶的非限制性实例包括dna酶i、片段化酶、限制性内切核酸酶、其变体及其组合。例如,用dna酶i消化可在不存在mg++和存在mn++的情况下诱导dna中的随机双链断裂。在一些实施方案中,片段化包括用一种或多种限制性内切核酸酶来处理样品多核苷酸。片段化可产生具有5’突出端、3’突出端、平端或其组合的片段。在一些实施方案中,如当片段化包括使用一种或多种限制性内切核酸酶时,样品多核苷酸的切割保留具有可预测序列的突出端。在一些实施方案中,该方法包括经由标准方法(如柱纯化或从琼脂糖凝胶中分离)来选择片段大小的步骤。
在一些实施方案中,将来自受试者的样品的一种或多种多核苷酸扩增。通常,扩增包括以模板依赖性方式产生全部或部分多核苷酸的一个或多个拷贝。扩增可以是引物依赖性的或者与引物无关的。当引物依赖性时,扩增可针对样品中的一种或多种特定多核苷酸或其部分,如一个或多个区(例如,约或多于约1、5、10、15、20、25、30、35、40、45、50、75、100、200、500个区或者更多个区),每个区包含一个或多个感兴趣的序列,并且具有约、小于约或大于约1、5、10、25、50、100、150、200、250、350、500、1000、2000个或更多个核苷酸的长度。扩增可以是线性的或非线性的(例如指数的)。扩增可以包括温度的定向变化,或者可以是等温的。本领域已知用于靶多核苷酸的引物定向扩增的方法,并且该方法包括但不限于基于聚合酶链式反应(pcr)的方法。本领域已知有利于通过pcr扩增靶序列的条件,该条件可以在该过程的各个步骤中进行优化,并取决于反应中元素的特征,如靶标类型、靶标浓度、待扩增的序列长度、靶标和/或一个或多个引物的序列、引物长度、引物浓度、所使用的聚合酶、反应体积、一种或多种元素与一种或多种其他元素的比例,这些因素的一些或全部可被改变。通常,pcr包括使待扩增的靶标变性(如果是双链的)、使一个或多个引物与靶标杂交以及通过dna聚合酶使引物延伸的步骤,其中重复(或“循环”)该步骤从而扩增靶序列。可针对各种结果来优化该过程中的步骤,如提高产率、减少假产物的形成和/或增加或降低引物退火的特异性。本领域公知优化方法,其包括调整扩增反应中元素的类型或量,和/或调整过程中给定步骤的条件,如调整特定步骤的温度,特定步骤的持续时间和/或循环次数。在一些实施方案中,扩增反应包括至少5、10、15、20、25、30、35、50或更多个循环。在一些实施方案中,扩增反应包括不超过5、10、15、20、25、35、50或更多个循环。循环可包含任意数量的步骤,如1、2、3、4、5、6、7、8、9、10或更多个步骤。步骤可包括有利于实现给定步骤的目的的任何温度或温度梯度,包括但不限于引物退火、引物延伸和链变性。步骤可具有任何持续时间,包括但不限于约、小于约或大于约1、5、10、15、20、25、30、35、40、45、50、55、60、70、80、90、100、120、180、240、300、360、420、480、540、600或更多秒,包括无限期直至手动中断。包括不同步骤的任何数目的循环可以以任何顺序进行组合。在一些实施方案中,将包括不同步骤的不同循环进行组合,使得组合中的循环总数为约、小于约或大于约5、10、15、20、25、30、35、50个或更多个循环。
可通过任何合适的方法来评估生物标志物如mapk途径基因或ras-erk反馈调节子的总表达水平。生物标志物的表达水平可通过检测由生物标志物转录的mrna水平;通过检测由从生物标志物转录的mrna逆转录产生的cdna水平;通过检测由生物标志物编码的多肽的水平或通过核酸扩增测定、杂交测定、测序或其组合来评估。还可间接确定靶基因或基因转录物的调节,如通过测量对基因的表型指示物或基因转录物活性的影响,如通过细胞测定。本领域已知检测基因表达产物的方法,其实例在本文中描述。这些方法可以逐个样品进行,或者经修改而用于高通量分析,例如,使用affymetrixtmu133微阵列芯片。
任选地,评估基因如mapk途径基因或ras-erk反馈调节子的总表达水平包括形成多个复合体,每个复合体包含基因的表达产物和与基因的表达产物杂交的核酸探针之间的缔合。核酸探针可包含第一核酸复合体,其中该复合体包含:(i)能够结合靶核酸的第一靶标特异性序列,(ii)第一标记附接区,其与第一靶标特异性序列不重叠,包含与第一核酸分子杂交的第一dna序列,该第一核酸分子附接至发射构成第一信号的光的一个或多个可检测标记,(iii)第二标记附接区,其与第一靶标特异性序列和第一标记附接区不重叠,其包含与第二核酸分子杂交的第二dna序列,该第二核酸分子附接至发射构成第二信号的光的一个或多个可检测标记,和(iv)能够选择性地结合至底物的第一部分。任选地,核酸探针进一步包含第二核酸复合体,该第二核酸复合体包含:(i)能够结合靶核酸的第二靶标特异性序列,其中第一靶标特异性序列和第二靶标特异性序列结合至靶核酸的不同区,和(ii)能够选择性地结合至底物的第二部分。在一些实施方案中,第一核酸分子包含至少一个与其他标记附接区不重叠的另外的附接区。至少一个另外的标记附接区可包含与核酸分子杂交的dna序列,该核酸分子与至少一个发射光的可检测标记相附接。至少一个另外的标记附接区可包含与核酸分子杂交的dna序列,该核酸分子不与发射光的可检测标记相附接。在一些实施方案中,第一和第二核酸分子各自包含四个或更多个氨基烯丙基修饰的utp核苷酸,其中一个或多个荧光团标记附接至每个氨基烯丙基修饰的utp核苷酸。第一部分和/或第二部分可各自独立地选自生物素、地高辛、fitc、抗生物素蛋白、链霉亲和素、抗地高辛和抗fitc。
在优选的实施方案中,使用
检测核酸可能涉及使用杂交反应,如在靶核酸与寡核苷酸探针或引物之间(例如,核酸杂交测定)。在一些实施方案中,寡核苷酸探针被固定在基底上。基底包括但不限于阵列、微阵列、多孔板的孔和珠粒(例如,非磁性、磁性、顺磁性、疏水性和亲水性的珠粒)。可用作基底的材料的实例包括但不限于硝酸纤维素、玻璃、硅和各种基因阵列。优选的杂交测定在如美国专利号5,445,934中所述的高密度基因芯片上进行。
可以通过将核酸样品暴露于探针修饰的芯片来确定基因的表达水平。将提取的核酸标记,例如,使用荧光标签标记,优选在扩增步骤期间进行。在适当的严格等级下使标记样品杂交。可使用检测装置来定量测量探针核酸杂交的程度。参见美国专利号5,578,832和5,631,734。
或者,可使用已知技术来确定基因拷贝数、转录或翻译中的任何一种。例如,可使用扩增方法,如pcr。用于pcr的通用程序在macpherson等人,pcr:apracticalapproach,(irlpressatoxforduniversitypress(1991))中教导。用于每个应用反应的pcr条件凭经验确定。许多参数影响反应的成功。其中包括退火温度和时间;延伸时间;mg2+和/或atp浓度;ph;以及引物、模板和脱氧核苷酸的相对浓度。在扩增后,可通过琼脂糖凝胶电泳,然后用溴化乙锭染色和紫外线照射可视化来检测所得的dna片段。
可通过检测附接于样品核酸的一个或多个标记来检测杂交的核酸。该标记可通过本领域技术人员公知的许多手段中的任何一种掺入。此外,在一个实施方案中,标记在扩增步骤期间在制备样品核酸的同时掺入。因此,例如,用标记的引物或标记的核苷酸进行的聚合酶链反应(pcr)将提供标记的扩增产物。在单独的实施方案中,如上所述,使用标记的核苷酸(例如,荧光素标记utp和/或ctp)进行的转录扩增在转录的核酸中掺入标记。
备选地,可在扩增完成后将标记直接添加至原始核酸样品(例如,mrna、polya、cdna等)或添加至扩增产物中。公知将标记附接至核酸的手段是本领域技术人员公知的,并包括例如通过对核酸应用激酶进行切口平移或末端标记(例如,用标记的rna),随后附接(连接)将样品核酸与标记(例如,荧光团)接合的核酸连接体。
合适的可检测标记可包括通过光谱、光化学、生物化学、免疫化学、电学、光学或化学手段检测的任何组合物。可用的标记包括:例如,用标记的链霉亲和素缀合物染色的生物素、磁珠(例如,dynabeadstm)、荧光染料(例如,荧光素、德克萨斯红、罗丹明、绿色荧光蛋白等)、放射性标记(例如,3h、125i、35s、14c或32p)、酶(例如,辣根过氧化物酶、碱性磷酸酶和elisa中常用的其他酶)和量热标记如胶体金或有色玻璃或塑料(例如,聚苯乙烯、聚丙烯、乳胶等)珠粒。教导此类标记的使用的专利包括美国专利号3,817,837、3,850,752、3,939,350、3,996,345、4,277,437、4,275,149和4,366,241。
标记的检测是本领域技术人员所公知的。因此,例如可使用胶片或闪烁计数器来检测放射性标记。可使用光感测器检测发射光来检测荧光标志物。通常通过向酶提供底物并检测通过酶在底物上的作用而产生的反应产物来检测酶标记。可通过简单地将有色标记可视化来检测量热标记。
可使用微阵列在生物样品中检测生物标志物(例如,mapk途径基因或ras-erk反馈调节子)。还可以使用微阵列技术鉴定或确认差异基因表达。因此,可使用微阵列技术在新鲜或固定的组织中测量表达谱。在该方法中,将感兴趣的多核苷酸序列(包括cdna和寡核苷酸)在微芯片基底上铺板或排布。然后将排布的序列与来自感兴趣的细胞或组织的特异性dna探针进行杂交。mrna源通常是从生物样品分离的总rna,并且相应的正常组织或细胞系可用于确定差异表达。
在微阵列技术的具体实施方案中,将cdna克隆的pcr扩增插入物以密集阵列施加至基底上。优选地,将至少10,000个核苷酸序列施加至基底上。以各自10,000个元件固定在微芯片上的微阵列基因适用于严格条件下的杂交。可通过从感兴趣的组织中提取的rna的逆转录来掺入荧光核苷酸,从而生成荧光标记的cdna探针。应用于芯片的标记cdna探针与阵列上每个dna点特异性杂交。在严格洗涤以除去非特异性结合的探针后,通过装置(如共聚焦激光显微镜检查,或者通过其他检测方法,如ccd相机)来扫描微阵列芯片。对每个阵列化元件的杂交的定量允许评估相应的mrna丰度。使用双色荧光,从两种rna来源产生的单独标记的cdna探针与阵列成对杂交。因此,同时确定来自对应于每个指定基因的两种来源的转录物的相对丰度。可遵循制造商的方案通过市售设备进行微阵列分析。
使用qrt-pcr可在生物样品中检测生物标志物,其可以用于比较在有或没有药物治疗情况下在正常组织和肿瘤组织中的不同样品群体中的mrna水平,从而表征基因表达的模式,区分密切相关的mrna,并分析rna结构。在通过rt-pcr的基因表达谱分析中的第一步是从生物样品中提取rna,然后将rna模板逆转录成cdna,并通过pcr反应扩增。逆转录反应步骤通常使用特异性引物、随机六聚物或寡-dt引物来引发,这取决于表达谱分析的目标。两种常用的逆转录酶为禽类(avilo)成髓细胞性白血病病毒逆转录酶(amv-rt)和莫洛尼鼠白血病毒逆转录酶(mlv-rt)。
尽管pcr步骤可使用多种热稳定的dna依赖性dna聚合酶,但它通常采用具有5’-3’核酸酶活性但缺乏3’-5’校对内切核酸酶活性的taqdna聚合酶。因此,taqmantmpcr通常利用taq或tth聚合酶的5’-核酸酶活性来使与其靶扩增子结合的杂交探针水解,但也可使用具有等同5’核酸酶活性的任何酶。两种寡核苷酸引物用于产生典型的pcr反应的扩增子。将第三寡核苷酸或探针设计用于检测位于两个pcr引物之间的核苷酸序列。该探针无法通过taqdna聚合酶延伸,并将其用报道荧光染料和淬灭荧光染料进行标记。当两种染料在探针上被定位成靠近在一起时,来自报道染料的任何激光诱导的发射被猝灭染料所猝灭。在扩增反应期间,taqdna聚合酶以模板依赖性方式切割探针。所得探针片段在溶液中解离,并且来自所释放的报道染料的信号不受第二荧光团的猝灭作用。每个合成一个新分子,释放一个报道染料的分子,并且未淬灭的报道染料的检测为数据的定量解释提供了基础。
生物标志物(例如,mapk途径基因或ras-erk反馈调节子)的差异表达也可通过例如使用合适的蛋白质测定法检查生物标志物的蛋白质表达或蛋白质产物来确定。确定蛋白质水平涉及测量选择性地识别和结合测试样品中的生物标志物的多肽的抗体之间发生的任何免疫特异性结合的量,并将其与参考样品中至少一个生物标志物的免疫特异性结合的量进行比较。与参考表达水平相比,生物标志物的蛋白质表达的量可以增加或减少。任选地,本文公开的所有生物标志物可作为单一组进行分析。
本领域中有多种技术可用于蛋白质分析。它们包括但不限于放射免疫测定法、elisa(酶联免疫吸附测定)、“夹心”免疫测定法、免疫放射测定法、原位免疫测定法(使用例如,胶体金、酶或放射性同位素标记)、western印迹分析法、免疫沉淀测定法、免疫荧光测定法、流式细胞术、免疫组织化学、共焦显微镜检查、酶测定法、表面等离子体共振和page-sds。
本公开内容提供检测生物样品中的生物标志物(如mapk途径基因或ras-erk反馈调节子)的方法。可与本公开内容一起使用的有用分析物捕获剂包括但不限于:抗体,如含有抗体的粗血清、纯化抗体、单克隆抗体、多克隆抗体、合成抗体、抗体片段(例如,fab片段);抗体相互作用剂,如蛋白a、碳水化合物结合蛋白和其他相互作用物;蛋白质相互作用物(例如抗生物素蛋白及其衍生物);肽;以及小化学实体,如酶底物、辅因子、金属离子/螯合物和半抗原。抗体可经修饰或化学处理,从而优化与靶标或固体表面(例如,生物芯片和柱)的结合。
在一些实施方案中,可使用免疫测定法在生物样品中检测生物标志物。免疫测定法是使用特异性结合或识别抗原(即蛋白质或肽上的位点、生物标志物靶标)的抗体的测定法。该方法包括以下步骤:使生物样品与抗体接触,并使抗体与样品中的抗原形成复合体,洗涤该样品,并用检测试剂对抗体-抗原复合体进行检测。在一个实施方案中,识别生物标志物的抗体可以是市售的。在另一个实施方案中,识别生物标志物的抗体可通过已知抗体产生方法来产生。
备选地,样品中的生物标志物可使用间接测定法来检测,其中,例如,第二标记抗体用于检测所结合的生物标志物特异性抗体。示例性可检测标记包括:磁珠(例如,dynabeadstm)、荧光染料、放射性标记、酶(例如,辣根过氧化物酶、碱性磷酸酶和其他常用品)和量热标记(如胶体金或者有色玻璃或塑料珠)。样品中的生物标志物可使用竞争或抑制测定法检测和/或在竞争或抑制测定法中检测,其中,例如与标志物的不同表位结合的单克隆抗体与该混合物同时温育。
使用免疫测定法来检测抗原的条件将会取决于所使用的特定抗体。此外,温育时间将取决于测定形式、生物标志物、溶液体积、浓度等。通常,该免疫测定法将在室温下进行,尽管它们也可以在一定温度范围内进行,如10℃至40℃,这取决于所使用的抗体。
本领域已知有各种类型的免疫测定法,其作为起始基础可用于定制用于检测本公开内容的生物标志物(例如,mapk途径基因或ras-erk反馈调节子)的测定法。可用的测定法可包括例如酶免疫测定法(eia),如酶联免疫吸附测定法(elisa)。这些方法有许多变化,但这些变化基于类似的想法。例如,如果抗原可以结合至固体支持物或表面,则该抗原可以通过使其与特异性抗体进行反应来检测,并且可以通过使该抗体与第二抗体进行反应或者通过将标记直接掺入第一抗体来对抗体进行定量。备选地,可将抗体结合至固体表面,并添加抗原。然后可添加并检测识别抗原上不同表位的第二抗体。这通常被称为“夹心测定法”,并且经常可用于避免高背景或非特异性反应的问题。这些类型的测定法是足够敏感和可再现的,足以测量生物样品中的低浓度抗原。
邻位连接测定法(pla)是本领域已知的另一种类型的免疫测定法,其可用于检测本公开内容的生物标志物。如本文所用的术语“邻位连接测定法”或“pla”是指利用所谓的pla探针(亲和试剂,如用dna寡核苷酸修饰的抗体)来检测和报道蛋白质在溶液中或原位存在的免疫测定法。当两个pla探针结合相同或两个相互作用的靶分子时,所附接的寡核苷酸实现紧密邻近。可对邻位连接测定法进行定制来检测本文公开的生物标志物。
免疫测定法可用于确定样品中是否存在生物标志物以及确定样品中生物标志物的量。测量抗体-生物标志物复合体的量或存在的方法包括但不限于:荧光、发光、化学发光、吸光度、反射率、透射率、双折射或折射率(例如,表面等离子共振、椭圆偏振法、共振镜法、光栅耦合器波导法或干涉法)。通常,这些试剂与光学检测方法如各种形式的显微镜检查、成像方法和非成像方法一起使用。电化学方法包括伏安法和电流分析法。射频方法包括多极共振光谱法。
可将生物芯片设计为具有固定的核酸分子、全长蛋白质、抗体、亲和抗体(经工程化以模拟单克隆抗体的小分子)、适体(基于核酸的配体)或化学化合物。芯片可被设计用于在一个芯片上检测多种大分子类型。例如,芯片可被设计用于在一个芯片上检测核酸分子、蛋白质和代谢物。生物芯片被用于并设计为在单个样品中同时分析一组生物标志物,产生这些生物标志物的受试者概况。使用生物芯片允许进行多次分析,这减少了总处理时间和所需样品量。
蛋白质微阵列是可以与本公开内容一起使用的特定类型的生物芯片。该芯片由支撑表面如玻璃载玻片、硝酸纤维素膜、珠粒或微量滴定板组成,其中捕获蛋白质阵列与该芯片以阵列形式在固体表面上结合。蛋白质阵列检测方法必须给出高信号和低背景。向阵列添加通常用荧光染料标记的检测探针分子。探针和固定的蛋白质之间的任何反应都会发出荧光信号,该信号由激光扫描仪读取。这种蛋白质微阵列是快速的、自动化的,并且为诊断测试提供蛋白质生物标志物读数的高灵敏度。然而,本领域技术人员将立即领会,存在可以与该技术一起使用的各种检测方法。
本公开内容提供使用质谱法来检测生物标志物。质谱法(ms)是一种测量带电荷粒子的质荷比的分析技术。它主要用于确定样品或分子的元素组成,以及用于阐明分子如肽和其他化合物的化学结构。ms通过电离化学化合物以产生带电荷的分子或分子碎片并测量它们的质荷比来发挥作用。ms仪器通常由三个模块组成:(1)离子源,其可以将气相样品分子转化为离子(或者,在电喷射电离的情况下,将存在于溶液中的离子移动至气相中);(2)质量分析仪,其通过施加电磁场按离子的质量而对其进行分类;和(3)检测器,其测量指示剂的量的值,从而提供用于计算存在的每种离子的丰度的数据。
与本公开内容一起使用的合适的质谱法包括但不限于电喷射电离质谱法(esi-ms)、esi-ms/ms、esi-ms/(ms)n、基质辅助激光解吸电离飞行时间质谱法(maldi-tof-ms)、表面增强激光解吸/电离飞行时间质谱法(seldi-tof-ms)、串联液相色谱法-质谱法(lc-ms/ms)质谱法、硅表面解吸/电离法(dios)、二次离子质谱法(sims)、四极杆飞行时间(q-tof)、大气压化学电离质谱法(apci-ms)、apci-ms/ms、apci-(ms)、大气压光电离质谱法(appi-ms)、appi-ms/ms,以及appi-(ms)n、四极杆质谱法、傅里叶变换质谱法(ftms)和离子阱质谱法中的一种或多种,其中n为大于零的整数。
为了深入了解样品的潜在蛋白质组学,通常使用lc-ms来分析复杂混合物的组分。lc-ms方法通常包括蛋白酶消化和变性(通常涉及蛋白酶(如胰蛋白酶)、使三级结构变性的变性剂(例如,尿素)和为半胱氨酸残基加帽的碘乙酰胺),然后进行带有肽质量指纹分析的lc-ms或lc-ms/ms(串联ms),从而得到个体肽的序列。lc-ms/ms最常用于复杂样品的蛋白质组学分析,其中肽质量可以甚至与高分辨率质谱仪重叠。复杂生物流体样品如人血清可首先在sds-page凝胶或hplc-scx上分离,然后在lc-ms/ms中运行,以鉴定超过1000种蛋白质。
在一些应用中,hplc和uhplc可以耦合至质谱仪。在质谱分析之前可进行许多其他肽和蛋白质分离技术。一些示例性的可用于从基质背景中分离出所需的分析物(例如,肽或蛋白质)的分离技术包括但不限于:蛋白质或肽的反相液相色谱法(rp-lc)、脱机液相色谱法(lc)、1-维凝胶分离法、2-维凝胶分离法、强阳离子交换(scx)色谱法、强阴离子交换(sax)色谱法、弱阳离子交换(wcx)和弱阴离子交换(wax)。可以在质谱分析之前使用一种或多种上述技术。
用于确定mapk途径基因如egfr是否被扩增的方法在现有技术中是众所周知的。所述方法包括但不限于:原位杂交(ish)(如荧光原位杂交(fish)、显色原位杂交(cish)或银原位杂交(sish))、基因组比较杂交或聚合酶链反应(如实时定量pcr)。对于任何ish方法,可以通过计算染色体或细胞核中荧光点、有色点或具有银的点的数目来确定扩增或拷贝数。
荧光原位杂交(fish)是一种细胞遗传学技术,用于检测和定位染色体中特定dna序列的存在与否。fish使用荧光探针,该探针仅结合染色体的某些部分,它们显示出高度的序列相似性。在典型的fish方法中,dna探针用通常呈氟-dutp、地高辛-dutp、生物素-dutp或半抗原-dutp的形式的荧光分子或半抗原来标记,该荧光分子或半抗原通过使用酶促反应如切口平移或pcr掺入dna中。将含有遗传物质(染色体)的样品置于载玻片上,并通过甲酰胺处理使其变性。然后在合适的条件下使标记的探针与含有遗传物质的样品杂交,该条件将由本领域技术人员确定。杂交后,直接观察样品(在用氟标记探针的情况下)或间接观察样品(使用荧光标记的抗体来检测半抗原时)。在cish的情况下,将探针用地高辛、生物素或荧光素标记,并在合适的条件下将其与含有遗传物质的样品杂交。
可使用诸如比较基因组杂交(cgh)、微卫星标志物、短串联重复(str)分析和限制性片段长度多态性(rflp)分析等方法来检测拷贝数异常。评估样品中核酸的拷贝数的其他方法包括但不限于基于杂交的测定法。用于评估样本中编码核酸的拷贝数的一种方法涉及southern印迹法。在southern印迹法中,使基因组dna(通常被片段化并在电泳凝胶上分离)与对靶区域特异的探针杂交。将来自针对靶区域的探针的杂交信号强度与来自正常基因组dna(例如,相同或相关的细胞、组织、器官等的非扩增部分)分析的对照探针信号进行比较,从而得到对靶核酸的相对拷贝数的估计。备选地,可利用northern印迹法来评估样品中编码核酸的拷贝数。在northern印迹法中,使mrna与对靶区域特异的探针杂交。将来自针对靶区域的探针的杂交信号强度与来自正常基因组mrna(例如,相同或相关的细胞、组织、器官等的非扩增部分)分析的对照探针信号进行比较,从而得到对靶核酸的相对拷贝数的估计。用于评估拷贝数的类似方法可以通过使用本领域公知的转录阵列来进行。
优选的基于杂交的分析法包括但不限于:传统的“直接探测”方法,如southern印迹法或原位杂交(例如,fish,以及fish附加sky);和“比较探测”方法,如比较基因组杂交(cgh),例如,基于cdna或基于寡核苷酸的cgh。这类方法可以以多种形式使用,包括但不限于基底(例如,膜或玻璃)结合方法或基于阵列的方法。
在cgh方法中,将第一核酸集合(例如,来自样品,如鳞状细胞癌细胞)用第一标记来标记,而将第二核酸集合(例如,对照,例如来自健康细胞/组织)用第二标记来标记。核酸杂交的比率由与阵列中每个纤维结合的两个(第一和第二)标记的比率来确定。在存在染色体缺失或倍增的情况下,将检测来自两个标记的信号的比率的差异,并且该比率将提供拷贝数的量度。基于阵列的cgh也可以用单色标记进行(而不是用两种不同的染料来标记对照和可能的肿瘤样品并在杂交前将它们混合,这将产生由阵列上探针的竞争性杂交而产生比率)。在单色cgh中,将对照标记并使其与一个阵列杂交并读取绝对信号,并将鳞状细胞癌样品标记并使其与第二阵列(具有相同内容物)杂交并读取绝对信号。基于来自两个阵列的绝对信号来计算拷贝数差异。例如,在albertson(1984)emboj.3:1227-1234;pinkel(1988)proc.natl.acad.sci.usa85:9138-9142;epo公开号430,402;methodsinmolecularbiology,第33卷:insituhybridizationprotocols,choo,ed.,humanapress,totowa,n.j.(1994)等中描述了适用于本公开内容的方法的杂交方案。在一个实施方案中,使用pinkel,等人,(1998)naturegenetics20:207-211或kallioniemi(1992)proc.natlacadsciusa89:5321-5325(1992)的杂交方案。
本公开内容的方法特别适用于基于阵列的杂交形式。基于阵列的cghis在美国专利号6,455,258中描述,其内容通过引用并入本文。在又一个实施方案中,基于扩增的测定法可用于测量拷贝数。在这种基于扩增的测定法中,核酸序列在扩增反应(例如,聚合酶链反应(pcr))中充当模板。在定量扩增中,扩增产物的量将与原始样品中的模板的量成比例。与适当的对照例如健康组织的比较得到拷贝数的量度。
“定量”扩增的方法是本领域技术人员公知的。例如,定量pcr涉及通过使用相同的引物来同时共扩增已知量的对照序列。这提供了可用于校准pcr反应的内标。在innis,等人,(1990)pcrprotocols,aguidetomethodsandapplications,academicpress,inc.n.y中提供定量pcr的详细方案。在ginzonger,等人,(2000)cancerresearch60:5405-5409中描述了使用定量pcr分析法在微卫星基因座处对dna拷贝数的测量。已知的基因核酸序列足以使得本领域技术人员能够常规地选择引物来扩增基因的任何部分。荧光定量pcr也可用于本公开内容的方法。在荧光定量pcr中,定量是基于荧光信号量的量,例如,taqman和sybrgreen。
其他合适的扩增方法包括但不限于:连接酶链反应(lcr)(参见wu和wallace(1989)genomics4:560,landegren,等人,(1988)science241:1077和barringer等人,(1990)gene89:117)、转录扩增(kwoh,等人,(1989)proc.natl.acad.sci.usa86:1173)、自我维持的序列复制(guatelli,等人,(1990)proc.nat.acad.sci.usa87:1874)、斑点pcr(dotpcr)和连接体接头pcr等。
在一些实施方案中,作为基于杂交的测定法的替代,使用核酸测序技术进行单个核酸分子(或其扩增产物)的测序。在一个实施方案中,可在测序之前,使用分离核酸分子群的单个核酸分子的高通量平行测序技术。这类策略可使用所谓的“下一代测序系统”,该测序系统包括但不限于:本领域公知的测序机器和/或策略,如由illumina/solexa(基因组分析仪;bennett等人,(2005)pharmacogenomics,6:373-20382)、appliedbiosystems,inc.(solid测序仪;solid.appliedbiosystems.com)、roche(例如,454gsflx测序仪;margulies等人,(2005)nature,437:376-380;美国专利号6,274,320;6,258,568;6,210,891)、来自helicosbiosciences的heliscope(注册商标)系统(参见例如美国专利申请公开号2007/0070349)和其他公司开发的测序机器和/或策略。例如,如国际申请号pct/gb2009/001690(公开号wo/2010/004273)中所描述的,也可以使用其他测序策略如随机测序(例如由oxfordnanopore开发)。
在一些实施方案中,借助处理器,如使用执行包含于计算机可读介质中的指令的计算机系统来进行评估和/或报告对erk抑制剂治疗有反应的可能性中的一个或多个步骤。在一个方面,本公开内容提供用于评估患有癌症如鳞状细胞癌的受试者对erk抑制剂治疗展现出临床有益反应的可能性的系统。在一个实施方案中,该系统包括:(a)存储器单元,其被配置用于存储关于包含来自鳞状细胞癌细胞的基因组和/或转录组物质的生物样品中的以下各项的信息:(i)至少两种选自以下的基因的第一总表达水平:egfr、erk1、ccnd1、kras、erk2和hras;(ii)至少两种选自以下的基因的第二总表达水平:dusp5、dusp6、dusp2、dusp4、spry2、spry4和spred1;(iii)至少两种选自以下的基因的第三总表达水平:ccnd1、craf、dusp5、egfr、erk1和kras;(iv)至少一种mapk途径基因的拷贝数谱;(v)areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的第四总表达水平;(vi)dcun1d1、pik3ca、prkci、sox2和tp63的第五总表达水平;和/或(vii)hif1a和tp63的表达水平。在一些实施方案中,该系统进一步包括:(b)一个或多个处理器,其单独或组合地被编程用于:(1)基于第一总表达水平、第二总表达水平、拷贝数谱、第三总表达水平、第四总表达水平、第五总表达水平和/或hif1a和tp63的表达水平,确定erk抑制剂反应性的加权概率;和(2)如果加权概率对应于基线概率的至少1.5倍,则将受试者指定为有较高的概率对erk抑制剂治疗展现出临床有益反应,其中基线概率代表在获得(b)(1)的加权概率之前受试者对erk抑制剂治疗将展现出临床有益反应的可能性。
在一些实施方案中,借助处理器,如使用执行包含于计算机可读介质中的指令的计算机系统来进行评估和/或报告对erk抑制剂治疗有反应的可能性中的一个或多个步骤。在一个方面,本公开内容提供用于评估患有癌症如鳞状细胞癌的受试者对erk抑制剂治疗展现出临床有益反应的可能性的系统。在一些实施方案中,该系统包括:(a)存储器单元,其被配置用于存储关于包含来自癌细胞的基因组和/或转录组物质的生物样品中的至少一种位于染色体11q13.3-13.4处的基因的拷贝数谱和/或表达水平的信息;和(b)一个或多个处理器,其单独或组合地被编程用于:(1)基于拷贝数谱和/或表达水平,确定erk抑制剂反应性的加权概率;和(2)如果加权概率对应于基线概率的至少1.5倍,则将受试者指定为有较高的概率对erk抑制剂治疗展现出临床有益反应,其中基线概率代表在获得(b)(1)的加权概率之前受试者对erk抑制剂治疗将展现出临床有益反应的可能性。在一些实施方案中,所述至少一种位于染色体11q13.3-13.4处的基因选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1和shank2。在一些实施方案中,所述至少一种基因为ccnd1或ano1。在一些实施方案中,所述至少一种基因包括ccnd1和ano1。在一些实施方案中,所述至少一种位于染色体11q13.3-13.4处的基因选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1、shank2、fgf3、fgf4和fgf19。
在一些实施方案中,表达水平通过以下来评估:(a)检测mrna水平;(b)检测由mrna逆转录产生的cdna水平;(c)检测多肽水平;(d)检测无细胞dna水平;和/或(e)核酸扩增测定、杂交测定、测序或其组合。在一些实施方案中,所述至少一种基因的拷贝数谱通过选自以下的方法来评估:原位杂交、southern印迹法、免疫组织化学(ihc)、聚合酶链反应(pcr)、定量pcr(qpcr)、定量实时pcr(qrt-pcr)、比较基因组杂交、基于微阵列的比较基因组杂交和连接酶链反应(lcr)。在一些实施方案中,癌症选自鳞状细胞癌和腺癌。在一些实施方案中,癌症选自肺鳞状细胞癌、食管鳞状细胞癌、宫颈鳞状细胞癌、头颈鳞状细胞癌、膀胱鳞状细胞癌和胃鳞状细胞癌。在一些实施方案中,癌症为食管鳞状细胞癌。在一些实施方案中,癌症为选自食管癌和胰腺癌的腺癌。在一些实施方案中,癌症选自肺癌、食管癌、宫颈癌、头颈癌、膀胱癌、胃癌和胰腺癌。在一些实施方案中,癌症选自乳腺癌、胰腺癌、肺癌、甲状腺癌、精原细胞瘤、黑素瘤、膀胱癌、肝癌、肾癌、骨髓增生异常综合征、急性髓细胞性白血病和结直肠癌。
在一些实施方案中,处理器或计算算法可有助于评估患有癌症如鳞状细胞癌的受试者对erk抑制剂治疗展现出临床有益反应的可能性。例如,本文描述的方法或系统的一个或多个步骤可以用硬件来实现。备选地,一个或多个步骤可以在存储于例如一个或多个存储器或其他计算机可读介质中的软件中实现,并且在一个或多个处理器上实现。众所周知,处理器可以与一个或多个控制器、计算单元和/或计算机系统的其他单元相联合,或者根据需要植入固件中。如果以软件实现,则例程可以存储在任何计算机可读存储器,如ram、rom、闪存、磁盘、激光盘、远程服务器(例如,云端)或其他存储介质中,这也是众所周知的。同样地,该软件可以经由任何已知的传递方法被传递到计算设备,该递送方法包括,例如,通过诸如电话线、互联网、无线连接等通信信道;或者经由便携式介质,如计算机可读盘、闪存驱动器等。各个步骤可以以各种块、操作、工具、模块和技术来实现,该块、操作、工具、模块和技术又可以以硬件、固件、软件或者硬件、固件和/或软件的任何组合来实现。当以硬件实现时,部分或全部的块、操作、技术等可以在例如定制集成电路(ic)、专用集成电路(asic)、现场可编程逻辑阵列(fpga)、可编程逻辑阵列(pla)等中实现。计算机系统可以涉及以下的一种或多种:样品收集、样品处理、数据分析、表达谱评估、加权概率的、基线概率的计算、加权概率与参考水平和/或对照样品的比较、确定受试者的绝对可能性或增加的可能性、生成报告和向接收者报告结果。
客户端-服务器、关系数据库体系结构可用于本公开内容的实施方式中。客户端-服务器体系结构是网络体系结构,其中网络上的每个计算机或进程为客户端或服务器。服务器计算机通常是专用于管理磁盘驱动器(文件服务器)、打印机(打印服务器)或网络流量(网络服务器)的强大计算机。客户端计算机包括用户在其上运行应用程序的pc(个人计算机)、工作站或移动计算设备(例如,平板计算机或智能电话),以及如本文所公开的示例性输出设备。客户端计算机可依靠服务器计算机来获取资源,如文件、设备甚至处理能力。在本公开内容的一些实施方案中,服务器计算机处理所有数据库功能。客户端计算机可具有处理所有前端数据管理的软件,并且还可接收来自用户的数据输入。
在一些实施方案中,计算机系统通过网络连接而连接至分析系统。计算机系统可以理解为可从介质和/或网络端口读取指令的逻辑装置,其可以任选地连接至具有固定介质的服务器。该系统可包括cpu、磁盘驱动器、任选的输入设备如键盘和/或鼠标,以及任选的监视器。数据通信可通过通向本地或远程位置的服务器的指定通信介质来实现。该通信介质可包括发送和/或接收数据的任何手段。例如,该通信介质可以是网络连接、无线连接或互联网连接。这种连接可提供经由万维网的通信。在一些实施方案中,生成物理报告并将其传递给接收者。
在一些实施方案中,提供了编码有计算机可执行软件的计算机可读介质,该计算机可执行软件包括用于使计算机执行与所识别的生物标志物相关联的功能的指令。这种计算机系统可包括这些代码或计算机可执行软件的任何组合,这取决于所期望完成的评价类型。该系统可具有用于计算erk抑制剂反应性的加权概率,并且任选地用于基于多个加权概率来计算合计概率的代码。在一些实施方案中,如果鳞状细胞癌细胞:(1)超表达一种或多种mapk途径基因和/或一种或多种ras-erk反馈调节子和/或areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa中的一种或多种,(2)低表达dcun1d1、pik3ca、prkci、sox2和tp63中的一种或多种,或(3)包含至少一种mapk途径基因的拷贝数扩增,则erk抑制剂反应性的加权概率增加。如果鳞状细胞癌细胞:(1)低表达一种或多种mapk途径基因和/或一种或多种ras-erk反馈调节子和/或areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa中的一种或多种,(2)超表达dcun1d1、pik3ca、prkci、sox2和tp63中的一种或多种,或(3)不包含至少一种mapk途径基因的拷贝数扩增,则erk抑制剂反应性的加权概率可能降低。鳞状细胞癌细胞可表达敏感性和抗性的预测因子。在计算加权概率时,计算机系统或计算算法可以考虑2种或更多种、3种或更多种、4种或更多种、5种或更多种、6种或更多种、7种或更多种、8种或更多种、9种或更多种、10种或更多种、15种或更多种或者20种或更多种的生物标志物的表达。例如,两种或更多种选自cdk4、cdk6、craf、egfr、erk1、ccnd1、kras、erk2、hras、dusp2、dusp4、dusp5、dusp6、spry2、spry4和spred1的生物标志物的表达水平可用于产生表达谱。在计算加权概率时,计算机系统或计算算法可以考虑1种或多种、2种或更多种、3种或更多种、4种或更多种、或5种或更多种的生物标志物的扩增状态。例如,至少一种选自cdk4、cdk6、craf、egfr、erk1、ccnd1、kras、erk2和hras的生物标志物的扩增状态可用于产生拷贝数状态。该系统可进一步包括用于基于所选择的特定生物标志物组来进行遗传分析的代码。如本文所述,该系统还可以具有用于进行以下一项或多项的代码:得到结果、分析结果、组织结果或报告结果。该系统还可具有用于生成报告的代码。在一些实施方案中,如果加权概率对应于至少约0.55、至少约0.6、至少约0.65、至少约0.7、至少约0.75、至少约0.8、至少约0.85、至少约0.9、至少约0.95或至少约0.99,则测试受试者可以被指定为有较高的概率对erk抑制剂治疗展现出临床有益反应。在一些实施方案中,如果加权概率对应于小于约0.45、小于约0.4、小于约0.35、小于约0.3、小于约0.25、小于约0.2、小于约0.15、小于约0.1、小于约0.05、小于约0.01,则测试受试者可以被指定为有较低的概率对erk抑制剂治疗展现出临床有益反应。
在一些实施方案中,提供了编码有计算机可执行软件的计算机可读介质,该计算机可执行软件包括用于使计算机执行与所识别的生物标志物相关联的功能的指令。这种计算机系统可以包括这些代码或计算机可执行软件的任意组合,这取决于所期望完成的评价类型。该系统可以具有用于计算erk抑制剂反应性的加权概率,并任选地用于基于多个加权概率来计算合计概率的代码。在一些实施方案中,如果癌细胞:(1)超表达至少一种位于染色体11q13.3-13.4处的基因和/或(2)包含至少一种位于染色体11q13.3-13.4处的基因的拷贝数扩增,则erk抑制剂反应性的加权概率增加。如果癌细胞:(1)低表达至少一种位于染色体11q13.3-13.4处的基因和/或(2)不包含至少一种位于染色体11q13.3-13.4处的基因的拷贝数扩增,则erk抑制剂反应性的加权概率可能降低。如上所述,可以基于一种或多种mapk途径基因和/或一种或多种ras-erk反馈调节子来进一步调整加权概率。癌细胞可以表达敏感性和抗性两者的预测因子。在计算加权概率时,计算机系统或计算算法可以考虑1种或多种、2种或更多种、3种或更多种、4种或更多种、5种或更多种、6种或更多种、7种或更多种、8种或更多种、9种或更多种、10种或更多种、15种或更多种或者20种或更多种生物标志物的表达。例如,一种或多种选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1和shank2的生物标志物的表达水平可用于产生表达谱。在计算加权概率时,计算机系统或计算算法可以考虑1种或多种、2种或更多种、3种或更多种、4种或更多种或者5种或更多种生物标志物的扩增状态。例如,至少一个选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1和shank2的生物标志物的扩增状态可用于产生拷贝数状态。该系统可以进一步包括用于基于所选择的特定生物标志物组来进行遗传分析的代码。在一些实施方案中,所述至少一种基因为ccnd1或ano1。在一些实施方案中,所述至少一种基因包括ccnd1和ano1。如本文所述,该系统还可以包含用于进行以下一项或多项的代码:得到结果、分析结果、组织结果或报告结果。该系统还可具有用于生成报告的代码。在一些实施方案中,如果加权概率对应于至少约0.55、至少约0.6、至少约0.65、至少约0.7、至少约0.75、至少约0.8、至少约0.85、至少约0.9、至少约0.95或者至少约0.99,则测试受试者可以被指定为有较高的概率对erk抑制剂治疗展现出临床有益反应。在一些实施方案中,如果加权概率对应于小于约0.45、小于约0.4、小于约0.35、小于约0.3、小于约0.25、小于约0.2、小于约0.15、小于约0.1、小于约0.05、小于约0.01,则测试受试者可以被指定为有较低的概率对erk抑制剂治疗展现出临床有益反应。
该系统可以进一步包括用于将加权概率与基线概率、阈值和/或参考水平进行比较并且基于是否超过基线概率、阈值或参考水平来对指定倍数基线概率的代码。评估加权概率、阈值或参考水平可与至少一种建议相联系。超过加权概率、阈值或参考水平可以与用erk抑制剂治疗的建议相联系。在一些实施方案中,基线概率代表患有癌症如鳞状细胞癌的受试者对erk抑制剂治疗展现出临床有益反应的平均概率,无论是在一般的群体还是在特定的群体中。在一些实施方案中,基线概率代表在应用本公开内容的方法来确定测试后风险之前,特定受试者将对erk抑制剂治疗展现出临床有益反应的测试前可能性。无论受试者的测试前基线为何值,高于基线概率的加权概率可以对应于指定的倍数基线概率。在一些实施方案中,如果加权概率对应于基线概率的约或至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.8倍、2倍、2.5倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、25倍、50倍或者100倍,则测试受试者可以被指定为有较高的概率对erk抑制剂治疗展现出临床有益反应。在一些实施方案中,如果加权概率对应于基线概率的约或小于约0.9倍、0.8倍、0.7倍、0.6倍、0.5倍、0.4倍、0.3倍、0.2倍、0.1倍、0.05倍、0.01倍,则测试受试者可以被指定为有较低的概率对erk抑制剂治疗展现出临床有益反应。
在执行计算之后,处理器可将例如来自计算的输出信息返回至例如输入设备或存储单元,返回至相同或不同的计算机系统的另一个存储单元,或者返回至输出设备。来自处理器的输出可以通过数据显示器来显示。数据显示器可以是显示屏(例如,数字设备上的监视器或屏幕)、打印输出、数据信号(例如,数据包)、警报(例如,闪烁的灯光或声音)、图形用户界面(例如,网页)或任何上述的组合。在实施方案中,输出通过网络(例如,无线网络)传输至输出设备。用户可使用输出设备来从数据处理计算机系统接收输出。在用户接收到输出之后,用户可以确定行动进程,或者可执行行动进程,如当用户是医务人员时的医疗处理。在一些实施方案中,输出设备是与输入设备相同的设备。示例性输出设备包括但不限于:电话、无线电话、移动电话、pda、平板计算机、闪存驱动器、光源、声音发生器、传真机、计算机、计算机监视器、打印机、ipod和网页。用户站可以与打印机或显示监视器通信,从而将由服务器处理的信息输出。
可以设想,与本公开内容相关的数据可以通过网络或连接进行传输,以便由接收者接收和/或查看。接收者可以是但不限于:个人;报告所涉及的受试者;健康护理提供者、管理者、其他健康护理专业人员或其他看护者;肿瘤科医生;遗传顾问;执行和/或订购生物标志物表达分析的人或实体;或用于存储此类报告的本地或远程系统(例如,服务器或“云计算”体系结构的其他系统)。在一个实施方案中,计算机可读介质包括适于传输生物样品分析(如对一种或多种生物标志物的分析)的结果的介质。该介质可包括关于个体的一种或多种生物标志物表达水平或扩增状态的结果、患有对erk抑制剂治疗敏感的癌症的可能性(如倍数基线概率)和/或针对个体的治疗计划,其中这样的结果是使用本文描述的方法得到的。
在一些实施方案中,如果受试者被指定为有“高概率”对erk抑制剂治疗具有有益反应,则提醒受试者或第三方(例如,健康护理提供者、健康护理管理者、其他健康专业人员或其他看护人)。所产生的分析可由医学专业人员(如管理医生或执业医师)或其他第三方审查和进一步分析。医学专业人员或其他第三方可以当面与受试者对结果、分析和报告进行讨论。所提供的信息可包括建议,如治疗(例如,用erk抑制剂或替代疗法)。
在一些实施方案中,所述方法进一步包括基于对患有鳞状细胞癌的受试者对erk抑制剂治疗将展现出临床有益反应的可能性(如指定为具有高可能性)的评估来提供治疗建议。建议可以形成基于生物标志物表达或拷贝数分析而生成的报告的一部分,或者可以由接收者基于该报告提出建议。建议可以是针对受试者一方和/或针对第三方(如健康护理提供者、健康护理经理、其他健康专业人员或其他看护人)的进一步行动的建议。建议可包括但不限于:用erk抑制剂治疗;继续监测受试者;可进一步表征癌症的筛查测试或实验室测试;处方和/或施用一种或多种非erk抑制剂的治疗剂;中止疗法;和用替代疗法治疗,例如,化疗、免疫疗法、放疗或外科手术。
在一些实施方案中,本公开内容提供对受试者的鳞状细胞癌状态进行分类的方法。可以基于来自受试者的生物样品的表达谱对受试者的状态进行分类。癌症状态可被分类为可能对erk抑制剂治疗敏感或可能对erk抑制剂治疗有抗性。可能敏感的分类可以被指定为具有以下情况的鳞状细胞癌:(1)超表达一种或多种mapk途径基因和/或一种或多种ras-erk反馈调节子和/或areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa中的一种或多种,(2)低表达dcun1d1、pik3ca、prkci、sox2和tp63中的一种或多种,和/或(3)至少一种mapk途径基因的拷贝数扩增。“可能有抗性”的分类可以被指定为具有以下情况的癌症或癌细胞:(1)具有一种或多种mapk途径基因和/或一种或多种ras-erk反馈调节子和/或areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa中的一种或多种的低表达,(2)具有dcun1d1、pik3ca、prkci、sox2和tp63中的一种或多种超表达,和/或(3)缺乏至少一种mapk途径基因的拷贝数扩增。鳞状细胞癌可具有具备敏感性和抗性两者的预测因子的表达谱。在一些实施方案中,如果至少2种或更多种、3种或更多种、4种或更多种、5种或更多种、6种或更多种、7种或更多种、8种或更多种、9种或更多种、10种或更多种、15种或更多种或者20种或更多种选自cdk4、cdk6、craf、egfr、erk1、ccnd1、kras、erk2、hras、dusp2、dusp4、dusp5、dusp6、spry2、spry4和spred1的生物标志物的总表达水平大于相应的参考水平,则可将鳞状细胞癌分类为敏感。在一些实施方案中,如果cdk4、cdk6、craf、egfr、erk1、ccnd1、kras、erk2和hras中的至少一种的平均拷贝数扩增,如平均拷贝数大于2、大于3、大于4、大于5、大于6、大于7、大于8、大于9或大于10,则可将鳞状细胞癌分类为敏感。
在一些实施方案中,本公开内容的方法提供参考水平,至少两种生物标志物必须以高于该参考水平表达方可被考虑用于评估对erk抑制剂治疗有反应的可能性。生物标志物可能在以比参考水平高至少1.1倍、至少1.2倍、至少1.3倍、至少1.4倍、至少1.5倍、至少2.0倍、至少2.25倍、至少2.5倍、至少2.75倍、至少3.0倍、至少3.5倍、至少4.0倍、至少5.0倍或者甚至至少10倍地差异表达时方可在调整反应可能性时被考虑。在一些实施方案中,参考水平是生物标志物表达的数值范围,该生物标志物表达从患有对erk抑制剂治疗具有低敏感性(如抗性)的鳞状细胞癌的个体群体的统计取样中获得。在一些实施方案中,参考水平是生物标志物表达的数值范围,该生物标志物表达从患有对erk抑制剂治疗敏感的癌症的个体群体的统计学取样中获得。参考水平可以是生物标志物表达的数值范围,该生物标志物表达从患有癌症(例如,与测试受试者相同的癌症)的个体群体的统计取样中获得。在一些实施方案中,参考水平通过比较敏感群体和抗性群体获得。如本文所用的,对erk抑制剂的低敏感性是指在用erk抑制剂治疗后疾病状况进展。在一些实例中,对erk抑制剂的低敏感性的特征在于用erk抑制剂治疗后对肿瘤生长的抑制小于60%。对erk抑制剂治疗有反应的疾病状况是响应于用erk抑制剂治疗而展现出治疗有益反应,如肿瘤的消退或稳定。在一些实例中,对肿瘤生长的抑制大于75%表明对erk抑制剂治疗有反应。
在一些实施方案中,本公开内容提供对受试者的鳞状细胞癌状态进行分类的方法。可以基于来自受试者的生物样品的表达谱对受试者的状态进行分类。癌症状态可被分类为可能对erk抑制剂治疗敏感或可能对erk抑制剂治疗具有抗性。可能敏感的分类可以被指定为具有以下情况的癌症或癌细胞:(1)超表达至少一种位于染色体11q13.3-13.4处的基因和/或(2)至少一种位于染色体11q13.3-13.4处的基因拷贝数扩增。分类可以进一步考虑如上文所讨论的一种或多种mapk途径基因和/或一种或多种ras-erk反馈调节子的表达谱和/或拷贝数谱。癌症可以具有具备敏感性和抗性两者的预测因子的表达谱。在一些实施方案中,如果至少1种或多种、2种或更多种、3种或更多种、4种或更多种、5种或更多种、6种或更多种、7种或更多种、8种或更多种、9种或更多种、10种或更多种、15种或更多种或者20种或更多种选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1和shank2的生物标志物的总表达水平大于相应的参考水平,则可将癌症分类为敏感。在一些实施方案中,如果ccnd1、cttn、fadd、oraov1、ano1、ppfia1和shank2中的至少一个的平均拷贝数扩增,如平均拷贝数大于2、大于3、大于4、大于5、大于6、大于7、大于8、大于9或大于10,则可将癌症分类为敏感。
在一些实施方案中,本公开内容的方法提供参考水平,至少两种生物标志物必须以超过该参考水平表达方可被考虑用于评估对erk抑制剂治疗有反应的可能性。生物标志物可能在以相对于参考水平高至少1.1倍、至少1.2倍、至少1.3倍、至少1.4倍、至少1.5倍、至少2.0倍、至少2.25倍、至少2.5倍、至少2.75倍、至少3.0倍、至少3.5倍、至少4.0倍、至少5.0或者甚至至少10倍地差异表达时方可在调整反应可能性时被考虑。在一些实施方案中,参考水平是生物标志物表达的数值范围,该生物标志物表达从患有对erk抑制剂治疗具有低敏感性(如抗性)的特定癌症的个体群体的统计取样中获得。在一些实施方案中,参考水平是生物标志物表达的数值范围,该生物标志物表达从患有对erk抑制剂治疗敏感的癌症的个体群体的统计学取样中获得。参考水平可以是生物标志物表达的数值范围,该生物标志物表达从患有癌症(例如,与测试受试者相同的癌症)的个体群体的统计取样中获得。在一些实施方案中,参考水平通过比较敏感群体和抗性群体获得。如本文所用的,对erk抑制剂的低敏感性是指在用erk抑制剂治疗后疾病状况进展。在一些实例中,对erk抑制剂的低敏感性的特征在于用erk抑制剂治疗后对肿瘤生长的抑制小于60%(例如,在pdx模型中)。对erk抑制剂治疗有反应的疾病状况是响应于用erk抑制剂治疗而展现出治疗有益反应,如肿瘤的消退或稳定。在一些实例中,对肿瘤生长的抑制大于75%表明对erk抑制剂治疗有反应。用于评价用erk抑制剂治疗的公开标准,如实体肿瘤疗效评价(recist)标准,可用于评价实体瘤。根据recist标准,完全反应(cr)通过所有目标病变的消失来证明;部分反应(pr)通过目标病变的最长直径(ld)之和减少至少30%来证明,以基线ld总和为参照;疾病稳定(sd)可以通过既没有足够收缩来符合pr也没有足够增大来符合pd来证明,以自治疗开始以来最小的ld总和作为参照;以及疾病进展(pd)通过目标病变的ld总和增加至少20%来证明以自治疗开始以来记录的最小ld总和或者一个或多个新病变的出现作为参照。在一些实例中,如果根据recist标准将疾病状况分类为响应于用erk抑制剂治疗的cr、pr或sd,则该疾病状况被归类为对erk抑制剂治疗有反应。可以通过recist标准将对治疗具有抗性的疾病状况分类为pd。
在进一步的实施方案中,本公开内容提供治疗癌症状况如鳞状细胞癌的方法,该方法包括施用有效剂量的erk抑制剂。erk抑制剂可以以下一种或多种方式生效:抑制癌细胞增殖、抑制癌细胞的侵袭或转移、杀死癌细胞、增加癌细胞对第二抗肿瘤药物治疗的敏感性,以及降低与存在的癌细胞有关的症状的严重程度或发生率。在一些实施方案中,该方法包括向癌细胞施用治疗有效量的erk抑制剂。在一些实施方案中,施用在体外进行。在其他实施方案中,施用在体内进行。
适用于主题方法的erk抑制剂可选自各种类型的分子。例如,erk抑制剂可以是生物化合物或化学化合物,如简单或复杂的有机或无机分子、肽、拟肽、蛋白质(例如,抗体)、脂质体或多核苷酸(例如,小干扰rna、微小rna、反义、适体、核酶或三股螺旋)。适用于主题方法的一些示例性化学化合物类别在以下部分中详述。用于本公开内容的erk抑制剂可以是本领域已知的任何erk抑制剂,并且可包括在施用于受试者后引起受试者中erk抑制的任何化学实体。任选地,用于治疗鳞状细胞癌的erk抑制剂是小分子。如本文所用的,术语“小分子”是指低分子量的有机化合物,如分子量小于800g/mol的化合物。
如本文所用的,术语“erk抑制剂”是指能够完全地或部分地降低或抑制erk信号传导活性的化合物。抑制可以在转录水平下有效,例如通过阻止或减少或抑制erk信号传导途径的关键成员的mrna合成,如mek1、mek2、erk1和/或erk2mrna。在一些实例中,所述erk抑制剂抑制mek1、mek2、erk1或erk2激酶活性中的一种或多种。抑制erk可通过多种机制实现,包括但不限于:直接与erk1或erk2结合,直接与mek1或mek2结合,或者抑制erk或mek基因的表达。
根据本公开内容,erk途径的任何组分均是用于抑制的潜在治疗靶标。抑制机制可以在遗传水平(例如,干扰转录或翻译)或在蛋白质水平(例如,结合、竞争)下进行。由于它们的会聚功能,预期mek1/2或erk1/2的特异性抑制可有效地截断多种上游促有丝分裂信号。优选地,erk抑制剂为特异性抑制剂,其以基因水平下或蛋白质水平作用于mek1/2或erk1/2。可以根据本公开内容使用任意一种或两种方法。例如,可以使用抑制剂来干扰erk1和/或erk2的表达,或者隔离细胞的细胞质中的erk1和/或erk2,从而阻止核易位。
示例性erk抑制剂包括但不限于:ulixertinib、bvd-523(biomeddiscoveries);rg7842、gdc-0094、gdc-0994(arraybiopharma,genentech);cc-90003(celgenecorp);ltt-462(novartisag);asn-007(asanabiosciences);amo-01(amopharma);ko-947(kuraoncology);aezs-134、aezs-131、aezs-140(aeternazentaris);aezs-136、aezs-132、d-87503(aeternazentaris);kin-2118、kin-4050类似物(kinentiabiosciences);rb-1、rb-3(irccssanraffaele);sch-722984、sch-772984(merck&co);mk-8353、sch-900353(merck&co);fr-180204(astellaspharma);idn-5491、贯叶金丝桃素三甲氧基苯甲酸酯(indenaspa);以及erk1-2067、erk1-23211、erk1-624(hleemoffittcancercenter)。在一些实施方案中,erk抑制剂选自sch772984、gdc-0994、cc-90003、bvd-523和ko-947。优选地,erk抑制剂为ko-947。
在一些实例中,erk抑制剂为选自以下的化合物:
可根据本公开内容使用的erk抑制剂的实例包括但不限于:raf-1抑制剂,如gw5074、bay43-9006和isis5132(分别参见lackey,k.等人,bioorg.med.chem.lett.,2000,10:223-226;lyons,j.f.等人,endocrine-relatedcancer,2001,8:219-225;和monia,b.p.等人,nat.med.,1996,2(6):668-675);和mek1/2抑制剂,如pd98059、pd184352、u0126(分别参见dudleyd.t.等人,proc.natl.acad.sci.usa,1995,92:7686-7689;sepolt-leopoldj.s.等人,nat.med.,1999,5:810-816;和favatam.f.等人,j.biol.chem.,273:18623-18632)。wyeth-ayerst(zhangn.等人,bioorg.med.chem.lett.,2000,10:2825-2828)还开发了一系列具有mek抑制活性的3-氰基-4-(苯氧基苯胺基)喹啉。已从微生物提取物中分离出几种对mek具有抑制剂活性的二羟基苯甲酸内酯。例如,从真菌肉汤fc2506中分离的ro09-2210和从茎点霉属(atcc74403)的有机提取物中纯化的l-783,277与atp竞争,且mek1抑制为可逆的(williamsd.h.等人,biochemistry,1998,37:9579-9585;和zhaoa.等人,j.antibiot.,1999,52:1086-1094)。咪唑鎓反式-咪唑二甲基亚砜-四氯钌酸盐(nami-a)是含钌的mek磷酸化抑制剂,mek是erk的上游活化剂(pintusg.等人,eur.j.biochem.,2002,269:5861-5870)。在一些实例中,erk抑制剂选自:bvd-523、fr180204、mk-8353(sch900353)、pluripotin、sch772984、vx-11e(erk-11e;tcserk11e)、sl327、金丝桃素、purvalanol、pd173074、gw5074、bay43-9006、ag99、cay10561、isis5132、芹菜配基、sp600125、su4984、sb203580、pd169316、ko947、gdc0994和ag1478。其他抑制剂包括但不限于:色酮和黄酮类抑制剂;pd98059(rundene等人,jneurosci1998,18(18)7296-305);pd0325901(pfizer);司美替尼,一种选择性mek抑制剂(astrazeneca/arraybiopharma,也称为azd6244);arry-438162(arraybiopharma);pd198306(pfizer);pd0325901(pfizer);azd8330(astrazeneca/arraybiopharma,也称为arry-424704);pd184352(pfizer,也称为ci-1040);pd184161(pfizer);α-[氨基[(4-氨基苯基)硫代]亚甲基]-2-(三氟甲基)苯乙腈(sl327);l,4-二氨基-2,3-二氰基-l,4-双(2-氨基苯基硫代)丁二烯;u0126(kohno&pouyssegur(2003)prog.cell.cyc.res.5:219-224);gw5074(santacruzbiotechnology);bay43-9006(bayer,索拉非尼);ro09-2210(roche,williams等人,biochemistry.1998年6月30日;37(26):9579-85);fr180204(ohori,m.等人,(2005)biochem.biophys.res.comm.336:357-363);3-(2-氨基乙基)-5-))4-乙氧基苯基)亚甲基)-2,4-噻唑烷二酮(pki-erk-005)(chen,f.等人,(2006)bioorg.med.chem.16:6281-6288.171.,hancock,cn.等人(2005)j.med.chem.48:4586-4595);cay10561(cas933786-58-4;caymanchemical);gsk120212;rdea119(ardeabiosciences);xl518;以及arry-704(astrazeneca)。
其他erk抑制剂及其合成已在us5,525,625、us2003/0060469、us2004/0048861、us2004/0082631、wo98/43960、wo99/01426、wo00/41505、wo00/42002、wo00/42003、wo00/41994、wo00/42022、wo00/42029、wo00/68201、wo01/68619、wo02/06213、wo03/077855和wo2005/23251中有述。任选地,erk抑制剂选自:司美替尼、u0126、pd98059、pd0325901、azd8330(arry-42704)、ci-1040(pd184352)和pd318088。优选地,erk抑制剂为在wo/2015051341中描述的化合物,其公开内容通过引用并入本文。
在某些实施方案中,本公开内容提供式i化合物的erk抑制剂:
其中:
x1为c=o、c=s、so、so2或po2-;y为cr5;w为n或c;
x2为nr1或cr1r1’,且x3为空、cr3r3’或c=o;或者x2-x3为r1c=cr3或r1c=n或n=cr3或nr12-cr11=cr3;
x4为n或cr4;x5为n或c;x6为n或c;x7为o、n、nr72或cr71;x8为o、n、nr82或cr81;x9为o、n、nr22或cr21;x10为o、n、nr92或cr91;
r1为-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c2-10烯基-c3-10芳基、-c2-10烯基-c1-10杂芳基、-c2-10烯基-c3-10环烷基、-c2-10烯基-c1-10杂环基、-c2-10炔基-c3-10芳基、-c2-10炔基-c1-10杂芳基、-c2-10炔基-c3-10环烷基、-c2-10炔基-c1-10杂环基、-c1-10杂烷基-c3-10芳基、-c1-10杂烷基-c1-10杂芳基、-c1-10杂烷基-c3-10环烷基、-c1-10杂烷基-c1-10杂环基、-c1-10烷氧基-c3-10芳基、-c1-10烷氧基-c1-10杂芳基、-c1-10烷氧基-c3-10环烷基、-c1-10烷氧基-c1-10杂环基、-c3-10芳基-c1-10烷基、-c3-10芳基-c2-10烯基、-c3-10芳基-c2-10炔基、-c3-10芳基-c3-10杂芳基、-c3-10芳基-c3-10环烷基、-c3-10芳基-c1-10杂环基、-c1-10杂芳基-c1-10烷基、-c1-10杂芳基-c2-10烯基、-c1-10杂芳基-c2-10炔基、-c3-10杂芳基-c3-10芳基、-c1-10杂芳基-c3-10环烷基、-c1-10杂芳基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c2-10烯基、-c3-10环烷基-c2-10炔基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c2-10烯基、-c1-10杂环基-c2-10炔基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r1’为氢、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c2-10烯基-c3-10芳基、-c2-10烯基-c1-10杂芳基、-c2-10烯基-c3-10环烷基、-c2-10烯基-c1-10杂环基、-c2-10炔基-c3-10芳基、-c2-10炔基-c1-10杂芳基、-c2-10炔基-c3-10环烷基、-c2-10炔基-c1-10杂环基、-c1-10杂烷基-c3-10芳基、-c1-10杂烷基-c1-10杂芳基、-c1-10杂烷基-c3-10环烷基、-c1-10杂烷基-c1-10杂环基、-c1-10烷氧基-c3-10芳基、-c1-10烷氧基-c1-10杂芳基、-c1-10烷氧基-c3-10环烷基、-c1-10烷氧基-c1-10杂环基、-c3-10芳基-c1-10烷基、-c3-10芳基-c2-10烯基、-c3-10芳基-c2-10炔基、-c3-10芳基-c3-10杂芳基、-c3-10芳基-c3-10环烷基、-c3-10芳基-c1-10杂环基、-c1-10杂芳基-c1-10烷基、-c1-10杂芳基-c2-10烯基、-c1-10杂芳基-c2-10炔基、-c3-10杂芳基-c3-10芳基、-c1-10杂芳基-c3-10环烷基、-c1-10杂芳基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c2-10烯基、-c3-10环烷基-c2-10炔基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c2-10烯基、-c1-10杂环基-c2-10炔基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r21为氢、卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-so2nr31r32、-nr31c(=o)r32、-nr31c(=o)or32、-nr31c(=o)nr32r33、-nr31s(o)0-2r32、-c(=s)or31、-c(=o)sr31、-nr31c(=nr32)nr32r33、-nr31c(=nr32)or33、-nr31c(=nr32)sr33、-oc(=o)or33、-oc(=o)nr31r32、-oc(=o)sr31、-sc(=o)sr31、-p(o)or31or32、-sc(=o)nr31r32、-l-c1-10烷基、-l-c2-10烯基、-l-c2-10炔基、-l-c1-10杂烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基、-l-c1-10杂环基、-l-c1-10烷基-c3-10芳基、-l-c1-10烷基-c1-10杂芳基、-l-c1-10烷基-c3-10环烷基、-l-c1-10烷基-c1-10杂环基、-l-c2-10烯基-c3-10芳基、-l-c2-10烯基-c1-10杂芳基、-l-c2-10烯基-c3-10环烷基、-l-c2-10烯基-c1-10杂环基、-l-c2-10炔基-c3-10芳基、-l-c2-10炔基-c1-10杂芳基、-l-c2-10炔基-c3-10环烷基、-l-c2-10炔基-c1-10杂环基、-l-c1-10杂烷基-c3-10芳基、-l-c1-10杂烷基-c1-10杂芳基、-l-c1-10杂烷基-c3-10环烷基、-l-c1-10杂烷基-c1-10杂环基、-l-c1-10烷氧基-c3-10芳基、-l-c1-10烷氧基-c1-10杂芳基、-l-c1-10烷氧基-c3-10环烷基、-l-c1-10烷氧基-c1-10杂环基、-l-c3-10芳基-c1-10烷基、-l-c3-10芳基-c2-10烯基、-l-c3-10芳基-c2-10炔基、-l-c3-10芳基-c1-10杂芳基、-l-c3-10芳基-c3-10环烷基、-l-c3-10芳基-c1-10杂环基、-l-c1-10杂芳基-c1-10烷基、-l-c1-10杂芳基-c2-10烯基、-l-c1-10杂芳基-c2-10炔基、-l-c1-10杂芳基-c3-10芳基、-l-c1-10杂芳基-c3-10环烷基、-l-c1-10杂芳基-c1-10杂环基、-l-c3-10环烷基-c1-10烷基、-l-c3-10环烷基-c2-10烯基、-l-c3-10环烷基-c2-10炔基、-l-c3-10环烷基-c3-10芳基、-l-c3-10环烷基-c1-10杂芳基、-l-c3-10环烷基-c1-10杂环基、-l-c1-10杂环基-c1-10烷基、-l-c1-10杂环基-c2-10烯基、-l-c1-10杂环基-c2-10炔基、-l-c1-10杂环基-c3-10芳基、-l-c1-10杂环基-c1-10杂芳基或-l-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
r22为氢、-oh、-cf3、-c(o)r31、-co2r31、-c(=o)nr31、-s(o)0-2r31、-c(=s)or31、-c(=o)sr31、-l-c1-10烷基、-l-c2-10烯基、-l-c2-10炔基、-l-c1-10杂烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基、-l-c1-10杂环基、-l-c1-10烷基-c3-10芳基、-l-c1-10烷基-c1-10杂芳基、-l-c1-10烷基-c3-10环烷基、-l-c1-10烷基-c1-10杂环基、-l-c2-10烯基-c3-10芳基、-l-c2-10烯基-c1-10杂芳基、-l-c2-10烯基-c3-10环烷基、-l-c2-10烯基-c1-10杂环基、-l-c2-10炔基-c3-10芳基、-l-c2-10炔基-c1-10杂芳基、-l-c2-10炔基-c3-10环烷基、-l-c2-10炔基-c1-10杂环基、-l-c1-10杂烷基-c3-10芳基、-l-c1-10杂烷基-c1-10杂芳基、-l-c1-10杂烷基-c3-10环烷基、-l-c1-10杂烷基-c1-10杂环基、-l-c1-10烷氧基-c3-10芳基、-l-c1-10烷氧基-c1-10杂芳基、-l-c1-10烷氧基-c3-10环烷基、-l-c1-10烷氧基-c1-10杂环基、-l-c3-10芳基-c1-10烷基、-l-c3-10芳基-c2-10烯基、-l-c3-10芳基-c2-10炔基、-l-c3-10芳基-c1-10杂芳基、-l-c3-10芳基-c3-10环烷基、-l-c3-10芳基-c1-10杂环基、-l-c1-10杂芳基-c1-10烷基、-l-c1-10杂芳基-c2-10烯基、-l-c1-10杂芳基-c2-10炔基、-l-c1-10杂芳基-c3-10芳基、-l-c1-10杂芳基-c3-10环烷基、-l-c1-10杂芳基-c1-10杂环基、-l-c3-10环烷基-c1-10烷基、-l-c3-10环烷基-c2-10烯基、-l-c3-10环烷基-c2-10炔基、-l-c3-10环烷基-c3-10芳基、-l-c3-10环烷基-c1-10杂芳基、-l-c3-10环烷基-c1-10杂环基、-l-c1-10杂环基-c1-10烷基、-l-c1-10杂环基-c2-10烯基、-l-c1-10杂环基-c2-10炔基、-l-c1-10杂环基-c3-10芳基、-l-c1-10杂环基-c1-10杂芳基或-l-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
l为键、-o-、-n(r31)-、-s(o)0-2-、-c(=o)-、-c(=o)o-、-oc(=o)-、-c(=o)n(r31)-、-n(r31)c(=o)-、-nr31c(=o)o-、-nr31c(=o)nr32-、-nr31s(o)0-2-、-s(o)0-2n(r31)-、-c(=s)o-、-c(=o)s-、-nr31c(=nr32)nr32-、-nr31c(=nr32)o-、-nr31c(=nr32)s-、-oc(=o)o-、-oc(=o)nr31-、-oc(=o)s-、-sc(=o)s-、-p(o)or31o-、-sc(=o)nr31-;
r3、r3’和r4中的每一个独立地为氢、卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-so2nr31r32、-nr31c(=o)r32、-nr31c(=o)or32、-nr31c(=o)nr32r33、-nr31s(o)0-2r32、-c(=s)or31、-c(=o)sr31、-nr31c(=nr32)nr32r33、-nr31c(=nr32)or33、-nr31c(=nr32)sr33、-oc(=o)or33、-oc(=o)nr31r32、-oc(=o)sr31、-sc(=o)sr31、-p(o)or31or32、-sc(=o)nr31r32、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c2-10烯基-c3-10芳基、-c2-10烯基-c1-10杂芳基、-c2-10烯基-c3-10环烷基、-c2-10烯基-c1-10杂环基、-c2-10炔基-c3-10芳基、-c2-10炔基-c1-10杂芳基、-c2-10炔基-c3-10环烷基、-c2-10炔基-c1-10杂环基、-c1-10杂烷基-c3-10芳基、-c1-10杂烷基-c1-10杂芳基、-c1-10杂烷基-c3-10环烷基、-c1-10杂烷基-c1-10杂环基、-c1-10烷氧基-c3-10芳基、-c1-10烷氧基-c1-10杂芳基、-c1-10烷氧基-c3-10环烷基、-c1-10烷氧基-c1-10杂环基、-c3-10芳基-c1-10烷基、-c3-10芳基-c2-10烯基、-c3-10芳基-c2-10炔基、-c3-10芳基-c3-10杂芳基、-c3-10芳基-c3-10环烷基、-c3-10芳基-c1-10杂环基、-c1-10杂芳基-c1-10烷基、-c1-10杂芳基-c2-10烯基、-c1-10杂芳基-c2-10炔基、-c3-10杂芳基-c3-10芳基、-c1-10杂芳基-c3-10环烷基、-c1-10杂芳基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c2-10烯基、-c3-10环烷基-c2-10炔基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c2-10烯基、-c1-10杂环基-c2-10炔基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r13取代基取代;或者r3’为-or6、-nr6r34、-s(o)0-2r6、-c(=o)r6、-c(=o)or6、-oc(=o)r6、-c(=o)n(r34)r6或-n(r34)c(=o)r6,其中r6与r34一起可任选地形成杂环;或者r3’为-or6、-nr6r34、-s(o)0-2r6、-c(=o)r6、-c(=o)or6、-oc(=o)r6、-c(=o)n(r34)r6或-n(r34)c(=o)r6,其中r6与r34一起可任选地形成杂环;
r5、r71、r81和r91中的每一个独立地为氢、卤素、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-so2nr31r32、-nr31c(=o)r32、-nr31c(=o)or32、-nr31c(=o)nr32r33、-nr31s(o)0-2r32、-c(=s)or31、-c(=o)sr31、-nr31c(=nr32)nr32r33、-nr31c(=nr32)or33、-nr31c(=nr32)sr33、-oc(=o)or33、-oc(=o)nr31r32、-oc(=o)sr31、-sc(=o)sr31、-p(o)or31or32或-sc(=o)nr31nr32;
r6为氢、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c2-10烯基-c3-10芳基、-c2-10烯基-c1-10杂芳基、-c2-10烯基-c3-10环烷基、-c2-10烯基-c1-10杂环基、-c2-10炔基-c3-10芳基、-c2-10炔基-c1-10杂芳基、-c2-10炔基-c3-10环烷基、-c2-10炔基-c1-10杂环基、-c1-10杂烷基-c3-10芳基、-c1-10杂烷基-c1-10杂芳基、-c1-10杂烷基-c3-10环烷基、-c1-10杂烷基-c1-10杂环基、-c1-10烷氧基-c3-10芳基、-c1-10烷氧基-c1-10杂芳基、-c1-10烷氧基-c3-10环烷基、-c1-10烷氧基-c1-10杂环基、-c3-10芳基-c1-10烷基、-c3-10芳基-c2-10烯基、-c3-10芳基-c2-10炔基、-c3-10芳基-c3-10杂芳基、-c3-10芳基-c3-10环烷基、-c3-10芳基-c1-10杂环基、-c1-10杂芳基-c1-10烷基、-c1-10杂芳基-c2-10烯基、-c1-10杂芳基-c2-10炔基、-c3-10杂芳基-c3-10芳基、-c1-10杂芳基-c3-10环烷基、-c1-10杂芳基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c2-10烯基、-c3-10环烷基-c2-10炔基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c2-10烯基、-c1-10杂环基-c2-10炔基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r14或r15取代基取代;
r72、r82和r92中的每一个独立地为氢、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-c(o)r31、-co2r31、-c(=o)nr31、-s(o)0-2r31、-c(=s)or31、-c(=o)sr31;
r10和r14中的每一个独立地为-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基,其任选地被一个或多个独立的r11取代基取代;
r11、r12、r13和r15中的每一个独立地为氢、卤素、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-so2nr31r32、-nr31c(=o)r32、-nr31c(=o)or32、-nr31c(=o)nr32r33、-nr31s(o)0-2r32、-c(=s)or31、-c(=o)sr31、-nr31c(=nr32)nr32r33、-nr31c(=nr32)or33、-nr31c(=nr32)sr33、-oc(=o)or33、-oc(=o)nr31r32、-oc(=o)sr31、-sc(=o)sr31、-p(o)or31or32或-sc(=o)nr31nr32;
r31、r32、r33和r34中的每一个独立地为氢、卤素、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基,或者其中r31与r32一起形成杂环;
其中环a包含一个或多个选自n、o或s的杂原子;且
其中如果x7为o,或者x2-x3为r1c=cr3,则环a包含至少两个选自n、o或s的杂原子;且
其中如果x2-x3为r1c=n,则x7或x9中的至少一个不是n。
在式i的一些实施方案中,x1为c=o,x2为nr1或cr1r1’,且x3为cr3r3’。在一些实施方案中,x1为c=o,x2为nr1,且x3为c=o。在一些实施方案中,w为c,y为cr5,x4为cr4,x5为c且x6为c。在一些实施方案中,x7为nh,x8为n且x9为cr21。在一些实施方案中,x7为cr71,x8为n且x9为nr22。在一些实施方案中,x1为c=o,x2为nr1或cr1r1’,x3为cr3r3’,w为c,y为cr5,x4为n或cr4,x5为n或c,x6为c,x7为nr72或cr71,x8为n,且x9为nr22或cr21。在一些实施方案中,x1为c=o,x2为nr1,x3为cr3r3’,w为c,y为cr5,x4为cr4,x5为c,x6为c,x7为nr72,x8为n,且x9为cr21。
在式i的一些实施方案中,x1为c=o,x2为nr1或cr1r1’,x3为cr3r3’或c=o,w为c,y为cr5,x4为n或cr4,x5为n或c,x6为c,x7为n或nr72或cr71,x8为n或cr81,x9为nr22或cr21,且x10为n或cr91;
r1为-c1-10烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r1’为氢、-c1-10烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r21为卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-nr31c(=o)r32、-l-c1-10烷基、-l-c2-10烯基、-l-c2-10炔基、-l-c1-10杂烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基或-l-c1-10杂环基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
r22为-oh、-cf3、-c(o)r31、-co2r31、-c(=o)nr31、-s(o)0-2r31、-l-c1-10烷基、-l-c2-10烯基、-l-c2-10炔基、-l-c1-10杂烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基或-l-c1-10杂环基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
l为键、-o-、-n(r31)-、-s(o)0-2-、-c(=o)-、-c(=o)o-、-oc(=o)-、-c(=o)n(r31)-、-n(r31)c(=o)-、-nr31c(=o)o-、-nr31c(=o)nr32-、-nr31s(o)0-2-或-s(o)0-2n(r31)-;
r3、r3’和r4中的每一个独立地为氢、卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-c1-10烷基、-c2-10烯基、-c2-10炔基、-l-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基或-c1-10杂环基,其中每一个为未取代的或被一个或多个独立的r13取代基取代;或者r3’为-or6、-nr6r34、-s(o)0-2r6、-c(=o)r6、-c(=o)or6、-oc(=o)r6、-c(=o)n(r34)r6或-n(r34)c(=o)r6,其中r6与r34一起可任选地形成杂环;
r5、r71和r81中的每一个独立地为氢、卤素、-c1-10烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31或-nr31c(=o)r32;
r6为-c1-10烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r14或r15取代基取代;
r72为氢、-c1-10烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-c(o)r31、-co2r31、-c(=o)nr31或-s(o)0-2r31;
r10和r14中的每一个独立地为-c1-10烷基、-c2-10烯基、-c2-10炔基,-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基或-c1-10杂环基,其任选地被一个或多个独立的r11取代基取代;
r11、r12、r13和r15中的每一个独立地为氢、卤素、-c1-10烷基、-c3-10芳基、-c3-10环烷基、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31或-nr31c(=o)r32;
r31、r32和r34中的每一个独立地为氢、-c1-10烷基、-c3-10芳基或-c3-10环烷基,或者其中r31与r32一起形成杂环;且
其中环a包含一个或多个选自n、o或s的杂原子。
在式i的一些实施方案中,x1为c=o,x2为nr1或cr1r1’,x3为cr3r3’,w为c,y为cr5,x4为n或cr4,x5为n或c,x6为c,x7为nr72或cr71,x8为n,x9为nr21或cr21,且x10为n或cr91;
r1为-c1-10烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基或-c1-10杂环基-c3-10芳基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r1’为氢、-c1-10烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基或-c1-10杂环基-c3-10芳基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r21为卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-nr31c(=o)r32、-l-c1-10烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基或-l-c1-10杂环基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
r22为-oh、-cf3、-c(o)r31、-co2r31、-c(=o)nr31、-s(o)0-2r31、-l-c1-10烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基或-l-c1-10杂环基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
l为键、-o-、-n(r31)-、-s(o)0-2-、-c(=o)-、-c(=o)o-、-oc(=o)-、-c(=o)n(r31)-或-n(r31)c(=o)-;
r3、r3’和r4中的每一个独立地为氢、卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-c1-10烷基、-c2-10烯基或-c2-10炔基,其中每一个为未取代的或被一个或多个独立的r13取代基取代;或者r3’为-or6、-nr6r34、-c(=o)n(r34)r6或-n(r34)c(=o)r6,其中r6与r34一起可任选地形成杂环;
r5和r71中的每一个独立地为氢、卤素、-c1-10烷基、-c3-10芳基、-c3-10环烷基、-oh、-cf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31或-nr31c(=o)r32;
r6为-c1-10烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基或-c1-10杂环基-c3-10芳基,其中每一个为未取代的或被一个或多个独立的r14或r15取代基取代;
r72为氢、-c1-10烷基、-c3-10芳基、-c3-10环烷基、-oh、-cf3、-c(o)r31、-co2r31、-c(=o)nr31或-s(o)0-2r31;
r10和r14中的每一个独立地为-c1-10烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基或-c1-10杂环基,其任选地被一个或多个独立的r11取代基取代;
r11、r12、r13和r15中的每一个独立地为氢、卤素、-c1-10烷基、-oh、-cf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31或-nr31c(=o)r32;
r31、r32和r34中的每一个独立地为氢或-c1-10烷基,或者其中r31与r32一起形成杂环;且
其中环a包含一个或多个选自n、o或s的杂原子。
在式i的一些实施方案中,x1为c=o,x2为nr1,x3为cr3r3’,w为c,y为cr5,x4为cr4,x5为c,x6为c,x7为nr72,x8为n,x9为cr21,且x10为n或cr91;
r1为-c1-10烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10杂环基-c1-10烷基或-c1-10杂环基-c3-10芳基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r21为卤素、-oh、-cf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-l-c1-10烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基或-l-c1-10杂环基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
l为键、-n(r31)-、-c(=o)n(r31)-或-n(r31)c(=o)-;
r3、r3’和r4中的每一个独立地为氢、卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-no2、-cn、-s(o)0-2r31、-c1-10烷基、-c2-10烯基或-c2-10炔基;或者r3’为-or6、-nr6r34、-c(=o)n(r34)r6或-n(r34)c(=o)r6,其中r6与r34一起可任选地形成杂环;
r5为氢、卤素或-c1-10烷基;
r6为-c1-10烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10杂环基-c1-10烷基或-c1-10杂环基-c3-10芳基,其中每一个为未取代的或被一个或多个独立的r14或r15取代基取代;
r72为氢、-c1-10烷基、-oh、-cf3、-c(o)r31、-co2r31、-c(=o)nr31或-s(o)0-2r31;
r10和r14中的每一个独立地为-c1-10烷基、-c3-10芳基、-c1-10杂芳基或-c1-10杂环基,任选地被一个或多个独立的r11取代基取代;
r11、r12和r15中的每一个独立地为氢、卤素、-c1-10烷基、-oh、-cf3、-or3、-nr31r32、-no2、-cn或-s(o)0-2r31;
r31、r32和r34中的每一个独立地为氢或-c1-10烷基,或者其中r31与r32一起形成杂环;且
其中环a包含一个或多个选自n、o或s的杂原子。
在式i的一些实施方案中,x1为c=o,x2为nr1,x3为cr3r3’,w为c,y为cr5,x4为cr4,x5为c,x6为c,x7为nr72,x8为n,x9为cr21,且x10为n;
r1为-c1-10烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10杂环基-c1-10烷基或-c1-10杂环基-c3-10芳基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r21为卤素、-cn、-l-c1-10烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基或-l-c1-10杂环基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
l为键、-n(r31)-或-c(=o)n(r31)-;或者r3’为-or6或-nr6r34,其中r6与r34一起可任选地形成杂环;
r3、r3’和r4中的每一个独立地为氢、卤素、-oh、-cf3或-c1-10烷基;或者r3’为-or6或-nr6r34,其中r6与r34一起可任选地形成杂环;
r5为氢;
r6为-c1-10烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10杂环基-c1-10烷基或-c1-10杂环基-c3-10芳基,其中每一个为未取代的或被一个或多个独立的r14或r15取代基取代;
r72为氢、-c1-10烷基、-oh、-cf3、-c(o)r31、-co2r31、-c(=o)nr31或-s(o)0-2r31;
r10和r14中的每一个独立地为-c1-10烷基、-c3-10芳基、-c1-10杂芳基或-c1-10杂环基,任选地被一个或多个独立的r11取代基取代;
r11、r12和r15中的每一个独立地为氢、卤素、-c1-10烷基、-oh或-cf3;
r31和r34中的每一个独立地为氢或-c1-10烷基;且
其中环a包含一个或多个选自n、o或s的杂原子。
在某些实施方案中,本公开内容提供式i-a化合物的erk抑制剂:
或其药学上可接受的盐或前药,并且其中取代基如上所述定义。
在式i-a的一些实施方案中,r1为-c1-10烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代。在一些实施方案中,r1为-c1-10烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基或-c1-10杂环基-c3-10芳基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代。在一些实施方案中,r1为-c1-10烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10杂环基-c1-10烷基或-c1-10杂环基-c3-10芳基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代。在一些实施方案中,r1为未取代的或被一个或多个独立的r10或r11取代基取代的-c1-10杂环基-c1-10烷基。
在式i-a的一些实施方案中,r21为氢、卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-nr31c(=o)r32、-l-c1-10烷基、-l-c2-10烯基、-l-c2-10炔基、-l-c1-10杂烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基或-l-c1-10杂环基,其中每一个为未取代的或被一个或多个独立的r12取代基取代。在一些实施方案中,r21为卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-nr31c(=o)r32、-l-c1-10烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基或-l-c1-10杂环基,其中每一个为未取代的或被一个或多个独立的r12取代基取代。在一些实施方案中,r21为卤素、-oh、-cf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-l-c1-10烷基,-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基或-l-c1-10杂环基,其中每一个为未取代的或被一个或多个独立的r12取代基取代。在一些实施方案中,r21为卤素、-cn、-l-c1-10烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基或-l-c1-10杂环基,其中每一个为未取代的或被一个或多个独立的r12取代基取代。
在式i-a的一些实施方案中,r21为未取代的或被一个或多个独立的r12取代基取代的-l-c1-10杂芳基;其中r21的c1-10杂芳基包含一个或多个氮原子;每个r12取代基,当存在时,独立地选自-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-ocf3、-or31;其中每个r31独立地为氢或-c1-10烷基;l为键;且r1为-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10杂环基-c1-10烷基或-c1-10杂环基-c3-10芳基,其为未取代的或被一个或多个独立的r10或r11取代基取代。
在式i-a的一些实施方案中,r21为未取代的或被一个或多个独立的r12取代基取代的-l-c1-10杂芳基;其中r21的c1-10杂芳基包含一个或多个氮原子;每个r12取代基,当存在时,独立地选自-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-ocf3、-or31;其中每个r31独立地为氢或-c1-10烷基;l为键;且r1为未取代的或被一个或多个独立的r10或r11取代基取代的
在式i-a的一些实施方案中,r21为未取代的或被一个或多个独立的取代r12取代基的-l-c1-10杂芳基;其中r21的c1-10杂芳基包含一个或多个氮原子;每个r12取代基,当存在时,独立地选自-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-ocf3、-or31;其中每个r31独立地为氢或-c1-10烷基;l为键;且r1为未取代的或被一个或多个独立的r10或r11取代基取代的
在式i-a的一些实施方案中,r21为未取代的或被一个或多个独立的r12取代基取代的-l-c1-10杂芳基;其中r21的c1-10杂芳基包含一个或多个氮原子;每个r12取代基,当存在时,独立地选自-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-ocf3、-or31;其中每个r31独立地为氢或-c1-10烷基;l为键;且r1为未取代的或被一个或多个独立的r10或r11取代基取代的
在式i-a的一些实施方案中,r21为未取代的或被一个或多个独立的r12取代基取代的-l-c1-10杂芳基;r21的c1-10杂芳基选自吡唑基、吡啶基、吡嗪基、嘧啶基和哒嗪基;每个r12取代基,当存在时,独立地选自-me、-et、-i-pr、-n-pr、-oh、-ome、-oet、-opr;l为键;且r1为-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10杂环基-c1-10烷基或-c1-10杂环基-c3-10芳基,其为未取代的或被一个或多个独立的r10或r11取代基取代。
在式i-a的一些实施方案中,r21为未取代的或被一个或多个独立的r12取代基取代的-l-c1-10杂芳基;r21的c1-10杂芳基选自吡唑基、吡啶基、吡嗪基、嘧啶基和哒嗪基;每个r12取代基,当存在时,独立地选自-me、-et、-i-pr、-n-pr、-oh、-ome、-oet、-opr;l为键;且r1为未取代的或被一个或多个独立的r10或r11取代基取代的
在式i-a的一些实施方案中,r21为未取代的或被一个或多个独立的r12取代基取代的-l-c1-10杂芳基;r21的c1-10杂芳基选自吡唑基、吡啶基、吡嗪基、嘧啶基和哒嗪基;每个r12取代基,当存在时,独立地选自-me、-et、-i-pr、-n-pr、-oh、-ome、-oet、-opr;l为键;且r1为未取代的或被一个或多个独立的r10或r11取代基取代的
在式i-a的一些实施方案中,r21为未取代的或被一个或多个独立的r12取代基取代的-l-c1-10杂芳基;r21的c1-10杂芳基选自吡唑基、吡啶基、吡嗪基、嘧啶基和哒嗪基;每个r12取代基,当存在时,独立地选自-me、-et、-i-pr、-n-pr、-oh、-ome、-oet、-opr;l为键;且r1为未取代的或被一个或多个独立的r10或r11取代基取代的
在式i-a的一些实施方案中,l为键、-o-、-n(r31)-、-s(o)0-2-、-c(=o)-、-c(=o)o-、-oc(=o)-、-c(=o)n(r31)-、-n(r31)c(=o)-、-nr31c(=o)o-、-nr31c(=o)nr32-、-nr31s(o)0-2-或-s(o)0-2n(r31)-。在一些实施方案中,l为键、-o-、-n(r31)-、-s(o)0-2-、-c(=o)-、-c(=o)o-、-oc(=o)-、-c(=o)n(r31)-或-n(r31)c(=o)-。在一些实施方案中,l为键、-n(r31)-、-c(=o)n(r31)-或-n(r31)c(=o)-。在一些实施方案中,l为键、-n(r31)-或-c(=o)n(r31)-。
在式i-a的一些实施方案中,r72为氢、-c1-10烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-c(o)r31、-co2r31、-c(=o)nr31或-s(o)0-2r31。在一些实施方案中,r72独立地为氢、-c1-10烷基、-c3-10芳基、-c3-10环烷基、-c(o)r31、-co2r31、-c(=o)nr31或-s(o)0-2r31。在一些实施方案中,r72独立地为氢或-c1-10烷基。在一些实施方案中,r72独立地为氢。
在式i-a的一些实施方案中,每个r10独立地为-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基,其任选地被一个或多个独立的r11取代基取代。在一些实施方案中,每个r10独立地为-c1-10烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基或-c1-10杂环基,其任选地被一个或多个独立的r11取代基取代。在一些实施方案中,每个r10独立地为-c1-10烷基、-c3-10芳基、-c1-10杂芳基或-c1-10杂环基,其任选地被一个或多个独立的r11取代基取代。
在式i-a的一些实施方案中,r11、r12和r13中的每一个独立地为氢、卤素、-c1-10烷基、-c3-10芳基、-c3-10环烷基、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31或-nr31c(=o)r32。在一些实施方案中,r11、r12和r13中的每一个独立地为氢、卤素、-c1-10烷基、-oh、-cf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31或-nr31c(=o)r32。在一些实施方案中,r11、r12和r13中的每一个独立地为氢、卤素、-c1-10烷基、-oh、-cf3、-or3、-nr31r32、-no2、-cn或-s(o)0-2r31。在一些实施方案中,r11、r12和r13中的每一个独立地为氢、卤素、-c1-10烷基,-oh或-cf3。
在式i-a的一些实施方案中,r31、r32和r33中的每一个独立地为氢、卤素、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基,或者其中r31与r32一起形成杂环。在一些实施方案中,r31、r32和r33中的每一个独立地为氢、-c1-10烷基、-c3-10芳基或-c3-10环烷基,或者其中r31与r32一起形成杂环。在一些实施方案中,r31、r32和r33中的每一个独立地为氢或-c1-10烷基,或者其中r31与r32一起形成杂环。在一些实施方案中,r31、r32和r33中的每一个独立地为氢或-c1-10烷基。
在式i-a的一些实施方案中,
r1为-c1-10烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r21为氢、卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-nr31c(=o)r32、-l-c1-10烷基、-l-c2-10烯基、-l-c2-10炔基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基或-l-c1-10杂环基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
l为键、-o-、-n(r31)-、-s(o)0-2-、-c(=o)-、-c(=o)o-、-oc(=o)-、-c(=o)n(r31)-、-n(r31)c(=o)-、-nr31c(=o)o-、-nr31c(=o)nr32-、-nr31s(o)0-2–或-s(o)0-2n(r31)-;
r72为氢、-c1-10烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-c(o)r31、-co2r31、-c(=o)nr31或-s(o)0-2r31;
每个r10独立地为-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基或-c1-10杂环基,其任选地被一个或多个独立的r11取代基取代;
r11、r12和r13中的每一个独立地为氢、卤素、-c1-10烷基、-c3-10芳基、-c3-10环烷基、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31或-nr31c(=o)r32;且
r31和r32中的每一个独立地为氢、-c1-10烷基、-c3-10芳基或-c3-10环烷基,或者其中r31与r32一起形成杂环。
在式i-a的一些实施方案中,
r1为-c1-10烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基或-c1-10杂环基-c3-10芳基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r21为卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-nr31c(=o)r32、-l-c1-10烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基或-l-c1-10杂环基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
l为键、-o-、-n(r31)-、-s(o)0-2-、-c(=o)-、-c(=o)o-、-oc(=o)-、-c(=o)n(r31)-或-n(r31)c(=o)-;
r72为氢、-c1-10烷基、-c3-10芳基、-c3-10环烷基、-c(o)r31、-co2r31、-c(=o)nr31、-s(o)0-2r31;
r10为-c1-10烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基或-c1-10杂环基,其任选地被一个或多个独立的r11取代基取代;
r11、r12和r13中的每一个独立地为氢、卤素、-c1-10烷基、-oh、-cf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31或-nr31c(=o)r32;且
r31和r32中的每一个独立地为氢或-c1-10烷基,或者其中r31与r32一起形成杂环。
在式i-a的一些实施方案中,
r1为c1-10烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基或-c1-10杂环基-c3-10芳基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r21为卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-nr31c(=o)r32、-l-c1-10烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基或-l-c1-10杂环基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
l为键、-o-、-n(r31)-、-s(o)0-2-、-c(=o)-、-c(=o)o-、-oc(=o)-、-c(=o)n(r31)-或-n(r31)c(=o)-;
r72为氢或-c1-10烷基;
每个r10独立地为-c1-10烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基或-c1-10杂环基,其任选地被一个或多个独立的r11取代基取代;
r11和r12中的每一个独立地为氢、卤素、-c1-10烷基、-oh、-cf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31或-nr31c(=o)r32;且
r31和r32中的每一个独立地为氢或-c1-10烷基。
在式i-a的一些实施方案中,
r1为-c1-10烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10杂环基-c1-10烷基或-c1-10杂环基-c3-10芳基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r21为卤素、-cn、-l-c1-10烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基或-l-c1-10杂环基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
l为键、-n(r31)-或-c(=o)n(r31)-;
r72为氢;
每个r10独立地为-c1-10烷基、-c3-10芳基、-c1-10杂芳基或-c1-10杂环基,其任选地被一个或多个独立的r11取代基取代;
r11和r12中的每一个独立地为氢、卤素、-c1-10烷基、-oh、-cf3、-or31或-cn;且
每个r31独立地为氢或-c1-10烷基。
在式i-a的一些实施方案中,
r1为-c1-10烷基、-c1-10烷基-c3-10芳基或-c1-10杂环基-c1-10烷基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r21为-l-c3-10芳基或-l-c1-10杂芳基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
l为键或-n(r31)-;
r72为氢;
每个r10独立地为-c3-10芳基、-c1-10杂芳基或-c1-10杂环基,其任选地被一个或多个独立的r11取代基取代;
r11和r12中的每一个独立地为卤素、-c1-10烷基、-oh、-cf3或-or31;且
每个r31独立地为氢或-c1-10烷基。
在式i-a的一些实施方案中,
r1为未取代的或被一个或多个独立的r11取代基取代的-c1-10杂环基-c1-10烷基;
r21为选自2-吡啶基、3-吡啶基和4-吡啶基的吡啶基,其为未取代的或被一个或多个独立的r12取代基取代;
l为键;
r72为氢;
r11和r12中的每一个独立地为卤素、-c1-10烷基、-cf3或-or31;且
每个r31独立地为氢或-c1-10烷基。
在某些实施方案中,对于式i或式i-a化合物,r1为未取代的-c1-10杂环基-c1-10烷基。在一些实施方案中,r1为被一个或多个独立的r10取代基取代的-c1-10杂环基-c1-10烷基。在一些实施方案中,r1为被一个或多个独立的r11取代基取代的-c1-10杂环基-c1-10烷基。在一些实施方案中,r1为被一个或多个独立的r10或r11取代基取代的-c1-10杂环基-c1-10烷基。在一些实施方案中,r10和r11选自芳基,如苯基。
在某些实施方案中,对于式i或式i-a化合物,r1为-c1-10烷基、-c1-10杂环基、-c1-10烷基-c3-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10杂环基-c1-10烷基或-c1-10杂环基-c3-10芳基,其为未取代的或被一个或多个独立的r10或r11取代基取代。在其他实施方案中,r1为-c1-10烷基、-c1-10杂环基、-c1-10烷基-c3-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10杂环基-c1-10烷基或-c1-10杂环基-c3-10芳基,其为未取代的或被一个或多个独立的r10或r11取代基取代。在另外其他的实施方案中,r1为-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10杂环基-c1-10烷基或-c1-10杂环基-c3-10芳基,其为未取代的或被一个或多个独立的r10或r11取代基取代。在另外其他的实施方案中,r1为-c1-10烷基-c3-10芳基或-c1-10杂环基-c3-10芳基,其为未取代的或被一个或多个独立的r10或r11取代基取代。在进一步的实施方案中,其中r1为未取代的或被一个或多个独立的r10或r11取代基取代的
在一些实施方案中,r1为
在某些实施方案中,对于式i或式i-a化合物,r1或r1’中的每一个独立地为如下所示的取代基:
在某些实施方案中,本公开内容提供为选自以下的化合物的erk抑制剂:
在某些实施方案中,本公开内容提供为选自以下的化合物的erk抑制剂:
在某些实施方案中,本公开内容提供选自以下化合物的erk抑制剂:
本公开内容的化合物还包括这些化合物的结晶和无定形形式、具有相同类型活性的这些化合物的药学上可接受的盐和活性代谢物,包括例如该化合物的多晶型物、假多晶型物、溶剂化物、水合物、非溶剂化多晶型物(包括无水物)、构象多晶型物和无定形形式,以及上述的混合物。
本文所述的化合物可展现出它们的天然同位素丰度,或者一个或多个原子可以人工富集在具有相同原子序数的特定同位素中,但是原子质量或质量数不同于主要见于自然界中的原子质量或质量数。本公开内的化合物的所有同位素变体,无论是否具有放射性,都包括在本公开内容的范围内。例如,氢有三种天然存在的同位素,表示为1h(氕)、2h(氘)和3h(氚)。氕是自然界中氢的最丰富的同位素。富集氘可以提供某些治疗优势,如增加的体内半衰期和/或暴露,或者可以提供用于研究药物消除和代谢的体内途径的化合物。富含同位素的化合物可通过本领域技术人员公知的常规技术来制备。
“异构体”是具有相同分子式的不同化合物。“立体异构体”是仅原子空间排列的方式不同的异构体。“对映体”是一对为彼此不可叠加的镜像的立体异构体。1:1的一对对映体的混合物为“外消旋”混合物。在适当的情况下,术语“(±)”用于指定外消旋混合物。“非对映异构体”或“非对映体”为具有至少两个不对称原子但不是彼此的镜像的立体异构体。绝对立体化学根据cahn-ingold-prelogr-s系统来指定。当化合物是纯对映体时,每个手性碳处的立体化学可以由r或s指定。绝对构型未知的拆分的化合物可以被指定为(+)或(-),这取决于它们在钠d线的波长处旋转平面偏振光的方向(右旋或左旋)。本文所述的某些化合物含有一个或多个不对称中心,因此可产生对映体、非对映体和其他立体异构形式,其非对称中心可根据绝对立体化学被定义为(r)-或(s)-。本发明的化学实体、药物组合物和方法意在包括所有这些可能的立体异构体,包括外消旋混合物、光学纯的形式,非对映体的混合物和中间体混合物。光学活性的(r)-和(s)-异构体可使用手性合成子(synthon)或手性试剂来制备,或使用常规技术来拆分。化合物的光学活性可以经由任何合适的方法进行分析,该方法包括但不限于手性色谱法和偏振测定法,并且可以确定一种立体异构体相对于另一种异构体的主导程度。
具有碳-碳双键或碳-氮双键的化学实体可以以z-或e-形式(或顺式-或反式-形式)存在。此外,一些化学实体可以以各种互变异构形式存在。除非另有说明,否则本文所述的化学实体旨在还包括所有z-、e-和互变异构形式。
术语“盐”或“药学上可接受的盐”是指衍生于本领域公知的多种有机和无机抗衡离子的盐。可以用无机酸和有机酸形成药学上可接受的酸加成盐。可以衍生出盐的无机酸包括:例如盐酸、氢溴酸、硫酸、硝酸、磷酸等。可以衍生出盐的有机酸包括:例如乙酸、丙酸、乙醇酸、丙酮酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸等。可以用无机和有机碱形成药学上可接受的碱加成盐。可以衍生出盐的无机碱包括:例如钠、钾、锂、铵、钙、镁、铁、锌、铜、锰、铝等。可以衍生出盐的有机碱包括:例如,伯胺、仲胺和叔胺;取代的胺,包括天然存在的取代的胺、环胺、碱性离子交换树脂等,特别是例如异丙胺、三甲胺、二乙胺、三乙胺、三丙胺和乙醇胺。在一些实施方案中,药学上可接受的碱加成盐选自铵盐、钾盐、钠盐、钙盐和镁盐。
“任选的”或“任选地”意指随后描述的情况事件可能发生或可能不发生,并且该描述包括所述事件或情况发生时的情形和所述事件或情况不发生时的情形。例如,“任选取代的芳基”是指芳基可以被取代或者可以不被取代,并且该描述既包括被取代的芳基也包括没有取代的芳基。
“药学上可接受的载体、稀释剂或赋形剂”包括但不限于已被美国食品和药品管理局批准为可用于人或家畜的任何佐剂、载体、赋形剂、助流剂、甜味剂、稀释剂、防腐剂、染料、着色剂、增味剂、表面活性剂、润湿剂、分散剂、悬浮剂、稳定剂、等渗剂、溶剂或乳化剂。
本文考虑了上文针对各种变量描述的基团的任何组合。在整个说明书中,可以选择基团和其取代基以提供稳定的部分和化合物。
本文所述的化学实体可根据本文的一种或多种说明性方案和/或本领域已知的技术(例如,如pct/us2014/059197中所述的技术)合成,其公开内容通过引用并入本文。本文使用的材料可商购或通过本领域公知的合成方法来制备。
本公开内容提供了抑制细胞中一种或多种erk激酶(包括erk1和erk2)的活性的方法,包括使细胞与有效量的一种或多种本文公开的化合物接触。激酶活性的抑制可以通过本领域已知的多种方法来评估和证明。非限制性实例包括:(a)用诸如抗磷酸酪氨酸抗体、抗磷酸丝氨酸抗体或抗磷酸苏氨酸抗体等抗体进行免疫印迹和免疫沉淀,上述抗体识别磷酸化蛋白;(b)使用特异性识别的特定磷酸化形式的激酶底物的抗体(例如抗磷酸化erk);(c)细胞增殖测定,诸如但不限于氚标记胸苷摄取测定、brdu(5’-溴-2’-脱氧尿苷)摄取(calibochem销售的试剂盒)、mts摄取(promega销售的试剂盒)、mtt摄取(caymanchemical销售的试剂盒)、
与其他pi3-激酶或蛋白激酶相比,选择性pi3kα抑制还可以通过pi3kα基因、其下游信号传导基因的表达水平(例如通过rt-pcr)或者蛋白质的表达水平(例如通过免疫细胞化学、免疫组织化学、western印迹法)来确定。
在一些实施方案中,主题方法的实践涉及体外发生的接触步骤。在其他实施方案中,接触步骤在体内进行。
以上示出的任何化合物可以在erk抑制测定中显示出约1pm至25μm(ic50)之间的生物学活性。
在一些实施方案中,本公开内容的一种或多种化合物可以与erk(mapk)激酶或者选自下组的蛋白激酶特异性结合:ras、raf、jnk、erbb-1(egfr)、her2(erbb-2)、her3(erbb-3)、her4(erbb-4)、map2k1(mek1)、map2k2(mek2)、map2k3(mek3)、map2k4(mek4)、map2k5(mek5)、map2k6(mek6)、map2k7(mek7)、cdk1、cdk2、cdk3、cdk4、cdk5、cdk6、cdk7、cdk8、cdk9、cdk11以及附表和附图中所列出的任何其他蛋白激酶,以及其任何功能性突变体。
在一些实施方案中,本公开内容的化合物对erk1和/或erk2的ic50小于约1μm、小于约100nm、小于约50nm、小于约10nm、小于1nm或者甚至小于约0.5nm。在一些实施方案中,本公开内容的化合物对erk的ic50小于约1μm、小于约100nm、小于约50nm、小于约10nm、小于1nm或者甚至小于约0.5nm。在一些实施方案中,本公开内容的一种或多种化合物展现出双重结合特异性并且能够抑制erk激酶(例如,erk-1激酶、erk-2激酶等)以及蛋白激酶(例如,ras、raf、her-2、mek1等),其ic50值小于约1μm、小于约100nm、小于约50nm、小于约10nm、小于1nm或者甚至小于约0.5nm。在一些实施方案中,本公开内容的一种或多种化合物可能能够抑制ras-raf-mek-erk途径中涉及的激酶,该途径包括,例如,ras、raf、jnk、erbb-1(egfr)、her2(erbb-2)、her3(erbb-3)、her4(erbb-4)、map2k1(mek1)、map2k2(mek2)、map2k3(mek3)、map2k4(mek4)、map2k5(mek5)、map2k6(mek6)、map2k7(mek7)、cdk1、cdk2、cdk3、cdk4、cdk5、cdk6、cdk7、cdk8、cdk9、cdk11及其功能性突变体。在一些实施方案中,激酶为ras、raf、jnk、erbb-1(egfr)、her2(erbb-2)、map2k1(mek1)、cdk1、cdk2、cdk3、cdk4、cdk5、cdk6或者本文表格和图中列出的任何其他激酶。
在又一个实施方案中,相对于包括但不限于丝氨酸/苏氨酸激酶如dna-pk和mtor的一种或多种蛋白激酶,本公开内容的化合物选择性地抑制erk1和/或erk2活性。该选择性抑制可以通过例如本公开内容的化合物的ic50值来证明,该ic50值是对参考蛋白激酶的ic50值的1/2、1/3、1/4、1/5、1/7、1/10、1/20、1/25、1/50、1/100、1/200、1/300、1/400、1/500、1/1000、1/2000或更少。在一些情况下,本公开内容的化合物与除erk1或erk2之外的至少约100种、200种、300种或更多种蛋白激酶缺乏明显的交叉反应性。与其他非erk蛋白激酶缺乏明显的交叉反应性可以通过例如当本公开内容的化合物以1μm、5μm、10μm或更高的浓度应用于该蛋白激酶时保留至少50%、60%、70%、80%、90%或更高的激酶活性来证明。
在一些实施方案中,如在体外激酶测定中所确定的,一种或多种本公开内容的化合物选择性抑制erk1和erk2两者的活性,其ic50值为约100nm、50nm、10nm、5nm、100pm、10pm或甚至1pm或者更少。
在一些实施方案中,一种或多种本公开内容的化合物与atp竞争结合至erk1和/或erk2上的atp结合位点。在一些实施方案中,一种或多种本公开内容的化合物在不同于atp结合位点的位点处结合至erk1和/或erk2。
在一些实施方案中,本公开内容的一种或多种化合物能够经由本文公开的一种或多种蛋白激酶或脂质激酶来抑制和/或以其他方式调节细胞信号转导。例如,本公开内容的一种或多种化合物能够抑制或调节信号转导途径的输出。给定途径的信号传导转导的输出可以通过感兴趣的途径中信号传导分子的磷酸化、去磷酸化、片段化、还原、氧化的水平来测量。在另一具体实施方案中,途径的输出可以是细胞输出或表型输出(例如,调节/抑制细胞增殖、细胞死亡、细胞凋亡、自噬、吞噬、细胞周期进展、转移、细胞侵袭、血管生成、血管形成、遍在蛋白化、翻译、转录、蛋白质运输、线粒体功能、高尔基功能、内质网功能等)。在一些实施方案中,举例来说,本公开内容的一种或多种化合物能够引起细胞凋亡、引起细胞周期停滞、抑制细胞增殖、抑制肿瘤生长、抑制血管生成、抑制血管形成、抑制转移和/或抑制细胞侵袭。
在一些实施方案中,本公开内容的一种或多种化合物引起所述细胞的凋亡或细胞周期停滞。细胞周期可以通过主题化合物在g0/g1期、s期和/或g2/m期停滞。
在一些实施方案中,本公开内容的一种或多种化合物(包括但不限于以上列出的化合物)能够抑制细胞增殖。例如,在一些情况下,本公开内容的一种或多种化合物可以抑制具有广泛的遗传组成的肿瘤细胞或肿瘤细胞系的增殖。在一些情况下,本公开内容的化合物可以在体外或在体内模型如异种移植小鼠模型中抑制pc3细胞增殖。在一些情况下,可通过本公开内容的一种或多种化合物来抑制体外培养的pc3细胞增殖,其ic50小于100nm、75nm、50nm、25nm、15nm、10nm、5nm、3nm、2nm、1nm、0.5nm、0.1nm或更小。
在一些实施方案中,如通过体外测定或者体内模型(例如,使用受试者的肿瘤细胞产生异种移植模型)所示,本公开内容的化合物可抑制来自受试者(例如,癌症患者)的原发性肿瘤的增殖。在一些情况下,可通过本公开内容的一种或多种化合物来抑制原发性肿瘤细胞系增殖,其ic50小于100nm、75nm、50nm、25nm、15nm、10nm、5nm、3nm、2nm、1nm、0.5nm、0.1nm或更小。在一些情况下,本公开内容的化合物对于抑制一组10、20、30、40、50、100种或更多种原发性肿瘤细胞的平均ic50可为约200nm、100nm、75nm、50nm、25nm、15nm、10nm、5nm、3nm、2nm、1nm、0.5nm、0.1nm或更小。可由本公开内容的化合物抑制的肿瘤细胞包括但不限于鳞状细胞癌,如肺、食管、头颈和宫颈的鳞状细胞癌。
在一些实施方案中,本公开内容的化合物可有效阻断细胞中的细胞增殖信号。在一些情况下,细胞增殖信号传导可以被本公开内容的一种或多种化合物抑制,如通过蛋白质磷酸化如foxo1磷酸化(在t24/3at32处磷酸化)、gsk3β磷酸化(在s9处磷酸化)、pras40磷酸化(在t246处磷酸化)或mapk磷酸化的western印迹分析所证明。在一些情况下,本公开内容的化合物可抑制信号蛋白的磷酸化并抑制含有这些信号蛋白但对现有的化疗剂具有抗性的细胞的增殖,该现有化疗剂包括但不限于:雷帕霉素、格列卫、达沙替尼、烷化剂、抗代谢药、蒽环类、植物生物碱、拓扑异构酶抑制剂和本文公开的其他抗肿瘤剂。
在一些实施方案中,本公开内容的一种或多种化合物可引起细胞周期停滞。在一些情况下,用本公开内容的一种或多种化合物处理的细胞可能停滞或需要更长时间才能经过一个或多个细胞周期阶段,如g0/g1、s或g2/m。例如,用本公开内容的一种或多种化合物处理的细胞可能停滞或需要更长时间才能经过g0/g1细胞周期阶段。在一些情况下,用本公开内容的一种或多种化合物处理的细胞中约35%、40%、50%、55%、60%、65%、70%或更多可处于g0/g1细胞周期阶段。在一些情况下,响应于用本公开内容的化合物治疗而表现出细胞周期停滞在g0/g1细胞周期阶段的细胞是肿瘤细胞或快速分裂细胞。在一些情况下,与多柔比星相比,本公开内容的化合物影响相当的或更大程度的g0/g1停滞。
在一些实施方案中,本公开内容方法涉及治疗对ras、raf和/或mek抑制剂具有抗性的疾病或状况。例如,该疾病可以是对b-raf和/或mek抑制剂具有抗性的鳞状细胞癌。
在某些方面,本公开内容提供治疗有需要的受试者的癌症的方法,包括向受试者施用有效剂量的细胞外信号调节激酶(erk)抑制剂,其中受试者展现出对ras、raf或mek抑制剂治疗的抗性。任选地,该方法包括针对ras、raf或mek抑制剂治疗有抗性来筛选受试者或筛选从受试者分离的癌细胞。在一些实施方案中,该方法包括如果受试者或从受试者分离的癌细胞经确定对ras、raf或mek抑制剂治疗有抗性,则向受试者施用erk抑制剂。
在一些实施方案中,受试者展现出对b-raf抑制剂治疗的抗性。该b-raf抑制剂可选自:维罗非尼、gdc-0879、plx-4720、plx-3603、plx-4032、raf265、xl281、az628、索拉非尼、达拉非尼和lgx818,如维罗非尼。在一些实施方案中,受试者展现出对mek抑制剂治疗的抗性。该mek抑制剂可选自:曲美替尼、考比替尼、binimetinib、司美替尼、pd-325901、ci-1040、pd-035901、tak-733、pd98059、pd184352、u0126、rdea119、azd8330、ro4987655、ro4927350、ro5068760、as703026和e6201,如曲美替尼。
在一些实施方案中,主题方法的癌症包括b-raf或n-ras突变。癌症可选自:乳腺癌、胰腺癌、肺癌、甲状腺癌、精原细胞瘤、黑素瘤、膀胱癌、肝癌、肾癌、骨髓增生异常综合征、急性髓性白血病和结直肠癌。在一些实施方案中,癌症选自:胰腺癌、肺癌、黑素瘤和结直肠癌,如黑素瘤。
在某些方面,本公开内容提供抑制癌细胞生长的方法,该方法包括向该细胞施用erk抑制剂,其中该细胞展现出对ras、raf或mek抑制剂治疗的抗性。在一些实施方案中,该细胞展现出对b-raf抑制剂治疗的抗性。在一些实施方案中,该细胞展现出对mek抑制剂治疗的抗性。上文提供了主题方法的示例性b-raf和mek抑制剂,包括例如曲美替尼和维罗非尼。在一些实施方案中,该细胞包含b-raf或n-ras突变。该细胞可选自胰腺癌细胞、肺癌细胞、黑素瘤细胞和结直肠癌细胞,如黑素瘤细胞。
术语“抗性”是指受试者或细胞对标准剂量的特定治疗剂或标准治疗方案的反应降低。受试者或细胞对特定治疗的抗性可通过缺乏所期望的反应来表征,其中在癌症治疗中的期望反应可包括以下情况的一种或多种:抑制肿瘤细胞增殖、抑制肿瘤细胞生长、抑制肿瘤血管化作用、根除肿瘤细胞、降低肿瘤的生长速度、减少至少一个肿瘤的大小,和/或根除或改善与癌症相关的一种或多种生理症状。对治疗展现出抗性的受试者或癌细胞可以是无反应的或对治疗表现出降低的或有限的反应,如对治疗的反应降低25%或更多,例如降低30%、40%、50%、60%、70%、80%或更多至降低2倍、3倍、4倍、5倍、10倍、15倍、20倍或更多。抗性可以通过b-raf或n-ras突变(例如,brafv600e或nrasq61r)或其他机制介导。
本公开内容还提供通过使激酶与有效量的本公开内容的化合物接触来调节erk激酶活性的方法。调节可以抑制或激活激酶活性。在一些实施方案中,本公开内容提供通过使激酶与有效量的本公开内容的化合物在溶液中接触来抑制激酶活性的方法。在一些实施方案中,本公开内容提供通过接触表达感兴趣的激酶的细胞、组织、器官来抑制激酶活性的方法。在一些实施方案中,本公开内容提供通过向受试者施用有效量的本公开内容的化合物来抑制受试者中激酶活性的方法,该受试者包括但不限于啮齿动物和哺乳动物(例如,人)。在一些实施方案中,抑制百分比超过25%、30%、40%、50%、60%、70%、80%或90%。
在一些实施方案中,激酶选自:erk,包括不同的同工型如erk1和erk2;ras;raf;jnk;erbb-1(egfr);her2(erbb-2);her3(erbb-3);her4(erbb-4);map2k1(mek1);map2k2(mek2);map2k3(mek3);map2k4(mek4);map2k5(mek5);map2k6(mek6);map2k7(mek7);cdk1;cdk2;cdk3;cdk4;cdk5;cdk6;cdk7;cdk8;cdk9;cdk11。
本公开内容还提供通过使erk接触足以调节erk活性的量的本公开内容的化合物来调节erk活性的方法。调节可以抑制或激活erk活性。在一些实施方案中,本公开内容提供通过使erk接触足以抑制erk活性的量的本公开内容的化合物来抑制erk的方法。在一些实施方案中,本公开内容提供使溶液接触足以抑制所述溶液中erk活性的量的本公开内容的化合物来抑制所述溶液中erk活性的方法。在一些实施方案中,本公开内容提供通过使细胞接触足以抑制所述细胞中erk活性的量的本公开内容的化合物来抑制所述细胞中erk活性的方法。在一些实施方案中,本公开内容提供通过使组织接触足以抑制所述组织中erk活性的量的本公开内容的化合物来抑制所述组织中erk活性的方法。在一些实施方案中,本公开内容提供通过使生物体接触足以抑制所述生物体中erk活性的量的本公开内容的化合物来抑制所述生物体中erk活性的方法。在一些实施方案中,本公开内容提供通过使动物接触足以抑制所述动物中erk活性的量的本公开内容的化合物来抑制所述动物中erk活性的方法。在一些实施方案中,本公开内容提供通过使哺乳动物接触足以抑制所述哺乳动物中erk活性的量的本公开内容的化合物来抑制所述哺乳动物中erk活性的方法。在一些实施方案中,本公开内容提供通过使人类接触足以抑制所述人类中erk活性的量的本公开内容的化合物来抑制所述人类中erk活性的方法。本公开内容提供在需要这种治疗的受试者中治疗由erk活性介导的疾病的方法。
在一些实施方案中,本公开内容的方法提供有效剂量的erk抑制剂。如本文所定义,有效剂量是指足以实现预期应用(包括但不限于疾病治疗)的量。在主题方法中还考虑使用亚治疗量的erk抑制剂来治疗预期的疾病状况。
所施用的erk抑制剂的量可以根据预期应用(在体外或在体内)或者所治疗的受试者以及疾病状况,例如,受试者的体重和年龄、疾病状况的严重程度、施用方式等而变化,这可由本领域普通技术人员容易地确定。
可以监测用erk抑制剂治疗的受试者以确定治疗的有效性,并且可以基于受试者对治疗的生理反应来调整治疗方案。例如,如果erk抑制的生物效果的抑制高于或低于阈值,则给药量或给药频率可相应地减少或增加。该方法可进一步包括如果确定疗法有效则继续该疗法。该方法可包括如果确定疗法有效,则维持、逐渐减少、减少或停止疗法中的化合物的施用量。该方法可包括如果确定疗法不是有效的,则增加疗法中化合物的施用量。备选地,该方法可包括如果确定疗法不是有效的,则停止疗法。在一些实施方案中,如果生物效果的抑制高于或低于阈值,如缺乏响应或有不良反应,则停止使用erk抑制剂治疗。生物效果可以是各种生理指标中的任何一种的变化。
基于治疗癌症的效果来衡量治疗的有效性(或者,“治疗功效”或“临床有益反应”)。通常,关于癌症(无论是良性的还是恶性的)的治疗,本公开内容的方法的治疗功效可通过方法和组合物促进抑制肿瘤细胞增殖、抑制肿瘤血管化、根除肿瘤细胞、降低肿瘤生长速度和/或减少至少一个肿瘤的大小的程度来衡量。本文讨论了在确定治疗功效时要考虑的几个参数。临床医生可以建立特定情况的参数的适当组合。本发明方法在治疗癌症(例如,减小肿瘤大小或根除癌细胞)方面的进展可以使用任何合适的方法来确定,如目前在临床中用于追踪肿瘤大小和癌症进展的那些方法。用于通过所公开的方法和组合物来评价癌症治疗的主要功效参数优选为肿瘤大小的减小。可使用任何合适的技术来计算肿瘤大小,如测量尺寸,或使用可用的能够准确估计肿瘤体积的计算机软件(如在wakeforestuniversity开发的freeflight软件)来估计肿瘤体积。可通过使用例如ct、超声、spect、螺旋ct、mri、照片等进行肿瘤可视化来确定肿瘤大小。在治疗期结束后手术切除肿瘤的实施方案中,可通过对要切除的组织的总体分析和/或通过切除组织的病理分析来确定肿瘤组织的存在和肿瘤大小。
临床医生在确定患有癌症的受试者是否展现出临床有益反应时可以考虑如本文所述的若干参数。在一些预期的实施方案中,主题方法和组合物造成肿瘤的生长被稳定(即,一个或多个肿瘤的大小不增加超过1%、5%、10%、15%或20%,和/或不转移)。在一些实施方案中,肿瘤稳定至少约1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周或更多周。在一些实施方案中,肿瘤稳定至少约1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月或更多个月。在一些实施方案中,肿瘤稳定至少约1年、2年、3年、4年、5年、6年、7年、8年、9年、10年或更多年。优选地,本发明方法使肿瘤大小减小至少约5%(例如,至少约10%、15%、20%或25%)。更优选地,肿瘤大小减少至少约30%(例如,至少约35%、40%、45%、50%、55%、60%或65%)。甚至更优选地,肿瘤大小减少至少约70%(例如,至少约75%、80%、85%、90%或95%)。最优选地,肿瘤完全消除或减小到低于检测水平。在一些实施方案中,在治疗后受试者保持无肿瘤(例如缓解)达至少约1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周或更多周。在一些实施方案中,在治疗后受试者保持无肿瘤达至少约1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月或更多个月。在一些实施方案中,在治疗后受试者保持无肿瘤至少约1年、2年、3年、4年、5年、6年、7年、8年、9年、10年或更多年。
在一些实施方案中,所公开的方法在减小肿瘤大小方面的效力可通过测量治疗期结束后手术切除肿瘤的坏死(即死亡)组织的百分比来确定。在一些进一步的实施方案中,如果切除组织的坏死百分比大于约20%(例如,至少约30%、40%、50%、60%、70%、80%、90%或100%),更优选地约90%或更大(例如,约90%、95%或100%),则治疗是有疗效的。最优选地,所切除组织的坏死百分比为100%,即肿瘤组织不存在或不可检测到。
所公开方法的功效可以通过多个次要参数来确定。次要参数的实例包括但不限于:新肿瘤的检测、肿瘤抗原或标志物的检测、活检、手术降期(downstaging)(即,将肿瘤的手术阶段从不可切除的转变为可切除的)、pet扫描、存活率、疾病无进展存活率、疾病进展的时间、生活质量评估如临床有益反应评估等,以上所有都可指出人癌症的总体进展(或消退)。活检在检测组织内癌细胞的根除方面特别有用。放射免疫检测法(raid)被用于使用由肿瘤(“肿瘤标志物”或“肿瘤相关抗原”)产生和/或与肿瘤相关的标志物(抗原)的血清水平进行肿瘤的定位和分期,并且可用作治疗前的诊断预测、复发的治疗后诊断指标以及治疗效果的治疗后指标。可作为治疗功效指标而评价的肿瘤标志物或肿瘤相关抗原的实例包括但不限于:癌胚抗原(cea)、前列腺特异性抗原(psa)、促红细胞生成素(epo)、ca-125、ca19-9、神经节苷脂分子(例如,gm2、gd2和gd3)、mart-1、热休克蛋白(例如,gp96)、唾液酸化tn(stn)、酪氨酸酶、muc-1、her-2/neu、c-erb-b2、ksa、psma、p53、ras、egf-r、vegf、mage和gp100。其他肿瘤相关抗原是本领域已知的。结合内窥镜检测系统的raid技术也可有效地区分小肿瘤与周围组织(参见,例如,美国专利号4,932,412)。
在另外的预期实施方案中,根据所公开的方法治疗人患者的癌症通过以下一种或多种结果证明:(a)肿瘤完全消失(即完全反应),(b)与治疗前肿瘤的大小相比,治疗期结束后至少四周肿瘤大小减小约25%至约50%,(c)与治疗期前肿瘤的大小相比,治疗期结束后至少约四周肿瘤大小减小至少约50%,和(d)与治疗期之前的肿瘤相关抗原水平相比,在治疗期结束后约4-12周,特定肿瘤相关抗原水平降低至少2%(例如,降低约5%、10%、20%、30%、40%、50%、60%、70%、80%或90%)。尽管肿瘤相关抗原水平至少降低2%为优选,但肿瘤相关抗原水平的任何降低都是通过本发明方法治疗患者癌症的证据。
关于生活质量评估,如临床有益反应标准,根据本公开内容治疗的治疗益处可根据疼痛强度、镇痛药消耗和/或karnofsky功能状态评分来证明。备选地或附加地,人患者中的癌症的治疗由以下证明:(a)与治疗前患者报告的疼痛强度相比,如在完成治疗后的12周内的任意连续四周的时间,患者报告的疼痛强度降低至少50%(例如,降低至少60%、70%、80%、90%或100%),(b)与治疗前患者报告的镇痛药消耗相比,如在治疗结束后12周内的任意连续4周的时间,患者报告的镇痛药消耗减少至少50%(例如,减少至少60%、70%、80%、90%或100%),和/或(c)与治疗前患者报告的karnofsky功能状态评分相比,如在治疗期结束后12周内的任意连续四周的时间,患者报告的karnofsky功能状态评分增加至少20分(例如,增加至少30分、50分、70分或90分)。
在一些实施方案中,本发明方法导致肿瘤大小减小,优选在受试者中没有显著不良事件。不良事件由国家癌症研究所(nci)的癌症治疗评价计划(ctep)分类或“分级”,其中0级代表最小的不良副作用,而4级代表最严重的不良事件。预期地,所公开的方法与最小的不良事件,例如由ctep/nci分级的0级、1级或2级不良事件相关。然而,如本文所讨论的,虽然是优选的,但肿瘤大小的减小不是必需的,因为尽管根除肿瘤细胞,但肿瘤的实际大小可能不会缩小。根除癌细胞足以实现治疗效果。同样,肿瘤大小的任何减少都足以实现治疗效果。
在cancerfactsandfigures2001,americancancersociety,newyork,n.y.,和internationalpatentapplicationwo01/24684中进一步描述了人的各种癌症的检测、监测和评级。因此,临床医生可使用标准测试来确定本发明方法的各种实施方案在治疗癌症时的功效。然而,除了肿瘤大小和扩散之外,临床医生还可以在评价治疗功效时考虑患者的生活质量和存活率。
在一些实施方案中,本公开内容提供包含一定量的erk抑制剂的药物组合物,其被配制用于向有需要的受试者施用。在一些实施方案中,药物组合物包含约0.0001-500g、0.001-250g、0.01-100g、0.1-50g或1-10g的erk抑制剂。在一些实施方案中,药物组合物包含约或大于约0.0001g、0.001g、0.01g、0.1g、0.5g、1g、2g、3g、4g、5g、6g、7g、8g、9g、10g、15g、20g、25g、50g、100g、200g、250g、300g、350g、400g、450g、500g或更多的erk抑制剂。在一些实施方案中,药物组合物在单剂量中包含0.001-2g的erk抑制剂。在一些实施方案中,治疗量可以是约0.001-0.1g的erk抑制剂的量。在一些实施方案中,治疗量可以是约0.01-30g的erk抑制剂的量。在一些实施方案中,治疗量可以是约0.45mg/kg/周至230.4mg/kg/周的erk抑制剂的量。在一些实施方案中,erk抑制剂作为每周一次的静脉输注给予。优选地,erk抑制剂作为以每周一次的静脉输注给予,该静脉输注的剂量为约0.45mg/kg/周至约1000mg/kg/周,如约10mg/kg/周至约50mg/kg/周。在一些实施方案中,erk抑制剂作为以每周一次的静脉输注给予,该静脉输注的剂量为约5mg/kg/周、约10mg/kg/周、约20mg/kg/周、约30mg/kg/周、约40mg/kg/周或约50mg/kg/周,如约20mg/kg/周。
在一些实施方案中,erk抑制剂可作为治疗方案的一部分施用,该治疗方案包括将一种或多种第二药剂(例如1种、2种、3种、4种、5种或更多种第二药剂)与erk抑制剂同时施用或者顺序施用。当顺序施用时,erk抑制剂可以在一种或多种第二药剂之前或之后施用。当同时施用时,erk抑制剂与一种或多种第二药剂可以通过相同的途径(例如,注射到同一部位;同时口服片剂)、不同的途径(例如,在接受静脉输注时口服片剂)或作为同一组合的一部分(例如,包含erk抑制剂和一种或多种第二药剂的溶液)施用。在一些实施方案中,erk抑制剂与抗egfr疗法联合施用。
本公开内容还提供联合疗法,其中已知会调节其他途径或相同途径的其他组分的药剂,或者甚至重叠组的靶酶,与本公开内容的化合物或其药学上可接受的盐、酯、前药、溶剂化物、水合物或衍生物联合使用。在一方面,这样的疗法包括但不限于一种或多种本公开内容的化合物与化疗剂、治疗性抗体和放射治疗的组合,以提供协同的或累加的治疗效果。
另一方面,本公开内容还涉及用于抑制哺乳动物的异常细胞生长的方法和药物组合物,该组合物包含一定量的本公开内容的化合物或其药学上可接受的盐、酯、前药、溶剂化物、水合物或衍生物,联合一定量的抗癌剂(例如化疗剂)。许多化疗剂是目前本领域已知的,并且可与本公开内容的化合物联合使用。在一些实施方案中,化疗剂选自:有丝分裂抑制剂、烷化剂、抗代谢物、嵌入抗生素(intercalatingantibiotics)、生长因子抑制剂、细胞周期抑制剂、酶、拓扑异构酶抑制剂、生物反应调节剂、抗激素、血管生成抑制剂和抗雄激素。
非限制性实例为化疗剂、细胞毒性剂和非肽小分子如
在某些实施方案中,本公开内容提供治疗有需要的受试者的鳞状细胞癌的方法,其包括向所述受试者施用erk抑制剂和第二治疗剂。在实践主题方法中的任一种时,第二治疗剂可选自吉西他滨、顺铂、egfr抑制剂和cdk抑制剂。在一些实施方案中,第二治疗剂选自吉西他滨、顺铂、西妥昔单抗、厄洛替尼和帕博西尼。在一些实施方案中,第二治疗剂选自吉西他滨、顺铂、西妥昔单抗。在一些实施方案中,第二治疗剂为egfr抑制剂,如西妥昔单抗或厄洛替尼。在一些实施方案中,第二治疗剂为cdk抑制剂,优选cdk4/6抑制剂,如帕博西尼。在一些实施方案中,第二治疗剂选自吉西他滨、顺铂、西妥昔单抗,其中鳞状细胞癌为肺鳞状细胞癌。在一些实施方案中,第二治疗剂为西妥昔单抗,其中鳞状细胞癌为食管鳞状细胞癌或头颈鳞状细胞癌。在一些实施方案中,第二治疗剂为厄洛替尼,其中鳞状细胞癌为肺鳞状细胞癌。
在实践主题方法中的任一种时,第二治疗剂可选自:奥希替尼、奥姆替尼、盐酸埃克替尼、阿法替尼、奈昔木单抗、拉帕替尼、培妥珠单抗、凡德他尼、bv-nsclc-001、尼妥珠单抗、帕尼单抗、厄洛替尼、吉非替尼、西妥昔单抗、布加替尼、甲磺酸naquotinib、抗egfr抗体、depatuxizumabmafodotin、tesevatinib、达可替尼、奈拉替尼、抗egfrcart细胞疗法、pf-06747775、ap-32788、azd-3759、纳扎替尼、恩替司他+厄洛替尼、甲苯磺酸艾力替尼、溴化tarloxotinib、s-222611、马来酸吡咯替尼(pyrroltinib)、poziotinib、第二代西妥昔单抗、rxdx-105、伏妥昔单抗、司瑞斑图单抗、威利替尼、盐酸埃克替尼、syn-004(synermorebiologics)、抗egfrcar-t疗法、德瓦鲁单抗+奥希替尼、ly-3164530、曲美木单抗+吉非替尼、德瓦鲁单抗+吉非替尼、gc-1118、jnj-61186372、哌罗替尼、sklb-1028、pb-357、bgb-283、sct-200、qlnc-120、tas-121、hemay-020、hemay-022、席栗替尼、nrc-2694-a、琥珀酸依吡替尼、mm-151、盐酸西莫替尼、depatuxizumab、afm-24、hti-1511、egfr/axl双抑制剂、rc-68、egfrviiicart细胞治疗剂、ubp-1215、ll-067、t细胞参与双特异性靶向cd3和egfr的probody、yh-25448、sklb-287、afm-22(affimed)、ak-568、帕尼单抗生物类似物、rjs-013、rjs-012、重组egf/crm-197疫苗、重组全人抗egfrmab、尼妥珠单抗生物类似物、egfr靶向的sirna疗法、抗egfr重组fc工程化iga2m抗体、苹果酸赛罗替尼、抗egfr靶向mab、抗egfr/抗cd3双特异性抗体、α-c-met/egfr-0286双特异性抗体药物缀合物、小分子治疗剂、hlx-07、jhl-1189、kn-023、帕尼单抗生物类似物、抗egfr单克隆抗体、fv-225、egfrt790m抑制剂(betapharma)、西妥昔单抗生物类似物、mp-0274、egfrt790m抑制剂(genentech/argenta)、sti-a020x、kl-on113、奈拉替尼、18f-阿法替尼、pmip、dbpr-112、ski-o-751、ptz-09、双特异性抗her3zybodies(zyngenia)、shr-1258、g5-7、双特异性centyrin(janssen)、ag-321、kahalalidef、e-10c、jrp-980、jrp-890、med-1007、la22-mmc、nt-004、nt-113、sym-013、抗her-2/抗ang2mab(zyngenia)、mt-062、曲妥珠单抗生物类似物、afm-21、nt-219、ang-mab(angiochem)、isu-101以及vrctc-310。在一些实施方案中,第二治疗剂选自奥希替尼、奥姆替尼、盐酸埃克替尼、阿法替尼、奈昔木单抗、拉帕替尼、培妥珠单抗、凡德他尼、bv-nsclc-001、尼妥珠单抗、帕尼单抗、厄洛替尼、吉非替尼、西妥昔单抗、布吉替尼、甲磺酸naquotinib、抗egfr抗体、depatuxizumabmafodotin、tesevatinib、达可替尼、奈拉替尼、抗egfrcart细胞疗法、pf-06747775、ap-32788、azd-3759、纳扎替尼、恩替司他+厄洛替尼、甲苯磺酸艾力替尼、溴化tarloxotinib、s-222611、马来酸pyrroltinib、poziotinib、第二代西妥昔单抗、rxdx-105、伏妥昔单抗、司瑞斑图单抗和威利替尼。在一些实施方案中,第二治疗剂选自帕博西尼、玻玛西尼、瑞博西尼、g1t-28、at-7519、阿伏西地、lx-925、g1t-38、gz-38-1、on-123300和voruciclib。在一些实施方案中,第二治疗剂选自:帕博西尼、玻玛西尼、瑞博西尼、g1t-28、at-7519和阿伏西地。在一些实施方案中,第二治疗剂选自:帕博西尼、奥希替尼、奥姆替尼、盐酸埃克替尼、阿法替尼、奈昔木单抗、拉帕替尼、培妥珠单抗、凡德他尼、bv-nsclc-001、尼妥珠单抗、帕尼单抗、厄洛替尼、吉非替尼和西妥昔单抗。
本公开内容还涉及使用本文提供的化合物或药物组合物联合放射疗法在哺乳动物中抑制异常细胞生长或治疗过度增生性病症的方法。施用放射疗法的技术是本领域已知的,并且这些技术可在本文所述的联合治疗中使用。可如本文所述确定本公开内容的化合物在该联合治疗中的施用。
放射疗法可通过若干种方法中的一种或方法的组合来施用,包括但不限于外线束治疗、内照射治疗、植入物辐射、立体定位性放射外科手术、全身放射疗法、放疗以及永久或临时间质近距离放射疗法。如本文所用的术语“近距离放射疗法”是指通过插入到体内的、在肿瘤或其他增生性组织疾病部位处或附近的、空间上限定的放射性物质实现的放射疗法。该术语意在非限制性地包括对放射性同位素(例如,at-211、i-131、i-125、y-90、re-186、re-188、sm-153、bi-212、p-32和lu的放射性同位素)的暴露。用作本公开内容的细胞调节物的合适的放射源包括固体和液体两者。举非限制性的实例来说,该放射源可以是放射性核素,如i-125、i-131、yb-169、ir-192(作为固体源),i-125(作为固体源)或发射光子、β粒子、γ射线或其他治疗射线的其他放射性核素。放射性物质也可以是由任意的放射性核素溶液(例如,i-125或i-131的溶液)制备的流体,或者放射性流体可采用含有固体放射性核素的小颗粒(如au-198,y-90)的合适的流体的浆料产生。此外,放射性核素可呈现在凝胶或放射性微球中。
不受任何理论的限制,本公开内容的化合物可使异常细胞对治疗更敏感,从而实现杀死和/或抑制这些细胞的生长的目的。因此,本公开内容还涉及使哺乳动物中的异常细胞对辐射治疗敏感的方法,该方法包括向哺乳动物施用一定量的本公开内容的化合物或其药学上可接受的盐、酯、前药、溶剂化物、水合物或衍生物,该量有效使异常细胞对辐射治疗敏感。该方法中的化合物、盐或溶剂化物的量可根据用于确定本文所述的此类化合物的有效量的方法来确定。
本公开内容的化合物或药物组合物可与一定量的一种或多种物质联合使用,该物质选自:抗血管生成剂、信号转导抑制剂、抗增殖剂、糖酵解抑制剂或自噬抑制剂。
抗血管生成剂,如mmp-2(基质-金属蛋白酶2)抑制剂、mmp-9(基质-金属蛋白酶9)抑制剂和cox-11(环加氧酶11)抑制剂,可与本公开内容的化合物和本文所述的药物组合物结合使用。抗血管生成剂包括,例如,雷帕霉素、西罗莫司(cci-779)、依维莫司(rad001)、索拉非尼、舒尼替尼和贝伐珠单抗。有用的cox-ii抑制剂的实例包括celebrextm(alecoxib)、伐地考昔和罗非昔布。以下文献中描述了有用的基质金属蛋白酶抑制剂的实例:wo96/33172(1996年10月24日公开)、wo96/27583(1996年5月7日公开)、欧洲专利申请号97304971.1(1997年7月8日提交)、欧洲专利申请号99308617.2(1999年10月29日提交)、wo98/07697(1998年2月26日公开)、wo98/03516(1998年1月29日公开)、wo98/34918(1998年8月13日公开)、wo98/34915(1998年8月13日公开)、wo98/33768(1998年8月6日公开)、wo98/30566(1998年7月16日公开)、欧洲专利公开606,046(1994年7月13日公开)、欧洲专利公开931,788(1999年7月28日公开)、wo90/05719(1990年5月31日公开)、wo99/52910(1999年10月21日公开)、wo99/52889(1999年10月21日公开)、wo99/29667(1999年6月17日公开)、pct国际申请号pct/ib98/01113(1998年7月21日提交)、欧洲专利申请号99302232.1(1999年3月25日提交)、英国专利申请号9912961.1(1999年6月3日提交)、美国临时申请号60/148,464(1999年8月12日提交)、美国专利5,863,949(1999年1月26日授权)、美国专利5,861,510(1999年1月19日授权)以及欧洲专利公开780,386(1997年6月25日公开),所有这些文献均通过引用全文并入本文。优选的mmp-2和mmp-9抑制剂是没有或具有很少的抑制mmp-1的活性的那些抑制剂。更优选的是相对于其他基质-金属蛋白酶(例如,map-1、mmp-3、mmp-4、mmp-5、mmp-6、mmp-7、mmp-8、mmp-10、mmp-11、mmp-12和mmp-13)选择性地抑制mmp-2和/或amp-9的那些抑制剂。在本公开内容中有用的mmp抑制剂的一些具体实例是ag-3340、ro32-3555和rs13-0830。
自噬抑制剂包括但不限于氯喹、3-甲基腺嘌呤、羟氯喹(plaqueniltm)、巴弗洛霉素a1、5-氨基-4-咪唑甲酰胺核苷(aicar)、冈田酸、抑制2a型或1型蛋白磷酸酶的自噬抑制性藻毒素、camp的类似物,以及提升camp水平的药物,如腺苷、ly204002、n6-巯基嘌呤核苷和长春碱。此外,还可以使用抑制蛋白质表达的反义或sirna,该蛋白质包括但不限于atg5(与自噬有关)。
本公开内容的化合物的施用可通过使得化合物能够递送至作用部位的任何方法来实现。本公开内容的化合物的有效量可以通过具有类似用途的任何可接受的药剂施用方式以单剂量或多剂量来施用,该施用方式包括:经直肠、经颊、鼻内和透皮途径、通过动脉内注射、静脉内、腹膜内、胃肠外、肌内、皮下、口服、局部、以吸入剂形式,或者经由浸渍或涂覆的装置(如支架),例如,或插入动脉的圆柱形聚合物。优选地,erk抑制剂静脉内施用或口服施用。
所施用的化合物的量将取决于所治疗的哺乳动物、病症或状况的严重程度、施用速率、化合物处理和处方医师的判断。然而,在单剂量或分开的剂量中,有效剂量范围为约0.001mg/kg/体重/天至约100mg/kg/体重/天,优选约1mg/kg/天至约35mg/kg/天。对于70kg的人,该量将达到约0.05g/天至7g/天,优选约0.05g/天至约2.5g/天。在一些情况下,低于上述范围下限的剂量水平可能完全足够,而在其他情况下,可使用更大的剂量而不会引起任何有害的副作用,例如,将这些较大剂量分成几个小剂量,以便全天施用。
在一些实施方案中,本公开内容的化合物以单剂量施用。通常,这种施用将通过注射例如静脉内注射来进行,以便快速引入药剂。但是,可以酌情使用其他途径。单剂量的本公开内容的化合物也可用于治疗急性状况。
在一些实施方案中,本公开内容的化合物以多剂量施用。给药可以是每天约1次、2次、3次、4次、5次、6次或多于6次。给药可以是约每月一次、每两周一次、每周一次或每隔一天一次。在另一个实施方案中,本公开内容的化合物和另一种药剂一起以每天约1次至每天约6次施用。在另一个实施方案中,本公开内容的化合物和药剂的施用持续少于约7天。在另外又一个实施方案中,施用持续超过约6天、10天、14天、28天、2个月、6个月或1年。在一些情况下,只要有必要,就可实现并保持连续给药。
只要有必要,就可以持续施用本公开内容的药剂。在一些实施方案中,本公开内容的药剂施用超过1天、2天、3天、4天、5天、6天、7天、14天或28天。在一些实施方案中,本公开内容的药剂施用少于28天、14天、7天、6天、5天、4天、3天、2天或1天。在一些实施方案中,本公开内容的药剂在持续进行的基础上长期给药,例如用于治疗慢性影响。
当本公开内容的化合物以包含一种或多种药剂的组合物施用,并且药剂具有比本公开内容的化合物更短的半衰期时,该药剂和本公开内容的化合物的单位剂型可以相应调整。
根据所治疗的状况,本文所述的化合物可与本文公开的其他药剂或其他合适的药剂联合使用。因此,在一些实施方案中,一种或多种本公开内容的化合物将与如上所述的其他药剂共同施用。在一些实施方案中,其他药剂为抗癌剂。当在联合治疗中使用时,本文所述的化合物可与第二药剂同时或分开施用。联合施用可包括两种药剂在同一剂型中同时施用,在分开的剂型中同时施用或分开施用。也就是说,本文所述的化合物和任何上述药剂可以在同一剂型中配制在一起并同时施用。或者,本公开内容的化合物和任何上述药剂可同时施用,其中两种药剂存在于分开的制剂中。在另一个替代方案中,可施用本公开内容的化合物,紧接着施用任何上述药剂,反之亦然。在分开施用方案中,本公开内容的化合物和任何上述药剂可隔开数分钟或隔开数小时或隔开数天施用。
所给出的以下实施例是为了阐述本公开内容的各种实施方案,并不意为以任何方式限制本公开内容。本实施例以及本文所述的方法和组合物目前为优选实施方案的代表,是示例性的,并不意为作为对本公开内容范围的限制。本领域技术人员将会想到其中的变化和包括在由权利要求的范围所限定的本公开内容范围内的其他用途。
实施例
实施例1:患者衍生的鳞状nsclc异种移植模型中的疗效研究。将来自用lu1868或lu0009原代人nsclc组织接种的原种小鼠(stockmice)的肿瘤片段(直径2-4mm)皮下接种至balb/c裸鼠中。当平均肿瘤大小达到约200mm3时,将小鼠分组。用媒介物或erk抑制剂(ko-947,如本文所述的式i化合物)以图1中所示的剂量处理动物。使用卡尺在两个维度上每周两次测量肿瘤体积,使用公式v=0.5(axb)2以mm3(平均值+/-sem)表示体积,其中a和b分别为肿瘤的长径和短径。用媒介物或erk抑制剂以相同方式处理总计11个nsclc患者衍生的异种移植(pdx)模型。nsclc模型的基因拷贝数数据如图2所示。lscc模型对erk抑制剂的反应的实例在图1中示出。在高反应性lu1868模型中,在每日一次和q2d给药方案中均观察到肿瘤消退,但在非反应性lu0009模型中,q2d或2qw方案仅观察到对肿瘤生长的较小抑制。
如图2所示,在大多数肺scc模型中,6种基因mapk途径基因组中的许多基因的一些表观拷贝数增加(对于egfr为10/11,对于kras、erk1和erk2为9/11,对于ccnd1为8/11,且对于hras为7/11)。更稳健的拷贝数增加不太常见,≥4个拷贝的kras或erk2在7/11的模型中被检测到,egfr或erk1在5/11的模型中被检测到,ccnd1在3/11的模型中被检测到,hras仅在单个模型中被检测到。尽管egfr、erk1和/或kras的拷贝数的稳健增加尤其与对erk抑制剂的反应相关,但是一些非反应性肿瘤也显示出这种模式。
基因拷贝数数据使用来自患者衍生的异种移植肿瘤样品的基因组dna通过affymetrixsnp6.0阵列产生,通过picnic或penncnv软件进行分析。通过rnaseq对样品的基因表达进行谱分析。根据制造商的方案,在trizol溶液中提取肿瘤rna。通过agilentbioanalyzer评估rna以供质量对照。使用具有rin7.0或更高的样品用于文库构建(使用illuminatruseq试剂盒),并且使用illuminahiseq系统进行转录组测序。使用mmseq软件执行基因表达分析。mmseq软件的输出格式为ln(fpkm),并被转换为线性值以供特征分析。
如果肿瘤生长抑制(tgi)超过100%,即给药完成时的肿瘤小于给药期开始时的肿瘤,则erk抑制剂反应被归类为“消退”。如果在给药期间肿瘤生长≤10%,则将反应分类为“肿瘤停滞”。许多scc患者衍生的异种移植模型保留了它们衍生自的原始肿瘤的共病特性,如诱导恶病质和自发性溃疡,其负面影响宿主动物的生理学并降低对外源药剂如治疗药物的耐受性。在这一系列实验中,观察到erk抑制剂在一些模型中耐受性较差,这可能是由于肿瘤相关因素,从而导致体重减轻。在小鼠体重减轻≥10%期间需要休药期,直到小鼠体重恢复到基线为止。在尽管超过四分之一剂量被漏服但tgi≥75%的模型中,认为药物的真实潜在活性受到显著削减,因此,这些模型被认为与一些分析的“肿瘤停滞”属于同一类别。当tgi为70-85%且没有漏服任何剂量时,活性被归类为“临界”,并且任何低于70%的tgi水平被归类为“抗性”。出于生物信息学分析以便鉴别与对erk抑制的敏感性或抗性相关的遗传和基因表达生物标志物的目的,临界组和抗性组(即,当没有剂量漏服时显示低于85%tgi的那些模型)被归类为“无活性”,或者如在本公开内容中所述的方法中所用,被归类为具有“对erk抑制剂的低敏感性”。所有其他模型被归类为“活性”,或者如在本文所述的方法中所用,被归类为“对erk抑制剂敏感”。
实施例2:患者衍生的escc异种移植模型中的疗效研究。遵循实施例1中的一般程序概述。简而言之,将接种有es0191或es0215原代人escc组织的原种小鼠的肿瘤片段(直径2-4mm)皮下接种到balb/c裸鼠中。当平均肿瘤大小达到约180mm3时,将小鼠分组。用媒介物或erk抑制剂(ko-947,如本文所述的式i化合物)以图3中所示的剂量处理动物。使用卡尺在两个维度上每周两次测量肿瘤体积,使用公式v=0.5(axb)2以mm3(平均值+/-sem)表示体积,其中a和b分别为肿瘤的长径和短径。用媒介物或erk抑制剂以相同方式处理总计9个escc患者衍生的异种移植模型。escc模型的基因拷贝数数据如图4所示。如实施例1中所述评估基因拷贝数和基因表达。escc模型对erk抑制剂的反应的实例在图3中示出。在高反应性es0191模型中,肿瘤消退是在每周计划下开始可见,其中在实验后期有一些再生,这最终导致肿瘤停滞。在非反应性es0215模型中,q2d或qw方案仅观察到对肿瘤生长的适度抑制。
如图4所示,mapk途径基因组中的拷贝数变化在escc模型中非常常见(对于egfr为8/9,对于kras或ccnd1为7/9,对于erk1、erk2或两者为6/9,且对于hras为2/9)。较少模型显示至少四个拷贝。在escc模型组中,mapk途径基因egfr、kras、hras、erk1、erk2和/或ccnd1中的一种的至少4个拷贝数与erk抑制剂处理的反应之间存在正相关。
实施例3:患者衍生的hnscc异种移植模型中的疗效研究。遵循实施例1中的一般程序概述。简而言之,将接种有hn0635或hn2221原代人hnscc组织的原种小鼠的肿瘤片段(直径2-4mm)皮下接种到balb/c裸鼠中。当平均肿瘤大小达到约150-200mm3时,将小鼠分组。用媒介物或erk抑制剂(ko-947,如本文所述的式i化合物)以图5中所示的剂量处理动物。使用卡尺在两个维度上每周两次测量肿瘤体积,使用公式v=0.5(axb)2以mm3(平均值+/-sem)表示体积,其中a和b分别为肿瘤的长径和短径。用媒介物或erk抑制剂以相同方式处理总计9个hnscc患者衍生的异种移植模型。hnscc模型的基因拷贝数数据如图6所示。如实施例1中所述评估基因拷贝数和基因表达。hnscc模型对erk抑制剂的反应的实例在图5中示出。在高反应性hn0635模型中,该erk抑制剂在以q2d或qw方案处理的6只动物中的5只中诱导肿瘤消退,而在非反应性hn2221模型中,在每周给予erk抑制剂的情况下仅达到较小的肿瘤生长抑制。
如图6所示,在分析中4/7的可评估模型对于所有六种mapk途径基因都是超二倍体,并且两个模型对于六种基因中的五种是超二倍体。尽管6/7的可评估模型具有至少4个egfr拷贝,并且4/7的模型各自具有至少4个kras或ccnd1拷贝,但高次序的拷贝数变化不太常见。
表1中总结了实施例1至3中描述的研究结果。在图7中绘制了所测试的每种鳞状细胞癌类型中egfr拷贝数与肿瘤生长抑制之间的相关性。
表1:患者衍生的scc异种移植模型中erk抑制剂活性的总结。
实施例4:患者衍生的其他肿瘤类型的异种移植模型中的疗效研究。针对代表11种不同肿瘤类型的46个不同的患者衍生的异种移植模型,遵循实施例1中的一般程序概述。如表2中所总结的,这11种肿瘤类型大多表现对erk抑制剂处理的低敏感性。令人吃惊的是,在这些实施例中测试的12种肿瘤类型中,只有鳞状细胞癌对erk抑制剂处理表现出稳健的反应性。
表2:各种肿瘤类型中erk抑制剂活性的总结。
实施例5:患者衍生的hnscc异种移植模型中的疗效研究。遵循实施例1中的一般程序概述。简而言之,将接种有hn1391原代人hnscc组织的原种小鼠的肿瘤片段(直径2-4mm)皮下接种到balb/c裸鼠中。当平均肿瘤大小达到约150mm3时,将小鼠分组。用媒介物或erk抑制剂(ko-947,如本文所述的式i化合物)以图8中所示的剂量处理动物达25天。中断给药以观察肿瘤再生长,然后在第56天以相同的给药方案重新开始。使用卡尺在两个维度上每周两次测量肿瘤体积,使用公式v=0.5(axb)2以mm3(平均值+/-sem)表示体积,其中a和b分别为肿瘤的长径和短径。如图8所示,当处理起始时,在hn1391模型中erk抑制剂诱导消退和肿瘤停滞。在120mg/kgq2d或300mg/kgqw的处理下,该活性维持25天。当给药中断时,肿瘤停滞维持10-20天,但最终所有肿瘤均再生长。使再生长进行2-3周,直到一些个别肿瘤超过1600mm3,然后重新开始处理。令人吃惊的是,所有再次处理的肿瘤均消退,在随后35天内大小缩小27-66%。在几种情况下,erk抑制剂处理实际上是治愈性的。
实施例6:患者衍生的hnscc异种移植模型中的疗效研究。遵循实施例1中的一般程序概述。简而言之,将接种有hn3067原代人hnscc组织的原种小鼠的肿瘤片段(直径2-4mm)皮下接种到balb/c裸鼠中。当平均肿瘤大小达到约180mm3时,将小鼠分组。用媒介物或erk抑制剂(ko-947,如本文所述的式i化合物)以图9中所示的剂量处理动物达40天。中断给药以观察肿瘤再生长。使用卡尺在两个维度上每周两次测量肿瘤体积,使用公式v=0.5(axb)2以mm3(平均值+/-sem)表示体积,其中a和b分别为肿瘤的长径和短径。如图9所示,携带hn3067患者衍生的异种移植肿瘤的所有6只动物在经120mg/kgq2d或300mg/kgqw处理后均显示出稳健的肿瘤消退。当中断给药以观察肿瘤再生长率时,6只动物中的4只(包括根据qw方案处理的所有3只)甚至在60天后都没有展现出剩余存活肿瘤的证据,这表明这些动物已经永久性地治愈了它们的疾病。
实施例7:拷贝数和基因表达特征的分析。实施例1至3中描述的拷贝数分析的结果表明,mapk途径的某些成员中频繁但高度可变的拷贝数变化出现在肺、食管和头颈的鳞状细胞癌中,至少如本文测试的患者衍生的模型所表示的那样,但是所测试的模型的特定单个基因的明显扩增与对erk抑制剂的反应之间的明显关联难以辨别,但escc除外。为此,集中于关键mapk途径基因和ras-erk反馈调节子的表达水平(即它们的mrna丰度,由rnaseq估计)的第二种分析方法被用于产生基因表达特征,该方法将来自多个感兴趣的基因的信息整合到单个值中,由此使对erk抑制的敏感性和以下任何一项的总读数进行比较:(i)通常扩增的路径组分的超表达(即总表达水平高于参考水平),和/或(ii)路径组分的信号传导输出,如路径中基因的mrna丰度所示。
在实施例1至3中测试的29个肺、食道和头颈鳞状细胞癌模型组中评估了几种基因特征。分析结果在图10-15中以热图显示,其显示对erk抑制剂处理的反应与构成特征的基因的总mrna丰度之间的关系。在每个图中从高到低(从左到右)绘制总表达水平(即总mrna丰度)。用于区分“高表达”与“低表达”的截止值(由热图中的粗黑线表示)是29个模型的平均表达水平。在本文描述的方法中将该截止值称为参考水平。如各图提供的转换关键词所示,治疗结果分为四类(消退、停滞、临界和无活性)。
如图10所示,针对两种mapk途径基因特征,来自基因表达特征(热图的左侧)的高信号与对erk抑制剂处理的阳性反应(例如,条形图中的消退或停滞)之间存在明显关联。图10的6基因特征包括egfr、erk1、erk2、kras、hras和ccnd1,并且4基因特征包括egfr、erk1、kras和ccnd1。阳性预测能力良好,14个具有高读数的模型中只有3或4个未能具有停滞或肿瘤消退反应。阴性预测能力稳健性稍差,15个低读数中有6或7个表现出良好的处理反应。有趣的是,该特征可以减少至三个关键基因(egfr、erk1和kras或者egfr、erk1和ccnd1)而不会丧失预测能力(图11)。即使双基因特征(egfr和erk1、erk1和ccnd1或者egfr和ccnd1)也分别正确预测了9/14、10/14和11/14的高表达者中的敏感性,以及分别在7/15、8/15和8/15的低表达者中的抗性(图12)。相比之下,所测试的所有标志物的单基因特征,或包括其他ras-erk途径组分的特征如包括nras、araf、braf、craf、mek1和mek2的6基因特征,在很大程度上是不提供信息的(图13)。
如图14所示,包括mapk途径基因和ras-erk反馈调节子(ccnd1、craf、dusp5、egfr、erk1和kras)两者的不同6基因特征正确地预测了具有高读数的11/14的模型中的敏感性,以及具有低读数的9/15的模型中的抗性。包括mapk途径基因(egfr、erk1、erk2、kras、hras、ccnd1、cdk4和cdk6)的8基因特征提供了类似的预测能力。
针对与对erk抑制剂的敏感性或抗性的关联,对包括erk磷酸酶(dusp2、dusp4、dusp5和dusp6)和ras抑制剂(spry2、spry4和spred1)在内的ras-erk反馈调节子的5、4和2基因特征的预测能力进行评估。如图15所示,在29个scc模型系列中包括dusp5、dusp6、spry2、spry4和spred1的5基因特征具有良好的预测值,其中具有高读数的11/14的模型被正确预测为敏感,而具有低读数的9/15的模型被正确预测为对erk抑制剂处理有抗性。由于ras在scc中很少发生突变,因此认为单独erk反馈调节子可能预测对erk抑制的敏感性,因此dusp特异性4基因特征(dusp2、dusp4、dusp5和dusp6)接受评估并发现其与5基因特征具有同等的预测性。值得注意的是,5基因和4基因特征的完全预测能力在仅包括dusp5和dusp6的2基因特征中得以保留,强调了这些生物标志物的值用于鉴别其肿瘤可能对erk抑制剂(如ko-947)处理有反应的scc患者。表3中提供了包括ko-947在内的的示例性erk抑制剂。
实施例8:头颈鳞状细胞癌中的基因表达特征分析。在实施例3中测试的9个头颈鳞状细胞癌模型的组中评估了几种基因特征。分析结果在图16中以热图显示,其显示对erk抑制剂处理的反应和构成特征的基因的总mrna丰度之间的关系。在每个图中从高到低(从上到下)绘制总表达水平(即总mrna丰度)。针对高读数模型,包括areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的12基因转录特征正确地预测了对erk抑制剂的良好反应。包括位于在hnscc中通常被扩增的染色体3的区域(ch3a)中的基因(即dcun1d1、pik3ca、prkc1、sox2和tp63)的5基因特征预测对erk抑制的较差反应,如图16所示。12基因特征和5基因特征的比率正确预测对erk抑制的良好反应。值得注意的是,hif1a与tp63表达的比率有力地预测了对erk抑制的良好反应。
实施例9:erk的抑制测定。根据制造商的说明,使用z’-lyte激酶测定试剂盒(lifetechnologies)连同ser/thr3肽底物(lifetechnologies)来确定本文公开的化合物对erk活性的抑制。使用浓度为0.47ng/l的erk2酶(lifetechnologies)在100μmatp(约为erk2的atpkm)下进行测定。用3倍连续稀释一式两份确定化合物的ic50值。首先将化合物以1:3稀释度在100%dmso中以100x所需浓度进行稀释,然后在20mmhepes缓冲液(invitrogen)中进一步稀释(1:25)以制备4x溶液,之后添加至酶溶液中。测定中的最终dmso浓度为1%。最终反应体积为在384孔板中20ml/孔。激酶反应进行1小时,然后以384孔板形式(20μl/孔)进行测定显色反应(1小时)。当在该测定中进行测试时,一种或多种本文公开的化合物表现出小于10nm的ic50。表3中示出了所选化合物的结果。
表3:所选化合物的体外erk2ic50数据(+++代表50nm至250nm,++++代表小于50nm)。
实施例10:肿瘤细胞系增殖测定。根据本领域已知的标准程序测定一种或多种本公开内容化合物抑制肿瘤细胞系增殖的能力。例如,进行体外细胞增殖测定以测量活细胞的代谢活性。使a375细胞(atcc)生长至接近80%铺满,使其胰蛋白酶化,并以每孔100μl的体积以1500个细胞/孔接种在96孔板中的完全生长培养基(10%fbs的dmem溶液或者10%fbs的rpmi溶液)中。将细胞在37℃5%co2下温育2小时,以使其附着于板上。首先将化合物以1:3稀释度在100%dmso中以250x所需浓度进行稀释,然后在10%dmem生长培养基中进一步稀释(1:50)。将稀释的化合物添加至细胞板(对于5x稀释为25μl),并将细胞与化合物(在0.4%dmso的10%fbsdmem溶液)一起在37℃5%co2下温育96小时。向细胞对照孔中仅添加媒介物(0.4%dmso的10%fbsdmem溶液或10%fbsrpmi溶液)。每种浓度的化合物一式两份进行测试。在化合物处理96小时后,将celltiterglo试剂(promega)以1:5稀释度添加至细胞板的每个孔中,并将该细胞板在室温下放置30分钟。使用tecan读板仪来测定孔的发光。当在本测定中测试时,表3中列出的每种化合物在a375细胞(atcc)中展现出250nm或更低的ic50。
实施例11:临床b-raf和mek抑制剂抗性模型的疗效研究。从atcc或dsmz获得人黑素瘤细胞系(例如,a375、mm383brafv600e和mm127nrasq61r)。使a375细胞被工程化以超表达lacz、brafv600e(brafv600eamp)或nras突变体nrasq61r。使细胞系生长至铺满,用肿瘤细胞培养基(dmem+10%fbs或imdm+20%fbs)洗涤,并以5,000-10,000个细胞/孔铺在90μl肿瘤细胞培养基中。向每个孔添加维罗非尼、曲美替尼(选自表3的erk抑制剂),或添加媒介物。将板在37℃和5%co2下温育72小时。向每个孔添加体积为100μl的
表4:临床b-raf和mek抑制剂抗性模型中erk抑制剂活性的总结。
实施例12:患者衍生的escc异种移植模型的功效研究。遵循实施例1中的一般程序概述。简而言之,将接种有原代人escc组织的原种小鼠的肿瘤片段(直径2-4mm)皮下接种到balb/c裸鼠中。当平均肿瘤大小达到约180mm3时,将小鼠分组。用媒介物或300-350mg/kgqw口服的erk抑制剂(ko-947,如本文所述的式i化合物)处理动物。使用卡尺在两个维度上每周两次测量肿瘤体积,使用公式v=0.5(axb)2以mm3(平均值+/-sem)表示体积,其中a和b分别为肿瘤的长径和短径。
如图18所示,以相同的方式用媒介物或erk抑制剂处理总计11个escc患者衍生的异种移植模型。在图18中,具有ccnd1拷贝数≥5或≤4的escc模型分别被分类为“b+”或“b-”。图19中显示了escc模型的ccnd1拷贝数和mrna水平,并且图21中显示了相同escc模型的位于染色体11q13.3-13.4处的基因的拷贝数。在图22中以图形方式显示了这些基因中的六种的表达水平。如实施例1中所述评估基因拷贝数和基因表达。如图24所示,在ano1mrna表达、ccnd1mrna表达、ano1扩增、ccnd1扩增与对erk抑制剂处理的反应之间存在正相关性。图29-图31图示了所有测试的escc模型的肿瘤生长百分比。当不使用生物标志物来预测敏感性时,观察到60%的疾病控制率(图29)。对于11q13扩增模型,疾病控制率增加至83%,相比之下,11q13野生型模型仅为21%(图30)。ano1+的11q13扩增模型的疾病控制率进一步增加至93%(图31)。
实施例13:患者衍生的lscc异种移植模型中的疗效研究。遵循实施例1中的一般程序概述。简而言之,将接种有原代人肺scc组织的原种小鼠的肿瘤片段(直径2-4mm)皮下接种到balb/c裸鼠中。当平均肿瘤大小达到约200mm3时,将小鼠分组。用媒介物或300-350mg/kgqw口服的erk抑制剂(ko-947,如本文所述的式i化合物)处理动物。使用卡尺在两个维度上每周两次测量肿瘤体积,使用公式v=0.5(axb)2以mm3(平均值+/-sem)表示体积,其中a和b分别为肿瘤的长径和短径。用媒介物或erk抑制剂以相同方式处理总计23个lscc患者衍生的异种移植模型。对erk抑制剂处理的反应在图25中显示为肿瘤生长抑制百分比。如果肿瘤生长抑制大于或等于75%,则可以将模型分类为对erk抑制剂处理有反应。如果经处理的三只动物中的至少一只达到肿瘤停滞或消退,则图25中以粗体文本显示的模型替代地被分类为对处理有反应。
实施例14:患者衍生的hnscc异种移植模型中的疗效研究。遵循实施例1中的一般程序概述。简而言之,将接种有原代人hnscc组织的原种小鼠的肿瘤片段(直径2-4mm)皮下接种到balb/c裸鼠中。当平均肿瘤大小达到约180mm3时,将小鼠分组。用媒介物或300-350mg/kgqw口服的erk抑制剂(ko-947,如本文所述的式i化合物)处理动物。使用卡尺在两个维度上每周两次测量肿瘤体积,使用公式v=0.5(axb)2以mm3(平均值+/-sem)表示体积,其中a和b分别为肿瘤的长径和短径。用媒介物或erk抑制剂以相同方式处理总计17个hncc患者衍生的异种移植模型。对erk抑制剂处理的反应在图26中显示为抑制肿瘤生长百分比。展现出ccnd1扩增的六个模型中有四个对erk抑制剂的处理有反应。
实施例15:患者衍生的胰腺癌异种移植模型中的疗效研究。遵循实施例1中的一般程序概述。简而言之,将接种有原代人胰腺癌组织的原种小鼠的肿瘤片段(直径2-4mm)皮下接种到balb/c裸鼠中。当平均肿瘤大小达到约180mm3时,将小鼠分组。用媒介物或300-350mg/kgqw口服的erk抑制剂(ko-947,如本文所述的式i化合物)处理动物。使用卡尺在两个维度上每周两次测量肿瘤体积,使用公式v=0.5(axb)2以mm3(平均值+/-sem)表示体积,其中a和b分别为肿瘤的长径和短径。如图27所示,用媒介物或erk抑制剂以相同方式处理总计4个患者衍生的异种移植模型。
实施例16:患者衍生的膀胱癌或胃癌异种移植模型中的疗效研究。遵循实施例1中的一般程序概述。简而言之,将接种有原代人膀胱癌或胃癌组织的原种小鼠的肿瘤片段(直径2-4mm)皮下接种到balb/c裸鼠中。当平均肿瘤大小达到约180mm3时,将小鼠分组。用媒介物、120mg/kgeod的erk抑制剂或300mg/kgqw的erk抑制剂(ko-947,如本文所述的式i化合物)处理动物。使用卡尺在两个维度上每周两次测量肿瘤体积,使用公式v=0.5(axb)2以mm3(平均值+/-sem)表示体积,其中a和b分别为肿瘤的长径和短径。如图28所示,用载体或erk抑制剂以相同方式处理膀胱癌和胃癌患者衍生的异种移植模型。
虽然本文已经示出和描述了本公开内容的优选实施方案,但对于本领域技术人员显而易见的是,这些实施方案仅通过示例的方式提供。在不脱离本公开内容的情况下,本领域技术人员现将想到众多变化、改变和替换。应当理解,在实施本发明的过程中可以采用本文所述的本公开内容实施方案的各种替代方案。以下权利要求旨在限定本发明的范围,并因此涵盖这些权利要求范围内的方法和结构及其等同物。
本公开内容进一步的实施方案
1.一种治疗有需要的受试者中的鳞状细胞癌的方法,包括向所述受试者施用有效剂量的细胞外信号调节激酶(erk)抑制剂,所述受试者包含展现出以下的基因组:(1)至少两种促分裂原活化蛋白激酶(mapk)途径基因的高于第一参考水平的第一总表达水平,(2)至少两种ras-erk反馈调节子的高于第二参考水平的第二总表达水平,和/或(3)至少一种mapk途径基因和至少一种ras-erk反馈调节子的高于第三参考水平的第三总表达水平,其中所述第一参考水平、所述第二参考水平和所述第三参考水平各自指示对所述erk抑制剂的低敏感性。
2.一种治疗患有鳞状细胞癌的受试者的方法,包括:
(a)针对是否存在指示对erk抑制剂的敏感性的基因特征来筛选所述受试者;以及
(b)如果确定所述基因特征存在,则向所述受试者施用所述erk抑制剂。
3.根据实施方案2所述的方法,进一步包括如果确定所述基因特征不存在,则向所述受试者施加替代疗法。
4.根据实施方案3所述的方法,其中所述替代疗法选自化疗、免疫疗法、放疗和外科手术。
5.根据实施方案2至4中任一项所述的方法,其中所述基因特征包括至少两种mapk途径基因的高于第一参考水平的第一总表达水平。
6.根据实施方案2至5中任一项所述的方法,其中所述基因特征包括至少两种ras-erk反馈调节子的高于第二参考水平的第二总表达水平。
7.根据实施方案2至6中任一项所述的方法,其中所述基因特征包括至少一种mapk途径基因和至少一种ras-erk反馈调节子的高于第三参考水平的第三总表达水平。
8.根据实施方案2至7中任一项所述的方法,其中所述基因特征包括至少一种mapk途径基因的拷贝数扩增。
9.根据实施方案2至8中任一项所述的方法,其中所述筛选包括对从所述受试者分离的核酸进行核酸分析。
10.根据实施方案9所述的方法,其中所述核酸来自鳞状细胞癌细胞。
11.一种用erk抑制剂下调多个鳞状细胞癌细胞中的mapk信号传导输出的方法,包括:
(a)在包含来自所述受试者的核酸的生物样品中评估:(1)至少两种mapk途径基因的第一总表达水平,(2)至少两种ras-erk反馈调节子的第二总表达水平,和/或(3)至少一种mapk途径基因和至少一种ras-erk反馈调节子的第三总表达水平;以及
(b)如果所述第一总表达水平高于第一参考水平、所述第二总表达水平高于第二参考水平和/或所述第三总表达水平高于第三参考水平,则向所述多个细胞施用有效剂量的所述erk抑制剂,其中所述第一参考水平、所述第二参考水平和所述第三参考水平各自指示对所述erk抑制剂的低敏感性。
12.一种对受试者的鳞状细胞癌状态进行分类的方法,包括:
(a)获得来自所述受试者的生物样品,所述样品包含来自所述受试者的鳞状细胞癌细胞的基因组和/或转录组物质;
(b)评估:(1)所述样品中的至少两种mapk途径基因的第一总表达水平,(2)所述样品中的至少两种ras-erk反馈调节子的第二总表达水平,和/或(3)所述样品中的至少一种mapk途径基因和至少一种ras-erk反馈调节子的第三总表达水平;
(c)基于以下生成表达谱:(1)所述第一总表达水平与第一参考水平之间的比较,(2)所述第二总表达水平与第二参考水平之间的比较,和/或(3)所述第三总表达水平与第三参考水平之间的比较,其中所述第一参考水平、所述第二参考水平和所述第三参考水平从来自具有已知鳞状细胞癌状态的不同受试者的参考样品获得;以及
(d)基于所述表达谱对(a)的所述受试者的鳞状细胞癌状态进行分类。
13.根据实施方案12所述的方法,其中如果所述第一总表达水平高于所述第一参考水平,则所述鳞状细胞癌状态被分类为可能对erk抑制剂治疗敏感,其中所述第一参考水平指示对所述erk抑制剂的低敏感性。
14.根据实施方案12或13所述的方法,其中如果所述第二总表达水平高于第二参考水平,则所述鳞状细胞癌状态被分类为可能对erk抑制剂治疗敏感,其中所述第二参考水平指示对所述erk抑制剂的低敏感性。
15.根据实施方案12或14中任一项所述的方法,其中如果所述第三总表达水平高于第三参考水平,则所述鳞状细胞癌状态被分类为可能对erk抑制剂治疗敏感,其中所述第三参考水平指示对所述erk抑制剂的低敏感性。
16.根据实施方案12至15中任一项所述的方法,其中所述不同的受试者的已知鳞状细胞癌状态被分类为对erk抑制剂抗性或者对erk抑制剂敏感。
17.根据实施方案12所述的方法,其中所述分类步骤包括基于所述表达谱使用计算机系统计算所述受试者对erk抑制剂治疗有反应的可能性,其中针对所述第一总表达水平相对于所述第一参考水平的每个倍增、所述第二总表达水平相对于所述第二参考水平的每个倍增和所述第三总表达水平相对于所述第三参考水平的每个倍增,上调所述可能性,其中所述第一参考水平、所述第二参考水平和所述第三参考水平各自指示对所述erk抑制剂的低敏感性。
18.根据实施方案17所述的方法,进一步包括制作包括所述受试者对所述erk抑制剂治疗有反应的可能性的预测的报告。
19.一种评估患有鳞状细胞癌的受试者对erk抑制剂治疗展现出临床有益反应的可能性的方法,所述方法包括:
(a)在包含来自鳞状细胞癌细胞的基因组和/或转录组物质的生物样品中评估:(1)至少两种mapk途径基因的第一总表达水平,(2)至少两种ras-erk反馈调节子的第二总表达水平,和/或(3)至少一种mapk途径基因和至少一种ras-erk反馈调节子的第三总表达水平;以及
(b)基于以下使用计算机系统计算erk抑制剂反应性的加权概率:(1)所述第一总表达水平与第一参考水平之间的比较,(2)所述第二总表达水平与第二参考水平之间的比较,和/或(3)所述第三总表达水平与第三参考水平之间的比较,其中所述第一参考水平、所述第二参考水平和所述第三参考水平从一个或多个参考样品获得。
20.根据实施方案19所述的方法,进一步包括如果所述加权概率对应于基线概率的至少1.5倍,则将所述受试者指定为有较高概率对所述erk抑制剂治疗展现出临床有益反应,其中所述基线概率代表在获得(b)的所述加权概率之前,所述受试者将对所述erk抑制剂治疗展现出临床有益反应的可能性。
21.根据实施方案20所述的方法,进一步包括向接受者传递关于所述可能性的信息。
22.根据实施方案19至21中任一项所述的方法,进一步包括基于所述加权概率提供建议。
23.根据实施方案22所述的方法,其中所述建议包括用所述erk抑制剂治疗所述受试者。
24.根据实施方案22所述的方法,其中所述建议包括中断治疗、化疗、免疫疗法、放疗或外科手术。
25.根据实施方案19至24中任一项所述的方法,进一步包括基于所述加权概率选择治疗。
26.根据实施方案19至25中任一项所述的方法,进一步包括基于所述加权概率施用所述erk抑制剂。
27.根据实施方案1至26中任一项所述的方法,其中所述第一总表达水平、所述第二总表达水平和/或所述第三总表达水平通过检测由以下转录的mrna的水平来评估:所述至少两种mapk途径基因;所述至少两种ras-erk反馈调节子;和/或所述至少一种mapk途径基因和所述至少一种ras-erk反馈调节子。
28.根据实施方案1至26中任一项所述的方法,其中所述第一总表达水平、所述第二总表达水平和/或所述第三总表达水平通过检测由以下转录的mrna的逆转录所产生的cdna的水平来评估:所述至少两种mapk途径基因;所述至少两种ras-erk反馈调节子;和/或所述至少一种mapk途径基因和所述至少一种ras-erk反馈调节子。
29.根据实施方案1至26中任一项所述的方法,其中所述第一总表达水平、所述第二总表达水平和/或所述第三总表达水平通过检测由以下编码的多肽的水平来评估:所述至少两种mapk途径基因;所述至少两种ras-erk反馈调节子;和/或所述至少一种mapk途径基因和所述至少一种ras-erk反馈调节子。
30.根据实施方案29所述的方法,其中所述多肽水平的检测包括至少一种选自以下的技术:免疫组织化学(ihc)、质谱分析、western印迹法、酶联免疫吸附测定(elisa)、免疫细胞化学、免疫荧光和流式细胞术。
31.根据实施方案1至26中任一项所述的方法,其中所述第一总表达水平、所述第二总表达水平和/或所述第三总表达水平通过核酸扩增测定、杂交测定、测序或其组合来评估。
32.根据实施方案31所述的方法,其中所述核酸扩增测定、所述杂交测定或所述测序使用来自所述受试者的核酸样品来进行。
33.根据实施方案32所述的方法,其中所述核酸样品包括选自基因组dna、cdna、ctdna、无细胞dna、rna和mrna的核酸。
34.根据实施方案32或33所述的方法,其中所述核酸来自鳞状细胞癌细胞。
35.根据实施方案1至26中任一项所述的方法,其中所述第一总表达水平、所述第二总表达水平和/或所述第三总表达水平使用
36.根据前述实施方案中任一项所述的方法,其中所述第一参考水平、所述第二参考水平和/或所述第三参考水平通过在来自患有鳞状细胞癌的对所述erk抑制剂治疗展现出低敏感性的受试者的生物样品中评估以下的表达来获得:所述至少两种mapk途径基因;所述至少两种ras-erk反馈调节子;和/或所述至少一种mapk途径基因和所述至少一种ras-erk反馈调节子。
37.根据前述实施方案中任一项所述的方法,其中所述第一参考水平代表在多个鳞状细胞癌样品中所述至少两种mapk途径基因的平均总表达水平。
38.根据前述实施方案中任一项所述的方法,其中第二参考水平代表在多个鳞状细胞癌样品中所述至少两种ras-erk反馈调节子的平均总表达水平。
39.根据前述实施方案中任一项所述的方法,其中所述第三参考水平代表在多个鳞状细胞癌样品中所述至少一种mapk途径基因和所述至少一种ras-erk反馈调节子的平均总表达水平。
40.根据前述实施方案中任一项所述的方法,其中所述至少两种mapk途径基因由四种mapk途径基因组成。
41.根据前述实施方案中任一项所述的方法,其中所述至少两种mapk途径基因由六种mapk途径基因组成。
42.根据前述实施方案中任一项所述的方法,其中所述至少两种mapk途径基因由八种mapk途径基因组成。
43.根据前述实施方案中任一项所述的方法,其中所述至少两种mapk途径基因选自cdk4、cdk6、egfr、erk1、ccnd1、kras、erk2和hras。
44.根据前述实施方案中任一项所述的方法,其中所述至少两种mapk途径基因选自egfr、erk1、ccnd1、kras、erk2和hras。
45.根据前述实施方案中任一项所述的方法,其中所述至少两种mapk途径基因选自egfr、erk1、ccnd1和kras。
46.根据前述实施方案中任一项所述的方法,其中所述至少两种mapk途径基因选自egfr、erk1和ccnd1。
47.根据前述实施方案中任一项所述的方法,其中所述至少两种mapk途径基因选自egfr、erk1和kras。
48.根据前述实施方案中任一项所述的方法,其中所述至少两种mapk途径基因选自erk1和ccnd1。
49.根据前述实施方案中任一项所述的方法,其中所述至少两种mapk途径基因选自erk1和egfr。
50.根据前述实施方案中任一项所述的方法,其中所述至少两种mapk途径基因选自egfr和ccnd1。
51.根据前述实施方案中任一项所述的方法,其中所述至少两种ras-erk反馈调节子由四种ras-erk反馈调节子组成。
52.根据前述实施方案中任一项所述的方法,其中所述至少两种ras-erk反馈调节子由五种ras-erk反馈调节子组成。
53.根据前述实施方案中任一项所述的方法,其中所述至少两种ras-erk反馈调节子选自dusp5、dusp6、spry2、spry4和spred1。
54.根据前述实施方案中任一项所述的方法,其中所述至少两种ras-erk反馈调节子选自dusp5、dusp6、dusp2和dusp4。
55.根据前述实施方案中任一项所述的方法,其中所述至少两种ras-erk反馈调节子选自dusp5和dusp6。
56.根据前述实施方案中任一项所述的方法,其中所述至少一种mapk途径基因和所述至少一种ras-erk反馈调节子选自egfr、erk1、ccnd1、kras、erk2、hras、dusp5、dusp6、dusp2、dusp4、spry2、spry4、spred1和craf。
57.根据前述实施方案中任一项所述的方法,其中所述至少一种mapk途径基因和所述至少一种ras-erk反馈调节子选自ccnd1、craf、dusp5、egfr、erk1和kras。
58.一种治疗有需要的受试者中的头颈鳞状细胞癌的方法,包括向所述受试者施用有效剂量的细胞外信号调节激酶(erk)抑制剂,所述受试者包含展现出以下的基因组:(1)areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的高于第四参考水平的第四总表达水平;(2)dcun1d1、pik3ca、prkci、sox2和tp63的低于第五参考水平的第五总表达水平;(3)大于1的所述第四总表达水平与所述第五总表达水平的比率;和/或(4)大于1的hif1a与tp63表达水平的比率,其中所述第四参考水平和所述第五参考水平各自指示对所述erk抑制剂的低敏感性。
59.一种治疗患有头颈鳞状细胞癌的受试者的方法,包括:
(a)针对是否存在指示对erk抑制剂的敏感性的基因特征来筛选所述受试者;以及
(b)如果确定所述基因特征存在,则向所述受试者施用所述erk抑制剂。
60.根据实施方案59所述的方法,进一步包括如果确定所述基因特征不存在,则向所述受试者施加替代疗法。
61.根据实施方案60所述的方法,其中所述替代疗法选自化疗、免疫疗法、放疗和外科手术。
62.根据实施方案59至61中任一项所述的方法,其中所述基因特征包括areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的高于第四参考水平的第四总表达水平。
63.根据实施方案59至62中任一项所述的方法,其中所述基因特征包括dcun1d1、pik3ca、prkci、sox2和tp63的低于第五参考水平的第五总表达水平。
64.根据实施方案59至63中任一项所述的方法,其中所述基因特征包括areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的第四总表达水平与dcun1d1、pik3ca、prkci、sox2和tp63的第五总表达水平的比率。
65.根据实施方案59至64中任一项所述的方法,其中所述基因特征包括hif1a与tp63表达水平的比率。
66.根据实施方案59至64中任一项所述的方法,其中所述基因特征包括hif1a与tp63蛋白质水平的比率。
67.根据实施方案59至65中任一项所述的方法,其中所述筛选包括对从所述受试者分离的核酸进行核酸分析。
68.根据实施方案67所述的方法,其中所述核酸来自头颈鳞状细胞癌细胞。
69.一种用erk抑制剂下调多个头颈鳞状细胞癌细胞中的mapk信号传导输出的方法,包括:
(a)在包含来自所述受试者的核酸的生物样品中评估:(1)areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的第四总表达水平;(2)dcun1d1、pik3ca、prkci、sox2和tp63的第五总表达水平;(3)所述第四总表达水平与所述第五总表达水平的比率;和/或(4)hif1a与tp63表达水平的比率;以及
(b)如果(1)所述第四总表达水平高于第四参考水平,(2)所述第五总表达水平低于第五参考水平,(3)所述第四总表达水平与所述第五总表达水平的比率大于1,和/或(4)hif1a与tp63的比率大于1,则向所述多个细胞施用有效剂量的所述erk抑制剂,其中所述第四参考水平和所述第五参考水平各自指示对所述erk抑制剂的低敏感性。
70.一种对受试者的头颈鳞状细胞癌状态进行分类的方法,包括:
(a)获得来自所述受试者的生物样品,所述样品包含来自所述受试者的鳞状细胞癌细胞的基因组和/或转录组物质;
(b)在所述样品中评估:(1)areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的第四总表达水平;(2)dcun1d1、pik3ca、prkci、sox2和tp63的第五总表达水平;和/或(3)hif1a和tp63的表达水平;
(c)基于以下生成表达谱:(1)所述第四总表达水平与第四参考水平之间的比较,(2)所述第五总表达水平与第五参考水平之间的比较,(3)所述第四总表达水平与所述第五总表达水平之间的比较,和/或(4)hif1a与tp63的表达水平之间的比较,其中所述第四参考水平和所述第五参考水平从来自具有已知鳞状细胞癌状态的不同受试者的参考样品获得;以及
(d)基于所述表达谱对(a)的所述受试者的鳞状细胞癌状态进行分类。
71.根据实施方案70所述的方法,其中如果所述第四总表达水平高于所述第四参考水平,则所述鳞状细胞癌状态被分类为可能对erk抑制剂治疗敏感,其中所述第四参考水平指示对所述erk抑制剂的低敏感性。
72.根据实施方案70或71所述的方法,其中如果所述第五总表达水平低于第五参考水平,则所述鳞状细胞癌状态被分类为可能对erk抑制剂治疗敏感,其中所述第五参考水平指示对所述erk抑制剂的低敏感性。
73.根据实施方案70至72中任一项所述的方法,其中如果所述第四总表达水平与所述第五总表达水平的比率大于1,则所述鳞状细胞癌状态被分类为可能对erk抑制剂治疗敏感。
74.根据实施方案70至73中任一项所述的方法,其中如果hif1a与tp63表达水平的比率大于1,则所述鳞状细胞癌状态被分类为可能对erk抑制剂治疗敏感。
75.根据实施方案70所述的方法,其中所述分类步骤包括基于所述表达谱使用计算机系统计算所述受试者对erk抑制剂治疗有反应的可能性,其中针对所述第四总表达水平相对于所述第四参考水平的每个倍增上调所述可能性,并针对所述第五总表达水平相对于所述第五参考水平的每个倍增下调所述可能性,其中所述第四参考水平和所述第五参考水平各自指示对所述erk抑制剂的低敏感性。
76.根据实施方案75所述的方法,进一步包括制作包括所述受试者对所述erk抑制剂治疗有反应的可能性的预测的报告。
77.一种评估患有头颈鳞状细胞癌的受试者对erk抑制剂治疗展现出临床有益反应的可能性的方法,所述方法包括:
(a)在包含来自鳞状细胞癌细胞的基因组和/或转录组物质的生物样品中评估:(1)areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的第四总表达水平;(2)dcun1d1、pik3ca、prkci、sox2和tp63的第五总表达水平;和/或(3)hif1a和tp63的表达水平;以及
(b)基于以下使用计算机系统计算erk抑制剂反应性的加权概率:(1)所述第四总表达水平与第四参考水平之间的比较,(2)所述第五总表达水平与第五参考水平之间的比较,(3)所述第四总表达水平与所述第五总表达水平之间的比较,和/或(4)hif1a与tp63的表达水平之间的比较,其中所述第四参考水平和所述第五参考水平从一个或多个参考样品获得。
78.根据实施方案77所述的方法,进一步包括如果所述加权概率对应于基线概率的至少1.5倍,则将所述受试者指定为有较高概率对所述erk抑制剂治疗展现出临床有益反应,其中所述基线概率代表在获得(b)的所述加权概率之前所述受试者将对所述erk抑制剂治疗展现出临床有益反应的可能性。
79.根据实施方案78所述的方法,进一步包括向接受者传递关于所述可能性的信息。
80.根据实施方案77至79中任一项所述的方法,进一步包括基于所述加权概率提供建议。
81.根据实施方案80所述的方法,其中所述建议包括用所述erk抑制剂治疗所述受试者。
82.根据实施方案77至81中任一项所述的方法,进一步包括基于所述加权概率选择治疗。
83.根据实施方案77至82中任一项所述的方法,进一步包括基于所述加权概率施用所述erk抑制剂。
84.根据实施方案58至83中任一项所述的方法,其中所述表达水平通过检测mrna的水平来评估。
85.根据实施方案58至83中任一项所述的方法,其中所述表达水平通过检测由mrna逆转录产生的cdna的水平来评估。
86.根据实施方案58至83中任一项所述的方法,其中所述表达水平通过检测多肽的水平来评估。
87.根据实施方案86所述的方法,其中所述多肽水平的检测包括至少一种选自以下的技术:免疫组织化学(ihc)、质谱分析、western印迹法、酶联免疫吸附测定(elisa)、免疫细胞化学、免疫荧光和流式细胞术。
88.根据实施方案58至83中任一项所述的方法,其中所述表达水平通过核酸扩增测定、杂交测定、测序或其组合来评估。
89.根据实施方案88所述的方法,其中所述核酸扩增测定、所述杂交测定或所述测序使用来自所述受试者的核酸样品进行。
90.根据实施方案89所述的方法,其中所述核酸样品包括选自基因组dna、cdna、ctdna、无细胞dna、rna和mrna的核酸。
91.根据实施方案89或90所述的方法,其中所述核酸来自头颈鳞状细胞癌细胞。
92.根据实施方案58至83中任一项所述的方法,其中所述表达水平通过使用
93.根据实施方案58至91中任一项所述的方法,其中所述第四参考水平和/或所述第五参考水平通过在来自患有鳞状细胞癌的展现出对所述erk抑制剂治疗的低敏感性的受试者的生物样品中分别评估以下的表达来获得:(1)areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa;和/或(2)dcun1d1、pik3ca、prkci、sox2和tp63。
94.根据实施方案58至93中任一项所述的方法,其中所述第四参考水平代表多个鳞状细胞癌样品中的areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的平均总表达水平。
95.根据实施方案58至94中任一项所述的方法,其中所述第五参考水平代表多个鳞状细胞癌样品中的dcun1d1、pik3ca、prkci、sox2和tp63的平均总表达水平。
96.一种治疗有需要的受试者中的鳞状细胞癌的方法,包括向所述受试者施用有效剂量的细胞外信号调节激酶(erk)抑制剂,所述受试者包含具有拷贝数谱的基因组,所述拷贝数谱包含至少一种促分裂原活化蛋白激酶(mapk)途径基因的拷贝数扩增。
97.一种用erk抑制剂下调多个鳞状细胞癌细胞中的mapk信号传导输出的方法,包括:
(a)在包含来自所述受试者的核酸的生物样品中评估至少一种mapk途径基因的拷贝数谱;以及
(b)如果所述拷贝数谱包含大于2的所述至少一种mapk途径基因的平均拷贝数,则向所述多个细胞施用有效剂量的所述erk抑制剂。
98.一种对受试者的鳞状细胞癌状态进行分类的方法,包括:
(a)获得来自所述受试者的生物样品,所述样品包含来自所述受试者的鳞状细胞癌细胞的基因组和/或转录组物质;
(b)评估所述样品中的至少一种mapk途径基因的拷贝数谱;以及(c)基于所述拷贝数谱对所述受试者的鳞状细胞癌状态进行分类。
99.根据实施方案98所述的方法,其中如果所述拷贝数谱包含大于2的所述至少一种mapk途径基因的平均拷贝数,则所述鳞状细胞癌状态被分类为可能对erk抑制剂治疗敏感。
100.根据实施方案98或99所述的方法,其中所述分类步骤包括基于所述拷贝数谱使用计算机系统计算所述受试者对erk抑制剂治疗有反应的可能性,其中每有一个额外的拷贝数大于2的所述至少一种mapk途径基因,上调所述可能性。
101.根据实施方案100所述的方法,进一步包括制作包括所述受试者对所述erk抑制剂治疗有反应的可能性的预测的报告。
102.一种评估患有鳞状细胞癌的受试者对erk抑制剂治疗展现出临床有益反应的可能性的方法,所述方法包括:
(a)在包含来自鳞状细胞癌细胞的基因组和/或转录组物质的生物样品中评估至少一种mapk途径基因的拷贝数谱;以及
(b)基于所述拷贝数谱使用计算机系统计算erk抑制剂反应性的加权概率。
103.根据实施方案102所述的方法,进一步包括如果所述加权概率对应于基线概率的至少1.5倍,则将所述受试者指定为有较高概率对所述erk抑制剂治疗展现出临床有益反应,其中所述基线概率代表在获得(b)的所述加权概率之前,所述受试者将对所述erk抑制剂治疗展现出临床有益反应的可能性。
104.根据实施方案103所述的方法,进一步包括向接受者传递关于所述可能性的信息。
105.根据实施方案102至104中任一项所述的方法,进一步包括基于所述加权概率提供建议。
106.根据实施方案105所述的方法,其中所述建议包括用所述erk抑制剂治疗所述受试者。
107.根据实施方案105所述的方法,其中所述建议包括中断治疗、化疗、免疫疗法、放疗或外科手术。
108.根据实施方案102至107中任一项所述的方法,进一步包括基于所述加权概率选择治疗。
109.根据实施方案102至108中任一项所述的方法,进一步包括基于所述加权概率施用所述erk抑制剂。
110.根据实施方案96至109中任一项所述的方法,其中所述至少一种mapk途径基因的拷贝数谱通过选自以下的方法评估:原位杂交、southern印迹法、免疫组织化学(ihc)、聚合酶链反应(pcr)、定量pcr(qpcr)、定量实时pcr(qrt-pcr)、比较基因组杂交、基于微阵列的比较基因组杂交和连接酶链反应(lcr)。
111.根据实施方案110所述的方法,其中所述至少一种mapk途径基因的拷贝数谱通过选自以下的方法评估:荧光原位杂交、显色原位杂交和银原位杂交。
112.根据实施方案110或111所述的方法,其中所述拷贝数谱使用来自所述受试者的核酸样品来评估。
113.根据实施方案112所述的方法,其中所述核酸样品包括选自基因组dna、cdna、ctdna、无细胞dna、rna和mrna的核酸。
114.根据实施方案112或113所述的方法,其中所述核酸来自鳞状细胞癌细胞。
115.根据实施方案96至114中任一项所述的方法,其中所述至少一种mapk途径基因选自cdk4、cdk6、egfr、erk1、ccnd1、kras、erk2和hras。
116.根据实施方案115所述的方法,其中所述至少一种mapk途径基因为egfr。
117.根据实施方案116所述的方法,其中所述鳞状细胞癌为食管鳞状细胞癌。
118.根据前述实施方案中任一项所述的方法,其中所述生物样品为组织样品。
119.根据实施方案118所述的方法,其中所述组织样品为固定的、石蜡包埋的、新鲜的或冷冻的。
120.根据实施方案118或119所述的方法,其中所述组织样品由细针、芯针或其他类型的活检而获得。
121.根据实施方案1至117中任一项所述的方法,其中所述生物样品为全血或血浆样品。
122.根据前述实施方案中任一项所述的方法,其中所述鳞状细胞癌选自肺鳞状细胞癌、食管鳞状细胞癌、宫颈鳞状细胞癌和头颈鳞状细胞癌。
123.一种治疗有需要的受试者中的癌症的方法,包括向所述受试者施用有效剂量的细胞外信号调节激酶(erk)抑制剂,其中所述受试者展现出对ras、raf或mek抑制剂治疗的抗性。
124.一种治疗患有癌症的受试者的方法,包括:
(a)针对对ras、raf或mek抑制剂治疗的抗性来筛选所述受试者;以及
(b)如果确定所述受试者对所述ras、raf或mek抑制剂治疗有抗性,则向所述受试者施用erk抑制剂。
125.根据实施方案123或124所述的方法,其中所述受试者展现出对b-raf抑制剂治疗的抗性。
126.根据实施方案125所述的方法,其中所述b-raf抑制剂选自维罗非尼、gdc-0879、plx-4720、plx-3603、plx-4032、raf265、xl281、az628、索拉非尼、达拉非尼和lgx818。
127.根据实施方案126所述的方法,其中所述b-raf抑制剂为维罗非尼。
128.根据实施方案123或124所述的方法,其中所述受试者展现出对mek抑制剂治疗的抗性。
129.根据实施方案128所述的方法,其中所述mek抑制剂选自曲美替尼、考比替尼、binimetinib、司美替尼、pd-325901、ci-1040、pd-035901、tak-733、pd98059、pd184352、u0126、rdea119、azd8330、ro4987655、ro4927350、ro5068760、as703026和e6201。
130.根据实施方案129所述的方法,其中所述mek抑制剂为曲美替尼。
131.根据实施方案123至130中任一项所述的方法,其中所述癌症包括b-raf或n-ras突变。
132.根据实施方案123至131中任一项所述的方法,其中所述癌症选自乳腺癌、胰腺癌、肺癌、甲状腺癌、精原细胞瘤、黑素瘤、膀胱癌、肝癌、肾癌、骨髓增生异常综合征、急性髓性白血病和结直肠癌。
133.根据实施方案132所述的方法,其中所述癌症选自胰腺癌、肺癌、黑素瘤和结直肠癌。
134.根据实施方案133所述的方法,其中所述癌症为黑素瘤。
135.一种抑制癌细胞生长的方法,所述方法包括向所述细胞施用erk抑制剂,其中所述细胞展现出对ras、raf或mek抑制剂治疗的抗性。
136.根据实施方案135所述的方法,其中所述细胞展现出对b-raf抑制剂治疗的抗性。
137.根据实施方案136所述的方法,其中所述b-raf抑制剂选自维罗非尼、gdc-0879、plx-4720、plx-3603、plx-4032、raf265、xl281、az628、索拉非尼、达拉非尼和lgx818。
138.根据实施方案137所述的方法,其中所述b-raf抑制剂为维罗非尼。
139.根据实施方案135所述的方法,其中所述细胞展现出对mek抑制剂治疗的抗性。
140.根据实施方案139所述的方法,其中所述mek抑制剂选自曲美替尼、考比替尼、binimetinib、司美替尼、pd-325901、ci-1040、pd-035901、tak-733、pd98059、pd184352、u0126、rdea119、azd8330、ro4987655、ro4927350、ro5068760、as703026和e6201。
141.根据实施方案140所述的方法,其中所述mek抑制剂为曲美替尼。
142.根据实施方案135至141中任一项所述的方法,其中所述细胞包含b-raf或n-ras突变。
143.根据实施方案135至142中任一项所述的方法,其中所述细胞选自胰腺癌细胞、肺癌细胞、黑素瘤细胞和结直肠癌细胞。
144.根据实施方案143所述的方法,其中所述细胞为黑素瘤细胞。
145.根据前述实施方案中任一项所述的方法,其中所述erk抑制剂作为单一疗法施用。
146.根据实施方案1至144中任一项所述的方法,其中所述erk抑制剂与至少一种其他抗癌疗法一起施用。
147.根据前述实施方案中任一项所述的方法,其中所述erk抑制剂为式i化合物:
其中:
x1为c=o、c=s、so、so2或po2-;y为cr5;w为n或c;
x2为nr1或cr1r1’,且x3为空、cr3r3’或c=o;或者x2-x3为r1c=cr3或r1c=n或n=cr3或nr12-cr11=cr3;
x4为n或cr4;x5为n或c;x6为n或c;x7为o、n、nr72或cr71;x8为o、n、nr82或cr81;x9为o、n、nr22或cr21;x10为o、n、nr92或cr91;
r1为-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c2-10烯基-c3-10芳基、-c2-10烯基-c1-10杂芳基、-c2-10烯基-c3-10环烷基、-c2-10烯基-c1-10杂环基、-c2-10炔基-c3-10芳基、-c2-10炔基-c1-10杂芳基、-c2-10炔基-c3-10环烷基、-c2-10炔基-c1-10杂环基、-c1-10杂烷基-c3-10芳基、-c1-10杂烷基-c1-10杂芳基、-c1-10杂烷基-c3-10环烷基、-c1-10杂烷基-c1-10杂环基、-c1-10烷氧基-c3-10芳基、-c1-10烷氧基-c1-10杂芳基、-c1-10烷氧基-c3-10环烷基、-c1-10烷氧基-c1-10杂环基、-c3-10芳基-c1-10烷基、-c3-10芳基-c2-10烯基、-c3-10芳基-c2-10炔基、-c3-10芳基-c3-10杂芳基、-c3-10芳基-c3-10环烷基、-c3-10芳基-c1-10杂环基、-c1-10杂芳基-c1-10烷基、-c1-10杂芳基-c2-10烯基、-c1-10杂芳基-c2-10炔基、-c3-10杂芳基-c3-10芳基、-c1-10杂芳基-c3-10环烷基、-c1-10杂芳基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c2-10烯基、-c3-10环烷基-c2-10炔基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c2-10烯基、-c1-10杂环基-c2-10炔基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r1’为氢、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c2-10烯基-c3-10芳基、-c2-10烯基-c1-10杂芳基、-c2-10烯基-c3-10环烷基、-c2-10烯基-c1-10杂环基、-c2-10炔基-c3-10芳基、-c2-10炔基-c1-10杂芳基、-c2-10炔基-c3-10环烷基、-c2-10炔基-c1-10杂环基、-c1-10杂烷基-c3-10芳基、-c1-10杂烷基-c1-10杂芳基、-c1-10杂烷基-c3-10环烷基、-c1-10杂烷基-c1-10杂环基、-c1-10烷氧基-c3-10芳基、-c1-10烷氧基-c1-10杂芳基、-c1-10烷氧基-c3-10环烷基、-c1-10烷氧基-c1-10杂环基、-c3-10芳基-c1-10烷基、-c3-10芳基-c2-10烯基、-c3-10芳基-c2-10炔基、-c3-10芳基-c3-10杂芳基、-c3-10芳基-c3-10环烷基、-c3-10芳基-c1-10杂环基、-c1-10杂芳基-c1-10烷基、-c1-10杂芳基-c2-10烯基、-c1-10杂芳基-c2-10炔基、-c3-10杂芳基-c3-10芳基、-c1-10杂芳基-c3-10环烷基、-c1-10杂芳基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c2-10烯基、-c3-10环烷基-c2-10炔基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c2-10烯基、-c1-10杂环基-c2-10炔基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r21为氢、卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-so2nr31r32、-nr31c(=o)r32、-nr31c(=o)or32、-nr31c(=o)nr32r33、-nr31s(o)0-2r32、-c(=s)or31、-c(=o)sr31、-nr31c(=nr32)nr32r33、-nr31c(=nr32)or33、-nr31c(=nr32)sr33、-oc(=o)or33、-oc(=o)nr31r32、-oc(=o)sr31、-sc(=o)sr31、-p(o)or31or32、-sc(=o)nr31r32、-l-c1-10烷基、-l-c2-10烯基、-l-c2-10炔基、-l-c1-10杂烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基、-l-c1-10杂环基、-l-c1-10烷基-c3-10芳基、-l-c1-10烷基-c1-10杂芳基、-l-c1-10烷基-c3-10环烷基、-l-c1-10烷基-c1-10杂环基、-l-c2-10烯基-c3-10芳基、-l-c2-10烯基-c1-10杂芳基、-l-c2-10烯基-c3-10环烷基、-l-c2-10烯基-c1-10杂环基、-l-c2-10炔基-c3-10芳基、-l-c2-10炔基-c1-10杂芳基、-l-c2-10炔基-c3-10环烷基、-l-c2-10炔基-c1-10杂环基、-l-c1-10杂烷基-c3-10芳基、-l-c1-10杂烷基-c1-10杂芳基、-l-c1-10杂烷基-c3-10环烷基、-l-c1-10杂烷基-c1-10杂环基、-l-c1-10烷氧基-c3-10芳基、-l-c1-10烷氧基-c1-10杂芳基、-l-c1-10烷氧基-c3-10环烷基、-l-c1-10烷氧基-c1-10杂环基、-l-c3-10芳基-c1-10烷基、-l-c3-10芳基-c2-10烯基、-l-c3-10芳基-c2-10炔基、-l-c3-10芳基-c1-10杂芳基、-l-c3-10芳基-c3-10环烷基、-l-c3-10芳基-c1-10杂环基、-l-c1-10杂芳基-c1-10烷基、-l-c1-10杂芳基-c2-10烯基、-l-c1-10杂芳基-c2-10炔基、-l-c1-10杂芳基-c3-10芳基、-l-c1-10杂芳基-c3-10环烷基、-l-c1-10杂芳基-c1-10杂环基、-l-c3-10环烷基-c1-10烷基、-l-c3-10环烷基-c2-10烯基、-l-c3-10环烷基-c2-10炔基、-l-c3-10环烷基-c3-10芳基、-l-c3-10环烷基-c1-10杂芳基、-l-c3-10环烷基-c1-10杂环基、-l-c1-10杂环基-c1-10烷基、-l-c1-10杂环基-c2-10烯基、-l-c1-10杂环基-c2-10炔基、-l-c1-10杂环基-c3-10芳基、-l-c1-10杂环基-c1-10杂芳基或-l-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
r22为氢、-oh、-cf3、-c(o)r31、-co2r31、-c(=o)nr31、-s(o)0-2r31、-c(=s)or31、-c(=o)sr31、-l-c1-10烷基、-l-c2-10烯基、-l-c2-10炔基、-l-c1-10杂烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基、-l-c1-10杂环基、-l-c1-10烷基-c3-10芳基、-l-c1-10烷基-c1-10杂芳基、-l-c1-10烷基-c3-10环烷基、-l-c1-10烷基-c1-10杂环基、-l-c2-10烯基-c3-10芳基、-l-c2-10烯基-c1-10杂芳基、-l-c2-10烯基-c3-10环烷基、-l-c2-10烯基-c1-10杂环基、-l-c2-10炔基-c3-10芳基、-l-c2-10炔基-c1-10杂芳基、-l-c2-10炔基-c3-10环烷基、-l-c2-10炔基-c1-10杂环基、-l-c1-10杂烷基-c3-10芳基、-l-c1-10杂烷基-c1-10杂芳基、-l-c1-10杂烷基-c3-10环烷基、-l-c1-10杂烷基-c1-10杂环基、-l-c1-10烷氧基-c3-10芳基、-l-c1-10烷氧基-c1-10杂芳基、-l-c1-10烷氧基-c3-10环烷基、-l-c1-10烷氧基-c1-10杂环基、-l-c3-10芳基-c1-10烷基、-l-c3-10芳基-c2-10烯基、-l-c3-10芳基-c2-10炔基、-l-c3-10芳基-c1-10杂芳基、-l-c3-10芳基-c3-10环烷基、-l-c3-10芳基-c1-10杂环基、-l-c1-10杂芳基-c1-10烷基、-l-c1-10杂芳基-c2-10烯基、-l-c1-10杂芳基-c2-10炔基、-l-c1-10杂芳基-c3-10芳基、-l-c1-10杂芳基-c3-10环烷基、-l-c1-10杂芳基-c1-10杂环基、-l-c3-10环烷基-c1-10烷基、-l-c3-10环烷基-c2-10烯基、-l-c3-10环烷基-c2-10炔基、-l-c3-10环烷基-c3-10芳基、-l-c3-10环烷基-c1-10杂芳基、-l-c3-10环烷基-c1-10杂环基、-l-c1-10杂环基-c1-10烷基、-l-c1-10杂环基-c2-10烯基、-l-c1-10杂环基-c2-10炔基、-l-c1-10杂环基-c3-10芳基、-l-c1-10杂环基-c1-10杂芳基或-l-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
l为键、-o-、-n(r31)-、-s(o)0-2-、-c(=o)-、-c(=o)o-、-oc(=o)-、-c(=o)n(r31)-、-n(r31)c(=o)-、-nr31c(=o)o-、-nr31c(=o)nr32-、-nr31s(o)0-2-、-s(o)0-2n(r31)-、-c(=s)o-、-c(=o)s-、-nr31c(=nr32)nr32-、-nr31c(=nr32)o-、-nr31c(=nr32)s-、-oc(=o)o-、-oc(=o)nr31-、-oc(=o)s-、-sc(=o)s-、-p(o)or31o-、-sc(=o)nr31-;
r3、r3’和r4中的每一个独立地为氢、卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-so2nr31r32、-nr31c(=o)r32、-nr31c(=o)or32、-nr31c(=o)nr32r33、-nr31s(o)0-2r32、-c(=s)or31、-c(=o)sr31、-nr31c(=nr32)nr32r33、-nr31c(=nr32)or33、-nr31c(=nr32)sr33、-oc(=o)or33、-oc(=o)nr31r32、-oc(=o)sr31、-sc(=o)sr31、-p(o)or31or32、-sc(=o)nr31r32、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c2-10烯基-c3-10芳基、-c2-10烯基-c1-10杂芳基、-c2-10烯基-c3-10环烷基、-c2-10烯基-c1-10杂环基、-c2-10炔基-c3-10芳基、-c2-10炔基-c1-10杂芳基、-c2-10炔基-c3-10环烷基、-c2-10炔基-c1-10杂环基、-c1-10杂烷基-c3-10芳基、-c1-10杂烷基-c1-10杂芳基、-c1-10杂烷基-c3-10环烷基、-c1-10杂烷基-c1-10杂环基、-c1-10烷氧基-c3-10芳基、-c1-10烷氧基-c1-10杂芳基、-c1-10烷氧基-c3-10环烷基、-c1-10烷氧基-c1-10杂环基、-c3-10芳基-c1-10烷基、-c3-10芳基-c2-10烯基、-c3-10芳基-c2-10炔基、-c3-10芳基-c3-10杂芳基、-c3-10芳基-c3-10环烷基、-c3-10芳基-c1-10杂环基、-c1-10杂芳基-c1-10烷基、-c1-10杂芳基-c2-10烯基、-c1-10杂芳基-c2-10炔基、-c3-10杂芳基-c3-10芳基、-c1-10杂芳基-c3-10环烷基、-c1-10杂芳基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c2-10烯基、-c3-10环烷基-c2-10炔基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c2-10烯基、-c1-10杂环基-c2-10炔基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r13取代基取代;或者r3’为-or6、-nr6r34、-s(o)0-2r6、-c(=o)r6、-c(=o)or6、-oc(=o)r6、-c(=o)n(r34)r6或-n(r34)c(=o)r6,其中r6与r34一起可任选地形成杂环;或者r3’为-or6、-nr6r34、-s(o)0-2r6、-c(=o)r6、-c(=o)or6、-oc(=o)r6、-c(=o)n(r34)r6或-n(r34)c(=o)r6,其中r6与r34一起可任选地形成杂环;
r5、r71、r81和r91中的每一个独立地为氢、卤素、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-so2nr31r32、-nr31c(=o)r32、-nr31c(=o)or32、-nr31c(=o)nr32r33、-nr31s(o)0-2r32、-c(=s)or31、-c(=o)sr31、-nr31c(=nr32)nr32r33、-nr31c(=nr32)or33、-nr31c(=nr32)sr33、-oc(=o)or33、-oc(=o)nr31r32、-oc(=o)sr31、-sc(=o)sr31、-p(o)or31or32或-sc(=o)nr31nr32;
r6为氢、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c2-10烯基-c3-10芳基、-c2-10烯基-c1-10杂芳基、-c2-10烯基-c3-10环烷基、-c2-10烯基-c1-10杂环基、-c2-10炔基-c3-10芳基、-c2-10炔基-c1-10杂芳基、-c2-10炔基-c3-10环烷基、-c2-10炔基-c1-10杂环基、-c1-10杂烷基-c3-10芳基、-c1-10杂烷基-c1-10杂芳基、-c1-10杂烷基-c3-10环烷基、-c1-10杂烷基-c1-10杂环基、-c1-10烷氧基-c3-10芳基、-c1-10烷氧基-c1-10杂芳基、-c1-10烷氧基-c3-10环烷基、-c1-10烷氧基-c1-10杂环基、-c3-10芳基-c1-10烷基、-c3-10芳基-c2-10烯基、-c3-10芳基-c2-10炔基、-c3-10芳基-c3-10杂芳基、-c3-10芳基-c3-10环烷基、-c3-10芳基-c1-10杂环基、-c1-10杂芳基-c1-10烷基、-c1-10杂芳基-c2-10烯基、-c1-10杂芳基-c2-10炔基、-c3-10杂芳基-c3-10芳基、-c1-10杂芳基-c3-10环烷基、-c1-10杂芳基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c2-10烯基、-c3-10环烷基-c2-10炔基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c2-10烯基、-c1-10杂环基-c2-10炔基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r14或r15取代基取代;
r72、r82和r92中的每一个独立地为氢、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-c(o)r31、-co2r31、-c(=o)nr31、-s(o)0-2r31、-c(=s)or31、-c(=o)sr31;
r10和r14中的每一个独立地为-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基,其任选地被一个或多个独立的r11取代基取代;
r11、r12、r13和r15中的每一个独立地为氢、卤素、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-so2nr31r32、-nr31c(=o)r32、-nr31c(=o)or32、-nr31c(=o)nr32r33、-nr31s(o)0-2r32、-c(=s)or31、-c(=o)sr31、-nr31c(=nr32)nr32r33、-nr31c(=nr32)or33、-nr31c(=nr32)sr33、-oc(=o)or33、-oc(=o)nr31r32、-oc(=o)sr31、-sc(=o)sr31、-p(o)or31or32或-sc(=o)nr31nr32;
r31、r32、r33和r34中的每一个独立地为氢、卤素、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基,或者其中r31与r32一起形成杂环;
其中环a包含一个或多个选自n、o或s的杂原子;并且
其中如果x7为o,或者x2-x3为r1c=cr3,环a包含至少两个选自n、o或s的杂原子;并且
其中如果x2-x3为r1c=n,则x7或x9中的至少一个不是n。
148.根据实施方案147所述的方法,其中所述erk抑制剂为式i-a化合物:
或其药学上可接受的盐。
149.根据实施方案147或148所述的方法,其中:
r1为-c1-10烷基、-c1-10烷基-c3-10芳基或-c1-10杂环基-c1-10烷基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r21为-l-c3-10芳基或-l-c1-10杂芳基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
l为键或-n(r31)-;
r72为氢;
每个r10独立地为-c3-10芳基、-c1-10杂芳基或-c1-10杂环基,其任选地被一个或多个独立的r11取代基取代;
r11和r12中的每一个独立地为卤素、-c1-10烷基、-oh、-cf3或-or31;并且
每个r31独立地为氢或-c1-10烷基。
150.根据前述实施方案中任一项所述的方法,其中所述erk抑制剂选自:
151.根据实施方案1至146中任一项所述的方法,其中所述erk抑制剂选自:
ulixertinib、bvd-523、rg7842、gdc-0094、gdc-0994、cc-90003、ltt-462、asn-007、amo-01、ko-947、aezs-134、aezs-131、aezs-140、aezs-136、aezs-132、d-87503、kin-2118、rb-1、rb-3、sch-722984、sch-772984、mk-8353、sch-900353、fr-180204、idn-5491、贯叶金丝桃素三甲氧基苯甲酸酯、erk1-2067、erk1-23211和erk1-624。
152.根据实施方案1至146中任一项所述的方法,其中所述erk抑制剂选自:
153.根据前述实施方案中任一项所述的方法,进一步包括向所述受试者施用第二治疗剂。
154.一种治疗有需要的受试者中的鳞状细胞癌的方法,包括向所述受试者施用erk抑制剂和第二治疗剂。
155.根据实施方案153或154所述的方法,其中所述第二治疗剂为化疗剂。
156.根据实施方案153或154所述的方法,其中所述第二治疗剂选自吉西他滨、顺铂、egfr抑制剂和cdk抑制剂。
157.根据实施方案156所述的方法,其中所述第二治疗剂选自吉西他滨、顺铂、帕博西尼、奥希替尼、奥姆替尼、盐酸埃克替尼、阿法替尼、奈昔木单抗、拉帕替尼、帕妥珠单抗、凡德他尼、尼妥珠单抗、帕尼单抗、厄洛替尼、吉非替尼和西妥昔单抗。
158.根据实施方案156所述的方法,其中所述第二治疗剂选自吉西他滨、顺铂、西妥昔单抗、厄洛替尼和帕博西尼。
159.根据前述实施方案中任一项所述的方法,进一步包括对所述受试者施用化疗、免疫疗法或放疗。
160.一种用于评估患有鳞状细胞癌的受试者对erk抑制剂治疗展现出临床有益反应的可能性的系统,所述系统包含:
(a)存储器单元,其被配置用于存储关于包含来自鳞状细胞癌细胞的基因组和/或转录组物质的生物样品中的以下各项的信息:
i.至少两种选自以下的基因的第一总表达水平:egfr、erk1、ccnd1、kras、erk2和hras;
ii.至少两种选自以下的基因的第二总表达水平:dusp5、dusp6、dusp2、dusp4、spry2、spry4和spred1;
iii.至少两种选自以下的基因的第三总表达水平:ccnd1、craf、dusp5、egfr、erk1和kras;
iv.至少一种mapk途径基因的拷贝数谱;
v.areg、cdh3、col17a1、egfr、hif1a、itgb1、krt1、krt9、nrg1、slc16a1、slc22a1和vegfa的第四总表达水平;
vi.dcun1d1、pik3ca、prkci、sox2和tp63的第五总表达水平;和/或
vii.hif1a和tp63的表达水平;
(b)一个或多个处理器,其单独或组合地被编程用于:
(1)基于所述第一总表达水平、所述第二总表达水平、所述拷贝数谱、所述第三总表达水平、所述第四总表达水平、所述第五总表达水平和/或所述hif1a和tp63的表达水平来确定erk抑制剂反应性的加权概率;和
(2)如果所述加权概率对应于基线概率的至少1.5倍,则将所述受试者指定为有较高概率对所述erk抑制剂治疗展现出临床有益反应,其中所述基线概率代表在获得(b)(1)的所述加权概率之前所述受试者将对所述erk抑制剂治疗展现出临床有益反应的可能性。
161.根据实施方案160所述的系统,其中所述第一总表达水平、所述第二总表达水平、所述第三总表达水平、所述第四总表达水平、所述第五总表达水平和/或所述hif1a和tp63的表达水平通过以下来评估:
(a)检测mrna的水平;
(b)检测由mrna逆转录产生的cdna的水平;
(c)检测多肽的水平;
(d)检测无细胞dna的水平;或者
(e)核酸扩增测定、杂交测定、测序或其组合。
162.根据实施方案160所述的系统,其中所述至少一种mapk途径基因的拷贝数谱通过选自以下的方法来评估:原位杂交、southern印迹法、免疫组织化学(ihc)、聚合酶链反应(pcr)、定量pcr(qpcr)、定量实时pcr(qrt-pcr)、比较基因组杂交、基于微阵列的比较基因组杂交和连接酶链反应(lcr)。
163.根据实施方案160至162中任一项所述的系统,其中所述至少一种mapk途径基因选自egfr、erk1、ccnd1、kras、erk2和hras。
164.根据实施方案163所述的系统,其中所述至少一种mapk途径基因为egfr。
165.根据实施方案160至164中任一项所述的系统,其中所述鳞状细胞癌选自肺鳞状细胞癌、食管鳞状细胞癌、宫颈鳞状细胞癌和头颈鳞状细胞癌。
166.根据实施方案165所述的系统,其中所述鳞状细胞癌为头颈鳞状细胞癌。
167.一种治疗有需要的受试者中的癌症的方法,包括向所述受试者施用有效剂量的细胞外信号调节激酶(erk)抑制剂,所述受试者包含展现出至少一种位于染色体11q13.3-13.4处的基因的扩增和/或超表达的基因组。
168.根据实施方案167所述的方法,包括:
(a)针对所述至少一种位于染色体11q13.3-13.4处的基因的扩增和/或超表达来筛选所述受试者;以及
(b)如果确定存在所述扩增和/或超表达,则向所述受试者施用所述erk抑制剂。
169.一种治疗患有癌症的受试者的方法,包括:
(a)针对至少一种位于染色体11q13.3-13.4处的基因或者与位于染色体11q13.3-13.4处的基因共扩增的基因的扩增和/或超表达来筛选所述受试者;以及
(b)如果确定存在所述扩增和/或超表达,则向所述受试者施用所述erk抑制剂。
170.根据实施方案168或169所述的方法,进一步包括如果不存在所述扩增和/或超表达,则向所述受试者施加替代疗法。
171.根据实施方案167至170中任一项所述的方法,其中所述筛选包括对从所述受试者分离的核酸进行核酸分析。
172.根据实施方案171所述的方法,其中所述核酸来自癌细胞。
173.根据实施方案168或169所述的方法,包括如果确定同时存在所述至少一种基因的扩增和超表达,则向所述受试者施用所述erk抑制剂。
174.根据实施方案167至172中任一项所述的方法,包括如果所述受试者展现出ccnd1或ano1的扩增和/或超表达,则向所述受试者施用所述erk抑制剂。
175.根据实施方案167至172中任一项所述的方法,包括如果所述受试者展现出ccnd1和ano1的扩增或超表达,则向所述受试者施用所述erk抑制剂。
176.根据实施方案167至172中任一项所述的方法,包括如果所述受试者展现出ccnd1和ano1的扩增和超表达,则向所述受试者施用所述erk抑制剂。
177.一种用erk抑制剂下调多个癌细胞中的mapk信号传导输出的方法,包括:
(a)在包含来自所述多个细胞的核酸的生物样品中评估至少一种位于染色体11q13.3-13.4处的基因的拷贝数谱和/或表达谱;以及
(b)如果所述拷贝数谱包含>2的所述至少一种基因的平均拷贝数和/或如果所述表达谱高于参考水平,则向所述多个细胞施用有效剂量的所述erk抑制剂,其中所述参考水平指示对所述erk抑制剂的低敏感性。
178.一种对受试者的癌症状态进行分类的方法,包括:
(a)获得来自所述受试者的生物样品,所述样品包含来自所述受试者的癌细胞的基因组和/或转录组物质;
(b)评估所述样品中至少一种位于染色体11q13.3-13.4处的基因的拷贝数谱和/或表达谱;以及
(c)基于所述拷贝数谱和/或所述表达谱,对(a)的所述受试者的癌症状态进行分类。
179.根据实施方案178所述的方法,其中如果所述拷贝数谱包含>2的所述至少一种基因的平均拷贝数,则所述癌症状态被分类为可能对erk抑制剂治疗敏感。
180.根据实施方案178或179所述的方法,其中如果所述表达谱高于参考水平,则所述癌症状态被分类为可能对erk抑制剂治疗敏感,其中所述参考水平指示对所述erk抑制剂的低敏感性。
181.根据实施方案178至180中任一项所述的方法,其中所述分类步骤包括基于所述拷贝数谱和/或所述表达谱使用计算机系统计算所述受试者对erk抑制剂治疗有反应的可能性,其中每有一个额外的拷贝数大于2的所述至少一种基因以及所述表达谱相对于参考水平的每个倍增,上调所述可能性,其中所述参考水平指示对所述erk抑制剂的低敏感性。
182.根据实施方案181所述的方法,进一步包括制作包括所述受试者对所述erk抑制剂治疗有反应的可能性的预测的报告。
183.一种评估患有癌症的受试者对erk抑制剂治疗展现出临床有益反应的可能性的方法,所述方法包括:
(a)评估包含来自癌细胞的基因组和/或转录组物质的生物样品中的至少一种位于染色体11q13.3-13.4处的基因的拷贝数谱和/或表达谱;以及
(b)基于所述拷贝数谱和/或所述表达谱使用计算机系统计算erk抑制剂反应性的加权概率。
184.根据实施方案183所述的方法,进一步包括如果所述加权概率对应于基线概率的至少1.5倍,则将所述受试者指定为有较高概率对所述erk抑制剂治疗展现出临床有益反应,其中所述基线概率代表在获得(b)的所述加权概率之前所述受试者将对所述erk抑制剂治疗展现出临床有益反应的可能性。
185.根据实施方案184所述的方法,进一步包括向接受者传递关于所述可能性的信息。
186.根据实施方案183至185中任一项所述的方法,进一步包括基于所述加权概率提供建议。
187.根据实施方案186所述的方法,其中所述建议包括用所述erk抑制剂治疗所述受试者。
188.根据实施方案186所述的方法,其中所述建议包括中断治疗、化疗、免疫疗法、放疗或外科手术。
189.根据实施方案183至188中任一项所述的方法,进一步包括基于所述加权概率选择治疗。
190.根据实施方案183至189中任一项所述的方法,进一步包括基于所述加权概率施用所述erk抑制剂。
191.根据实施方案167至190中任一项所述的方法,其中所述表达通过检测由所述至少一种基因转录的mrna的水平来评估。
192.根据实施方案167至190中任一项所述的方法,其中所述表达通过检测由通过所述至少一种基因转录的mrna的逆转录所产生的cdna的水平来评估。
193.根据实施方案167至190中任一项所述的方法,其中所述表达通过检测由所述至少一种基因编码的多肽的水平来评估。
194.根据实施方案193所述的方法,其中所述多肽水平的检测包括至少一种选自以下的技术:免疫组织化学(ihc)、质谱分析、western印迹法、酶联免疫吸附测定(elisa)、免疫细胞化学、免疫荧光和流式细胞术。
195.根据实施方案167至190中任一项所述的方法,其中所述表达通过核酸扩增测定、杂交测定、测序或其组合来评估。
196.根据实施方案195所述的方法,其中所述核酸扩增测定、所述杂交测定或所述测序使用来自所述受试者的核酸样品进行。
197.根据实施方案196所述的方法,其中所述核酸样品包括选自基因组dna、cdna、ctdna、无细胞dna、rna和mrna的核酸。
198.根据实施方案196或197所述的方法,其中所述核酸来自癌细胞。
199.根据实施方案167至190中任一项所述的方法,其中所述表达使用
200.根据实施方案167至199中任一项所述的方法,其中所述参考水平通过在来自患有癌症的展现出对所述erk抑制剂治疗的低敏感性的受试者的生物样品中评估所述至少一种基因的表达获得。
201.根据实施方案167至199中任一项所述的方法,其中所述参考水平代表多个癌症样品中所述至少一种基因的平均总表达水平。
202.根据实施方案167至201中任一项所述的方法,其中所述至少一种基因的所述拷贝数谱通过选自以下的方法评估:原位杂交、southern印迹法、免疫组织化学(ihc)、聚合酶链反应(pcr)、定量pcr(qpcr)、定量实时pcr(qrt-pcr)、比较基因组杂交、基于微阵列的比较基因组杂交和连接酶链反应(lcr)。
203.根据实施方案202所述的方法,其中所述至少一种基因的所述拷贝数谱通过选自以下的方法评估:荧光原位杂交、显色原位杂交和银原位杂交。
204.根据实施方案202或203所述的方法,其中所述拷贝数谱使用来自所述受试者的核酸样品来评估。
205.根据实施方案204所述的方法,其中所述核酸样品包括选自基因组dna、cdna、ctdna、无细胞dna、rna和mrna的核酸。
206.根据实施方案204或205所述的方法,其中所述核酸来自癌细胞。
207.根据实施方案167至206中任一项所述的方法,其中所述至少一种基因选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1和shank2。
208.根据实施方案207所述的方法,其中所述至少一种基因为ccnd1或ano1。
209.根据实施方案207所述的方法,其中所述至少一种基因为ccnd1和ano1。
210.根据实施方案167至209中任一项所述的方法,其中所述生物样品为组织样品。
211.根据实施方案210所述的方法,其中所述组织样品为固定的、石蜡包埋的、新鲜的或冷冻的。
212.根据实施方案210或211所述的方法,其中所述组织样品由细针、芯针或其他类型的活检而获得。
213.根据实施方案167至209中任一项所述的方法,其中所述生物样品为全血或血浆样品。
214.根据实施方案167至213中任一项所述的方法,其中所述癌症选自鳞状细胞癌和腺癌。
215.根据实施方案167至213中任一项所述的方法,其中所述癌症为选自以下的鳞状细胞癌:肺鳞状细胞癌、食管鳞状细胞癌、宫颈鳞状细胞癌、头颈鳞状细胞癌、膀胱鳞状细胞癌和胃鳞状细胞癌。
216.根据实施方案215所述的方法,其中所述鳞状细胞癌为食管鳞状细胞癌。
217.根据实施方案167至213中任一项所述的方法,其中所述癌症为选自食管腺癌和胰腺腺癌的腺癌。
218.根据实施方案167至213中任一项所述的方法,其中所述癌症选自肺癌、食管癌、宫颈癌、头颈癌、膀胱癌、胃癌和胰腺癌。
219.根据实施方案167至213中任一项所述的方法,其中所述癌症选自乳腺癌、胰腺癌、肺癌、甲状腺癌、精原细胞瘤、黑素瘤、膀胱癌、肝癌、肾癌、骨髓增生异常综合征、急性髓性白血病和结直肠癌。
220.根据实施方案167至219中任一项所述的方法,其中所述erk抑制剂作为单一疗法施用。
221.根据实施方案167至219中任一项所述的方法,其中所述erk抑制剂与至少一种其他抗癌疗法一起施用。
222.根据实施方案167至221中任一项所述的方法,其中所述erk抑制剂为式i化合物:
其中:
x1为c=o、c=s、so、so2或po2-;y为cr5;w为n或c;
x2为nr1或cr1r1’,且x3为空、cr3r3’或c=o;或者x2-x3为r1c=cr3或r1c=n或n=cr3或nr12-cr11=cr3;
x4为n或cr4;x5为n或c;x6为n或c;x7为o、n、nr72或cr71;x8为o、n、nr82或cr81;x9为o、n、nr22或cr21;x10为o、n、nr92或cr91;
r1为-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c2-10烯基-c3-10芳基、-c2-10烯基-c1-10杂芳基、-c2-10烯基-c3-10环烷基、-c2-10烯基-c1-10杂环基、-c2-10炔基-c3-10芳基、-c2-10炔基-c1-10杂芳基、-c2-10炔基-c3-10环烷基、-c2-10炔基-c1-10杂环基、-c1-10杂烷基-c3-10芳基、-c1-10杂烷基-c1-10杂芳基、-c1-10杂烷基-c3-10环烷基、-c1-10杂烷基-c1-10杂环基、-c1-10烷氧基-c3-10芳基、-c1-10烷氧基-c1-10杂芳基、-c1-10烷氧基-c3-10环烷基、-c1-10烷氧基-c1-10杂环基、-c3-10芳基-c1-10烷基、-c3-10芳基-c2-10烯基、-c3-10芳基-c2-10炔基、-c3-10芳基-c3-10杂芳基、-c3-10芳基-c3-10环烷基、-c3-10芳基-c1-10杂环基、-c1-10杂芳基-c1-10烷基、-c1-10杂芳基-c2-10烯基、-c1-10杂芳基-c2-10炔基、-c3-10杂芳基-c3-10芳基、-c1-10杂芳基-c3-10环烷基、-c1-10杂芳基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c2-10烯基、-c3-10环烷基-c2-10炔基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c2-10烯基、-c1-10杂环基-c2-10炔基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r1’为氢、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c2-10烯基-c3-10芳基、-c2-10烯基-c1-10杂芳基、-c2-10烯基-c3-10环烷基、-c2-10烯基-c1-10杂环基、-c2-10炔基-c3-10芳基、-c2-10炔基-c1-10杂芳基、-c2-10炔基-c3-10环烷基、-c2-10炔基-c1-10杂环基、-c1-10杂烷基-c3-10芳基、-c1-10杂烷基-c1-10杂芳基、-c1-10杂烷基-c3-10环烷基、-c1-10杂烷基-c1-10杂环基、-c1-10烷氧基-c3-10芳基、-c1-10烷氧基-c1-10杂芳基、-c1-10烷氧基-c3-10环烷基、-c1-10烷氧基-c1-10杂环基、-c3-10芳基-c1-10烷基、-c3-10芳基-c2-10烯基、-c3-10芳基-c2-10炔基、-c3-10芳基-c3-10杂芳基、-c3-10芳基-c3-10环烷基、-c3-10芳基-c1-10杂环基、-c1-10杂芳基-c1-10烷基、-c1-10杂芳基-c2-10烯基、-c1-10杂芳基-c2-10炔基、-c3-10杂芳基-c3-10芳基、-c1-10杂芳基-c3-10环烷基、-c1-10杂芳基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c2-10烯基、-c3-10环烷基-c2-10炔基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c2-10烯基、-c1-10杂环基-c2-10炔基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r21为氢、卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-so2nr31r32、-nr31c(=o)r32、-nr31c(=o)or32、-nr31c(=o)nr32r33、-nr31s(o)0-2r32、-c(=s)or31、-c(=o)sr31、-nr31c(=nr32)nr32r33、-nr31c(=nr32)or33、-nr31c(=nr32)sr33、-oc(=o)or33、-oc(=o)nr31r32、-oc(=o)sr31、-sc(=o)sr31、-p(o)or31or32、-sc(=o)nr31r32、-l-c1-10烷基、-l-c2-10烯基、-l-c2-10炔基、-l-c1-10杂烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基、-l-c1-10杂环基、-l-c1-10烷基-c3-10芳基、-l-c1-10烷基-c1-10杂芳基、-l-c1-10烷基-c3-10环烷基、-l-c1-10烷基-c1-10杂环基、-l-c2-10烯基-c3-10芳基、-l-c2-10烯基-c1-10杂芳基、-l-c2-10烯基-c3-10环烷基、-l-c2-10烯基-c1-10杂环基、-l-c2-10炔基-c3-10芳基、-l-c2-10炔基-c1-10杂芳基、-l-c2-10炔基-c3-10环烷基、-l-c2-10炔基-c1-10杂环基、-l-c1-10杂烷基-c3-10芳基、-l-c1-10杂烷基-c1-10杂芳基、-l-c1-10杂烷基-c3-10环烷基、-l-c1-10杂烷基-c1-10杂环基、-l-c1-10烷氧基-c3-10芳基、-l-c1-10烷氧基-c1-10杂芳基、-l-c1-10烷氧基-c3-10环烷基、-l-c1-10烷氧基-c1-10杂环基、-l-c3-10芳基-c1-10烷基、-l-c3-10芳基-c2-10烯基、-l-c3-10芳基-c2-10炔基、-l-c3-10芳基-c1-10杂芳基、-l-c3-10芳基-c3-10环烷基、-l-c3-10芳基-c1-10杂环基、-l-c1-10杂芳基-c1-10烷基、-l-c1-10杂芳基-c2-10烯基、-l-c1-10杂芳基-c2-10炔基、-l-c1-10杂芳基-c3-10芳基、-l-c1-10杂芳基-c3-10环烷基、-l-c1-10杂芳基-c1-10杂环基、-l-c3-10环烷基-c1-10烷基、-l-c3-10环烷基-c2-10烯基、-l-c3-10环烷基-c2-10炔基、-l-c3-10环烷基-c3-10芳基、-l-c3-10环烷基-c1-10杂芳基、-l-c3-10环烷基-c1-10杂环基、-l-c1-10杂环基-c1-10烷基、-l-c1-10杂环基-c2-10烯基、-l-c1-10杂环基-c2-10炔基、-l-c1-10杂环基-c3-10芳基、-l-c1-10杂环基-c1-10杂芳基或-l-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
r22为氢、-oh、-cf3、-c(o)r31、-co2r31、-c(=o)nr31、-s(o)0-2r31、-c(=s)or31、-c(=o)sr31、-l-c1-10烷基、-l-c2-10烯基、-l-c2-10炔基、-l-c1-10杂烷基、-l-c3-10芳基、-l-c1-10杂芳基、-l-c3-10环烷基、-l-c1-10杂环基、-l-c1-10烷基-c3-10芳基、-l-c1-10烷基-c1-10杂芳基、-l-c1-10烷基-c3-10环烷基、-l-c1-10烷基-c1-10杂环基、-l-c2-10烯基-c3-10芳基、-l-c2-10烯基-c1-10杂芳基、-l-c2-10烯基-c3-10环烷基、-l-c2-10烯基-c1-10杂环基、-l-c2-10炔基-c3-10芳基、-l-c2-10炔基-c1-10杂芳基、-l-c2-10炔基-c3-10环烷基、-l-c2-10炔基-c1-10杂环基、-l-c1-10杂烷基-c3-10芳基、-l-c1-10杂烷基-c1-10杂芳基、-l-c1-10杂烷基-c3-10环烷基、-l-c1-10杂烷基-c1-10杂环基、-l-c1-10烷氧基-c3-10芳基、-l-c1-10烷氧基-c1-10杂芳基、-l-c1-10烷氧基-c3-10环烷基、-l-c1-10烷氧基-c1-10杂环基、-l-c3-10芳基-c1-10烷基、-l-c3-10芳基-c2-10烯基、-l-c3-10芳基-c2-10炔基、-l-c3-10芳基-c1-10杂芳基、-l-c3-10芳基-c3-10环烷基、-l-c3-10芳基-c1-10杂环基、-l-c1-10杂芳基-c1-10烷基、-l-c1-10杂芳基-c2-10烯基、-l-c1-10杂芳基-c2-10炔基、-l-c1-10杂芳基-c3-10芳基、-l-c1-10杂芳基-c3-10环烷基、-l-c1-10杂芳基-c1-10杂环基、-l-c3-10环烷基-c1-10烷基、-l-c3-10环烷基-c2-10烯基、-l-c3-10环烷基-c2-10炔基、-l-c3-10环烷基-c3-10芳基、-l-c3-10环烷基-c1-10杂芳基、-l-c3-10环烷基-c1-10杂环基、-l-c1-10杂环基-c1-10烷基、-l-c1-10杂环基-c2-10烯基、-l-c1-10杂环基-c2-10炔基、-l-c1-10杂环基-c3-10芳基、-l-c1-10杂环基-c1-10杂芳基或-l-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
l为键、-o-、-n(r31)-、-s(o)0-2-、-c(=o)-、-c(=o)o-、-oc(=o)-、-c(=o)n(r31)-、-n(r31)c(=o)-、-nr31c(=o)o-、-nr31c(=o)nr32-、-nr31s(o)0-2-、-s(o)0-2n(r31)-、-c(=s)o-、-c(=o)s-、-nr31c(=nr32)nr32-、-nr31c(=nr32)o-、-nr31c(=nr32)s-、-oc(=o)o-、-oc(=o)nr31-、-oc(=o)s-、-sc(=o)s-、-p(o)or31o-、-sc(=o)nr31-;
r3、r3’和r4中的每一个独立地为氢、卤素、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-so2nr31r32、-nr31c(=o)r32、-nr31c(=o)or32、-nr31c(=o)nr32r33、-nr31s(o)0-2r32、-c(=s)or31、-c(=o)sr31、-nr31c(=nr32)nr32r33、-nr31c(=nr32)or33、-nr31c(=nr32)sr33、-oc(=o)or33、-oc(=o)nr31r32、-oc(=o)sr31、-sc(=o)sr31、-p(o)or31or32、-sc(=o)nr31r32、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c2-10烯基-c3-10芳基、-c2-10烯基-c1-10杂芳基、-c2-10烯基-c3-10环烷基、-c2-10烯基-c1-10杂环基、-c2-10炔基-c3-10芳基、-c2-10炔基-c1-10杂芳基、-c2-10炔基-c3-10环烷基、-c2-10炔基-c1-10杂环基、-c1-10杂烷基-c3-10芳基、-c1-10杂烷基-c1-10杂芳基、-c1-10杂烷基-c3-10环烷基、-c1-10杂烷基-c1-10杂环基、-c1-10烷氧基-c3-10芳基、-c1-10烷氧基-c1-10杂芳基、-c1-10烷氧基-c3-10环烷基、-c1-10烷氧基-c1-10杂环基、-c3-10芳基-c1-10烷基、-c3-10芳基-c2-10烯基、-c3-10芳基-c2-10炔基、-c3-10芳基-c3-10杂芳基、-c3-10芳基-c3-10环烷基、-c3-10芳基-c1-10杂环基、-c1-10杂芳基-c1-10烷基、-c1-10杂芳基-c2-10烯基、-c1-10杂芳基-c2-10炔基、-c3-10杂芳基-c3-10芳基、-c1-10杂芳基-c3-10环烷基、-c1-10杂芳基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c2-10烯基、-c3-10环烷基-c2-10炔基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c2-10烯基、-c1-10杂环基-c2-10炔基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r13取代基取代;或者r3’为-or6、-nr6r34、-s(o)0-2r6、-c(=o)r6、-c(=o)or6、-oc(=o)r6、-c(=o)n(r34)r6或-n(r34)c(=o)r6,其中r6与r34一起可任选地形成杂环;或者r3’为-or6、-nr6r34、-s(o)0-2r6、-c(=o)r6、-c(=o)or6、-oc(=o)r6、-c(=o)n(r34)r6或-n(r34)c(=o)r6,其中r6与r34一起可任选地形成杂环;
r5、r71、r81和r91中的每一个独立地为氢、卤素、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-so2nr31r32、-nr31c(=o)r32、-nr31c(=o)or32、-nr31c(=o)nr32r33、-nr31s(o)0-2r32、-c(=s)or31、-c(=o)sr31、-nr31c(=nr32)nr32r33、-nr31c(=nr32)or33、-nr31c(=nr32)sr33、-oc(=o)or33、-oc(=o)nr31r32、-oc(=o)sr31、-sc(=o)sr31、-p(o)or31or32或-sc(=o)nr31nr32;
r6为氢、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-c1-10烷基-c3-10芳基、-c1-10烷基-c1-10杂芳基、-c1-10烷基-c3-10环烷基、-c1-10烷基-c1-10杂环基、-c2-10烯基-c3-10芳基、-c2-10烯基-c1-10杂芳基、-c2-10烯基-c3-10环烷基、-c2-10烯基-c1-10杂环基、-c2-10炔基-c3-10芳基、-c2-10炔基-c1-10杂芳基、-c2-10炔基-c3-10环烷基、-c2-10炔基-c1-10杂环基、-c1-10杂烷基-c3-10芳基、-c1-10杂烷基-c1-10杂芳基、-c1-10杂烷基-c3-10环烷基、-c1-10杂烷基-c1-10杂环基、-c1-10烷氧基-c3-10芳基、-c1-10烷氧基-c1-10杂芳基、-c1-10烷氧基-c3-10环烷基、-c1-10烷氧基-c1-10杂环基、-c3-10芳基-c1-10烷基、-c3-10芳基-c2-10烯基、-c3-10芳基-c2-10炔基、-c3-10芳基-c3-10杂芳基、-c3-10芳基-c3-10环烷基、-c3-10芳基-c1-10杂环基、-c1-10杂芳基-c1-10烷基、-c1-10杂芳基-c2-10烯基、-c1-10杂芳基-c2-10炔基、-c3-10杂芳基-c3-10芳基、-c1-10杂芳基-c3-10环烷基、-c1-10杂芳基-c1-10杂环基、-c3-10环烷基-c1-10烷基、-c3-10环烷基-c2-10烯基、-c3-10环烷基-c2-10炔基、-c3-10环烷基-c3-10芳基、-c3-10环烷基-c1-10杂芳基、-c3-10环烷基-c1-10杂环基、-c1-10杂环基-c1-10烷基、-c1-10杂环基-c2-10烯基、-c1-10杂环基-c2-10炔基、-c1-10杂环基-c3-10芳基、-c1-10杂环基-c1-10杂芳基或-c1-10杂环基-c3-10环烷基,其中每一个为未取代的或被一个或多个独立的r14或r15取代基取代;
r72、r82和r92中的每一个独立地为氢、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-c(o)r31、-co2r31、-c(=o)nr31、-s(o)0-2r31、-c(=s)or31、-c(=o)sr31;
r10和r14中的每一个独立地为-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基,其任选地被一个或多个独立的r11取代基取代;
r11、r12、r13和r15中的每一个独立地为氢、卤素、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基、-oh、-cf3、-ocf3、-or31、-nr31r32、-c(o)r31、-co2r31、-c(=o)nr31、-no2、-cn、-s(o)0-2r31、-so2nr31r32、-nr31c(=o)r32、-nr31c(=o)or32、-nr31c(=o)nr32r33、-nr31s(o)0-2r32、-c(=s)or31、-c(=o)sr31、-nr31c(=nr32)nr32r33、-nr31c(=nr32)or33、-nr31c(=nr32)sr33、-oc(=o)or33、-oc(=o)nr31r32、-oc(=o)sr31、-sc(=o)sr31、-p(o)or31or32或-sc(=o)nr31nr32;
r31、r32、r33和r34中的每一个独立地为氢、卤素、-c1-10烷基、-c2-10烯基、-c2-10炔基、-c1-10杂烷基、-c3-10芳基、-c1-10杂芳基、-c3-10环烷基、-c1-10杂环基,或者其中r31与r32一起形成杂环;
其中环a包含一个或多个选自n、o或s的杂原子;并且
其中如果x7为o,或者x2-x3为r1c=cr3,环a包含至少两个选自n、o或s的杂原子;并且
其中如果x2-x3为r1c=n,则x7或x9中的至少一个不是n。
223.根据实施方案222所述的方法,其中所述erk抑制剂为式i-a化合物:
或其药学上可接受的盐。
224.根据实施方案222或223所述的方法,其中:
r1为-c1-10烷基、-c1-10烷基-c3-10芳基或-c1-10杂环基-c1-10烷基,其中每一个为未取代的或被一个或多个独立的r10或r11取代基取代;
r21为-l-c3-10芳基或-l-c1-10杂芳基,其中每一个为未取代的或被一个或多个独立的r12取代基取代;
l为键或-n(r31)-;
r72为氢;
每个r10独立地为-c3-10芳基、-c1-10杂芳基或-c1-10杂环基,其任选地被一个或多个独立的r11取代基取代;
r11和r12中的每一个独立地为卤素、-c1-10烷基、-oh、-cf3或-or31;并且
每个r31独立地为氢或-c1-10烷基。
225.根据实施方案167至224中任一项所述的方法,其中所述erk抑制剂选自:
226.根据实施方案167至221中任一项所述的方法,其中所述erk抑制剂选自:ulixertinib、bvd-523、rg7842、gdc-0094、gdc-0994、cc-90003、ltt-462、asn-007、amo-01、ko-947、aezs-134、aezs-131、aezs-140、aezs-136、aezs-132、d-87503、kin-2118、rb-1、rb-3、sch-722984、sch-772984、mk-8353、sch-900353、fr-180204、idn-5491、贯叶金丝桃素三甲氧基苯甲酸酯、erk1-2067、erk1-23211和erk1-624。
227.根据实施方案167至221中任一项所述的方法,其中所述erk抑制剂选自:
228.根据实施方案167至227中任一项所述的方法,进一步包括向所述受试者施用第二治疗剂。
229.一种用于评估患有癌症的受试者对erk抑制剂治疗展现出临床有益反应的可能性的系统,所述系统包含:
(a)存储器单元,其被配置用于存储关于包含来自癌细胞的基因组和/或转录组物质的生物样品中的至少一种位于染色体11q13.3-13.4处的基因的拷贝数谱和/或表达水平的信息;以及
(b)一个或多个处理器,其单独或组合地被编程用于:
(1)基于所述拷贝数谱和/或所述表达水平来确定erk抑制剂反应性的加权概率;和
(2)如果所述加权概率对应于基线概率的至少1.5倍,则将所述受试者指定为有较高概率对所述erk抑制剂治疗展现出临床有益反应,其中所述基线概率代表在获得(b)(1)的所述加权概率之前所述受试者将对所述erk抑制剂治疗展现出临床有益反应的可能性。
230.根据实施方案229所述的系统,其中所述表达水平通过以下来评估:
(a)检测mrna的水平;
(b)检测由mrna逆转录产生的cdna的水平;
(c)检测多肽的水平;
(d)检测无细胞dna的水平;或者
(e)核酸扩增测定、杂交测定、测序或其组合。
231.根据实施方案229所述的系统,其中所述至少一种基因的拷贝数谱通过选自以下的方法来评估:原位杂交、southern印迹法、免疫组织化学(ihc)、聚合酶链反应(pcr)、定量pcr(qpcr)、定量实时pcr(qrt-pcr)、比较基因组杂交、基于微阵列的比较基因组杂交和连接酶链反应(lcr)。
232.根据实施方案229至231中任一项所述的系统,其中所述至少一种基因选自ccnd1、cttn、fadd、oraov1、ano1、ppfia1和shank2。
233.根据实施方案232所述的系统,其中所述至少一种基因为ccnd1或ano1。
234.根据实施方案232所述的系统,其中所述至少一种基因为ccnd1和ano1。
235.根据实施方案229至234中任一项所述的系统,其中所述癌症选自鳞状细胞癌和腺癌。
236.根据实施方案229至234中任一项所述的系统,其中所述癌症为选自以下的鳞状细胞癌:肺鳞状细胞癌、食管鳞状细胞癌、宫颈鳞状细胞癌、头颈鳞状细胞癌、膀胱鳞状细胞癌和胃鳞状细胞癌。
237.根据实施方案236所述的系统,其中所述鳞状细胞癌为食管鳞状细胞癌。
238.根据实施方案229至234中任一项所述的系统,其中所述癌症为选自食管腺癌和胰腺腺癌的腺癌。
239.根据实施方案229至234中任一项所述的系统,其中所述癌症选自肺癌、食管癌、宫颈癌、头颈癌、膀胱癌、胃癌和胰腺癌。
240.根据实施方案229至234中任一项所述的系统,其中所述癌症选自乳腺癌、胰腺癌、肺癌、甲状腺癌、精原细胞瘤、黑素瘤、膀胱癌、肝癌、肾癌、骨髓增生异常综合征、急性髓性白血病和结直肠癌。
- 还没有人留言评论。精彩留言会获得点赞!