具有来自微泡的减小的干扰的治疗性超声波的制作方法
本发明的领域总地涉及热能治疗系统,且更特别地涉及用于最小化由在热能治疗系统中的微泡引起的干扰的系统和方法。
背景技术:
聚焦超声(即,具有大于约20千赫兹的频率的声波)可用于对在患者体内的内部身体组织进行成像或有疗效地进行治疗。例如,超声波可在涉及肿瘤的消融的应用中被使用,从而消除了对侵入性手术、目标药物输送、血脑屏障的控制、凝块的裂解和其它外科手术的需要。在肿瘤消融期间,压电陶瓷换能器放置在患者外部,但极接近待消融的组织(即,目标)。换能器将电子驱动信号转换成机械振动,导致声波的发射。换能器可以用几何方式被成形并连同其它这样的换能器一起被定位,使得它们发射的超声能量在对应于目标组织区域(或在目标组织区域内)的“聚焦区”处共同形成聚焦波束。可替换地或另外地,单个换能器可由多个单独地驱动的换能器元件形成,换能器元件的相位可以各自独立地被控制。这样的“相控阵”换能器便于通过调节在换能器之间的相对相位来将聚焦区引导到不同的位置。如在本文使用的,术语“元件”意指在阵列中的单独换能器或单个换能器的独立地可驱动的部分。磁共振成像(mri)可用于使患者和目标可视化,并从而引导超声波束。
超声手术的无创性质对脑肿瘤的治疗是特别吸引人的。而且,穿过人类颅骨的超声波的相干非侵入性聚焦被考虑为用于对大脑的靶向给药、改进的溶栓中风治疗、血流成像、内出血的检测和断层脑成像的工具。然而,人类颅骨是对超声治疗的临床实现的障碍。经颅超声手术的障碍包括强烈的衰减和由颅骨的形状、密度和声速的不规则性引起的畸变,其是破坏聚焦和/或降低在空间上记录所接收的诊断信息的能力的一个原因。
此外,在聚焦超声程序期间,例如由于从由传播的超声波产生的负压力和/或由当加热的液体破裂并充满气体/蒸汽时引起的应力,小气泡(或“微泡”)可在被包含在脑组织中的液体中产生。在超声能量的连续施加期间的包含较高的相对百分比的微泡的组织的反应是非线性的且难以预测。例如,微泡可反映和/或散射超声波,并进一步使聚焦恶化或减小其强度。此外,微泡可能由于来自声场的所施加的应力而塌陷;被称为“空化”的这种机制可引起在那个目标之外的大规模的组织损伤,且可能难以控制。最后,因为微泡一般在患者的身体中以非均匀的方式产生和/或扩散,在颅骨中累积的微泡可进一步增加考虑当估计/计算聚焦特性时从颅骨和微泡产生的超声畸变的挑战。
因此,需要最小化对治疗性超声波的微泡干扰以便优化聚焦特性并最大化在聚焦处可得到的声能的量。
技术实现要素:
本发明提供用于当超声波经过中间的组织(例如颅骨)时通过“清除”来自经过的组织的高输送量区域(hta)的微泡来最小化对超声波的微泡干扰的系统和方法。在各种实施方式中,定义在经过的组织内的多个区域,每个区域对应于换能器元件(或一组换能器元件)。可利用预测模型和/或测量来确定每个区域的特性;基于其且连同声波相对于经过的组织的已知或期望的入射角,可估计在经过它的相应区域以到达聚焦区之后的由每个换能器元件(或每组换能器元件)贡献的声能。基于所估计的能量贡献,每个经过的区域可被表征为hta(其中能量的贡献高于阈值)或低输送量区域(lta)(其中能量的贡献低于阈值)。
在一个实施方式中,在聚焦超声程序期间监控在hta区域中产生或累积的微泡。如果微泡的量(被表示为绝对数量或每单位体积的浓度)高于预定阈值,则发起微泡减少过程以减少在hta中的微泡。例如,可使用由超声波本身产生的声辐射力来将微泡从hta区域扫到lta区域内。可替换地,可创建超声操纵波束以在微泡上施加应力,以便引起微泡塌陷和/或将微泡从hta区域扫到lta区域内。在微泡的数量在hta区域中减小之后,聚焦超声程序可继续(例如靶向治疗可重新开始)。
在一个实现中,超声换能器耦合到包括所有必要的硬件部件和/或软件模块的控制器以自动监控微泡,分析在hta区域中累积的微泡的量,执行微泡减少过程和/或开始或继续聚焦超声程序。因此,本发明自动最小化对在经过的组织中的超声波的微泡干扰以由此最大化在聚焦处可得到的声能;此外,本发明有利地避免从微泡空化产生的不期望的组织损伤。
因此,在一个方面中,本发明提供用于减小对根据治疗计划从多个换能器元件传输并经过患者的颅骨到目标区域内的超声波的微泡干扰的方法。在各种实施方式中,该方法包括:(a)识别颅骨的高输送量区域,在治疗计划的执行期间,高于第一阈值量的超声能量不被期望穿过该高输送量区域;(b)在治疗计划的执行期间针对微泡监控高输送量区域;以及(c)如果在高输送量区域中的微泡的量超过阈值,则使用超声波来减小微泡的量。高输送量区域中的每个可对应于换能器元件之一或一组换能器元件。
在各种实施方式中,该方法包括产生具有首先被产生的声辐射力的聚焦(例如点聚焦或线聚焦)以及使用辐射力来向高输送量区域外部扫除微泡。例如,声辐射力可将微泡从颅骨的高输送量区域扫到低输送量区域;高于第二阈值量(其一般小于第一阈值量)的超声能量并不期望在治疗计划的执行期间穿过低输送量区域。在一些实施方式中,特别是如果没有相邻于高输送量区域的低输送量区域,声辐射力将微泡从颅骨的高输送量区域扫到中等输送量区域;高于第一阈值量的超声能量并不期望穿过中等输送量区域,但高于第二阈值量的超声能量被期望穿过中等输送量区域。
在一些实施方式中,该方法包括产生超声操纵波束以及使用操纵波束来在微泡上施加应力以引起其塌陷。可通过相对于微泡物理地移动换能器元件或通过调节换能器元件的相对相位来产生超声操纵波束。
可至少部分地基于物理模型、所传输或反射的超声波的测量、使用成像装置获取的图像和/或超声波相对于患者的颅骨的入射角来识别高输送量区域。可至少部分地基于换能器元件的几何结构及它们相对于颅骨的位置和方向以及目标区域的位置来计算入射角。此外,可至少部分地基于从微泡反射的超声波和/或由成像装置获取的图像的分析来监控微泡。微泡的量可被定义为其绝对数量或每单位体积的浓度。
在另一方面中,本发明涉及包括具有多个换能器元件的超声换能器和控制器的超声治疗系统。在各种实施方式中,控制器被配置成:(a)根据治疗计划来操作换能器以将超声波聚焦到患者的颅骨内的组织上;(b)至少基于治疗计划和换能器相对于颅骨的方向来识别颅骨的高输送量区域,在治疗计划的执行期间,高于第一阈值量的超声能量被期望穿过高输送量区域;(c)在治疗计划的执行期间针对微泡监控高输送量区域;以及(d)如果在高输送量区域中的微泡的量超过阈值,则使用超声波来减小微泡的量。在一些实施方式中,系统还包括耦合到控制器的检测器装置,其用于测量微泡的量。此外,系统可包括耦合到控制器的成像器,其用于测量微泡的量。
控制器还可被配置成操作换能器以产生具有声辐射力的聚焦(例如点聚焦或线聚焦)并使用声辐射力来向高输送量区域外部扫除微泡。例如,声辐射力可将微泡从颅骨的高输送量区域扫到低输送量区域;高于第二阈值量(一般小于第一阈值量)的超声能量并不期望在治疗计划的执行期间穿过低输送量区域。在一些实施方式中,声辐射力将微泡从颅骨的高输送量区域扫到中等输送量区域;高于第一阈值量的超声能量并不期望穿过中等输送量区域,但高于第二阈值量的超声能量被期望穿过中等输送量区域。
在一些实施方式中,控制器还被配置成产生超声操纵波束以在微泡上施加应力并由此引起其塌陷。控制器被配置成相对于微泡物理地移动换能器元件,以便产生超声操纵波束。可替换地,控制器被配置成调节换能器元件的相对相位,以便产生超声操纵波束。
此外,控制器可被配置成至少部分地基于物理模型来识别高输送量区域。可替换地,系统可包括耦合到控制器的检测器装置,其用于测量聚焦超声波或从患者的颅骨反射的超声波,控制器被配置成基于检测器装置的测量来识别高输送量区域。在一个实施方式中,系统包括耦合到控制器的成像器,其用于获取图像,且控制器被配置成基于图像来识别高输送量区域。在另一实施方式中,控制器还被配置成至少部分地基于换能器元件的几何结构及它们相对于颅骨的位置和方向以及组织的位置来计算超声波相对于患者的颅骨的入射角。此外,控制器可被配置成将微泡的量定义为其绝对数量或每单位体积的浓度。
如在本文使用的,术语“基本上”意指±10%,且在一些实施方式中为±5%。在整个该说明书中对“一个例子”、“例子”、“一个实施方式”或“实施方式”的引用意指结合该例子所述的特定特征、结构或特性被包括在当前技术的至少一个例子中。因此,短语“在一个例子中”、“在例子中”、“一个实施方式”或“实施方式”在整个该说明书中的不同地方的出现并不一定都指同一例子。此外,在本技术的一个或多个例子中,特定的特征、结构、例程、步骤或特性可以用任何适当的方式组合。在本文提供的标题仅为了方便,且并不意欲限制或解释所主张的技术的范围或含义。
附图说明
在附图中,在不同的视图中相似的附图标记通常指相同的部件。此外,附图不一定按比例,而是通常强调说明本发明的原理。在下面的描述中,参考以下附图描述了本发明的各种实施方式,其中:
图1示出根据各种实施方式的聚焦超声系统;
图2a示意性示出人类颅骨的组织层;
图2b描绘根据各种实施方式被定义为多个区域的颅骨;
图2c和2d描绘根据各种实施方式将每个颅骨区域表征为低输送量区域、中等输送量区域或高输送量区域;
图3a-3c描绘根据各种实施方式的执行微泡减少程序的换能器元件的各种配置;
图4a描绘根据各种实施方式的用于将微泡从一个颅骨区域扫到另一颅骨区域内的方法;
图4b描绘根据各种实施方式的用于引起微泡塌陷的方法;以及
图5是示出根据各种实施方式的用于最小化对超声波的微泡干扰的方法的流程图。
具体实施方式
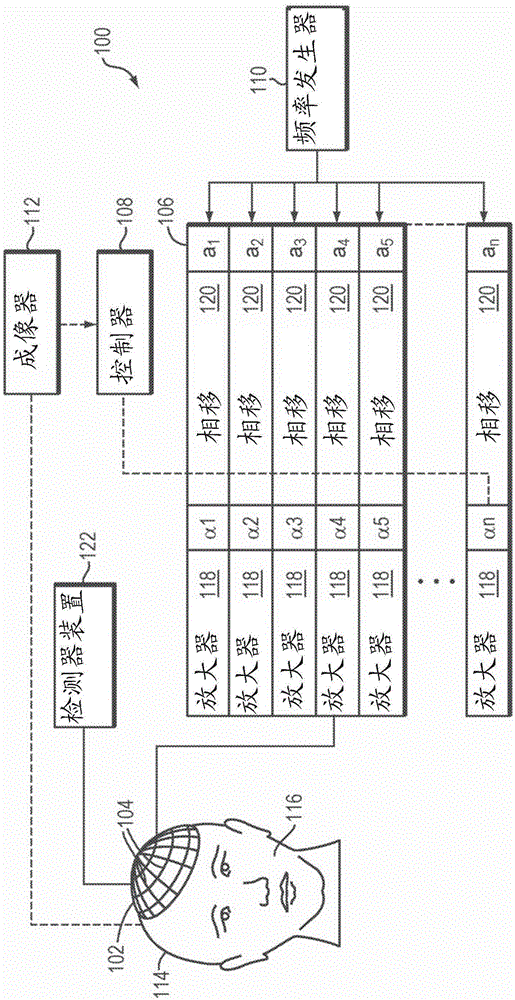
图1示出用于通过颅骨将超声波聚焦到患者的大脑内的示例性超声治疗系统100。然而,本领域中的普通技术人员将理解,本文所述的超声系统100可应用于人体的任何部分。在各种实施方式中,系统100包括换能器元件104的相控阵102、驱动相控阵102的波束形成器106、与波束形成器106通信的控制器108、以及向波束形成器106提供输入电子信号的频率发生器110。在各种实施方式中,系统还包括用于确定患者116的颅骨114的解剖特性的成像器112,例如磁共振成像(mri)装置、计算机断层扫描(ct)装置、正电子发射断层扫描(pet)装置、单光子发射计算机断层扫描(spect)装置或超声波扫描装置。
阵列102可具有适合于将它放置在颅骨114或除了颅骨以外的身体部分的表面上的弯曲(例如球形或抛物线)形状,或可包括一个或多个平面或以其他方式成形的区段。它的尺寸可根据应用在几毫米和数十厘米之间改变。阵列102的换能器元件104可以是压电陶瓷元件,且可安装在硅酮橡胶或适合于抑制在元件104之间的机械耦合的任何其它材料中。也可使用压电复合材料或通常能够将电能转换成声能的任何材料。为了确保到换能器元件104的最大功率传输,元件104可被配置为用于在50ω处的电共振,匹配输入连接器阻抗。
换能器阵列102耦合到波束形成器106,其驱动各个换能器元件104,使得它们共同产生聚焦超声波束或场。对于n个换能器元件,波束形成器106可包含n个驱动电路,每个驱动电路包括放大器118和相位延迟电路120或由放大器118和相位延迟电路120组成;驱动电路驱动换能器元件104之一。波束形成器106从频率发生器110接收一般在从0.1mhz到1.0mhz的范围内的射频(rf)输入信号,频率发生器110可以例如是从stanfordresearchsystems可得到的modelds345发生器。输入信号可以针对波束形成器106的n个放大器118和延迟电路120分成n个通道。在一些实施方式中,频率发生器110与波束形成器106集成在一起。射频发生器110和波束形成器106被配置成以同一频率但以不同的相位和/或不同的振幅驱动换能器阵列102的单独换能器元件104。
由波束形成器106施加的放大或衰减因子α1-αn和相移a1-an用来通过患者的颅骨114将超声能量传输并聚焦到患者大脑的所选择区域上,并考虑在颅骨114和软脑组织中引起的波畸变。使用控制器108来计算放大因子和相移,控制器108可通过软件、硬件、固件、硬连线或其任何组合来提供计算功能。例如,控制器108可利用使用软件以常规方式且在没有过度实验的情况下编程的通用或专用数字数据处理器,以便确定得到期望聚焦或任何其它期望空间场图案所必需的相移和放大因子。在某些实施方式中,计算基于关于颅骨114的特性(例如结构、厚度、密度等)以及它们对声能的传播的影响的详细信息。可从如下面进一步描述的成像器112得到这样的信息。图像采集可以是三维的,或可替换地,成像器112可提供适合于重构颅骨114的三维图像的一组二维图像,厚度和密度可从三维图像推断出。可在成像器112中、在控制器108中或在单独的装置中实现图像操纵功能。
可在本发明的范围内以各种方式修改系统100。例如,对于诊断应用,系统还可包括检测器装置122,其测量所传输或反射的超声,并且可向控制器108提供它接收的信号以用于进一步的处理。反射和传输信号也可用作对波束形成器106的相位和振幅调节的反馈。系统100可包含用于相对于患者的颅骨114布置换能器元件104的阵列102的定位器。为了将超声治疗应用于除了大脑以外的身体部分,换能器阵列102可采用不同的(例如圆柱形)形状。在一些实施方式中,换能器元件104可移动和可旋转地被安装,提供可被利用来改进聚焦特性的机械自由度。这样的可移动换能器可由常规致动器调节,常规致动器可由控制器108的部件或由单独的机械控制器驱动。
参考图2a,一般人类颅骨114具有多个组织层,包括外层202、骨髓层204、以及内层或皮层206;颅骨104的每层可以在形状、厚度和密度方面是高度不规则的,但对患者是唯一的。作为结果,当从系统100发射的超声波遇到颅骨114时,入射声能的部分可根据波相对于颅骨114的入射角
参考图2b,颅骨114可被定义为多个区域216,每个区域可与特定的换能器元件104或一组元件有关或相对应。在各种实施方式中,可基于关于换能器元件104的几何结构及它们相对于颅骨区域216的位置和方向以及目标区域214的位置的信息来计算从每个换能器元件104(或每组元件)传输到每个颅骨区域216上的声波218的入射角
在一些实施方式中,由使用成像器112获取的图像来确定沿着每个所估计的路径220的颅骨区域202的结构不均匀性。例如,ct成像可用于提取颅骨区域216的解剖特性,例如颅骨厚度、局部骨密度和/或包括相对于颅骨的表面区域的法线的方向或几何特征。例如在美国专利公开no.2010/0179425中描述了创建颅骨区域216的局部几何模型或映射的方法,该专利公开的全部公开内容通过引用包含于此。此外,可使用可在颅骨114的微结构水平处量化的指示器来表征每个颅骨区域216的结构不均匀性;基于在使用成像器112获取的图像中测量的颅骨密度来确定指示器。该方法在美国专利公开no.2016/0184026中被描述,该专利公开的全部公开内容通过引用包含于此。
在各种实施方式中,关于声波相对于颅骨区域216的入射角、经过颅骨区域的声波218的波束路径220和每个颅骨区域216的特性的信息可用于估计从每个颅骨区域216的表面反射的声能以及在每个颅骨区域216内衰减和/或吸收的能量。基于该估计,可计算在经过它的相应颅骨区域216之后的从每个换能器元件104(或每组换能器元件)贡献的在聚焦区处的声能。参考图2c,如果来自换能器元件的能量贡献低于阈值,则对应于其的颅骨区域216被表征为低输送量区域(lta);如果来自换能器元件的贡献高于阈值,则对应于其的颅骨区域216被表征为高输送量区域(hta)。在一些实施方式中,如果对应于颅骨区域216的能量贡献与阈值相差小于某个百分比(例如10%、5%或1%),则颅骨区域216被表征为中等输送量区域(ita)。在这种情况下,具有高于该百分比加上阈值的相应能量贡献的颅骨区域被表征为hta,且具有低于阈值减去该百分比的相应能量贡献的颅骨区域被表征为lta。例如,假设阈值是x%,则具有高于(x+5)%的相关能量贡献的颅骨区域被表征为hta,具有在(x±5)%之间的相关能量贡献的颅骨区域被表征为ita,以及具有低于(x–5)%的相关能量贡献的颅骨区域被表征为lta。每个颅骨区域的表征(即,它是lta、ita还是hta)可存储在系统存储器中,并在聚焦超声程序之前或期间被取回以最小化在hta颅骨区域中产生和/或累积的微泡。
可替换地,参考图2d,颅骨区域被表征为lta区域、ita区域或hta区域可基于由检测器装置122和/或换能器元件104测量的所传输或反射的超声波。例如,检测器装置122可测量来自每个颅骨区域216的超声反射并将因而得到的信号传输到控制器108以得到与反射相关联的信息(例如强度)。可选择阈值(例如50%),以使得高于其的反射强度指示沿着波束路径的相关颅骨区域216是反射的且因而被表征为lta区域。同样,如果反射强度低于阈值,则沿着波束路径的颅骨区域216被表征为hta区域。如果与阈值(例如50%)的百分比(例如5%)偏差用于定义ita区域,则具有在45%和55%之间的反射强度的颅骨区域被表征为ita,具有高于55%的反射强度的颅骨区域被表征为lta,以及具有低于45%的反射强度的颅骨区域被表征为hta。
可替换地,换能器元件104可拥有传输和检测能力。参考图3a,在一个实施方式中,每个单独的换能器元件104在将超声信号传输到颅骨和接收从其反射的超声信号之间交替。例如,所有换能器元件104可基本上同时地将超声波传输到颅骨并随后从其接收回波信号。参考图3b,在一个实施方式中,换能器阵列被分成多个子区域302;每个子区域302包括换能器元件104的一维或二维阵列(例如行或矩阵)。子区域302可以是单独地可控制的,即,它们各自能够(i)以独立于其它子区域302的振幅和/或相位的振幅和/或相位发射超声波,以及(ii)测量从颅骨反射的波。在一个实施方式中,子区域302被分配彼此不同的振幅和/或相位,并一次一个被激活以将超声波传输到颅骨并接收来自颅骨的反射。参考图3c,在另一实施方式中,换能器阵列被分成传输区域304和接收区域306;在传输区域304中的换能器元件传输超声波,而在接收区域306中的换能器元件接收反射波。所接收的反射波然后被传输到控制器108以用于确定颅骨区域的表征(例如hta、ita或lta)。传输区域304和接收区域306可在换能器阵列的各种位置处以不同的图案和形状被配置。在一个实现中,入射角
在聚焦超声程序期间(例如在目标区域的治疗期间),例如由于从由传播的超声波产生的负压力和/或由当加热的液体破裂并充满气体/蒸汽时引起的应力,小气泡(或具有范围从0.1μm到几百μm的直径的“微泡”)可在组织中产生。微泡倾向于累积在颅骨的界面附近。使用例如由成像器112获取的图像来监控在颅骨区域中的微泡的形成和/或量。可替换地,检测器装置122可使用来自微泡的反射来检测微泡;这是因为微泡包封气体且可因此反射超声波。
参考图4a,在各种实施方式中,如果在hta颅骨区域402中的微泡的数量或浓度高于预定阈值且这个hta区域402邻近lta区域404,则控制器108操作波束形成器106,以便减小在区域402中的气泡群。在一个实施方式中,控制器108使波束形成器106向换能器元件104提供驱动信号以在包括累积的微泡的位置处产生聚焦(例如点聚焦、线聚焦或任何适当形状的聚焦)以将足够的累积的微泡从hta区域102扫到邻近的lta区域404以减小低于阈值的微泡的量。每个hta区域可对应于不同的lta区域;多于一个hta区域可共享同一lta区域。此外,如果hta区域406不邻近任何lta区域,则在其中累积的微泡可逐步移动,在到达最近的lta410之前穿过中间的hta408。可替换地,控制器108可使换能器元件104产生聚焦,其在缺乏邻近hta区域406的lta区域的情况下将微泡从hta区域406扫到邻近的ita区域412。
应理解,如在本文使用的术语“点聚焦”和“线聚焦”并不指在严格数学意义上的点和线,而是指分别近似于点或线的聚焦形状。因此,点聚焦的强度分布(其可例如采取二维高斯分布的形状)可由在几个声波长的数量级上的焦平面的两个维度中的半宽度表征,而线聚焦的强度分布(其可例如具有垂直于线的一维高斯分布图)沿着线的方向延伸,但可具有垂直于其的在仅几个声波长的数量级上的半宽度。
在各种实施方式中,聚焦通过将声辐射力施加到微泡而引起微泡的移动。声辐射力由从来自颅骨的吸收、散射或反射产生的传播的超声波的能量密度和动量的变化产生。通常,声辐射力的振幅与超声强度成比例。因此在一个实现中,指向微泡的超声波束的强度逐渐增加,直到所产生的声辐射力足以操作和移动微泡为止。在另一实施方式中,在微泡的操纵之前,如上所述测量和/或预测颅骨的特性(例如吸收系数);可基于其来计算足以移动微泡的超声波束的强度。在各种实施方式中,控制器108被配置成自动调节超声强度以当在hta区域中的微泡量高于阈值时开始微泡减少过程。因为从hta颅骨区域产生的能量衰减明显小于从lta区域产生的能量衰减,最小化在hta区域中的微泡可减小由微泡引起的反射和/或散射,并从而增加在聚焦区222处可得到的声能。此外,可最小化从微泡空化产生的健康组织的不期望的损伤。在一些实施方式中,从与微泡被扫到的lta区域和/或ita区域相关联的换能器元件发射的波束强度作为结果而减小;这可避免来自lta和/或ita区域的由其中的微泡引起的不期望的超声反射和/或散射,并允许在这些区域中的波束强度减小。也就是说,因为来自lta和/或ita区域的在聚焦处的能量贡献总之相对小,减小在这些区域中的波束强度可能不会明显降低在聚焦区222处可得到的声能。
可替换地,参考图4b,当微泡的累积量高于预定阈值(使用例如来自微泡的反射被测量)时,操纵超声波束被创建以在微泡上施加应力并从而引起微泡塌陷。操纵波束可以用离散或连续方式跨越具有微泡的区域扫描,直到相当大部分的微泡塌陷为止。通常,所产生的微泡以被输送的超声波的频率振荡,并具有由其共振频率确定的平衡半径:
其中f0、p0和r0分别代表共振频率、环境压力和平衡微泡半径,且σ、κ和ρ分别代表在液体-气体界面处的表面张力、气体的多变指数和液体的密度。因为微泡的平衡半径一般是几微米,所以在平衡半径和共振频率之间的关系可被近似为:
f0~r0-1。
因此,具有1mhz的共振频率的微泡的平衡半径是大约1μm,且具有0.5mhz的共振频率的微泡的平衡半径是大约2μm。具有小于平衡半径的一半的半径的微泡可能是不稳定的,并引起惯性空化。
操纵波束的频率可与产生微泡的超声波的频率相同,或可替换地,它可被减小,以便增加微泡塌陷。例如,当操纵超声波束的频率是f0时,可引起具有低于r0/2的半径的微泡塌陷。然而,通过将操纵超声波束的频率减小到f0/2,微泡的平衡半径增加到2r0;这表明大量的微泡(即,具有低于r0的半径的微泡)可能塌陷。在一些实施方式中,超声操纵波束在微泡上施加足够的应力以用如上所述的方式将微泡从hta区域扫到lta区域或ita区域内。
可机械或电气地产生超声操纵波束。在一个实施方式中,换能器元件104相对于微泡物理地移动以机械地操纵它们。当换能器阵列实质上大于颅骨(例如在直径上大约30cm或更大)以提供足够的移动自由时,机械操纵是特别合适的。在另一实施方式中,使用从由换能器元件发射的声能的相对相位的调节产生的电子操纵。由这样的电子操纵提供的控制的程度与单独的换能器元件的尺寸成反比。例如,使换能器元件的尺寸在由阵列发射的声能的波长的数量级上且优选地小至波长的一半通常是合乎需要的,以便有效地操纵超声波束。因此,在具有在两毫米(2mm)的数量级上的波长的声能的情况下,如常常用于聚焦超声系统的,具有类似尺寸、即在横截面上是大约两毫米或更小的换能器元件对有效的操纵是需要的。电子操纵是优选的,因为没有换能器阵列的物理移动且这样的操纵技术是相对快速的。
在各种实施方式中,上述微泡减少过程(通过将微泡从hta区域扫到lta区域和/或在hta区域中引入微泡塌陷)可在同一hta区域中重复,直到累积的微泡低于阈值为止;再次,这可使用由成像器112获取的图像或由检测器装置112检测的反射信号来验证。此外,微泡减少过程可反复地应用于所有(或至少一些)hta颅骨区域,直到在其中累积的微泡被最小化为止。随后,控制器108可以使具有预定治疗参数的换能器元件104通电以将超声波传输到目标区域以开始或继续治疗。在一个实施方式中,基于如上所述的颅骨的所测量和/或预测的特性来预先确定治疗参数(包括换能器元件104的频率、振幅和/或相位和超声处理时间),以便产生具有期望聚焦特性的聚焦区。在一些实施方式中,对应于lta颅骨区域的换能器元件被去激活,且只有对应于hta颅骨区域的换能器元件在治疗期间被激活;这可在聚焦区中有利地产生足够的声能以用于治疗目的,同时避免损伤沿着lta颅骨区域的路径定位的非目标组织。
在另一实施方式中,在将超声传输到目标区域以开始或重新开始治疗之前,患者的颅骨的特性通过测量来自其的超声反射或分析由成像器112获取的图像来被评估;这可增加治疗效率和准确度,特别是当用于确定hta区域和lta区域的颅骨特性基于模型预测而被获取时。
图5是示出根据各种实施方式的用于当超声波经过组织(例如患者的颅骨)以到达目标区域时最小化对超声波的微泡干扰的方法的流程图500。在第一步骤502中,使用预测物理模型和/或来自颅骨的所传输和/或反射的超声波的测量来获取颅骨的特性。在第二步骤504中,在颅骨上限定多个颅骨区域,且基于所获取的颅骨特性和超声波相对于颅骨区域的入射角来将每个颅骨区域表征为hta区域或lta区域。在第三步骤506中,将超声波传输到目标区域,且监控在hta颅骨区域中产生或累积的微泡。如果微泡的量高于预定阈值,则将如上所述的微泡减少过程应用于hta区域(步骤508)。如果微泡的量(数量或浓度)低于阈值,则对目标区域的治疗开始或继续(步骤510)。步骤506、508重复,直到在hta颅骨区域中的微泡的量低于阈值为止。此外,步骤506、508可应用于多于一个hta颅骨区域。因此,这种方法允许在hta颅骨区域中产生或累积的微泡的数量减小,以便增加超声治疗的效率并避免从微泡空化产生的不期望的组织损伤。
通常,可在用硬件、软件或两者的组合实现的一个或多个模块中构造如上所述的用于执行微泡干扰的最小的功能,包括获取患者的颅骨的特性(使用预测物理模型和/或来自颅骨的超声传输和/或反射的测量),将颅骨定义为多个颅骨区域,将每个颅骨区域表征为hta或lta,监控在hta中的微泡,执行微泡减少过程和/或开始或重新开始超声治疗,而不管是否被集成在成像器的控制器和/或超声系统内或由单独的外部控制器提供。对于功能被提供为一个或多个软件程序的实施方式,可以用多种高级语言,例如fortran、pascal、java、c、c++、c#、basic、各种脚本语言和/或html中的任一种来写程序。此外,可以用指向存在于目标计算机上的微处理器(例如控制器)的汇编语言实现软件;例如,如果软件被配置成在ibmpc或pc克隆上运行,则可以用intel80x86汇编语言实现软件。软件可体现在制造物品上,包括但不限于软盘、闪存盘、硬盘、光盘、磁带、prom、eprom、eeprom、现场可编程门阵列或cd-rom。可使用例如一个或多个fpga、cpld或asic处理器来实现使用硬件电路的实施方式。
此外,在本文使用的术语“控制器”广泛地包括用于执行如上所述的任何功能的所有必要的硬件部件和/或软件模块;控制器可包括多个硬件部件和/或软件模块,且功能可在不同的部件和/或模块之间扩展。
上面描述了本发明的某些实施方式。然而明确地提到,本发明不限于那些实施方式;而是,对本文明确描述的内容的添加和修改也被包括在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!