用于产生小梁纤维的方法与装置与流程
本申请要求在2016年11月28日提交的临时申请no.62/426,995的优先权,该临时申请通过引用整体结合至此。
本申请涉及用于产生新生(denovo)小梁纤维的医疗装置与方法。更特定地,本发明涉及产生小梁纤维以微创方式修复心脏的装置与方法。
背景技术:
成百上千万的人受害于衰弱的或受损的心脏,导致削弱的心脏输出。例如,一些人可受害于扩张型心肌炎,导致薄化、弱化的心室壁。该弱化的心室壁可无法有效地泵血。其他人可具有来自心脏瓣叶不对齐的间隙,导致返流。心脏瓣叶的返流也可导致较为低效的泵血。又一些人可受害于来自心肌缺血或心肌梗死的对于心室壁的损害。受损心室壁通常用纤维化来治愈,使用无功能性结缔瘢痕组织来替代失去的心脏细胞(传导性或收缩性)。心脏细胞丢失且用瘢痕组织来替代是次优的修复。此举通常导致其中心脏可不能有效泵血的状况。这些疾病中的任一项可导致受损的心脏输出。
现有的治疗心脏疾病的方法,诸如上述那些、以及其他方法,可能是高度侵入性的。侵入性治疗可包括,例如,需要开胸手术的植入人工心脏泵、或冠状动脉搭桥(cabg)。这些治疗经常要求具有使用心脏药物的药物性介入。最终,这些治疗可导致小于最佳临床效果。所需要的是以微创方式修复心脏的途径,调节并放大固有修复机制。
技术实现要素:
示例1是在用于在心脏的心室内产生小梁纤维的装置。该装置包括衬底以及连接至该衬底的第一纤维锚。该衬底由非刚性材料制成。
示例2是示例1的该装置,其中该装置被配置为整体地被包含在心室内。
示例3是示例1或2中任一个的装置,其中该衬底包括电纺纤维的肋部。
示例4是示例1-3中任一项的装置,其中该衬底由如下项中的至少一项制成:聚氨酯聚合物、聚酯聚合物、硅酮聚合物、苯乙烯-异丁烯-苯乙烯嵌段共聚物、膨化聚四氟乙烯聚合物、胶原、透明质酸、纤维素、纤维蛋白、纤维蛋白原和纤维连接蛋白。
示例5是示例1-4中任一项的装置,其中该衬底包括设置于该衬底上的至少一个电极。
示例6是示例1或2中任一项的装置,其中该衬底包括形成至少一个电极的至少一个螺旋缠绕的导电线圈。
示例7是示例5或6中任一项的装置,其中该装置被配置为由电引线连接至心脏外部的脉冲发生器和电源,该电引线将该脉冲发生器和该电源连接至该至少一个电极从而在该至少一个电极处生成多个电压脉冲。
示例8是示例5或6中任一项的装置,其中该装置还包括脉冲发生器和电源,该脉冲发生器和电源电连接至该至少一个电极从而在该至少一个电极处生成多个电压脉冲。
示例9是示例1-8中任一项的装置,还包括连接至该衬底的第二组织锚,该第二组织锚与所述第一组织锚相对。
示例10是示例1-9中任一项的装置,还包括设置于该衬底周围的至少一个药物洗脱环,该药物洗脱环包括消炎或免疫抑制生物或药物制剂。
示例11是用于在心脏的心室内产生至少一个小梁纤维以修复心脏的方法。该方法包括将装置整体插入心脏内,该装置包括柔性衬底以及连接至该衬底的至少一个组织锚;通过将该至少一个组织锚固定至心内膜来锚定该所插入的装置,该衬底与该心内膜不接触;且将所锚定的装置保持在心脏内达一时间至少足以在该衬底与该心内膜之间形成至少一个小梁纤维,其中该衬底和至少一个小梁纤维被设置为修复心脏。
示例12是示例11的方法,其中将该装置保持在心脏内包括在该衬底上的电极与该心内膜之间产生电势。
示例13是示例11或12的方法,其中形成多个小梁纤维,其中该多个小梁纤维的第一部分被设置于修复心脏且该多个小梁纤维的第二部分不被设置于修复心脏,该方法还包括切断该多个小梁纤维的第二部分离开该心内膜,切断该多个小梁纤维的第二部分离开该衬底,且从心脏移除该多个小梁纤维的第二部分。
示例14是示例11-13中任一项的方法,其中该装置被插入心脏的右心室内。
示例15是示例11-14中的任一项的方法,其中将该装置保持在心脏内包括从设置于围绕该衬底的药物洗脱环洗脱消炎或免疫抑制生物或药物制剂。
示例16是用于在心脏的心室内产生小梁纤维的装置。该装置包括衬底以及连接至该衬底的第一组织锚。该衬底由非刚性材料制成。该装置被配置为整体地包含在心室内。
示例17是示例16的装置,其中该衬底包括电纺纤维的肋部。
示例18是示例16的装置,其中该衬底由如下项中的至少一项制成:聚氨酯聚合物、聚酯聚合物、硅酮聚合物、苯乙烯-异丁烯-苯乙烯嵌段共聚物、膨化聚四氟乙烯聚合物、胶原、透明质酸、纤维素、纤维蛋白、纤维蛋白原和纤维连接蛋白。
示例19是示例16的装置,其中该衬底包括至少一个电极。
示例10是示例19的装置,其中该装置被配置为由电引线连接至心脏外部的脉冲发生器和电源,该电引线将该脉冲发生器和该电源连接至该至少一个电极从而在该至少一个电极处生成多个电压脉冲。
示例21是示例19的装置,其中该装置还包括脉冲发生器和电源,该脉冲发生器和电源电连接至该至少一个电极从而在该至少一个电极处生成多个电压脉冲。
示例22是示例16的装置,还包括连接至该衬底的第二组织锚,该第二组织锚与所述第一组织锚相对。
示例23是示例16的装置,还包括围绕该衬底所设置的至少一个药物洗脱环,该药物洗脱环包括类固醇。
示例24是用于在心脏的心室内产生小梁纤维的装置。该装置包括衬底以及连接至该衬底的第一组织锚。该衬底由至少一个螺旋缠绕的导电线圈制成。该装置被配置为整体地包含在该心室内。
示例25是示例24的装置,其中该至少一个螺旋缠绕的导电线圈形成电极。
示例26是示例25的装置,其中该装置被配置为由电引线连接至心脏外部的脉冲发生器和电源,该电引线将该脉冲发生器和该电源连接至该至少一个电极从而在该至少一个电极处生成多个电压脉冲。
示例27是示例25的装置,其中该装置还包括脉冲发生器和电源,该脉冲发生器和电源电连接至该至少一个电极从而在该至少一个电极处生成多个电压脉冲。
示例28是用于在心脏的心室内产生至少一个小梁纤维以修复心脏的方法。该方法包括将装置整体插入心脏的心室内,该装置包括柔性衬底以及连接至该衬底的至少一个组织锚;通过将该至少一个组织锚固定至心内膜来锚定该所插入的装置,该衬底与该心内膜不接触;且将所锚定的装置保持在心脏内达一时间至少足以形成在该衬底与该心内膜之间延伸的至少一个小梁纤维,该至少一个小梁纤维包括心肌细胞,其中该衬底和该至少一个小梁纤维被设置为修复心脏。
示例29是示例28的方法,其中将该装置保持在心脏内包括在位于该衬底上的电极和该心内膜之间产生电势。
示例30是示例29的方法,其中该电势被产生为一系列电脉冲。
示例31是示例28的方法,其中在该装置已经被保持在心脏达一时间至少足以产生在该衬底和该心内膜之间延伸的多个小梁纤维后,该装置留存在心脏内。
示例32是示例28的方法,其中形成多个小梁纤维,其中该多个小梁纤维的第一部分被设置于修复心脏且该多个小梁纤维的第二部分不被设置于修复心脏,该方法还包括切断该多个小梁纤维的第二部分离开该心内膜,切断该多个小梁纤维的第二部分离开该衬底,且从心脏移除该多个小梁纤维的第二部分。
示例33是示例27的方法,其中将该装置锚定在心脏内包括将第一组织锚和第二组织锚锚定至心内膜。
示例34是示例27的方法,其中该装置被插入心脏的右心室内。
示例35是示例27的方法,其中将该装置保持在心脏内包括从设置于衬底周围的药物洗脱环洗脱类固醇。
尽管公开了多个实施例,但从下述详细描述中对于本领域技术人员而言本发明的很多其他实施例都将是显而易见的,下述详细描述示出并描述了本发明的说明性实施例。因此,附图和详细描述都被看作本质上是说明性的而非限制性的。
附图简述
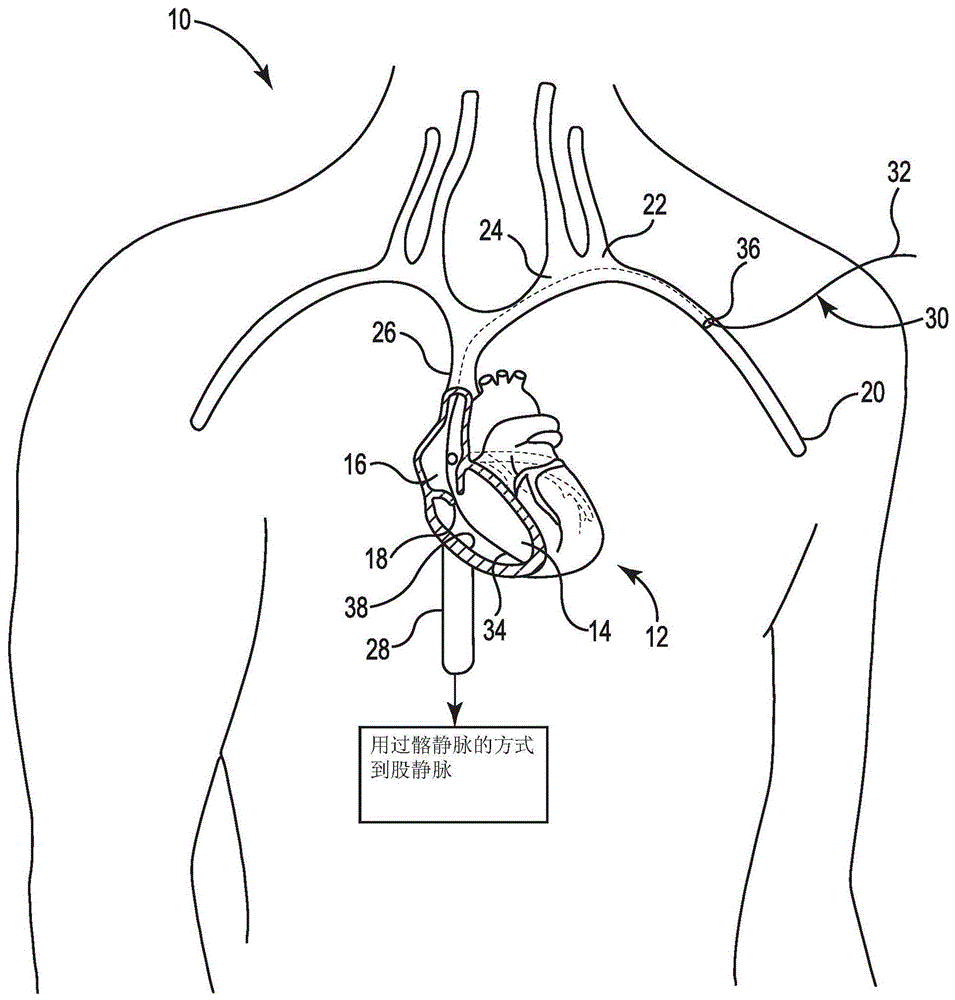
图1是根据本公开的各实施例的示意图,示出用于模仿至少一个新生(denovo)小梁纤维的生长的装置的植入。
图2是根据本公开的各实施例的,患者心脏的一部分的示意图,进一步示出图1的所植入的装置。
图3是包含心肌细胞的新生小梁纤维的示意性截面图。
图4是根据本公开的各实施例的图1的心脏12的放大的示意图,示出用于刺激至少一个小梁纤维的生长的另一个装置。
图5是根据本公开的各实施例的图1的心脏12的放大的示意图,示出用于刺激至少一个小梁纤维的生长的另一个装置。
图6是根据本公开的各实施例的图1的心脏12的放大的示意图,示出用于刺激至少一个小梁纤维的生长的另一个装置。
图7a和7b是根据本公开的各实施例的图6的心脏的放大的示意图,示出不必要的心室纤维的移除。
图8是在如图7a和7b中所示在不必要的心室纤维的移除后图6的心脏的示意图。
图9是根据本公开的各实施例的图1的心脏12的放大的示意图,示出用于刺激至少一个小梁纤维的生长的另一个装置。
同时本发明能修改为各种变型和可选方式,通过附图中的示例的方式示出特定实施例且在下文进行详细描述。然而,并不意图于将本发明限制于所描述的具体实施例。相反,本发明意在覆盖落在由所附权利要求所限定的本发明的范围内的所有修改、等效物、和替代物。
具体实施例
图1是根据本公开的各实施例,示出用于在心脏内产生至少一个小梁纤维以帮助修复心脏的装置的植入。该至少一个小梁纤维包括新的收缩性或传导性心脏肌肉组织,或心肌组织。如下所述产生的该小梁纤维包括在心脏腔室内新生生长的新的心肌细胞,而且不是简单重组的之前存在的心脏组织。该装置,与所附着的至少一个小梁纤维,一起,通过连接至包围心室的各种结构,可修复心脏,从而强化和/或重塑心脏,包围心室的各种结构诸如心室壁、隔膜、瓣膜。在一些实施例中,该新生小梁纤维可用作没有这种解剖特征的那些人的调节带,从而限制由于波动的静脉回流引起的突然扩张,帮助同步右心室自由壁去极化以治疗传导延迟,和/或提供侧支血流。
图1是示出用于在心脏内产生至少一个小梁纤维的装置的植入的示意图。图1示出包括心脏12的患者10。该心脏12包括右心室14、右心房16、以及将该右心房16与该右心室14间隔开的三尖瓣18。还如图1中所示的是将血液引导至心脏12的静脉,包括左辅助静脉20,其流入左锁骨下静脉22,其流入左头臂静脉24。左头臂静脉24流入上腔静脉26,上腔静脉26将血液从身体的上部提供至右心房16。通过髂外静脉(未示出)和髂总静脉(未示出)的方式,下腔静脉28从股静脉(未示出)接收血液。下腔静脉28也将血液提供给右心房16。
图1示出具有近端32和远端34的导管30。在一些实施例中,该导管30可经皮通过血管进入点36进入左辅助静脉20。远端34可被操作通过左辅助静脉20、左锁骨下静脉22、左肱头静脉24、上腔静脉26、并在右心房16处进入心脏12。在其他实施例中,该导管30可经皮进入股动脉。远端34可被操作通过髂外静脉、髂总静脉、下腔静脉28、并在右心房16处进入心脏12。在又一些实施例中,远端34可被操作从右心房16,通过三尖瓣18,并进入右心室14。导管30可包括从近端32延伸至远端34的至少一个内腔(未示出),器械(未示出)通过该内腔可被用于将装置植入用作右心室14的心室壁的内衬的心内膜38内,装置诸如如下参看图2描述的用于在心脏12内产生至少一个小梁纤维的装置40。如上所述,以微创方式完成装置40的植入。
图2是图1的心脏12的放大的示意图。如图2中所示,心脏12还包括左心室42、左心房44、心室壁46、以及位于右心室14和左心室42之间的隔膜48。图2示出装置40,根据一些实施例,被植入至心室壁46的心内膜38内。如图2中所示,装置40包括组织锚50和衬底52。组织锚50可包括连接部54和固定装置56。连接部54将固定装置56连接至衬底52,将组织锚50连接至衬底52。
在一些实施例中,衬底52是柔性、非刚性肋部或片状物,至少部分地由生物可兼容聚合物制成,例如聚氨酯聚合物、聚酯聚合物、硅酮聚合物、苯乙烯-异丁烯-苯乙烯嵌段共聚物或膨胀聚四氟乙烯聚合物。可选地或附加地,衬底52可至少部分地由有机物质制成,例如胶原、透明质酸、纤维素、纤维蛋白、纤维蛋白原或纤维连接蛋白。在一些实施例中,衬底52可以是固状物或可以是生物可兼容的聚合物和/或有机物质的电纺网。在一些实施例中,组织锚50的连接部54可由上述生物可兼容的聚合物或有机物质中的任一项制成。固定装置56可以是被动固定装置,诸如图2中所示的尖齿,或主动固定装置,诸如钩子或螺旋形配置从而钻入心脏壁,诸如心室壁46或隔膜48。
如图2中所示。组织锚50的固定装置56被固定至心内膜38和心室壁46内从而将该装置40锚定在心脏12的右心室14内,以使得衬底52与心内膜38间隔开。当装置40被保持在心脏12内时,在心内膜38与衬底52之间形成至少一个新生小梁纤维。在图2所示的实施例中,形成了多个小梁纤维58。在图2所示实施例中,在衬底52和心室壁46之间延伸的小梁纤维58以及在衬底52和隔膜48之间延伸的小梁纤维58,使用新的收缩性或传导性心脏肌肉组织用于将心室壁46连接至隔膜。如此设置后,衬底52和具有其收缩性或传导性心脏肌肉组织的小梁纤维58可增强心室壁从而修复由于心室壁46变薄或者心室壁46内的梗塞引起的损伤。
图3是小梁纤维58的示意性截面图。在该特定的所说明的实施例中,小梁纤维58包括血管60、多个心肌细胞62、细胞外基质层55、弹性蛋白层56、外胶原蛋白层58和内皮细胞层59。心肌细胞62可被设置在该小梁纤维58的核心处且可被取向为其长轴(未示出)平行于小梁纤维58的长度(图2)。心肌细胞62可被嵌入在由细胞外基质层64形成的细胞外基质内,且可由平行于心肌细胞62流动的血管60和/或由右心室14内的血液提供营养(图2)。外胶原蛋白层68可以是小梁纤维58的外层。弹性蛋白层66可被设置在细胞外基质层64和外胶原蛋白层68之间。尽管小梁纤维58的各层被图示为具有明显的边界,要理解的是这些层可在它们各自的界面上混合。小梁纤维58的整体组织的组织结构是管状(心肌细胞62)、在管道内(弹性蛋白层66)、在管道内(外胶原蛋白层68)。位于小梁纤维58的核心处的心肌细胞62的存在将小梁细胞58与某种程度上外观相似的结构区分开来,诸如三尖瓣18的腱索(图1)。在不希望受到任何理论约束的情况下,所相信的是装置40在右心室14的动态环境中的存在对心脏12的心内膜38产生机械应力。所相信的是,这些应力可能是由衬底52的移动所引起的,刺激小梁纤维58的生长,包括心肌细胞62的核心。根据一些实施例,还相信的是,衬底52的柔性、非刚性结构产生更大的移动,进一步刺激这种生长。进一步相信,衬底52对连接至衬底52的临时性基质的形成创建刺激,该临时基质由纤维蛋白原、红细胞、血小板、白细胞和,在一些实施例中,干细胞或祖细胞组成。所相信的是,白细胞可能是白细胞(leukoscyte),如巨噬细胞和/或t细胞。所相信的是,干细胞或祖细胞可能是右心室14的心内膜38内的骨髓源性或驻留细胞。所相信的是,临时基质有助于细胞的生长和培养,从而创建不成熟的新生小梁纤维,该小梁纤维成熟为收缩性/传导性功能的小梁纤维58。
图4是图1的心脏12的放大的示意图。根据一些实施例,图4示出装置72,被植入心室壁46的心内膜38内。如图4中所示,装置72包括组织锚50、衬底74、电源76、和脉冲发生器78。衬底74可基本类似于上述衬底40,除了衬底74包括设置于衬底74上的至少一个电极80(如图4中所示)。电源76可包括电池。脉冲发生器78电连接到电源76且电连接到至少一个电极80,以使得电源76和脉冲发生器78一起在至少一个电极80处生成多个电压脉冲。脉冲发生器78可控制多个电压脉冲的特性,比如脉冲的频率、脉冲的长度、以及脉冲的幅度。这样的脉冲发生器是本领域已知的。至少一个电极80可由任何导电、生物可兼容材料制成,例如,钛、铂、不锈钢、镍钛醇、铱或氧化铱。在一些实施例中,至少一个电极80被设置于衬底74的表面上。
如上述装置40一样,组织锚50可包括连接部54和固定装置56。连接部54将固定装置56连接至衬底74,将组织锚50连接至衬底74。在图4所示实施例中,电源76和脉冲发生器78设置于衬底74的一端处。然而,在其他实施例中,电源76和脉冲发生器78可沿衬底74或锚50设置于任何地方。
如图4中所示,组织锚50的固定装置56被固定到心内膜38内从而将装置72锚定在心脏12内从而使得衬底74于心内膜38间隔开。可从至少一个电极80生成电压脉冲从而在衬底74和心内膜38之间产生电势。当装置72被保持在心脏12内时,至少一个小梁纤维58形成于心内膜38和衬底74之间。在图4所示实施例中,形成了多个小梁纤维58。在图4所示实施例中,在衬底74和心室壁46之间延伸的小梁纤维58、以及在衬底74和隔膜48之间延伸的小梁纤维58,用于使用新的收缩性/传导性心脏肌肉组织将心室壁46连接至隔膜。如此被设置,衬底74与具有其收缩性心脏肌肉组织的小梁纤维58可用于修复由于心室壁46变薄或者由于心室壁46内的梗塞引起的损伤,因此改善心脏输出。在不希望受到任何理论约束的情况下,所相信的是在至少一个电极80处的电压脉冲可进一步刺激小梁纤维58的生长。在图4所示实施例中,小梁纤维58被图示为在电极80处附连至衬底74。然而,在其他实施例中,小梁纤维58可附连在衬底74上的任何其他地方。
图5是图1的心脏12的放大的示意图。根据一些实施例,图5示出装置82,被植入心室壁46的心内膜38。如图5中所示,装置82包括组织锚50、和衬底84。如上述装置40和72那样,组织锚50可包括连接部54和固定装置56。连接部54将固定装置56连接至衬底84的端部,将组织锚50连接至衬底84。
在一些实施例中,衬底84是柔性、非刚性、螺旋缠绕的导电线圈,至少部分地由生物可兼容导体制成,例如,钛、铂、不锈钢、镍钛醇、铱或氧化铱。在一些实施例中,线圈匝可被接近地间隔开,以使得为了改进的mri兼容性而相邻匝物理接触。在其他实施例中,线圈匝可较远地间隔从而在相邻匝之间提供较大的间隙,以增强小梁纤维与衬底84的粘附。
如图5的实施例中所示,衬底84的端部可电连接且物理连接至电引线86,电引线86从装置82延伸、通过三尖瓣18、右心房16并且延伸出心脏12到心脏12外的脉冲发生器88和电源90。在一些实施例中,可将脉冲发生器88和电源90可被设置在与血管进入点36(图1)相邻的皮下袋(未示出)中。如上述装置40和72一样,组织锚50可包括连接部54和固定装置56。连接部54将固定装置56连接至衬底44,将组织锚50连接至衬底44。
电源90可包括电池。脉冲发生器88电连接至电源90且电连接至衬底84,以使得电源90和脉冲发生器88一起在衬底84处生成多个电压脉冲,衬底84用作电极。脉冲发生器88可控制多个电压脉冲的特性,比如脉冲的频率、脉冲的长度、以及脉冲的幅度。这样的脉冲发生器是本领域已知的。
如图5中所示,组织锚50的固定装置56被固定至心内膜38以将装置82锚定在心脏12内以使得衬底84与心内膜38间隔开。可在衬底84处生成电压脉冲从而在衬底84和心内膜38之间产生电势。当装置82被保持在心脏12内时,至少一个小梁纤维58形成于心内膜38和衬底84之间。在图5所示实施例中,形成了多个小梁纤维。在图5所示实施例中,在衬底84和心室壁46之间延伸的多个小梁纤维58以及在衬底84和心室壁46的另一部分之间延伸的锚50,用于使用小梁纤维58的新的收缩性/传导性心脏肌肉组织来将心室壁46的不同部分彼此连接。如此被设置,衬底84与具有收缩性心脏肌肉组织的小梁纤维84可用于增强心室壁以修复由于心室壁46变薄或者心室壁46内的梗塞引起的损伤。在不希望受到任何理论约束的情况下,所相信的是在衬底84处的电压脉冲可进一步刺激小梁纤维58的生长。
图6是图1的心脏12的放大示意图,示出另一个实施例。根据一些实施例,图6示出装置92,被植入隔膜48的心内膜38内。如图6中所示,装置92包括衬底94、第一组织锚96、和第二组织锚98。第一组织锚96和第二组织锚98可各自基本类似于上述的锚50,包括连接部54和固定装置56。在图6的实施例中所示,第一组织锚96和第二组织锚98连接至衬底94的相对两端。如图6中所示,衬底94可基本类似于上述参看图2描述的衬底52。在其他实施例中,衬底94可基本类似于衬底74,且装置92还可包括上述参看图4描述的电源76和脉冲发生器78。在又一些实施例中,衬底94可基本类似于上述参看图5描述的衬底84。
如图6中所示,第一组织锚96和第二组织锚98被固定至隔膜48的心内膜38以使得装置92锚定在心脏12内,从而衬底92与心内膜38间隔开。当装置92被保持在心脏12内时,至少一个小梁纤维58在心内膜38和衬底94之间形成。在图6所示实施例中,在衬底94和位于三尖瓣18、心室壁46、和隔膜48上的心内膜38之间形成小梁纤维58。
在图6所示实施例中,在衬底84和隔膜48之间延伸、以及在衬底84和三尖瓣18之间延伸的小梁纤维58用于使用小梁纤维58的新的收缩性心脏肌肉组织将三尖瓣18的一部分连接至隔膜48。如此被设置,衬底94与具有其收缩性心脏肌肉组织的小梁纤维58可改变心脏12的形状从而通过重塑心脏12来修复由于三尖瓣18的不对齐导致返流而引起的损伤。然而,在衬底94和心室壁46之间延伸的小梁纤维58并不是必须的且,在一些实例中,可与由衬底94和其他小梁纤维58引起的修复进行干扰。
图7a和7b是图6的心脏12的一部分的放大示意图,示出根据一些实施例的不必要的小梁纤维58的移除。图7a和7b示出用于对小梁纤维58进行成像和提取的工具100。工具100可包括导管102、可视化装置104、和钳取装置106。钳取装置106可包括一对颌部108。一对颌部108可被用于切割和/或抓取组织,诸如小梁纤维58。导管102可包括在导管的长度延伸的多个内腔(未示出),用于容纳可视化装置104和钳取装置106。如上参看图1对于导管30所描述,导管102可被操作到右心室14内。
在一些实施例中,导管102可以是,例如,来自马萨诸塞州、纳提克的波士顿科学公司的
如图7a中所示,移除小梁纤维58可包括通过钳取装置106的一对颌部108的操作来切除小梁纤维58离开心内膜38。以类似方式,通过钳取装置106的一对颌部108的操作来切除小梁纤维58离开衬底94(图6)。如图7b中所示,一旦小梁纤维58切除离开心内膜38和衬底94两者,一对颌部108可抓取小梁纤维58。钳取装置106可通过导管102中的内腔撤出,从而将整个小梁纤维58从心脏12移除。该过程可被重复用于移除任何附加不需要的小梁纤维58。尽管该过程被描述为切除小梁纤维58离开心内膜38、且然后切除小梁纤维58离开衬底94,可理解的是,这些实施例可包括切除小梁纤维58离开衬底,然后切除小梁纤维58离开心内膜38。图8是在小梁纤维58移除后图6的心脏12的示意图。
图9是图1的心脏12的放大示意图,示出又一个实施例。根据一些实施例,图9示出装置110,被植入心室壁46的心内膜38内。如图9中所示,装置110包括组织锚50、衬底52、以及至少一个药物洗脱环112。组织锚50和衬底如参看图2所上述地一样。在图9所示实施例中,洗脱环112被设置于围绕衬底52的中部。然而,在其他实施例中,洗脱环112可被设置在沿衬底52的任何地方。
药物洗脱环112可包括消炎或免疫抑制的生物或药物制剂,诸如类固醇。类固醇可以是,例如,糖皮质激素,诸如醋酸地塞米松或氢化可的松。类固醇可被设置于液体硅橡胶(lsr)基质内,以使得类固醇可以从lsr基质洗脱。可通过在lsr固化前将类固醇混合进lsr中来形成洗脱环112。在一些实施例中,类固醇可在较长时间段从lsr基质洗脱。在一些实施例中,洗脱环112可包括少如0.20毫克(mg)、0.30mg、0.40mg、或0.50mg,或者多如0.70mg、0.80mg、0.90mg、或1.0mg、或者上述值中任一项之间的类固醇剂量。在一些实施例中,洗脱环112可包括范围从0.20mg到1.0mg、从0.30mg到0.90mg、从0.40mg到0.80mg、或从0.50mg到0.70mg范围内的类固醇剂量。在一些实施例中,洗脱环112可包括约0.60mg的类固醇剂量。
如上对于装置40所述,组织锚50可包括连接部54和固定装置56。连接部54将固定装置56连接至衬底52、将组织锚50连接至衬底52。
如图9中所示,组织锚50的固定装置56被固定到心内膜38内以将装置110锚定在心脏12内,从而衬底52与心内膜38间隔开。抗炎或免疫抑制的生物或药物制剂,诸如类固醇地塞米松醋酸酯,可以从洗脱环112洗脱。当装置110被保持在心脏12内时,在心内膜38和衬底52之间形成至少一个小梁纤维58。在图9所示实施例中,形成了多个小梁纤维58。在图9所示实施例中,在衬底52和心室壁46之间延伸的小梁纤维58、以及在衬底53和隔膜48之间延伸的小梁纤维58,用于使用其新的收缩性/传导性心脏肌肉组织来将心室壁46连接至隔膜。如此被设置,衬底52和具有其收缩性/传导性心脏肌肉组织的小梁纤维58可用于修复由于心室壁46变薄或者由于心室壁46梗塞引起的损伤,因此改善心脏输出。在不希望受到任何理论约束的情况下,所相信的是从洗脱环112洗脱的抗炎或免疫抑制生物或药物制剂可进一步刺激小梁纤维58的生长。
在上述所有实施例中,用于在心脏中产生至少一个小梁纤维以修复心脏的装置被配置为整体地被包含在心室内。即,该装置大小和形状被调整为被整体地包含在心室内从而增强该装置的微创本质。
在上述所有实施例中,为简洁起见,用于在心脏中产生至少一个小梁纤维以修复心脏的装置被植入在右心室内。然而,可理解的是在本公开的其他实施例中,该装置可被附加地或可选地植入在左心室内。
在不背离本发明的范围的情况下,可对于所讨论的示例性实施例做出各种变型和添加。例如,尽管上述实施例涉及具体特征,本发明的范围还包括具有不同特征组合的实施例以及未包括全部所描述特征的实施例。因此,本发明的范围意在包含落在权利要求范围内的所有替代物、变化、和变型,以及所有等效物。
- 还没有人留言评论。精彩留言会获得点赞!