医疗用皮肤外用剂的制作方法
本发明涉及一种医疗用皮肤外用剂,其含有1-环丙基-8-甲基-7-[5-甲基-6-(甲基氨基)-3-吡啶基]-4-氧代-1,4-二氢-3-喹啉羧酸(以下称为“化合物a”)和/或其药物上可接受的盐作为有效成分。
背景技术:
作为浅表性皮肤感染症,已知有痤疮、传染性脓疱病等各种疾病,其由于多种因素而发病,最主要的因素是革兰氏阳性厌氧菌之一的痤疮丙酸杆菌、葡萄球菌等在皮脂腺管中增殖。
主要的治疗方法是使用外用抗菌剂、口服抗菌剂,一直使用的是那氟沙星、米诺环素、罗红霉素等抗菌剂。最近,作为新的药品,含有化合物a作为有效成分的制剂已经上市(专利文献1、专利文献2)。
现有技术文献
专利文献
专利文献1:wo99/51588
专利文献2:wo2007/015453
技术实现要素:
发明要解决的课题
本发明的目的主要在于,提供含有化合物a作为有效成分且适合于治疗浅表性皮肤感染症、特别是伴有水泡、糜烂等的浅表性皮肤感染症的医疗用皮肤外用剂。
用于解决课题的方案
本发明人进行了深入研究,结果发现:在以化合物a和/或其药物上可接受的盐为有效成分的医疗用皮肤外用剂中,添加醇和/或脂肪酸,由此可以解决上述课题,从而完成了本发明。
还发现:通过将添加的醇和/或脂肪酸的过氧化值控制在120meq/kg以下,可以提供具有高稳定性的医疗用皮肤外用剂。
作为本发明,可列举例如以下方案。
(1)一种医疗用皮肤外用剂(以下称为“本发明的医疗用皮肤外用剂”),含有化合物a和/或其药物上可接受的盐作为有效成分,且含有碳数为12以上的醇和/或脂肪酸。
(2)根据上述1所述的本发明的医疗用皮肤外用剂,此外,其有效成分的稳定性优异。
(3)根据上述1或2所述的本发明的医疗用皮肤外用剂,其特征在于,该有效成分的分解物的含量为该有效成分的0.5%以下。
(4)根据上述1~3中任一项所述的本发明的医疗用皮肤外用剂,其特征在于,该有效成分的分解物为1-环丙基-3-羟基-8-甲基-7-(5-甲基-6-(甲基氨基)吡啶-3-基)喹啉-4(1h)-酮。
(5)根据上述1~4中任一项所述的本发明的医疗用皮肤外用剂,其特征在于,醇和/或脂肪酸的过氧化值为120meq/kg以下。
(6)根据上述1~4中任一项所述的本发明的医疗用皮肤外用剂,其特征在于,醇和/或脂肪酸的过氧化值为40meq/kg以下。
(7)根据上述1~6中任一项所述的本发明的医疗用皮肤外用剂,其中,醇和/或脂肪酸的碳数在16~22的范围内。
(8)根据上述1~6中任一项所述的本发明的医疗用皮肤外用剂,其中,醇和/或脂肪酸的碳数为18。
(9)根据上述1~6中任一项所述的本发明的医疗用皮肤外用剂,其中,醇和/或脂肪酸具有不饱和的碳键。
(10)根据上述1~6中任一项所述的本发明的医疗用皮肤外用剂,其中,醇和/或脂肪酸具有支链。
(11)根据上述1~6中任一项所述的本发明的医疗用皮肤外用剂,其中,其为月桂醇、己基癸醇、异硬脂醇、油醇、辛基十二烷醇、油酸、异硬脂酸和/或硬脂酸。
(12)根据上述1~11中任一项所述的本发明的医疗用皮肤外用剂,其中,醇的添加量在0.1~40重量%的范围内。
(13)根据上述1~11中任一项所述的本发明的医疗用皮肤外用剂,其中,脂肪酸的添加量在0.1~40重量%的范围内。
附图说明
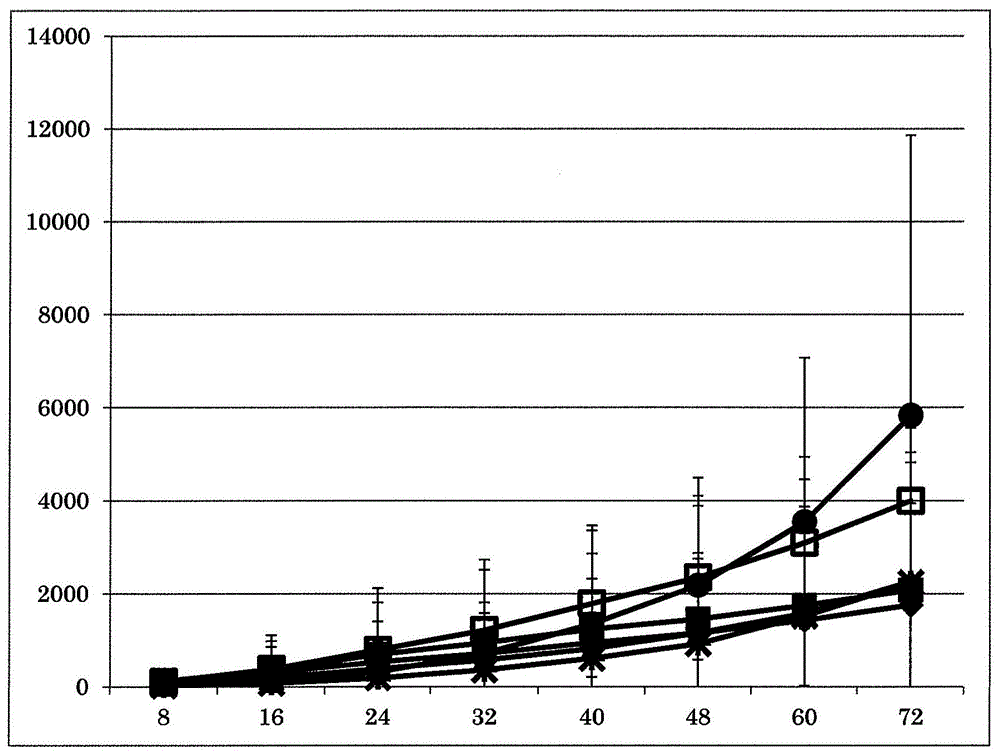
图1示出本发明的医疗用皮肤外用剂的化合物a的经皮吸收性。纵轴表示化合物a的累积皮肤透过量(ng/cm2),横轴表示时间。*表示霜剂3,■表示霜剂13,▲表示霜剂14,◆表示霜剂15,□表示霜剂16,●表示霜剂17。
具体实施方式
化合物a归类于喹诺酮系合成抗菌化合物,通过抑制参与细菌dna复制的dna促旋酶及拓扑异构酶iv而对革兰氏阳性菌、革兰氏阴性菌、厌氧菌、衣原体及耐药性革兰氏阳性菌具有广泛的抗菌谱和强的抗菌活性。
作为化合物a的药物上可接受的盐,可列举通常已知的氨基等碱性基团的盐、或者羟基或羧基等酸性基团的盐。
作为碱性基团的盐,可列举例如:与盐酸、氢溴酸、硫酸等无机酸的盐;与酒石酸、甲酸、富马酸、马来酸、苹果酸、柠檬酸等有机羧酸的盐;以及,与甲磺酸、苯磺酸、对甲苯磺酸、均三甲苯磺酸和萘磺酸等磺酸的盐。
作为酸性基团的盐,可列举例如:与钠、钾等碱金属的盐;与钙、镁等碱土金属的盐;铵盐;以及,与赖氨酸、精氨酸、鸟氨酸等氨基酸的盐、与三甲胺、三乙胺、三丁胺、吡啶、n,n-二甲基苯胺、n-甲基哌啶、n-甲基吗啉、二乙胺、二环己胺、普鲁卡因、二苄胺、n-苄基-β-苯乙胺、1-二苯羟甲胺(日文:1-エフェナミン)以及n,n’-二苄基乙二胺等含氮有机碱的盐。
化合物a和/或其药物上可接受的盐的含量只要为发挥治疗效果的量则没有特别限定,例如,在制剂中在0.01~20重量%的范围内是适宜的,优选在0.1~5重量%的范围内。
化合物a在碱性条件下稳定,因此本发明的医疗用皮肤外用剂的最适ph在9~13的范围内。ph可以使用通常所用的方法测定,没有特别限定,例如,可以向制剂中加入纯化水而稀释10倍左右并加温而使制剂溶解、混合后,进行离心分离,收集下层部分测定ph。
本发明的醇和/或脂肪酸的碳数为12以上,碳数为16~22是适宜的,优选碳数为18。另外,本发明的醇和/或脂肪酸优选具有不饱和的碳键和/或支链。需要说明的是,这些可以使用1种或2种以上。
作为本发明的醇,只要是药物上可接受的醇则没有特别限定,可列举例如以下醇。
·碳数12的醇:月桂醇
·碳数13的醇:十三烷醇
·碳数14的醇:肉豆蔻醇
·碳数15的醇:十五烷醇
·碳数16的醇:十六烷醇(鲸蜡醇、棕榈醇)、己基癸醇、棕榈油醇(日文:パルミトレイルアルコール)
·碳数17的醇:1-十七烷醇
·碳数18的醇:硬脂醇、异硬脂醇、油醇、反油醇(日文:エライジルアルコール)、亚油醇、9e,12e-十八烷-1-醇(日文:エライドリノレイルアルコール)、亚麻醇、9e,12e,15-e-十八烷-1-醇、蓖麻油醇
·碳数19的醇:鲛肝醇(单十六烷基甘油醚)、十九烷醇
·碳数20的醇:辛基十二烷醇、花生醇
·碳数21的醇:鲨肝醇(单硬脂基甘油醚)、鲨油醇(单油基甘油醚)、二十一烷醇
·碳数22的醇:山嵛醇、瓢儿菜醇
·碳数24的醇:癸基十四醇、二十四烷醇
·碳数26的醇:二十六烷醇
·碳数27的醇:胆甾醇(胆固醇)、1-二十七烷醇
·碳数28的醇:蒙旦醇
·碳数29的醇:谷甾醇(谷固醇)、1-二十九烷醇
·碳数30的醇:蜂花醇
·碳数32的醇:1-三十二烷醇
·碳数34的醇:1-三十四烷醇
另外,还可以列举例如:硬脂醇与十六烷醇混合而成的十六十八醇之类的、两种以上醇混合而成的醇。作为这种醇,可列举例如植物甾醇(植物固醇)、羊毛脂醇或氢化羊毛脂醇。
本发明的医疗用皮肤外用剂中的醇含量在0.1~40重量%的范围内是适宜的,优选在0.5~20重量%的范围内,更优选在1~10重量%的范围内。
本发明的醇为月桂醇、己基癸醇、异硬脂醇、油醇、辛基十二烷醇是适宜的,优选为异硬脂醇、油醇、辛基十二烷醇,更优选为油醇。
作为本发明的脂肪酸,只要是药物上可接受的脂肪酸则没有特别限定,可列举例如以下脂肪酸。
·碳数12的脂肪酸:月桂酸
·碳数14的脂肪酸:肉豆蔻酸
·碳数15的脂肪酸:十五烷酸
·碳数16的脂肪酸:棕榈酸、棕榈油酸
·碳数17的脂肪酸:十七烷酸
·碳数18的脂肪酸:硬脂酸、异硬脂酸、油酸、亚油酸、异油酸、亚麻酸、桐酸
·碳数20的脂肪酸:花生酸、8,11-二十碳二烯酸、二十碳三烯酸、花生四烯酸
·碳数22的脂肪酸:山嵛酸
·碳数24的脂肪酸:二十四烷酸、神经酸
·碳数25的脂肪酸:二十五烷酸
·碳数26的脂肪酸:二十六烷酸
·碳数28的脂肪酸:褐煤酸
·碳数30的脂肪酸:蜂花酸
本发明的医疗用皮肤外用剂中的脂肪酸含量在0.1~40重量%的范围内是适宜的,优选在0.5~20重量%的范围内,更优选在1~10重量%的范围内,进一步优选在1~5重量%的范围内。
本发明的医疗用皮肤外用剂中的醇及脂肪酸的含量在0.1~40重量%的范围内是适宜的,优选在0.5~20重量%的范围内,更优选在1~10重量%的范围内。
本发明的脂肪酸为肉豆蔻酸、棕榈酸、硬脂酸、油酸、异硬脂酸、山嵛酸是适宜的,优选为硬脂酸、油酸、异硬脂酸,更优选为硬脂酸。
本发明的医疗用皮肤外用剂的“医疗用皮肤外用剂”是指:作为医疗用途而应用于人皮肤的制剂,只要药物上可接受则没有特别限定,可以列举例如软膏剂、霜剂、洗剂、凝胶剂或泡沫剂。它们中,特别优选软膏剂或霜剂。
软膏剂通常定义为:涂布于皮肤的、使有效成分溶解或分散于基剂的半固体的制剂,可以分为油性软膏剂和水性软膏剂。油性软膏剂可以进一步分为:有效成分以晶体形式分散于基剂的分散型;有效成分溶解于溶解剂后再分散于基剂的液滴分散型(日文:液滴分散型);有效成分不需要溶解剂而直接溶解于基剂的溶解型。
霜剂通常定义为:涂布于皮肤的、乳化为水包油型或油包水型的半固体的制剂。
本发明的医疗用皮肤外用剂中可使用的基剂只要是药物上可接受的则没有特别限定,可列举例如油脂类、蜡类、石蜡等烃类或水,这些可以使用1种或2种以上。
油脂类没有特别限定,可列举例如植物油或角鲨烷,这些可以使用1种或2种以上。
蜡类没有特别限定,可列举例如蜂蜡、白蜂蜡或羊毛脂,这些可以使用1种或2种以上。
石蜡是在c14-16、c18-22、c20-22、c20-26、c28-40及c40-44处具有链长峰(日文:鎖長ピーク)(利用气相色谱进行测定)且具有c5~c60的链长的烃,可列举例如:白凡士林、黄凡士林、白色软石蜡、液体石蜡或轻质液体石蜡,这些可以使用1种或2种以上。
医疗用皮肤外用剂中,有时会由于时间推移或光、热、ph、水等的作用、或者与容器、封堵物的化学反应而产生有效成分的分解物。分解物的有效性、安全性是未知的,因此,考虑到含有新有效成分的药品中的制剂杂质的相关准则(平成15年6月24日通知、ichq3b(r2)),要求将分解物抑制为有效成分的含量的0.5%以下。
申请人在制备含有化合物a的医疗用皮肤外用剂时,获知化合物a发生了分解,进行深入研究的结果,查明原因在于医疗用皮肤外用剂中所添加的醇和/或脂肪酸中的过氧化物,并发现通过控制过氧化值的值可以将分解物抑制在化合物a的含量的0.5%以下。
需要说明的是,化合物a的分解物为以下化学式所示的化合物(1-环丙基-3-羟基-8-甲基-7-(5-甲基-6-(甲基氨基)吡啶-3-基)喹啉-4(1h)-酮)。
[化1]
为了将该分解物抑制为化合物a的含量的0.5%以下,理想的是添加到本发明的医疗用皮肤外用剂中的醇和/或脂肪酸的过氧化值为120meq/kg以下。需要说明的是,通过使添加到本发明的医疗用皮肤外用剂中的醇和/或脂肪酸的过氧化值为40meq/kg以下,从而能够将该分解物抑制为化合物a的含量的0.2%以下,可以进一步提高稳定性。
该分解物的含量可通过本领域技术人员通常可用的方法测定,例如可通过高效液相色谱法测定。
过氧化值可利用通常使用的方法测定。使试样与碘化钾反应,将游离的碘分子的量以每千克试样的毫当量数(meq)表示的数值即为过氧化值。生成的碘分子的量通过使用硫代硫酸钠的氧化还原滴定来求出,滴定中使用淀粉,利用碘-淀粉反应。碘分子与淀粉反应而呈现蓝紫色,当逐渐加入硫代硫酸钠时,碘分子被还原并从淀粉游离,颜色逐渐变浅。将颜色消失的时刻设为滴定终点。
本发明的医疗用皮肤外用剂中可以添加ph调节剂,以将ph调节为9~13。
所述ph调节剂只要是具有缓冲能力的化合物则没有特别限定,可列举例如:氢氧化钾、氢氧化锂及氢氧化钠等金属氢氧化物;单乙醇胺、单异丙醇胺、二乙醇胺、二异丙醇胺、三乙醇胺、三异丙醇胺及2-氨基-2-甲基-1,3-丙二醇等羟基低级烷基胺;碳酸氢钠、柠檬酸钠、乳酸钠、磷酸氢二钠、酒石酸钠等弱酸的金属盐,这些可以使用1种或2种以上。
此外,ph调节剂的添加量只要可以将本发明的医疗用皮肤外用剂的ph调节为9~13则没有特别限定,在0.1~20重量%的范围内是适宜的,优选在0.1~10重量%的范围内,更优选在0.1~5重量%的范围内。
本发明的医疗用皮肤外用剂中还可以添加保存剂(防腐剂)。作为保存剂,没有特别限定,可列举例如:依地酸钠水合物、依地酸四钠、脱氢乙酸钠、山梨酸、山梨酸钾、苯氧基乙醇、苯甲酸钠、对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯、百里酚、苯扎氯铵或干燥亚硫酸钠,这些可以使用1种或2种以上。
本发明的医疗用皮肤外用剂中还可以添加稳定剂(包括抗氧化剂)。作为稳定剂,没有特别限定,可列举例如抗坏血酸及其衍生物、依地酸钠、硫代硫酸钠、亚硫酸钠、焦亚硫酸钠、亚硝酸钠或二丁基羟基甲苯,这些可以使用1种或2种以上。
本发明的医疗用皮肤外用剂中还可以添加紫外线吸收剂。作为紫外线吸收剂,没有特别限定,可列举例如对氨基苯甲酸、水杨酸苯酯、对甲氧基肉桂酸异丙酯、对甲氧基肉桂酸辛酯或2,4-二羟基二苯甲酮,这些可以使用1种或2种以上。
本发明的医疗用皮肤外用剂中还可以添加有效成分的溶解剂(溶剂)。作为有效成分的溶解剂,没有特别限定,可列举例如:1,2,6-己三醇、克罗米通、角鲨烷、硅油、棕榈酸异硬脂酯、2-乙基己酸鲸蜡酯、聚丙二醇2000、三(辛酸/癸酸)甘油酯、异硬脂酸-2-十六烷基酯、液体石蜡、肉豆蔻酸异丙酯、辛基十二烷醇、异硬脂醇、中链脂肪酸甘油三酯、油醇、己基癸醇、三异辛酸甘油酯、癸二酸二异丙酯、月桂醇、蓖麻油、异硬脂酸、癸二酸二乙酯、己二酸二异丙酯、水、苯甲醇、甘油三乙酸酯、碳酸亚丙酯、脱水山梨醇单月桂酸酯、2-乙基-1,3-己二醇、水杨酸乙二醇酯、二丙二醇、乙醇、聚乙二醇400、1,3-丁二醇、丙二醇、乳酸、d-山梨醇或甘油,这些可以使用1种或2种以上。
本发明的医疗用皮肤外用剂中还可以添加润湿剂。作为润湿剂,没有特别限定,可列举例如1,3-丁二醇、甘油、丙二醇或二丙二醇,这些可以使用1种或2种以上。
本发明的医疗用皮肤外用剂中还可以添加乳化剂。作为乳化剂,没有特别限定,可列举鲸蜡基三甲基氯化铵、月桂基二甲基苄基氯化铵、四丁基氯化铵、二(十八烷基)二甲基氯化铵、烷基苯磺酸钠、十二烷基硫酸钠、椰油醇乙氧基硫酸钠、α-烯烃磺酸钠、乳化十六十八醇、聚氧乙烯烷基醚、烷基酚聚氧乙烯基醚(日文:ポリオキシエチレンアルキルフェノールエーテル)、聚氧乙烯氢化蓖麻油、聚乙二醇硬脂酸酯、甘油脂肪酸酯、二甘油脂肪酸酯、n-烷基-n,n-二甲基铵甜菜碱或咪唑啉型两性表面活性剂,这些可以使用1种或2种以上。
本发明的医疗用皮肤外用剂中还可以添加乳化稳定剂。作为乳化稳定剂,没有特别限定,可列举例如l-精氨酸、甘氨酸或n-酰基-l-谷氨酸钠,这些可以使用1种或2种以上。
本发明的医疗用皮肤外用剂中还可以添加增稠剂(包括凝胶化剂)。作为增稠剂,没有特别限定,可列举例如海藻酸钠、明胶、羧乙烯基聚合物、聚丙烯酸钠、甲基纤维素、甘油单油酸酯、羟丙基纤维素、羟丙基甲基纤维素、羟乙基纤维素或黄原胶,这些可以使用1种或2种以上。
本发明的医疗用皮肤外用剂中还可以添加起泡剂。作为起泡剂,没有特别限定,可列举例如聚氧乙烯山梨糖醇酐单硬脂酸酯、硬脂酸甘油酯、聚氧乙烯氢化蓖麻油、聚乙二醇单硬脂酸酯、蔗糖月桂酸酯、聚氧乙烯硬脂醚、月桂酸钠、硬脂酸精氨酸(日文:ステアリン酸アルギニン)或月桂基硫酸钠,这些可以使用1种或2种以上。
本发明的医疗用皮肤外用剂中还可以添加其它皮肤用外用剂通常所使用的添加剂。
由于有效成分的抗菌作用,可以出于治疗和/或预防广泛的皮肤科领域感染症的目的来使用本发明的医疗用皮肤外用剂。
作为可使用本发明的医疗用皮肤外用剂的皮肤科领域感染症,只要是原因之一为细菌感染的疾病则没有特别限定,可列举例如单纯性皮肤软组织感染症、复杂性皮肤软组织感染症或伴有化脓性炎症的痤疮。
作为单纯性皮肤软组织感染症,可列举例如浅表性皮肤感染症或深层皮肤感染症。它们中,特别优选浅表性皮肤感染症。
浅表性皮肤感染症可以分为附件相关感染(日文:附属器関連感染症)和非附件相关感染(日文:非附属器関連感染症)。
作为附件相关感染,可列举例如毛囊炎、须疮或化脓性汗孔周围炎。
作为非附件相关感染,可列举例如传染性脓疱病。
复杂性皮肤软组织感染症也可以分为附件相关感染和非附件相关感染。
作为附件相关感染,可列举例如疖、疖病以及痈。
作为非附件相关感染,可列举例如蜂窝织炎、丹毒、淋巴管炎以及淋巴结炎。
复杂性皮肤软组织感染症可分为慢性脓皮病和皮肤继发性感染。
作为慢性脓皮病,可列举例如感染性粉瘤、化脓性汗腺炎。
作为皮肤继发性感染症,可列举例如皮肤溃疡等继发性感染。
作为伴有化脓性炎症的痤疮,可列举例如寻常痤疮、新生儿痤疮或聚合性痤疮。
本发明的医疗用皮肤外用剂不易刺激皮肤,对于这些皮肤科领域感染症中的伴有水泡、糜烂的疾病、症状特别有用。作为伴有水泡、糜烂的疾病,不限定于这些,还可以列举例如传染性脓疱病。
本发明的医疗用皮肤外用剂的制造方法没有特别限定,本领域技术人员可以利用通常可用的方法来制造。
实施例
以下列举制剂例及试验例对本发明进行进一步详细说明,但本发明不限于实施例所示的范围。
[制剂例1~17]
医疗用皮肤外用剂的制备
基于表1~3所示的配方称量各成分。向化合物a中加入水及ph调节剂,搅拌,得到主药相。另外,向水中加入ph调节剂,搅拌,得到ph调节相。将包含白色凡士林、醇和/或脂肪酸的油相加热到70~80℃使其融解。向油相加入主药相及ph调节相,用乳化机(primix株式会社制)进行搅拌,得到实施例的霜剂。
[表1]
[表2]
[表3]
[试验例1]经皮吸收性的评价
将去除了皮下脂肪的人皮肤切片设于franz垂直型渗透单元(hansonresearch制),每1.77cm2涂布约20mg的霜剂3、13~17,然后灌注受体液(日文:レセプター液),利用lc/ms/ms(液相色谱(lc):株式会社岛津制作所制、串联型质谱仪(ms/ms):株式会社absciex制)持续测定累积人皮肤透过量。对于每种制剂使用6~8片人皮肤切片。将结果示于图1。
由图1可知,对于霜剂3、13~17的医疗用皮肤外用剂均确认到良好的经皮吸收性。
[试验例2]分解物的生成量的研究
用高效液相色谱法测定表1~3所示的医疗用皮肤外用剂中的分解物(1-环丙基-3-羟基-8-甲基-7-(5-甲基-6-(甲基氨基)吡啶-3-基)喹啉-4(1h)-酮)的生成量。分解物的测定在制备制剂后立即实施。
对于表1~3所示的医疗用皮肤外用剂,研究了过氧化值和分解物的量。结果,由表4~6可知,如果过氧化值为120meq/kg以下则可以将分解物的生成抑制为化合物a的含量的0.5%以下,如果过氧化值为40meq/kg以下则可将分解物的生成抑制为化合物a的含量的0.2%以下。
[表4]
[表5]
[表6]
- 还没有人留言评论。精彩留言会获得点赞!